焙烧硫铁矿得到的二氧化硫炉气为什么要进行净化和干燥
 aa难逃2022-10-04 11:39:541条回答
aa难逃2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 fatfat_31 共回答了15个问题
fatfat_31 共回答了15个问题 |采纳率86.7%- 因为水会吸收热量,这是第一个,浪费燃料,其次水会吸收部分的二氧化硫,是二氧化硫催化氧化为三氧化硫的过程中的原料变少,不利于反应的正向进行,其三,产生的三氧化硫用的是浓硫酸吸收,在这个过程中如果有水的话会先跟三氧化硫剧烈反应并大量放热,导致设备的腐蚀,所以要干燥二氧化硫.
- 1年前
相关推荐
- 金属铜的提炼多从黄铜矿(CuFeS 2 )开始,已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中发生的主要反应为:2CuFeS
金属铜的提炼多从黄铜矿(CuFeS 2 )开始,已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中发生的主要反应为:2CuFeS 2 +O 2 =Cu 2 S+2FeS+SO 2 ,下列说法 不正确 的是
A.SO 2 既是氧化产物又是还原产物 B.CuFeS 2 既是氧化剂又是还原剂 C.O 2 只做氧化剂 D.若有1mol O 2 参加反应,则反应中有4mol电子转移  阿宝乖1年前1
阿宝乖1年前1 -
 heiheih 共回答了21个问题
heiheih 共回答了21个问题 |采纳率95.2%D
A正确,氧化产物由还原剂生成,还原产物由氧化剂生成;B正确,CuFeS 2 在反应的过程中既有元素化合价升高又有元素化合价降低,所以既是氧化剂又是还原剂;
C正确,氧气在反应中元素化合价只降低;D错,若有1mol O 2 参加反应,则反应中电子转移数大于4mol;1年前查看全部
- (2014•湖南一模)高温下焙烧CuFeS2的反应之一为:2CuFeS2+7O2═CuSO4+CuO+Fe2O3+3SO
(2014•湖南一模)高温下焙烧CuFeS2的反应之一为:2CuFeS2+7O2═CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是( )
A.CuFeS2中硫的化合价为-1
B.CuFeS2发生还原反应
C.1mol CuFeS2完全反应转移13mol电子
D.CuSO4和SO2既是氧化产物,又是还原产物 其农1年前1
其农1年前1 -
 小部 共回答了17个问题
小部 共回答了17个问题 |采纳率100%解题思路:由2CuFeS2+7O2═CuSO4+CuO+Fe2O3+3SO2,可知Fe元素的化合价由+2价升高为+3价,S元素的化合价由-2价升高为+4价、+6价,O元素的化合价由0降低为-2价,以此来解答.A.CuFeS2中CuFe均为+2价,由化合物中正负化合价的倒数和为0可知,硫的化合价为-2,故A错误;B.Fe元素的化合价升高,S元素的化合价升高,则CuFeS2发生氧化反应,故B错误;C.由反应可知,1mol CuFeS2完全反应...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,选项C为易错点,题目难度不大.1年前查看全部
- 铜的冶炼大致可分为:(1)富集,将硫化物矿进行浮选;(2)①焙烧,主要反应为2CuFeS 2 +4O 2 Cu 2 S+
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选;
(2)①焙烧,主要反应为2CuFeS 2 +4O 2 Cu 2 S+3SO 2 +2FeO(炉渣)
Cu 2 S+3SO 2 +2FeO(炉渣)
②制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S
2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S 6Cu+SO 2 ↑。
6Cu+SO 2 ↑。
(3)电解精炼。
下列说法正确的是[ ]A.上述灼烧过程的尾气均可直接排空
B.由6 mol CuFeS 2 生成6 mol Cu,上述共消耗15 mol O 2
C.在反应2Cu 2 O+Cu 2 S 6Cu+SO 2 ↑中,作氧化剂的只有Cu 2 O
6Cu+SO 2 ↑中,作氧化剂的只有Cu 2 O
D.电解精炼时,粗铜应与外电源负极相连 迷迷的oo1年前1
迷迷的oo1年前1 -
 苹果梦 共回答了21个问题
苹果梦 共回答了21个问题 |采纳率95.2%B1年前查看全部
- 煅烧,焙烧,炭化的区别及英文表达?
煅烧,焙烧,炭化的区别及英文表达?
化工中三者具体含义及区别 kevin88481年前1
kevin88481年前1 -
 xywrlj 共回答了18个问题
xywrlj 共回答了18个问题 |采纳率100%calcination
baking(电工名词) roasting(冶金名词)
charring1年前查看全部
- 在N2中焙烧与在马弗炉中焙烧有什么区别?什么情况下一定要再N2中焙烧
 大海浪花21年前1
大海浪花21年前1 -
 柳湘灵 共回答了21个问题
柳湘灵 共回答了21个问题 |采纳率85.7%在氮气N2中焙烧是防止氧化,在马弗炉中焙烧不防氧化,但真空气氛厢式马弗炉可实现此目的.如果物件在高温下易被氧化,则一定要在N2中焙烧(也可在Ar2氩气中焙烧) 更详细可打0379-64618600咨询1年前查看全部
- 氟化物掺杂焙烧,如何防止氟化物挥发,以及能够得到纯单相?
氟化物掺杂焙烧,如何防止氟化物挥发,以及能够得到纯单相?
稀土掺杂氟化物(如NaF)采用固相法焙烧,如何防止氟化物挥发,以及能够得到纯单相? 1)采用固相法焙烧,要得到稀土掺杂氟化物纯单相,要注意哪些问题? 2)在焙烧和处理氟化物(如NaF)时 ... b12345678901年前1
b12345678901年前1 -
 gxds18 共回答了16个问题
gxds18 共回答了16个问题 |采纳率93.8%改变稀土掺杂量看看,纯固溶体必须在一定的配比下才能生成.查看原帖1年前查看全部
- (2012•海淀区一模)工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸.焙烧后的矿渣用于炼
(2012•海淀区一模)工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸.焙烧后的矿渣用于炼铁.其转化过程如下(部分条件和产物已略去).

请回答下列问题:
(1)如图出现的含硫元素的物质中,属于氧化物的有______(填化学式).
(2)FeS2中的铁元素是+2价,硫元素的化合价为______.
(3)写出②处炼铁的化学方程式3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.若用2000t含杂质30%的矿渣炼铁,理论上可得到含铁98%的生铁质量为______ t.
2Fe+3CO2高温 .
(4)在煤炭燃烧过程中也会产生SO2.工业上将煤燃烧产生的烟气通入吸收塔,用石灰水淋洗,外加氧气的作用,使之反应生成硫酸钙和水.请写出该反应的化学方程式______. langzi_fruit1年前1
langzi_fruit1年前1 -
 深圳灵之 共回答了19个问题
深圳灵之 共回答了19个问题 |采纳率84.2%解题思路:(1)根据氧化物的概念:氧化物中只有两种元素且是含有氧元素的化合物,进行分析解答.
(2)根据在化合物中正负化合价代数和为零,结合FeS2的化学式进行解答本题.
(3)根据炼铁的反应原理可知,结合化学方程式的书写方法、步骤,写出炼铁反应的化学方程式即可.由矿渣的质量、杂质的质量分数、生铁中铁的质量分数,根据炼铁的化学方程式可以列式计算出炼出生铁的质量.
(4)根据题意,产生的SO2用石灰水淋洗,外加氧气的作用,使之反应生成硫酸钙和水,写出反应的化学方程式即可.(1)图中出现的含硫元素的物质中,SO2、SO3是由两种元素组成的且有一种是氧元素的化合物,均属于氧化物;H2SO4是由氢、硫、氧三种元素组成的化合物,不属于氧化物.
(2)铁氧元素显+2,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可知FeS2中硫元素的化合价:(+2)+2x=0,则x=-1.
(3)工业上炼铁是用还原剂一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O3
高温
.
2Fe+3CO2;
设理论上可炼出含铁98%的生铁质量为x.
Fe2O3+3CO
高温
.
3CO2+2Fe
160 112
2000t×(1-30%) 98%x
[160/112=
2000t×(1−30%)
98%x] x=1000t
(4)根据题意,SO2、石灰水、氧气反应生成硫酸钙和水,反应的化学方程式为2SO2 +2Ca(OH)2 +O2 ═2CaSO4 +2H2O.
故答案为:(1)SO2、SO3;(2)-1;(3)3CO+Fe2O3
高温
.
2Fe+3CO2;1000;(4)2SO2 +2Ca(OH)2 +O2 ═2CaSO4 +2H2O.点评:
本题考点: 物质的相互转化和制备;一氧化碳还原氧化铁;含杂质物质的化学反应的有关计算;从组成上识别氧化物;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握氧化物的特征、利用化合价的原则计算指定元素的化合价的方法、化学方程式的书写方法、含杂质物质的化学方程式的计算等是正确解答本题的关键.1年前查看全部
- 二氧化硅焙烧到多少度,骨架坍塌
 yabinage1年前2
yabinage1年前2 -
 lov1lov 共回答了17个问题
lov1lov 共回答了17个问题 |采纳率88.2%一般二氧化硅的比表面随焙烧温度增加会渐渐降低,特别是当焙烧温度高于800度时,同时孔径也会相应收缩;
另外,焙烧对二氧化硅表面羟基的影响较大,焙烧温度越高,会有越多B酸中心转化为L酸中心;
所以,针对不同反应,应采用不同的焙烧温度.
如果要使二氧化硅更好地涂覆于堇青石蜂窝陶瓷上,应该焙烧温度稍高一些,而且最好采用程序升温方法,缓慢升温.
常用的二氧化硅载体的焙烧温度为550度.
而且需要注意的是,二氧化硅载体,特别是硅胶载体在高温焙烧过程中容易炸裂1年前查看全部
- MgAl型水滑石焙烧产物”是什么意思
 dalangquan1年前2
dalangquan1年前2 -
 幸福的花朵_ly 共回答了20个问题
幸福的花朵_ly 共回答了20个问题 |采纳率95%通过共沉淀法值得的MgAl沉淀物通常呈现层状结构的水滑石,这可以通过XRD检测得到,通常在10度左右出现一个较强的衍射峰,而后将其被烧得到氧化物,层状结构能不能保持就要看焙烧的温度和条件了.1年前查看全部
- 明矾石的主要成分为碱性硫酸铝钾KAl3(SO4)2(OH)6,可用于炼铝、净水等,焙烧碱性硫酸铝钾和硫的混合物,其反应为
明矾石的主要成分为碱性硫酸铝钾KAl3(SO4)2(OH)6,可用于炼铝、净水等,焙烧碱性硫酸铝钾和硫的混合物,其反应为4KAl3(SO4)2(OH)6+3S=2K2SO4+6Al2O3+9SO2↑+12H2O.下列说法正确的是( )
A.当生成6mol H2O时,转移的电子数为6NA
B.K2SO4为氧化产物,SO2为还原产物
C.焙烧后的固体产物不能完全溶于NaOH溶液
D.反应中体现氧化性的硫元素与体现还原性的硫元素的质量比为8:3 ninjajean1年前1
ninjajean1年前1 -
 nfsoft 共回答了25个问题
nfsoft 共回答了25个问题 |采纳率84%解题思路:4KAl3(SO4)2(OH)6+3S=2K2SO4+6Al2O3+9SO2↑+12H2O中S元素化合价由+6价、0价变为+4价,根据转移电子守恒知,有[3/4]的KAl3(SO4)2(OH)6参加氧化还原反应,据此分析解答.A.有12molH2O生成时,参加反应的S的物质的量是3mol,则转移电子的物质的量=3mol×(4-0)=12mol,所以当生成6mol H2O时,转移电子的物质的量是6mol,则转移的电子数为6NA,故A正确;
B.K2SO4既不是氧化产物也不是还原产物,SO2既是氧化产物也是还原产物,故B错误;
C.K2SO4为可溶性盐,Al2O3能溶于NaOH溶液生成可溶性的NaAlO2,故C错误;
D.有[3/4]的KAl3(SO4)2(OH)6参加氧化还原反应,所以反应中体现氧化性的硫元素与体现还原性的硫元素的质量比为6:3=2:1,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,再结合物质的溶解性来分析解答,注意KAl3(SO4)2(OH)6部分参加氧化还原反应,题目难度较大.1年前查看全部
- MnO2经1400摄氏度焙烧,转化成什么物质,显什么样的颜色?
MnO2经1400摄氏度焙烧,转化成什么物质,显什么样的颜色?
如果我把少量的该物质添加到氧化铝陶瓷中烧1450度,会影响氧化铝的颜色不? mncjksdifausdopi1年前1
mncjksdifausdopi1年前1 -
 david95 共回答了15个问题
david95 共回答了15个问题 |采纳率93.3%Mn3O41年前查看全部
- 工业上焙烧明矾[ (SO 4 ) 2 ·12H 2 O]的化学方程式为:4Al(SO 4 ) 2 ·12H 2 O+3S
工业上焙烧明矾[ (SO 4 ) 2 ·12H 2 O]的化学方程式为:4Al(SO 4 ) 2 ·12H 2 O+3S
 2K 2 SO 4 +2Al 2 O 3 +9SO 2 +48H 2 O,下列判断正确的是
2K 2 SO 4 +2Al 2 O 3 +9SO 2 +48H 2 O,下列判断正确的是A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 B.最后得到的K 2 SO 4 溶液呈中性,所以c(K + )=c(SO 4 2- ) C.焙烧产生的SO 2 可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO 2 的利用率为96%,可生产质量分数为98%的硫酸432 t D.工业上冶炼Al 2 O 3 制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH) 2 ,该电池反应的化学方程式是Al+3NiO(OH)+NaOH  NaAlO 2 +3Ni(OH) 2
NaAlO 2 +3Ni(OH) 2  329116341年前1
329116341年前1 -
 活动通知 共回答了16个问题
活动通知 共回答了16个问题 |采纳率100%C
1年前查看全部
- 如图所示火法炼铜首先要焙烧黄铜矿……
如图所示火法炼铜首先要焙烧黄铜矿……

第三题,. 霉酸1年前3
霉酸1年前3 -
 东方狮 共回答了19个问题
东方狮 共回答了19个问题 |采纳率78.9%1年前查看全部
- (2012•连云港三模)粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.
(2012•连云港三模)粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.
以粗CuO为原料制备胆矾的主要流程如下: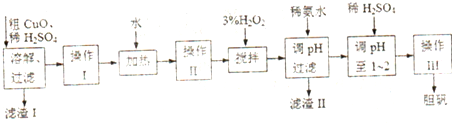
已知Fe3+,Fe2+,Cu2+转化为相应氢氧化物时,开始沉淀的沉淀完全时的pH如下表:
(1)为使粗CuO充分溶解,可采取的措施除适当延长溶解时间、充分搅拌、将粗CuO粉碎外,还有______(答一条即可)Fe3+ Fe2+ Cu2+ 开始沉淀的pH 2.7 7.6 5.2 沉淀完全的pH 3.7 9.6 6.4
(2)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的目的是______.H2O2参加反应的离子方程式为______.
(3)加入稀氨水后,溶液的pH应在______范围内.
(4)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精制胆矾.两步操作相同,都包括燕发浓缩、冷却结晶、吸滤、洗涤、干燥等步骤示和普通过滤相比,吸滤的优点是______.(至少答两条).
(5)吸滤操作中,除烧杯、玻璃棒、安全瓶外,还必须使用的属于硅酸盐材料的仪器有______. 龙红太1年前1
龙红太1年前1 -
 san340021 共回答了14个问题
san340021 共回答了14个问题 |采纳率92.9%解题思路:(1)加快溶解的方法有加热、增大接触面积、搅拌等;
(2)过氧化氢不稳定,受热易分解;
(3)调节溶液的pH目的是使铁离子全部沉淀,铜离子不沉淀,依据图表数据分析可知pH应为:3.7~5.2;
(4)循环水真空泵使吸滤瓶内减压,由于瓶内与布氏漏斗液面上形成压力差,因而加快了过滤速度;
(5)布什漏斗与吸滤瓶配套,用于无机制备中晶体或粗颗粒沉淀的减压过滤.(1)加热可促进反应速率,故答案为:给反应混合物加热;(2)过氧化氢不稳定,受热易分解,故加入过氧化氢前需使溶液冷却.Fe2+可被过氧化氢氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为...
点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质;制备实验方案的设计.
考点点评: 本题考查了铜的化合物知识,对于减压过滤,教材没有介绍,可从网上查找更多信息.1年前查看全部
- (2014•红河州模拟)工业上焙烧明矾[KAl(SO4)2•12H2O]的化学方程式为:4KAl(SO4)2•12H2O
(2014•红河州模拟)工业上焙烧明矾[KAl(SO4)2•12H2O]的化学方程式为:4KAl(SO4)2•12H2O+3S
2K2SO4+2Al2O3+9SO2↑+48H2O,下列判断正确的是( )△ .
A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4
B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-)
C.焙烧产生的SO2可用于制硫酸,焙烧948t明矾(M=474g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432t
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH═NaAlO2+3Ni(OH)2 手指间oo1年前1
手指间oo1年前1 -
 ji0916 共回答了22个问题
ji0916 共回答了22个问题 |采纳率95.5%解题思路:A.该反应中,S元素的化合价由0价和+6价变为+4价,得电子的反应物是氧化剂,失电子的反应物是还原剂;
B.根据电荷守恒判断;
C.根据硫原子守恒进行计算;
D.以Al和NiO(OH)为电极,铝做原电池 负极失电子发生氧化反应,NiO(OH)得到电子发生还原反应.A.该反应中,S元素的化合价由0价和+6价变为+4价,所以部分4KAl(SO4)2•12H2O作氧化剂(6个硫酸根被还原,2个硫酸根保持不变),硫作还原剂,还原剂和氧化剂的物质的量之比为3:3=1:1,故A错误;
B.溶液呈中性得c(H+)=c(OH-),根据电荷守恒得2c(K+)=c(SO42-),故B错误;
C.明矾的物质的量=
948×106g
474g/mol=2×106mol,根据方程式知,生成二氧化硫的物质的量=
2×106mol
4×9=4.5×106mol,SO2的利用率为96%,根据硫原子守恒知,硫酸的物质的量=二氧化硫的物质的量=4.32×106mol,则98%的质量=
4.32×106mol×98g/mol
98%=4.32×106g=432吨,故C正确;
D.以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,铝做负极失电子在氢氧化钠溶液中生成偏铝酸钠,反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2 ,故D错误;
故选C.点评:
本题考点: 氧化还原反应;电解原理.
考点点评: 本题以电解原理、氧化还原反应为载体考查了物质的量的计算,根据元素化合价变化、电荷守恒、物质之间的关系来分析解答,易错选项是A,注意部分明矾作氧化剂,为易错点.1年前查看全部
- 铜的冶炼大致可分为:①富集,将硫化物矿进行浮选;②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(
铜的冶炼大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2,2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法不正确( )
A.上述灼烧过程的尾气回收后可用来制硫酸
B.上述过程中,由6mol CuFeS2制取6 mol Cu时共消耗15mol O2
C.在反应2Cu2O+Cu2S═6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6
D.在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 会飞的泥巴1年前1
会飞的泥巴1年前1 -
 foxbear2021 共回答了25个问题
foxbear2021 共回答了25个问题 |采纳率96%解题思路:A.二氧化硫能用来制取硫酸;
B.根据最终产物为Cu、SO2和FeO可写出反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据方程式计算;
C.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,则氧化剂是Cu2O、Cu2S,还原剂是Cu2S,氧化产物是二氧化硫、还原产物是Cu;
D.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,则氧化剂是Cu2O、Cu2S.A.在铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫被氧化生成三氧化硫,三氧化硫和水反应生成硫酸,所以所以冶炼过程中的尾气可用来制硫酸,故A正确;
B.总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据方程式知由6mol CuFeS2制取6 mol Cu时共消耗15mol O2,故B正确;
C.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,则氧化剂是Cu2O、Cu2S,还原剂是Cu2S,氧化产物是二氧化硫、还原产物是Cu,则氧化产物和还原产物的物质的量之比为1:6,故C正确;
D.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,则氧化剂是Cu2O、Cu2S,氧化产物是二氧化硫、还原产物是Cu,故D错误;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据元素化合价变化及方程式中各个物理量的关系分析解答,注意D选项中氧化剂的判断,题目难度不大.1年前查看全部
- 高温焙烧石灰石的化学方程式
 红豆的温柔1年前0
红豆的温柔1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高一奥化!!高手快进!!工业上将磷酸钙、石英砂和碳粉混合在电弧炉中焙烧来制取白磷: (1) 配平下列化学方程式: Ca3
高一奥化!!高手快进!!
工业上将磷酸钙、石英砂和碳粉混合在电弧炉中焙烧来制取白磷:
(1) 配平下列化学方程式:
Ca3(PO4)2 + SiO2 + C ---- CaSiO3 + Px + CO
(2) 反应得到的气体的密度是相同条件下氢气的18.37倍,据此计算反应制得白磷的相对分子量_____.
注明:(1)题答案为:Ca3(PO4)2 + 3SiO2 + 5C ---- 3CaSiO3 + (2/x)Px + 5CO
急求(2)题的方法!
请详细解答!拜托了!
拜托不要灌水!!
 长今的ee1年前2
长今的ee1年前2 -
 先烈中路 共回答了23个问题
先烈中路 共回答了23个问题 |采纳率91.3%楼上理解太麻烦了吧。记住密度=质量/体积就可以了。因为相同温度,相同压强,相同物质的量的气体有相同的体积(比如标准条件下1mol任何气体的体积为22.4L,这里设摩尔体积为V L/mol)。这样就可以列方程了。
2 Px ~ 5x CO,为方便计算,不妨令Px为2mol,CO为5x mol,H2为1mol。
1 mol * 2 g/mol / (1mol*V L/mol) * 18.37 (氢气的密度×18.37)
=
( 2mol * 31x g/mol + 5x mol * 28 g/mol ) / [ ( 5x + 2 )mol * V L/mol ] (混合气体的密度)
解得 x≈4
列式的时候把单位带上,检查一下等式两边的单位是不是一致的,是不是密度的单位,不一致的话肯定是列错了。
推荐就记住密度=质量/体积这种简单的公式就可以了,完全可以写出来,不要记一些看似很简单的结论,因为这种结论多如牛毛,记不下来的。做题的时候往往就去想有什么结论去了,而这种只需要用定义式做的题却想不到。1年前查看全部
- FeSO4焙烧分解吗?
 bjr01111年前1
bjr01111年前1 -
 股界007 共回答了18个问题
股界007 共回答了18个问题 |采纳率88.9%FeSO4的分解产物(分解温度约500℃)是Fe2O3、SO2和SO3,反应方程式如下:
2FeSO4=(500℃)=Fe2O3+SO2+SO31年前查看全部
- 为什么说硫化锌是较难焙烧的硫化物?
 会会入会1年前2
会会入会1年前2 -
 亮泽 共回答了18个问题
亮泽 共回答了18个问题 |采纳率94.4%白色或微黄色粉末.在H2S气氛中灼烧即转变为晶体.α变体为无色六方晶体,密度3.98g/cm3,熔点1700±28℃(202.66千帕--20大气压);β变体为无色立方晶体,密度4.102g/cm3,于1020℃转化为α型.存在于闪锌矿中.Β型硫化锌为立方结晶.白色至灰白色或黄色粉末.相对密度4.102,熔点l700℃.晶型转变温度1020℃.
熔点1700多度,你说焙烧容易吗?1年前查看全部
- 焙烧 为什么需要泥三角
 6647111年前2
6647111年前2 -
 qzelogin 共回答了19个问题
qzelogin 共回答了19个问题 |采纳率94.7%泥三角因有耐热的陶瓷管包着因此可耐高温,而其中空的管柱内又有铁线穿过故可承受重量.当有物体需要加热时通常都会将泥三角置于铁环上做为该物的支撑.最常见到的是在坩埚加热的实验中使用.实验室常用坩埚是瓷制的,铁三角是铁制的.而瓷与铁的膨胀系数不同,若瓷坩埚与铁三角直接接触加热,可能导致瓷坩埚炸裂.1年前查看全部
- 火法炼铜首先要焙烧黄铜矿,主要涉及以下反应:
火法炼铜首先要焙烧黄铜矿,主要涉及以下反应:
①2CuFeS2+O2=Cu2S+2FeS+SO2
②Cu2S+O2=2Cu+SO2
下列说法正确的是( )
A.在反应①中:SO2既是氧化产物又是还原产物
B.在反应②中:Cu2S仅作还原剂,硫元素被氧化
C.在反应①中:每转移1.2 mol电子,有0.2 mol硫被氧化
D.在反应②中:每消耗1.0 molCu2S,有4.0 mol电子转移 二十四桥依旧1年前1
二十四桥依旧1年前1 -
 回头是岸吗 共回答了19个问题
回头是岸吗 共回答了19个问题 |采纳率100%解题思路:A、标注元素化合价变化,依据氧化还原反应的概念分析判断,还原剂被氧化生成氧化产物,氧化剂被还原生成氧化产物;
B、标注化合价分析判断;
C、依据化学方程式和电子守恒、化合价变化计算判断;
D、依据化学方程式和电子守恒、化合价变化计算判断;A、2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,则SO2既是氧化产物又是还原产物,故A正确;
B、Cu2S+O2=2Cu+SO2,铜元素化合价从+1价降到0价,氧元素化合价从 0价降低到-2价,硫元素化合价从-2价升高到+4价,则在反应②中:Cu2S即作氧化剂又做还原剂,硫元素被氧化,故B错误;
C、2CuFeS2+O2=Cu2S+2FeS+SO2中,硫元素化合价从-2价升高到+4价,所以生成1molSO2转移电子为6mol,被氧化的硫元素为1mol,每转移1.2 mol电子,有0.2 mol硫被氧化,故C正确;
D、Cu2S+O2=2Cu+SO2,铜元素化合价从+1价降到0价,氧元素化合价从 0价降低到-2价,硫元素化合价从-2价升高到+4价,消耗1molCu2S,电子转移6mol,故D错误;
故选AC.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应的概念应用,电子守恒的判断,化合价的升降分析判断概念的应用,转移电子的计算方法.1年前查看全部
- 求氯化亚铁溶液经高温焙烧的化学方程式?
 若子xiang1年前1
若子xiang1年前1 -
 mingyangzeng 共回答了22个问题
mingyangzeng 共回答了22个问题 |采纳率90.9%4Fecl2+4H2O+O2=2Fe2O3+8HCl
111年前查看全部
- 采用活性炭负载Pd-Cu催化剂去除硝酸盐,第一次采用硼氢化纳还原的时候没有金属掉下,但是回收后经过干燥、焙烧再还原就有金
采用活性炭负载Pd-Cu催化剂去除硝酸盐,第一次采用硼氢化纳还原的时候没有金属掉下,但是回收后经过干燥、焙烧再还原就有金属掉下来,是什么原因
回收就是使用以后经过干燥焙烧还原后再利用,分析第一次不掉金属可能是形成了络合物,第二次掉是因为被还原成了金属,金属在焙烧时被氧化了,氧化形成的氧化物在还原的时候部分掉了下来,但是在200度焙烧不会掉金属,只有温度大于300度的时候才会掉金属 最爱况ii1年前1
最爱况ii1年前1 -
 kermosi 共回答了16个问题
kermosi 共回答了16个问题 |采纳率81.3%回收时的催化剂是什么?反应后的了,虽然性能没变但结构变了,不然不会促进反应,这样当然会有金属脱落了.这个原因还是由于吸附的状态程度不够理想,倘若能改变一下吸附的方法,使之与载体结合紧密就会好多了.1年前查看全部
- (2013•开封模拟)紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘
(2013•开封模拟)紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.已知:
图1为某兴趣小组模拟从紫菜提取碘单质的过程:乙醇 四氯化碳 裂化汽油 碘(晶体) 密度/g•cm-3 0.7893 1.595 0.71~0.76 4.94 沸点/℃ 78.5 76.8 25~232 184.35 
(1)实验室中焙烧紫菜用到的仪器有______(填写相应的字母).
A.烧杯B.表面皿C.蒸发皿D.坩埚
E.试管F.酒精灯G.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,该反应的离子方程式为______,
(3)操作①的名称是______;操作②中所用的主要玻璃仪器为______,振荡、静置,待液体分层后,应首先将______(填“上层”或“下层”)液体分离出来.
(4)试剂A为______(填本题表格中一种最佳化学试剂的名称),
不选择另外两种试剂的主要原因分别是:①______;②______.
(5)将图2框图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离. 宫廷玉液1年前1
宫廷玉液1年前1 -
 foreverjinyi 共回答了19个问题
foreverjinyi 共回答了19个问题 |采纳率84.2%解题思路:(1)实验室中焙烧紫菜,因为紫菜是固体,要置于坩埚中加热,所以要用到的仪器有坩埚、酒精灯、泥三角等.
(2)焙烧所得的紫菜灰主要含有碘离子,与足量的双氧水和稀硫酸作用,会发生氧化还原反应,方程式为:2I-+H2O2+2H+=I2+2H2O.
(3)操作①主要是将浸泡后紫菜灰和溶液的混合物中杂质去除,留下含碘离子的溶液,操作②主要是把碘单质从水中萃取到四氯化碳溶液中.
(4)萃取碘水中的碘,选四氯化碳做萃取剂,因为乙醇与水互溶,裂化汽油与碘会发生加成反应,都不适合做萃取剂.
(5)为了实现实验目的,图2框图中缺少温度计和接受液体的装置及石棉网.(1)实验室中焙烧紫菜,因为紫菜是固体,要置于坩埚中加热,所以要用到的仪器有坩埚、酒精灯、泥三角等,故答案为:DFG.
(2)焙烧所得的紫菜灰主要含有碘离子,与足量的双氧水和稀硫酸作用,会发生氧化还原反应,方程式为:2I-+H2O2+2H+=I2+2H2O,故答案为:2I-+H2O2+2H+=I2+2H2O.
(3)操作①主要是将浸泡后紫菜灰和溶液的混合物中杂质去除,留下含碘离子的溶液,操作②主要是把碘单质从水中萃取到四氯化碳溶液中,然后再分液,且在分液时下层液体从下口放出后,上层液体要从上口倒出,故答案为:过滤;分液漏斗;下层.
(4)萃取碘水中的碘,选四氯化碳做萃取剂,因为乙醇与水互溶,裂化汽油与碘会发生加成反应,都不适合做萃取剂,故答案为:四氯化碳;乙醇与水互溶;裂化汽油与碘会发生加成反应.
(5)为了实现实验目的,图2框图中缺少温度计和接受液体的装置及石棉网,装置如图 :故答案为:
:故答案为:
点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;海水资源及其综合利用.
考点点评: 本题以碘的提取为载体,考查了学生对混合物的分离提纯的掌握情况,同时考查了氧化还原反应的书写,难度不大,中等偏易的难度.1年前查看全部
- 金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS 2 +O 2 =
金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS 2 +O 2 = 
+2FeS+SO 2
下列说法不正确的是( )A.方框中的物质应为Cu 2 S B.O 2 只作氧化剂 C.SO 2 既是氧化产物又是还原产物 D.若有1molSO 2 生成,则反应中有4mol电子转移  kk1badq1年前1
kk1badq1年前1 -
 zvzv27 共回答了23个问题
zvzv27 共回答了23个问题 |采纳率82.6%A.由质量守恒定律可知,Cu、S原子守恒,则方框中的物质应为Cu 2 S,故A正确;
B.反应中O元素的化合价降低,则O 2 只作氧化剂,故B正确;
C.S元素由-1价升高到+4价,O元素0价降低为-2价,则SO 2 既是氧化产物又是还原产物,故C正确;
D.若有1molSO 2 生成,则反应中转移的电子为1mol×(4-(-2))=6mol,故D错误;
故选D.1年前查看全部
- (2014•崇明县一模)粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.以粗CuO为原料制备
(2014•崇明县一模)粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.以粗CuO为原料制备胆矾的主要流程如图所示:
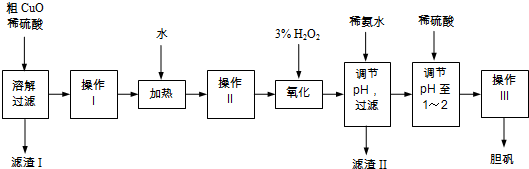
经操作I得到粗胆矾,操作III得到精制胆矾.两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤.
已知:Fe3+、Fe2+、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如表:
(1)溶解、过滤需要用到玻璃棒,它的作用是______.Fe3+ Fe2+ Cu2+ 开始沉淀时的pH 2.7 7.6 5.2 完全沉淀时的pH 3.7 9.6 6.4
(2)写出加入3% H2O2后发生反应的离子方程式______(原溶液显酸性).
(3)加稀氨水调节pH应调至范围______.下列物质可用来替代稀氨水的是______.(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
(4)操作Ⅲ析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、______.
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如表所示:
两次都无须再做第三次加热、冷却、称量,理由是______,该生此次实验的相对误差为______%(保留1位小数),产生实验误差的原因可能是______(填字母).第一次实验 第二次实验 坩埚质量(g) 14.520 14.670 坩埚质量+晶体质量(g) 17.020 18.350 第一次加热、冷却、称量(g) 16.070 16.989 第二次加热、冷却、称量(g) 16.070 16.988
A.加热前称量时坩埚未完全干燥
B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却
D.玻璃棒上沾有的固体未刮入坩埚. 沅起沅灭1年前1
沅起沅灭1年前1 -
 橙色朝阳 共回答了13个问题
橙色朝阳 共回答了13个问题 |采纳率84.6%解题思路:在粗CuO中加入硫酸生成硫酸铜、硫酸铁、硫酸亚铁等物质,经操作I得到粗胆矾,然后加入过氧化氢,将亚铁离子氧化为铁离子,使之在铜离子之前沉淀,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,然后调节溶液pH1~2之间可得到纯净的硫酸铜溶液,经蒸发浓缩、冷却结晶可得到胆矾,
(1)溶解时需要玻璃棒搅拌,过滤时需要玻璃棒引流;
(2)过氧化氢与Fe2+发生氧化还原反应;
(3)调节pH的范围应使Fe3+完全沉淀而Cu2+不生成沉淀,且尽量不引入新的杂质;
(4)因加入氨水,则可能生成(NH4)2SO4 或NH4HSO4;
(5)根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水x的值,在测定中若被测样品中含有加热挥发的杂质或实验前容器中有水或玻璃棒上沾有的固体未刮入坩埚,都会造成测量结果偏高.在粗CuO中加入硫酸生成硫酸铜、硫酸铁、硫酸亚铁等物质,经操作I得到粗胆矾,然后加入过氧化氢,将亚铁离子氧化为铁离子,使之在铜离子之前沉淀,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,然后调节溶液pH1~2之间可得到纯净的硫酸铜溶液,经蒸发浓缩、冷却结晶可得到胆矾,
(1)溶解时需要玻璃棒搅拌,过滤时需要玻璃棒引流,故答案为:搅拌、引流;
(2)过氧化氢与Fe2+发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)调节pH的范围应使Fe3+完全沉淀而Cu2+不生成沉淀,由表中数据可知应调节pH介于3.7~5.2之间,且尽量不引入新的杂质,则可用氢氧化铜、氧化铁或碳酸铜代替,不能够用氢氧化钠或碳酸氢钠,易引入硫酸钠杂质,
故答案为:3.7~5.2;BC;
(4)因加入氨水,则可能生成(NH4)2SO4 或NH4HSO4,故答案为:(NH4)2SO4 或NH4HSO4;
(5)由表中数据可知,由表格中的数据,第一次酸硫铜的质量为16.070g-14.520g=1.55g,水的质量:17.020g-16.070g=0.95g,
第二次酸硫铜的质量为:[16.988+16.989/2]g-14.670g=2.3185g,水的质量:18.350g-[16.988+16.989/2]g=1.3615g,
硫酸铜的平均质量为[1.55g+2.3185g/2]=1.934g,水的平均重量为[0.95g+1.3615g/2]=1.156g,
则n(CuSO4)=[1.934g/160g/mol]=0.012mol,n(H2O)=[1.156g/18g/mol]=0.0642mol,
则结晶水的个数为[0.0642/0.012]=5.352,
该生此次实验的相对误差=[5.352−5/5.352]×100%=+6.6%,
A.加热前称量时坩埚未完全干燥,加热后水挥发,导致水的质量测定结果偏大,故A正确;
B.该胆矾中含有受热不分解的杂质,会导致硫酸铜质量偏小,水的含量偏小,故B错误;
C.加热后坩埚放在干燥器中冷却,对实验没有影响,故C错误;
D.玻璃棒上沾有的固体未刮入坩埚,导致固体质量偏小,水的质量偏大,故D正确.
故答案为:已达恒重;+6.6%;AD.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和操作方法,难度不大,易错点为(5),注意把握误差的计算方法,从题目本身对学生的实验能力要求较高,但此题实际上就来源于课本的学生实验,只要学生认真的去操作过、体验过、思考过,就会觉得很熟悉、很简单.1年前查看全部
- 焙烧温度过高或过低对Pd/γ-Al2O3催化剂有什么影响?
 muddle_No11年前1
muddle_No11年前1 -
 罗小罗 共回答了18个问题
罗小罗 共回答了18个问题 |采纳率83.3%温度高催化剂被破坏
温度低催化剂没有活性1年前查看全部
- 生石膏加热反应的化学方程式将生石膏(CaSO4·2H2O)放入火中焙烧是制作石膏豆腐时的一个关键工序.生石膏加热至163
生石膏加热反应的化学方程式
将生石膏(CaSO4·2H2O)放入火中焙烧是制作石膏豆腐时的一个关键工序.生石膏加热至163°C,失去结晶水变成熟石膏(CaSO4).该反应的化学方程式是----------------. 2819578771年前2
2819578771年前2 -
 黄山侠客 共回答了13个问题
黄山侠客 共回答了13个问题 |采纳率76.9%CaSO4·2H2O ===(条件163度) CaSO4 + 2H2O1年前查看全部
- 下列事实中肯定不属于熔化的是( ) A 白糖受潮后逐渐变为液体.B 白糖放在锅中焙烧成液体.
下列事实中肯定不属于熔化的是( ) A 白糖受潮后逐渐变为液体.B 白糖放在锅中焙烧成液体.
C 冰在10℃的环境下逐渐变为水.
D石蜡被加热时逐渐软化成液体.
我要答案更要原因! PPCurve1年前1
PPCurve1年前1 -
 fjdsgwj 共回答了23个问题
fjdsgwj 共回答了23个问题 |采纳率87%熔化是通过对物质加热,使物质从固态变成液态的相变过程.
熔化要吸收热量,是吸热过程.
选A 不是受热,是受潮 其他都是受热1年前查看全部
- 铜的冶炼大致可分为:(1)富集,将硫化物矿进行浮选;(2)焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
(3)制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑;
(4)电解精炼.
下列说法正确的是( )
A.上述灼烧过程的尾气均可直接排空
B.由6molCuFeS2生成6molCu,上述共消耗15molO2
C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,作氧化剂只有Cu2O
D.电解精炼时,粗铜应与外电源负极相连 冰雪皑1年前1
冰雪皑1年前1 -
 huanghm927 共回答了13个问题
huanghm927 共回答了13个问题 |采纳率100%解题思路:A、根据尾气SO2气体的性质判断能否直接排空;
B、根据最终产物为Cu、SO2和FeO可写出反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据总反应方程式判断;
C、根据反应物各元素的化合价的变化判断;
D、精炼铜时,粗铜做阳极.A、SO2有毒,不能直接排放到空气中,故A错误;
B、反应的总反应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,由6molCuFeS2生成6molCu,共消耗15molO2,故B正确;
C、在反应2Cu2O+Cu2S=6Cu+SO2↑中,Cu的化合价由+1价升高为+2价,S的化合价由-2价升高为+4价,反应物中Cu2O只做氧化剂,Cu2S既是氧化剂又是还原剂,故C错误;
D、精炼铜时,粗铜做阳极,与电源的正极相连,故D错误.
故选B.点评:
本题考点: 金属冶炼的一般原理;铜的电解精炼;氧化还原反应.
考点点评: 本题考查金属的冶炼以及氧化还原有关知识,题目难度不大,注意分析C项中各元素的化合价的变化特点,以正确分析氧化剂和还原剂.1年前查看全部
- 接触法制硫酸的生产过程中焙烧硫铁矿(含FeS2)时发生的主要化学反应是( )
接触法制硫酸的生产过程中焙烧硫铁矿(含FeS2)时发生的主要化学反应是( )
A.FeS2
FeS+S△ .
B.4FeS2+11O2
2Fe2O3+8SO2△ .
C.4FeS2+15O2
2Fe2O3+8SO3△ .
D.4FeS2+3O2
2Fe2O3+8S△ . honshu1年前1
honshu1年前1 -
 moonwei 共回答了20个问题
moonwei 共回答了20个问题 |采纳率95%解题思路:由工业制硫酸的工艺流程可知,铁矿石在沸腾炉中燃烧生成二氧化硫和氧化铁,接触室中二氧化硫催化氧化为三氧化硫,吸收塔中吸收三氧化硫生成硫酸;所以生产过程中焙烧硫铁矿(含FeS2)时发生的主要化学反应是铁矿石在沸腾炉中燃烧生成二氧化硫和氧化铁,采用最小公倍数法利用质量守恒定律即可解答.接触法制硫酸的生产过程中焙烧硫铁矿(含FeS2),是铁矿石在沸腾炉中燃烧生成二氧化硫和氧化铁,FeS2+O2→Fe2O3+SO2,以Fe元素为标准,其最小公倍数为2,FeS2的化学计量数为2,Fe2O3的化学计量数为1,SO2的化学计量...
点评:
本题考点: 工业制取硫酸.
考点点评: 本题主要考查了接触法制硫酸的生产过程中焙烧硫铁矿反应原理,熟悉反应原理掌握最小公倍数法配平是解答的关键,题目难度不大.1年前查看全部
- 铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 ═Cu
铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 ═Cu 2 S+3SO 2 +2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 ═2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S═6Cu+SO 2 ↑;④电解精炼铜.
下列说法正确的是( )A.冶炼过程中的尾气可用来制硫酸 B.上述过程中,由1molCuFeS 2 制取1molCu时共消耗2molO 2 C.在反应2Cu 2 O+Cu 2 S═6Cu+SO 2 ↑中,只有Cu 2 O作氧化剂 D.电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g  曲尘1年前1
曲尘1年前1 -
 jimmy4446 共回答了21个问题
jimmy4446 共回答了21个问题 |采纳率95.2%A、在铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫的制取硫酸的原料,所以冶炼过程中的尾气可用来制硫酸,故A正确.B、反应的总分应方程式为6CuFeS 2 +15O 2 =6Cu+12SO 2 +6FeO,由1molCu...1年前查看全部
- 硫铁矿在焙烧后产出的铁渣的含铁量和硫铁矿的含硫量的关系怎么算假设是这个公式:4FeS2+11O2=2Fe2O3+8SO2
硫铁矿在焙烧后产出的铁渣的含铁量和硫铁矿的含硫量的关系怎么算假设是这个公式:4FeS2+11O2=2Fe2O3+8SO2
如题,硫酸沸腾焙烧里面的, jjzxz6661年前1
jjzxz6661年前1 -
 奔腾的芯 共回答了16个问题
奔腾的芯 共回答了16个问题 |采纳率87.5%该题只能假设硫铁矿中的杂质不含S、Fe元素,且焙烧过程中杂质没有质量损失才可以计算.
设硫铁矿质量分数为X,
那么单位重量硫铁矿中的黄铁矿重量为(64+56)/64*X,杂质重量为1-(64+56)/64*X
黄铁矿经焙烧生成氧化铁的重量为(64+56)/64*X*160*2/(4*(64+56))=1.25X
焙烧后铁渣的总重量为(64+56)/64*X*160*2/(4*(64+56))+1-(64+56)/64*X=1-0.625X
烧渣中铁的重量为1.25X*112/160=0.875X
所以:烧渣中铁的品位为0.875X/(1-0.625X)1年前查看全部
- 有一黑色固体A,在氧气中焙烧,得红棕色固体B和气体C.将A加入HCl中,得到D气体和E溶液.在E溶液中加足量NaOH溶液
有一黑色固体A,在氧气中焙烧,得红棕色固体B和气体C.将A加入HCl中,得到D气体和E溶液.在E溶液中加足量NaOH溶液,得到白色沉淀,将该白色沉淀取出置于空气中,然后在空气中加热,可得到B,完成下列问题:
(1)写出A、C、D的化学式:A______________,C______________,D_________________. 汤汤汤1年前1
汤汤汤1年前1 -
 糜烂的猫 共回答了17个问题
糜烂的猫 共回答了17个问题 |采纳率88.2%A:Fe;
B: Fe3O2
C: CO2
D:H2
E: FeCI21年前查看全部
- (2014•陕西三模)火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2则下列说法正确的
(2014•陕西三模)火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2则下列说法正确的是( )
A.CuFeS2仅作还原剂,硫元素被氧化
B.每生成1mol Cu2S,有4 mol硫被氧化
C.SO2只是氧化产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.2 mol硫被氧化 mingmei351年前1
mingmei351年前1 -
 qq海角1234 共回答了18个问题
qq海角1234 共回答了18个问题 |采纳率100%解题思路:反应2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,以此解答该题.A.Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,CuFeS2既是氧化剂又是还原剂,故A错误;
B.由方程式可知,每生成1mol Cu2S,有1mol硫被氧化生成SO2,其它物质中的S元素化合价没有发生变化,故B错误;
C.生成FeS,元素化合价没有变化,FeS不是还原产物,也不是氧化产物,故C错误;
D.元素化合价升高的只有S元素,由-2价升高到+4价,变化6价,则每转移1.2mol电子,有0.2mol硫被氧化,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意元素化合价的判断,为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.1年前查看全部
- (2013•河南模拟)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的
(2013•河南模拟)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是( )
A.SO2既是氧化产物又是还原产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1 molCu2S,有4mol硫被氧化
D.每转移1.2 mol电子,有0.1 mol硫被氧化 eleven-l1年前1
eleven-l1年前1 -
 雪河之子 共回答了24个问题
雪河之子 共回答了24个问题 |采纳率75%解题思路:2CuFeS2+O2→Cu2S+2FeS+SO2中,Cu元素的化合价由+2价降低为+1价,O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,以此来解答.A.O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,则SO2既是氧化产物又是还原产物,故A正确;
B.Cu元素的化合价降低,S元素的化合价升高,则CuFeS2既作还原剂又作还原剂,S元素被氧化,故B错误;
C.由反应可知,生成1 molCu2S,有1mol硫被氧化,故C错误;
D.由反应可知,1molS被氧化转移6mol电子,则每转移1.2 mol电子,有0.2mol硫被氧化,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念的考查,题目难度不大.1年前查看全部
- (2011•如皋市模拟)铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 &
(2011•如皋市模拟)铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2
2PbO+2SO2;③制粗铅:PbO+C高温 .
Pb+CO;PbO+CO高温 .
Pb+CO2.下列说法正确的是( )高温 .
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS冶炼成Pb理论上至少需要6g碳 第三日1年前1
第三日1年前1 -
 DIANCHANGDE 共回答了17个问题
DIANCHANGDE 共回答了17个问题 |采纳率94.1%解题思路:A、有新物质生成的反应是化学变化;
B、化合价升高元素所在的反应物是还原剂,化合价降低元素所在的产物是还原产物;
C、根据化合价降低值=化合价升高值=转移电子数,结合原子守恒来回答;
D、根据化学方程式找出物质间的关系并进行计算.A、浮选法富集方铅矿的过程没有新物质生成,属于物理变化,故A错误;
B、方铅矿焙烧反应2PbS+3O2
高温
.
2PbO+2SO2中,PbS中S元素化合价升高,是还原剂,氧元素化合价降低,还原产物有PbO和SO2,故B错误;
C、整个冶炼过程中,根据Pb原子守恒,则PbS转化为PbO转移电子是2mole-,PbO转化为Pb转移电子是2mole-,所以制取1molPb共转移4mol电子,故C错误;
D、将1molPbS冶炼成Pb的过程中,根据方程式得出:2PbS~2PbO~C~2Pb,1molPbS冶炼成Pb理论上至少需要0.5mol的碳,即需要6g碳,故D正确.
故选D.点评:
本题考点: 金属冶炼的一般原理;氧化还原反应的计算.
考点点评: 本题是一道关于氧化还原反应知识的综合题目,注意平时知识的积累是解题的关键,难度中等.1年前查看全部
- 铜的冶炼过程大致可分为: ①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 ===Cu 2
铜的冶炼过程大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS 2 +4O 2 ===Cu 2 S+3SO 2 +2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 ===2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S===6Cu+SO 2 ↑;
④电解精炼铜。
下列说法正确的是[ ]A.冶炼过程中的尾气可用来制硫酸
B.上述过程中,由1 mol CuFeS 2 制取1 mol Cu时共消耗2 mol O 2
C.在反应2Cu 2 O+Cu 2 S===6Cu+SO 2 ↑中,只有Cu 2 O作氧化剂
D.电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g wzok1年前1
wzok1年前1 -
 zjcky 共回答了26个问题
zjcky 共回答了26个问题 |采纳率76.9%A1年前查看全部
- 固相反应对烧结过程和球团过程焙烧有何作用
 yz1261年前1
yz1261年前1 -
 天渊客腾蛟人 共回答了21个问题
天渊客腾蛟人 共回答了21个问题 |采纳率95.2%固相反应一般是固体质点进行扩散迁移并发生化学反应,颗粒与颗粒之间形成固体连接桥(或者连接颈),化合物和固溶体把颗粒连接起来.塔曼学派的观点认为,固相反应开始的温度都比较低,开始反应的温度远低于它们的熔点或它们的低共熔点,该温度与其熔点之间存在一定的规律,对于盐类和氧化物,开始反应的温度T反≈0.57T熔;对于硅酸盐及有机物,T反≈(0.0.9)T熔.
我们知道烧结矿的固结方式主要依靠液相固结,而球团矿的固结方式依靠的是固相固结.固相反应形成了原始料中所没有的低熔点新物质,特别是在烧结过程中,随着温度的提高,这些低熔点物质将是液相形成的先导,因为液相的存在对固相物质的扩散提供了通道,强化了固相扩散反应;另外,液相的存在能将固体颗粒表面润湿,并靠表面张力的作用使颗粒靠近、拉紧、并重新排列,这对扩大颗粒之间的反应界面有利;液相使固体颗粒溶解、重结晶和促进晶体长大.1年前查看全部
- 陶瓷在焙烧过程中发生了怎样的化学反应?
 刘毅哥哥1年前1
刘毅哥哥1年前1 -
 粉红oo巫 共回答了17个问题
粉红oo巫 共回答了17个问题 |采纳率94.1%是一个非常复杂的化学反应,主要有硅,铁等元素产生化学变化!所以陶瓷工业有时候也叫硅酸盐工业!
——————————————————————————
CaO+SiO2--->CaSiO3 这是制作陶瓷的原理1年前查看全部
- 关于硫化亚铜和空气反应从含硫化亚铜(Cu2S)的铜矿石中冶炼铜的一种方法是:①先将铜矿石通入空气高温焙烧,生成黑色固体和
关于硫化亚铜和空气反应
从含硫化亚铜(Cu2S)的铜矿石中冶炼铜的一种方法是:①先将铜矿石通入空气高温焙烧,生成黑色固体和有刺激性气味的气体;②再将所得的黑色固体和未经焙烧的铜矿石混合均匀后,在隔绝空气条件下高温煅烧,得到金属铜和有刺激性气味的气体.请写出上述反应的化学方程式
①
②
谢谢大神,这里5分挂着啦
 cfsms1年前1
cfsms1年前1 -
 coldx98 共回答了15个问题
coldx98 共回答了15个问题 |采纳率93.3%Cu2S+O2=CuO+SO2
CuO+Cu2S=Cu+SO21年前查看全部
- 我在焙烧硫磺 制造硫酸时 触媒上会出现金黄色物质覆盖触媒表面并将触媒粘在一起 请问此物质是什么 如何解
我在焙烧硫磺 制造硫酸时 触媒上会出现金黄色物质覆盖触媒表面并将触媒粘在一起 请问此物质是什么 如何解
我们烧的是含硫量50%左右的 硫磺渣 以前烧好硫磺的时候都没出现过 现在 触媒上出现了少量的金黄色物质 覆盖在触媒表面 并把触媒粘在一起 使风机阻力增加.那是什么东西.用刀刮下来呈粉末状
触媒确实是 钒触媒 但是 经过700度高温加热 那种固体还在啊.应该不是硫吧? 忍不住也得忍1年前1
忍不住也得忍1年前1 -
 Google测试员3352 共回答了14个问题
Google测试员3352 共回答了14个问题 |采纳率100%硫化亚铁结晶,俗称愚人金,焙烧时矿渣里少许共价硫化亚铁挥发,遇到催化剂温度下降结晶.1年前查看全部
- 制备二氧化钛为什么要焙烧采用溶胶-凝胶法制备二氧化钛时,焙烧的作用是什么呢?
 专砍带刀的1年前1
专砍带刀的1年前1 -
 好花常开 共回答了17个问题
好花常开 共回答了17个问题 |采纳率76.5%将固体物质加热到高温以达到脱水、分解或除去挥发性杂质、烧去有机物等目的的操作 称为灼烧(也就是焙烧).焙烧二氧化钛是为了使其改变晶型和性质等.1年前查看全部
- 钨钼经过煤焙烧后会产生什么混合气体
钨钼经过煤焙烧后会产生什么混合气体
钨钼是指钨钼矿石 mdkylc1年前1
mdkylc1年前1 -
 vpandoor 共回答了16个问题
vpandoor 共回答了16个问题 |采纳率87.5%产生的多是SO2
因为Mo,W等矿石多以硫化物的形式存在
句个例子,MoS2焙烧的方程式是
2MoS2+7O2===2MoO3+4SO21年前查看全部
- 关于硫酸的制法的一些问题..1黄铁矿焙烧前要粉碎,解释是黄铁矿不能燃烧..为什么错?2沸腾炉出来的炉气必须净化,因为杂质
关于硫酸的制法的一些问题..
1黄铁矿焙烧前要粉碎,解释是黄铁矿不能燃烧..为什么错?
2沸腾炉出来的炉气必须净化,因为杂质会和SO2反应..为什么错?
3SO2氧化成SO3时需要使用催化剂,因为要提高SO2的转化率...为什么错? wwxtu241年前1
wwxtu241年前1 -
 heqing1980 共回答了17个问题
heqing1980 共回答了17个问题 |采纳率70.6%黄铁矿可以燃烧,粉碎是为了彻底完全燃烧;
杂质气体会使催化剂钝化;
催化剂不能提高转化率.1年前查看全部
- 铜的冶炼过程大致可分为: ①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S
铜的冶炼过程大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S+3SO 2 +2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 =2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑;
④电解精炼铜
下列说法正确的是[ ]A.上述过程中,由1molCuFeS 2 制取1molCu时共消耗2molO 2
B.在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,只有Cu 2 O作氧化剂
C.电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量一定为32g
D.冶炼过程中的尾气可用来制硫酸 duke5111年前1
duke5111年前1 -
 20070910cd 共回答了19个问题
20070910cd 共回答了19个问题 |采纳率94.7%D1年前查看全部
- 铜的冶炼大致可分为:(1)富集,将硫化物矿进行浮选;(2)焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S+3SO 2 +2FeO(炉渣);
(3)制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 =2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑;
(4)电解精炼.
下列说法正确的是( )A.上述灼烧过程的尾气均可直接排空 B.由6molCuFeS 2 生成6molCu,上述共消耗15molO 2 C.在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,作氧化剂只有Cu 2 O D.电解精炼时,粗铜应与外电源负极相连  shapei0011年前1
shapei0011年前1 -
 mmqsf 共回答了25个问题
mmqsf 共回答了25个问题 |采纳率84%A、SO 2 有毒,不能直接排放到空气中,故A错误;
B、反应的总分应方程式为6CuFeS 2 +15O 2 =6Cu+12SO 2 +6FeO,由6molCuFeS 2 生成6molCu,共消耗15molO 2 ,故B正确;
C、在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,Cu的化合价由+1价升高为+2价,S的化合价由-2价升高为+4价,反应物中Cu 2 O只做氧化剂,Cu 2 S既是氧化剂又是还原剂,故C错误;
D、精炼铜时,粗铜做阳极,与电源的正极相连,故D错误.
故选B.1年前查看全部
- 有色金属冶炼行业 硫化锌精矿焙烧后,二氧化硫烟气制硫酸,请问从投矿量算产酸量的公式 理论值
有色金属冶炼行业 硫化锌精矿焙烧后,二氧化硫烟气制硫酸,请问从投矿量算产酸量的公式 理论值
矿S含量32% 水分9% 转化率99.6% 吸收率99.5% 酸浓93% evening_mist1年前1
evening_mist1年前1 -
 tense 共回答了20个问题
tense 共回答了20个问题 |采纳率90%工业硫酸的计算一般以干基计算.你的矿含硫32%,可能指干基含硫.吸收率99.5%不能达标排放,一般吸收率很容易达到99.95%.计算产量,一般按标酸(浓度100%,不是含量100%)计算.还需要焙烧的烧出率,净化的收得率的值.一般硫的总收得率在95%~96%之间.硫的总收得率取96%,一吨含硫32%(干基)矿可生产940kg标酸.1年前查看全部
大家在问
- 1砂石怎么能变成细沙呢?是不是经过某种机器啊?
- 2I don't envy others have much good,but I envy you for others
- 3一个定语从句I'll never forget the days when I studied in the middl
- 4青岛版小学四年级数学下册第7页15题:一个响铃每次响铃时间4秒,中间间隔2秒,响铃x次,持续时间多少秒?
- 5化简求值,c求过程,o(≧ o ≦)o谢谢
- 6形容我国地大物博'风景秀丽'古诗句有那些
- 7帮我把这段翻译一下。谢谢!Lingling went to London Town.She met john , a l
- 8浓硫酸中溶质的百分数能达98%,那么浓盐酸呢?
- 9某人从A地驱车赶往B地公用2个小时 A地至B地全程为120KM
- 10《影响世界的名人在童年》书中一个感人的故事
- 11犊的文言文翻译是神马意思?全一点.
- 12do you know the girl dressing of the short skirt为什么用 dressin
- 13一张桌子32元一把椅子24元学校买来桌子椅子共38件总计1096元桌椅各买了多少件?怎么写
- 14年 级 一年级 二年级 三年级 四年级 五年级 六年级 金额/元 270 360 246 420 354 54
- 15求报纸上的英语作文,假如你是李华,近期你的美国朋友Bob将去四川省 游玩,请你根据以下要点向他介绍 1.九寨沟位于四川省

