硝酸亚铁和硝酸反应方程式
 垫起脚尖2022-10-04 11:39:542条回答
垫起脚尖2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 波何 共回答了18个问题
波何 共回答了18个问题 |采纳率94.4%- 3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O 稀硝酸
Fe(NO3)2+2HNO3=Fe(NO3)3+NO2↑+H2O 浓硝酸 - 1年前
 方便爱 共回答了8个问题
方便爱 共回答了8个问题 |采纳率- 稀硝酸:9Fe(No3)2+12Hcl=4Fecl3+3No+6H2o+5Fe(No3)3
浓硝酸:3Fe(No3)2+6Hcl=2Fecl3+3No2+3H2o+Fe(No3)3 - 1年前
相关推荐
- 高中化学方程式及其配平硝酸亚铁和碘化氢反应化学方程式,还有怎么配平呢?有点难啊是和HI溶液
 cundum1年前6
cundum1年前6 -
 dairyman123 共回答了16个问题
dairyman123 共回答了16个问题 |采纳率93.8%Fe(NO3)2+8HI==2NO+3I2+FeI2+4H2O HI过量
2Fe(NO3)2+4HI==NO+I2+Fe(NO3)3+FeI2+2H2O HI少量
但要注意这是两个极端情况下的反应方程式,根据题目所给的量不同,可以是这两个方程式按一定比例的叠加,一般会出计算题,给你信息让你最终写出方程式的~1年前查看全部
- 锌片、铁片、稀硫酸、硝酸银溶液、硝酸亚铁溶液、氢氧化钠溶液从中选
锌片、铁片、稀硫酸、硝酸银溶液、硝酸亚铁溶液、氢氧化钠溶液从中选
反应后质量不变的.
增加的.
减小的`? 诗情女孩1年前1
诗情女孩1年前1 -
 为爱变乖2 共回答了19个问题
为爱变乖2 共回答了19个问题 |采纳率94.7%指的是溶液质量吧?问的明确点啊
应该只有铁和硝酸亚铁质量不变
铁 锌 和硝酸银变小
硝酸银 硝酸亚铁 和氢氧化钠变小
其他都变大1年前查看全部
- 在新制的硝酸亚铁溶液中,滴入少量浓盐酸,可观察到变为 色,写出发生反应的离子方程式和化学方程式!
在新制的硝酸亚铁溶液中,滴入少量浓盐酸,可观察到变为 色,写出发生反应的离子方程式和化学方程式!
生成的气体是NO还是NO2呢?判断依据是什么 芜草1231年前3
芜草1231年前3 -
 因为漫画 共回答了13个问题
因为漫画 共回答了13个问题 |采纳率100%3Fe2++4H++NO3_=3Fe3++NO【上箭头】+2H2O
化学方程式就比较麻烦了,我写了很久的:9Fe[NO3]2+12HCl=5Fe[NO3]3+4FeCl3+3NO[上箭头】+6H2O
硝酸浓度稀得就生成NO,浓的就生成NO2,现在滴入少量浓盐酸,明显很稀了,肯定生成NO.溶液不一定是红色!硝酸亚铁也许很多 !1年前查看全部
- (2010•南通模拟)现有含硝酸锌、硝酸亚铁和硝酸银的混合废液.下列有关说法正确的是( )
(2010•南通模拟)现有含硝酸锌、硝酸亚铁和硝酸银的混合废液.下列有关说法正确的是( )
A.若要回收银,较为经济合理的方案是向废液中加稍过量的铁粉,过滤后向滤渣中加过量盐酸
B.若向废液中加入过量的锌粉,先置换出来的是铁
C.若向废液中加入一定量锌粉充分反应后过滤,向滤液中加入稀盐酸一定无现象
D.若向废液中加入一定量锌粉充分反应后过滤,滤液与原溶液相比,质量一定减小 62639821年前1
62639821年前1 -
 向羽纱 共回答了14个问题
向羽纱 共回答了14个问题 |采纳率100%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,除杂时选择的试剂与杂质反应时不能生成新的杂质.A、向废液中加稍过量的铁粉,能与硝酸银反应生成银,还有剩余的铁,加入过量的盐酸,只与铁反应不与银反应,能回收银,故A正确;
B、若向废液中加入过量的锌粉,锌与银的电势差大,先置换出来的是银,故B错误;
C、向废液中加入一定量锌粉充分反应后过滤,可能有锌剩余,加入盐酸可能产生气泡,故C错误;
D、向废液中加入一定量锌粉充分反应后过滤,所得滤液的质量与原废液的质量比较大小,取决于硝酸亚铁和硝酸银的量的多少,若硝酸银的量多,则滤液质量减小,若硝酸亚铁的量多,则可能滤液的质量增大,故D错误,
故选A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 都答对算你厉害!1.往浅绿色的硝酸亚铁溶液中逐滴加入稀盐酸,溶液的颜色为什么变为棕黄色?2.铜片放入热的稀硫酸中无明显现
都答对算你厉害!
1.往浅绿色的硝酸亚铁溶液中逐滴加入稀盐酸,溶液的颜色为什么变为棕黄色?
2.铜片放入热的稀硫酸中无明显现象,为什么当加入硝酸钠时会有明显变化?
3.为什么用氯化钡溶液和盐酸可以检验亚硫酸钠是否被氧化?
4.某气瓶内的气体呈红棕色,加入足量的水,盖上玻璃片后振荡,得红棕色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色.该气体可能是下列混合气体中的:A氮气 一氧化氮 溴气 B二氧化氮 一氧化氮 氮气.(说明为什么!)
5.1L1mol/L硫酸铁溶液中含有硫酸根离子数目为什么是0.2NA(NA表示阿伏加德罗常数)
每道题都请说明为什么! 安靜的向日葵1年前6
安靜的向日葵1年前6 -
 sjsgnsjsgn 共回答了11个问题
sjsgnsjsgn 共回答了11个问题 |采纳率100%1.往浅绿色的硝酸亚铁溶液中逐滴加入稀盐酸,溶液的颜色为什么变为棕黄
色?
答:Fe(NO3)2溶液中主要存在Fe2+、NO3-,当加入稀HCl时,又增加了H+.而溶液中有H+和NO3-时,就相当于有了稀HNO3,稀HNO3具有强氧化性,可以把Fe2+氧化生成Fe3+,故溶液颜色变黄:
3Fe2++NO3-+4H+====3Fe3++NO(g)+2H2O
2.铜片放入热的稀硫酸中无明显现象,为什么当加入硝酸钠时会有明显变化?
同理,在稀H2SO4中存在着大量H+,加入NaNO3时,又产生了NO3-,这就相当于有了稀HNO3,而Cu容易被稀HNO3氧化.
3Cu+8HNO3===3Cu(NO3)2+2NO(g)+4H2O
3.为什么用氯化钡溶液和盐酸可以检验亚硫酸钠是否被氧化?
(1)BaCl2+Na2SO3===BaSO3(沉淀)+2NaCl
(2)BaCl2+Na2SO4===BaSO4(沉淀)+2NaCl
(3)BaSO3溶于HCl,而BaSO4不溶于HCl
BaSO3+2HCl===BaCl2+SO2(g)+H2O
故先加BaCl2,必有白色沉淀生成.再加入足量稀HCl,若沉淀全部溶解,说明全部都是BaSO3,则原Na2SO3未变质.若沉淀部分溶解,说明其中存在着BaSO4,则原Na2SO3已变质.
4.某气瓶内的气体呈红棕色,加入足量的水,盖上玻璃片后振荡,得红棕色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色.该气体可能是下列混合气体中的:A氮气 一氧化氮 溴气 B二氧化氮 一氧化氮 氮气.(说明为什么!)
答:A 分析:中学遇到的红棕色气体只有Br2蒸气和NO2气体2种.这2种气体的典型区别就是Br2溶于水所得溶液仍有色(一般溴水为橙色,浓度过大时也可为红棕色),而NO2溶于水得到HNO3溶液无色.
本题得到红棕色溶液,则必有Br2.“再打开玻璃片后,瓶中气体又变为红棕色.”说明有NO(2NO+O2===2NO2)
5. 1L1mol/L硫酸铁溶液中含有硫酸根离子数目为什么是0.2NA(NA表示阿伏加德罗常数)
答:1L1mol/L硫酸铁含溶质为1mol,而1molFe2(SO4)3在溶液中产生的SO42-为3mol,也即SO42-离子数目为3NA,绝对不可能是0.2NA.所以说,不是你的数据打错了,就是你的书有错印.1年前查看全部
- 铁单质和硝酸亚铁反应的离子方程式.急!
 chris55611年前3
chris55611年前3 -
 me1986at2003 共回答了30个问题
me1986at2003 共回答了30个问题 |采纳率90%硝酸亚铁有酸性,硝酸根离子的氧化性被体现出来.
Fe(少量)+NO3-+2H+=Fe3++NO2↑+H2O
3Fe(过量)+NO3-+2H+=Fe2++NO2↑+H2O
(第二个反应其实是三价铁把金属铁氧化为二价铁的反应加上之前的反应)1年前查看全部
- 硝酸亚铁的性质最好在10月15号之前给出答案延长到10月23日了
 lucky_1111年前6
lucky_1111年前6 -
 平行追击 共回答了22个问题
平行追击 共回答了22个问题 |采纳率77.3%Fe(NO3)2
水合物:Fe(NO3)2·6H2O
M=179.848
物理——淡绿色斜方晶系,片状结晶.熔点60.5℃.易溶于水.冷时呈湿状态,稳定.
化学——
硝酸亚铁水溶液微弱水解
Fe(NO3)2+2H2O=Fe(OH)2+2HNO3
易被氧化
9Fe(NO3)3+6H2O=5Fe(NO3)3+3NO↑+4Fe(OH)3↓
其他还真不知道有什么性质了,大部分都是Fe2+的性质
亚铁离子在碱性条件下生成白色的氢氧化亚铁沉淀,因氢氧化亚铁具有还原性被空气中的氧气氧化而最终生成红褐色的氢氧化铁.现象是:白色沉淀迅速变为灰绿色,最后变为红褐色.你的观察是对的,时间长点还会变为红褐色.
检验方法
方法1:观察.亚铁离子,是绿色的,看的出来.
方法2:加入硫氰化钾(不是硫氢化钾),不显血红色.然后加入氯水,显血红色,则为亚铁离子
反应离子方程式:
2Fe2+ +Cl2 ==2Fe3+ +2Cl-
Fe3+ +3SCN- ==Fe(SCN)3(络合反应,是可逆的,是检验三价铁的特征反应;二价铁无此特性)
方法3:加入氢氧化钠溶液,生成白色沉淀,白色沉淀迅速变成灰绿色,最后,变成红褐色.这证明有铁离子.
方法4:向溶液中加入酸性高锰酸钾,若褪色,则有二价铁,不褪色,则完全变质.
方法5:向溶液中加入醋酸钠,由于二价铁遇醋酸钠无现象,而三价铁则发生双水解,产生沉淀,再结合方法3或4,则可判断.1年前查看全部
- 铁与硝酸反应的化学方程式(不会生成H2,好象会有硝酸亚铁,硝酸铁什么的)急!
 wenying_5791年前7
wenying_5791年前7 -
 zaiyige 共回答了25个问题
zaiyige 共回答了25个问题 |采纳率84%Fe+4HNO3==Fe(NO3)3+NO+2H2O--------------[硝酸过量]
3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O-----------[Fe过量]
如果是浓的 类似 生成NO2.
补充你说会有硝酸亚铁,硝酸铁什么的
那是因为有这个反应
Fe +Fe3+ =Fe2+1年前查看全部
- 碳酸的化学式碳酸亚硫酸磷酸盐酸硝酸钠硝酸银硝酸钙硝酸镁硝酸钡硝酸锌硝酸铝硝酸铜硝酸铁硝酸亚铁硫酸钾硫酸钠硫酸银硫酸钙硫酸
碳酸的化学式
碳酸
亚硫酸
磷酸
盐酸
硝酸钠
硝酸银
硝酸钙
硝酸镁
硝酸钡
硝酸锌
硝酸铝
硝酸铜
硝酸铁
硝酸亚铁
硫酸钾
硫酸钠
硫酸银
硫酸钙
硫酸镁
硫酸钡
硫酸锌
硫酸铝
硫酸铜
硫酸铁
硫酸亚铁
硫酸铵 拖把拖把1年前4
拖把拖把1年前4 -
 dengdeng000 共回答了15个问题
dengdeng000 共回答了15个问题 |采纳率93.3%碳酸 H2CO3
亚硫酸 H2SO3
磷酸 H3PO4
盐酸 HCl
硝酸钠 NaNO3
硝酸银 AgNO3
硝酸钙 Ca(NO3)2
硝酸镁 Mg(NO3)2
硝酸钡 Ba(NO3)2
硝酸锌 Zn(NO3)2
硝酸铝 Al(NO3)3
硝酸铜 Cu(NO3)2
硝酸铁 Fe(NO3)3
硝酸亚铁 Fe(NO3)2
硫酸钾 KNO3
硫酸钠 Na2SO4
硫酸银 Ag2SO4
硫酸钙 CaSO4
硫酸镁 MgSO4
硫酸钡 BaSO4
硫酸锌 ZnSO4
硫酸铝 Al2(SO4)3
硫酸铜 CuSO4
硫酸铁 Fe2(SO4)3
硫酸亚铁 FeSO4
硫酸铵 (NH3)2SO41年前查看全部
- 为了从硝酸银和硝酸亚铁混合液中回收银单质,某同学现取一定量废液,做了如图所示的实验:
为了从硝酸银和硝酸亚铁混合液中回收银单质,某同学现取一定量废液,做了如图所示的实验:
若第一次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题: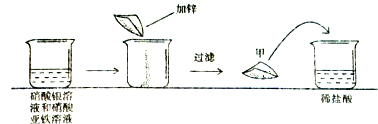
(1)写出第一次实验中发生反应的化学方程式:______;第一次 第二次 锌的质量 13g 15g 14.6%稀盐酸的质量 50g 50g 最终的反应现象 浅绿色、气泡 浅绿色、气泡
(2)第二次实验中甲物质的化学式为:______;
(3)根据已知条件列出求解第一次实验中与稀盐酸反应的固体物质质量(x)的比例式:[56/73]=[x/50g×14.6%][56/73]=[x/50g×14.6%];
(4)原混合废液中溶质的质量总和为:______;
(5)若将第一次实验中甲与稀盐酸反应后的滤液中加入44.6g水,则所得的不饱和溶液中溶质的质量分数为______. 杭州漂浮1年前1
杭州漂浮1年前1 -
 ysrmeggie 共回答了17个问题
ysrmeggie 共回答了17个问题 |采纳率76.5%解题思路:(1)锌和硝酸银反应生成硝酸锌和银,和硝酸亚铁反应生成硝酸锌和铁,稀盐酸和铁反应生成氯化亚铁和氢气;
(2)当锌过量时,甲物质中含有锌、银和铁;
(3)已知稀盐酸的质量、溶质质量分数可以计算铁的质量;
(4)根据铁的质量可以计算硝酸亚铁的质量和反应的锌的质量,进一步可以计算硝酸银的质量,从而可以计算原混合废液中溶质的质量总和;
(5)根据溶质的质量及其溶液的质量,可以计算所得的不饱和溶液中溶质的质量分数.(1)锌和硝酸银、硝酸亚铁,铁和稀盐酸反应的化学方程式为:Zn+2AgNO3═Zn(NO3)2+2Ag,Zn+Fe(NO3)2═Zn(NO3)2+Fe,Fe+2HCl═FeCl2+H2↑.
故填:Zn+2AgNO3═Zn(NO3)2+2Ag,Zn+Fe(NO3)2═Zn(NO3)2+Fe,Fe+2HCl═FeCl2+H2↑.
(2)第二次实验中锌过量,所以甲中的物质有锌、银和铁,化学式分别为Zn、Ag、Fe.
故填:Zn、Ag、Fe.
(3)设铁的质量为x,生成氯化亚铁的质量为n,生成氢气的质量为t,
Fe+2HCl═FeCl2+H2↑,
56 73 127 2
x 50g×14.6% n t
[56/73]=[x/50g×14.6%],[73/127]=[50g×14.6%/n],[73/2]=[50g×14.6%/t],
x=5.6g,n=12.7g,t=0.2g,
故填:[56/73]=[x/50g×14.6%].
(4)设硝酸亚铁的质量为y,和硝酸亚铁反应的锌的质量为z,
Zn+Fe(NO3)2═Zn(NO3)2+Fe,
65 180 56
z y 5.6g
[65/z]=[180/y]=[56/5.6g],
y=18g,z=6.5g,
设硝酸银的质量为m,
Zn+2AgNO3═Zn(NO3)2+2Ag,
65 340
13g-6.5g m
[65/340]=[13g−6.5g/m],
m=34g,
原混合废液中溶质的质量总和为:18g+34g=52g,
故填:52g.
(5)若将第一次实验中甲与稀盐酸反应后的滤液中加入44.6g水,则所得的不饱和溶液中溶质的质量分数为:[12.7g/5.6g+50g+44.6g−0.2g]×100%=12.7%,
故填:12.7%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- 下列说法不正确的是( )A.把硝酸亚铁溶液与稀盐酸混合,因不符合复分解反应进行到底的条件,所以它们不能发生化学反应B.
下列说法不正确的是( )
A.把硝酸亚铁溶液与稀盐酸混合,因不符合复分解反应进行到底的条件,所以它们不能发生化学反应
B.分液实验操作时,下层液体从下端放出,上层液体从上口倒出
C.氢氧化钠固体应保存在带有橡胶塞的广口瓶里
D.凡是有元素化合价升降的化学反应都是氧化还原反应 漂漂客1年前1
漂漂客1年前1 -
 caixuedan 共回答了23个问题
caixuedan 共回答了23个问题 |采纳率100%A.硝酸有强氧化性,氢离子、硝酸根和二价铁离子能反应生成三价铁离子,故A错误;
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,以免两种液体相互污染,故B正确;
C.固体氢氧化钠易潮解且与二氧化碳反应,且能与玻璃反应,所以应采用广口瓶橡皮塞密封保存,不是被氧化,故C正确;
D.有元素化合价升降的化学反应都是氧化还原反应,故D正确.
故选A.1年前查看全部
- 硝酸亚铁与碘化氢的反应这个东西能反应?怎么反应的?还有HCL+NANO3 也能?我晕,为什么啊
 鸭蛋的蛋1年前1
鸭蛋的蛋1年前1 -
 dajv 共回答了14个问题
dajv 共回答了14个问题 |采纳率85.7%反应是肯定的,具体方程式看物质的量了
HI电离出H+,加上NO3-有强氧化性,I-和FE2+是不能存在的1年前查看全部
- 过氧化钠与硝酸亚铁反应
 peepeelei1年前3
peepeelei1年前3 -
 fdke 共回答了19个问题
fdke 共回答了19个问题 |采纳率73.7%6Fe(NO3)2 + 3Na2O2 + 6H2O= 4Fe(OH)3 + 2Fe(NO3)3 + 6NaNO3
❤您的问题已经被解答~(>^ω^1年前查看全部
- 硝酸亚铁溶液中存在的主要平衡关系是:Fe 2+ +2H 2 O Fe(OH) 2 +2H + 。若向硝酸亚铁溶液中加入盐
硝酸亚铁溶液中存在的主要平衡关系是:Fe 2+ +2H 2 O
 Fe(OH) 2 +2H + 。若向硝酸亚铁溶液中加入盐酸,观察到的现象是()
Fe(OH) 2 +2H + 。若向硝酸亚铁溶液中加入盐酸,观察到的现象是()A.溶液颜色变黄 B.溶液颜色变浅 C.溶液颜色变绿 D.无明显变化  想念西瓜1年前1
想念西瓜1年前1 -
 PANMIN 共回答了16个问题
PANMIN 共回答了16个问题 |采纳率87.5%A
加入盐酸,引入了H + ,相当于有HNO 3 ,Fe 2+ 被HNO 3 氧化成了Fe 3+ 。1年前查看全部
- 硝酸亚铁中加过量氨水方程式?
 qqwbr1年前1
qqwbr1年前1 -
 windy51E3 共回答了23个问题
windy51E3 共回答了23个问题 |采纳率82.6%Fe(NO3)2 + 2 NH3·H2O = Fe(OH)2 ↓ + 2 NH4NO3
离子方程式 Fe2+ + 2 NH3·H2O = Fe(OH)2 ↓ + 2 NH4+
产生白色沉淀.1年前查看全部
- 硝酸铁,硝酸亚铁,硫酸钾,硫酸镁,硫酸锌,硫酸亚铁,硫酸铁,碳酸钾,碳酸钠,碳酸钙,碳酸钡,氯化铵
 qingqinghepancao1年前1
qingqinghepancao1年前1 -
 库姆塔格 共回答了25个问题
库姆塔格 共回答了25个问题 |采纳率88%硝酸铁Fe(NO3)3,硝酸亚铁Fe(NO3)2,硫酸钾K2SO4,硫酸镁MgSO4,硫酸锌ZnSO4,硫酸亚铁FeSO4,硫酸铁Fe2(SO4)3,碳酸钾K2CO3,碳酸钠Na2CO3,碳酸钙CaCO3,碳酸钡BaCO3,氯化铵NH4Cl 上面的那些数字全是下标1年前查看全部
- 向0.1摩尔/L硝酸亚铁溶液200毫升中加入适量氢氧化钠 使Fe2+恰好完全沉淀,小心加热此混合物直到水分蒸干
向0.1摩尔/L硝酸亚铁溶液200毫升中加入适量氢氧化钠 使Fe2+恰好完全沉淀,小心加热此混合物直到水分蒸干
灼烧到质量不再变化 此质量为 猫狐11年前1
猫狐11年前1 -
 qwe_123 共回答了19个问题
qwe_123 共回答了19个问题 |采纳率78.9%用质量守恒法进行计算.
最终得到的产物是Fe2O3.
n[Fe(NO3)2]=cV=0.1*0.2=0.02mol
n[Fe(NO3)2]=1/2n(Fe2O3)=0.01mol
m(Fe2O3)=nM=0.01*160=1.6g
最终产物的质量是1.6g1年前查看全部
- 一定量的铁与稀硝酸反应生成硝酸铁,硝酸亚铁,一氧化氮和水,下列四种情况不能得出溶液中铁离子与亚铁离子
一定量的铁与稀硝酸反应生成硝酸铁,硝酸亚铁,一氧化氮和水,下列四种情况不能得出溶液中铁离子与亚铁离子
物质的量之比的是
1.已知参加反应的硝酸与被还原的硝酸的物质的量之比为4:1
2.已知参加反应的硝酸与铁的物质的量之比为3:1
3.已知参加反应的铁与生成的一氧化氮物质的量之比是4:3
4.已知溶液中的铁离子与硝酸根离子物质的量之比 qxwxd1年前3
qxwxd1年前3 -
 光光明明 共回答了21个问题
光光明明 共回答了21个问题 |采纳率95.2%铁和硝酸的反应高中书上有,我记不得了,
好像3:8和1:4是两个临界点,
>3/8 是一个区间
在3/8 和 1/4之间是一个区间
<1/4是一个区间
在这3个区间讨论 思考就行
具体情况现在都忘了1年前查看全部
- 不会造成空气污染的是1,盐酸加氯化铁2,乙醇加酚醛树脂3,浓盐酸加高锰酸钾4,硝酸亚铁加稀硫酸
 huang7371年前1
huang7371年前1 -
 平静1984 共回答了18个问题
平静1984 共回答了18个问题 |采纳率100%盐酸加氯化铁1年前查看全部
- 请用离子方程式表示以下反应取一些锌粉和硝酸亚铁粉末充分混合后放入试管中,滴加过量硫酸,将生成气体通入含蒸馏水的烧杯中.试
请用离子方程式表示以下反应
取一些锌粉和硝酸亚铁粉末充分混合后放入试管中,滴加过量硫酸,将生成气体通入含蒸馏水的烧杯中.试管中发生了几个反应,请用离子方程式表示.此时,烧杯中的水含哪些离子? long03331年前2
long03331年前2 -
 lhcyhx 共回答了20个问题
lhcyhx 共回答了20个问题 |采纳率90%2H+.+NO3-.+Fe2+.==Fe3+.+NO2↑+H2O
Zn+2H+==H2↑+Zn2+
2Fe3+.Zn==Zn2+.+2Fe2+
若锌粉足够多,还可能有:
Zn+Fe2+==Fe+Zn2+
Fe+2H+==H2↑+Fe2+
烧杯中的水含H+,OH-,NO3-1年前查看全部
- 硝酸亚铁与稀硫酸反应为什么生成一氧化氮不生成二氧化氮
 cherloewi1151年前2
cherloewi1151年前2 -
 就喜欢妞妞 共回答了16个问题
就喜欢妞妞 共回答了16个问题 |采纳率87.5%硝酸亚铁与稀硫酸反应,由于有H+和NO2-存在,因此相当于亚铁离子和HNO2反应,酸性环境下亚硝酸具有一定的氧化性,因此是由亚硝酸氧化Fe2+.
亚硝酸中N是+3价的,反应中亚硝酸还要的得电子,N的化合价必然降低,因此只能还原到+2价,即NO,不可能还原到较高价态的NO2.1年前查看全部
- 硝酸亚铁与稀硫酸反应的化学方程式怎么写?
硝酸亚铁与稀硫酸反应的化学方程式怎么写?
我死活配不平. ED_心霖1年前1
ED_心霖1年前1 -
 idegz 共回答了13个问题
idegz 共回答了13个问题 |采纳率100%楼上的正是误人子弟
硝酸亚铁与稀硫酸反应实质上是 亚铁离子和硝酸反应
我写的是离子方程式 3Fe2+ +NO3- +4H+=3Fe3++NO↑+2H2O
化学方程式就是加个硫酸根吧 自己试试应该很简单
6Fe(NO3)2 + 9H2SO4 ==> 3Fe2(SO4)3 + 10HNO3+ 2NO +4H2O1年前查看全部
- 氯化亚铁,氯化铁,氢氧化铁,硝酸铁,硫酸铁,硝酸亚铁,氢氟酸的化学式
 lcb5181年前3
lcb5181年前3 -
 pino000 共回答了14个问题
pino000 共回答了14个问题 |采纳率100%FeCL2
FeCl3
Fe(OH)3
Fe(NO3)3
Fe2(SO4)3
Fe(NO3)2
HF1年前查看全部
- 将一定质量的镁粉放入含有硝酸亚铁、硝酸银的混合溶液中,充分反应后,过滤,向滤出的固体中滴加稀盐酸有气泡产生,则下列判断正
将一定质量的镁粉放入含有硝酸亚铁、硝酸银的混合溶液中,充分反应后,过滤,向滤出的固体中滴加稀盐酸有气泡产生,则下列判断正确的是( ) A.镁粉一定过量 B.滤液中溶质只含硝酸镁 C.镁粉可能反应完了 D.向滤液中滴加稀盐酸有白色沉淀产生  lg144881年前1
lg144881年前1 -
 因名 共回答了19个问题
因名 共回答了19个问题 |采纳率89.5%A、向滤出的固体中滴加稀盐酸有气泡产生,可判断固体中含有镁或铁,但却不能判断一定含镁;故A不正确;
B、由于不能确定过滤出的固体中是否一定含镁,也就无法判断溶液中的硝酸亚铁是否被完全反应,因此,滤液中还可能含有硝酸亚铁;故B不正确;
C、根据选项A的分析,滤出的固体中可能有镁也可能没有,因此,加入的镁粉可能完全反应;故C正确;
D、因为滤出固体中含铁或镁,说明溶液中的硝酸银已完全反应,因此,滤液中不含硝酸银,向滤液滴加稀盐酸不会产生白色沉淀;故D不正确;
故选C.1年前查看全部
- 硝酸亚铁Fe(NO3)2是一种受热易分解的盐,下列各组对硝酸亚铁受热分解产物的判断,可能符合事实的是( )
硝酸亚铁Fe(NO3)2是一种受热易分解的盐,下列各组对硝酸亚铁受热分解产物的判断,可能符合事实的是( )
A. Fe2O3+N2O5
B. Fe2O3+NO2+O2
C. FeO+NO2
D. Fe2O3+N2O5+O2 路宇光儿1年前3
路宇光儿1年前3 -
 artini 共回答了17个问题
artini 共回答了17个问题 |采纳率82.4%解题思路:氧化还原反应中,存在电子的得失,反应中存在化合价的升降,从化合价的角度分析该题.A.元素化合价不可能都升高,N元素的化合价应降低,故A错误;
B.Fe的化合价升高,N的化合价降低,O元素的化合价升高,符合氧化还原反应规律,故B正确;
C.元素化合价不可能都降低,Fe元素的化合价应升高,故C错误;
D.素化合价不可能都升高,N元素的化合价应降低,故D错误.
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,本题注意氧化还原反应中,某种元素的化合价升高,肯定有化合价降低的元素.1年前查看全部
- 为了回收硝酸亚铁和硝酸银的混合溶液中的银,设计了如下的实验方案:
为了回收硝酸亚铁和硝酸银的混合溶液中的银,设计了如下的实验方案:

(1)若溶液乙为无色溶液,则固体甲一定有的物质是______,可能有的物质是______,步骤②中肯定发生的反应的化学方程式为______.
(2)若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是______或______(填物质的名称或化学式). 侠骨豪情1年前2
侠骨豪情1年前2 -
 你都看不见 共回答了14个问题
你都看不见 共回答了14个问题 |采纳率100%解题思路:根据溶液颜色特征,分析流程图中反应的发生情况,对所得固体或溶液组成成分进行分析.(1)溶液乙为无色溶液,可判断溶液乙中不含亚铁离子,则原溶液中的硝酸亚铁被全部置换,根据金属活动性,硝酸银中金属银先于铁被置换出来,因此,原溶液中的硝酸银、硝酸铁全部被置换,反应后所得固体中一定含有被置换出来的金属铁和银;如果加入的锌过量,则固体中含有锌;
故选Ag、Fe;Zn;
固体甲中一定含有铁、银,向其加入稀硫酸,则铁与稀硫酸反应,生成硫酸亚铁和氢气;
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)溶液乙为浅绿色,说明原溶液中的硝酸亚铁没有完全反应,则所加入金属锌量不足;根据盐溶液与金属反应的先后顺序可判断:所加入金属锌和硝酸银溶液完全反应后,继续和硝酸亚铁反应,由于溶液中含有硝酸亚铁,所以不能判断硝酸银溶液是否完全反应.则反应后溶液中所含溶质可能有:硝酸锌、硝酸亚铁或硝酸锌、硝酸亚铁、硝酸银.
故答案为:Zn(NO3)2、Fe(NO3)2;Zn(NO3)2、Fe(NO3)2、AgNO3.点评:
本题考点: 金属活动性顺序及其应用;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 活泼金属与盐溶液反应时,会按金属活动性由弱到强的顺序逐一置换.1年前查看全部
- 往浅绿色的硝酸亚铁溶液中逐滴加入稀盐酸,溶液的颜色变化是
往浅绿色的硝酸亚铁溶液中逐滴加入稀盐酸,溶液的颜色变化是
A颜色变浅 B变为绿色 C没有改变 D变为棕黄色 飞翔的西红柿sky1年前1
飞翔的西红柿sky1年前1 -
 wyf_nj 共回答了18个问题
wyf_nj 共回答了18个问题 |采纳率88.9%选D.
因为加入盐酸,为硝酸亚铁溶液提供了氢离子,而酸化的硝酸根离子具有强氧化性,会氧化亚铁离子.亚铁离子变成铁离子,所以容易颜色变为三价铁离子的颜色,即棕黄色.1年前查看全部
- 硝酸镁,硝酸亚铁,氢氧化锌,碳酸根,磷酸钠,氯化铵的化学式.
 lipen3211年前2
lipen3211年前2 -
 清清萝卜 共回答了11个问题
清清萝卜 共回答了11个问题 |采纳率90.9%MgNo3 Fe(No3)2
Zn(OH)2
co3 2-
NH4Cl1年前查看全部
- Fe与少量稀硝酸反应生成硝酸亚铁还是硝酸铁
 轻声淡影1年前1
轻声淡影1年前1 -
 想做一只懒猫 共回答了20个问题
想做一只懒猫 共回答了20个问题 |采纳率95%生成硝酸亚铁1年前查看全部
- 铁与硝酸银的反应铁与硝酸银溶液(过量)反应应该生成什么?是硝酸铁还是硝酸亚铁? 老师说应该是硝酸亚铁,我开始也是这样想的
铁与硝酸银的反应
铁与硝酸银溶液(过量)反应应该生成什么?是硝酸铁还是硝酸亚铁? 老师说应该是硝酸亚铁,我开始也是这样想的,可是Ag+好像要和Fe2+反应生成银镜的……
 栀孜椰曳1年前1
栀孜椰曳1年前1 -
 纳蓝飞雪 共回答了25个问题
纳蓝飞雪 共回答了25个问题 |采纳率96%和浓度有关 你可以去参考大学无机化学中的电化学章节 用能斯特方程算电极电位 这个反应的方向貌似和浓度有比较大的关系1年前查看全部
- Fe和硝酸反应会生成硝酸亚铁吗?理由.
 rrt43451年前3
rrt43451年前3 -
 monkeyggh 共回答了20个问题
monkeyggh 共回答了20个问题 |采纳率100%首先说明的是与铁反应的硝酸首先应该是稀硝酸,如果是浓硝酸的话会在铁表面形成致密的氧化膜组织铁和硝酸的反应,再者应该看铁和硝酸的物质量比,如果铁大大过量会形成硝酸亚铁,如果不完全过量会形成2价3价铁盐的混合物1年前查看全部
- 硝酸的性质是什么?硝酸盐与其他物质反应遵循硝酸的性质么?比如硝酸亚铁溶液与稀硫酸反应的方程式怎么写?
 meizhu5121年前3
meizhu5121年前3 -
 q2911901 共回答了18个问题
q2911901 共回答了18个问题 |采纳率88.9%第一个问题:硝酸的性质是人教版《氮族元素》一章中的重要知识.其主要性质是1、不稳定性.光照或受热易分解.2、强氧化性:能够氧化除铂、金之外的几乎所有金属.3、酸的通性.
第二个:硝酸盐种类很多,全都易溶于水,很难总结规律.
第三个:硝酸亚铁溶液与稀硫酸.此反应类型为高考热点:Fe2+具有还原性,NO3-和H+在溶液中即硝酸,所以此为离子间的氧化还原反应.3Fe2+ 4H+ NO3- ===3Fe3+ NO +2H2O1年前查看全部
- 硝酸亚铁和酸反应硝酸亚铁和氢离子的反应方程式..怎么生成硝酸铁了勒..硝酸亚铁和氢离子反应要生成硝酸铁。它的反应方程式是
硝酸亚铁和酸反应
硝酸亚铁和氢离子的反应方程式..怎么生成硝酸铁了勒..
硝酸亚铁和氢离子反应要生成硝酸铁。它的反应方程式是什么.. 蓝筹881年前4
蓝筹881年前4 -
 醉影人生 共回答了14个问题
醉影人生 共回答了14个问题 |采纳率100%在硝酸亚铁溶液加入稀盐酸发生的变化有:①溶液中存在水解平衡:Fe2+ + 2H2O=Fe(OH)2 + 2H+,加入盐 酸,使溶液中氢离子浓度增大,平衡左移,使溶液中亚铁离子的浓度增大,表现为浅绿色加深;②溶液中同时有较多的氢离子和硝酸根离子,则具有较强氧化性,即发生反应:3Fe2+ + 4H+ + NO3-=NO↑+3Fe3+ + 2H2O等.主要矛盾是②,即反应现象:溶液变黄色,同时有气体产生,遇空气变为红棕色.1年前查看全部
- 往浅绿色的硝酸亚铁溶液中逐渐加稀盐酸,溶液的颜色应该是?
 lf_chun20001年前1
lf_chun20001年前1 -
 jjzhong2006 共回答了25个问题
jjzhong2006 共回答了25个问题 |采纳率88%变为棕黄色
因为加入盐酸,为硝酸亚铁溶液提供了氢离子,而酸化的硝酸根离子具有强氧化性,会氧化亚铁离子.亚铁离子变成铁离子,所以容易颜色变为三价铁离子的颜色,即棕黄色.1年前查看全部
- 铁与什么反应生成硝酸亚铁?铁与什么东西反应生成硝酸亚铁?
 波波海1年前1
波波海1年前1 -
 曾经也想一心一意 共回答了19个问题
曾经也想一心一意 共回答了19个问题 |采纳率94.7%硝酸铜等硝酸盐和活泼性差的金属离子的盐.1年前查看全部
- 硝酸铁生成硝酸亚铁的方程式是什么
 84011oo1年前4
84011oo1年前4 -
 6644760 共回答了19个问题
6644760 共回答了19个问题 |采纳率94.7%将硝酸亚铁氧化成硝酸铁即可,所以最好加入稀硝酸:化学方程式:3Fe(NO3)2 + 4HNO3 == 3Fe(NO3)3 + NO↑+ 2H2O离子方程式:3Fe(2+) + NO3(-) + 4H(+) == 3Fe(3+) + NO↑+ 2H2O
来自网络1年前查看全部
- 如何除去硝酸铁中混有的硝酸亚铁 和硫酸铁中混有的硫酸亚铁 并写出上述两个除杂的 离子方程式
 正在擦枪1年前2
正在擦枪1年前2 -
 lq5r 共回答了16个问题
lq5r 共回答了16个问题 |采纳率93.8%由于硝酸铁和硫酸铁均为酸性溶液,所以均可以通过加入H2O2的方法,不混入杂质
2Fe(2+)+H2O2+2H(+)==2Fe(3+)+2H2O
其中硝酸铁溶液还可以用加入HNO3的方法
NO3(-)+3Fe(2+)+4H(+)==NO+3Fe(3+)+2H2O1年前查看全部
- 若将硝酸亚铁固体代替硝酸银固体实验苯酚溶液不变红的原因
 グ济也行1年前1
グ济也行1年前1 -
 新山 共回答了21个问题
新山 共回答了21个问题 |采纳率85.7%亚铁不能和苯酚生成红色物质1年前查看全部
- 铁粉加入到硝酸银、硝酸铜及硝酸锌的混合溶液充分反应后过滤加入稀盐酸为什么滤液中会有硝酸亚铁?
 远欧1年前3
远欧1年前3 -
 闽越土著 共回答了10个问题
闽越土著 共回答了10个问题 |采纳率100%首先铁会与银离子反应,再与铜离子反应,不与锌离子反应.再向滤液中加入稀盐酸,那么就有了稀硝酸,这样亚铁离子就会被氧化,亚铁离子是否全部被氧化,这要看加入的稀盐酸是否过量.1年前查看全部
- 考试中遇到一道题目 用什么试剂可以除去硝酸亚铁中的硝酸银 我写氯化亚铁 l氯化亚铁也属于试剂吗
 tianmaxinkong1年前1
tianmaxinkong1年前1 -
 地产浪人 共回答了20个问题
地产浪人 共回答了20个问题 |采纳率85%定义:
试剂(reagent),又称化学试剂或试药.主要是实现化学反应、分析化验、研究试验、教学实验、化学配方使用的纯净化学品.
试剂是纯净化学品,即为纯净物,而氯化亚铁是化合物,即为纯净物,所以是试剂.1年前查看全部
- 硝酸亚铁溶液与氢氧化钠溶液反应式?
 刃双1年前3
刃双1年前3 -
 司空岚3 共回答了15个问题
司空岚3 共回答了15个问题 |采纳率86.7%Fe(NO3)2+2NaOH=Fe(OH)2(沉淀符号)+2NaNO31年前查看全部
- 将5.6克某固体投入HNO3中,产生红棕色气体A,把所得溶液减压蒸干,得到20克硝酸亚铁和硝酸铁的混合物;将该股题在隔绝
将5.6克某固体投入HNO3中,产生红棕色气体A,把所得溶液减压蒸干,得到20克硝酸亚铁和硝酸铁的混合物;将该股题在隔绝空气的条件下高温加热,得到红棕色的三氧化二铁和气体B,A、B气体混合后通入足量水中充分反应后,收集到标况下气体体积为(不考虑气体的溶解)( )
A.2240ml B.4480ml C.3360ml D.1120ml 冷冰霜931年前3
冷冰霜931年前3 -
 boyxinqing 共回答了24个问题
boyxinqing 共回答了24个问题 |采纳率95.8%5.6g 的 Fe 最后全变成三氧化二铁,Fe为+3价,也就是铁提供了0.3mol的电子,给谁?硝酸.最后一步A、B混合通入水中,反应,肯定生成了HNO3溶液,气体是NO.那么生成的气体NO应该是原来的HNO3的还原.N从+5将为+2,得到0.3mol的气体,就是有0.1mol的N被还原,生成NO 0.1mol,标况体积为2.24L,即2240mL.选择A
整个过程就是个元素守恒,不用管反应中具体每步发生了什么反应.N元素的过程就是由HNO3——硝酸亚铁、硝酸铁、红棕色气体A(就是NO2)——分解生成的是N的氧化物——与水反应变为HNO3和NO,也就是N元素开始时硝酸,最后有部分还是硝酸,部分还原成了NO,而被还原的这部分就是所有的Fe被氧化成+3价所提供的电子.就是一个电子守恒,元素守恒1年前查看全部
- 硝酸亚铁溶液呈绿色,其中存在下列平衡Fe2+ +H2O===Fe(OH)2+2H+ ,.
硝酸亚铁溶液呈绿色,其中存在下列平衡fe2+ +h2o===fe(oh)2+2h+ ,.
硝酸亚铁溶液呈绿色,其中存在下列平衡fe2+ +h2o===fe(oh)2+2h+ ,往该溶液中逐滴加如盐酸,发生的变化是( )a平衡向逆方向移动,c(fe2+)增大 b平衡向正方向移动 c溶液由浅绿色变为深绿色 d溶液由浅绿色变为棕绿色 选哪个?为什么?
 yoer54ghirr1年前1
yoer54ghirr1年前1 -
 jy小苍 共回答了10个问题
jy小苍 共回答了10个问题 |采纳率80%D溶液由浅绿色变为棕绿色或棕黄色
因为硝酸根离子在酸性环境中氧化性增强,所以能将亚铁离子氧化为铁离子,颜色加深为棕绿色或棕黄色1年前查看全部
- 制造氢氧化亚铁为什么用硫酸亚铁,不是用硝酸亚铁或者氯化亚铁?
 qianx1年前3
qianx1年前3 -
 李满强1 共回答了20个问题
李满强1 共回答了20个问题 |采纳率90%工业生产需要考虑原材料的供应量、成本等因素.从化学角度考虑,硝酸亚铁不是直接由铁与硝酸反应生成(只能得到硝酸铁),还得从硫酸亚铁去制造;由铁与盐酸反应制造氯化亚铁,机理上可行,但由于实际供应的盐酸大部分都是副产盐酸(氯碱行业),总是含有少量的次氯酸或者氯气,会将少量的氯化亚铁进一步氧化为氯化铁,造成氯化亚铁纯度降低;工业硫酸亚铁由废硫酸(除混酸硝化的废硫酸外一般的废硫酸不含氧化剂)与铁反应生成,得到的硫酸亚铁纯度较高.工业上,存在大量的废硫酸,故硫酸亚铁的产量巨大,价格十分低廉,纯度较高,是氢氧化亚铁的首选原料.1年前查看全部
- 硝酸亚铁投入稀硫酸中的化学方程式如何写?
 水榭楼台江南1年前2
水榭楼台江南1年前2 -
 link449316377 共回答了12个问题
link449316377 共回答了12个问题 |采纳率83.3%NO3(-)+3Fe(2+)+4H(+)==3Fe(3+)+NO+2H2O
化学式:9Fe(NO3)2+6H2SO4==2Fe2(SO4)3+5Fe(NO3)3+3NO+6H2O1年前查看全部
- 铁和稀硝酸反应的生成物是硝酸亚铁和氢气吗?
铁和稀硝酸反应的生成物是硝酸亚铁和氢气吗?
Fe+2HNO3=Fe(NO3)2+H2
正确否 綱絡幽靈1年前5
綱絡幽靈1年前5 -
 gmajauiqpl123 共回答了18个问题
gmajauiqpl123 共回答了18个问题 |采纳率88.9%HNO3具有强氧化性,其+5价的N元素的氧化性比H+更强,因此它和金属反应时,得电子的是N元素而不是H+,导致还原产物通常是氮氧化物、N2、NH3等物质而不是H2.而且,在HNO3足量的情况下,通常会将变价金属氧化到高价(相对于该金属与非氧化性酸,如HCl反应的产物而言),如足量HNO3和Fe反应,产物是Fe3+而不是Fe2+1年前查看全部
- 现有含硝酸锌、硝酸亚铁和硝酸银的混合废液。下列有关说法正确的是 A.若要回收银,较为经济合理的方案是向废液中加稍过量的铁
现有含硝酸锌、硝酸亚铁和硝酸银的混合废液。下列有关说法正确的是
A.若要回收银,较为经济合理的方案是向废液中加稍过量的铁粉,过滤后向滤渣中加过量盐酸 B.若向废液中加入过量的锌粉,先置换出来的是铁 C.若向废液中加入一定量锌粉充分反应后过滤,向滤液中加入稀盐酸一定无现象 D.若向废液中加入一定量锌粉充分反应后过滤,滤液与原溶液相比,质量一定减小  wswchen1年前1
wswchen1年前1 -
 v9egleni 共回答了13个问题
v9egleni 共回答了13个问题 |采纳率76.9%A
1年前查看全部
- 硝酸亚铁和水反应么亚铁离子有强还原性,硝酸有强氧化性,和水能生成氢氧化铁,铁离子和no么?如果不能的话请说明下原因,那k
硝酸亚铁和水反应么
亚铁离子有强还原性,硝酸有强氧化性,和水能生成氢氧化铁,铁离子和no么?如果不能的话请说明下原因,
那kmno4为什么没有氢离子也有强还原性 66chen661年前1
66chen661年前1 -
 qq1115201111 共回答了18个问题
qq1115201111 共回答了18个问题 |采纳率88.9%不反应.
这里不是HNO3,只是NO3-.NO3-要有大量H+的条件下才具有强氧化性.
高锰酸钾是高锰酸钾,NO3-是NO3-.拿2种不同的物质来比较,没意思.1年前查看全部
- 请问老师为什么氧化铁,氢氧化钾,硝酸钾反应为什么生成亚硝酸钾而不是硝酸亚铁
 壹枝独秀1年前1
壹枝独秀1年前1 -
 天天做股东 共回答了16个问题
天天做股东 共回答了16个问题 |采纳率93.8%氧化铁,氢氧化钾,硝酸钾反应自然生成不了硝酸亚铁,反应物处于碱性环境就没有游离的金属阳离子
还有氧化铁一般很难再继续被氧化了,碱性环境下会被氯酸钾、过氧化钠、硝酸钾等氧化剂氧化成六价铁,就是高铁酸离子,这个反应条件需要无水1年前查看全部
大家在问
- 1小明、小华、小芳三人跳绳,小明跳了42下.
- 2如图所示,在水平地面上有A,B两个物体,质量分别为mA=3.00Kg,mB=2.00Kg,它们与地面的动摩擦因素均为μ=
- 3做完高锰酸钾制取氧气试验之后,试管上那些难溶于水的东西怎么洗?
- 4对曲线运动中速度的方向,下列说法正确的是( )
- 5(2007•泉州)在测定额定电压为3.8V小灯泡电阻的实验中:
- 6已知tana=-1且cos>0,则角a=?
- 7春天里,花红柳绿,到处是一派迷人的____.他真能干,一会儿功夫把玻璃擦得十分____.
- 8用棱长1cm的正方体拼成如下的图形,它的体积是多少立方厘米?他的表面积是多少平方厘米
- 9物体做自由落体运动的位移与时间成正比 这句话为什么不对
- 10两个阻值分别为R1,R2的电阻并联后接入电路中,此时干路的总电流为I,则流过R1的电流I1=?
- 11英语的情景剧《皇帝的新衣》是分角色演 一共七个人表演.最好都有的演哈 ,要英语的台词,越简单越好哈,谢了 、 哈
- 12孙中山提出的解决农民土地问题的途径有:
- 13北回归线以北的地区 太阳是不是永远在偏南方向?
- 14我这里还有个问题想要请教下.希望您不吝赐教.
- 15一个圆柱体的体积是180立方米,侧面积是120平方米,底面半径是多少米?
