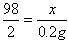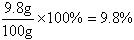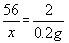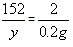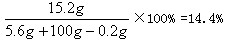某钢样1.1g在纯氧气中完全燃烧,得到0.037g二氧化碳,求钢样中碳的质量分数!
 weiweiqianqian2022-10-04 11:39:541条回答
weiweiqianqian2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 亮亮的眼睛 共回答了15个问题
亮亮的眼睛 共回答了15个问题 |采纳率93.3%- C + O2 =点燃= CO2
12 44
x 0.037g
12/x=44/0.037g
x=0.01g
钢样中碳的质量分数 0.01g/1.1g*100%=0.9% - 1年前
相关推荐
- 取1.000g钢样溶解于Hno3,其中的Mn用KIo3氧化成KMNo4并稀释至100ml,用1.0cm吸收池在波长545
取1.000g钢样溶解于Hno3,其中的Mn用KIo3氧化成KMNo4并稀释至100ml,用1.0cm吸收池在波长545nm测得此溶液的吸光度0.700.用1.52×10-4mol/LKMNO4作为标液,在相同条件下测得的吸光度为0.350,计算钢样中MN的百分含量 答案是 0.17 % 求过程还有一道:已知石蒜碱的分子量为287,用乙醇配制成0.0075%的溶液,用1cm吸收池在波长297nm处,测得A值为0.614,其摩尔吸光系数为多少?
 sissi1131年前2
sissi1131年前2 -
 爱吃的小猪7171 共回答了14个问题
爱吃的小猪7171 共回答了14个问题 |采纳率100%1.52×10-4mol/L的OD是0.35,因为浓度和OD在一定情况下成正比,因此当OD=0.7的时候,那浓度应该是
1.52×10-4mol/L的两倍,也就是3.04×10-4mol/L,就是0.304mmol/L
也就是说100mL里面MnO4-浓度是0.304mmol/L,也就是0.0304mmol
MnO4-和原来的Mn2+等量,那么Mn2+浓度也是0.0304mmol,即原来1g样品含Mn0.0304mmol
Mn的摩尔质量是54.9380mg/mmol,那么Mn质量也就是1.67mg,1.67mg/1.000g×100%=0.167%,跟答案0.17%差不多1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 下一步241年前1
下一步241年前1 -
 sunman910 共回答了17个问题
sunman910 共回答了17个问题 |采纳率100%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 孤一独1年前1
孤一独1年前1 -
 天下美眉 共回答了22个问题
天下美眉 共回答了22个问题 |采纳率95.5%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
- 现有某钢样10g,在充足的氧气中燃烧后,生成二氧化碳0.22g,求钢样的含碳量比率
现有某钢样10g,在充足的氧气中燃烧后,生成二氧化碳0.22g,求钢样的含碳量比率
写出方程式及主要过程 四川仙人板板1年前1
四川仙人板板1年前1 -
 heningfish 共回答了23个问题
heningfish 共回答了23个问题 |采纳率95.7%C+O2=CO2
12.44
x.0.22
x=0.06g
0.06/10=0.6%1年前查看全部
- 二块钢样,退火后经显微组织分析,其组织组成物的相对含量如下:\x0b第一块:珠光体占40%,铁素体60%.\x0b第二块
二块钢样,退火后经显微组织分析,其组织组成物的相对含量如下:x0b第一块:珠光体占40%,铁素体60%.x0b第二块:珠光体占95%,二次渗碳体占5%.x0b试问它们的含碳量约为多少?(铁素体含碳量可思略不计)
能回答详细点么 我想知道原理 bingozjd1年前1
bingozjd1年前1 -
 86866 共回答了13个问题
86866 共回答了13个问题 |采纳率100%1 w(c)=0.4*0.77%=0..308
2 w(c)=0.95*0.77%+0.05*6.69%1年前查看全部
- 1.0克某钢样在纯痒中完全燃烧,得到0.011克二痒化碳,求此钢样中碳的质量分数
 水^水1年前1
水^水1年前1 -
 蝴蝶5758664 共回答了19个问题
蝴蝶5758664 共回答了19个问题 |采纳率100%设此钢样中含碳的质量为X
C + O2 =点燃= CO2
12 44
X 0.011g
X=0.003g
此钢样中碳的质量分数=0.003g/1.0g*100%=0.3%
希望我的回答能对你的学习有帮助!1年前查看全部
- 在炼钢的过程中需要用抽样的方法对产品的含碳量进行检测.现抽取6g钢样,在足量的氧气中充分燃烧,最终收集到0.11g二氧化
在炼钢的过程中需要用抽样的方法对产品的含碳量进行检测.现抽取6g钢样,在足量的氧气中充分燃烧,最终收集到0.11g二氧化碳.通过计算判断,该样品含碳量是否已达到要求.
 yummyang1年前1
yummyang1年前1 -
 brendtears 共回答了18个问题
brendtears 共回答了18个问题 |采纳率83.3%解题思路:含C量在0.03%~2%之间的铁合金称为钢,要计算含碳酸是否达到要求,就需要知道6g钢样中碳的质量,而在氧气燃烧,碳全部转化为二氧化碳,所以根据反应生成二氧化碳的质量求出钢样中碳的质量即可解决问题.0.11g二氧化碳中C元素的质量=0.11g×[12/44]×100%=0.03g
即6g钢样中碳的质量为0.03g,所以
钢样中碳的质量分数=[0.03g/6g]×100%=0.5%
0.03%<0.5%<2%
所以样品含碳量已达要求
答:该样品含碳量已达到要求.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 燃烧规律:含碳物质完全燃烧生成二氧化碳,物质中的碳全部转化为二氧化碳,所以二氧化碳中的碳即原可燃物中的碳.1年前查看全部
- (2014•铁岭模拟)为测定某钢样的含碳量是否合格,取该钢样6g(假设钢样中仅含铁和碳)和98g稀硫酸恰好完全反应,反应
(2014•铁岭模拟)为测定某钢样的含碳量是否合格,取该钢样6g(假设钢样中仅含铁和碳)和98g稀硫酸恰好完全反应,反应后测得烧杯中剩余物的质量总和为103.8g(钢的含碳量为0.03%-2%).请计算:
(1)所用稀硫酸的溶质质量分数;
(2)该钢样是否合格. ccxacnf1年前1
ccxacnf1年前1 -
 jie012 共回答了23个问题
jie012 共回答了23个问题 |采纳率95.7%解题思路:(1)根据钢样的成分可知,加入稀硫酸时,只有铁与硫酸反应生成了硫酸亚铁和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应所用稀硫酸的溶质质量.
(2)根据氢气质量利用反应的化学方程式列式计算出参加反应的铁的质量.根据质量守恒定律H2质量=6g+98g-103.8g=0.2g
设H2SO4质量为x 铁的质量为y
Fe+H2SO4═FeSO4+H2↑
56982
yx0.2g
[98/2=
x
0.2g]x=9.8g
稀硫酸的质量分数=[9.8g/98g]×100%=10%
[56/2=
y
0.2g]y=5.6g
钢样中碳的质量分数=[6g−5.6g/6g]×100%=6.7%>2%
所以属于不合格样品
答案:
(1)所用稀硫酸的溶质质量分数10%
(2)该钢样不合格点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 amestryst1年前1
amestryst1年前1 -
 ssx75366 共回答了24个问题
ssx75366 共回答了24个问题 |采纳率100%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
- 未知含量的样品怎么用光谱仪检测拿来一块钢样,不知道是什么钢,怎么用光谱仪对其做定性或定量分析?
 h78671年前2
h78671年前2 -
 xfcy_2001 共回答了22个问题
xfcy_2001 共回答了22个问题 |采纳率86.4%不知道你是用什么光谱仪,我们这个就有个未知样品那条分析程序,自动选择曲线.一般对于这种,只要你的仪器中元素的含量范围在未知元素范围内的话,挨个试过去就是了,然后根据范围排除就是了!1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 聆涛20001年前1
聆涛20001年前1 -
 mfkfnqqw 共回答了19个问题
mfkfnqqw 共回答了19个问题 |采纳率94.7%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
- 某化学调查小组的同学到钢铁厂做社会调查。他们抽取组成完全相同的质量为2.84g、4.26g、6.24g的三份钢样(假设钢
某化学调查小组的同学到钢铁厂做社会调查。他们抽取组成完全相同的质量为2.84g、4.26g、6.24g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图像:试回答(计算结果精确到0. 1%)。 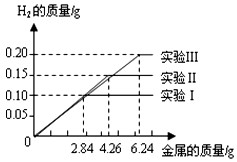
(1)由图可知实验Ⅰ产生的氢气为_______g。
(2)100g稀硫酸在实验______(填I或Ⅱ或Ⅲ)被完全反应掉。
(3)钢样中铁的质量分数为_________。
(4)所用稀硫酸的溶质质量分数是多少? 多多思1年前1
多多思1年前1 -
 melonsmile 共回答了21个问题
melonsmile 共回答了21个问题 |采纳率100%1年前查看全部
- 取某刚样a g,放在氧气中灼烧,共得到2gCO2,则该钢样中碳的质量分数为多少?
 艾昕1年前1
艾昕1年前1 -
 1234来 共回答了16个问题
1234来 共回答了16个问题 |采纳率100%(2g/44)*12=碳的质量
碳的质量/a=质量分数1年前查看全部
- (2014•北京)碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测
(2014•北京)碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用图1装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.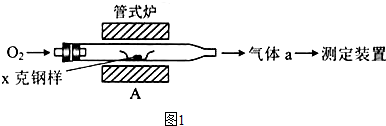
①气体a的成分是______.
②若钢样中碳以FeS形式存在,A中反应:3FeS+5O2
1______+3______.高温 .
(2)将气体a通入测硫酸装置中(如图2),采用滴定法测定硫的含量.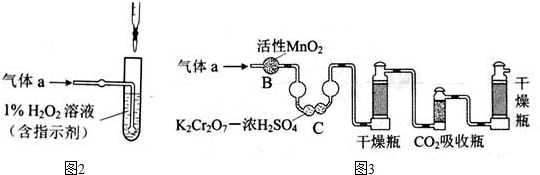
①H2O2氧化SO2的化学方程式:______
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:[yz/x][yz/x].
(3)将气体a通入测碳装置中(如图3),采用重量法测定碳的含量.
①气体a通过B和C的目的是______
②计算钢样中碳的质量分数,应测量的数据是______. 兔子夏1年前1
兔子夏1年前1 -
 魔术杨 共回答了16个问题
魔术杨 共回答了16个问题 |采纳率93.8%解题思路:(1)①该装置中C、S和氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余;
②若钢样中碳以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,再根据质量分数公式计算硫的质量分数;
(3)①测定二氧化碳的含量,需要将二氧化硫除去防止造成干扰;
②计算钢样中碳的质量分数,需要测定吸收二氧化碳的质量.(1)①该装置中C、S在A装置中被氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余,所以气体a的成分是SO2、CO2、O2,故答案为:SO2、CO2、O2;
②若钢样中碳以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁,所以反应方程式为3FeS+5O2
高温
.
Fe3O4+3SO2,
故答案为:Fe3O4;SO2;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水,反应方程式为 H2O2+SO2=H2SO4,故答案为:H2O2+SO2=H2SO4;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,硫的质量分数为[yzg/xg×100%=
yz
x],故答案为:[yz/x];
(3)①测定二氧化碳的含量,需要将二氧化硫除去防止造成干扰,B装置可吸收二氧化硫,C装置可以验证二氧化硫是否除尽,所以装置B和C的作用是除去二氧化硫,故答案为:排除二氧化硫对二氧化碳测定的干扰;
②计算钢样中碳的质量分数,需要测定吸收二氧化碳的质量,所以需要测定吸收二氧化碳前后吸收瓶的质量,故答案为:二氧化碳前后吸收瓶的质量.点评:
本题考点: 真题集萃;含硫物质的性质及综合应用;探究物质的组成或测量物质的含量.
考点点评: 本题考查了C、S含量的测定,涉及氧化还原反应、方程式的配平等知识点,明确实验原理是解本题关键,结合物质的性质来分析解答,题目难度中等.1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 无忌秋风1年前1
无忌秋风1年前1 -
 wufwufwuf 共回答了22个问题
wufwufwuf 共回答了22个问题 |采纳率81.8%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
- 钢是铁的合金,主要由铁和碳等元素组成,现取某钢样粉末30克(假设只含fe和C)在氧气流中充分反应,
钢是铁的合金,主要由铁和碳等元素组成,现取某钢样粉末30克(假设只含fe和C)在氧气流中充分反应,
将产生的气体通入足量的石灰水中,得到3克白色沉淀,(1)计算此钢样粉末中铁的质量分数(2)再取三份不同质量的钢样粉末分别加入到50克质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表所示(标准状况下,2克氢气的体积为22.4L) 实验序号 1 2 3
加入钢样粉末的质量/ g 3 6 9
生成气体的体积(标准状况)/L 1.12 2.24 2.8
请根据表中的数据计算稀硫酸中硫酸的质量分数
(3)若在实验2中继续加入M克钢样粉末,请用含M的代数式表示反应结束后剩余的全部固体的质量.
要有步聚的解题 yj021年前1
yj021年前1 -
 ffia 共回答了14个问题
ffia 共回答了14个问题 |采纳率100%(1)设30克样品中含碳元素的质量为X
根据碳原子守恒可得:
C→CO2→CaCO3
12 100
X 3g
12:100=X:3g
X=0.36g
计算此钢样粉末中铁的质量分数=0.36g/30g*100%=1.2%
(2)设50克稀硫酸中含H2SO4的质量为X
根据三次实验数据可以看出:第一次加入3克样品生成 1.12L氢气、第二次加入6克样品生成2.24L氢气,第三次加入9克样品,按前面的比例生成氢气的体积应为3.36L,实际生成2.8L,说明第三次钢样有剩余、硫酸完全反应.
Fe + H2SO4 = FeSO4 + H2↑
98 22.4
X 2.8L
98:22.4L=X:2.8L
X=12.25g
稀硫酸中硫酸的质量分数=12.25g/50g*100%=24.5%
(3)设6克钢样中含纯铁的质量为X
Fe + H2SO4 = FeSO4 + H2↑
56 22.4
X 2.24L
56:22.4=X:2.24L
X=5.6克
6克钢样中含碳的质量=6g-5.6g=0.4g
设在实验2中可继续反应纯铁的质量为Y
Fe + H2SO4 = FeSO4 + H2↑
56 22.4
Y (2.8-2.24)
56:22.4=Y:(2.8-2.24)
解得Y=1.4g
反应结束后剩余的全部固体的质量=0.4g+M-1.4g=(M-1)g1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 xxava1年前1
xxava1年前1 -
 lixuemei525 共回答了20个问题
lixuemei525 共回答了20个问题 |采纳率80%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
- 取某钢样a克,放在氧气中灼烧,共得2g CO2,则该钢样中碳的质量分数为
取某钢样a克,放在氧气中灼烧,共得2g CO2,则该钢样中碳的质量分数为
多少?
我做出来答案好像不太对~是不是错了?
(600/11a)%
 MT_KKK1年前1
MT_KKK1年前1 -
 zj138 共回答了19个问题
zj138 共回答了19个问题 |采纳率94.7%C--------CO2
12 44
x 2g
x=6/11
碳的质量分数=6/11/a *100%=(600/11a)%1年前查看全部
- 分析化学问答题称取钢样2.000g ,充分燃烧后产生的so2通入50.00ml0.0100mol/Lr NaoH溶液中吸
分析化学问答题
称取钢样2.000g ,充分燃烧后产生的so2通入50.00ml0.0100mol/Lr NaoH溶液中吸收,过量的 NaoH用0.0100mol/Lr HCL溶液返滴定至酚酞终点,消耗30.00ml,则钠样中硫的质量分数为:
0.16,0.32'0.08,0.64 有谁知道怎么算吗?最好给个过程 ,我算得是0.32,16呀 BSeppendorf1年前1
BSeppendorf1年前1 -
 8040044 共回答了19个问题
8040044 共回答了19个问题 |采纳率89.5%答案是对的.具体如下:
NaOH-----------------HCl
1---------------------1
n=0.0003mol-----(0.01*0.03)mol
S----SO2----Na2SO3----2NaOH
32----------------------2
m=0.032g----------(0.05*0.01-0.0003)mol
0.032g/2=0.16%1年前查看全部
- 取某钢样A克,放在氧气中灼烧,共得到2克CO2,则该钢样中碳的质量分数是多少?
 浪漫酷男孩1年前1
浪漫酷男孩1年前1 -
 ii放牛娃 共回答了17个问题
ii放牛娃 共回答了17个问题 |采纳率82.4%2克CO2中碳元素质量为2*12/44=6/11g
该钢样中碳的质量分数是6/11A*100%1年前查看全部
- 某课外活动小组将1.100g碳素钢钢样在纯氧中完全燃烧,生成的CO2通入足量的NaOH溶液中,NaOH溶液增重0.013
某课外活动小组将1.100g碳素钢钢样在纯氧中完全燃烧,生成的CO2通入足量的NaOH溶液中,NaOH溶液增重0.013g.求此钢样中碳的质量分数.
 luanlai88881年前1
luanlai88881年前1 -
 反转7爱 共回答了17个问题
反转7爱 共回答了17个问题 |采纳率94.1%由题意可知:
NaOH溶液增重0.013g就是CO2的重量.
C + O2 = CO2
12 44
X 0.013
钢样中碳:X=0.0035g,所以,
钢样中碳的质量分数=0.0035g÷1.100g×100%=3.18%1年前查看全部
- (2013•葫芦岛)钢的含碳量为0.03%~2%.为测定某钢样的含碳量是否合格,取该钢样粉末6.00g(假设钢样中仅含F
 (2013•葫芦岛)钢的含碳量为0.03%~2%.为测定某钢样的含碳量是否合格,取该钢样粉末6.00g(假设钢样中仅含Fe和C)和足量稀硫酸按如图所示操作.根据所得数据计算:
(2013•葫芦岛)钢的含碳量为0.03%~2%.为测定某钢样的含碳量是否合格,取该钢样粉末6.00g(假设钢样中仅含Fe和C)和足量稀硫酸按如图所示操作.根据所得数据计算:
(1)产生气体的质量为______g.
(2)通过计算判断该钢样是否合格. 掌心的精灵1年前1
掌心的精灵1年前1 -
 御轩 共回答了22个问题
御轩 共回答了22个问题 |采纳率81.8%解题思路:(1)根据图中的信息可以知道反应前后减少的质量即为生成的氢气的质量,可以据此解答;
(2)根据(1)中求得的氢气的质量结合铁和稀硫酸反应的化学方程式可以求出铁的质量,然后求出其质量分数 跟钢的含碳量进行比较即可作出判断.(1)根据图中的信息可以知道反应前后减少的质量即为生成的氢气的质量,即为:146.0-145.79g=0.21g;
(2)设钢样品中铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.21g
[56/x]=[2/0.21g]
解得:x=5.88g
所以钢样品中碳的质量为:6.00g-5.88g=0.12g
所以碳元素的质量分数为:[0.12g/6.00g]×100%=2%
通过计算,含碳量应为2%,在0.03%~2%之间,因此合格.
答:该钢样合格.
故答案为:(1)0.21g;
(2)合格.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.1年前查看全部
- 某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.28g的三份钢样(假设钢
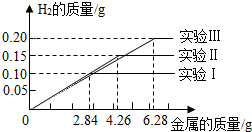 某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.28g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验Ⅰ、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图象:
某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.28g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验Ⅰ、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图象:
试回答(计算结果精确到0.1%):
(1)该钢样含铁的质量分数是______.
(2)稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是多少. 恒阳一盈1年前1
恒阳一盈1年前1 -
 etqewtweqtew 共回答了18个问题
etqewtweqtew 共回答了18个问题 |采纳率100%解题思路:(1)对比实验Ⅰ、实验Ⅱ可得,实验Ⅰ中2.84g钢样与稀硫酸完全反应,根据铁与硫酸反应生成硫酸亚铁和氢气的化学方程式,由反应放出氢气的质量可计算参加反应铁的质量,再求出该钢样含铁的质量分数;
(2)由实验一Ⅰ的数据可知,2.84g钢样完全反应放出氢气0.1g,同样组成的钢样4.26完全反应可放出氢气0.15g;而实验Ⅲ取钢样6.23g时结果得到氢气只有0.2g,说明钢样未完全反应,则稀硫酸不足,稀硫酸完全反应;此时所得溶液为硫酸亚铁溶液,然后计算溶质的质量分数,硫酸亚铁质量要根据反应的化学方程式,由生成氢气质量计算;而反应后溶液质量可根据质量守恒进行计算.(1)设实验Ⅰ参加反应的铁质量为x.
Fe+H2SO4=H2↑+FeSO4
56 2
x 0.10g
[56/x=
2
0.1g]
x=2.8g
2.84g钢铁样品中铁的质量分数:[2.8g/2.84g]×100%≈98.6%
(2)由表中数据分析,实验Ⅲ中100g稀硫酸完全反应.
设实验Ⅲ消耗铁的质量为y,生成硫酸亚铁的质量为z.
Fe+H2SO4=H2↑+FeSO4
56 2 152
y0.2g z
[56/y=
2
0.2g]
y=5.6g
[152/z=
2
0.2g]
z=15.2g
所得溶液中溶质的质量分数为 [15.2g/100g+5.6g−0.2g]×100%=14.4%.
答:反应后溶液中溶质的质量分数是14.4%.
故答案为:(1)98.6%;(2)14.4%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题难度较大,主要考查了实验数据的分析,根据分析出来的数据进行有关化学方程式的计算,从而培养学生分析问题的能力.1年前查看全部
- 某化学调查小组的同学到钢铁厂做社会调查。他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢
某化学调查小组的同学到钢铁厂做社会调查。他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得 到的实验数据绘制出如下图象: 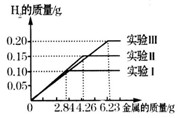
试回答(计算结果精确到0.1%):
(1)写出实验中有关的化学方程式。
(2)实验I中铁参加反应的质量为____。
(3)稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是多少。 lyw_8121年前1
lyw_8121年前1 -
 zhaozhixin 共回答了12个问题
zhaozhixin 共回答了12个问题 |采纳率91.7%1年前查看全部
- 称取某待测钢样1.50g,用同样方法在相同条件下收集到二氧化碳16.6ml,求待测钢样的含碳量(精确到0.1)(二氧化碳
称取某待测钢样1.50g,用同样方法在相同条件下收集到二氧化碳16.6ml,求待测钢样的含碳量(精确到0.1)(二氧化碳密度为1.99g/L)
 lz_uu1年前1
lz_uu1年前1 -
 泰xx香香米 共回答了21个问题
泰xx香香米 共回答了21个问题 |采纳率95.2%碳的质量:X=16.6/1000*1.99
碳的质量分数:(X/1.5)*100%
答案楼主按一下计算器就行了,我机子的计算器不见了.1年前查看全部
- 某工厂采购到一批钢材,质检员为检验其含碳量,需要用抽样对比的方法进行化验.他先称取含碳量为0.5%的标准钢样1.50g,
某工厂采购到一批钢材,质检员为检验其含碳量,需要用抽样对比的方法进行化验.他先称取含碳量为0.5%的标准钢样1.50g,让其在足量的氧气中充分燃烧,最终收集到通常状况下的二氧化碳13.8mL.再称取待测钢样1.50g,用同样的方法在相同条件下收集到二氧化碳16.6mL,求待测钢样的含碳量(计算结果精确到0.1%).(已知通常状况下,二氧化碳的密度为1.99g/L)  yilin99881年前1
yilin99881年前1 -
 逍遥客-- 共回答了17个问题
逍遥客-- 共回答了17个问题 |采纳率88.2%待测钢样充分燃烧后生成二氧化碳中碳元素质量=(16.6mL×10 -3 ×l.99g/L)×
12
44 ×100%=0.009g
则待测钢样的含碳量=
0.009g
1.5g ×100%=0.6%
答:待测钢样的含碳量为0.6%.
解法二:设待测钢样的含碳量为x,则
0.5%:13.8mL=x:16.6mL
x=0.6%
答:待测钢样的含碳量为0.6%.1年前查看全部
- 现取12g钢样,在足量的氧气中充分燃烧,收集到0.11g 二氧化碳,求碳的质量分数,是否达标.
 南海0081年前1
南海0081年前1 -
 哈古622 共回答了14个问题
哈古622 共回答了14个问题 |采纳率100%答案:达标
C + O2 → CO2
12 44
X 0.11g
解得X=0.03g
即原来钢铁中有C是0.03g
即含碳量是0.03/12*100%=0.25%1年前查看全部
- 在探究一种钢的含铁量活动中,某同学称取5.7g钢样投入盛有10g稀盐酸(足量)的烧杯(烧杯质量也是10g)中,该同学在其
在探究一种钢的含铁量活动中,某同学称取5.7g钢样投入盛有10g稀盐酸(足量)的烧杯(烧杯质量也是10g)中,该同学在其反应大的过程中对烧杯(包括溶液和残余固体)进行了四次称量,实验结果如下:
(1)能产生氢气的质量是多少?这种钢的样品中含铁的质量分数是多少?______;反应时间 t 0 t 1 t 2 t 3 烧杯和药品质量/g 25.7 25.6 25.5 25.5
(2)有同学根据钢的含碳量少的特点,提出灼烧可使钢中的碳转变为二氧化碳挥发掉,灼烧后钢样品的质量会减轻,可他们将一定量的钢样品灼烧后,却发现其质量反而增加了很多,你认为原因是______. 阳光-剑客1年前1
阳光-剑客1年前1 -
 寒如月 共回答了16个问题
寒如月 共回答了16个问题 |采纳率93.8%(1)根据质量守恒,反应前后质量差即为氢气质量,所以生成氢气的质量=25.7g-25.5g=0.2g;
设样品中含铁的质量为x.
Fe+2HCl═FeCl 2 +H 2 ↑
56 2
x 0.2g
56
x =
2
0.2g
解得:x=5.6g
这种钢的样品中含铁的质量分数是
5.6g
5.7g ×100%=98.2%
答:能产生氢气的质量是0.2g;这种钢的样品中含铁的质量分数是98.2%.
(2)灼烧时,铁与氧气反应生成铁的氧化物而使剩余固体质量增加,碳与氧气反应放出二氧化碳而使剩余固体质量减少,但钢样中含有较多的铁而只含少量的碳,因此,将一定量的钢样品灼烧后,发现质量反而增加了许多.
故答案为:(1)0.2g;98.2%.
(2)因为钢的含碳量较少,碳减少的质量远小于铁转化为氧化物的质量,所以反而增加了很多.1年前查看全部
- 某钢样10g在纯氧中完全燃烧,将生成气体用足量石灰水吸收,共得到沉淀0.5g,求钢样中含碳的质量分数
 兰色幸运草1年前1
兰色幸运草1年前1 -
 undersky 共回答了16个问题
undersky 共回答了16个问题 |采纳率100%CO2 + Ca(OH)2 = CaCO3 + H2O
44---------------------100
X------------------0.5
X=0.22g(CO2)
C + O2 =CO2
12---------44
X---------0.22
X=0.06g(C)
钢样中含碳的质量分数=0.06/10*100%=0.6%1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 jones1年前1
jones1年前1 -
 ai20031023 共回答了25个问题
ai20031023 共回答了25个问题 |采纳率92%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
- 1.1g某钢样在纯氧中完全燃烧得到0.013g二氧化碳.求此钢样中碳的质量分数
 秋易浓1年前1
秋易浓1年前1 -
 萌梓 共回答了11个问题
萌梓 共回答了11个问题 |采纳率90.9%碳的质量=0.013*12/44=0.0035g
钢样中碳的质量分数=0.0035/1.1=0.32%1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 lee3322607091年前1
lee3322607091年前1 -
 马亮蛋 共回答了26个问题
马亮蛋 共回答了26个问题 |采纳率92.3%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
- 某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
某钢样1.1 g在纯氧中完全燃烧,得到0.013 g二氧化碳,求此钢样中碳的质量分数.
 zizhe111年前1
zizhe111年前1 -
 peter5896 共回答了19个问题
peter5896 共回答了19个问题 |采纳率94.7%解题思路:钢样在氧气中完全燃烧,其中的碳全部燃烧生成二氧化碳,可根据二氧化碳的质量计算出碳元素质量即钢样中所含碳的质量.0.013g CO2中C元素质量=0.013 g×[12/44×100%≈0.0035g
此钢样中碳的质量分数=
0.0035g
1.1g]×100%≈0.3%
答:此钢样中碳的质量分数约为0.3%.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 也可根据碳燃烧生成二氧化碳的化学方程式计算钢样中碳的质量.1年前查看全部
大家在问
- 1英语翻译这里的give birth to 谢拉
- 2用棒敲打7个装不同水量的玻璃瓶这七个瓶子发出了不同的声音,请问发出声音的原因和音调不同的原因各是什么?七点半以前.
- 3当氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)通过电压为U的云强电场,Uq那个最大
- 4我仅会一点点英语,用英文怎么说?
- 5还反国的反是什么意思
- 6Kathina 这个单词要怎么发音啊拜托各位了 3Q
- 7关于文明的英语手抄报必须有翻译的
- 8三十六种动物猜谜谜底 知道者答 不知者不答.请不要不知道乱答的,
- 9a terrific headache.是什么意思
- 10已知D,E分别为△ABC的边AB,AC上的点,F是线段DE上的任意一点,且S△ABC=1,求证:△BDF和△CEF中至少
- 11如图,四边形ABCD为矩形,AD⊥平面ABE,AE=EB=BC=2,F为CE上的点,且BF⊥平面ACE.
- 12李萍和赵娜做轮流报数的游戏,每次只能报1、2、3这三个数中的一个。把两人报的数逐次相加,谁报数后和(两人报数的总和)是2
- 13如何能得知电话机听筒里是否有一块永久磁体?并说明应用的物理知识.
- 14树干又高又直的树有哪些?
- 15电源电压为6v,灯l1和灯l2串联电流表测串联电路电流电压表测灯l1两端电压闭合开关,示数为2v,l2电阻4殴,