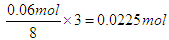0.15mol某金属单质R与足量的稀硫酸充分反应后,生成标况下5.04L的H2和25.65g该金属的硫酸盐,如果该金属原
 Google测试员57032022-10-04 11:39:540条回答
Google测试员57032022-10-04 11:39:540条回答
已提交,审核后显示!提交回复
共0条回复
相关推荐
- 当PCl5 = PCl3 +Cl2的化学平衡常数Kc=1.8M时,在0.5L的容器中加入0.15molPCl5,求平衡后
当PCl5 = PCl3 +Cl2的化学平衡常数Kc=1.8M时,在0.5L的容器中加入0.15molPCl5,求平衡后Cl2的浓度
 ai流浪鱼1年前1
ai流浪鱼1年前1 -
 hanyijun 共回答了15个问题
hanyijun 共回答了15个问题 |采纳率93.3%解析:PCl5 = PCl3 +Cl2
开 0.15 0 0
变 X X X
平 0.15-X X X
Kc= C(PCl3)C(Cl2)/C(PCl5) =X/0.5*X/0.5/ ( 0.15-X)/0.5 =1.8
X= 0.13mol C(Cl2)=0.13/0.5=0.26(mol/L)1年前查看全部
- (2013•黄浦区二模)某废水200g,其中含硫酸0.15mol,加入一定量的氢氧化钠溶液,可使废水酸性降低.
(2013•黄浦区二模)某废水200g,其中含硫酸0.15mol,加入一定量的氢氧化钠溶液,可使废水酸性降低.
①在上述废水中加入80g10%的氢氧化钠溶液,可以中和多少mol的硫酸?
②上述反应结束后,恢复到室温,所得溶液的pH______(填“>”、“=”或“<”). clear-ice1年前1
clear-ice1年前1 -
 糖盒糖盒 共回答了14个问题
糖盒糖盒 共回答了14个问题 |采纳率85.7%解题思路:依据溶液的有关计算求出氢氧化钠的质量,而后将其转化为物质的量,利用化学反应方程式即可求出消耗硫酸的量,利用此数据与原来含有的硫酸的质量进行比较,即可判断溶液的pH;80g10%的氢氧化钠溶液中含有氢氧化钠的质量是80g×10%=8g,则其物质的量为[8g/40g/mol]=0.2mol;
①设这些氢氧化钠可中和硫酸的量是x
2NaOH+H2SO4═Na2SO4+2H2O
2 1
0.2mol x
[2/1=
0.2mol
x]
x=0.1mol
②由于这些氢氧化钠中和的硫酸的量是0.1mol<0.15mol,所以反应后硫酸有剩余,故溶液呈酸性,则溶液的pH<7;
故答案为:①可以中和0.1mol的硫酸;②<;点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是对化学反应方程式的考查,解题的关键是对物质的质量与物质的量之间的转化方法;1年前查看全部
- 标况下2.24L的co2通入0.15mol的naoh溶液,为什么c(hco3-)>c(co3 2-)
 马季3051年前1
马季3051年前1 -
 th76511 共回答了19个问题
th76511 共回答了19个问题 |采纳率73.7%标况下2.24L的co2通入0.15mol的naoh溶液,为什么c(hco3-)>c(co3 2-)
利用元素守恒计算结果是c(hco3-)==c(co3 2-)=0.05mol/L,碳酸根离子对应的酸碳酸氢比碳酸氢对应的酸碳酸弱,所以碳酸根离子更易水解,生成了碳酸氢根离子,同时溶液中存在少量的碳酸分子.1年前查看全部
- 将铝投入到一定量的氢氧化钠溶液中,充分反应后有0.15mol的电子发生转移,则参加反应的铝的物质的量是
将铝投入到一定量的氢氧化钠溶液中,充分反应后有0.15mol的电子发生转移,则参加反应的铝的物质的量是
求详解 餐厅主任1年前2
餐厅主任1年前2 -
 vviolette 共回答了15个问题
vviolette 共回答了15个问题 |采纳率86.7%2Al+2NaOH+6H2O=2Al[Na(OH)4]+3H2
根据化学反应方程式,1molAl对应3mol电子,则0.15mol电子对应0.05molAl1年前查看全部
- 13.7G NA2CO3和NAHCO3的混合物,加入足量的盐酸完全反应,得到0.15MOL CO2气体,求混合物中NA2
13.7G NA2CO3和NAHCO3的混合物,加入足量的盐酸完全反应,得到0.15MOL CO2气体,求混合物中NA2CO3的质量百分含量
 llsjyzh1年前1
llsjyzh1年前1 -
 jessica_cqu 共回答了11个问题
jessica_cqu 共回答了11个问题 |采纳率90.9%我简单的说下 思路
NA2CO3和NAHCO3 和 CO2中的C都是一个
所以可求得混合物(把混合物看成一种物质)的摩尔质量
已知 CO2是0.15mol 则混合物的摩尔质量M=m/n=13.7/0.15=91.33
已知NA2CO3和NAHCO3的摩尔质量分别为106 和84
用十字交叉法
NA2CO3 106 7.33 1
91.33
NAHCO3 84 14.67 2
可知NA2CO3和NAHCO3在混合物中的摩尔比为1:2
即 NA2CO3为0.05molNAHCO3为0.1mol
NA2CO3的质量百分比=5.3/13.7/=38.7%1年前查看全部
- 0.1mol某金属和足量盐酸反应,产生0.15mol H2,该金属的核电荷数是( )
0.1mol某金属和足量盐酸反应,产生0.15mol H2,该金属的核电荷数是( )
A. 11
B. 12
C. 13
D. 19 醉蝶1161年前4
醉蝶1161年前4 -
 wangyingzhou 共回答了23个问题
wangyingzhou 共回答了23个问题 |采纳率91.3%解题思路:设该金属化合价为n,则化学方程式为:2M+2nHCl=2MCln+nH2↑,然后根据方程式求解.设该金属化合价为n,则化学方程式为:
2M+2nHCl=2MCln+nH2↑
2 n
0.10.15
所以[2/0.1=
n
0.15]
求得n=3,
三价金属在中学阶段只有铝,所以该金属的核电荷数为13.故选C.点评:
本题考点: 化学方程式的有关计算;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查根据化学方程式计算的相关问题,学生只要根据方程求解就可以了,比较容易.1年前查看全部
- 某元素A2.7g和稀盐酸反应生成ACl3,置换出0.15mol氢气,A的原子核里有14个中子,根据计算结果,写出A的电子
某元素A2.7g和稀盐酸反应生成ACl3,置换出0.15mol氢气,A的原子核里有14个中子,根据计算结果,写出A的电子排布式、元素名称和元素符号,指出A在周期表中的位置
 飞火流星Ivan1年前2
飞火流星Ivan1年前2 -
 芗5 共回答了21个问题
芗5 共回答了21个问题 |采纳率85.7%该元素名称是铝,元素符号是Al,电子排布是从内到外依次是283,在原始周期表中的位置是第三周期,第三主族.1年前查看全部
- 用氯酸钾与二氧化锰混合,充分反应可制取0.15mol的氧气,需要氯酸钾多少摩尔
 微笑的妖精1年前2
微笑的妖精1年前2 -
 无冻鱼终 共回答了23个问题
无冻鱼终 共回答了23个问题 |采纳率95.7%设需要氯酸钾的物质的量是x
2 KClO3 = 2 KCl + 3 O2↑
2 3
x 0.15 mol
所以2/3 = x/0.15
x=0.1 mol
即需要氯酸钾0.1 mol1年前查看全部
- 求一道化学计算题13.7克Na2CO3和NaHCO3的混合物,加入足量的盐酸完全反应,得到0.15molCO2气体,求混
求一道化学计算题
13.7克Na2CO3和NaHCO3的混合物,加入足量的盐酸完全反应,得到0.15molCO2气体,求混合物中的Na2CO3的质量 欧阳去非1年前4
欧阳去非1年前4 -
 sheillar 共回答了16个问题
sheillar 共回答了16个问题 |采纳率93.8%分别写出两个物质于盐酸的化学反应方程式,会发现Naco3和NaHCo3与Co2的比例都是1:1,根据这个关系以及题目条件的两个关系式即可求解.
M1/106+M2/84=0.15
M1+M2=13.7
M1,M2分别代表碳酸钠和碳酸氢钠质量.1年前查看全部
- 在KCL MGCL2 MG(NO3)2 形成的混合溶液中,C(K+)=0.2MOL/L,C(MG2+)=0.15MOL/
在KCL MGCL2 MG(NO3)2 形成的混合溶液中,C(K+)=0.2MOL/L,C(MG2+)=0.15MOL/L C(CL-)=0.4MOL/L,则C(NO3-)为?
 sdjnlzf1年前1
sdjnlzf1年前1 -
 fei85124 共回答了20个问题
fei85124 共回答了20个问题 |采纳率90%根据电荷守恒:
C(K+)+2*C(MG2+)= C(CL-)+C(NO3-)
即0.2mol/L+2*0.15mol/L=0.4mol/L+C(NO3-)
C(NO3-)=0.1mol/L1年前查看全部
- (2013•浦东新区三模)向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的
(2013•浦东新区三模)向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L].乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.
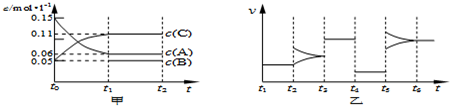
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为______mol/L;该反应的平衡常数表达式为K=c(B)c2(C) c3(A) .c(B)c2(C) c3(A)
(2)若t5时改变的条件是升温,此时v(正)>v(逆),平衡常数K的值将______(选填“增大”、“减小”或“变”).
(3)若 t1=15s,则t0~t1阶段以C 浓度变化表示的平均反应速率为v(C)=______mol/L•s.t3 时改变的某一反应条件可能是______(选填序号).
a.使用催化剂b.增大压强c.增大反应物浓度d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式______. 就做股东1年前1
就做股东1年前1 -
 我的爱在那 共回答了21个问题
我的爱在那 共回答了21个问题 |采纳率81%解题思路:(1)根据C、A浓度的变化判断二者计量数关系,根据t4~t5阶段判断化学方程式,根据化学方程式计算,平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)若t5时改变的条件是升温,此时v(正)>v(逆),则平衡向正反应方向移动,根据生成物浓度和反应物浓度的变化确定K值变化;
(3)根据v=[△C/△t] 计算反应速率,t3 时平衡不移动,且正逆反应速率都增大,增大压强或使用催化剂都增大反应速率;
(4)计算2molA反应的热量,结合方程式书写热化学方程式.(1)t1时反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,若t4时改变的条件为减小压强,根据图乙知,减小压强平衡不移动,则该反应中气体的化学计量数之和前后相等,则有:3A(g)⇌B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,平衡时B的浓度是0.05mol/L,则B的起始物质的量浓度为0.02mol/L;
该反应的方程式为:3A(g)⇌B(g)+2C(g),则其平衡常数表达式为K=
c(B)c2(C)
c3(A);
故答案为:0.02;
c(B)c2(C)
c3(A);
(2)若t5时改变的条件是升温,此时v(正)>v(逆),平衡向正反应方向移动,则反应物浓度减小生成物浓度增大,所以K值增大,故答案为:增大;
(3)若 t1=15s,平均反应速率为v(C)=
(0.11−0.05)mol/L
15s=0.004mol/(L.s),t3 时正逆反应速率都相等且增大,平衡不移动,则改变的某一反应条件可能是使用催化剂或增大压强,故选ab,
故答案为:0.004;ab;
(4)反应的方程式为3A(g)⇌B(g)+2C(g),A的物质的量减少0.02mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为150akJ,根据图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为3A(g)⇌B(g)+2C(g)△H=+150akJ•mol-1,
故答案为:3A(g)⇌B(g)+2C(g)△H=+150akJ•mol-1.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡常数的含义;化学反应速率与化学平衡图象的综合应用.
考点点评: 本题考查化学平衡移动图象题,题目难度较大,注意从乙图判断各阶段的影响因素,此为解答该题的关键.1年前查看全部
- 化学金属元素某金属M和足量盐酸反应0.1molM可产生0.15mol的氢气,该金属元素的核电荷数可能是
 c1ib1年前1
c1ib1年前1 -
 meixia620 共回答了17个问题
meixia620 共回答了17个问题 |采纳率82.4%+3
用电子守恒法,产生0.15摩尔氢气转移的电子是0.3摩尔,0.1摩尔的M得到了0.3摩尔电子,很容易推出M是+3价.1年前查看全部
- 13.7gNa2CO3和NaHCO3的混合物,假如足量的盐酸完全反应,得到0.15molCO2气体,求混合物中Na2CO
13.7gNa2CO3和NaHCO3的混合物,假如足量的盐酸完全反应,得到0.15molCO2气体,求混合物中Na2CO3的质量分数
 fdfeed1年前1
fdfeed1年前1 -
 xiaoling308 共回答了25个问题
xiaoling308 共回答了25个问题 |采纳率88%设Na2CO3,NaHCO3物质的量分别为x,y
碳元素守恒:x+y=0.15 mol(Na2CO3,NaHCO3都只有1个C,产物是CO2)
总质量:106x+84y=13.7 g
解得x=0.05 mol,y=0.1 mol
Na2CO3有0.05 mol,即0.05×106 g = 5.3 g
NaHCO3有0.1 mol,即 84×0.1 g = 8.4 g
Na2CO3质量分数 = 5.3 g ÷(5.3 g+8.4 g) =38.7%1年前查看全部
- 现有五十毫升碳酸钠和硫酸钠的混合液,钠离子的物质的量为0.5mol,硫酸根0.15mol.问,混合物中钠离子和碳酸根的物
现有五十毫升碳酸钠和硫酸钠的混合液,钠离子的物质的量为0.5mol,硫酸根0.15mol.问,混合物中钠离子和碳酸根的物质的量的浓度?解题公式!详细解答,谢谢了!
 湮灭生活1年前2
湮灭生活1年前2 -
 sabrinaa2007 共回答了17个问题
sabrinaa2007 共回答了17个问题 |采纳率82.4%毫无疑问 钠离子的物质的量浓度为: 0.5mol/50ml=10mol/L (毫升变成升) 一个硫酸根离子和一个碳酸根离子都要结合两个钠离子 这样的话就可以知道 硫酸根离子和碳酸根离子一共的物质的量为:0.5mol/2=0.25mol 又知道硫酸根物质的量为0.15mol 则碳酸根物质的量为:0.25-0.15=0.1mol 所以碳酸根的物质的量浓度为 0.1mol/50ml=2mol/L1年前查看全部
- 0.1ml/L氢氧化钠溶液100ml与0.15mol/L盐酸100ml完全混合后氯化钠的物质的量的浓度是多少?
0.1ml/L氢氧化钠溶液100ml与0.15mol/L盐酸100ml完全混合后氯化钠的物质的量的浓度是多少?
同上 最好有过程,谢谢了O(∩_∩)O~
 flashmentha1年前1
flashmentha1年前1 -
 cmiil 共回答了10个问题
cmiil 共回答了10个问题 |采纳率90%0.1×0.1÷(0.1+0.1)
=0.05mol/L1年前查看全部
- 配置500ml 0.15mol/L硫酸溶液,应取98%的浓硫酸多少毫升
 jtling1年前2
jtling1年前2 -
 heavenrain_jing 共回答了21个问题
heavenrain_jing 共回答了21个问题 |采纳率90.5%500ml = 0.5L
则
需要浓硫酸溶质的物质的量为
0.5 * 0.15 = 0.075 mol
浓硫酸溶质的质量为
0.075 mol * 98 g/mol = 7.35 g
查得
98%的浓硫酸 密度为 1.84 g/ml
所以
需要浓硫酸体积为V(mL)
V = 7.35 / ( 1.84 * 98% ) = 4.08 ml1年前查看全部
- 两种气态烃的混合气体0.1mol,完全燃烧得0.15molCO2和3.6gH2O,下列对混合气体的说法正确的是( )
两种气态烃的混合气体0.1mol,完全燃烧得0.15molCO2和3.6gH2O,下列对混合气体的说法正确的是( )
A. 一定有甲烷
B. 一定有甲烷和乙烯(C2H4)
C. 一定没有乙烷
D. 一定有丙炔(C3H4) lbj7171年前2
lbj7171年前2 -
 xyl522 共回答了21个问题
xyl522 共回答了21个问题 |采纳率95.2%解题思路:烃完全燃烧生成二氧化碳和水,结合水、二氧化碳的物质的量,根据H原子、C原子守恒,计算烃的平均分子组成,据此判断.两种气态烃的混合气体0.1mol,完全燃烧得0.15molCO2和3.6gH2O.
3.6g水的物质的量为[3.6g/18g/mol]=0.2mol.
令平均分子组成为CxHy,则:
由碳原子守恒,0.1x=0.15,解得x=1.5.
由氢原子守恒,0.1y=0.2×2,解得y=4.
所以平均分子组成为C1.5H4.
由平均分子组成中碳原子数目为1.5,可知一定含有CH4,由平均分子组成中氢原子数目为4,可知另一烃分子中H原子数目为4.
A、由上述分析可知,一定含有CH4,故A正确;
B、由上述分析可知,另一烃分子中H原子数目为4,如C2H4、C3H4等,可能为甲烷和乙烯,故B错误;
C、由上述分析可知,另一烃分子中H原子数目为4,故一定没有乙烷,故C正确;
D、由上述分析可知,另一烃分子中H原子数目为4,如C2H4、C3H4等,可能含有丙炔(C3H4),故D错误.
故选:AC.点评:
本题考点: 有关混合物反应的计算.
考点点评: 考查烃混合物分子式确定,难度中等,注意利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.1年前查看全部
- (1/2)求方法:两种气态烃组成的混合气体0.1mol,完全燃烧得0.15molCO2和3.6g水混合气体中 A一定有甲
(1/2)求方法:两种气态烃组成的混合气体0.1mol,完全燃烧得0.15molCO2和3.6g水混合气体中 A一定有甲烷...
(1/2)求方法:两种气态烃组成的混合气体0.1mol,完全燃烧得0.15molCO2和3.6g水混合气体中 A一定有甲烷 B一定有甲烷和 心零度1年前1
心零度1年前1 -
 还不够被爱 共回答了25个问题
还不够被爱 共回答了25个问题 |采纳率80%设混合物的平均分子式CxHy
0.1molCxHy 产生0.15molCO2,则x=1.5 产生0.2molH2O y=4 所以平均分子式C1.5H4
对于C来讲,一种烃中大于1.5,一种烃中小于1.5 所以一定有甲烷.1年前查看全部
- 已知镁n=0.15mol.镁的质量为3.6g.由Mg+Hcl==Mgcl2+H2↑,可得金属镁反应生成的氢气的物质的量为
已知镁n=0.15mol.镁的质量为3.6g.由Mg+Hcl==Mgcl2+H2↑,可得金属镁反应生成的氢气的物质的量为?
 长青号1年前3
长青号1年前3 -
 q906520 共回答了24个问题
q906520 共回答了24个问题 |采纳率79.2%反应的Mg和生成的H2是1:1的关系,所以是0.15mol1年前查看全部
- 将0.15mol的镁、铝混合物溶于100mL 3mol/LH2SO4溶液中,然后再滴加1mol/L
将0.15mol的镁、铝混合物溶于100mL 3mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
(1)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)______ mL.
(2)若混合物仍为0.15mol,其中Mg粉的物质的量分数为x,用100mL 3mol/L的硫酸溶解此混合物后,再加入675mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3.满足此条件的x的取值范围是:
______. 香草宝贝1年前1
香草宝贝1年前1 -
 cat5218 共回答了19个问题
cat5218 共回答了19个问题 |采纳率94.7%解题思路:(1)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4),据此求出n(NaOH),再利用V=[n/c]计算;
(2)反应后的混合溶液,再加入675mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则x<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用x表示出n(NaAlO2),据此确定x的取值范围.(1)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×3mol/L=0.6mol,所以,V(NaOH)=[0.6mol/1mol/L]=0.6L=600ml,
故答案为:600;
(2)由于为金属混合物,则x<1,Al的物质的量为0.15(1-x)mol,反应后的混合溶液,再加入675mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.15(1-x)mol,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.675×1≥0.6+0.15(1-x),解得x≥0.5,故0.5≤x<1,
故答案为:0.5≤x<1.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查了以镁、铝的化学性质为主线的混合物的计算,难度中等,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化.1年前查看全部
- 0.15mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生正确成5.04LH2和25.65g该金属的硫酸盐,若该金
0.15mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生正确成5.04LH2和25.65g该金属的硫酸盐,若该金属原子核内的质子数比中子数少一个,试通过计算推导该金属元素在周期表中的位置?
 翟米恰布1年前0
翟米恰布1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 取0.15mol未知浓度的浓硫酸,加入铜片后加热,使铜全部溶解,冷却至室温后定容为1L,从中取出50mL,加入铁粉7.0
取0.15mol未知浓度的浓硫酸,加入铜片后加热,使铜全部溶解,冷却至室温后定容为1L,从中取出50mL,加入铁粉7.00g,充分反应后生成气体1.68L(STP)溶液下部残渣是3.04g,所得溶液为FeSO4,计算原浓硫酸的物质的量浓度
 小灰兔呼叫大白兔1年前1
小灰兔呼叫大白兔1年前1 -
 chxyang 共回答了23个问题
chxyang 共回答了23个问题 |采纳率78.3%18mol/L
硫酸和铜反应后有剩余
铁和剩余硫酸反应生成氢气0.075mol,与他反应的硫酸为0.075mol
铁还原铜可用查量法解得:Fe+Cu2+=Cu+Fe2+
64-56=8
差量为:3.04-(7-0.075*56)=0.24mol
所以n(Cu)=64*0.24/8/64=0.03mol
c(硫酸)=(0.03+0.075)*20/0.15=18mol/L
问你个问题哦,这个是化学竞赛班的卷子么,我最近才做的1年前查看全部
- 两种气态烃组成的混合气体0.1mol,完全燃烧得0.15mol CO2 和 3.6g H2O,下列关于该混合气体的说法正
两种气态烃组成的混合气体0.1mol,完全燃烧得0.15mol CO2 和 3.6g H2O,下列关于该混合气体的说法正确的是:
A 一定有甲烷 B 一定没有乙烯 C 一定有乙烯 D 一定有乙烷 nancy_ld1年前3
nancy_ld1年前3 -
 qqaw1314 共回答了21个问题
qqaw1314 共回答了21个问题 |采纳率85.7%水的物质的量为0.2mol
烃:C:H=0.1:0.15:0.4=1:1.5:4 烃的平均组成为C1.5H4,一定有一烃分子式中碳原子数小于1.5只有甲烷,则另有一烃分子式中碳原子数大于1.5,氢原子数必须为4,则另一烃分子式 一定没有乙烷,可能有乙烯.所以选择A1年前查看全部
- 1、某Na2co3和NaHco3的混合物14.8g,与足量盐酸反应生成0.15mol的co2气体,则混合物中Na2co3
1、某Na2co3和NaHco3的混合物14.8g,与足量盐酸反应生成0.15mol的co2气体,则混合物中Na2co3和Nahco3的物质的量之比为多少?
2、把2.5g NaOH和kOH的混合固体溶解与水配成50ml溶液,取出5ml恰好跟5.25ml、1mol/L的盐酸完全中和,求混合物中氢氧化钠和氢氧化钾各多少克? Ivan61年前2
Ivan61年前2 -
 whjiufeng 共回答了24个问题
whjiufeng 共回答了24个问题 |采纳率91.7%1)设碳酸钠物质的量x,碳酸氢钠y,106x+84y=14.8,x+y=0.15mol,x:y=2:1 (2)设NaOH质量为x,KOH为y,x+y=2.5g,(x/40+y/56)/10=5.25/10^3*1,x=1.1g,y=1.4g1年前查看全部
- 0.15mol某金属单质与足量的稀硫酸充分作用后,生成5.04mol氢气(标准状态下),同时生成了25.65g该金属的硫
0.15mol某金属单质与足量的稀硫酸充分作用后,生成5.04mol氢气(标准状态下),同时生成了25.65g该金属的硫酸盐.若该金属原子核内的质子数比中子数少1个,试根据计算推导它在周期表中的位置和主要性质.
 youdiann1年前2
youdiann1年前2 -
 LY-lantianma 共回答了23个问题
LY-lantianma 共回答了23个问题 |采纳率95.7%0.15mol金属生成了0.25mol氢气,他的化合价为+3
经计算他的相对原子质量应为27
27-1在除以2得13
正好化合价为+3
所以为铝,在第三周期3A族1年前查看全部
- 0.15mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生正确成5.04LH2和25.65g该金属的硫酸盐,若该金
0.15mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生正确成5.04LH2和25.65g该金属的硫酸盐,若该金属原子核内的质子数比中子数少一个,试通过计算推导该金属元素在周期表中的位置?
 点点爱成都1年前0
点点爱成都1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某有机物由C、H、O三种元素组成,将该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,已知该有机物的蒸汽密度为
某有机物由C、H、O三种元素组成,将该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,已知该有机物的蒸汽密度为2.68g/L(折算成标准状况),该有机物能与金属钠反应.试回答:
(1)通过计算求出该有机物的分子式.
(2)写出该有机物可能的结构简式. 雪与寂静的季节1年前1
雪与寂静的季节1年前1 -
 yangliyuan4424 共回答了21个问题
yangliyuan4424 共回答了21个问题 |采纳率81%解题思路:有机物的蒸汽密度为2.68g/L,则其相对分子质量为2.68×22.4L=60g,根据原子守恒计算有机物分子中N(C)、N(H),再结合相对分子质量计算有机物分子中N(O),据此确定有机物分子式,该有机物能与金属钠反应,至少含有-COOH、-OH中的一种,结合有机物分子式书写可能的结构.(1)有机物的蒸汽密度为2.68g/L,则其相对分子质量为2.68×22.4L=60g,该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,3g有机物的物质的量=[3g/60g/mol]=0.05mol,3.6g H2O的物质的量为[3.6g/18g/mol]=0.2mol,根据原子守恒,可知有机物分子中N(C)=[0.15mol/0.05mol]=3、N(H)=[0.2mol×2/0.05mol]=8,则有机物分子中N(O)=[60−12×3−1×8/16]=1,故有机物分子式为C3H8O,
答:该有机物分子式为C3H8O.
(2)该有机物能与金属钠反应,有机物分子式为C3H8O,故有机物含有-OH,该有机物的结构简式为CH3CH2CH2OH、CH3CH(OH)CH3,
答:该有机物的结构简式为CH3CH2CH2OH、CH3CH(OH)CH3.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式的确定、限制条件同分异构体书写,难度不大,注意理解标况下密度与摩尔质量的关系.1年前查看全部
- 铁粉和铜粉的均匀混合物你们似乎都错了,应该选BD,第一步和第二步都是反映掉 0.15mol(8.4g)铁,第三步反应掉9
铁粉和铜粉的均匀混合物
你们似乎都错了,应该选BD,第一步和第二步都是反映掉 0.15mol(8.4g)铁,第三步反应掉9.6克铜,最后是Fe2+粒子被过量的稀硝酸氧化 还会生成气体,最后答案是BD, 小曹11年前2
小曹11年前2 -
 很内疚 共回答了19个问题
很内疚 共回答了19个问题 |采纳率89.5%首先来看,当硝酸量为300毫升的时候金属就已经消耗完了,说明最大气体生成量就是6720毫升,因此硝酸体积再增加,生成的NO量不会变化,所以V=6720,D是错的
Fe+4HNO3=Fe(NO3)3+NO+2H2O 3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O
从这里看出要生成1molNO,就要反应1mol铁(56g),或者是1.5mol铜(97.5g).条件1到条件2消耗了8.4g金属;条件2到条件3消耗了9.6g金属.而条件1到条件2生成了0.1molNO,条件2到条件3生成了0.1molNO.这说明直到反应2结束,铁都没被消耗完,而且铁,铜与硝酸是同时反应的,即条件1,2,3所消耗的金属中一定有铁和铜.那么答案A,C都是错的.
所以我们选B.1年前查看全部
- 化学计算题——烃的衍生物某碳氢氧化合物0.075mol在0.15mol氧气中燃烧,反应完毕后,此有机物已完全变成气态无机
化学计算题——烃的衍生物
某碳氢氧化合物0.075mol在0.15mol氧气中燃烧,反应完毕后,此有机物已完全变成气态无机化合物(110℃),混合物平均分子量为27,将此气态混合物通过盛有碱石灰的干燥管,干燥管增重6g,若将此气态混合物通过1L,0.1mol/L的氢氧化钙溶液,产生7.5g沉淀,求有机物的分子式并写出其可能的结构简式.(请写出具体过程) xiaoping4u1年前2
xiaoping4u1年前2 -
 喜儿重现xx 共回答了19个问题
喜儿重现xx 共回答了19个问题 |采纳率89.5%通过氢氧化钙溶液,产生7.5g沉淀可知C元素物质的量为0.075摩尔 而干燥管增重6g为二氧化碳和水 可知氢元素为0.15摩尔 C H之比为1比2 6g为二氧化碳和水为燃烧后带氧元素的质量 质量守恒 故碳氢氧化合物的中氧元素物质的量为0.15摩尔 故C H O比例为 1 2 2 可知最简式为 (cH2o2)n 然后就是确定N了 而碳氢氧化合物0.075mol 可知N=1 故结构简式为HCOOH1年前查看全部
- 0.15mol某气态烃完全燃烧需要消耗0.75mol氧气,求该烃的化学式
 qie--1年前1
qie--1年前1 -
 yvonne881 共回答了22个问题
yvonne881 共回答了22个问题 |采纳率86.4%用烃的燃烧通式
CxHy+(x+y/4)O2=xCO2+(y/2)H2O
1 x+y/4
0.15 0.75
1/0.15=(x+y/4)/0.75
4x+y=20
要使x,y都是整数,并且满足烃的结构,只能是C3H8或C4H41年前查看全部
- 分析化学配位滴定问题混合等体积的0.15mol/升的EDTA和0.1mol/升的Ni(NO3)2溶液,在pH为9的缓冲溶
分析化学配位滴定问题
混合等体积的0.15mol/升的EDTA和0.1mol/升的Ni(NO3)2溶液,在pH为9的缓冲溶液中(不考虑水解等副反应),缓冲剂的组成不与Ni2+配合,求没有配合的Ni离子浓度.lgKni=18.56
各位xdjm,最好能有详细的解答过程,练习册的答案是3.89*10-8 mol/L,但就是算不对。 cvfg2301年前1
cvfg2301年前1 -
 回贴专业户 共回答了14个问题
回贴专业户 共回答了14个问题 |采纳率85.7%方程式:Ni2++EDTA4ˉ=Ni(EDTA)2ˉ.然后用平衡常数解出,不过好难解啊!1年前查看全部
- 某金属0.1mol与足量的盐酸反应,得到0.15mol氢气,则该金属在生成物中的化合价为多少?
 江苏射阳cc李恒1年前1
江苏射阳cc李恒1年前1 -
 bwenwen 共回答了24个问题
bwenwen 共回答了24个问题 |采纳率95.8%因为生成0.15mol氢气,可知反应中转移电子数为:0.15*2=0.3 mol
又因为某金属有0.1mol.故.此金属化合价升高数为 0.3/0.1=3 .
故该金属在生成物中的化合价为 +3 价.1年前查看全部
- 两中气态烃组成的混合气体0.1MOL,完全燃烧得0.15MOL的CO2和3.6G的H2O 问这气体是什么
 zhuyd21988a1年前1
zhuyd21988a1年前1 -
 傻丫头翱翔 共回答了23个问题
傻丫头翱翔 共回答了23个问题 |采纳率91.3%设混合气体平均分子式CxHy
0.1mol燃烧得到0.15CO2和0.2molH2O
所以分子式为C1.5H4
因此一定有CH4,可能有C2H4或者C3H4
CH4和C2H4时,体积比为1:1
CH4和C3H4时,体积比为3:11年前查看全部
- 标况下,3036LH2和O2的混合气体,一共0.15MOL,问,其中原子有多少摩尔,
标况下,3036LH2和O2的混合气体,一共0.15MOL,问,其中原子有多少摩尔,
3摩尔.0.15乘以2,为什么不是乘以4,不是问原子有多少个吗? zhaj10151年前4
zhaj10151年前4 -
 思绪铭 共回答了23个问题
思绪铭 共回答了23个问题 |采纳率82.6%一共是0.15MOL 分子个数为0.15乘NA 得0.15NA 因为都是双原子分子,原子个数为0.15NA乘2 个 也就是0.3MOL1年前查看全部
- 两种气态烃组成的混合气体0.1mol,完全燃烧得0.15molCO2和4.5g水下列说法正确的是混合气体一定有甲烷
两种气态烃组成的混合气体0.1mol,完全燃烧得0.15molCO2和4.5g水下列说法正确的是混合气体一定有甲烷
A混合气体一定有甲烷B混合气体种C混合气体中一定没有乙烯D混合气体中一定有乙烯 (选择哪个? 醴陵12401年前2
醴陵12401年前2 -
 wl368 共回答了24个问题
wl368 共回答了24个问题 |采纳率75%设平均气态烃的化学式这CxHy
4.5g水的物质的量=4.5g/18g/mol=0.25mol
反应的化学方程式为:
CxHy+(x+y/4)O2→xCO2+y/2H2O
1 x+y/4 x y/2
0.1mol 0.15mol 0.25mol
X=1.5
Y=5
混合气态烃中平均的碳原子数为1.5,
则混合气态烃是一种烃的碳原子数比1.5小,另一种烃的碳原子数比1.5大,而烃中碳原子数比1.5小的只有甲烷,所以混合气体一定有甲烷,A正确.1年前查看全部
- 0.15mol某金属单质R与足量的稀硫酸充分反应后,生成标准状况下5.04L H2和25.65g该
 嗷嗷穷的小伙1年前2
嗷嗷穷的小伙1年前2 -
 烦恼小女人 共回答了19个问题
烦恼小女人 共回答了19个问题 |采纳率89.5%提问又不采纳,不厚道.1年前查看全部
- 某金属0.1mol和足量的盐酸反应,得到0.15mol氢气,则该金属在生成物中的化合价是多少?
 dbzathade1年前3
dbzathade1年前3 -
 sfsdhgdfhdfh 共回答了13个问题
sfsdhgdfhdfh 共回答了13个问题 |采纳率84.6%H+生成H2得两个电子,0.15molH2得0.3mol,金属的化合价是+31年前查看全部
- 0.15mol某金属单质与足量稀硫酸充分反应后,在标准状况下生成5.04LH2和·25.65g该金属的硫酸盐
0.15mol某金属单质与足量稀硫酸充分反应后,在标准状况下生成5.04LH2和·25.65g该金属的硫酸盐
若该金属元素原子核内的质子数比中子数少一个,确定他在周期表的位置 militantbomber1年前3
militantbomber1年前3 -
 MZF玫瑰余香 共回答了17个问题
MZF玫瑰余香 共回答了17个问题 |采纳率94.1%标准状况下5.04LH2物质的量为0.225mol,质量为0.45g
生成0.225mol H2需H2SO4 0.225mol参与反应 质量为 22.05g
则0.15mol金属单质的质量为 25.65g + 0.45g -22.05= 4.05g(生成物质量等于反应物的质量)
金属的摩尔质量为 4.05g/0.15mol =27 (Al)
金属元素原子核内的质子为(27-1)/2 =13
13-2-8=3
则该金属元素在周期表的第三周期的IIIA位置1年前查看全部
- 把含氯化氢0.2mol的稀盐酸滴入到含0.15mol的碳酸钠溶液中
把含氯化氢0.2mol的稀盐酸滴入到含0.15mol的碳酸钠溶液中
充分反应后,溶液中碳酸钠、氯化氢、氯化钠、碳酸氢钠各有多少摩尔? joannajyr1年前3
joannajyr1年前3 -
 kaoshijiaolv 共回答了8个问题
kaoshijiaolv 共回答了8个问题 |采纳率87.5%碳酸钠 0mol
氯化氢0mol
碳酸氢钠0.1mol
氯化钠0.2mol1年前查看全部
- 常温下某溶液中含有8种离子,有关离子的浓度如下:c(Na+)= xmol/L c(SO4 2-)=0.15mol/L.c
常温下某溶液中含有8种离子,有关离子的浓度如下:c(Na+)= xmol/L c(SO4 2-)=0.15mol/L.c(K+)=0.2mol/L ,c(Cl-)=0.45mol/L ,c(Mg 2+) = 0.25mol/L,c(NO3 2-)=0.25mol/L,c(OH-)=1×10^-13 mol/L 则x值为
A.0.2 B.0.3 C.0.4 D.0.1 love66981年前2
love66981年前2 -
 marsgy 共回答了17个问题
marsgy 共回答了17个问题 |采纳率82.4%溶液显电中性,即正负电荷之和为零.
c(H+) = 10^(-14)/10^(-13) = 0.1mol/L
所以:(+1)*x + (-2)*0.15 + (+1)*0.2 + (-1)*0.45 + (+2)*0.25 + (-1)*0.25 + (+1)*0.1 = 0
OH-浓度太小,可以忽略
解得x = 0.2
选A
是NO3-,不是NO3 2-1年前查看全部
- 0.15mol某气态烃完全燃烧需消耗0.75mol氧气,通过计算求该烃的化学式
 绿荫幽径1年前2
绿荫幽径1年前2 -
 其实我是土豆 共回答了19个问题
其实我是土豆 共回答了19个问题 |采纳率100%CnH2n+2
2n+(2n+2)/2=10
3n+1=10
n=3
C3H8 丙烷、气态
1个C要2molO
2个H要1molO1年前查看全部
- 铝和硫酸反应 如果 铝有0.15mol 那么铝失去了多少电子?
铝和硫酸反应 如果 铝有0.15mol 那么铝失去了多少电子?
应该是0.15mol乘以6=0.9mol电子吗? bunnygirl1年前3
bunnygirl1年前3 -
 xiaohuicao 共回答了15个问题
xiaohuicao 共回答了15个问题 |采纳率86.7%不是
Al从0价因失去三个电子而变成正三价
Al一共有0.15mol ,只考虑Al就行,不用考虑方程式了
应该是0.15mol乘以3=0.45mol电子1年前查看全部
- 计算0.15mol.L-1NH4Cl溶液的PH值.(已知Kb(NH3)=1.8x10-5)
 dg5986des1年前1
dg5986des1年前1 -
 76202997 共回答了15个问题
76202997 共回答了15个问题 |采纳率86.7%NH4++H2O=NH3·H2O+H+K=[NH3·H2O]*[H+]/[NH4+],上下同时乘以[OH-],K=[NH3·H2O]*[OH-]*[H+]/[NH4+]*[OH-],K=Kw/Kb=[NH3·H2O]*[H+]/[NH4+]=[H+]^2/(0.15-x),因为水解的量不多,可以简化计算,0.15-X=0.15.H+]^2=0.15*...1年前查看全部
- 在某100mL混合液中,HNO 3 和H 2 SO 4 的物质的量浓度分别是0.30mol·L -1 和0.15mol·
在某100mL混合液中,HNO 3 和H 2 SO 4 的物质的量浓度分别是0.30mol·L -1 和0.15mol·L -1 。向该混合液中加入3.20g铜粉,加热,待充分反应后,所得溶液中的Cu 2+ 的物质的量浓度(mol·L -1 )是
A.0.225 B.0.25 C.0.45 D.0.50  tangyanxia1年前1
tangyanxia1年前1 -
 梦断了dd 共回答了29个问题
梦断了dd 共回答了29个问题 |采纳率93.1%1年前查看全部
- 将0.1mol的两种气体烃组成的混合气完全燃烧后得0.15molCO2和0.2mol的水.那么这两种气体中
将0.1mol的两种气体烃组成的混合气完全燃烧后得0.15molCO2和0.2mol的水.那么这两种气体中
A、一定有乙烷
B、一定有乙烯
c、一定没有甲烷
d、一定没有乙烷 林静止水1年前1
林静止水1年前1 -
 wanouzy 共回答了19个问题
wanouzy 共回答了19个问题 |采纳率89.5%选D
原题可转换为:1mol的两种气体烃组成的混合气完全燃烧后得1.5molCO2和2mol的H2O.那么1mol的原混合气体含有1.5mol的C原子和4mol的H原子.
先分析C原子:1mol的两种气体混合气含有1.5mol的C原子,则这两种气体必须满足每种气体每mol的C原子一个大于1.5mol,一个小于1.5mol.小于1.5molC的气体烃只有CH4(甲烷),则一定有甲烷.
再分析H原子:同理C原子的分析方法,这两种气体必须满足每种气体每mol的H原子一个大于4mol,一个小于4mol,或者是都等于4mol.而已经确定含有CH4了,则另一种气体必须满足每mol有4个H原子.
综上所述,这两种气体中,一个是甲烷,另一个分子式中C的个数大于1且H的个数等于4(一定没有乙烷C2H6,可能有乙烯C2H4).1年前查看全部
- 3、充分燃烧4.5g某有机物后,得到3.36L二氧化碳和0.15mol的水.(同条件下测得)该有机物的蒸气对空气的
3、充分燃烧4.5g某有机物后,得到3.36L二氧化碳和0.15mol的水.(同条件下测得)该有机物的蒸气对空气的
相对密度是2.069.求:该有机物的相对分子质量和分子式,若该有机物能与碳酸钠反应放出气体,写出此有机物的同系物中最简单物质的结构简式及名称. M_M_G_G1年前1
M_M_G_G1年前1 -
 2329710 共回答了16个问题
2329710 共回答了16个问题 |采纳率81.3%燃烧4.5g有机物,得到3.36L(标况下)二氧化碳和0.15mol水,则4.5g有机物中含有0.15mol碳元素和0.3mol氢元素.所以4.5g有机物中含氧元素0.15mol(由总质量减去碳氢元素质量求得).
故有机物的最简式为CH2O,相对分子质量为29x2.069=60.00.
设有机物分子式为(CH2O)n,则30xn=60.00 n=2.该有机物分子式为C2H4O2.
该有机物能与碳酸钠反应放出气体,说明分子中含有羧基,为羧酸 (C2H4O2 乙酸).
此有机物的同系物中最简单物质的结构简式为HCOOH,名称为甲酸.1年前查看全部
- 铝与足量氢氧化钠溶液,1.若转移电子0.15mol时,则反映放出的气体在标准状况下体积为
铝与足量氢氧化钠溶液,1.若转移电子0.15mol时,则反映放出的气体在标准状况下体积为
2.若氢氧化钠溶液的的物质 的量浓度0.1mol/L,求消耗氢氧化钠溶液的体积为? qingshan5211年前1
qingshan5211年前1 -
 qhhwb 共回答了18个问题
qhhwb 共回答了18个问题 |采纳率88.9%(0.15/3*4)/0.1=2L1年前查看全部
- 8NH3+3Cl2→N2+6NH4CL其中若消耗0.15mol氧化剂,则被氧化的物质的量为___ 电子转移数目为____
8NH3+3Cl2→N2+6NH4CL其中若消耗0.15mol氧化剂,则被氧化的物质的量为___ 电子转移数目为____
注:电子转移数目为1.806*10的23次方 孙鲁东1年前2
孙鲁东1年前2 -
 fbfrw34t 共回答了23个问题
fbfrw34t 共回答了23个问题 |采纳率78.3%氧化剂CL2 0.15mol
被氧化的物质的量为NH3 0.15mol
电子转移数目为 0.15*2*6.02*10的23次方
ps :电子转移数目的解法
氧化剂(还原剂)的量*化学价升高数*元素个数*阿弗加德罗系数
0.15 * 1 * 2 *6.02*10的23次方1年前查看全部
- 将0.15mol 稀盐酸逐滴滴入0.1mol碳酸钠中再将0.1mol碳酸钠逐滴滴入0.15mol稀盐酸中,哪种情况得到气
将0.15mol 稀盐酸逐滴滴入0.1mol碳酸钠中再将0.1mol碳酸钠逐滴滴入0.15mol稀盐酸中,哪种情况得到气体最多
 zxfwf771年前3
zxfwf771年前3 -
 执手无言9527 共回答了25个问题
执手无言9527 共回答了25个问题 |采纳率100%后者多 盐酸 与碳酸钠反应 先生成碳酸氢钠 再继续与盐酸反应 生成二氧化碳
所以 盐酸滴碳酸钠 会先生成 0.1摩碳酸氢钠 最终生成0.05摩二氧化碳 反之 则直接产生二氧化碳 0.075摩1年前查看全部
大家在问
- 1求微分方程dy/dx-ny/x=e^x x^n的通解
- 2不定积分∫dx/(sinx√(1+cosx))
- 3南京长江大桥的铁路桥比公路桥长2185米,公路桥的2倍比铁路桥长2403米,铁路桥与公路桥各长多少米?
- 4小李打靶,10发打了75环,全部命中在10环、8环、5环,他命中10环、8环、5环各几发
- 51.向装有20mL水的憢杯中加入5g氯化钠,搅拌;2.氯化钠溶解后,再加入5g氯化钠,搅拌;3.然后再加入5mL水
- 6已知在△ABC中,A,B,C的对边为a,b,c,且b=2cosA/2,c=2sinA/2.1.求△ABC的面积S的最大值
- 7化学元素周期表中原子和离子的半径大小比较
- 8因式分解:(2x-1)y^2+(1-2x)^2y
- 9同一平面内三个共点力作用于-个物体上,这个物体处在静止状态,已知其中两个力的大小分别为5N和8N,则第三个力肯定不是下列
- 10仿写 江河海洋是母亲的血液
- 11有一批袜子,用同样的盒子包装.上午将全部的60%装了25盒还余2双;下午把余下的装完,正好装17箱
- 12古诗《风》里有哪几种自然现象
- 13可我不知道写什么写个范文
- 14(2012•天宁区模拟)下图是生活用电的几种做法,其中正确的是( )
- 15数字在汉语中的意思 "一"在汉语中所表示的意义(按要求选成语填空) 帮下忙,