水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列
 惟愿2022-10-04 11:39:541条回答
惟愿2022-10-04 11:39:541条回答A.每生成1mol Fe3O4,转移的电子总数为3mol
B.该反应中x=6
C.被1molS2O32-还原的O2的物质的量为[1/4]mol
D.此反应中只有S2O32-是还原剂

已提交,审核后显示!提交回复
共1条回复
 alonelw 共回答了11个问题
alonelw 共回答了11个问题 |采纳率90.9%- 解题思路:从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.
A.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故A错误;
B.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故B错误;
C.由电子守恒可知,被1molS2O32-还原的O2的物质的量为
1mol×2×(2.5−2)
2×(2−0)=[1/4]mol,故C正确.
D.Fe和S元素的化合价升高,则Fe2+、S2O32-均为还原剂,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,明确各元素的化合价变化是解答该题的关键,注意Fe、S元素的化合价均升高,题目难度中等. - 1年前
相关推荐
- 水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-→Fe3O4+S4O62-+2H2O,下列
水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-→Fe3O4+S4O62-+2H2O,下列说法中,不正确的是( )
A. 每生成1mol Fe3O4,反应转移的电子总数为2mol
B. Fe2+和S2O32-都是还原剂
C. 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol
D. x=4 igobo1年前3
igobo1年前3 -
 丫丫扮靓 共回答了17个问题
丫丫扮靓 共回答了17个问题 |采纳率88.2%解题思路:从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.A.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故A错误;
B.反应中Fe2+→Fe3O4,Fe元素化合价升高,S2O32-→S4O62-+,S元素的化合价升高,Fe2+和S2O32-都是还原剂,故B正确;
C.1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为[1/4]mol,故C错误;
D.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故D正确.
故选AC.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度不大.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法中,正确的是( )
A. 每生成1mol Fe3O4,反应转移的电子总数为2mol
B. Fe2+和S2O32-都是还原剂
C. 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol
D. x=2 linhong080251321年前2
linhong080251321年前2 -
 ahahah32 共回答了17个问题
ahahah32 共回答了17个问题 |采纳率100%解题思路:A.反应中只有氧气的元素化合价降低,根据方程式计算生成1mol Fe3O4,需要消耗氧气的物质的量,再结合氧元素化合价变化计算转移电子数目;
B.S2O32-中S由+2价升高为S4O62-中+2.5价,Fe3O4中两个铁为+3价,一个铁为+2价,Fe2+被氧化;
C.Fe2+被氧化时,提供1 mol电子,根据电子转移守恒计算被Fe2+还原的O2的物质的量;
D.根据电荷守恒可确定x的值.A.在反应中每生成1molFe3O4同时消耗1mol O2,反应中只有氧气的元素化合价降低,由0价降低为-2价,所以转移的电子数为1mol×4=4 mol,故A错误;
B.S2O32-中S由+2价升高为S4O62-中+2.5价,S2O32-是还原剂.Fe3O4中两个铁为+3价,一个铁为+2价,Fe2+被氧化,Fe2+是还原剂,故B正确;
C.Fe2+被氧化时,提供1 mol电子,氧元素由0价降低为-2价,所以被Fe2+还原的O2的物质的量为[1/4]mol,故C错误;
D.根据电荷守恒可确定x的值,3×2-4-x=-2,x=4,故D错误;
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应基本概念、计算与配平等,题目难度中等,明确各元素的化合价变化是解答该题的关键,本题注意根据电荷守恒可确定x的值.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,
水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,
参加反应的Fe2+全部做还原剂、1molFe2+被氧化时,被Fe2+还原的O2的物质的量为1/4……请问这俩结论,为什么第一个是错误的,第二个是正确的, 相忘相望1年前1
相忘相望1年前1 -
 莘智 共回答了17个问题
莘智 共回答了17个问题 |采纳率100%第一个的方程式配平是不对的,还原剂失电子数目和氧化剂得电子数目不相等.
其中在S2O3 2-中,S为+2价;在S4O6 2- 中,S为+2.5价.反应前后S转移电子数目=4×(2.5-2)=2mol ;3mol的Fe2+失电子生成Fe3+转移电子3mol,到此,还原剂共转移了5mol的电子.而做为氧化剂的O2只得到了4mol的电子.因此,第一个方程式的配平是错误的.
第二个说法中1molFe2+被氧化,转移1mol的电子;而1molO2被还原到H2O或OH-需要转移4mol的电子.因此Fe2+还原的O2的物质的量为其1/4.
希望能够帮助到你~
如有疑惑,欢迎追问1年前查看全部
- (2014•湖北模拟)水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-═Y+S4O62-
(2014•湖北模拟)水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列说法中,不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2O32-是还原剂
D.每有1molO2参加反应,转移的电子总数为4mol king2ll81年前1
king2ll81年前1 -
 誘o惑 共回答了25个问题
誘o惑 共回答了25个问题 |采纳率92%解题思路:氧化还原反应遵循电荷守恒、电子守恒以及原子守恒,化合价升高元素所在的反应物做氧化剂.A、根据氢原子守恒可以知道a=4,故A正确;
B、根据电荷守恒,方程式的左边带2个负电荷,所以右边的Y为电中性的,根据铁元素和氧元素守恒,可知Y为Fe3O4,故B错误;
C、S2O32-中的硫元素化合价升高,是还原剂,故C正确;
D、反应中转移的电子总数等于氧元素化合价降低的数目,氧气中的氧元素全部从0价降到-2价,共得到1mol×2×(2-0)=4mol电子,故D正确.
故选B.点评:
本题考点: 氧化还原反应方程式的配平;氧化还原反应的电子转移数目计算.
考点点评: 本题主要考查学生氧化还原反应的有关知识,难度较大.1年前查看全部
- 已知Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+
已知Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法不正确的是( )
A.O2是氧化剂,S2O32-和Fe2+是还原剂
B.每生成1molFe3O4,则转移电子数为4mol
C.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
D.参加反应的氧化剂与还原剂的物质的最之比为1:5 取个名就这么难1年前1
取个名就这么难1年前1 -
 今年我落榜了 共回答了18个问题
今年我落榜了 共回答了18个问题 |采纳率88.9%解题思路:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe元素的化合价由+2价升高为+3价,S元素的化合价升高,只有氧气中O元素的化合价降低,该反应中转移4e-,以此来解答.A.Fe、S元素的化合价升高,O元素的化合价降低,则O2是氧化剂,S2O32-和Fe2+是还原剂,故A正确;
B.每生成1molFe3O4,由O元素的化合价变化可知,转移电子数为1mol×2×(2-0)=4mol,故B正确;
C.若有2molFe2+被氧化,由电子守恒可知,则被Fe2+还原的O2为
2mol×(3−2)
2×(2−0)=0.5mol,故C正确;
D.O2是氧化剂,S2O32-和Fe2+是还原剂,由反应中的化学计量数可知,3molFe2+中有1mol不作氧化剂,则参加反应的氧化剂与还原剂的物质的最之比为1:(2+2)=1:4,故D错误;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子转移及电子守恒的考查,注意选项D为解答的易错点,题目难度不大.1年前查看全部
- 关于水热法合成合成有机金属配合物 对有机物的性质有什么限制吗 是否适用于酰胺类与过渡金属的合成
 llf64571年前1
llf64571年前1 -
 hcgnitgb 共回答了13个问题
hcgnitgb 共回答了13个问题 |采纳率84.6%水热和溶剂热都可通称为水热法,酰胺类有机物作配体,最好采用有机溶剂,而且尽可能使用具有相邻酰基的酰胺.毕竟酰胺在高温下遇水容易发生水解,就像肉在高压锅了更容易煮烂一样.1年前查看全部
- 急需,只需详解D水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62
急需,只需详解D
水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法不正确的是 ( )
A.x=4
B.每生成1 mol Fe3O4,反应转移的电子总数为4mol
C.Fe2+和S2O32-都是还原剂
D.1 mol Fe2+被氧化时,被Fe2+还原的O2物质的量为1/3mol filwy1年前0
filwy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 溶剂热或水热法制备氧化石墨烯复合材料文献
 秋凉晓寒1年前2
秋凉晓寒1年前2 -
 yixuan_luo 共回答了16个问题
yixuan_luo 共回答了16个问题 |采纳率93.8%石墨烯_金属氧化物复合材料的制备及电化学性能研究
氧化石墨烯负载金属硫化物_CdS_ZnS_的制备及电化学性能研究
Chitosan-Functionalized Graphene Oxide as a Nanocarrier for Drug and Gene Delivery
这几篇应该差不多了
其中第二篇中的参考文献100-104也有你想要的哈1年前查看全部
- 已知Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+
已知Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法不正确的是( )
A.参加反应的氧化剂与还原剂的物质的最之比为1:5
B.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
C.每生成1molFe3O4,则转移电子数为4mol
D.O2是氧化剂,S2O32-和Fe2+是还原剂 天夕紫紫1年前1
天夕紫紫1年前1 -
 yixiang235 共回答了23个问题
yixiang235 共回答了23个问题 |采纳率95.7%解题思路:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe、S元素的化合价升高,O元素的化合价降低,以此来解答.A.Fe、S元素的化合价升高,O元素的化合价降低,则O2为氧化剂,Fe2+、S2O32-为还原剂,则参加反应的氧化剂与还原剂的物质的最之比为1:(1+2)=1:3,故A错误;
B.若有2molFe2+被氧化,由电子守恒可知,则被Fe2+还原的O2为
2mol×(3−2)
2×(2−0)=0.5mol,故B正确;
C.每生成1molFe3O4,有1mol氧化剂参加反应,由O元素的化合价变化可知转移电子数为1mol×2×(2-0)=4mol,故C正确;
D.Fe、S元素的化合价升高,O元素的化合价降低,则O2为氧化剂,Fe2+、S2O32-为还原剂,故D正确;
故选A.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化计算转移电子为解答的关键,侧重分析与计算能力的考查,题目难度不大.1年前查看全部
- 化学文献翻译:本文提出了一种以水热法合成一系列水溶性CdTe量子点的简单制备路线.在各种优化的条件下,制
 晴天CH1年前1
晴天CH1年前1 -
 三生石上缘自诀 共回答了12个问题
三生石上缘自诀 共回答了12个问题 |采纳率91.7%A facile hydrothermal approach to synthesize a series of water-soluble CdTe quantum dots was presented.
找篇类似文献
http://www.***.net/kcms/detail/detail.aspx?dbcode=cjfq&dbname=cjfq2008&filename=gdxh200804005&uid=WEEvREcwSlJHSldRa1FiK0UxOVZCbjNvMm9QV3VNYnNPWHJvd1p5MVVjM3FnK2lGN21oWm0vajdJd3o2OExRPQ==&p=1年前查看全部
- 水热法制备纳米材料需要加入表面活性剂吗?一般要注意哪些问题,我合成复合的.
 song02021年前1
song02021年前1 -
 就是呆呆 共回答了23个问题
就是呆呆 共回答了23个问题 |采纳率91.3%有些需要,有些不需要.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O下列说
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O下列说法中,正确的是( )
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为[1/4]mol
D.x=6 wstxdydbd1年前1
wstxdydbd1年前1 -
 简单平凡ckm 共回答了19个问题
简单平凡ckm 共回答了19个问题 |采纳率94.7%解题思路:从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.A.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故A错误;
B.反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,所以只有[2/3]的Fe2+作还原剂,故B错误;
C.1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为[1/4]mol,故C正确.
D.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故D错误;
故选C.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,题目难度中等,明确各元素的化合价变化是解答该题的关键.1年前查看全部
- 化学专业英语翻译以Na2WO4.2H2O和Zn(NO3)2.6H2O为原料,采用水热法制备出ZnWO4纳米晶催化剂.以曙
化学专业英语翻译
以Na2WO4.2H2O和Zn(NO3)2.6H2O为原料,采用水热法制备出ZnWO4纳米晶催化剂.以曙红B为目标降解物,研究了ZnWO4催化剂的光催化性能,探讨了水热温度、水热时间和水热溶液pH值对ZnWO4催化剂的结晶形态及光催化活性的影响规律,结果表明:在酸性条件下制备的ZnWO4为片状结构,链状分布,而在碱性条件下为棒状结构.在180℃,24 h的制备条件下,ZnWO4催化剂显示出最高的光催化活性.水热溶液pH=5和pH=8时制得的催化剂在2 h内对5 mg/L的曙红B溶液的脱色率分别达到86%和95%.制备过程中溶液的pH值,催化剂的晶态和比表面积是影响催化剂活性的重要因素.
 注册被说是重名1年前1
注册被说是重名1年前1 -
 andijiaren 共回答了20个问题
andijiaren 共回答了20个问题 |采纳率90%To Na2WO4. 2H2O and Zn (NO3) 2.6 H2O as raw material, adopting hydrothermal legal system for the ZnWO4 nanocrystalline catalysts. To Shu red B as the goal, studied degradants ZnWO4 catalyst photocatalytic performance, discusses the heat and water temperature, hydrothermal time and hydrothermal solution pH value of crystal morphology and ZnWO4 catalyst photocatalytic activity of the influence law, the result shows: in acidic condition for the preparation of ZnWO4 patchy distribution structure, chain in alkaline conditions for rod structure. In 180 ℃, 24 h preparation conditions, ZnWO4 catalyst shows the highest photocatalytic activity. Hydrothermal solution pH = 5 and pH = 8 preparation of catalysts in 2 to 5 mg/h L within the Shu red B solution determined.the decolored rate achieved respectively 86% and 95%. During the preparation of solution of pH value, the catalyst of amorphous and specific surface area is the effect of catalyst activeness of important factor.1年前查看全部
- 水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O 3 2- +O 2 +xOH — =Fe 3
水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O 3 2- +O 2 +xOH — =Fe 3 O 4 +S 4 O 6 2- +2H 2 O,下列说法中,正确的是
A.Fe 2+ 和S 2 O 3 2— 都是还原剂 B.x=6 C.1mol Fe 2+ 被氧化时,被Fe 2+ 还原的O 2 的物质的量为1/3mol D.每生成1mol Fe 3 O 4 ,反应转移的电子总数为3mol  龙年话梅1年前1
龙年话梅1年前1 -
 amwcivw 共回答了12个问题
amwcivw 共回答了12个问题 |采纳率108.3%A
1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-→Fe3O4+S4O62-+2H2O,下列
水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-→Fe3O4+S4O62-+2H2O,下列说法中,不正确的是( )
A. 每生成1mol Fe3O4,反应转移的电子总数为2mol
B. Fe2+和S2O32-都是还原剂
C. 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol
D. x=4 静夜埙声1年前1
静夜埙声1年前1 -
 rou_2006 共回答了17个问题
rou_2006 共回答了17个问题 |采纳率88.2%解题思路:从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.A.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故A错误;
B.反应中Fe2+→Fe3O4,Fe元素化合价升高,S2O32-→S4O62-+,S元素的化合价升高,Fe2+和S2O32-都是还原剂,故B正确;
C.1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为[1/4]mol,故C错误;
D.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故D正确.
故选AC.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度不大.1年前查看全部
- (2014•闵行区一模)水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH-→Fe3O4+S
(2014•闵行区一模)水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH-→Fe3O4+S4O62-+2H2O,有关说法正确的是( )
A.每转移1.5mol电子,有1.125mol Fe2+被氧化
B.x=2
C.Fe2+、S2O32-都是还原剂
D.每生成1mol Fe3O4,转移电子2mol 30453335310f786e1年前1
30453335310f786e1年前1 -
 ▓星際豬頭▓ 共回答了22个问题
▓星際豬頭▓ 共回答了22个问题 |采纳率86.4%解题思路:从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,
反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.在3Fe2++2 S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+[8/3];
硫元素的化合价变化为:+2→+[5/2];氧元素的化合价变化:0→-2,
A.由方程式3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O可知,当转移4mol电子时,有2molFe2+被氧化,则每转移1.5mol电子,有0.75mol Fe2+被氧化,故A错误;
B.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故B错误;
C.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,Fe2+和S2O32-都是还原剂,故C正确;
D.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,需要氧气1mol,反应转移的电子总数为4mol,故D错误.
故选C.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意Fe3O4是复杂的化合物,铁元素既有+2价也有+3价,把Fe3O4中铁元素的化合价用平均化合价处理,S2O32-的硫元素的化合价用平均化合价处理是解本题的关键,本题难度较大,需细心分析.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,(
水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,(Fe3O4可看成FeO.Fe2O3)下列说法中,正确的是( )
A.x=2
B.参加反应的Fe2+全部做还原剂
C.每生成1mol Fe3O4,反应转移的电子总数为4mol
D.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol 大连四大之331年前1
大连四大之331年前1 -
 汉时明月 共回答了18个问题
汉时明月 共回答了18个问题 |采纳率94.4%解题思路:由电荷守恒可知,(+2)×3+(-2)×2+x×(-1)=-2,解得x=4,反应中Fe元素的化合价升高,S元素的化合价升高,O元素的化合价降低,以此来解答.A.由电荷守恒可知,(+2)×3+(-2)×2+x×(-1)=-2,解得x=4,故A错误;
B.反应产物Fe3O4中Fe的化合价为+3、+2价,则参加反应的Fe2+部分被氧化作还原剂,故B错误;
C.每生成1mol Fe3O4,只有1mol氧气得到电子,则反应转移的电子总数为1mol×2×(2-0)=4mol,故C正确;
D.由电子守恒可知,1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
1mol×(3−2)
2×(2−0)=[1/4]mol,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重电子守恒、电荷守恒分析与应用,题目难度不大.1年前查看全部
- (2013•湖北一模)已知Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++
(2013•湖北一模)已知Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.每生成1molFe3O4,则转移电子数为2mol
C.参加反应的氧化剂与还原剂的物质的最之比为1:1
D.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol wangshengk1年前1
wangshengk1年前1 -
 利刃魔 共回答了8个问题
利刃魔 共回答了8个问题 |采纳率100%解题思路:A、所含元素化合价降低得到反应物是氧化剂,所含元素化合价升高的反应物是还原剂.结合方程式中元素化合价变化判断.
B、反应中只有氧气中氧元素的化合价降低,由0价升高为-2价,据此计算转移电子物质的量.
C、所含元素化合价降低得到反应物是氧化剂,所含元素化合价升高的反应物是还原剂.结合方程式计算判断.
D、根据部分电子转移守恒计算.在3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+[8/3];硫元素的化合价变化为:+2→[5/2]+;氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-.
A、由上述分析可知,还原剂是Fe2+、S2O32-,氧化剂是O2,故A错误;
B、由方程式可知,每生成1molFe3O4,参加反应的氧气为1mol,转移电子数为1mol×4=4mol,故B错误;
C、由上述分析可知,氧化剂是O2,还原剂是Fe2+、S2O32-,3molFe2+参加反应时只有2mol被氧化,参加反应的氧化剂与还原剂的物质的最之比为1:(2+2)=1:4,故C错误;
D、2molFe2+被氧化时,失去电子2mol,则被Fe2+还原的O2的物质的量为[2mol/4]=0.5mol,故D正确.
故选:D.点评:
本题考点: 氧化还原反应的计算;氧化还原反应的电子转移数目计算.
考点点评: 考查氧化还原反应的基本概念与计算,Fe3O4是复杂的化合物,铁元素既有+2价也有+3价,把Fe3O4中铁元素的化合价用平均化合价处理,S2O32-的硫元素的化合价用平均化合价处理是解本题的关键,本题难度较大,需细心分析.1年前查看全部
- 已知Fe 3 O 4 可表示成(FeO•Fe 2 O 3 ),水热法制备Fe 3 O 4 纳米颗粒的总反应为:3Fe 2
已知Fe 3 O 4 可表示成(FeO•Fe 2 O 3 ),水热法制备Fe 3 O 4 纳米颗粒的总反应为:3Fe 2+ +2S 2 O 3 2- +O 2 +4OH - =Fe 3 O 4 +S 4 O 6 2- +2H 2 O,下列说法正确的是( ) A.O 2 和S 2 O 3 2- 是氧化剂,Fe 2+ 是还原剂 B.每生成1molFe 3 O 4 ,则转移电子数为2mol C.参加反应的氧化剂与还原剂的物质的最之比为1:1 D.若有2molFe 2+ 被氧化,则被Fe 2+ 还原的O 2 为0.5mol  wzzlb1年前1
wzzlb1年前1 -
 ss4g9 共回答了21个问题
ss4g9 共回答了21个问题 |采纳率90.5%在3Fe 2+ +2S 2 O 3 2- +O 2 +4OH - =Fe 3 O 4 +S 4 O 6 2- +2H 2 O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+
8
3 ;硫元素的化合价变化为:+2→
5
2 +;氧元素的化合价变化:0→-2,所以氧化剂是O 2 ;还原剂是Fe 2+ 、S 2 O 3 2- .
A、由上述分析可知,还原剂是Fe 2+ 、S 2 O 3 2- ,氧化剂是O 2 ,故A错误;
B、由方程式可知,每生成1molFe 3 O 4 ,参加反应的氧气为1mol,转移电子数为1mol×4=4mol,故B错误;
C、由上述分析可知,氧化剂是O 2 ,还原剂是Fe 2+ 、S 2 O 3 2- ,3molFe 2+ 参加反应时只有2mol被氧化,参加反应的氧化剂与还原剂的物质的最之比为1:(2+2)=1:4,故C错误;
D、2molFe 2+ 被氧化时,失去电子2mol,则被Fe 2+ 还原的O 2 的物质的量为
2mol
4 =0.5mol,故D正确.
故选:D.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+4OH-=Fe3O4+S2O62-+2H2O,每生成1m
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+4OH-=Fe3O4+S2O62-+2H2O,每生成1molFe3O4被S2O32-还原的O2为0.5mol这个怎么理解啊
 再来三杯1年前1
再来三杯1年前1 -
 hkhjhy 共回答了15个问题
hkhjhy 共回答了15个问题 |采纳率80%每生成1mol四氧化三铁,就有两个二价铁离子被氧化成三价铁离子1年前查看全部
- (2012•唐山一模)水热法制备直径为1〜100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+a
(2012•唐山一模)水热法制备直径为1〜100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列说法中不正确的是( )
A.a=4
B.S2O32-中硫元素被氧化
C.将Y均匀分散到水中可制得胶体
D.Y物质中铁元素的化合价均为+3价 DSGBVJKDJKHJK1年前1
DSGBVJKDJKHJK1年前1 -
 Tiffanywt 共回答了14个问题
Tiffanywt 共回答了14个问题 |采纳率100%解题思路:从电荷守恒的角度分析,6-4-a=-2,所以a=4.可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Y+S4O62-+2H2O,根据铁元素和氧元素守恒,可知Y为Fe3O4,所以该离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O.
A、根据电荷守恒计算a的值;
B、所含元素化合价升高的反应物是还原剂;
C、直径为1~100nm的颗粒Y,均匀分散到水中形成的体系属于胶体;
D、根据电子守恒和元素守恒配平化学方程式确定元素的化合价.从电荷守恒的角度分析,6-4-a=-2,所以a=4.可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Y+S4O62-+2H2O,根据铁元素和氧元素守恒,可知Y为Fe3O4,所以该离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O.
A、从电荷守恒的角度分析,6-4-a=-2,所以a=4,故A正确;
B、S2O32-转化为S4O62-的过程中硫元素化合价升高,做还原剂被氧化,故B正确;
C、1~100nm的颗粒Y,微粒直径在胶体大小之内,将其均匀分散到水中形成的体系属于胶体,故C正确;
D、Fe3O4中铁元素的化合价既有+2价,又有+3价,故D错误.
故选:D.点评:
本题考点: 氧化还原反应;氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,题目难度中等,明确各元素的化合价变化是解答该题的关键.1年前查看全部
- 英语翻译在本文白色纳米棒被成功的通过水热法制备(并通过加热将之转化为了红色粉末).In this paper the w
英语翻译
在本文白色纳米棒被成功的通过水热法制备(并通过加热将之转化为了红色粉末).
In this paper the white nanorods were successfully synthesized by a hydrothermal approach_________________________________
翻译括号中的 大虫子重重1年前2
大虫子重重1年前2 -
 伤感toyota 共回答了23个问题
伤感toyota 共回答了23个问题 |采纳率87%and converted to red powder by heating1年前查看全部
- (2011•万州区一模)水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O6
(2011•万州区一模)水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O;下列说法中正确的是( )
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1mol O2参加反应,转移的电子总数为4mol 天之骄子01年前1
天之骄子01年前1 -
 三叶草的郁闷 共回答了16个问题
三叶草的郁闷 共回答了16个问题 |采纳率75%解题思路:氧化还原反应遵循电荷守恒、电子守恒以及原子守恒,从电荷守恒和原子守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化做还原剂,O2为氧化剂;化合价升高元素所在的反应物做氧化剂;A、S2O32-中的硫元素化合价升高,是还原剂,故A正确;
B、根据电荷守恒,方程式的左边带2个负电荷,所以右边的Y为电中性的,根据铁元素和氧元素守恒,可知Y为
Fe3O4,故B错误;
C、根据氢原子守恒可以知道a=4,故C正确;
D、反应中转的电子总数等于氧元素化合价降低的数目,氧气中的氧元素全部从0价降到-2价,
共得到1mol×2×(2-0)=4mol电子,故D正确.
故选ACD.点评:
本题考点: 氧化还原反应;氧化还原反应的计算.
考点点评: 本题主要考查学生氧化还原反应的有关知识,书写配平氧化还原反应的依据,电子转移的计算,难度较大.1年前查看全部
- (2014•闸北区一模)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+
(2014•闸北区一模)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O62-+2H2O
(1)上述离子方程式中x=______;
(2)每生成1mol Fe3O4,反应转移的电子为______mol. qcatherine1年前1
qcatherine1年前1 -
 虫二青山 共回答了15个问题
虫二青山 共回答了15个问题 |采纳率93.3%解题思路:(1)由电荷守恒可知,反应前后的电荷总数相等;
(2)Fe、S元素的化合价升高,O元素的化合价降低,由反应可知,该反应转移4e-.(1)由电荷守恒可知,反应前后的电荷总数相等,则3×(+2)+2×(-2)+x×(-1)=-2,
解得x=4,故答案为:4;
(2)Fe、S元素的化合价升高,O元素的化合价降低,由反应可知,该反应转移4e-,所以每生成1mol Fe3O4,由O元素的化合价变化可知,转移电子为1mol×2×[0-(-2)]=4mol,故答案为:4.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握电荷守恒和反应中元素的化合价变化为解答的关键,侧重学生分析能力和计算能力的考查,题目难度不大.1年前查看全部
- (2013•大连模拟)水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-═Y+S4O62-
(2013•大连模拟)水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列有关说法不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2O32-是还原剂
D.每32 g O2参加反应,转移电子的物质的量为4 mol hunanlinjun1年前1
hunanlinjun1年前1 -
 随风11 共回答了15个问题
随风11 共回答了15个问题 |采纳率86.7%解题思路:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O中,4个S原子中S的化合价由+2升高为+2.5,O元素的化合价由0降低为-2,利用质量守恒及电子守恒来分析.
A.根据电荷守恒计算a的值;
B.根据质量守恒定律判断;
C.S2O32-中的硫元素化合价升高,由+2升高为+2.5,是还原剂;
D.反应中只有氧气中氧元素的化合价降低,由0价降低为-2价,据此计算转移电子.A.Y为化合物,根据电荷守恒可知,6-4-a=4,故a=4,故A正确;
B.Y为化合物,根据质量守恒可知,则Y为Fe3O4,故B错误;
C.因S2O32-中S元素的化合价升高,由+2升高为+2.5,则S2O32-是还原剂,故C正确;
D.32gO2的物质的量为1mol,每有1molO2参加反应,转移的电子总数为1mol×2×(2-0)=4mol,故D正确;
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,元素的化合价判断是解答本题的关键,注意S元素的化合价是解答的难点,题目难度较大.1年前查看全部
- 热重的样品架被如何清理污染?做使用硝酸铈、柠檬酸和CTAB(十六烷基三甲基溴化铵)合成(水热法)的氧化铈的热重分析实验,
热重的样品架被如何清理污染?
做使用硝酸铈、柠檬酸和CTAB(十六烷基三甲基溴化铵)合成(水热法)的氧化铈的热重分析实验,结果样品架的外表面出现许多的黑色斑点,不知道是什么原因,样品架的黑色斑点能去除吗?使用1000度空烧空烧过了,不过 ... yxl_201年前1
yxl_201年前1 -
 萌萌14 共回答了21个问题
萌萌14 共回答了21个问题 |采纳率85.7%热重厂家写错了,支架用酒精泡一下,擦拭,如果下不来,建议你空烧4个小时温度1200℃以上,看你的设备温度了!如果还不行的话,问问厂家了! 查看原帖1年前查看全部
- 8.已知Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2
8.已知Fe3O4可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O +O2+4OH-=Fe3O4+S4O +2H2O,下列说法正确的是 ( )A.O2和S2O 是氧化剂,Fe2+是还原剂 A错在哪里?
 槟榔大哥哥1年前3
槟榔大哥哥1年前3 -
 古秋月下 共回答了15个问题
古秋月下 共回答了15个问题 |采纳率93.3%化学式未配平,电子没有平衡,氧也没有平衡
可能应该是这样吧:
3Fe2++2S2O +O2+4OH-=Fe3O4+(S4O2)2+ +2H2O
所以S2O 不是氧化剂,是还原剂,看氧气的和亚铁离子的电子转移就知道了1年前查看全部
- 水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62
水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列说法中不正确的是( )
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol
D.S2O32-是还原剂
为什么第二个是错误的 求详解! deji81年前1
deji81年前1 -
 flytyh 共回答了23个问题
flytyh 共回答了23个问题 |采纳率95.7%3Fe2+ + 2S2O32- + O2 + aOH- = Y + S4O62- + 2H2O
根据H元素守恒:a=4
根据①Fe和O元素守恒②电荷守恒③题意:Y为化合物可知:Y=3Fe+4O → Y=Fe3O4
3Fe2+ + 2S2O32- + O2 + 4OH- = Fe3O4 + S4O62- + 2H2O
A,a=4,正确
B,具有丁达尔效应是胶体特有的性质,分散系粒子粒子直径在1nm—100nm之间称为胶体,由题中所给信息“水热法制备直径为1~100nm的颗粒Y”,可知B正确
C,①O2 → 得到4e- → 2H2O
②2S2O32- → 失去2e- → S4O62- 3Fe2+ → 失去2e- → Fe3O4
可知每有3 mol Fe2+参加反应,反应中转移的电子总数为4mol
D,由②可知S2O32-是还原剂(反应中失电子化合价升高),正确
亲!不懂的问题追问我就好!1年前查看全部
- 水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O 3 2- +O 2 +xOH - ═Fe 3
水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O 3 2- +O 2 +xOH - ═Fe 3 O 4 +S 4 O 6 2- +2H 2 O,下列说法中,正确的是( ) A.x=2 B.参加反应的Fe 2+ 全部作还原剂 C.每生成1molFe 3 O 4 ,反应转移的电子总数为4mol D.1molFe 2+ 被氧化时,被Fe 2+ 还原的O 2 的物质的量为
mol1 3  有价值的认购1年前1
有价值的认购1年前1 -
 370715068 共回答了16个问题
370715068 共回答了16个问题 |采纳率93.8%A.反应的离子方程式为3Fe 2+ +2S 2 O 3 2- +O 2 +4OH - ═Fe 3 O 4 +S 4 O 6 2- +2H 2 O,则x=4,故A错误;
B.反应中3Fe 2+ →Fe 3 O 4 ,当3molFe 2+ 参加反应时,有2molFe 2+ 化合价升高,故B错误;
C.反应3Fe 2+ +2S 2 O 3 2- +O 2 +4OH - ═Fe 3 O 4 +S 4 O 6 2- +2H 2 O中,Fe和S元素的化合价升高,被氧化,O 2 为氧化剂,每生成1molFe 3 O 4 ,反应转移的电子总数为4mol,故C正确;
D.1molFe 2+ 被氧化时,失去1mol电子,则被Fe 2+ 还原的O 2 的物质的量为
1
4 mol,故D错误.
故选C.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32−+O2+xOH−═Fe3O4+S4O62−+2H2O.
水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32−+O2+xOH−═Fe3O4+S4O62−+2H2O.下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32-都是还原剂
C. x=2
D. 每生成1 mol Fe3O4,则转移电子数为3 mol xxvy88881年前1
xxvy88881年前1 -
 tt夏天001jay 共回答了21个问题
tt夏天001jay 共回答了21个问题 |采纳率85.7%解题思路:反应中Fe元素化合价升高,被氧化,S元素化合价升高,被氧化,反应中氧气为氧化剂,结合化合价的变化判断电子转移的数目,以此解答该题.A.反应中S和Fe元素化合价都升高,被氧化,故A错误;
B.S和Fe元素化合价都升高,被氧化,则Fe2+、S2O32-都是还原剂,故B正确;
C.由离子方程式的电荷守恒可知x=4,故C错误;
D.每生成1 mol Fe3O4,有1mol O2参加反应,则转移电子数为4 mol,故D错误.
故选:B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,侧重于学生的分析能力和计算能力的考查,明确元素化合价的变化为解答该题的关键,难度不大.1年前查看全部
- 硬脂酸锌的水热法合成工艺是什么?
 54ing1年前1
54ing1年前1 -
 19810329 共回答了12个问题
19810329 共回答了12个问题 |采纳率100%水热法是液相制备超细颗粒的方法.该法采用高压釜作为反应容器,在一定的温度和高压下实现从原子级到分子级的微粒构筑及生长.水热法合成硬脂酸锌的基本过程是:在高压釜中加入适量水,启动搅拌,加入化学计量的硬脂酸、氧化锌,冲入氮气,保持一定的压力,加热升温到一定温度后恒温反应一段时间,反应产物经分离釜脱水,滤饼经干燥、粉碎即得到产品.
水热法工艺过程简单,无副产品产生,介质水及余热可回收循环利用,实现了高质量硬脂酸锌的无污染合成,但是又带来设备提升问题.
目前采用一步法生产硬脂酸锌是主流,工艺更简单,更加环保,硬脂酸锌首推东莞汉维.1年前查看全部
- 水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O 3 2- +O 2 +xOH - ==Fe 3
水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O 3 2- +O 2 +xOH - ==Fe 3 O 4 +S 4 O 6 2- +2H 2 O,下列说法中,正确的是 [ ]A.x=2
B.参加反应的Fe 2+ 全部做还原剂
C.每生成1mol Fe 3 O 4 ,反应转移的电子总数为4mol
D.1mol Fe 2+ 被氧化时,被Fe 2+ 还原的O 2 的物质的量为1/3mol thresholdsw1年前1
thresholdsw1年前1 -
 Feebeebee 共回答了17个问题
Feebeebee 共回答了17个问题 |采纳率94.1%C1年前查看全部
- 水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O 2-3 +O 2 +xOH -
水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O
+O 2 +xOH - ═Fe 3 O 4 +S 4 O2-3
+2H 2 O下列说法中,正确的是( )2-6 A.每生成1mol Fe 3 O 4 ,反应转移的电子总数为3mol B.Fe 2+ 和S 2 O
都是还原剂2-3 C.1mol Fe 2+ 被氧化时,被Fe 2+ 还原的O 2 的物质的量为
mol1 4 D.x=6  玉娇龙tjf1年前1
玉娇龙tjf1年前1 -
 无_声 共回答了25个问题
无_声 共回答了25个问题 |采纳率96%A.反应3Fe 2+ +2S 2 O 3 2- +O 2 +4OH - ═Fe 3 O 4 +S 4 O 6 2- +2H 2 O中,Fe和S元素的化合价升高,被氧化,O 2 为氧化剂,每生成1molFe 3 O 4 ,反应转移的电子总数为4mol,故A错误;
B.反应中3Fe 2+ →Fe 3 O 4 ,当3molFe 2+ 参加反应时,有2molFe 2+ 化合价升高,所以只有
2
3 的Fe 2+ 作还原剂,故B错误;
C.1molFe 2+ 被氧化时,失去1mol电子,则被Fe 2+ 还原的O 2 的物质的量为
1
4 mol,故C正确.
D.反应的离子方程式为3Fe 2+ +2S 2 O 3 2- +O 2 +4OH - ═Fe 3 O 4 +S 4 O 6 2- +2H 2 O,则x=4,故D错误;
故选C.1年前查看全部
- 已知Fe 3 O 4 可表示成(FeO· Fe 2 O 3 ),水热法制备Fe 3 O 4 纳米颗粒的总反应为:
已知Fe 3 O 4 可表示成(FeO· Fe 2 O 3 ),水热法制备Fe 3 O 4 纳米颗粒的总反应为:
3Fe 2+ +2S 2 O 3 2- +O 2 +4OH - = Fe 3 O 4 +S 4 O 6 2- +2H 2 O 下列说法不正确的是()A.O 2 是氧化剂,S 2 O 3 2- 、Fe 2+ 是还原剂 B.当有1 mol Fe 3 O 4 生成时共转移的电子为4mol C.若有3mol Fe 2+ 参加反应,则被Fe 2+ 还原的O 2 为1mol D.若有2mol Fe 2+ 被氧化,则被Fe 2+ 还原的O 2 为0.5mol  lvfangge1年前1
lvfangge1年前1 -
 aling0428 共回答了22个问题
aling0428 共回答了22个问题 |采纳率81.8%C
1年前查看全部
- (2007•深圳二模)水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O
(2007•深圳二模)水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列说法中,正确的是( )
A.每生成1molFe3O4,反应转移的电子总数为4mol
B.Fe2+和S2O32-都是还原剂
C.1molFe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol
D.x=2 nonota1年前1
nonota1年前1 -
 小欧飞雁 共回答了24个问题
小欧飞雁 共回答了24个问题 |采纳率95.8%解题思路:从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,Fe2+、S2O32-是还原剂、O2为氧化剂,结合电子转移守恒计算解答.A.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,需要氧气1mol,反应转移的电子总数为4mol,故A正确;
B.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,Fe2+和S2O32-都是还原剂,故B正确;
C.1molFe2+被氧化时,失去1mol电子,根据电子转移守恒,则被Fe2+还原的O2的物质的量为[1/4]mol,故C错误;
D.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故D错误.
故选AB.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应计算、基本概念及配平等,题目难度中等,明确各元素的化合价变化是解答该题的关键.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法中,正确的是( )
A. 每生成1mol Fe3O4,反应转移的电子总数为2mol
B. Fe2+和S2O32-都是还原剂
C. 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol
D. x=2 leilei蕾蕾1年前1
leilei蕾蕾1年前1 -
 牙疼妹妹吧 共回答了15个问题
牙疼妹妹吧 共回答了15个问题 |采纳率93.3%解题思路:A.反应中只有氧气的元素化合价降低,根据方程式计算生成1mol Fe3O4,需要消耗氧气的物质的量,再结合氧元素化合价变化计算转移电子数目;
B.S2O32-中S由+2价升高为S4O62-中+2.5价,Fe3O4中两个铁为+3价,一个铁为+2价,Fe2+被氧化;
C.Fe2+被氧化时,提供1 mol电子,根据电子转移守恒计算被Fe2+还原的O2的物质的量;
D.根据电荷守恒可确定x的值.A.在反应中每生成1molFe3O4同时消耗1mol O2,反应中只有氧气的元素化合价降低,由0价降低为-2价,所以转移的电子数为1mol×4=4 mol,故A错误;
B.S2O32-中S由+2价升高为S4O62-中+2.5价,S2O32-是还原剂.Fe3O4中两个铁为+3价,一个铁为+2价,Fe2+被氧化,Fe2+是还原剂,故B正确;
C.Fe2+被氧化时,提供1 mol电子,氧元素由0价降低为-2价,所以被Fe2+还原的O2的物质的量为[1/4]mol,故C错误;
D.根据电荷守恒可确定x的值,3×2-4-x=-2,x=4,故D错误;
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应基本概念、计算与配平等,题目难度中等,明确各元素的化合价变化是解答该题的关键,本题注意根据电荷守恒可确定x的值.1年前查看全部
- 我在水热法制备二氧化钛纳米管时,待反应结束后在高压釜内得到坚硬沉淀,并且很难移出,请问为什么?二氧化钛纳米管应该是什么状
我在水热法制备二氧化钛纳米管时,待反应结束后在高压釜内得到坚硬沉淀,并且很难移出,请问为什么?二氧化钛纳米管应该是什么状态的,本人药品用量tio2是3g,氢氧化钠10M的30ml,
 草修1年前1
草修1年前1 -
 锦oo程 共回答了19个问题
锦oo程 共回答了19个问题 |采纳率94.7%你用的量太大!尝试50-100mg之间.应当是粉体,就算是有结块也不会很硬的.
我知道这样产量会很小,但是做实验也不用那么大的量.经验告诉我量越小越是好东西.1年前查看全部
- (2013•信阳二模)水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32−+O2+xOH−=Fe3O4+S4O
(2013•信阳二模)水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32−+O2+xOH−=Fe3O4+S4O62−+2H2O
下列说法正确的是( )
A.将纳米Fe3O4颗粒分散在水中没有丁达尔现象
B.将纳米Fe3O4颗粒分散在水中,Fe3O4不能透过滤纸
C.每生成1molFe3O4,反应转移的电子为4mol
D.反应物OH-的化学计量数x=2 长天一啸1年前1
长天一啸1年前1 -
 8618535 共回答了17个问题
8618535 共回答了17个问题 |采纳率94.1%解题思路:A.胶体是指分散质粒子直径在1 nm~100 nm之间的分散系;
B.将纳米Fe3O4颗粒分散在水中得到的分散系是胶体;
C.每生成1molFe3O4,则转移电子数为4mol;
D.根据氢原子守恒得x值.A.将纳米Fe3O4颗粒分散在水中得到的分散系是胶体,有丁达尔效应,故A错误;
B.将纳米Fe3O4颗粒分散在水中得到的分散系是胶体,故B错误;
C.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故C正确;
D.根据氢原子守恒,水的化学计量数为2,则OH-的化学计量数为4,即x=4,故D错误.
故选C.点评:
本题考点: 纳米材料.
考点点评: 本题考查胶体的性质,难度中等,明确各元素的化合价变化是解答该题的关键.1年前查看全部
- (2012•天津模拟)水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62
(2012•天津模拟)水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O下列说法中,不正确的是 ( )
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1molO2参加反应,转移的电子总数为4mol. 落叶归根啊1年前1
落叶归根啊1年前1 -
 无奈的园丁 共回答了15个问题
无奈的园丁 共回答了15个问题 |采纳率93.3%解题思路:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O中,4个S原子中S的化合价由+2升高为+2.5,O元素的化合价由0降低为-2,利用质量守恒及电子守恒来分析.A.因S元素的化合价升高,则S2O32-是还原剂,故A正确;
B.根据质量守恒可知,Y为化合物,反应前后的原子个数相等,则Y为Fe2O3,故B正确;
C.根据电荷守恒可知,a=4,故C正确;
D.每有1molO2参加反应,转移的电子总数为1mol×2×(2-0)×NA=4NA,故D错误;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,元素的化合价判断是解答本题的关键,注意S元素的化合价是解答的难点,题目难度较大.1年前查看全部
- 请问有没有详细介绍水热法合成纳米粉体的书
请问有没有详细介绍水热法合成纳米粉体的书
希望内容包括水热法合成纳米粉体的机理,粉体生长机理这些内容, 雪花落在水面上1年前1
雪花落在水面上1年前1 -
 弦来无曲 共回答了15个问题
弦来无曲 共回答了15个问题 |采纳率80%水热法合成纳米粉体:好像文献有一些,出书还没发现过,不过好久没关注这个问题了
粉体生长机理:应该有书介绍,普通的都是介绍气/固、液(高温)/固、固/固界面反应等生长机理的,也有一些涉及纳米尺度粉体的内容,水热法的还没见过出书.1年前查看全部
- 在用水热法制备纳米材料时,为保护高能面而添加一些盖帽剂,请问哪位高人知道盖帽剂的作用?
 cc撑着1年前1
cc撑着1年前1 -
 风同狂2 共回答了27个问题
风同狂2 共回答了27个问题 |采纳率92.6%capping reagent,的作用起源于,他会对某些晶面有选择性吸附作用.由于他的吸附造成了特殊晶面的比表面降低,生长缓慢.从而起到了调控纳米晶体形状的作用.
capping reagent类型很多了.表面活性剂,一些有机小分子等.至于一个体系里面,用什么作为盖剂,什么时候起到作用,谁也说不清楚,必须做实验.因为不同体系里,不同分子对晶面的选择吸附是不同的.多查文献看吧.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法中,正确的是( )
A.每生成1mol Fe3O4,反应转移的电子总数为2mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol
D.x=2 丌韵1年前1
丌韵1年前1 -
 充档 共回答了27个问题
充档 共回答了27个问题 |采纳率92.6%解题思路:A.反应中只有氧气的元素化合价降低,根据方程式计算生成1mol Fe3O4,需要消耗氧气的物质的量,再结合氧元素化合价变化计算转移电子数目;
B.S2O32-中S由+2价升高为S4O62-中+2.5价,Fe3O4中两个铁为+3价,一个铁为+2价,Fe2+被氧化;
C.Fe2+被氧化时,提供1 mol电子,根据电子转移守恒计算被Fe2+还原的O2的物质的量;
D.根据电荷守恒可确定x的值.A.在反应中每生成1molFe3O4同时消耗1mol O2,反应中只有氧气的元素化合价降低,由0价降低为-2价,所以转移的电子数为1mol×4=4 mol,故A错误;
B.S2O32-中S由+2价升高为S4O62-中+2.5价,S2O32-是还原剂.Fe3O4中两个铁为+3价,一个铁为+2价,Fe2+被氧化,Fe2+是还原剂,故B正确;
C.Fe2+被氧化时,提供1 mol电子,氧元素由0价降低为-2价,所以被Fe2+还原的O2的物质的量为[1/4]mol,故C错误;
D.根据电荷守恒可确定x的值,3×2-4-x=-2,x=4,故D错误;
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应基本概念、计算与配平等,题目难度中等,明确各元素的化合价变化是解答该题的关键,本题注意根据电荷守恒可确定x的值.1年前查看全部
- 水热法制备纳米氧化锌,氢氧化钠浓度过高有什么影响?
 美丽奴羊1年前1
美丽奴羊1年前1 -
 robin434343 共回答了14个问题
robin434343 共回答了14个问题 |采纳率100%氧化锌(氢氧化锌)会溶解的1年前查看全部
- 水热法制备Fe(FeO 2 ) 2 纳米颗粒的反应为3Fe 2+ +2S 2 O 3 2- +O 2 +xOH - =F
水热法制备Fe(FeO 2 ) 2 纳米颗粒的反应为3Fe 2+ +2S 2 O 3 2- +O 2 +xOH - =Fe(FeO 2 ) 2 +S 4 O 6 2- +2H 2 O.下列说法中,不正确的是( ) A.每生成1molFe 3 O 4 转移4mol电子 B.该反应中Fe 2+ 和S 2 O 3 2- 都是还原剂 C.3molFe 2+ 被氧化时有1molO 2 被还原 D.反应方程式中化学计量数x=4  xiuyanlei1年前1
xiuyanlei1年前1 -
 流水潺潺123 共回答了17个问题
流水潺潺123 共回答了17个问题 |采纳率94.1%A、因氧化还原反应中得电子数=失电子数=转移的电子总数,则生成1molFe 3 O 4 时1molO 2 参加反应,转移的电子数为1×2×2=4mol电子,故A说法正确;
B、因该反应中铁由+2价升高到+3价,硫由+2价升高到+2.5价,则该反应中Fe 2+ 和S 2 O 3 2- 都是还原剂,故B说法正确;
C、3molFe 2+ 参加反应时只有2mol被氧化,此时该反应中1molO 2 被还原,故C说法不正确;
D、由电荷守恒可知,(+2)×3+(-2)×2+x×(-1)=-2,则x=4,故D说法正确;
故选C.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下
水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列说法中,正确的是( )
A.Fe2+和S2O32-都是还原剂
B.x=6
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol
D.每生成1mol Fe3O4,反应转移的电子总数为3mol guoyanghappy1年前1
guoyanghappy1年前1 -
 lyxq0515 共回答了13个问题
lyxq0515 共回答了13个问题 |采纳率61.5%解题思路:由电荷守恒可知,(+2)×3+(-2)×2+x×(-1)=-2,解得x=4,反应中Fe元素的化合价升高,S元素的化合价升高,O元素的化合价降低,以此来解答.A.Fe、S元素的化合价升高,则Fe2+和S2O32-都是还原剂,故A正确;
B.由电荷守恒可知,x=4,故B错误;
C.由电子守恒可知,1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
1mol×(3−2)
2×(2−0)=[1/4]mol,故C错误;
D.每生成1mol Fe3O4,只有1mol氧气得到电子,则反应转移的电子总数为1mol×2×(2-0)=4mol,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒、电荷守恒分析与应用,题目难度不大.1年前查看全部
- 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列说法中,正确的是( )
A.x=2
B.参加反应的Fe2+全部作还原剂
C.每生成1molFe3O4,反应转移的电子总数为4mol
D.1molFe2+被氧化时,被Fe2+还原的O2的物质的量为[1/3]mol THEKAEN1年前1
THEKAEN1年前1 -
 evan_sun 共回答了19个问题
evan_sun 共回答了19个问题 |采纳率89.5%解题思路:从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,
反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.A.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故A错误;
B.反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,故B错误;
C.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故C正确;
D.1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为[1/4]mol,故D错误.
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,明确各元素的化合价变化是解答该题的关键.1年前查看全部
- 哪里有用水热法制备氯氧化铋的方法啊.
哪里有用水热法制备氯氧化铋的方法啊.
具体的实验步骤,做实验用
毕业实验.所有文献都找了都没用啊.有个Bi(NO3)3 5H2O缓慢加入到乙二醇溶液,包含化学计量比的KCL,KI,NABR.混合物室温下搅拌0.5小时,导入到25ml的高压釜.高压釜加热到160度,12小时,然后空气冷却到室温.用酒精和水收集和洗涤沉淀物,在50度下干燥.这个是不行的.还有没别的方法 半颗心and一滴泪1年前1
半颗心and一滴泪1年前1 -
 玄玄佳佳 共回答了22个问题
玄玄佳佳 共回答了22个问题 |采纳率81.8%制备方法:由水杨酸与氢氧化铋缩合而得.先将硝酸铋加水搅拌乳化,加30%氨水水解为氢氧化铋,过滤,水洗后与水杨酸缩合反应,将生成的次水杨酸铋滤出,用501年前查看全部
- 水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O下列说法中
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O下列说法中,不正确的是 ( )
A. S2O32-是还原剂
B. Y的化学式为Fe2O3
C. a=4
D. 每有1molO2参加反应,转移的电子总数为4mol. bsbxs33331年前1
bsbxs33331年前1 -
 95279527520 共回答了20个问题
95279527520 共回答了20个问题 |采纳率95%解题思路:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O中,4个S原子中S的化合价由+2升高为+2.5,O元素的化合价由0降低为-2,利用质量守恒及电子守恒来分析.A.因S元素的化合价升高,则S2O32-是还原剂,故A正确;
B.根据质量守恒可知,Y为化合物,反应前后的原子个数相等,则Y为Fe2O3,故B正确;
C.根据电荷守恒可知,a=4,故C正确;
D.每有1molO2参加反应,转移的电子总数为1mol×2×(2-0)×NA=4NA,故D错误;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,元素的化合价判断是解答本题的关键,注意S元素的化合价是解答的难点,题目难度较大.1年前查看全部
- 水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O +O 2 +xOH —
水热法制备Fe 3 O 4 纳米颗粒的反应是3Fe 2+ +2S 2 O
 +O 2 +xOH —
+O 2 +xOH — 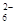 +2H 2 O,
+2H 2 O,
下列说法中,正确的是()A.每生成1mol Fe 3 O 4 ,反应转移的电子总数为3mol ; B.x="6" C.1mol Fe 2+ 被氧化时,被Fe 2+ 还原的O 2 的物质的量为1/3mol; D.Fe 2+ 和S 2 O 3 2—- 都是还原剂;  蔡一贫1年前1
蔡一贫1年前1 -
 看客流痕 共回答了17个问题
看客流痕 共回答了17个问题 |采纳率82.4%D
1年前查看全部
大家在问
- 1正方形AEFG的边AE AG分别在正方形ABCD的边AB AD上,O为正方形AEFG的中心,M为BE中点
- 21.the clothes____(wash) yesterday ,they____ (wash) easily.2.
- 3把手指贴在玻璃镜面上,手指与它的像相距8cm,则镜子厚度为
- 4在抗击“非典”和“禽流感”的战斗中,医务人员工作时所采取的措施或用到的器械,许多都利用了物理知识,下列说法错误的是(
- 5分别把每组中的两个数化为分母相同的假分数 五分之二和5 8的四又三分之一
- 6Perhaps May be Maybe probable的用法
- 7Dear Abby,
- 8写作. 全球气候变暖已经成了一个全世界关注的问题,它已经 严重威胁到了
- 9从2 3 4 5 6 7 8选择三个数,用两个数除以一个数,使商末尾有0
- 10昆虫有哪些特征
- 11跪求大工11春道桥施工2,
- 12急!六下语文18课课堂作业本答案
- 13这个 为什么是选AC啊
- 14混凝土配合比计算题由初步计算配合比经试拌调整后,求基准配合比.先称取以下材料进行试拌:42.5级普通水泥10.0kg,中
- 15已知a,b,c是正实数 且a+b+c=1.求证:a^2+b^2+c^2大于等于1/3
