将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
 vivachenbo2022-10-04 11:39:541条回答
vivachenbo2022-10-04 11:39:541条回答A.c(HCN)<c(CN-)
B.c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-)
D.c(HCN)+c(CN-)=0.1 mol•L-1

已提交,审核后显示!提交回复
共1条回复
 lilin007 共回答了11个问题
lilin007 共回答了11个问题 |采纳率90.9%- 解题思路:将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明
CN-水解程度大于HCN电离程度,以此解答该题.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明CN-水解程度大于HCN电离程度,则
A.等浓度的CN-水解程度大于HCN电离程度,则c(HCN)>c(CN-),故A错误;
B.溶液显碱性,则c(OH-)>c(H+),根据c(Na+)+c(H+)=c(CN-)+c(OH-)可知,c(Na+)>c(CN-),故B正确;
C.根据物料守恒可知,c(HCN)+c(CN-)=2c(Na+),根据电荷守恒可知c(Na+)+c(H+)=c(CN-)+c(OH-),二者联式可得:c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C错误;
D.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,c(HCN)+c(CN-)=0.1mol•L-1,故D正确.
故选BD.点评:
本题考点: 离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,溶液显碱性,说明CN-水解程度大于HCN电离程度,结合电荷守恒和物料守恒解答. - 1年前
相关推荐
- 将10ml 0.1mol•L-1氨水与10ml 0.2mol•L-1盐酸混合后,溶液中各种离子的
将10ml 0.1mol•L-1氨水与10ml 0.2mol•L-1盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是( )
A.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.c(H+)>c(CL-)>c(NH4+>c(OH-) glory_6101年前3
glory_6101年前3 -
 楚膺1 共回答了22个问题
楚膺1 共回答了22个问题 |采纳率77.3%选A
n(NH3·H2O)=0.1mol/L*0.01L=0.001mol
n(Cl^-)=n(HCl)=0.2mol/L*0.01L=0.002mol
NH3·H2O + HCl = NH4Cl+H2O
0.001mol 0.001mol 0.001mol
NH4^++H2O﹤=﹥NH3·H2O+H^+
n(NH4Cl)=n(HCl)剩余=0.001mol
但铵根离子水解,使溶液中C(H^+)>C(NH4^+)
所以选Ac(Cl-)>c(H+)>c(NH4+)>c(OH-)1年前查看全部
- 温度相同,浓度均为0.2mol•L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3C
温度相同,浓度均为0.2mol•L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤
B.①③⑤④②
C.③②①⑤④
D.⑤②④①③ dfxx1年前1
dfxx1年前1 -
 燕子的燕 共回答了17个问题
燕子的燕 共回答了17个问题 |采纳率94.1%解题思路:根据盐类水解的酸碱性和水解程度比较.①(NH4)2SO4、④NH4NO3水解呈酸性,pH<7;③NH4HSO4电离出H+呈酸性,pH<7;②NaNO3不水解,pH=7;⑤CH3COONa水解呈碱性,pH>7,①、④比较,前者c(NH4+)大,水解生成c(H+)大,pH小,①③比较,后者电离出c(H+)比前者水解出c(H+)大,pH小,所以③①④②⑤,故选A.
点评:
本题考点: 弱电解质在水溶液中的电离平衡;盐类水解的应用.
考点点评: 本题考查溶液PH的大小比较,题目难度不大,要考虑盐类的水解程度大小,注意硫酸氢铵中硫酸氢根离子电离出氢离子.1年前查看全部
- 现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4来配制500mL 0.2mol•L-1的稀H2S
现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4来配制500mL 0.2mol•L-1的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙⑤量筒 ⑥容量瓶 ⑦托盘天平.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有______(填代号).配制时还欠缺的仪器是______.
(2)经计算,需浓H2SO4的体积为______mL(精确到0.1).
(3)配制过程有以下操作:
A.移液B.量取C.洗涤D.定容E.溶解F.摇匀
其正确的操作顺序应是______ (填序号).
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有______(填代号).
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线.请问所得溶液中c(H+)=______.
(6)某研究小组欲利用氯气和二氧化硫通入水溶液中来制备100mL含0.4molH+的溶液,反应原理:Cl2+SO2+2H2O=H2SO4+2HCl,若忽略制备过程中气体的损耗,请问需标准状况下的氯气______L. sdghsfhdfgjgfjk1年前1
sdghsfhdfgjgfjk1年前1 -
 suqier119 共回答了15个问题
suqier119 共回答了15个问题 |采纳率93.3%解题思路:(1)根据配制500mL、0.2mol•L-1的稀H2SO4的步骤选择使用的仪器,然后判断不需要的仪器;
(2)根据c=[1000ρw/M]计算出浓硫酸的物质的量浓度,然后根据溶液稀释过程中溶质的物质的量不变计算出浓硫酸的体积;
(3)根据溶液配制,一般可分为以下步骤:计算、称量、溶解或稀释、冷却、转移、洗涤、定容、摇匀据此进行排序;
(4)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)稀释前后氢离子物质的量保持不变;
(6)根据Cl2+SO2+2H2O=H2SO4+2HCl解题.(1)配制500mL、0.2mol•L-1的稀H2SO4的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要选用的仪器为:量筒、烧杯、玻璃棒、容量瓶、胶头滴管、500mL容量瓶等,不需要的仪器为:②烧瓶、④药匙、...
点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- 将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
A. c(HCN)<c(CN-)
B. c(Na+)>c(CN-)
C. c(HCN)-c(CN-)=c(OH-)
D. c(HCN)+c(CN-)=0.1 mol•L-1 霉菜扣肉1年前1
霉菜扣肉1年前1 -
 zilong_32 共回答了20个问题
zilong_32 共回答了20个问题 |采纳率100%解题思路:将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明
CN-水解程度大于HCN电离程度,以此解答该题.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明CN-水解程度大于HCN电离程度,则
A.等浓度的CN-水解程度大于HCN电离程度,则c(HCN)>c(CN-),故A错误;
B.溶液显碱性,则c(OH-)>c(H+),根据c(Na+)+c(H+)=c(CN-)+c(OH-)可知,c(Na+)>c(CN-),故B正确;
C.根据物料守恒可知,c(HCN)+c(CN-)=2c(Na+),根据电荷守恒可知c(Na+)+c(H+)=c(CN-)+c(OH-),二者联式可得:c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C错误;
D.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,c(HCN)+c(CN-)=0.1mol•L-1,故D正确.
故选BD.点评:
本题考点: 离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,溶液显碱性,说明CN-水解程度大于HCN电离程度,结合电荷守恒和物料守恒解答.1年前查看全部
- 实验室要配制100mL 0.2mol•L-1 Na2CO3溶液.请回答下列问题.
实验室要配制100mL 0.2mol•L-1 Na2CO3溶液.请回答下列问题.
(1)用托盘天平称取无水碳酸钠固体的质量为______ g.
(2)需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和______.
(3)下列操作中,可能造成所配制溶液的浓度偏低的是______(填序号).
①碳酸钠固体未充分干燥②称量时左盘放砝码③转移溶液时有少量滴洒. pantiantian1年前1
pantiantian1年前1 -
 yq1206 共回答了17个问题
yq1206 共回答了17个问题 |采纳率94.1%解题思路:(1)根据m=cVM计算需要碳酸钠的质量.
(2)根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签以及每步操作需要仪器确定反应所需仪器.
(3)分析操作对溶质的物质的量、溶液体积的影响,根据c=[n/V]分析操作对所配溶液浓度的影响.(1)实验室配制1mol/L的Na2CO3溶液100mL需要Na2CO3的质量为:0.1L×0.2mol/L×106g/mol=2.1g.
故答案为:2.1g.
(2)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.
所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管.
所以还需要用的玻璃仪器为:100mL容量瓶.
故答案为:100mL容量瓶.
(3)①碳酸钠固体未充分干燥,实际称取的碳酸钠的质量偏小,所配溶液的浓度偏低;
②称量时左盘放砝码,由于使用游码,实际称量的碳酸钠的质量为1.9g,称取的碳酸钠的质量偏小,所配溶液的浓度偏低;
③转移溶液时有少量滴洒,移入容量瓶内碳酸钠的物质的量减少,所配溶液的浓度偏低.
故选:①②③.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制的计算、步骤以及仪器、误差分析等,难度不大,根据c=[n/V]理解溶液的配制与误差分析.1年前查看全部
- 设N A 为阿伏加德罗常数的值,下列关于2L0.2mol•L -1 的Ba(NO 3 ) 2 溶液的说法不正确的是(
设N A 为阿伏加德罗常数的值,下列关于2L0.2mol•L -1 的Ba(NO 3 ) 2 溶液的说法不正确的是( )
①溶液中的阴、阳离子总数为0.8N A
②取0.5L溶液则其中NO 3 - 的浓度为0.1mol•L -1
③取0.5L溶液则其中Ba 2+ 的浓度为0.2mol•L -1
④取0.5L溶液则其中NO 3 - 的总数为0.2N A .A.①② B.③④ C.①④ D.②④  bobolaw1年前1
bobolaw1年前1 -
 jjp520 共回答了15个问题
jjp520 共回答了15个问题 |采纳率80%①2L 0.2mol•L -1 的Ba(NO 3 ) 2 溶液中,含有0.4mol硝酸钡,含有0.4mol钡离子、0.8mol硝酸根离子,阴、阳离子的总物质的量为1.2mol,总数为1.2N A ,故①错误;
②溶液的浓度与溶液的体积无关,所以0.5L溶液中NO 3 - 的浓度为0.2mol•L -1 ,故②错误;
③根据②的计算可知,取0.5L溶液则其中Ba 2+ 的浓度为0.2mol•L -1 ,故③正确;
④0.5L溶液中含有0.1mol硝酸钡,含有0.2mol硝酸根离子,NO 3 - 的总数为0.2N A ,故④正确;
故选:B.1年前查看全部
- 设NA为阿伏加德罗常数,下列关于0.2mol•L-1硝酸钡溶液的说法不正确的是( )
设NA为阿伏加德罗常数,下列关于0.2mol•L-1硝酸钡溶液的说法不正确的是( )
A.1L溶液中所含阴阳离子总数是0.6NA
B.1L溶液中含有0.2NA个NO3-
C.500mL溶液中含有0.2NA个NO3-
D.500mL溶液中Ba2+浓度为0.2mol•L-1 江上一飞鸥1年前1
江上一飞鸥1年前1 -
 zjwxy 共回答了22个问题
zjwxy 共回答了22个问题 |采纳率86.4%解题思路:1L0.2mol•L-1硝酸钡溶液含0.2molBa(NO3)2,一个Ba(NO3)2中有2个NO3-,阴阳离子总数为3.A、1L0.2mol•L-1硝酸钡溶液含0.2molBa(NO3)2,一个Ba(NO3)2中阴阳离子总数为3,0.2molBa(NO3)2中所含阴阳离子总数是0.6NA,故A正确;B、一个Ba(NO3)2中有2个NO3-,1L0.2mol•L-1硝酸钡溶液含0.4NA个NO3-,...
点评:
本题考点: 阿伏加德罗常数;物质的量的相关计算.
考点点评: 500mL0.2mol•L-1硝酸钡溶液中Ba2+浓度仍为0.2mol•L-1,与体积无关,本题易错选D.1年前查看全部
- 常温下,0.2mol•L-1的盐酸30mL分别与下列Na2CO3溶液混合,再加水稀释到100mL,其中最初产生CO2的速
常温下,0.2mol•L-1的盐酸30mL分别与下列Na2CO3溶液混合,再加水稀释到100mL,其中最初产生CO2的速率最快的是( )
A.20mL 0.3mol•L-1 Na2CO3
B.10mL 0.4mol•L-1 Na2CO3
C.25mL 0.4mol•L-1 Na2CO3
D.15mL 0.5mol•L-1 Na2CO3 andy10141年前1
andy10141年前1 -
 sesr88 共回答了30个问题
sesr88 共回答了30个问题 |采纳率96.7%解题思路:都加水稀释至100mL,后来溶液的体积相同,则选项中物质的物质的量最大的,其和混合后浓度最大,反应速率最快,以此来解答.都加水稀释至100mL,后来溶液的体积相同,则选项中物质的物质的量最大的,其和混合后浓度最大,反应速率最快,
A.碳酸钠的物质的量:0.02L×0.3mol/L=0.006mol
B.碳酸钠的物质的量:0.01L×0.4mol/L=0.004mol
C.碳酸钠的物质的量:0.025L×0.4mol/L=0.01mol
D.碳酸钠的物质的量:0.015L×0.5mol/L=0.0075mol
显然C中碳酸钠物质的量最大,反应速率最快,
故选C.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响化学反应速率的因素,为高频考点,把握后来溶液体积相同计算选项中物质的量为解答的关键,侧重分析能力的考查,题目难度不大.1年前查看全部
- 现有0.1mol•L-1的Na2SO4和0.2moL•L-1的H2SO4混合溶液l00mL,向其中逐滴加入0.2moL•
现有0.1mol•L-1的Na2SO4和0.2moL•L-1的H2SO4混合溶液l00mL,向其中逐滴加入0.2moL•L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行.
(1)当加入100mLBa(OH)2溶液时,所得溶液中的溶质是______(写化学式),其质量为______
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为______mL,所得溶液中溶质为______(写化学式),则该溶质物质的量浓度为______mol•L-1 (最后一步计算要写出计算过程.溶液混合后,体积可以加和) 五月小文1年前1
五月小文1年前1 -
 老槐树茶吧 共回答了14个问题
老槐树茶吧 共回答了14个问题 |采纳率78.6%解题思路:(1)反应相当于Ba(OH)2先与H2SO4反应,然后再Na2SO4与反应,100mLBa(OH)2溶液中n[Ba(OH)2]=0.1L×0.2moL•L-1=0.02mol,100mL溶液中n(H2SO4)=0.1L×0.2moL•L-1=0.02mol,故氢氧化钡与硫酸恰好反应,硫酸钠不反应,根据n=cV计算硫酸钠的物质的量,再根据m=nM计算硫酸钠的质量;
(2)溶液中沉淀量达到最大时,发生Ba2++SO42-=BaSO4↓,故n[Ba(OH)2]=n(SO42-),再根据V=[n/c]计算氢氧化钡的体积.溶液中溶质为NaOH,根据钠离子守恒可知n(NaOH)=n(Na+),再根据c=[n/V]计算.(1)反应相当于Ba(OH)2先与H2SO4反应,然后再Na2SO4与反应,100mLBa(OH)2溶液中n[Ba(OH)2]=0.1L×0.2moL•L-1=0.02mol,100mL溶液中n(H2SO4)=0.1L×0.2moL•L-1=0.02mol,故氢氧化钡与硫酸恰好反应,硫酸钠不反应,溶液中溶质为Na2SO4,Na2SO4的物质的量为0.1L×0.1moL•L-1=0.01mol,Na2SO4的质量为0.01mol×142g/moL=1.42g,
故答案为:Na2SO4;1.42g;
(2)溶液中沉淀量达到最大时,硫酸根完全反应,发生Ba2++SO42-=BaSO4↓,故n[Ba(OH)2]=n(SO42-)=0.02mol+0.01mol=0.03mol,故氢氧化钡溶液的体积为[0.03mol/0.2mol/L]=0.15L=150mL.
此时溶液中溶质为NaOH,根据钠离子守恒可知n(NaOH)=n(Na+)=0.01mol×2=0.02mol,故溶液中NaOH浓度为[0.02mol/0.25L]=0.08mol/L,
故答案为:150;NaOH;0.08.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算、常用化学计量的有关计算等,难度不大,理解发生反应的本质是解题的关键.1年前查看全部
- 用 NA表示阿伏伽德罗常数,下列关于0.2mol•L-1K2SO4溶液说法正确的是( )
用 NA表示阿伏伽德罗常数,下列关于0.2mol•L-1K2SO4溶液说法正确的是( )
A.1L溶液中K+浓度是0.4mol•L-1
B.500mL溶液中含有0.1NA个K+
C.1L溶液中所含K+和SO42-总数为0.3NA
D.2L溶液中SO42-浓度 为0.4mol•L-1 baijian871年前1
baijian871年前1 -
 甜缘115 共回答了20个问题
甜缘115 共回答了20个问题 |采纳率80%解题思路:A.1molK2SO4含有2molK+,故K+的浓度为K2SO4的2倍;
B.根据n=cV计算K+的物质的量,再根据N=nNA计算K+的数目;
C.根据n=cV计算K2SO4的物质的量,1molK2SO4含有3mol离子(2molK+,1molSO42-),再根据N=nNA计算离子的数目;
D.溶液是均一的,1molK2SO4含有1molSO42-,SO42-的浓度等于K2SO4的浓度.A.1molK2SO4含有2molK+,K+的浓度为K2SO4的2倍,K2SO4溶液为0.2mol/L,所以K+离子浓度是0.4mol/L,故A正确;B.500mL0.2mol•L-1K2SO4溶液中,K2SO4的物质的量n=C•V=0.5L×0.2mol•L-1=0.1mol,K+的个数N=0.1×2×...
点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数,题目难度中等,注意注意溶液是均一的,浓度与体积无关.1年前查看全部
- 现有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L
现有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1.要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要2mol•L-1的NaOH溶液的体积为( )
A.80mL
B.100mL
C.120mL
D.140mL csykos1年前1
csykos1年前1 -
 riczeng 共回答了23个问题
riczeng 共回答了23个问题 |采纳率78.3%解题思路:根据电荷守恒计算出混合溶液中溶液中n(Al3+).MgCl2和AlCl3的混合溶液与氢氧化钠溶液的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH)=n(Cl)+n(Al),由此计算即可.溶液中n(Cl-)=0.1L×1.3mol/L=0.13mol,
溶液中n(Mg2+)=0.2mol/L×0.1L=0.02mol.
所以溶液中n(Al3+)=[1.3mol−0.02mol×2/3]=0.03mol,
将100mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,
反应后溶液为NaCl、NaAlO2的混合液,
由原子守恒可知n(NaOH)=n(Na)=n(Cl)+n(Al)=0.13mol+0.03mol=0.16mol,
所以至少需要2mol/L氢氧化钠溶液的体积为[0.16mol/2mol/L]=0.08L=80ml.
故选:A.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查计算,利用原子守恒,简化解题,关键在于清楚反应后溶液为NaCl、NaAlO2的混合液.1年前查看全部
- 常温下,取0.2mol•L-1 HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶
常温下,取0.2mol•L-1 HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c(H+)______0.2mol•L-1 HCl溶液中由水电离出的c(H+)(填“>、<或=”).
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=______mol•L-1,c(H+)-c(MOH)=______mol•L-1.
(3)若常温下取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度______(填“>、<或=”)MCl的水解程度.溶液中各离子浓度由大到小的顺序为______.
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH______7(填“>、<或=”). haogupiao66691年前1
haogupiao66691年前1 -
 哈萨迪克 共回答了18个问题
哈萨迪克 共回答了18个问题 |采纳率77.8%解题思路:(1)室温下取0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,其溶液呈酸性,含有弱根离子的盐促进水电离;
(2)根据物料守恒和电荷守恒计算离子浓度大小;
(3)室温下如果取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,根据电荷守恒判断离子浓度大小;
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,氨水为弱碱,混合后氨水过量,溶液显示碱性.(1)等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol•L-1 HCl溶液中水电离出的c(H+),
故答案为:>;
(2)根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol•L-1,根据质子守恒得 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol•L-1,
故答案为:9.9×10-7;1.0×10-8;
(3)室温下如果取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒知c(Cl-)>c(M+),盐中阴阳离子浓度大于氢离子和氢氧根离子浓度,所以溶液中各离子浓度由大到小的顺序为c(Cl-)>c(M+)>c(H+)>c(OH-),
故答案为:<;c(Cl-)>c(M+)>c(H+)>c(OH-);
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,氨水的浓度大于0.001mol/L,而盐酸的浓度为0.001mol/L,等体积混合后氨水过量,溶液显示碱性,溶液的pH>7,
故答案为:>.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合的定性判断和计算,为高频考点,侧重于学生的分析能力和计算能力的考查,根据电荷守恒和质子守恒分析弱电解质的电离及盐类水解,题目难度中等.1年前查看全部
- 实验基础题(1)现要配制150mL 0.2mol•L-1 NaCl溶液,请按使用的先后顺序,写出所用
实验基础题
(1)现要配制150mL 0.2mol•L-1 NaCl溶液,请按使用的先后顺序,写出所用到的玻璃仪器:______.
(2)要除去NO中NO2杂质,所用的除杂方法是______,所用的试剂是______;请画出装置图______.
(3)请回忆下列气体制取的发生装置:
A.实验室用MnO2和浓盐酸反应制取氯气; B.大理石与稀盐酸反应制取CO2 C.氯化铵与熟石灰反应制取氨气
某同学计划在实验室,用铜片与浓硫酸反应制取SO2气体,其发生装置应选用上述三种装置中的______,请按从下往上的顺序写出所用玻璃仪器的名称______. cookiecookie1年前0
cookiecookie1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
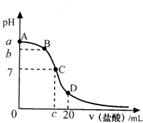
- 在25mL 0.1mol•L-1的NaOH溶液中逐滴加入0.2mol•L-1的CH3COOH溶液,溶液pH变化
在25mL 0.1mol•L-1的NaOH溶液中逐滴加入0.2mol•L-1的CH3COOH溶液,溶液pH变化曲线如图1所示.
(1)B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?______(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在______(填“AB”、“BC”或“CD”)区间内.
(2)关于该滴定实验,从下列选项中选出最恰当的一项(选用滴定管如图2所示)______.
(3)的D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)(填“>”、“<”或“=”).锥形瓶中的溶液 滴定管中的溶液 选用指示剂 选用滴定管 A 碱 酸 石蕊 乙 B 酸 碱 甲基橙 甲 C 碱 酸 酚酞 甲 D 酸 碱 酚酞 乙
(4)在C点,溶液中离子浓度由大到小的顺序为:______.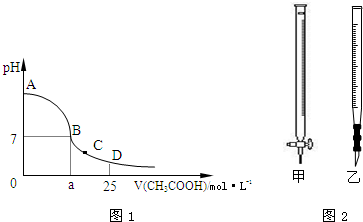
 晒风1年前1
晒风1年前1 -
 dnwx 共回答了18个问题
dnwx 共回答了18个问题 |采纳率88.9%解题思路:(1)根据若恰好完全反应,生成了醋酸钠,溶液应该显示碱性分析;
(2)25mL 0.1mol•L-1的NaOH溶液中逐滴加入0.2mol•L-1的CH3COOH溶液,锥形瓶中盛放氢氧化钠溶液,滴定管中盛放醋酸溶液,指示剂应该选用酚酞;
(3)根据物料守恒进行分析;
(4)C点醋酸过量,溶液显示酸性,根据电荷守恒判断溶液中各离子浓度大小.(1)NaOH溶液与CH3COOH溶液恰好完全反应时,生成了醋酸钠,醋酸根离子水解,溶液显示碱性,溶液的pH大于7;二者恰好完全反应时溶液的pH大于7,所以应该在AB段,
故答案为:否;AB;
(2)根据题干信息,锥形瓶中应该盛放氢氧化钠溶液,滴定管中盛放醋酸,二者恰好反应时溶液显示碱性,应该使用酚酞作为指示剂,所以C正确,
故选C;
(3)D点时醋酸的体积为25mL,n(CH3COO-)+n(CH3COOH)=0.2mol•L-1×0.025L=0.005mol,
n(Na+)=0.1mol•L-1×0.025L=0.0025mol,所以n(CH3COO-)+n(CH3COOH)=2n(Na+),
由于溶液的体积相同,所以c(CH3COO-)+c(CH3COOH)=2c(Na+),
故答案为:=;
(4)在C点,溶液的pH<7,氢离子浓度大于氢氧根离子浓度,根据电荷守恒:CH3COO-+OH-=Na++H+可知,溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).点评:
本题考点: 中和滴定.
考点点评: 本题考查了中和滴定,题目难度不大,注意掌握中和滴定方法及指示剂的选用方法,比较离子浓度大小时,注意电荷守恒和物料守恒的应用;本题充分培养了学生的分析、理解能力及灵活应用所学知识的能力.1年前查看全部
- 现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4来配制500mL、0.2mol•L-1的稀H2SO4.可供
现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4来配制500mL、0.2mol•L-1的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有______(填代号).
(2)经计算,需浓H2SO4的体积为______mL(保留一位小数).现有①10mL②50mL③100mL三种规格的量筒,你选用的量筒是______(填代号)
(3)在配制过程中,其他操作都准确,下列操作中:错误的是______,能引起实验结果偏高的有______(填代号).
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线. 快乐篮精灵1年前1
快乐篮精灵1年前1 -
 我来子潮洲 共回答了18个问题
我来子潮洲 共回答了18个问题 |采纳率94.4%解题思路:(1)根据配制500mL、0.2mol•L-1的稀H2SO4的步骤选择使用的仪器,然后判断不需要的仪器;
(2)根据c=[1000ρw/M]计算出浓硫酸的物质的量浓度,然后根据溶液稀释过程中溶质的物质的量不变计算出浓硫酸的体积;根据计算结果选择量筒规格;
(3)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)配制500mL、0.2mol•L-1的稀H2SO4的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要选用的仪器为:量筒、烧杯、玻璃棒、容量瓶、胶头滴管、500mL容量瓶等,不需要的仪器为:②烧瓶、⑦托盘天平、⑧药匙,
故答案为:②⑦⑧;
(2)该浓硫酸的物质的量浓度为:[1000×1.84×98%/98]mol/L=18.4mol/L,配制500mL、0.2mol•L-1的稀H2SO4,需要浓硫酸的体积为:[0.2mol/L×0.5L/18.4mol/L]≈0.0054L=5.4mL,需要选用10mL量筒,所以①正确,
故答案为:5.4; ①;
(3)①量取浓硫酸的量筒不能洗涤,如果洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,会导致量取的浓硫酸体积偏大,配制的溶液浓度偏高;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,热的溶液体积判断,冷却后溶液体积变小,配制的溶液浓度偏高;
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸,稀释浓硫酸时,应该将浓硫酸缓缓加入水中,顺序不能颠倒;
④定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致溶质的物质的量偏小,配制的溶液浓度偏低;
⑤转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量及溶液体积没有影响,不影响配制结果;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致配制的溶液体积偏大,配制的溶液浓度偏低;
⑦定容时,俯视标线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
根据以上分析可知,错误的操作有:①②③④⑥⑦;能引起实验结果偏高的有:①②⑦,
故答案为:①②③④⑥⑦; ①②⑦.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- 实验室用98%的浓H2SO4(ρ=1.84g•cm-3)配制500mL 0.2mol•L-1稀H2SO4溶液,
实验室用98%的浓H2SO4(ρ=1.84g•cm-3)配制500mL 0.2mol•L-1稀H2SO4溶液,请回答有关问题.
实验步骤 有关问题 (1)计算所需浓H2SO4体积为(保留一位小数) 需要浓H2SO4体积为______mL. (2)量取浓H2SO4 用______mL量筒量取所需浓H2SO4 (填“10”、“50”或“100”) (3)在100mL烧杯中稀释浓H2SO4 向盛有一定量水的烧杯中沿烧杯内壁慢慢倒入浓H2SO4,并不断搅拌.冷却到室温. (4)将烧杯中的溶液转移至______中(填实验仪器); (5)并用少量的水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶. (8)出现如下情况,对所配溶液浓度有何影响?(填“偏低”、“偏高”或“无影响”)
①没有进行操作步骤(5)______;
②在第(4)步不慎有少量液体流到容量瓶外
______;
③容量瓶没干燥,内壁附有少量蒸馏水______;
④在定容观察液面时,俯视刻度线______;(6)轻轻摇匀容量瓶,使溶液混合均匀 (7)将蒸馏水注入容量瓶,液面离容量瓶刻度线下1~2cm时,改用______向容量瓶中滴加蒸馏水至______,盖好瓶塞,反复上下颠倒,摇匀.  eDataPower1年前1
eDataPower1年前1 -
 62131 共回答了17个问题
62131 共回答了17个问题 |采纳率88.2%解题思路:(1)根据C=[1000ρω%/M]求出浓硫酸的浓度,再根据溶液的稀释定律C浓V浓=C稀V稀来求解;
(2)根据需要量取的浓硫酸的体积来选用合适的量筒;
(4)移液是将稀释并冷却的溶液转移到500ml容量瓶中;
(7)定容时待液面离刻度线1~2CM时,要改用胶头滴管进行滴加,至凹液面的最低处与刻度线相切;
(8)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=[n/V]分析对所配溶液的浓度影响.(1)根据C=[1000ρω%/M]可知浓硫酸的浓度C=[1000×1.84×98%/98]=18.4mol/L,设需要的浓硫酸的体积为VL,根据溶液的稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×VL=0.5L×0.2mol•L-1
解得V=0.0054L=5.4ml
故答案为:5.4;
(2)需要的浓硫酸为5.4ml,则根据量筒的选用规则是“大而近”,故选用10ml的量筒,故答案为:10;
(4)移液是将稀释并冷却的溶液转移到500ml容量瓶中,故答案为:500ml容量瓶;
(7)定容时,继续向容量瓶中缓缓加入蒸馏水至液面距离刻度线1~2cm处,改用胶头滴管进行定容,要逐滴滴加蒸馏水至溶液的凹液面正好与刻度线相切,故答案为:胶头滴管,溶液的凹液面正好与刻度线相切;
(8)①没有进行操作步骤(5),导致溶质损失,溶液浓度偏低,故答案为:偏低;
②在第(4)步不慎有少量液体流到容量瓶外,会导致溶质损失,溶液浓度偏低,故答案为:偏低;
③容量瓶没干燥,内壁附有少量蒸馏水,对所配溶液的浓度无影响,故答案为:无影响;
④在定容观察液面时,俯视刻度线,会导致溶液体积偏小,浓度偏高,故答案为:偏高.点评:
本题考点: 溶液的配制.
考点点评: 本题考查了配制一定物质的量浓度的溶液方法,题目难度中等,注意熟练掌握配制一定物质的量浓度的溶液的步骤,本题难度、易错点为误差分析,注意明确误差分析的方法.1年前查看全部
- 常温时,纯水中由水电离的c(OH-)=a,pH=1的盐酸中由水电离的c(OH-)=b,0.2mol•L-1的醋酸与0.2
常温时,纯水中由水电离的c(OH-)=a,pH=1的盐酸中由水电离的c(OH-)=b,0.2mol•L-1的醋酸与0.2mol•L-1的氢氧化钠溶液等体积混合后的溶液中,由水电离的c(OH-)=c,则a、b、c的关系正确的是( )
A. a>b=c
B. c>a>b
C. c>b>a
D. b>c>a WUJING885211年前1
WUJING885211年前1 -
 盲刘一辉 共回答了20个问题
盲刘一辉 共回答了20个问题 |采纳率90%解题思路:酸或碱抑制水电离,含有弱根离子的盐促进水电离,据此分析解答.0.2mol•L-1的醋酸与0.2mol•L-1的氢氧化钠溶液等体积混合,二者恰好反应生成强碱弱酸盐醋酸钠,醋酸钠促进水电离,盐酸是酸抑制水电离,所以a、b、c的关系是c>a>b,
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了影响水电离的因素,明确哪些物质促进水电离哪些物质抑制水电离是解本题关键,难度不大.1年前查看全部
- 有200mLMgCl2和AlCl3的混合溶液,其中Mg2+浓度为0.2mol•L-1,Cl-浓度为1.3mol•L-1.
有200mLMgCl2和AlCl3的混合溶液,其中Mg2+浓度为0.2mol•L-1,Cl-浓度为1.3mol•L-1.要使Mg2+全部转化为沉淀分离出来,至少需加4mol•L-1NaOH溶液的体积为( )
A.40mL
B.72mL
C.80mL
D.128mL lxj161年前1
lxj161年前1 -
 她和蚊子 共回答了17个问题
她和蚊子 共回答了17个问题 |采纳率94.1%解题思路:根据MgCl2和AlCl3的混合溶液与碱的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+恰好转化为AlO2-,先利用电荷守恒来计算Al3+的浓度,再根据反应方程式计算即可.MgCl2和AlCl3的混合溶液,其中Mg2+浓度为0.2mol•L-1,Cl-浓度为1.3mol•L-1,
设Al3+的浓度为x,由电荷守恒可知,
0.2mol/L×2+x×3=1.3mol/L×1,
解得x=0.3mol/L,
则将Mg2+、Al3+的物质的量分别为0.2L×0.2mol/L=0.04mol、0.2L×0.3mol/L=0.06mol,
由发生反应为MgCl2+2NaOH=Mg(OH)2↓+2NaCl
1 2
0.04mol 0.08mol
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,
1 4
0.06mol 0.24mol
使Mg2+全部转化为沉淀分离出来,消耗的NaOH的物质的量为0.08mol+0.24mol=0.32mol,
则需加4mol•L-1NaOH溶液的体积为[0.32mol/4mol/L]=0.08L=80mL,
故选C.点评:
本题考点: 镁、铝的重要化合物;离子方程式的有关计算.
考点点评: 本题考查离子的分离及利用化学反应方程式的计算,明确Mg2+全部转化为沉淀分离出来发生的化学反应是解答本题的关键,并注意利用氢氧化铝的两性来解答.1年前查看全部
- 将0.2molL•-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性正确
将0.2molL•-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性正确的是
A c(HCN)<c(CN-) B c(Na+)>c(CN-)
C c(HCN)-c(CN-)=c(OH-) D c(HCN)+c(CN-)=0.1mol•L
[思路分析] 将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,所得溶液中c(HCN) =0.05mol/L,为什么c(NaCN) =0.05 mol/L 52232121年前1
52232121年前1 -
 酒歌九 共回答了15个问题
酒歌九 共回答了15个问题 |采纳率93.3%c(NaCN) =0.05 mol/L
首先等体积混合后体积扩大了2倍...那么NA离子的浓度自然由原来的0.1mol•L-1变为0.05 mol/L-1.CN离子浓度大于0.05 mol/L-1...所以以NA的来计算1年前查看全部
- 实验室需要配制0.2mol•L-1 的Na2CO3溶液250mL,请问:
实验室需要配制0.2mol•L-1 的Na2CO3溶液250mL,请问:
①需要固体Na2CO3______g;
②需要含结晶水的碳酸钠晶体(Na2CO3•10H2O)______g;
③需要物质的量浓度为4mol•L-1的Na2CO3溶液______mL;
④需要溶质的质量分数为12%、密度为1.12g•cm-3的Na2CO3溶液______mL. chrisitina1年前1
chrisitina1年前1 -
 dxh_com 共回答了15个问题
dxh_com 共回答了15个问题 |采纳率100%解题思路:①根据n=c•V和m=n•M来计算;
②根据1molNa2CO3•10H2O能提供1molNa2CO3,得出需要的Na2CO3•10H2O的物质的量,再根据m=n•M来计算质量;
③根据稀释定律C浓V浓=C稀V稀来计算;
④根据C=[1000ρω%/M]计算出溶液的浓度,然后根据稀释定律C浓V浓=C稀V稀来计算.①根据n=c•V可知需要的Na2CO3的物质的量n=0.2mol•L-1×0.25L=0.05mol,质量m=n•M=0.05mol×106g/mol=5.3g,故答案为:5.3;②根据1molNa2CO3•10H2O能提供1molNa2CO3,可知需要的Na2CO3•10H2O的物质的量n=0.05mo...
点评:
本题考点: 溶液的配制.
考点点评: 本题考查了有关物质的量浓度的计算,掌握好公式的使用方法是解题的关键,难度不大.1年前查看全部
- 实验室配制物质的量浓度为0.2mol•L-1的NaOH溶液500mL,则
实验室配制物质的量浓度为0.2mol•L-1的NaOH溶液500mL,则
(1)需要固体NaOH______g.
(2)配制时,必须使用的仪器有______(填代号)
①烧杯 ②100mL量筒 ③10mL量筒④250mL容量瓶⑤500mL容量瓶 ⑥托盘天平(带砝码)⑦玻璃棒 ⑧胶头滴管
(3)下列操作中,容量瓶所具备的功能有______(填序号).
A.配制一定体积准确浓度的标准溶液B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体D.准确稀释某一浓度的溶液
E.量取一定体积的液体F.用来加热溶解固体溶质
(4)实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.2mol•L-1(填“大于”、“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.2mol•L-1. fwt6171年前1
fwt6171年前1 -
 kimjunggook 共回答了18个问题
kimjunggook 共回答了18个问题 |采纳率100%解题思路:(1)根据n=C•V和m=n•M来计算溶质的质量;
(2)根据配制溶质质量分数一定的溶液的步骤推出需要的仪器;
(3)容量瓶是专用于配制一定物质的量浓度溶液的仪器,只有一条刻度线,故不能配制容量瓶规格以下的任意体积的液体,不能受热,不能用于溶解固体、稀释浓溶液、反应容器,也不能储存溶液;
(4)根据c=[n/V]分析操作对溶质的物质的量或对溶液的体积的影响判断.(1)根据n=C•V可知需要的NaOH固体的物质的量n=0.2mol•L-1×0.5L=0.1mol,质量m=n•M=0.1mol×40g/mol=4.0g,故答案为:4.0;
(2)配制一定物质的量浓度的溶液的基本步骤:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶,所以配制溶液需要用到的仪器有:托盘天平、烧杯、玻璃棒、500ml容量瓶、胶头滴管,故必须使用的仪器有:①⑤⑥⑦⑧,故答案为:①⑤⑥⑦⑧;
(3)容量瓶是专用于配制一定物质的量浓度溶液的仪器,只有一条刻度线,不能受热.
A、容量瓶是专用于配制一定物质的量浓度溶液的仪器,故A正确;
B、容量瓶不能用于储存溶液,配制好溶液后必须尽快转移到试剂瓶中,故B错误;
C、容量瓶只有一条刻度线,故不能配制容量瓶规格以下的任意体积的液体,故C错误;
D、容量瓶不能受热,故不能用于稀释浓溶液,故D错误;
E、容量瓶不能用于量取一定体积的液体,故E错误;
F、容量瓶不能受热,故不能用于加热溶解固体,故F错误.
故选A.
(4)若定容时仰视刻度线,则溶液体积偏大,所得溶液浓度偏偏低;若NaOH溶液在转移至容量瓶时,洒落了少许,导致溶质的损失,则所配制溶液的浓度偏低.故答案为:小于;小于.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,注意误差的分析和容量瓶的使用,难度不大,1年前查看全部
- 将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
A. c(HCN)<c(CN-)
B. c(Na+)>c(CN-)
C. c(HCN)-c(CN-)=c(OH-)
D. c(HCN)+c(CN-)=0.1 mol•L-1 雪下长河1年前1
雪下长河1年前1 -
 zhangdas 共回答了17个问题
zhangdas 共回答了17个问题 |采纳率100%解题思路:将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明
CN-水解程度大于HCN电离程度,以此解答该题.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明CN-水解程度大于HCN电离程度,则
A.等浓度的CN-水解程度大于HCN电离程度,则c(HCN)>c(CN-),故A错误;
B.溶液显碱性,则c(OH-)>c(H+),根据c(Na+)+c(H+)=c(CN-)+c(OH-)可知,c(Na+)>c(CN-),故B正确;
C.根据物料守恒可知,c(HCN)+c(CN-)=2c(Na+),根据电荷守恒可知c(Na+)+c(H+)=c(CN-)+c(OH-),二者联式可得:c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C错误;
D.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,c(HCN)+c(CN-)=0.1mol•L-1,故D正确.
故选BD.点评:
本题考点: 离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,溶液显碱性,说明CN-水解程度大于HCN电离程度,结合电荷守恒和物料守恒解答.1年前查看全部
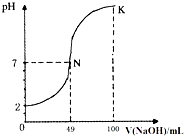
- 1 000mL某待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:
1 000mL某待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):阳离子 K+、NH4+、Fe3+、Ba2+ 阴离子 Cl-、Br-、CO32-、HCO3-、SO32-、SO42- 
(1)写出生成白色沉淀B的离子方程式:______.
(2)待测液中肯定不存在的阳离子是______.
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):阴离子 Cl- Br- CO32- HCO3- SO32- SO42- 浓度/mol•L-1
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:______.
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是______.
②沉淀A中能与稀硝酸反应的成分是______(写化学式). 蓝色闲Q1年前1
蓝色闲Q1年前1 -
 ghsteven03 共回答了14个问题
ghsteven03 共回答了14个问题 |采纳率92.9%解题思路:(1)(2)待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(3)若无色气体D是单一气体,则D为CO2,E为CaCO3,溶液中含有CO32-,白色沉淀D只能为BaSO4,溶液中一定没有SO32-,一定含有SO42-,计算B(碳酸钡)、E(碳酸钙)、硫酸钡的物质的量,根据离子守恒计算各离子的浓度;
根据电荷守恒判断是否含有钾离子,若溶液含有K+,当溶液中没有Cl-,K+离子浓度最小,根据电荷守恒计算;
(4)若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,沉淀A中一定含有BaCO3,BaSO3.待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(1)由上述分析可知,白色沉淀B为碳酸钡,是由HCO3-、Ba2+、OH-反应生成,反应离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,
故答案为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
(2)由上述分析可知,溶液中一定没有的阳离子是:Fe3+、Ba2+,
故答案为:Fe3+、Ba2+;
(3)①由上述分析可知,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-.
若无色气体D是单一气体,则D为CO2,E为CaCO3,溶液中含有CO32-,白色沉淀D只能为BaSO4,溶液中一定没有SO32-,一定含有SO42-,
B(碳酸钡)的物质的量=[19.7/197g/mol]=0.1mol,则n(HCO3-)=0.1mol,故c(HCO3-)=[0.1mol/1L]=0.1mol/L,
E(碳酸钙)的物质的量=[10g/100g/mol]=0.1mol,则n(CO32-)=0.1mol,故c(CO32-)=[0.1mol/1L]=0.1mol/L,
D(硫酸钡)的物质的量=[11.65g/233g/mol]=0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=[0.05mol/1L]=0.05mol/L,
故答案为:
阴离子 Cl- Br- CO32- HCO3- SO32- SO42-
浓度/mol•L-1 ? 0 0.1 0.1 0 0.05②n(NH4+)=n(NH3)=[2.24L/22.4L/mol]=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,当溶液中没有Cl-,K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L-0.3mol.L=0.1mol/L,
故答案为:存在;K+离子最小浓度为0.1mol/L;
(4)由上述分析可知,溶液中一定含有CO32-、HCO3-,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-.
若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,沉淀A中一定含有BaCO3,BaSO3,
①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-,故答案为:CO32-、HCO3-、SO32-;
②沉淀A中BaCO3,BaSO3能与稀硝酸反应,故答案为:BaCO3、BaSO3.点评:
本题考点: 无机物的推断;离子方程式的书写.
考点点评: 本题考查了离子的推断、检验,熟悉物质的性质是解本题关键,根据实验过程中反应现象、离子共存条件来确定溶液中存在的离子,注意根据溶液中电荷守恒确定钾离子是否存在,同时考查学生综合运用知识解决问题的能力,题目难度较大.1年前查看全部
- 硫酸镁和硫酸铝溶液等体积混合后,铝离子浓度为0.2mol•L-1,硫酸根离子的浓度为0.4mol•L-1,则混合液中镁离
硫酸镁和硫酸铝溶液等体积混合后,铝离子浓度为0.2mol•L-1,硫酸根离子的浓度为0.4mol•L-1,则混合液中镁离子的浓度为( )
A.0.1mol•L-1
B.0.15mol•L-1
C.0.2mol•L-1
D.0.3mol•L-1 捕鸟的小鱼1年前1
捕鸟的小鱼1年前1 -
 cb19871019 共回答了16个问题
cb19871019 共回答了16个问题 |采纳率100%解题思路:根据混合溶液中不显电性,则阳离子的电荷总数等于阴离子的电荷总数,以此来解答.铝离了浓度为0.2mol•L-1,硫酸根离子的浓度为0.4mol•L-1,
设镁离了的浓度为为x,
根据电荷守恒可知,
0.2mol/L×3+x×2=0.4mol/L×2,
解得x=0.1mol/L,
故选A.点评:
本题考点: 电解质在水溶液中的电离;物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的计算,明确电荷守恒是解答本题的关键,并注意离子的电荷数,难度不大.1年前查看全部
- 在500mL的稀硝酸溶液中,HNO 3 物质的量浓度为0.2mol•L -1 ,向该溶液中加入1.92克铜粉,加热充分反
在500mL的稀硝酸溶液中,HNO 3 物质的量浓度为0.2mol•L -1 ,向该溶液中加入1.92克铜粉,加热充分反应.求:(要求写出计算过程)
(1)生成气体的体积(标准状况下)
(2)被还原的HNO 3 的物质的量. xvhaixiang1年前1
xvhaixiang1年前1 -
 tempzhang 共回答了21个问题
tempzhang 共回答了21个问题 |采纳率81%(1)n(HNO 3 )=0.5L×0.2mol/L=0.1mol,n(Cu)=
1.92g
64g/mol =0.03mol,
由3Cu+8HNO 3 =3Cu(NO 3 ) 2 +2NO↑+4H 2 O可知,0.03molCu反应生成0.02molNO,
则生成气体的体积为0.02mol×22.4L/mol=0.448L=448mL,
答:生成气体的体积为448mL;
(2)由3Cu+8HNO 3 =3Cu(NO 3 ) 2 +2NO↑+4H 2 O可知,生成2molNO时2molHNO 3 作氧化剂,被还原,
则生成0.02molNO时有0.02molHNO 3 被还原,
答:被还原的HNO 3 的物质的量为0.02mol.1年前查看全部
- 常温下,向100mL0.1mol•L-1H2A(二元酸)溶液中逐滴加入0.2mol•L-1NaOH溶液,图中所示曲线表示
 常温下,向100mL0.1mol•L-1H2A(二元酸)溶液中逐滴加入0.2mol•L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol•L-1H2A(二元酸)溶液中逐滴加入0.2mol•L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
A.H2A为二元强酸
B.K点时加水稀释溶液,c(H+)增大
C.N点对应溶液有:c(Na+)=c(A2-)+c(HA-)
D.K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) libo104191年前1
libo104191年前1 -
 wfs90 共回答了22个问题
wfs90 共回答了22个问题 |采纳率86.4%解题思路:A、图象分析向100mL 0.1mol•L-1 H2A(二元酸)溶液PH=2,说明H2A为弱酸;
B、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大;
C、依据溶液中电荷守恒分析判断离子浓度大小;
D、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小比较.A、图象分析,100mL 0.1mol•L-1 H2A(二元酸)溶液PH=2,说明氢离子未全部电离,H2A为弱酸,故A错误;
B、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大,c(H+)增大,故B正确;
C、依据溶液中电荷,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),如呈中性,c(H+)=c(OH-),c(Na+)=2c(A2-)+c(HA-),故C错误;
D、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小为:c(Na+)>c(A2-)>c(OH-)>c(H+),故D错误;
故选B.点评:
本题考点: 中和滴定.
考点点评: 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,图象分析是关键,题目难度中等.1年前查看全部
- 在500mL 0.2mol•L-1的稀硝酸中加入1.92g铜片,让其充分反应.试求:
在500mL 0.2mol•L-1的稀硝酸中加入1.92g铜片,让其充分反应.试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计) 人鬼再混血1年前1
人鬼再混血1年前1 -
 timins 共回答了26个问题
timins 共回答了26个问题 |采纳率88.5%解题思路:发生3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑,n(Cu)=[1.92g/64g/mol]=0.03mol,n(HNO3)=V•c=0.5L×0.2 mol•L-1=0.1 mol,结合反应计算解答.(1)n(Cu)=[1.92g/64g/mol]=0.03mol,n(HNO3)=V•c=0.5L×0.2 mol•L-1=0.1 mol,
由3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑可知,稀硝酸过量,
设生成的一氧化氮物质的量为x,消耗HNO3的物质的量为y,
则3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
38 2
0.03moly x
(1)生成NO的物质的量x=[2×0.03mol/3]=0.02mol,标准状况下所占的体积为0.02mol×22.4L/mol=0.448L,答:标准状况下所占的体积为0.448L;
(2)消耗硝酸的物质的量y=[0.03mol×8/3]=0.08mol,则反应后溶液中H+的物质的量浓度是[0.1mol−0.08mol/0.5L]=0.04mol/L,
答:反应后溶液中H+的物质的量浓度是0.04mol/L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.1年前查看全部
- 有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol•L-1,SO42-的浓度是0.7mol•L-
有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol•L-1,SO42-的浓度是0.7mol•L-1,则Al3+浓度最接近于( )
A.0.4mol•L-1
B.0.2mol•L-1
C.0.3mol•L-1
D.0.6mol•L-1 无穷的ll1年前1
无穷的ll1年前1 -
 飞天狮 共回答了16个问题
飞天狮 共回答了16个问题 |采纳率87.5%解题思路:电解质溶液呈电中性,所以溶液中阴阳离子所带电荷相等,根据电荷守恒确定铝离子浓度.电解质溶液呈电中性,则溶液中阴阳离子所带电荷相等,根据电荷守恒得c(K+)+3c(Al3+)=2c(SO42-),
所以c(Al3+)=
2c(SO42−)−c(K+)
3=[2×0.7mol/L−0.2mol/L/3]=0.4mol/L,
故选A.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了离子浓度的计算,根据电解质溶液呈电中性,再结合电荷守恒来分析解答即可,注意再这里不考虑铝离子水解,为易错点.1年前查看全部
- 现有0.4mol•L-1HA溶液和0.2mol•L-1NaOH溶液等体积混合组成溶液.下列有关推论不正确的是( )
现有0.4mol•L-1HA溶液和0.2mol•L-1NaOH溶液等体积混合组成溶液.下列有关推论不正确的是( )
A.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
B.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
C.若该溶液中HA电离能力大于A-水解能力,则有c(A'>c(Na+)>c(HA)>c(H,>c(OH-
D.若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(Na+)>c(HA)>c(OH-)>c(H+)>c(OH-) poff11年前1
poff11年前1 -
 拔毛助长 共回答了14个问题
拔毛助长 共回答了14个问题 |采纳率85.7%解题思路:将0.4mol•L-1HA溶液和0.2mol•L-1的NaOH溶液等体积混合后,溶液溶质为HA和NaA,二者浓度相等,一般溶液显酸性,酸的电离为主,也可能为中性或碱性,取决电离与水解的程度,以此解答该题.将0.4mol•L-1HA溶液和0.2mol•L-1的NaOH溶液等体积混合后,溶液溶质为HA和NaA,二者浓度相等,
A.无论该溶液呈酸性还是碱性,溶液遵循电荷守恒,都有c(Na+)+c(H+)=c(A-)+c(OH-),故A正确;
B.无论该溶液呈酸性还是碱性,由物料守恒可知都有2c(Na+)=c(A-)+c(HA),故B错误;
C.若该溶液中HA电离能力大于A-水解能力,溶液显酸性,则有c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故C正确;
D.若该溶液中A-水解能力大于HA电离能力,溶液显碱性,则则有c(HA)>(Na+)>c(A-)>c(OH-)>c(H+),故D错误;
故选BD.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,反应后溶质的量及电离、水解的大小,结合电荷守恒和物料守恒解答.1年前查看全部
- 实验室需要450mL、0.2mol•L-1的稀硫酸,现用质量分数为98%、密度为1.84g•cm-3的浓硫酸来配制.请回
实验室需要450mL、0.2mol•L-1的稀硫酸,现用质量分数为98%、密度为1.84g•cm-3的浓硫酸来配制.请回答下列问题:
(1)所需的仪器除了玻璃棒、烧杯、量筒,还可能用到的玻璃仪器是:______
(2)配制溶液时,一般可以分为以下几个步骤:
①量取 ②计算 ③溶解 ④倒转摇匀 ⑤转移⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为______.
(3)经计算,需浓硫酸的体积为______;
(4)在容量瓶的使用方法中,下列操作不正确的是(填编号)______.
A.往容量瓶中转移溶液时应用玻璃棒引流
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接沿玻璃棒引流至容量瓶中,缓慢加入蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶反复倒转多次
(5)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是______.
①量取浓硫酸时仰视刻度线
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线. 兰花指的妖媚1年前1
兰花指的妖媚1年前1 -
 yjzct 共回答了20个问题
yjzct 共回答了20个问题 |采纳率90%解题思路:(1)根据配制一定物质的量浓度的溶液的操作步骤选择使用的仪器;
(2)根据操作过程是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶等步骤来排序;/ml
(3)根据C=[1000ρω/M]和稀释定律C浓V浓=C稀V稀来计算;
(4)根据容量瓶的使用方法和具体的操作流程来判断;
(5)根据C=[n/V],通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.(1)配制溶液的操作步骤:首先计算出需要的药品的体积,然后用量筒量取,后放入烧杯中稀释,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.用到的仪器有:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管.故还用到的仪器是500ml容量瓶和胶头滴管,
故答案为:500ml容量瓶、胶头滴管;
(2)根据操作过程是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:②①③⑧⑤⑥⑦④,故答案为:②①③⑧⑤⑥⑦④;
(3)根据C=[1000ρω/M]可知:浓硫酸的物质的量浓度C=[1000×18.4g/ml×98%/98g/mol]=18.4mol/L,设需要浓硫酸的体积为VL,根据稀释定律C浓V浓=C稀V稀来计算可有:18.4mol/L×VL=0.5L×0.2mol•L-1,解得:V=0.0054L=5.4mL,故答案为:5.4mL;
(4)A.往容量瓶中转移溶液时应用玻璃棒引流是正确的,因为如果不引流溶液容易洒出,故A正确;
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗是不正确的,这样会导致溶质的物质的量偏大,导致所配溶液浓度偏高,故B错误;
C.容量瓶不能用于溶解固体,故C错误;
D.容量瓶不能用于稀释浓溶液,故D错误;
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶反复倒转多次是摇匀的正确操作,故E正确.
故选:BCD;
(5)①量取浓硫酸时仰视刻度线,会导致量取的浓硫酸的体积偏多,所配稀溶液的浓度偏高,故①选;
②转移溶液时不慎有少量洒到容量瓶外面,会导致溶质的损失,则溶液浓度偏低,故②不选;
③只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,故③不选;
④定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,故④选;
⑤未冷却到室温就将溶液转移到容量瓶并定容,待溶液冷却后体积偏小,则浓度偏高,故⑤选;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线是正常的,再加水至刻度线会导致浓度偏低,故⑥不选.
故答案为:①④⑤.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.1年前查看全部
- (2013•安庆三模)常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 N
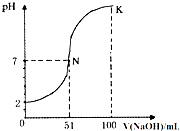 (2013•安庆三模)常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
(2013•安庆三模)常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
A.H2A为二元强酸
B.N点对应溶液有:c(Na+)=c(A2-)+c(HA-)
C.K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+)
D.K点时加水稀释溶液,c(H+)增大 1983528xmf1年前1
1983528xmf1年前1 -
 positionww 共回答了18个问题
positionww 共回答了18个问题 |采纳率94.4%解题思路:A、图象分析向100mL 0.1mol•L-1 H2A(二元酸)溶液PH=2,说明H2A为弱酸;
B、常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液50ml,恰好反应生成NaHA,溶液呈酸性,所以加入51ml氢氧化钠溶液溶液呈中性,依据溶液中电荷守恒分析判断离子浓度大小;
C、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小比较;
D、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大;A、图象分析,100mL 0.1mol•L-1 H2A(二元酸)溶液PH=2,说明氢离子未全部电离,H2A为弱酸,故A错误;
B、常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液50ml,恰好反应生成NaHA,溶液呈酸性,所以加入51ml氢氧化钠溶液溶液呈中性,依据溶液中电荷守恒分析判断离子浓度大小,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),如呈中性,c(H+)=c(OH-),c(Na+)=2c(A2-)+c(HA-),故B错误;
C、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小为:c(Na+)>c(A2-)>c(OH-)>c(H+),故C错误;
D、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大,c(H+)增大,故D正确;
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,图象分析是关键,题目难度中等.1年前查看全部
- 常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1NaOH溶液.有关微粒的物质的量(
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1NaOH溶液.有关微粒的物质的量(n)变化如图.(其中I表示H2A,Ⅱ代表HA-、Ⅲ代表A2-.).根据图示判断,当V (NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
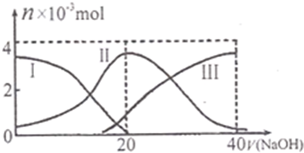
A. c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
B. c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A)
C. c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)>c(H2A)
D. c(Na+)>c(OH-)>c(HA-)>c(H2A)>c(H-)>c(A2-) tian001年前1
tian001年前1 -
 riverlengjie 共回答了25个问题
riverlengjie 共回答了25个问题 |采纳率88%解题思路:向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1NaOH溶液,当V (NaOH)=20mL时,此时为NaOH+H2A=NaHA+H2O;溶液主要为NaHA,依据图象分析,曲线Ⅰ是H2A物质的量的变化,溶液中存在电离生成氢离子和HA-离子,加入氢氧化钠溶液体积为20ml时反应后,溶液主要为NaHA,H2A物质的量为0,说明HA-不水解,只存在电离平衡,所以浓度略小于钠离子浓度,由曲线可以看出,HA-离子电离生成氢离子和A-离子,溶液显酸性,因此H+、A2-大于OH-、H2A,再加上水电离出的氢离子和氢氧根,所以H+>A2-,OH->H2A;向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1NaOH溶液,当V (NaOH)=20mL时,此时为NaOH+H2A=NaHA+H2O;溶液主要为NaHA,依据图象分析,曲线Ⅰ是H2A物质的量的变化,溶液中存在电离生成氢离子和HA-离子,加入氢氧化钠溶液体积为20ml时反应后,溶液主要为NaHA,曲线Ⅱ是HA-两种浓度变化,H2A物质的量为0,说明HA-不水解,只存在电离平衡,所以浓度略小于钠离子浓度,由曲线可以看出,HA-离子电离生成氢离子和A-离子,溶液显酸性,因此H+、A2-大于OH-、H2A,再加上水电离出的氢离子和氢氧根,所以H+>A2-,OH->H2A;所以有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A);
故选B.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了酸碱反应定量关系计算分析,图象分析判断,溶液酸碱性的分析应用,题目难度中等.1年前查看全部
- 如图为配制0.2mol•L-1Na2CO3溶液250mL示意图.
如图为配制0.2mol•L-1Na2CO3溶液250mL示意图.
回答下列问题:
(1)①中称得Na2CO3______g.
(2)玻璃棒在②、③两步中的作用分别是______、______.
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视______;
B.没有进行操作步骤④和⑤______;
C.在第⑤步不慎有少量液体流到容量瓶外______. huangytx1年前1
huangytx1年前1 -
 chinosaur 共回答了19个问题
chinosaur 共回答了19个问题 |采纳率84.2%解题思路:(1)根据溶质的质量m=nM=cvM计算;
(2)溶解固体时搅拌是加速溶解,过滤时是引流作用;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=[n/V]分析对所配溶液的浓度影响.(1)0.2mol•L-1Na2CO3溶液250mL需要Na2CO3的质量为:0.25L×0.2mol/L×106g/mol=5.3g,故答案为:5.3;
(2)玻璃棒在溶解固体时为了加速溶解,起搅拌作用,过滤时是起引流作用,
故答案为:搅拌;引流;
(3)A.某同学在第⑧步观察液面时俯视,溶液的体积偏小,所得溶液浓度偏高,故答案为:偏高;
B.没有进行操作步骤④和⑤,溶质的质量偏小,所得溶液浓度偏低,故答案为:偏低;
C.在第⑤步不慎有少量液体流到容量瓶外,溶质的质量偏小,所得溶液浓度偏低,故答案为:偏低.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,难度不大,注意从c=[n/V]理解溶液配制原理与误差分析.1年前查看全部
- 甲同学只用0.2mol•L-1 的硫酸和0.05mol•L-1的硫酸配制100mL0.1mol•L-1的稀硫酸
甲同学只用0.2mol•L-1 的硫酸和0.05mol•L-1的硫酸配制100mL0.1mol•L-1的稀硫酸:(忽略混合时溶液体积的变化)
(1)计算所需两种浓度的硫酸溶液的体积之比______乙同学欲用CuSO4•5H2O晶体配制100mL 0.1mol•L-1 CuSO4溶液
(2)若实验仪器有:A.100mL量筒;B.10mL量筒;C.托盘天平;D.玻璃棒;E.50mL容量瓶;F.100mL容量瓶;G.50mL烧杯;H.胶头滴管,实验时应选用仪器的有(不考虑使用先后顺序)(填写字母代码):______.
(3)乙同学应称取CuSO4•5H2O______g
A.使用容量瓶前______
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.准确称量好固体,把称好的试样用纸条小心倒入容量瓶中,并加少量水溶解
D.用玻璃棒引流向容量瓶中缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
F.将配好的溶液转移到贴好标签的试剂瓶中.
上述操作中不正确的是(填编号)______. thinkf1年前1
thinkf1年前1 -
 心灵快感 共回答了18个问题
心灵快感 共回答了18个问题 |采纳率94.4%解题思路:(1)根据溶液混合前后,溶质的物质的量不变来进行计算;
(2)根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签以及每步操作需要仪器确定反应所需仪器;
(3)根据溶质CuSO4的物质的量n=cV,CuSO4的物质的量等于CuSO4•5H2O,最后根据m=nM计算出CuSO4•5H2O的质量;
使用容量瓶前检验容量瓶是否漏水;
容量瓶用蒸馏水洗净后,直接加入待配溶液,无需润洗,否则浓度偏大;
容量瓶不能用来溶解固体;(1)设两种浓度的硫酸溶液的体积分别为V1,V2,溶液混合前后,溶质的物质的量不变,则有:
0.2mol•L-1×V1+0.05mol•L-1×V2=0.1mol•L-1×100mL;
V1+V2=100mL;
解得:V1=[100/3]mL;V2=[200/3]mL;
所以所需两种浓度的硫酸溶液的体积之比1:2;
故答案为:1:2;
(2)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以应选用的仪器为:CDFGH;
故答案为:CDFGH;
(3)100mL 0.1mol•L-1 CuSO4溶液中CuSO4的物质的量n=0.1mol•L-1×0.1L=0.01mol,CuSO4•5H2O的质量m=0.01mol×250g/mol=2.5g;
使用容量瓶前检验容量瓶是否漏水;
容量瓶用蒸馏水洗净后,直接加入待配溶液,无需润洗,否则浓度偏大;
容量瓶不能用来溶解固体;
故答案为:2.5;检验容量瓶是否漏水;BC;点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制步骤、计算以及仪器,难度不大.1年前查看全部
- 现用质量分数为98%、密度为1.84g•cm3的浓H2SO4配制500mL、0.2mol•L-1的稀H2SO4.可供选择
现用质量分数为98%、密度为1.84g•cm3的浓H2SO4配制500mL、0.2mol•L-1的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有______(填代号).
(2)经计算,需浓H2SO4的体积为______.现有①10mL②50mL③100mL三种规格的量筒,你选用的量筒是______
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到______ mL的容量瓶中,转移时应用玻璃棒______.转移完毕,用少量蒸馏水洗涤______2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度______处.改用______滴加蒸馏水到瓶颈刻度的地方,使溶液的______.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其他操作都准确,下列操作中错误的是______(多选)
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
⑧最后定容后,发现在刻度线的上方粘有一滴H2SO4的浓溶液. siben4261年前1
siben4261年前1 -
 mimimi2006 共回答了18个问题
mimimi2006 共回答了18个问题 |采纳率83.3%解题思路:(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)可设出溶液的体积,利用m=ρV求出质量,根据溶液稀释前后溶质质量不变来列式解答;根据溶液的体积选取稍大的量筒;
(3)根据实验操作的步骤;
(4)根据实验操作的步骤的要求来解答.(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、容量瓶,故答案为:②⑦⑧;
(2)设需要98%H2SO4的体积为VmL,根据溶液稀释前后溶质质量不变则,VmL×1.84g/cm3×98%=500mL×0.2mol•L-1×98g/mol,解得V=5.4ml,选用量筒的规格为10mL,
故答案为:5.4ml;10mL;
(3)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,故答案为:500;引流;烧杯及玻璃棒;1-2cm;胶头滴管;凹液面的最低点与刻线相平;
(4)①洗涤量取浓H2SO4后的量筒,不需要将洗涤液转移到容量瓶中,故①错误;
②稀释后的H2SO4溶液应冷却至室温才能转移到容量瓶,故②错误;
③稀释浓H2SO4时,将浓H2SO4沿着烧杯内壁缓慢倒入盛有蒸馏水的烧杯中,故③错误;
④定容时,加蒸馏水超过标线,不能胶头滴管吸出,应重新配制,故④错误;
⑤转移前,容量瓶中含有少量蒸馏水,对实验无影响,故⑤正确;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,这样会导致溶液的体积偏大,故⑥错误;
⑦定容时,俯视标线,会使溶液的体积偏小,故⑦错误;
⑧最后定容后,发现在刻度线的上方粘有一滴H2SO4的浓溶液,这样会导致溶液的体积偏大,故⑧错误;
故答案为:①②③④⑥⑦⑧.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,正确的操作才能配得浓度准确的溶液.1年前查看全部
- 将20mL 0.5mol•L-1K2SO3溶液逐滴加入到20mL 0.2mol•L-1 硫
将20mL 0.5mol•L-1K2SO3溶液逐滴加入到20mL 0.2mol•L-1 硫酸酸化的紫色KMnO4溶液中,溶液恰好变为无色.则Mn元素在产物中的存在形态是( )
A.Mn
B.Mn2+
C.Mn2O3
D.K2MnO4 竞走1年前1
竞走1年前1 -
 kickbally 共回答了16个问题
kickbally 共回答了16个问题 |采纳率87.5%解题思路:由信息可知,S元素的化合价由+4价升高为+6价,则Mn元素的化合价降低,结合电子守恒计算.由信息可知,S元素的化合价由+4价升高为+6价,则Mn元素的化合价降低,设反应后Mn元素的化合价为x,
由电子守恒可知,20×0.001L×0.5mol/L×(6-4)=20×10-3L×0.2mol•L-1×(7-x),
解得x=+2,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力及计算能力的考查,注意从化合价角度及电子守恒角度分析,题目难度不大.1年前查看全部
- 常温下,向20mL 0.2mol•L-1 H2SO3,溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的
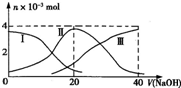 常温下,向20mL 0.2mol•L-1 H2SO3,溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表HS
常温下,向20mL 0.2mol•L-1 H2SO3,溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表HS
、Ⅲ代表SO −3
).根据图示下列判断正确的是( )O 2−3
A.当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-12
B.当V(NaOH)=20 mL时:c(Na+)>c(HS
)>c(H+)>c(SO −3
)>c(OH-)O 2−3
C.当V(NaOH)=40 mL时2c(Na+)=c(S
)O 2−3
D.当V(NaOH)=40 mL后,继续滴加NaOH溶液,溶液的温度会继续升高 紫衣蝴蝶_1年前1
紫衣蝴蝶_1年前1 -
 angel362271 共回答了20个问题
angel362271 共回答了20个问题 |采纳率95%解题思路:A.当V(NaOH)=0时,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=
;KW c(H+)
B.当V(NaOH)=20 mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,电离为主,溶液显酸性;
C.当V(NaOH)=40 mL时,由图象可知,溶质为Na2SO3,以水解为主;
D.当V(NaOH)=40 mL后,继续滴加NaOH溶液,不再发生化学反应.A.当V(NaOH)=0时,由图象可知,酸电离生成的c(H+)>2×10-3mol/L,由水电离出的c(H+)水=
KW
c(H+)≠1.0×10-12mol/L,故A错误;
B.当V(NaOH)=20 mL时,发生反应为NaOH+H2SO3=NaHSO3+H2O,溶液主要为NaHSO3,HSO3-电离大于水解,溶液显酸性,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故B正确;
C.当V(NaOH)=40 mL时,由图象可知,溶质为Na2SO3,以水解为主,则c(Na+)>2c(SO32-),故C错误;
D.当V(NaOH)=40 mL后,继续滴加NaOH溶液,不再发生化学反应,所以温度变化不明显,不会继续升高,故D错误;
故选B.点评:
本题考点: 离子方程式的有关计算;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查离子反应,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图中分析即可,不需要进行计算,题目难度中等.1年前查看全部
- 设NA为阿伏加德罗常数,下列关于0.2mol•L-1硝酸钡溶液的说法不正确的是( )
设NA为阿伏加德罗常数,下列关于0.2mol•L-1硝酸钡溶液的说法不正确的是( )
A. 1L溶液中所含阴阳离子总数是0.6NA
B. 1L溶液中含有0.2NA个NO3-
C. 500mL溶液中含有0.2NA个NO3-
D. 500mL溶液中Ba2+浓度为0.2mol•L-1 wuyou88881年前2
wuyou88881年前2 -
 若乔1030 共回答了17个问题
若乔1030 共回答了17个问题 |采纳率100%解题思路:1L0.2mol•L-1硝酸钡溶液含0.2molBa(NO3)2,一个Ba(NO3)2中有2个NO3-,阴阳离子总数为3.A、1L0.2mol•L-1硝酸钡溶液含0.2molBa(NO3)2,一个Ba(NO3)2中阴阳离子总数为3,0.2molBa(NO3)2中所含阴阳离子总数是0.6NA,故A正确;
B、一个Ba(NO3)2中有2个NO3-,1L0.2mol•L-1硝酸钡溶液含0.4NA个NO3-,故B错误;
C、一个Ba(NO3)2中有2个NO3-,500mL0.2mol•L-1Ba(NO3)2含有0.2NA个NO3-,故C正确;
D、500mL0.2mol•L-1硝酸钡溶液中Ba2+浓度仍为0.2mol•L-1,与体积无关,故D正确;
故选:B.点评:
本题考点: 阿伏加德罗常数;物质的量的相关计算.
考点点评: 500mL0.2mol•L-1硝酸钡溶液中Ba2+浓度仍为0.2mol•L-1,与体积无关,本题易错选D.1年前查看全部
- 将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
A. c(HCN)<c(CN-)
B. c(Na+)>c(CN-)
C. c(HCN)-c(CN-)=c(OH-)
D. c(HCN)+c(CN-)=0.1 mol•L-1 tiantian1101191年前2
tiantian1101191年前2 -
 夜色张狂 共回答了18个问题
夜色张狂 共回答了18个问题 |采纳率88.9%解题思路:将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明
CN-水解程度大于HCN电离程度,以此解答该题.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明CN-水解程度大于HCN电离程度,则
A.等浓度的CN-水解程度大于HCN电离程度,则c(HCN)>c(CN-),故A错误;
B.溶液显碱性,则c(OH-)>c(H+),根据c(Na+)+c(H+)=c(CN-)+c(OH-)可知,c(Na+)>c(CN-),故B正确;
C.根据物料守恒可知,c(HCN)+c(CN-)=2c(Na+),根据电荷守恒可知c(Na+)+c(H+)=c(CN-)+c(OH-),二者联式可得:c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C错误;
D.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,c(HCN)+c(CN-)=0.1mol•L-1,故D正确.
故选BD.点评:
本题考点: 离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查离子浓度大小比较,题目难度中等,本题注意根据题目信息判断,溶液显碱性,说明CN-水解程度大于HCN电离程度,结合电荷守恒和物料守恒解答.1年前查看全部
- 现用质量分数为98%、密度为1.84g•cm 3 的浓H 2 SO 4 配制500mL、0.2mol•L -1 的稀H
现用质量分数为98%、密度为1.84g•cm 3 的浓H 2 SO 4 配制500mL、0.2mol•L -1 的稀H 2 SO 4 .可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀H 2 SO 4 时用不到的有______(填代号).
(2)经计算,需浓H 2 SO 4 的体积为______.现有①10mL②50mL③100mL三种规格的量筒,你选用的量筒是______
(3)将浓H 2 SO 4 加适量蒸馏水稀释后,冷却片刻,随后全部转移到______ mL的容量瓶中,转移时应用玻璃棒______.转移完毕,用少量蒸馏水洗涤______2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度______处.改用______滴加蒸馏水到瓶颈刻度的地方,使溶液的______.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其他操作都准确,下列操作中错误的是______(多选)
①洗涤量取浓H 2 SO 4 后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H 2 SO 4 溶液冷却至室温就转移到容量瓶中
③将浓H 2 SO 4 直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H 2 SO 4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
⑧最后定容后,发现在刻度线的上方粘有一滴H 2 SO 4 的浓溶液. ZTWING1年前1
ZTWING1年前1 -
 直达特快 共回答了10个问题
直达特快 共回答了10个问题 |采纳率90%(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、容量瓶,故答案为:②⑦⑧;
(2)设需要98%H 2 SO 4 的体积为VmL,根据溶液稀释前后溶质质量不变则,VmL×1.84g/cm 3 ×98%=500mL×0.2mol•L -1 ×98g/mol,解得V=5.4ml,选用量筒的规格为10mL,
故答案为:5.4ml;10mL;
(3)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,故答案为:500;引流;烧杯及玻璃棒;1-2cm;胶头滴管;凹液面的最低点与刻线相平;
(4)①洗涤量取浓H 2 SO 4 后的量筒,不需要将洗涤液转移到容量瓶中,故①错误;
②稀释后的H 2 SO 4 溶液应冷却至室温才能转移到容量瓶,故②错误;
③稀释浓H 2 SO 4 时,将浓H 2 SO 4 沿着烧杯内壁缓慢倒入盛有蒸馏水的烧杯中,故③错误;
④定容时,加蒸馏水超过标线,不能胶头滴管吸出,应重新配制,故④错误;
⑤转移前,容量瓶中含有少量蒸馏水,对实验无影响,故⑤正确;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,这样会导致溶液的体积偏大,故⑥错误;
⑦定容时,俯视标线,会使溶液的体积偏小,故⑦错误;
⑧最后定容后,发现在刻度线的上方粘有一滴H 2 SO 4 的浓溶液,这样会导致溶液的体积偏大,故⑧错误;
故答案为:①②③④⑥⑦⑧.1年前查看全部
- 取0.2mol•L -1 HX溶液与0.2mol•L -1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得
取0.2mol•L -1 HX溶液与0.2mol•L -1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( ) A.混合溶液中由水电离出的c(OH - )小于0.2 mol•L -1 HX溶液中由水电离出的c(H + ) B.c(Na + )=c(X - )+c(HX)=0.2 mol•L -1 C.c(Na + )-c(X - )=9.9×10 -7 mol•L -1 D.c(OH - )=c(HX)+c(H + )=1×10 -8 mol•L -1  balloon761年前1
balloon761年前1 -
 封情十月 共回答了15个问题
封情十月 共回答了15个问题 |采纳率80%取0.2mol•L -1 HX溶液与0.2mol•L -1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),一元酸和一元碱的物质的量相等,混合后测得混合溶液的pH=8,说明形成的盐是强碱弱酸盐水溶液呈碱性.
A、混合溶液是盐溶液,且该盐含有弱根离子所以能促进水的电离,酸或碱能抑制水的电离,所以混合溶液中由水电离出的c(OH - )大于0.2 mol•L -1 HX溶液中由水电离出的c(H + ),故A错误.
B、溶液混合后,溶液的体积扩大1倍,离子的浓度缩小1倍,根据物料守恒知c(Na + )=c(X - )+c(HX)=0.1 mol•L -1 ,故B错误.
C、溶液呈电中性,所以C(H + )+C(Na + )=c(X - )+C(OH - ),所以c(Na + )-c(X - )=C(OH - )-C(H + )=10 -6 mol/L-10 -8 mol/L=9.9×10 -7 mol•L -1 ,故C正确.
D、根据物料守恒知c(Na + )=c(X - )+c(HX)=0.1 mol•L -1 ,根据电荷守恒得C(H + )+C(Na + )=c(X - )+C(OH - ),
所以C(OH - )=c(HX)+c(H + ),溶液中氢离子浓度为-10 -8 mol/L,所以氢氧根离子浓度大于1×10 -8 mol•L -1 ,故D错误.
故选C.1年前查看全部
- 实验室要配制100mL 0.2mol•L -1 Na 2 CO 3 溶液.请回答下列问题.
实验室要配制100mL 0.2mol•L -1 Na 2 CO 3 溶液.请回答下列问题.
(1)用托盘天平称取无水碳酸钠固体的质量为______ g.
(2)需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和______.
(3)下列操作中,可能造成所配制溶液的浓度偏低的是______(填序号).
①碳酸钠固体未充分干燥②称量时左盘放砝码③转移溶液时有少量滴洒. 非Faye1年前1
非Faye1年前1 -
 一个落后生 共回答了15个问题
一个落后生 共回答了15个问题 |采纳率93.3%(1)实验室配制1mol/L的Na 2 CO 3 溶液100mL需要Na 2 CO 3 的质量为:0.1L×0.2mol/L×106g/mol=2.1g.
故答案为:2.1g.
(2)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.
所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管.
所以还需要用的仪器为:托盘天平、药匙、100mL容量瓶.
故答案为:托盘天平、药匙、100mL容量瓶.
(3)①碳酸钠固体未充分干燥,实际称取的碳酸钠的质量偏小,所配溶液的浓度偏低;
②称量时左盘放砝码,由于使用游码,实际称量的碳酸钠的质量为1.9g,称取的碳酸钠的质量偏小,所配溶液的浓度偏低;
③转移溶液时有少量滴洒,移入容量瓶内碳酸钠的物质的量减少,所配溶液的浓度偏低.
故选:①②③.1年前查看全部
- NA表示阿伏加德罗常数的值,下列关于0.2mol•L-1的Ba(NO3)2溶液的说法不正确的是( )
NA表示阿伏加德罗常数的值,下列关于0.2mol•L-1的Ba(NO3)2溶液的说法不正确的是( )
A. 2L溶液中有阴、阳离子总数为1.2NA
B. 500mL溶液中NO3-浓度为0.2mol•L-1
C. 500mL溶液中Ba2+浓度为0.2mol•L-1
D. 500mL溶液中NO3-总数为0.2NA ywzhujianjun1年前1
ywzhujianjun1年前1 -
 cc123 共回答了24个问题
cc123 共回答了24个问题 |采纳率91.7%解题思路:A、根据N=化学式中阴阳离子个数×c(Ba(NO3)2)•V•NA计算;
B、根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
C、根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
D、根据n(NO3-)=2c(Ba(NO3)2)V计算.A、N(阴阳离子数)=3×c(Ba(NO3)2)2V NA=3×0.2mol/L×2L×NA=1.2NA,故A正确;
B、0.2mol•L-1的Ba(NO3)2溶液中:c(NO3-)=2×c[Ba(NO3)2)]=2×0.2mol/L=0.4mol/L,故B错误;
C、c(Ba2+)=1×c(Ba(NO3)2)=1×0.2mol/L=0.2mol/L,故C正确;
D、n(NO3-)=2 c(Ba(NO3)2)V=2×0.2mol/L×0.5L=0.2mol,NO3-总数为0.2NA,故D正确;
故选B.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了有关物质的量浓度的计算,题目难度不大,注意掌握物质的量浓度的概念及计算方法,明确化学式与离子的关系是解本题的关键.1年前查看全部
- 有200mLMgCl 2 和AlCl 3 的混合溶液,其中Mg 2+ 浓度为0.2mol•L -1 ,Cl - 浓度为1
有200mLMgCl 2 和AlCl 3 的混合溶液,其中Mg 2+ 浓度为0.2mol•L -1 ,Cl - 浓度为1.3mol•L -1 .要使Mg 2+ 全部转化为沉淀分离出来,至少需加4mol•L -1 NaOH溶液的体积为( ) A.40mL B.72mL C.80mL D.128mL  帅帅的女子1年前1
帅帅的女子1年前1 -
 qpymg 共回答了20个问题
qpymg 共回答了20个问题 |采纳率90%MgCl 2 和AlCl 3 的混合溶液,其中Mg 2+ 浓度为0.2mol•L -1 ,Cl - 浓度为1.3mol•L -1 ,
设Al 3+ 的浓度为x,由电荷守恒可知,
0.2mol/L×2+x×3=1.3mol/L×1,
解得x=0.3mol/L,
则将Mg 2+ 、Al 3+ 的物质的量分别为0.2L×0.2mol/L=0.04mol、0.2L×0.3mol/L=0.06mol,
由发生反应为MgCl 2 +2NaOH=Mg(OH) 2 ↓+2NaCl
1 2
0.04mol 0.08mol
AlCl 3 +4NaOH=NaAlO 2 +3NaCl+2H 2 O,
1 4
0.06mol 0.24mol
使Mg 2+ 全部转化为沉淀分离出来,消耗的NaOH的物质的量为0.08mol+0.24mol=0.32mol,
则需加4mol•L -1 NaOH溶液的体积为
0.32mol
4mol/L =0.08L=80mL,
故选C.1年前查看全部
- 某同学按下列步骤配制500mL 0.2mol•L-1KCl溶液,请回答有关问题.
某同学按下列步骤配制500mL 0.2mol•L-1KCl溶液,请回答有关问题.
(1)上述实验中使用容量瓶前应检验______.实验步骤 有关问题 ①计算所需KCl的质量 需要KCl的质量为______克(保留小数点后一位) ②称量KCl固体 称量需要用到的主要仪器是:______ ③将KCl加入100mL烧杯中,并加入适量水 为了加快溶解速率,可以采取哪些措施:
______④将烧杯中溶液转移至500mL容量瓶中 为了防止溶液溅出,应采取什么措施:
______⑤向容量瓶中加蒸馏水至刻度线 在进行此操作时当加水至刻度线1-2厘米处应如何操作:______
(2)在进行④步操作时未将洗涤烧杯、玻棒的洗液转移至容量瓶,则配制溶液浓度______(填写偏高、偏低、不影响).
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需______. cheng陈1年前1
cheng陈1年前1 -
 WaWa2046 共回答了16个问题
WaWa2046 共回答了16个问题 |采纳率93.8%解题思路:根据500mL 0.2mol•L-1KCl溶液中溶质氯化钾的物质的量计算出氯化钾的质量,再根据配制一定物质的量浓度的溶液的正确操作方法完成②-⑤;
(1)容量瓶有瓶塞,配制时需要摇匀,所以必须检查容量瓶是否漏水;
(2)没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小;
(3)加蒸馏水超过刻度线,配制失败,需要重新配制.500mL 0.2mol•L-1KCl溶液中含有溶质氯化钾0.1mol,需要氯化钾的质量为:74.5g/mol×0.1mol=7.45≈7.5g;称量7.5g氯化钾,可以使用托盘天平进行称量;为了加速溶解,需要使用玻璃棒进行搅拌;转移溶液时,需要使用玻璃棒引流,目的是避免液体流到容量瓶外边;定容时,先直接加蒸馏水到容量瓶刻度线1-2cm,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切,
故答案为;①7.5;②托盘天平; ③搅拌(或适当加热);④转移过程中用玻棒进行引流;⑤当加水至离刻度线1-2厘米时,改用胶头滴管加水至凹液面与刻度线相切;
(1)在使用容量瓶配制一定物质的量浓度的溶液时,必须检查容量瓶是否漏水,故答案为:容量瓶是否漏水;
(2)未将洗涤烧杯、玻棒的洗液转移至容量瓶,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故答案为:偏低;
(3)若进行⑤步操作时加蒸馏水超过刻度线,会导致配制的溶液浓度偏低,此次配制失败,需要倒掉重新配制,故答案为:重新配制.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度中的,注意掌握配制一定物质的量浓度的溶液的方法,明确误差分析的方法与技巧.1年前查看全部
- 设N A 为阿伏加德罗常数,下列关于0.2mol•L -1 硝酸钡溶液的说法不正确的是( ) A.1L溶液中所含阴阳离
设N A 为阿伏加德罗常数,下列关于0.2mol•L -1 硝酸钡溶液的说法不正确的是( ) A.1L溶液中所含阴阳离子总数是0.6N A B.1L溶液中含有0.2N A 个NO 3 - C.500mL溶液中含有0.2N A 个NO 3 - D.500mL溶液中Ba 2+ 浓度为0.2mol•L -1  lala_ss3331年前1
lala_ss3331年前1 -
 w363685798 共回答了18个问题
w363685798 共回答了18个问题 |采纳率94.4%A、1L0.2mol•L -1 硝酸钡溶液含0.2molBa(NO 3 ) 2 ,一个Ba(NO 3 ) 2 中阴阳离子总数为3,0.2molBa(NO 3 ) 2 中所含阴阳离子总数是0.6N A ,故A正确;
B、一个Ba(NO 3 ) 2 中有2个NO 3 - ,1L0.2mol•L -1 硝酸钡溶液含0.4N A 个NO 3 - ,故B错误;
C、一个Ba(NO 3 ) 2 中有2个NO 3 - ,500mL0.2mol•L -1 Ba(NO 3 ) 2 含有0.2N A 个NO 3 - ,故C正确;
D、500mL0.2mol•L -1 硝酸钡溶液中Ba 2+ 浓度仍为0.2mol•L -1 ,与体积无关,故D正确;
故选:B.1年前查看全部
- 25℃时,在20mL0.1mol•L -1 NaOH溶液中逐滴加入0.2mol•L -1 醋酸溶液,pH的变化曲线如图所
25℃时,在20mL0.1mol•L -1 NaOH溶液中逐滴加入0.2mol•L -1 醋酸溶液,pH的变化曲线如图所示,有关粒子浓度关系的比较中,不正确的是( ) A.在A点:C(Na + )>C(OH - )>C(Ac - )>C(H + ) B.在B点:C(Na + )=C(Ac - )>C(OH - )=C(H + ) C.在C点:C(Ac - )+C(HAc)=2C(Na + ) D.在C点:C(Ac - )>C(Na + )>C(H + )>C(OH - ) 
 zmhuang1年前1
zmhuang1年前1 -
 3213649 共回答了13个问题
3213649 共回答了13个问题 |采纳率76.9%A.在A点醋酸和NaOH恰好中和生成NaAc,为强碱弱酸盐,水解呈碱性,但Ac - 水解程度较小,应为c(Ac - )>c(OH - ),故A错误;
B.B点呈中性,应为C(Na + )=C(Ac - )>C(OH - )=C(H + ),故B正确;
C.C点时,n(NaOH)=0.02L×0.1mol/L=0.002mol,n(HAc)=0.02mol/L×0.02L=0.004mol,根据物料守恒可知c(Ac - )+c(HAc)=2c(Na + ),故C正确;
D.C点醋酸过量,溶液呈酸性,应存在C(Ac - )>C(Na + )>C(H + )>C(OH - ),故D正确.
故选A.1年前查看全部
- 现用10mol•L-1的浓硫酸来配制500mL 0.2mol•L-1的稀硫酸,可供选择的仪器有:①玻璃棒
现用10mol•L-1的浓硫酸来配制500mL 0.2mol•L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤容量瓶 ⑥托盘天平⑦药匙
(1)上述仪器在配制过程中不需要用到的是______.(填序号)
(2)配制该溶液应选用______ ml容量瓶
(3)计算所需浓硫酸的体积为______.现有①10mL ②50mL ③100mL三种规格的量筒,应当选用______.(填序号)
(4)实验中两次用到玻璃棒,其作用分别是:______、______.
(5)配制时,一般可分为以下几个步骤:
①计算 ②量取③稀释 ④______ ⑤转移 ⑥洗涤 ⑦定容 ⑧摇匀.
(5)配制好的溶液______填“能”或“不能”)长期存放在容量瓶中. 居士901年前1
居士901年前1 -
 Edwardwjj 共回答了20个问题
Edwardwjj 共回答了20个问题 |采纳率90%解题思路:(1)根据配制溶液的实验操作过程选择仪器;
(2)根据溶液的体积选择容量瓶规格;
(3)根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算浓硫酸的体积;根据浓硫酸的体积选择量筒的规格;
(4)稀释浓硫酸需要玻璃棒搅拌,向容量瓶移液,需要玻璃棒引流;
(5)根据配制溶液的实验操作过程解答;
(7)某些强碱溶液会腐蚀玻璃,存放时间久了会影响容量瓶的测量体积.(1)配制500ml0.2mol/L稀硫酸,操作步骤有计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故不需要用到的仪器为:⑥托盘天平、⑦药匙,故答案为:⑥⑦;
(2)需要配制500ml0.2mol/L稀硫酸,一定容积的容量瓶只能配制需要体积的溶液,硅选择500mL容量瓶,故答案为:500;
(3)根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×10mol/L=500mL×0.2mol/L,解得:x=10.0,所以选择10mL量筒,故答案为:10.0mL;①;
(4)稀释浓硫酸需要玻璃棒搅拌,向容量瓶移液,需要玻璃棒引流,故答案为:搅拌、引流;
(5)操作步骤有计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作,故答案为:冷却;
(6)某些强碱溶液会腐蚀玻璃,存放时间久了会影响容量瓶的测量体积,影响所配溶液的精度,故配制好的溶液不变长期存放在容量瓶中,故答案为:不能.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,注意从c=[n/V]理解配制原理,注意浓硫酸的稀释操作.1年前查看全部
- 25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )
 25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )
25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+)
C.若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:c(NH4+)+c(NH3•H2O)=2c(Cl-) lhy8208231年前1
lhy8208231年前1 -
 fox_male 共回答了17个问题
fox_male 共回答了17个问题 |采纳率94.1%解题思路:氨水呈碱性,盐酸呈酸性,向氨水中加入盐酸,发生酸碱中和反应导致溶液的pH值降低,当盐酸和氨水的物质的量相等时,恰好生成氯化铵;当继续加盐酸时,盐酸的物质的量远远大于氨水时,溶液中以盐酸为主,溶液的PH值近似于盐酸的PH值.
溶液中根据物料守恒和电荷守恒判断溶液中离子浓度的相对大小.A、在A、C间任一点,当盐酸的量很少时,溶液中以氨水的电离为主,所以溶液中离子存在的关系可能是c(NH4+)>c(OH-)>c(Cl-)>c(H+),故A错误;B、氯化铵是强酸弱碱盐,其水溶液呈酸性,当溶液的PH=7时,氨水...
点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱中和反应中PH值图象的分析,难度不大,注意特殊点的分析,1未加盐酸溶液时,2酸碱恰好反应时,3溶液的PH=7时.1年前查看全部
大家在问
- 12A(g)可逆B(g)+D(g)反应温度升高,A达到平衡的浓度就小,怎么判断该反应是吸热,还是放热
- 2如图10,已知△ABC全等△ADE,且∠CAD=20°,∠B=∠D=30°∠EAB=120°,求∠DFB和∠DGB的度数
- 3小红和小方原来一共有60张画片.小红送给小方6张后,两人画片的张数一样多,她们两人原来各有多少张画片?
- 4为什么冬天和夏天摆钟的摆锤摆动的快慢不一致?
- 512分之11除以14分之11 5分之4除以4分之3 9分之5除以15分之2
- 6求大侠紧急救急!(1)如图所示,已知AB∥CD,分别探讨下面的四个图形中∠APC与∠PAB﹑∠PCD的关系,并说明理由.
- 7请用简洁的语言概括,什么是低碳?
- 8用面积法解题1、已知如图AB=AC,AD⊥BC于D,DE⊥AB于F,求证DE=DF2、如图,BD=CD,BF⊥AC,CE
- 9给点建议撒1.如图,有一圆形的马戏帐篷,其半径为20cm,从A到B有一笔挺的棚栏,∠ACB=120°.(1)求AB的长;
- 10从《庖丁解牛》分析庄子的生存智慧
- 11The last paragraph states what you want from the receiver .的
- 12用所给单词的适当形式填空. 2.Three------(quarter) of the earth is covered
- 13鲁班的特点是什么
- 14话题作文:My day,写出星期几,这天你上什么课,一日三餐吃什么,进行什么样的活动
- 15德语初学者的问题 分析句型 Was darf es sonst noch sein?我知道这句话的意思 但不知到 具体结
