“硫化物”和“含硫化合物”一样么?即so2、so3是不是既是“硫化物”有是“氧化物”?
 水冷美妹2022-10-04 11:39:542条回答
水冷美妹2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 ccll12345678 共回答了16个问题
ccll12345678 共回答了16个问题 |采纳率93.8%- 很明显不一样.
硫化物是盐,即硫化钠等.
含硫化合物就多了,只要是含有硫元素的化合物都叫作含硫化合物,包括硫化物.如硫化钠、二氧化硫、硫酸、亚硫酸钠等.要注意是化合物. - 1年前
 喜欢猪的人 共回答了6个问题
喜欢猪的人 共回答了6个问题 |采纳率- 含硫化合物:只要该化合物里有硫元素,就是含硫化合物,比如硫酸,亚硫酸,so2、so3、H2S。
事实是这样的,你要从得失电子的的方面考虑,so2、so3中,硫元素失去电子,硫被氧元素夺取电子,所以是氧化不是硫化。在硫化氢(H2S)中,氢元素失去电子,氢被硫元素夺取电子,所以是硫化。
可以这样记住:某元素得能力电子强,该物质就是某化物。
所以你说的so2、so3是“含硫化合物... - 1年前
相关推荐
- 在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为七a七O大,还有少量的硫化物.查阅相关的资料:已知碳
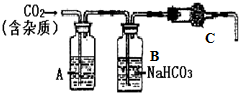 在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为七a七O大,还有少量的硫化物.查阅相关的资料:已知碳酸钙与盐酸的复分解反应可自发进行.在常温下,测得浓度均为a%的四种溶液的7H大小情况见表格
在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为七a七O大,还有少量的硫化物.查阅相关的资料:已知碳酸钙与盐酸的复分解反应可自发进行.在常温下,测得浓度均为a%的四种溶液的7H大小情况见表格
(1)表中7H大小情况揭示出复分解反应的一条规律:较强酸发生类似反应可以生成较弱酸.下列反应均能发生,但不符合上述规律的是______(填字母)溶质 H2SO三 H七l H2S H2七O大 7H 小→大
A.H七l+NaH七O大=Na七l+H2O+七O2↑
B.2H七l+七aS=七a七l2+H2S↑
七.H2S+七uSO三=H2SO三+七uS↓
(2)根据以上信息,为了得到干燥、纯净的二氧化碳,设计了k图装置,请i分析:
已知B装置的作用是除去H七l气体.A装置中可以放______,是为了检验并除去其中的______,从而确定大理石中是否含有硫化钙. hanbing818681641年前1
hanbing818681641年前1 -
 张新成 共回答了28个问题
张新成 共回答了28个问题 |采纳率96.4%解题思路:(1)根据题意:较强酸发生类似反应可以生成较弱酸分析解答;
(2)利用“2HCl+CaS=CaCl2+H2S↑;H2S+CuSO4=H2SO4+CuS↓”考虑,进行分析.(r)由题目中的表格信息可知:酸性强的酸能制取酸性弱的酸,
溶质 H口SO4 HCl H口S H口CO3
pH 小→大A、HCl的酸性比H口CO3强,故可发生;
B、HCl的酸性比H口S强,故可发生;
C、因H口S的酸性比硫酸酸性弱,故C错误.
(口)已知B装置的作用是除去HCl气体.因为“口HCl+CaS=CaCl口+H口S↑;H口S+CuSO4=H口SO4+CuS↓”,则A装置中可以放硫酸铜溶液,是为了检验并除去其中的 H口S,从而确定大理石中是否含有硫化钙.
故答案是:
(r)C;(口)硫酸铜溶液,H口S,点评:
本题考点: 二氧化碳的实验室制法;气体的干燥(除水).
考点点评: 本题很好的将化学实验与其他化学知识有机结合,能综合考查学生的能力和素质,分析装置的作用是解答问题的关键要素.1年前查看全部
- 为什么自然界铁多以硫化物形式存在而不是氧化物
 孤锋立蓑衣1年前2
孤锋立蓑衣1年前2 -
 画伊 共回答了11个问题
画伊 共回答了11个问题 |采纳率90.9%谁说的,自然界中的几种主要铁的矿物:赤铁矿Fe2O3、磁铁矿Fe3O4、黄铁矿FeS2
铁与硫和氧的亲和力都比较强,硫化物和氧化物两种形式都有,都普遍存在.1年前查看全部
- 将4.6g钠和1.6g硫粉迅速混合,并放在石棉网上加热,反应后生成的固体是 A黄色固体纯净物 B硫和硫化物 C过氧化钠和
将4.6g钠和1.6g硫粉迅速混合,并放在石棉网上加热,反应后生成的固体是 A黄色固体纯净物 B硫和硫化物 C过氧化钠和硫化钠 D氧化钠和硫化钠
 mmtme19931年前1
mmtme19931年前1 -
 放逐浮云 共回答了24个问题
放逐浮云 共回答了24个问题 |采纳率95.8%C1年前查看全部
- 铜的冶炼大致可分为:(1)富集,将硫化物矿进行浮选;(2)焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
(3)制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑;
(4)电解精炼.
下列说法正确的是( )
A.上述灼烧过程的尾气均可直接排空
B.由6molCuFeS2生成6molCu,上述共消耗15molO2
C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,作氧化剂只有Cu2O
D.电解精炼时,粗铜应与外电源负极相连 冰雪皑1年前1
冰雪皑1年前1 -
 huanghm927 共回答了13个问题
huanghm927 共回答了13个问题 |采纳率100%解题思路:A、根据尾气SO2气体的性质判断能否直接排空;
B、根据最终产物为Cu、SO2和FeO可写出反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据总反应方程式判断;
C、根据反应物各元素的化合价的变化判断;
D、精炼铜时,粗铜做阳极.A、SO2有毒,不能直接排放到空气中,故A错误;
B、反应的总反应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,由6molCuFeS2生成6molCu,共消耗15molO2,故B正确;
C、在反应2Cu2O+Cu2S=6Cu+SO2↑中,Cu的化合价由+1价升高为+2价,S的化合价由-2价升高为+4价,反应物中Cu2O只做氧化剂,Cu2S既是氧化剂又是还原剂,故C错误;
D、精炼铜时,粗铜做阳极,与电源的正极相连,故D错误.
故选B.点评:
本题考点: 金属冶炼的一般原理;铜的电解精炼;氧化还原反应.
考点点评: 本题考查金属的冶炼以及氧化还原有关知识,题目难度不大,注意分析C项中各元素的化合价的变化特点,以正确分析氧化剂和还原剂.1年前查看全部
- 铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 ═Cu
铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 ═Cu 2 S+3SO 2 +2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 ═2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S═6Cu+SO 2 ↑;④电解精炼铜.
下列说法正确的是( )A.冶炼过程中的尾气可用来制硫酸 B.上述过程中,由1molCuFeS 2 制取1molCu时共消耗2molO 2 C.在反应2Cu 2 O+Cu 2 S═6Cu+SO 2 ↑中,只有Cu 2 O作氧化剂 D.电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g  曲尘1年前1
曲尘1年前1 -
 jimmy4446 共回答了21个问题
jimmy4446 共回答了21个问题 |采纳率95.2%A、在铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫的制取硫酸的原料,所以冶炼过程中的尾气可用来制硫酸,故A正确.B、反应的总分应方程式为6CuFeS 2 +15O 2 =6Cu+12SO 2 +6FeO,由1molCu...1年前查看全部
- 在氧气流中灼烧0.4g铁的一种硫化物,使其中的硫经过一系列变化,最后全部转化为H2SO4,用20ml0.5mol.L-1
在氧气流中灼烧0.4g铁的一种硫化物,使其中的硫经过一系列变化,最后全部转化为H2SO4,用20ml0.5mol.L-1的NaOH溶液恰好完全中和这些H2SO4,计算铁的硫化物中硫的质量分数
 三亚又怎样1年前1
三亚又怎样1年前1 -
 了夫 共回答了19个问题
了夫 共回答了19个问题 |采纳率89.5%H2SO4+2NaOH=Na2SO4+2H2O 1 2 x 0.02×0.5=0.01mol 解得x=0.005mol 说明S物质的量也是0.005mol 也就是0.005×32=0.16g 0.16/0.4=40%1年前查看全部
- 有哪些硫化物不溶于强酸
 云凝1年前3
云凝1年前3 -
 girl790201 共回答了21个问题
girl790201 共回答了21个问题 |采纳率95.2%CuS-不溶于强HCl,但溶于浓HNO3
HgS-不溶于浓HNO3,但溶于王水.1年前查看全部
- 硫化物与碘反应的化学方程式
 滴水之海1年前2
滴水之海1年前2 -
 kjwwf 共回答了17个问题
kjwwf 共回答了17个问题 |采纳率88.2%离子方程式:S2- + I2 = S + 2I- 因为碘氧化性强于硫.1年前查看全部
- 有3g某种铁的硫化物,在空气中充分燃烧后生成了铁的氧化物和二氧化硫.生成的二氧化硫能将溶液中12.7g碘还原为碘离子,这
有3g某种铁的硫化物,在空气中充分燃烧后生成了铁的氧化物和二氧化硫.生成的二氧化硫能将溶液中12.7g碘还原为碘离子,这种铁的硫化物的化学式是 A Fe2S3 B FeS C FeS2
 dmfyos4d1年前1
dmfyos4d1年前1 -
 haier8886 共回答了20个问题
haier8886 共回答了20个问题 |采纳率90%SO2 +2H2O +I2==H2SO4 +2HI
32 127*2
x 12.7
x==1.6
即3g 中有S 1.6 g
则 Fe有3-1.6==1.4 g
则 Fe:S==1.4/56 :1.6/32==1:2
即FeS21年前查看全部
- 环境污染,为什么人类连原子,原子核之类的分解都能完成(核裂变,核聚变).却没法把CO2,CO,硫化物之类的污染物分解成,
环境污染,
为什么人类连原子,原子核之类的分解都能完成(核裂变,核聚变).却没法把CO2,CO,硫化物之类的污染物分解成,碳,氧硫之类的基本元素.如果能现在的环境问题不是很好解决?这样分解的技术难点在那里? 韓德强1年前1
韓德强1年前1 -
 plxshmily 共回答了14个问题
plxshmily 共回答了14个问题 |采纳率92.9%其实CO2,CO,SO2什么的在一定的条件下很可以按楼主说的分解为基本元素,但它们十分不稳定,又立刻会生成原来的物质,所以基本上是很难实现的.从另外一个角度讲,任何反应都必须遵守两个守恒,能量守恒与物质守恒,你说的只遵循后者,但对前者是不符合的1年前查看全部
- 求砷的硫化物与双氧水反应的产物As4S4As2S3As2S3以上三种物质分别与H2O2反应,产物是什么 在常温常压条件下
求砷的硫化物与双氧水反应的产物
As4S4
As2S3
As2S3
以上三种物质分别与H2O2反应,产物是什么
在常温常压条件下需催化吗 爱你的鹏1年前1
爱你的鹏1年前1 -
 sky_flyman 共回答了24个问题
sky_flyman 共回答了24个问题 |采纳率87.5%反应
As转化为砷酸H3AsO4
S转化为H2SO4以及S,动力学原因单质硫难以完全被氧化1年前查看全部
- 将0.6克某种铁的硫化物在氧气中灼烧,使硫全部氧化为二氧化硫,再将所得二氧化硫全部氧化为三氧化硫;三氧化硫与水反应完全转
将0.6克某种铁的硫化物在氧气中灼烧,使硫全部氧化为二氧化硫,再将所得二氧化硫全部氧化为三氧化硫;三氧化硫与水反应完全转化为硫酸;这些硫酸恰好与40ml 0.5mol/L氢氧化钠溶液中和生成盐.
1.求0.6克这种铁的硫化物中硫的物质的量.
2.写出铁的硫化物的化学式
说明白点,刚才也问了同样问题,可有个猪不知道写了什么 夜色咖啡男子1年前3
夜色咖啡男子1年前3 -
 商业网虫 共回答了12个问题
商业网虫 共回答了12个问题 |采纳率91.7%第一问...我觉得是硫元素守恒...相当于铁的硫化物中的硫全转化成硫酸中的硫.1mol硫酸对应2mol氢氧化钠,那就是0.01mol硫酸.1mol硫酸对应1mol硫,所以硫是0.01mol.
第二问...0.01mol刘的质量是0.32克,那么铁的质量就是0.28克,0.005mol,铁和硫的物质的量之比是1:2,所以是FeS21年前查看全部
- 关于硫化物在水中溶解度问题。有个说法是阳离子极化作用越强,溶解度越小。Mg的极化力应该比Hg要强吧,为何MGS的溶解度大
关于硫化物在水中溶解度问题。有个说法是阳离子极化作用越强,溶解度越小。Mg的极化力应该比Hg要强吧,为何MGS的溶解度大呢。
 xtxlp1年前3
xtxlp1年前3 -
 kingsoccor 共回答了18个问题
kingsoccor 共回答了18个问题 |采纳率77.8%Mg是8电子构型,Hg是18电子构型1年前查看全部
- 碘量法测水样硫化物如何防止碘挥发
 吟吟松风1年前2
吟吟松风1年前2 -
 herrydy 共回答了13个问题
herrydy 共回答了13个问题 |采纳率92.3%从原理上将,加入过量的碘化钾,使溶液中的碘都以I3-(碘三负离子)的形式存在
I2+I-=I3-
同时控制溶液中碘的浓度不要太高,就可以避免挥发.
另外,在实际的实验过程中,有一种专门做碘量法的碘量瓶,就是能在瓶塞周围加一些水的锥形瓶,它可以在反应(如I2氧化硫离子)的时候,在瓶口形成液封,使浓度高的I2不至于挥发,等到反应完成后,浓度低了,这时再快速滴定,挥发就会很少了.1年前查看全部
- 铜的冶炼过程大致可分为: ①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 ===Cu 2
铜的冶炼过程大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS 2 +4O 2 ===Cu 2 S+3SO 2 +2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 ===2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S===6Cu+SO 2 ↑;
④电解精炼铜。
下列说法正确的是[ ]A.冶炼过程中的尾气可用来制硫酸
B.上述过程中,由1 mol CuFeS 2 制取1 mol Cu时共消耗2 mol O 2
C.在反应2Cu 2 O+Cu 2 S===6Cu+SO 2 ↑中,只有Cu 2 O作氧化剂
D.电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g wzok1年前1
wzok1年前1 -
 zjcky 共回答了26个问题
zjcky 共回答了26个问题 |采纳率76.9%A1年前查看全部
- 硫化物属于盐吗?RT盐的定义是只有金属离子(包括铵根)和酸根组成才叫盐吗?
 sadfgnbdfkm1年前1
sadfgnbdfkm1年前1 -
 bestlover_wzj 共回答了16个问题
bestlover_wzj 共回答了16个问题 |采纳率81.3%金属硫化物属于盐1年前查看全部
- R的硫化物化学式RS,其相对分子质量与相同价态的氧化物的相对分子质量之比为9;7,则R的氧化物
 lyz7105111年前2
lyz7105111年前2 -
 鱼虾舞 共回答了27个问题
鱼虾舞 共回答了27个问题 |采纳率92.6%R的硫化物化学式RS,说明R的化合价为+2,其氧化物分子式为RO.根据题意(R+32)/(R+16)=9:7,R=40,应为钙,所以氧化物为CaO.1年前查看全部
- 用第四版亚甲蓝法做硫化物,50ml的比色管,空白0.025正常吗
 anranwang19801年前1
anranwang19801年前1 -
 attawa 共回答了18个问题
attawa 共回答了18个问题 |采纳率100%不正常,空白应该在0.005左右1年前查看全部
- 测定药品中铅含量时,其中一种方法是用硫代乙酰胺在弱酸性条件下水解产生硫化氢,与铅离子反应生成硫化物混悬液,与标准进比色.
测定药品中铅含量时,其中一种方法是用硫代乙酰胺在弱酸性条件下水解产生硫化氢,与铅离子反应生成硫化物混悬液,与标准进比色.
这里为什么不直接用硫化氢溶液而要采用硫代乙酰胺水解产生的硫化氢? pansyzheng1年前1
pansyzheng1年前1 -
 不要盗我号 共回答了19个问题
不要盗我号 共回答了19个问题 |采纳率84.2%硫代乙酰胺在若酸性条件下缓慢分解产生硫化氢,与铅反应.以前的方法是直接加饱和硫化氢水溶液,因为那个直接加不是挺臭的吗.所以就用硫代乙酰胺取代了.1年前查看全部
- (2009•揭阳二模)海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产.若从海底黑烟囱附近的矿产物中分离出富铜矿Cu
(2009•揭阳二模)海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产.若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜,熔炼过程主要反应为:
2CuFeS2=Cu2S+2FeS+S…①2Cu2S+3O2=2Cu2O+2SO2…②
Cu2O+FeS=Cu2S+FeO③2FeS+3O2+SiO2=2FeO•SiO2+2SO2…④
2FeO+SiO2=2FeO•SiO2⑤Cu2S+2Cu2O=6Cu+SO2 ⑥
下列有关说法不正确的是( )
A.上述反应均属于氧化还原反应
B.该厂可同时建硫酸厂和炼铁厂
C.该厂的原料除富铜矿外,还需空气和硅石
D.反应④转移12e- a99961年前1
a99961年前1 -
 闲看流水过小桥 共回答了19个问题
闲看流水过小桥 共回答了19个问题 |采纳率94.7%解题思路:A.化学反应前后有元素化合价变化的一定是氧化还原反应;依据元素化合价变化分析反应判断;
B.根据工业上制备硫酸和炼铁原理进行解答;
C.根据冶炼铜,熔炼过程主要反应进行解答;
D.2FeS+3O2+SiO2=2FeO•SiO2+2SO2中S元素的化合价升高,氧气中O元素的化合价降低,据此分析进行解答.A.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价;②中S元素的化合价升高,氧气中O元素的化合价降低;③中,铜氧、硫、铁四种元素化合价未变,不是氧化还原反应;④中S元素的化合价升高,氧气中O元素的化合价降低;⑤中,氧、硅、铁三种元素化合价未变,不是氧化还原反应;⑥中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;则③⑤不是氧化还原反应,故A错误;
B.工业制硫酸常用接触法,先制气制取SO2,然后在接触室中进行的反应为2SO2+O2
催化剂
.
加热2SO3,最后用98.3%的硫酸吸收,①中的硫可制取二氧化硫,②④⑥产生二氧化硫,所以该厂可同时建硫酸厂;炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应①③④⑤均有氧化亚铁,能提供含铁的原料,所以该厂可同时建炼铁厂,故B正确;
C.硅石的主要成分为二氧化硅,从反应④⑥看出需硅石,从反应②④需氧气可知需空气,故C正确;
D.2FeS+3O2+SiO2=2FeO•SiO2+2SO2中FeS中S元素从-2价升高为二氧化硫中的+4价,2FeS转移12e-,氧气中O元素的化合价降低为-2价转移12e-,故D正确;
故选A.点评:
本题考点: 金属冶炼的一般原理;氧化还原反应;铜金属及其重要化合物的主要性质.
考点点评: 本题考查冶炼铜,熔炼过程,明确反应中的元素的化合价变化是解答本题的关键,注意选项D转移的电子数目为易错点,题目难度中等.1年前查看全部
- 将 0.6克某种铁得硫化物在氧气中灼烧,使硫全部转化为二氧化硫,在将得到的二氧化硫全部氧化为三氧化硫,三氧化硫与水反应完
将 0.6克某种铁得硫化物在氧气中灼烧,使硫全部转化为二氧化硫,在将得到的二氧化硫全部氧化为三氧化硫,三氧化硫与水反应完全转化为硫酸.这些硫酸恰好与40毫升0.5摩每升氢氧化钠溶液完全中和生成正盐
(1) 0.6克这种铁的硫化物中硫的物质的量
(2) 该铁的硫化物的化学式 chengduren1年前1
chengduren1年前1 -
 侠隐红颜 共回答了19个问题
侠隐红颜 共回答了19个问题 |采纳率84.2%0.04*0.5=0.02 H2SO4+NaOH→Na2SO4+H2O
所以硫酸为0.01MOL
所以S的物质的量为0.01MOL
因为56 S为32 所以 该硫化物中铁和流的比例为1:2
FeS21年前查看全部
- Fe与s2反应为+2的硫化物,与cl2生成+3的氯化物.这为什么提现Cl非金属性更强?
 东边白勺东边1年前4
东边白勺东边1年前4 -
 菜刀0706 共回答了19个问题
菜刀0706 共回答了19个问题 |采纳率89.5%S的氧化性弱,只能把Fe氧化为Fe2+.Fe+S=△=FeS
Cl2的氧化性强,可以把Fe氧化为Fe3+.2Fe+3Cl2=点燃=2FeCl3
这个证明Cl2的氧化性比S的氧化性强.
单质的氧化性越强,对应元素的非金属性越强.1年前查看全部
- 重金属硫化物均不溶于水
 1655858341年前1
1655858341年前1 -
 2007nowhereman 共回答了24个问题
2007nowhereman 共回答了24个问题 |采纳率83.3%除碱金属或者碱土金属以外的金属硫化物一般不溶于水,且具有不同的颜色如:CuS、Ag2S、ZnS、FeS等 碱金属或者碱土金属的硫化物遇水就水解生成硫氢化物 铝、铬1年前查看全部
- 硫代硫酸钠和硫化钠反应方程式?1、请问硫代硫酸钠和硫化钠反应方程式是什么?2、做硫化物实验时,对数据影响最大、最关键的什
硫代硫酸钠和硫化钠反应方程式?
1、请问硫代硫酸钠和硫化钠反应方程式是什么?
2、做硫化物实验时,对数据影响最大、最关键的什么?
 abcdxx1年前2
abcdxx1年前2 -
 one_of 共回答了17个问题
one_of 共回答了17个问题 |采纳率88.2%Na2S2O3+2Na2S+3H2O=6NaOH+4S,这是归中反应.
这不太好说,外因内因都会有.1年前查看全部
- 怎么确定和区别各种盐,像硅酸盐,氧化物,碳酸盐,硫化物和硫酸盐
 最小的善1年前1
最小的善1年前1 -
 1675384 共回答了18个问题
1675384 共回答了18个问题 |采纳率88.9%首先注意氧化物和硫化物不是盐.这个问题太宽泛,简洁的回答就是可以先看状态,在根据物理和化学性质鉴别.比如硅酸根在酸性条件下生成硅酸沉淀,硫酸根和钡离子生成沉淀,碳酸根离子在酸性条件下放出二氧化碳.等等1年前查看全部
- 碱金属吸附在催化剂的毛细孔表面,金属氧化物(如MgO、KaO等)中和催化剂表面的SO3生成硫化物而造成催化剂
碱金属吸附在催化剂的毛细孔表面,金属氧化物(如MgO、KaO等)中和催化剂表面的SO3生成硫化物而造成催化剂
KaO有这种金属氧化物吗?还是人家打错了? ttv将asd1年前1
ttv将asd1年前1 -
 静流水止 共回答了21个问题
静流水止 共回答了21个问题 |采纳率85.7%Ca应该是1年前查看全部
- 金属硫化物都是难溶的吗?
 zt166881年前1
zt166881年前1 -
 快乐宝贝5074 共回答了22个问题
快乐宝贝5074 共回答了22个问题 |采纳率95.5%对1年前查看全部
- 硫酸镁算金属硫化物吗?是不是只要一个金属化合物中有硫元素都叫金属硫化物?
 老鹰是hh的1年前1
老鹰是hh的1年前1 -
 328830 共回答了17个问题
328830 共回答了17个问题 |采纳率82.4%金属硫化物是指单纯的金属和硫形成的化合物.如Na2S、FeS等
硫酸镁是硫酸盐,不是金属硫化物1年前查看全部
- 谁在使用气相分子,求交流主要分析硫化物,想知道曲线斜率、加标回收率等方面的内容
 77yaya1年前1
77yaya1年前1 -
 xng90908 共回答了36个问题
xng90908 共回答了36个问题 |采纳率88.9%不太清楚你想要问的是什么,但就我了解的:
斜率:是配制至少五个浓度的样品,根据不同浓度样品的峰高或峰面积的不同做线,浓度为纵坐标,峰高或峰面积为横坐标,用EXCEL表格可以求出线性方程和斜率.
加标回收率:就是投入已知量(浓度)的标准物质制备出不同浓度的样品,用你的常规分析方法分析它,得出的标准物质的量(浓度)与投入量(浓度)的百分比.一般至少配制三个浓度.1年前查看全部
- 请问,亚硫酸钠是不是硫化物?亚硫酸钠与甲醛水溶液发生反应吗?
 6000154801年前3
6000154801年前3 -
 玲子_sophie 共回答了25个问题
玲子_sophie 共回答了25个问题 |采纳率88%别听他们的
不是硫化物,加成生成羟甲基磺酸钠1年前查看全部
- 氢氧化铁,氢氧化镍,氢氧化钴(铁钴镍都是三价的)哪个碱性强,怎么得出来的啊?还有二价的三种硫化物呢?
 追欢逐梦1年前2
追欢逐梦1年前2 -
 fisher7456 共回答了18个问题
fisher7456 共回答了18个问题 |采纳率77.8%氢氧化铁〉氢氧化钴〉氢氧化镍 因为元素周期表从左到右金属性减弱非金属性增强,金属性越强,碱性越强!三种二价硫化物:H2S(硫化氢)、Na2S2O3(硫代硫酸钠)、NaHS(硫氢化钠)1年前查看全部
- 请问,哪些还原性比较强的硫化物是能够溶于水的?
 qrgzzwp1年前2
qrgzzwp1年前2 -
 无事神仙 共回答了15个问题
无事神仙 共回答了15个问题 |采纳率86.7%硫化物的还原性一般是硫离子的还原性,况且能溶于水的硫化物只有硫化钾,硫化钠,硫化按和硫化氢,而硫化氢中氢又显少许氧化性,所以硫化钾,硫化钠,硫化按的还原性相当1年前查看全部
- 硫化物的溶解性为什么硫化铁溶于稀酸,硫化铜不溶于稀酸?哪些硫化物易水解?为什么?
 毛猴1年前1
毛猴1年前1 -
 soso2006 共回答了10个问题
soso2006 共回答了10个问题 |采纳率100%本质就是溶度积
CuS溶度积足够小,可以看成是比H2S还难电离的物质1年前查看全部
- 如何简单生成硫化铜不要硫化氢.用一种中性的硫化物的盐溶液和硫酸铜反应,可以用什么?直接混合就反应的.
 houzk1年前3
houzk1年前3 -
 孩儿她亲爸 共回答了26个问题
孩儿她亲爸 共回答了26个问题 |采纳率96.2%最简单易得的就是硫化铵,硫化钠,直接和硫酸铜混合就反应生成硫化铜沉淀了1年前查看全部
- 已知某金属M的硫化物的化学式为MaSb,则该金属元素硝酸盐的化学式是?
 怒火攻心1年前1
怒火攻心1年前1 -
 ruumeng 共回答了19个问题
ruumeng 共回答了19个问题 |采纳率84.2%M(NO3)21年前查看全部
- 工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去
工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去
工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+
这句话哪里不对啊 阿甬1年前1
阿甬1年前1 -
 想耍的 共回答了20个问题
想耍的 共回答了20个问题 |采纳率95%这句话是正确的,可以除Hg2+、Cu2+等,但不能除Fe2+.1年前查看全部
- 难溶金属硫化物为什么有特殊的颜色
 网络aa1年前2
网络aa1年前2 -
 活鱼菜鸟 共回答了19个问题
活鱼菜鸟 共回答了19个问题 |采纳率94.7%金属硫化物为什么难溶 这是它们的性质 如果一定要解释的话 用相似相溶原理来解释呗 为什么1年前查看全部
- Al能和Ago发生铝热反应吗?和金属硫化物(例如Ags)发生铝热反应吗?
 zzjjffzjf1年前1
zzjjffzjf1年前1 -
 蛋挞我爱吃 共回答了14个问题
蛋挞我爱吃 共回答了14个问题 |采纳率92.9%可以.
但和AgS反应时,S元素会因为高温而被氧气氧化生成二氧化硫.最终产物是Al2O3、Ag和SO2.1年前查看全部
- 关于硫化物和醋酸铅的反应我知道 Pb(CH3COO)2+H2S=PbS(黑色沉淀)+CH3COOH那Pb(CH3COO)
关于硫化物和醋酸铅的反应
我知道 Pb(CH3COO)2+H2S=PbS(黑色沉淀)+CH3COOH
那Pb(CH3COO)2+甲基硫醇 以及 Pb(CH3COO)2+二甲基硫 能否反应呢?能否生成有颜色的沉淀? 晨钟暮钟1年前2
晨钟暮钟1年前2 -
 婷儿丫头 共回答了17个问题
婷儿丫头 共回答了17个问题 |采纳率100%甲硫醇可与醋酸铅生成沉淀,黄色.
硫醚不反应.1年前查看全部
- 闪锌矿中的Fe元素主要以什么形式存在?氧化物,还是硫化物?
 黄雄健1年前1
黄雄健1年前1 -
 chingstar 共回答了16个问题
chingstar 共回答了16个问题 |采纳率87.5%硫化物,闪锌是还原性环境1年前查看全部
- 铜银锌镉汞的硫化物为何对酸的溶解度不一样?
 梦旋1年前2
梦旋1年前2 -
 wenyiduoshizhu 共回答了14个问题
wenyiduoshizhu 共回答了14个问题 |采纳率92.9%它们的容度积不同,容度积大的其饱和溶液(剩余固体)中硫离子浓度就相对的高(有的能差十余个数量级),如果加入酸,使溶液中氢离子和硫离子浓度商高于生成硫化氢(弱电解质)的浓度,就会表现为沉淀溶解.对于溶解平衡常数大的沉淀,就可以通过加酸使之溶解,表现为沉淀溶于酸,该常数小的,你可能无法把氢离子浓度提高到产生沉淀的水平,表现为沉淀不溶解于酸.1年前查看全部
- 硫化物标准曲线线性不好的原因
 fogdirt1年前1
fogdirt1年前1 -
 菜饼 共回答了18个问题
菜饼 共回答了18个问题 |采纳率100%主要原因还是硫化物不稳定造成的.
根据我的经验,应该注意的地方如下:
1、硫化钠标准使用液配制的时候,当加入乙酸锌-乙酸钠溶液后,溶液将出现混悬状态.在取用时应摇匀.有可能会造成移液管移液困难.
2、显色时,加入的试剂含硫酸,应沿管壁徐徐加入,避免冲击太大.加完后立即闭塞.避免硫化氢的流逝.
3、在整个过程中,应做到快速,闭塞,避光.
4、我已经有两年没做这实验了,有些细节一时想不起.但做到以上三点,应该问题不大.1年前查看全部
- 铜的冶炼过程大致可分为: ①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S
铜的冶炼过程大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S+3SO 2 +2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 =2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑;
④电解精炼铜
下列说法正确的是[ ]A.上述过程中,由1molCuFeS 2 制取1molCu时共消耗2molO 2
B.在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,只有Cu 2 O作氧化剂
C.电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量一定为32g
D.冶炼过程中的尾气可用来制硫酸 duke5111年前1
duke5111年前1 -
 20070910cd 共回答了19个问题
20070910cd 共回答了19个问题 |采纳率94.7%D1年前查看全部
- 铜的冶炼大致可分为:(1)富集,将硫化物矿进行浮选;(2)焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S+3SO 2 +2FeO(炉渣);
(3)制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 =2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑;
(4)电解精炼.
下列说法正确的是( )A.上述灼烧过程的尾气均可直接排空 B.由6molCuFeS 2 生成6molCu,上述共消耗15molO 2 C.在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,作氧化剂只有Cu 2 O D.电解精炼时,粗铜应与外电源负极相连  shapei0011年前1
shapei0011年前1 -
 mmqsf 共回答了25个问题
mmqsf 共回答了25个问题 |采纳率84%A、SO 2 有毒,不能直接排放到空气中,故A错误;
B、反应的总分应方程式为6CuFeS 2 +15O 2 =6Cu+12SO 2 +6FeO,由6molCuFeS 2 生成6molCu,共消耗15molO 2 ,故B正确;
C、在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,Cu的化合价由+1价升高为+2价,S的化合价由-2价升高为+4价,反应物中Cu 2 O只做氧化剂,Cu 2 S既是氧化剂又是还原剂,故C错误;
D、精炼铜时,粗铜做阳极,与电源的正极相连,故D错误.
故选B.1年前查看全部
- 水解酸化-好氧接触氧化工艺?用这个工艺处理COD1200-1600mg/l、氨氮100mg/l左右、硫化物30左右,生化
水解酸化-好氧接触氧化工艺?
用这个工艺处理COD1200-1600mg/l、氨氮100mg/l左右、硫化物30左右,生化池各项指标控制多少?尤其是水解段的溶解氧、ph值、温度、营养比、等 nijunjie1231年前1
nijunjie1231年前1 -
 司马ee 共回答了19个问题
司马ee 共回答了19个问题 |采纳率89.5%就1600 COD,不是16000,用厌氧是糟蹋钱,和钱过不去.
水解酸化没什么特别要求的,只是不知道你们是填料还是穿孔曝气?出水指标是什么?用接触氧化,出水对TN没要求么?
DO么好氧一般2~3,C:N:P=100:5:1,接触氧化的话那也没有MLSS的讲究,其他温度,PH之类不解释,如果不明白应该百度一下,如果还是不明白,那只能说你不适合做这个了.
不知道你们具体工艺流程,以上作参考1年前查看全部
- 原生铜的硫化物经氧化、淋滤作用变成cuso4溶液过程中,原生铜的硫化物表现出还原性吗?如何体现?
 rabboni1年前2
rabboni1年前2 -
 回vicky忆 共回答了13个问题
回vicky忆 共回答了13个问题 |采纳率92.3%体现.S元素发生变价.从-2变为+6.
至于铜元素则有两种可能.有可能原来是CuS,也有可能是Cu2S.
如果是CuS就只有S升价,如果是Cu2S则Cu和S都升价.
不管是那种情况,都会体现出还原性.1年前查看全部
- 25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18 mol2•
25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18 mol2•L-2;Ksp(CuS)=1.3×10-36 mol2•L-2;Ksp(ZnS)=1.6×10-24 mol2•L-2.下列关于常温时的有关叙述正确的是( )
A.硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B.除去工业废水中含有的Cu2+,可采用FeS 固体作为沉淀剂
C.将足量的ZnSO4晶体加入到0.1 mol•L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-2 3 mol•L-1
D.向饱和的FeS 溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,但Ksp(FeS)变大 vate20071年前1
vate20071年前1 -
 秋风疾 共回答了13个问题
秋风疾 共回答了13个问题 |采纳率84.6%解题思路:A、根据溶度积大小进行比较,溶度积越大,溶解度越大;
B、根据硫化铜与硫化亚铁的溶度积进行判断;
C、根据溶液中硫离子的增大浓度及Ksp(ZnS)=1.6×10-24 mol2•L-2计算出锌离子的浓度;
D、根据溶度积只受温度影响,与离子浓度大小无关进行分析.解;A、由于Ksp(CuS)=1.3×10-36<Ksp(ZnS)=1.6×10-24<Ksp(FeS)=6.3×10-18,所以溶解度CuS<ZnS<FeS,故A错误;
B、由于Ksp(CuS)=1.3×10-36<Ksp(FeS)=6.3×10-18,硫化铜的溶解度小于硫化亚铁的,所以除去工业废水中含有的Cu2+,可采用FeS 固体作为沉淀剂,故b正确;
C、原硫化钠溶液中硫离子增大浓度为:c(S2-)=0.1 mol•L-1,所以锌离子最小浓度为:c(Zn2+)=
1.6×1024
0.1mol/L=1.6×10-2 3 mol•L-1,故C错误;
D、向饱和的FeS 溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,温度不变,所以Ksp(FeS)不变,故D错误;
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度不大,注意对溶度积常数的利用和理解.1年前查看全部
- 根据下列信息,写出有关化学反应方程式汞蒸气有毒,为防止汞蒸气使人中毒,可在洒落的液态汞上覆盖硫粉,产生+2价汞的硫化物
 awalkingbird1年前3
awalkingbird1年前3 -
 cq8gjd 共回答了21个问题
cq8gjd 共回答了21个问题 |采纳率95.2%正确的写法应是: Hg + S = HgS 写化学式是要注意大小写的. HG+S==HGS 不要反应条件,1年前查看全部
- 硫的不含氧酸盐是不是都不溶于水RT,像CuS什么的.此外,有没有什么特殊颜色的硫化物?THX!
 翠绿的心痕1年前2
翠绿的心痕1年前2 -
 何炜 共回答了11个问题
何炜 共回答了11个问题 |采纳率90.9%不全是,如Na2S就可溶.但大部分金属的硫化物均为不溶物或微溶物.1年前查看全部
大家在问
- 1别让人偷走了你的梦 阅读答案别让人偷走你的梦 蒙迪·罗伯特上高中时,老师出了一道作文题,让同学们谈谈自己的理想,罗伯特兴
- 2达尔文在《物种起源》一书中明确指出,人类和现代类人猿有着共同的祖先。 [
- 3She often watches cartoons.划线提问,划watches cartoons怎么做?
- 4动词的句子适当形式填空。谢谢!
- 5给这个文章加个单词..这是个听力,自己听了好多遍才听了大半,但有个词不会,下面括号那个.The flu usually
- 6星期1到星期6怎么用英文说?
- 78 8 8 88加88等于1000
- 8环保建议 作文
- 9简述一种关联规则挖掘算法基本过程.《数据挖掘》作业题追分100
- 10写出由下面和数组成的数.①四千万、五百万、六十万和三百组成的数.______②三千亿、三百万和六十组成的数.______
- 11无盖长方体粉笔盒,从外量,长1分米,宽9厘米,高8厘米,木木板厚1厘米,体积和容积一样吗,
- 12阅读下面的对话,根据 阅读下面的对话,根据上下文从方框内的选项中选择恰当的选项补全对话,使句义完整,符合逻辑.有两项为多
- 13英语翻译通俗地讲,食物链是各种生物通过一系列吃与被吃的关系,把这种生物与那种生物紧密地联系起来.就像老鹰吃小鸟,小鸟吃虫
- 14These socks are too short.的同意句
- 15关于操作顺序的题做实验题时经常会遇到填写实验操作顺序的填空题,蒸发浓缩 冷却结晶 洗涤干燥 趁热过滤 这些操作的前后顺序
