叠氮酸中氮原子的杂化过程,后两个是如何实现sp杂化的,电子如何分配的?
 海衍子2022-10-04 11:39:540条回答
海衍子2022-10-04 11:39:540条回答
已提交,审核后显示!提交回复
共0条回复
相关推荐
- 题设条件:叠氮酸(HN3)与醋酸酸性相似,那么
题设条件:叠氮酸(HN3)与醋酸酸性相似,那么
那么,NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
为什么?(选择题中的一个正确选项) dremboy1年前1
dremboy1年前1 -
 tianhz 共回答了27个问题
tianhz 共回答了27个问题 |采纳率92.6%NaN3在水中会电离,既然叠氮酸(HN3)与醋酸酸性相似,那么我们可以把NaN3看成是醋酸钠(CH3COONa).溶液呈碱性,c(OH-)>c(H+)
NaN3电离成钠离子与叠氮酸根离子,而叠氮酸根离子又会水解,但是水解的量是不大的,所以c(N3-)>c(OH-).
钠离子不水解也不电离,所以量最多.1年前查看全部
- 叠氮酸结构,为什么有一个N不参与大π键!
叠氮酸结构,为什么有一个N不参与大π键!
如图,也就是说有一个π3(4),还有一个π2(2).为什么不是两个π3(4)啊.旁边那个N原子怎么了.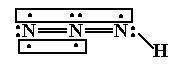
 domoyoqia1年前1
domoyoqia1年前1 -
 幻影2VISION 共回答了21个问题
幻影2VISION 共回答了21个问题 |采纳率90.5%图中从左边看,第一个和第二个N原子都可视为sp杂化,而第三个是sp2杂化.
第一个N原子两个sp杂化轨道,一个容纳孤对电子,另一个与第二个N原子的一个sp杂化轨道形成σ键;第二个N原子的两个杂化轨道其一与第一个N原子杂化轨道形成σ键,另一个与第三个N原子的一个sp2杂化轨道形成σ键;第三个N原子一个sp2杂化轨道与第二个N原子形成σ键,一个sp2杂化轨道与H原子的s轨道形成σ键,剩余一个sp2杂化轨道容纳孤对电子.
第一个和第二个N原子各还有两个与sp杂化轨道互相垂直的p轨道,第一个N原子的两个p轨道各有一个单电子,第二个N原子两个p轨道分别为一个单电子和一对成对电子;而第三个N有一个与三个sp2杂化轨道垂直的p轨道,有一个单电子.
三个N原子的垂直于图中平面的三个p轨道形成π3(4)离域大π键,第一个和第二个N原子的在平面内但垂直于N-N-N的两个p轨道形成π2(2)定域π键.1年前查看全部
- .叠氮酸(HN3)与醋酸同属一元弱酸,且两者的酸性很接近,则下列叙述中不正确的是
.叠氮酸(HN3)与醋酸同属一元弱酸,且两者的酸性很接近,则下列叙述中不正确的是
A.HN3与NH3作用生成的叠氮酸铵(NH4 N3)是弱电解质
B.HN3水溶液中粒子浓度大小顺序为:C(HN3)>C(H+)>C(N3¯ )>C(OH¯ )
C.KN3水溶液中存在以下关系:C(K+) +C (H+) = C(N3¯ ) +C(OH¯ )
D.KN3水溶液中离子浓度大小顺序为:C(K+)>C(N3¯ )>C(OH¯ )>C(H+) 无爱故无怨1年前3
无爱故无怨1年前3 -
 刘建宇 共回答了23个问题
刘建宇 共回答了23个问题 |采纳率95.7%A错误,除极少数反例外,盐类都是强电解质.
B正确,由于水的电离,氢离子浓度会稍微大于叠氮离子.
C正确,这是电荷守恒式.
D正确,由于叠氮离子的水解,钾离子浓度会稍微大于叠氮离子.由于叠氮酸是弱酸,所以叠氮化钾水解显碱性,故氢氧根浓度大于氢离子.1年前查看全部
- C项 NaN3 水溶液中离子浓度大小顺序为 钠离子 大于 叠氮酸根离子 大于 氢离子 大于氢氧根离子 是对的
 emtm781年前1
emtm781年前1 -
 风随波动 共回答了17个问题
风随波动 共回答了17个问题 |采纳率94.1%NaN3跟CH3COONa类似显碱性:即NaN3水N3- + H2O (可逆)= HN3 + OH-
所以离子浓度大小顺序为钠离子大于叠氮酸根离子大于氢氧根离子大于氢离子1年前查看全部
- 叠氮酸和叠氮酸根结构式和共振式是什么?
 万里笑寒1年前1
万里笑寒1年前1 -
 嫣妍JJ 共回答了18个问题
嫣妍JJ 共回答了18个问题 |采纳率83.3%H-N=N=N←→H-N-N≡N
[N=N=N]-←→[N-N≡N]-1年前查看全部
- 叠氮酸(HN3)与醋酸酸性相似 下列错误的是
叠氮酸(HN3)与醋酸酸性相似 下列错误的是
B 项 HN3 与NH3分子作用生成的叠氮酸按是共价化合物 为什么错
C项 NaN3 水溶液中离子浓度大小顺序为 钠离子 大于 叠氮酸根离子 大于 氢离子 大于氢氧根离子 是对的
为什么 电荷就不守恒了呀! 六瑟耳儿1年前1
六瑟耳儿1年前1 -
 xwq128312 共回答了22个问题
xwq128312 共回答了22个问题 |采纳率95.5%醋酸铵是离子化合物噻,既然都说了叠氮酸(HN3)与醋酸相似
不必太深究,就根据出题人说叠氮酸(HN3)与醋酸酸性相似的意图:则同理生成的叠氮酸铵也是离子化合物1年前查看全部
- 叠氮酸的的杂化方式~
 领先一1年前2
领先一1年前2 -
 qingqingcao1981 共回答了16个问题
qingqingcao1981 共回答了16个问题 |采纳率87.5%在HN3分子中,三个N原子以直线相连,H-N键与N-N-N键间的夹角为110°51',显然靠近H原子的第1个N原子是sp2杂化的,第2和第3个N原子都是sp杂化的,在三个N原子间存在着离域的大π 键.HN3中N原子的平均氧化数为-1/31年前查看全部
- 叠氮酸分子结构叠氮酸分子中共用电子对和孤电子对的数目分别为5和3,据此写出叠氮酸分子可能的结构简式我想知道的是5和3 具
叠氮酸分子结构
叠氮酸分子中共用电子对和孤电子对的数目分别为5和3,据此写出叠氮酸分子可能的结构简式
我想知道的是5和3 具体指的哪5对共用电子对,哪3对孤电子对 lurched1年前0
lurched1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•山东模拟)叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
(2012•山东模拟)叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
C.HN3与NH3作用生成的产物是共价化合物
D.
与CO2含相等电子数N −3 hq8141年前1
hq8141年前1 -
 雨之痕2 共回答了14个问题
雨之痕2 共回答了14个问题 |采纳率100%解题思路:叠氮酸(HN3)与醋酸酸性相似,应为弱酸,
A.HN3水溶液呈弱酸性,根据电离特征比较离子浓度大小;
B.NaN3水溶液呈碱性,N3-水解;
C.HN3与NH3作用生成的叠氮酸铵是离子化合物;
D.根据原子的构成判断.A.HN3为弱酸,不能完全电离,电离程度较小,则有c(HN3)>c(H+),溶液呈酸性,则有c(H+)>c(OH-),溶液中还存在水的电离,则有c(H+)>c(N3-),所以有c(HN3)>c(H+)>c(N3-)>c(OH-),故A正确;
B.叠氮酸(HN3)与醋酸酸性相似,醋酸钠溶液呈碱性,则NaN3水溶液呈碱性,存在c(Na+)>c(N3-)>c(OH-)>c(H+),故B正确;
C.HN3与NH3作用生成的叠氮酸铵属于盐,为离子化合物,故C错误;
D.N3-含有电子数为3×7+1=22,CO2含有电子数为6+2×8=22,二者含相等电子数,故D正确.
故选C.点评:
本题考点: 离子浓度大小的比较;弱电解质在水溶液中的电离平衡;盐类水解的应用.
考点点评: 本题考查离子浓度的大小比较,题目难度中等,注意把握题给信息,此为解答该题的关键,易错点为A,注意不能忽视水的电离.1年前查看全部
- 叠氮酸(HN3)与醋酸酸性相似,0.2mol HN3与0.2molNaOH反应后将溶液稀释至500mL,测得溶液pH =
叠氮酸(HN3)与醋酸酸性相似,0.2mol HN3与0.2molNaOH反应后将溶液稀释至500mL,测得溶液pH =a
根据题给数据可以计算该温度下叠氮酸的电离常数Ka,怎么算?
装置从左向右为锥形瓶(发生装置)干燥装置(浓硫酸),集气瓶,NaOH溶液吸收尾气装置 ruoshigeti1年前1
ruoshigeti1年前1 -
 yzh0yw 共回答了17个问题
yzh0yw 共回答了17个问题 |采纳率100%1.Ka=Kw/Kb;
2.c(NaN3)Kb=c(OH-)^2;
已知PH,可求得c(OH-)=10^(a-14);
代入2,得到Kb=2.5*10^(2a-28);
Ka=0.4*10^(14-2a);1年前查看全部
- 氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物.
氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物.
(1)氨可用于制造氮肥、硝酸等.
①合成氨工业中,“造气”有关反应的热化学方程式如下:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.4kJ•mol-1
C(s)+2H2O(g)=CO2(g)+2H2(G)△H2=+90.2kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H3
则△H3=______.
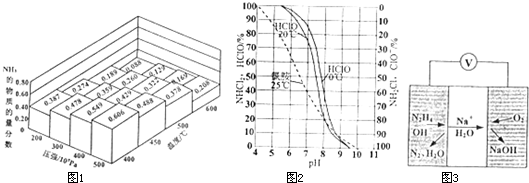
②在一密闭容器中,加入物质的量之比为1:3的N2与H2,在不同温度、压强下测得平衡体系中NH3的物质的量分数如图1所示.则温度为400℃、压强为500×105 Pa时,H2的平衡转化率最接近______(填序号).
A.89%B.75%
C.49%D.34%
③实际生产中,合成氨的温度一般控制在400~500℃,选择该温度范围的理由是______.
④饮用水氯化消毒时若水中含有氨则会产生氯胺(NH2Cl、NHCl2等),氯胺水解缓慢释放出HClO,有良好的消毒效果.图2是饮用水氯化消毒时有关成分的含量与pH的关系.下列说法正确的是______(填序号).
A.HCIO在20℃的电离程度一定大于0℃的电离程度
B.pH越大,消毒效果越好
C.用NH2Cl消毒时,平衡NH2Cl+H2O⇌NH3+HClO向右移动
(2)肼可用于火箭燃料、制药原料等.
①次氯酸钠与过量的氨反应可以制备肼,该反应的化学方程式为______.
②一种肼燃料电池的工作原理如图3所示.该电池工作时负极的电极反应式为______.
③肼与亚硝酸(HNO2)反应可生成叠氮酸.8.6g叠氮酸完全分解可放出6.72L氮气(标准状况下),则叠氮酸的分子式为______. 桃布丁1年前1
桃布丁1年前1 -
 我行我素的云 共回答了16个问题
我行我素的云 共回答了16个问题 |采纳率75%解题思路:(1)①根据盖斯定律计算反应热;
②从图中找出此条件下的氨气质量分数,根据三段式进行计算;
③选择适宜的温度,保障反应速率和限度较大;
④A.从图象可看出次氯酸的电离度与温度的关系;
B.从图象可看出pH与次氯酸浓度的关系;
C.由题给信息得出结论;
(2)①次氯酸钠与过量的氨反应制备肼,依据反应物和生成物,结合原子守恒写出化学方程式;
②在碱性电解质中肼失去电子生成氮气和水;
③根据数据计算出N、H的个数比,进而写出化学式.(1)①C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.4kJ•mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(G)△H2=+90.2kJ•mol-1
反应②减去反应①得反应③CO(g)+H2O(g)=CO2(g)+H2(g)△H3
所以,△H3=△H2-△H1=90.2kJ•mol-1-131.4kJ•mol-1=-41.kJ•mol-1
故答案为:-41.2kJ•mol-1;
②从图中可看出,在温度为400℃、压强为500×105 Pa时,氨气的物质的量分数为0.606
设氢气的转化率为x,则
N2 +3H2 =2NH3
起始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
[2x
(1−x)+(3−3x)+2x=0.606
解得:x≈0.75;
故答案为:B;
③合成氨反应是放热反应,温度太高,NH3物质的量分数降低;温度太低,反应速率太慢;
此400-500℃温度范围内,催化剂活性最高,为保障反应速率和限度较大、催化剂的活性大,要选择适宜的温度400-500℃;
故答案为:温度太高,NH3物质的量分数降低;温度太低,反应速率太慢;此温度范围内,催化剂活性最高;
④A.从图象可看出,在20℃时次氯酸的含量大于0℃次氯酸的含量,故20℃时次氯酸的电离小于0℃次氯酸的电离,故A错误;
B.从图象可看出pH与次氯酸浓度的关系:pH越大,次氯酸的浓度越小,所以消毒效果越差,故B错误;
C.由题给信息可知,氯胺水解缓慢释放出HClO,有良好的消毒效果,所以平衡右移,故C正确;
故选C;
(2)①次氯酸钠与过量的氨反应制备肼,氨气被氧化为肼,本身被还原为氯离子,
结合原子守恒配平写出化学方程式为:NaClO+2NH3═N2H4+NaCl+H2O;
故答案为:NaClO+2NH3═N2H4+NaCl+H2O;
②在碱性电解质中肼失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O;
故答案为:N2H4-4e-+4OH-=N2+4H2O;
③8.6g叠氮酸完全分解可放出6.72L氮气,可知8.6g叠氮酸中含N的物质的量为:
6.72L/22.4L/mol×2=0.6mol,
含H的物质的量为:
8.6g−0.6mol×14g/mol
1g/mol]=0.2mol,n(N):n(H)=0.6:0.2=3:1,所以叠氮酸的分子式为HN3;
故答案为:HN3.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学电源新型电池;化学平衡的调控作用;化学平衡的计算.
考点点评: 本题考查了盖斯定律的计算、反应条件的选择、平衡的计算及方程式、电极反应式的书写、推断分子式,难度适中.本题所给图表较多,要正确分析利用图表信息.1年前查看全部
- 叠氮酸第二个氮是SP杂化,但两个sp轨道为什么会是sp(1)的电子构型?在杂化之前难道S轨道电子有跃迁?
 wb871年前1
wb871年前1 -
 Ys_hmily 共回答了15个问题
Ys_hmily 共回答了15个问题 |采纳率93.3%对.有这种理论,说s轨道满电子后,进行sp(n)杂化时,s轨道成对电子先跃迁为p轨道单电子,在进行杂化.叠氮酸就是如此.1年前查看全部
- 叠氮酸(HN3)与醋酸酸性相似,0.2mol HN3与0.2molNaOH反应后将溶液稀释至500mL,测得溶液pH =
叠氮酸(HN3)与醋酸酸性相似,0.2mol HN3与0.2molNaOH反应后将溶液稀释至500mL,测得溶液pH =a
根据题给数据可以计算该温度下叠氮酸的电离常数Ka,怎么算? jayveno1年前1
jayveno1年前1 -
 jobjob510 共回答了13个问题
jobjob510 共回答了13个问题 |采纳率84.6%NaN3===Na+ + N3-;N3- + H2O === HN3 + OH-
0.2/0.5=0.4mol/L;.0.4.x.x
pH=a=14+lgx
Kh=xx/0.4
Ka=Kw/Kh1年前查看全部
- 为什么氨水显碱性而叠氮酸显酸性
 xiaohaowen1年前1
xiaohaowen1年前1 -
 孤岛残客 共回答了16个问题
孤岛残客 共回答了16个问题 |采纳率87.5%NH3中N有孤对电子,可以吸引结合H+,所以显碱性
HN3中3个N原子参与形成离域π键,H易解离1年前查看全部
- 下列化合物热稳定性最高的是 叠氮酸钠 叠氮酸银 叠氮酸铅 叠氮酸钡
 kvwo1231年前1
kvwo1231年前1 -
 孤山探梅 共回答了25个问题
孤山探梅 共回答了25个问题 |采纳率92%叠氮酸钠1年前查看全部
- 叠氮酸的酸根中3个N都是sp杂化,为什么结合氢离子以后,第一个N就变成sp2杂化?而且HN3中离域键也比酸根中
 cdedj1年前1
cdedj1年前1 -
 lh2004 共回答了4个问题
lh2004 共回答了4个问题 |采纳率N3 - 与CO2是等电子体,所以都是2个pi3 4
而HN3和CO2就不是等电子体了,原子个数不同
然后画画图可发现(百度百科查“叠氮酸”有图)跟H连接的那个N变成了SP2杂化,而另外两个都还是SP。所以是pi 2 2和pi 3 41年前查看全部
- 叠氮酸(HN3)与醋酸酸性相似,下列叙述中一定错误的是( )
叠氮酸(HN3)与醋酸酸性相似,下列叙述中一定错误的是( )
A. HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
B. HN3与NH3作用生成的叠氮酸铵是共价化合物
C. NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
D. N3-与CO2含相等电子数 amalgamation1年前1
amalgamation1年前1 -
 fdas87fd5as 共回答了16个问题
fdas87fd5as 共回答了16个问题 |采纳率100%解题思路:A.HN3为弱酸,在水溶液中极少部分电离生成氢离子和酸根离子,导致溶液呈酸性;
B.叠氮酸铵中叠氮酸根离子和铵根离子之间存在离子键;
C.叠氮酸钠为强碱弱酸盐,其溶液呈碱性,但叠氮酸根离子水解程度较小;
D.叠氮酸根离子和二氧化碳都含有22个电子.A.HN3为弱酸,在水溶液中极少部分电离生成氢离子和酸根离子,导致溶液呈酸性,水也电离生成氢离子,所以溶液中离子浓度大小顺序是:c(HN3)>c(H+)>c(N3-)>c(OH-),故A正确;
B.叠氮酸铵中叠氮酸根离子和铵根离子之间存在离子键,所以为离子化合物,故B错误;
C.叠氮酸钠为强碱弱酸盐,其溶液呈碱性,但叠氮酸根离子水解程度较小,所以离子浓度大小顺序是c(Na+)>c(N3-)>c(OH-)>c(H+),故C正确;
D.叠氮酸根离子和二氧化碳都含有22个电子,所以其电子数相等,故D正确;
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查弱电解质电离、物质结构等知识点,根据物质性质及溶液酸碱性确定离子浓度大小,会正确计算分子或离子中电子数,题目难度不大.1年前查看全部
大家在问
- 1《诗经采薇(节选)》表达了作者怎样的思想感情
- 2由牛顿问题的方法解:一片匀速生长的草地,可供20匹马吃10天,24匹马吃6天,几匹
- 3下列有关化学键的叙述,正确的是 A.离子化合物中一定含有离子键 B.单质分子均不存在化学键 C.共价化合物一定只含有极性
- 4把一枚硬币掷三次,三次都出现正面的概率为( ) A. B. C. D.
- 5小孩子爱听故事为什么?我会的故事都讲过了,怎么办?
- 6扬子鳄是凶猛动物吗?会不会攻击人
- 7逮住的读音是什么
- 8The policeman asked
- 9生物学家根据生物之间的相似程度,把他们划分不同等级,其中______是最大分类单位,______是最基本的分类单位.
- 10(2006•安徽)附加题:下列现象不属于平移的是( )
- 11关于内能、热量等热学知识,下列说法中不正确是( )
- 12I didn't like the cross talk.____ of the actors was funny.
- 13鲁迅《故乡》的最后一段赏析,第一句环境描写的作用,和后面一句的含义
- 14七年级数学题------可能性的大小
- 15请问春秋战国时期诸侯国对于周王朝有什么意义?每一个诸侯国是因为什么才被分封的呢?
