过滤时,需要用到的仪器有哪些?漏斗,烧杯,玻璃棒,量筒,集气瓶,试管,滴管
 一缕绿色阳光2022-10-04 11:39:542条回答
一缕绿色阳光2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 yjf8hh25 共回答了22个问题
yjf8hh25 共回答了22个问题 |采纳率81.8%- 漏斗,烧杯,玻璃棒
- 1年前
 2329710 共回答了16个问题
2329710 共回答了16个问题 |采纳率81.3%- 漏斗,烧杯,玻璃棒,试管,滤纸
- 1年前
相关推荐
- 往某BaCL2溶液中加入密度为1.28/mL硫酸溶液,恰好完全反应后,过滤,测得滤液的质量与对BaCL2溶液的质量相等.
往某BaCL2溶液中加入密度为1.28/mL硫酸溶液,恰好完全反应后,过滤,测得滤液的质量与对BaCL2溶液的质量相等.则所加硫酸溶液的物质的量浓度是多少?
 丑小鸭工作室1年前1
丑小鸭工作室1年前1 -
 静以养心 共回答了20个问题
静以养心 共回答了20个问题 |采纳率85%BaCL2+H2SO4---baso4+hcl
陪平 用书上的例题就可解答
为什么要问?1年前查看全部
- 我的水中锰离子超标了国家饮用水的3倍为0.3mg/L,我用锰砂过滤了,但效果总是不理想,各位有什么好建议的.
我的水中锰离子超标了国家饮用水的3倍为0.3mg/L,我用锰砂过滤了,但效果总是不理想,各位有什么好建议的.
注:我的水的过滤方法是这样的,我用泵把地下水(水是清的,但放置半天就成浑浊了)抽上来的,大概流量每小时是9立方吧!我设有一个晒水装置,大概是高1米半左右吧,用作曝气,跟着晒下来的水直接流到我的锰砂过滤池里,滤池是0.5*0.5*1米,再经过另一个石英砂和活性炭的过滤池里,过滤出来的水是清的,但把那些水放置半天时间就开始出现浑浊了!请问我是在那一个步骤出错了?(如果我这种方法不行的话,那有什么更好的建议了,不过也需要注意一下成本的,我是用于养殖的只想除掉锰离子,但其它的离子不能改变的!)还有要求的是过滤出来的是清水,我每天水用量为50立方吧! ququkaikai1年前1
ququkaikai1年前1 -
 feelings829 共回答了23个问题
feelings829 共回答了23个问题 |采纳率87%曝气部分不充分,用曝气泵加氧.1年前查看全部
- (2014•昆明模拟)向AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一些锌粉,完全反应后过滤.下列说法
(2014•昆明模拟)向AgNO3、Cu(NO3)2和Mg(NO3)2的混合溶液中加入一些锌粉,完全反应后过滤.下列说法正确的是( )
A.滤纸上一定有Ag和Cu
B.滤纸上一定有Ag,可能有Cu、Mg
C.滤液中一定含有Zn(NO3)2、Mg(NO3)2
D.滤液中可能有Cu(NO3)2,滤纸上可能有Ag 坏鱼鱼1年前1
坏鱼鱼1年前1 -
 yuanfang6113 共回答了11个问题
yuanfang6113 共回答了11个问题 |采纳率90.9%解题思路:这类题目有个窍门,就是滤渣中一定会有最不活泼金属的单质,滤液中一定会有最活泼金属的盐溶液,也就是说滤渣中一定有银,滤液中一定有硝酸锌,但是整个过程硝酸镁并不参加反应,因为锌不如镁活泼,所以滤液中还应该有硝酸镁.
“加入一些锌粉”,根据金属活动性顺序镁>锌>铜>银,锌粉不和硝酸镁反应,和硝酸银、硝酸铜发生反应时首先与硝酸银反应,待硝酸银完全反应后继续和硝酸铜进行反应.A、根据金属活动性顺序镁>锌>铜>银,锌粉不和硝酸镁反应,和硝酸银、硝酸铜发生反应时首先与硝酸银反应,待硝酸银完全反应后继续和硝酸铜进行反应,因为锌粉的量未知,所以滤纸上一定有银,但不一定由铜,故说法错误;
B、由A的分析可知滤纸上一定有银,但不一定由铜,一定无镁,故说法错误;
C、根据金属活动性顺序镁>锌>铜>银可知:锌能置换出银所以溶液中一定含有Zn2+、但不能置换出镁所以也一定含有Mg2+,则滤液中一定含有Zn(NO3)2、Mg(NO3)2,故说法正确;
D、由C的分析可知溶液中一定含有Zn2+、Mg2+,而是否含有Ag+、Cu2+由A的分析可知:决定于放入锌粉的量,而滤纸上一定有Ag;故该项错误.
故选:C.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,利用化学反应判断物质组成的题目属于中考常考的知识点,通常在探究题中出现,考察基础知识和化学实验思想,注意仔细审题.1年前查看全部
- 向AgNO3溶液中放入一定量的铁粉和铜粉,充分反应后过滤,向滤渣中滴入稀盐酸,有气泡冒出.则下列对滤渣成分的判断中,正确
向AgNO3溶液中放入一定量的铁粉和铜粉,充分反应后过滤,向滤渣中滴入稀盐酸,有气泡冒出.则下列对滤渣成分的判断中,正确的是( )
A. Fe、Cu、Ag都有
B. 只有Fe和Ag
C. 只有Ag
D. 只有Fe nancylg1年前4
nancylg1年前4 -
 afeng_1982 共回答了16个问题
afeng_1982 共回答了16个问题 |采纳率100%解题思路:根据金属活动性顺序表的应用分析判断.根据题意向滤渣中滴入稀盐酸,有气泡冒出,说明所加入铁粉的量是过量的.向AgNO3的溶液中加入一定量的铁粉和铜粉,在铁和铜同时存在时,由于铁的活泼性大于铜,铁首先与硝酸银反应生成硝酸亚铁和银,铁全部反应完全了,铜再与硝酸银反应.由题意可知,滤渣中加入稀盐酸,发现有气泡产生,则滤渣中含有铁,说明铁是过量的,硝酸银全部与铁参加反应,铜没有参加反应,故滤渣中含有铁、铜和银,滤液中含有硝酸亚铁.由以上分析可知:
A、滤渣成分中含有Fe、Cu、Ag.故A正确;
B、滤渣成分中不仅含有Fe和Ag,还含有Cu,故B不正确;
C、滤渣成分中不只含有Ag,还含有Cu、Fe,故C不正确;
D、滤渣成分中不只含有Fe,还含有Cu、Ag,故D不正确.
故选A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 要除去碳粉中的氧化铜加适量盐酸搅拌过滤可以吗?如不行怎么半
 chen51chen1年前3
chen51chen1年前3 -
 jh8779 共回答了17个问题
jh8779 共回答了17个问题 |采纳率88.2%可以.
C不与盐酸反应,CuO+2HCl=CuCl2+H2O反应生成的CuCl2溶于水,过滤即可.1年前查看全部
- 某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
(1)测定过程中发生反应的化学方程式为______;稀硫酸用量 剩余固体质量 第一次加入10g mg 第二次加入10g 2.0g 第三次加入10g 1.5g 第四次加入10g 1.0g 第五次加入10g 0.6g 第六次加入10g 0.6g
(2)从以上数据可知,最后剩余的0.6g固体的成分是______;这六次实验中,第______次加入稀硫酸时样品中的镁已经完全反应;表格中,m=______.
(3)计算合金样品中镁的质量分数.
(4)计算所用稀硫酸中H2SO4的质量分数. 燕山落雪1年前1
燕山落雪1年前1 -
 冰雨虫 共回答了21个问题
冰雨虫 共回答了21个问题 |采纳率81%解题思路:在金属活动顺序表中镁排在氢前面,而铜排在氢后面,所以将合金放入硫酸中,镁与硫酸反应,而铜与硫酸不反应.由表格中所给数据可得第五次反应后,镁全部反应完,剩余的全部是铜,从而可以得出合金样品中镁的质量分数;根据前四次中任意一次消耗金属的质量计算稀硫酸中溶质的质量,然后根据公式求出溶质质量分数.镁能与硫酸反应,而铜与硫酸不反应,所以我们可以得到当把合金放入硫酸中镁反应质量减少,减少的部分为反应的镁的质量.由表格中所给的数据可知每加入10g硫酸,合金减少0.5g,而在第五次时只减少了0.4g,所以在第五次时镁完全反应,剩余的0.6g为铜的质量.所以3g合金中镁的质量为2.4g.根据表格信息可以看出每消耗10克稀硫酸,就有0.5克金属镁参加反应,进而可以根据镁的质量求出稀硫酸中所含溶质的质量.
故答案为:(1)Mg+H2SO4=MgSO4+H2↑;
(2)铜、五、2.5;
(3)由表格数据分析可知,0.6g为铜的质量,所以3g合金中镁的质量为2.4g;
合金样品中镁的质量分数为:[2.4g/3g]×100%=80%.
(4)设10克稀硫酸中所含H2SO4的质量为x.
Mg+H2SO4=MgSO4+H2↑
24 98
0.5g x
[24/0.5g=
98
x]
x=2.04g
稀硫酸的溶质质量分数=
2.04g
10g×100%=20.4%.点评:
本题考点: 金属的化学性质;实验数据处理或者误差分析的探究;金属活动性顺序及其应用.
考点点评: 表格题关键是能够通过图中所给的数据,分析出完全反应的点,同时由表格中的数据得到想要的信息,学会分析表格是关键.1年前查看全部
- 向氯化铜溶液中加入一定量的锌粉充分反应后过滤,下列情况可能出现的是( )
向氯化铜溶液中加入一定量的锌粉充分反应后过滤,下列情况可能出现的是( )
①滤液中只有Zn2+,滤渣为Zn
②滤液中有Zn2+、Cu2+,滤渣为Cu
③滤液中有Zn2+、Cu2+,滤渣为Zn
④滤液中只有Zn2+,滤渣为Zn、Cu.
A.①②
B.②③
C.②④
D.③④ scacrise1年前1
scacrise1年前1 -
 贝壳壳 共回答了19个问题
贝壳壳 共回答了19个问题 |采纳率100%解题思路:在金属活动顺序表中锌的活动性比铜强,向CuCl2溶液加入一定量的锌粉,锌粉置换氯化铜中的铜得到铜和氯化锌,根据加入锌粉的量,分析氯化铜完全反应还是部分反应,是判断可能出现情况的根本依据.①溶液只有 Zn2+不溶物为Zn,因为加入的锌粉一定会与氯化铜反应而得到铜,固体中一定含有铜,因此该情况不可能出现;
②若加入锌粉的量不足,氯化铜部分被置换,则溶液中含有氯化铜和氯化锌,所得固体只含有铜,即溶液中有Zn2+、Cu2+,不溶物为Cu;故该情况有可能;
③溶液中有Zn2+、Cu2+,不溶物为Zn,因为锌会继续与氯化铜发生反应,故该情况不可能出现;
④若加入锌粉的过量,氯化铜全部被置换,则溶液中只含有氯化锌,所得固体含有铜及剩余的锌粉,即溶液中只有Zn2+,不溶物为Zn、Cu;故该情况有可能.
故选C点评:
本题考点: 金属的化学性质.
考点点评: 在金属活动性顺序中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来,这是解决此类题的关键所在.1年前查看全部
- 净水的习题静置,吸附,过滤,蒸馏 中净水效果由高到低的顺序是( ).综合运用上述( )项净水效果较好,其先后顺序是( )
净水的习题
静置,吸附,过滤,蒸馏 中净水效果由高到低的顺序是( ).综合运用上述( )项净水效果较好,其先后顺序是( )
第二个括号中,应该填4吧.因为后面让排先后顺序啊. 受伤的熊1年前1
受伤的熊1年前1 -
 g4ken 共回答了12个问题
g4ken 共回答了12个问题 |采纳率83.3%过滤 蒸馏 吸附 静置
蒸馏最好 顺序是 静置 过滤 吸附 蒸馏1年前查看全部
- 某同学将浑浊的湖水样品倒入烧杯中,先加入白色粉末搅拌溶解,静置一会后,用下列图1所示的装置进行过滤,请问:
 某同学将浑浊的湖水样品倒入烧杯中,先加入白色粉末搅拌溶解,静置一会后,用下列图1所示的装置进行过滤,请问:
某同学将浑浊的湖水样品倒入烧杯中,先加入白色粉末搅拌溶解,静置一会后,用下列图1所示的装置进行过滤,请问:
(1)白色粉末的名称是______.
(2)如图中还缺少的一种仪器,该仪器的作用是______.
(3)过滤后发现,滤液仍浑浊,可能的原因是______.(一种即可)
(4)改进后过滤,得到了澄清透明的水,这种水是______(填纯净物、混合物)
(5)他按图2将该水电解:______(填甲或乙)试管里产生的是氧气. admy1年前1
admy1年前1 -
 来了3 共回答了21个问题
来了3 共回答了21个问题 |采纳率95.2%解题思路:根据已有的知识进行分析,净化水时可以加入明矾;根据过滤操作的仪器以及过滤操作注意事项进行分析;电解水时产生的氧气体积较小,据此解答.(1)加入的白色粉末是明矾,故填:明矾;
(2)过滤操作中需要使用玻璃棒进行引流,故填:引流;
(3)过滤后的滤液仍然浑浊,可能是滤纸破损,也可能是液面高于滤纸边缘,还可能是仪器本身不干净,故填:滤纸破损;
(4)过滤得到的水中仍然含有可溶性杂质,是混合物,故填:混合物;
(5)观察图示可以看出,乙管内得到的气体体积较小,是氧气,故填:乙.点评:
本题考点: 水的净化;过滤的原理、方法及其应用;电解水实验.
考点点评: 本题考查了净水以及电解水的知识,完成此题,可以依据已有的知识进行.1年前查看全部
- .33.2g KClO3和MnO2的混合物,加热一段时间后,质量变为28.4g.冷却后加水搅拌,溶解完全后过滤,在滤液中
.33.2g KClO3和MnO2的混合物,加热一段时间后,质量变为28.4g.冷却后加水搅拌,溶解完全后过滤,在滤液中加硝酸银.滤纸上的不溶物与足量的浓盐酸反应,可生成0.1molCl2,求:
(1)KClO3的分解百分率.
(2)可生成AgCl沉淀的质量. zhutianren1年前1
zhutianren1年前1 -
 gujienanhai88 共回答了14个问题
gujienanhai88 共回答了14个问题 |采纳率78.6%(2) 氯酸钾分2KClO3=(Δ/MnO2)=2KCl+3O2↑
Δm=m(O2)=33.2-28.4=4.8g 则n(O2)=0.15mol 推得n(KCl)=0.15×2/3=0.1mol
加水后,滤液中溶解有生成的KCl,则生成AgCl沉淀物质的量与KCl相同.
n(AgCl)=0.1mol m(AgCl)=14.35g
(1) 2步骤中先加水滤出的沉淀是MnO2,方程式:MnO2+4HCl(浓)=(加热)=MnCl2+Cl2↑+2H2O
生成n(Cl2)=0.1mol,则n(MnO2)=0.1mol 推得m(MnO2)=8.7g
原混合物质量为33.2g,分解后剩余28.4g,
则总m(KClO3)=33.2-8.7g=24.5g,
分解的m(KClO3)=0.1×122.5=12.25g
则分解率(用质量算)=12.25/24.5=50%1年前查看全部
- 验纯 洗涤氢气点燃前要验纯.怎么验纯?那带火星的木条点燃!过滤出来的晶体要洗涤.怎么洗涤!拿水冲洗!感觉这两步骤有点矛盾
验纯 洗涤
氢气点燃前要验纯.怎么验纯?那带火星的木条点燃!过滤出来的晶体要洗涤.怎么洗涤!拿水冲洗!感觉这两步骤有点矛盾啊.( ̄. ̄) 小画1年前1
小画1年前1 -
 青萝佛行衣 共回答了22个问题
青萝佛行衣 共回答了22个问题 |采纳率100%检验氢气纯度的操作方法是:用向下排空气法或排水法收集一试管氢气,集满氢气的试管用拇指堵住管口,管口朝下,立即移近酒精灯火焰,点燃试管里的氢气.点火后,根据声音判断氢气是否纯净,如果听到的是尖锐的爆鸣声,则表示氢气不纯,必须重新收集进行检验,直至听到“噗”的声音,才表明收集的氢气已经纯净,可以使用.重新收集氢气检验时,应另换一支试管进行操作,若仍使用原试管,要先用拇指堵住试管口一会儿,然后再去收集氢气进行点火验纯.
你说的拿带火星的木条点燃(应该是复燃)是检验氧气存在的.
洗涤的话不一定是水,洗涤主要去除杂质,一般是用能很好的溶解杂质又不溶解你要的产物的溶剂,如果水能溶解你的产物,用水的话那产物就没了,不白做了吗1年前查看全部
- 用什么方法证明水不是蒸馏水自来水厂对自来水的净化过程可表示为:河水→沉淀→过滤→杀菌消毒→自来水.现在有一瓶伪劣的水,用
用什么方法证明水不是蒸馏水
自来水厂对自来水的净化过程可表示为:河水→沉淀→过滤→杀菌消毒→自来水.现在有一瓶伪劣的水,用什么化学试验方法证明它是水而不是蒸馏水. lonelywing1年前1
lonelywing1年前1 -
 IT鳌头 共回答了21个问题
IT鳌头 共回答了21个问题 |采纳率85.7%加硝酸银和稀硝酸
检验氯离子1年前查看全部
- 一直没弄懂:分离和提纯是同时进行的吗?像过滤,蒸发,蒸馏,萃取,分液这些方法到地属于分离还是提纯?(如果分离和提纯是同时
一直没弄懂:分离和提纯是同时进行的吗?像过滤,蒸发,蒸馏,萃取,分液这些方法到地属于分离还是提纯?(如果分离和提纯是同时进行的,那就既属于分离又属于提纯了?)
————————(我是弱弱的分割线)——————
我的问题有些弱,望大神们见谅,谢 小-黑1年前1
小-黑1年前1 -
 冰颖雪花 共回答了17个问题
冰颖雪花 共回答了17个问题 |采纳率82.4%这取决于你需要的是什么,只要其中一种 就叫提纯.两种物质都要 就叫分离了1年前查看全部
- 简述过滤的实验操作50字左右
 phoenix_d_lee1年前1
phoenix_d_lee1年前1 -
 潘趣酒 共回答了18个问题
潘趣酒 共回答了18个问题 |采纳率94.4%实验仪器
漏斗、烧杯、玻璃棒、铁架台(含铁圈)、滤纸.
操作要领
要做到“一贴、二低、三靠”.
一贴
即滤纸紧贴漏斗内壁.
二低
1.滤纸边缘低于漏斗边缘.
2.液面低于滤纸边缘.
三靠
1.盛混合物的烧杯紧靠玻璃棒.
2.玻璃棒下端紧靠滤纸三层处.
3.漏斗下端管口紧靠烧杯内壁.1年前查看全部
- 小雨同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,采用如图所示装置进行过滤,请回答过滤后仍然浑浊的
 小雨同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,采用如图所示装置进行过滤,请回答过滤后仍然浑浊的原因是什么?(至少写出三条)
小雨同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,采用如图所示装置进行过滤,请回答过滤后仍然浑浊的原因是什么?(至少写出三条)  步履无需匆匆1年前1
步履无需匆匆1年前1 -
 janesn 共回答了15个问题
janesn 共回答了15个问题 |采纳率80%解题思路:根据过滤(“一贴、二低、三靠”的原则)操作的注意事项进行分析解答即可.过滤后滤液仍浑浊,可能原因是滤纸破损(会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊)、液面高于滤纸边缘(会使部分液体未经过滤纸的过滤直接流下,该操作会使滤液仍然浑浊)或盛接滤液的烧杯不干净等.
故答案为:(1)滤纸破损;(2)液面高于滤纸边缘;(3)仪器不干净.
故答案为:(1)滤纸破损;(2)滤液边缘高于滤纸边缘;(3)盛接滤液的烧杯不干净.点评:
本题考点: 过滤的原理、方法及其应用.
考点点评: 本题难度不大,掌握过滤操作(“一贴、二低、三靠”的原则)的注意事项等即可正确解答本题.1年前查看全部
- 一定质量的铁粉加入盐酸和氯化铜混合溶液中,反应完全后过滤,称得滤渣的质量与所加的铁粉质量相同,则混合溶液中盐酸和氯化铜两
一定质量的铁粉加入盐酸和氯化铜混合溶液中,反应完全后过滤,称得滤渣的质量与所加的铁粉质量相同,则混合溶液中盐酸和氯化铜两溶质的分子个数比为____.为什么是8:27?
 小潼天天天蓝1年前2
小潼天天天蓝1年前2 -
 巴黎人7512 共回答了15个问题
巴黎人7512 共回答了15个问题 |采纳率93.3%①Fe+Cucl2=FeSO4+Cu; ②Fe+2HCl=FeCl2+H2↑(基本上反应①先于②发生)
因为铁粉质量未知所以有三种情况符合题意:
一 铁粉与Cucl2反应完全后,剩下的铁粉与盐酸正好完全反应.这种情况下1molFe(56g)消耗1molCucl2生成1molCu(64g),固体质量增加了8g;所以还应消耗8gFe与盐酸恰好完全反应,计算得盐酸物质的量为2*8/56,即2/7mol,所以盐酸和氯化铜两溶质的分子个数比为是2/7,质量比则是8:27;题目中的8:27是误把分子个数比认为是质量比;
二 铁粉大大过量,铁粉与氯化铜和盐酸反应完全后,还剩下铁粉.此种情况说明溶液中盐酸正好是2/7mol,最终计算结果也是2/7;
三 盐酸大大过量,铁粉被氯化铜和盐酸消耗后,还剩盐酸.此种情况下1molFe(56g)消耗1molCucl2生成1molCu(64g),固体质量增加了8g;所以还应消耗8gFe与盐酸反应.符合题中的“称得滤渣的质量与所加的铁粉质量相同”条件,盐酸过量,故盐酸的量未知,所以无法计算.1年前查看全部
- 化学过滤中,一帖二低三靠,是为了避免什么
 applexiapingappl1年前2
applexiapingappl1年前2 -
 恩赫杜亚纳 共回答了19个问题
恩赫杜亚纳 共回答了19个问题 |采纳率94.7%一贴:过滤时,为了保证过滤速度快,而且避免液体顺着漏斗与滤纸间的夹缝流下,滤纸应紧贴漏斗内壁,且中间不要留有气泡.
二低:如果滤纸边缘高于漏斗边缘,过滤器内的液体极有可能溢出;如果漏斗内液面高于滤纸边缘,液体也会顺着漏斗与滤纸间的夹缝流下,这样都会导致过滤失败.
三靠:倾倒液体的烧杯口要紧靠玻璃棒,是为了使液体顺着玻璃棒缓缓流下,避免了液体飞溅;玻璃棒下端如果紧靠一层滤纸处,万一玻璃棒把湿的滤纸戳破,液体就会顺着漏斗与滤纸间的夹缝流下,导致过滤失败,而靠在三层滤纸处则能避免这一后果;漏斗下端管口的尖嘴要紧靠承接滤液的烧杯内壁,可以使滤液顺着烧杯内壁流下,避免了滤液从烧杯中溅出.
总之,“一贴、二低、三靠”,都是为了保证过滤实验操作成功.1年前查看全部
- 为什么要在热溶液中沉淀BaSO4?但要在冷却后过滤?晶形沉淀为何要沉化(陈化的目的)?
 xiang_cha20011年前3
xiang_cha20011年前3 -
 瓶中秀 共回答了24个问题
瓶中秀 共回答了24个问题 |采纳率91.7%楼上的同志答非所问.热溶液中沉淀BaSO4的目的是增大产生晶核时硫酸钡溶解度,降低过饱和度,避免沉淀过于细碎,在冷却后过滤,使沉淀更完全.陈化的目的是通过溶剂的溶解-结晶过程减少杂质的吸附和裹夹,纯化沉淀.1年前查看全部
- (2014•衡阳模拟)将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里搅拌使其充分反应后过滤,滤纸上留下的金属
(2014•衡阳模拟)将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里搅拌使其充分反应后过滤,滤纸上留下的金属是( )
A.Ag
B.Fe、Zn
C.Fe、Ag
D.Ag、Zn、Fe 1652897021年前1
1652897021年前1 -
 GeeBee1980 共回答了17个问题
GeeBee1980 共回答了17个问题 |采纳率94.1%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.在金属活动性顺序中,锌>铁>银,将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里,铁能与硝酸银发生置换反应生成银,不能与硝酸锌发生置换反应,由于铁过量,充分反应后铁有剩余,故滤纸上留下的金属是铁和银,
A、铁过量,一定有铁,故A错误;
B、铁不能与硝酸锌发生反应,一定不会有锌,故B错误;
C、铁过量,一定有铁,铁能与硝酸银发生置换反应生成银,一定有银,故C正确;
D、铁不能与硝酸锌发生反应,一定不会有锌,故D错误;
故选C.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 雨过天晴,天空和大地多像过滤过似的,格外清新
雨过天晴,天空和大地多像过滤过似的,格外清新
改病句 任澈诺1年前8
任澈诺1年前8 -
 西南东北 共回答了22个问题
西南东北 共回答了22个问题 |采纳率95.5%雨过天晴,空气多像过滤过似的,格外清新1年前查看全部
- 下列各组混合物按溶解、过滤、蒸发的操作顺序进行分离的是( )
下列各组混合物按溶解、过滤、蒸发的操作顺序进行分离的是( )
A. 水和花生油
B. 蔗糖和泥沙
C. 面粉和泥沙
D. 蔗糖和食盐 XIaobing1111年前1
XIaobing1111年前1 -
 ee19成仁 共回答了20个问题
ee19成仁 共回答了20个问题 |采纳率90%解题思路:按照“溶解、过滤、蒸发”的步骤进行分离的物质,必须需要满足两种固体物质的溶解性不同,必须具备:一种不能溶于水,另一种物质能溶于水.A、水和花生油均是液体,不能按溶解、过滤、蒸发的操作顺序分离,故选项错误.
B、蔗糖易溶于水,而泥沙不溶于水,能按溶解、过滤、蒸发的操作顺序分离,故选项正确.
C、面粉和泥沙均难溶于水,不能按溶解、过滤、蒸发的操作顺序分离,故选项错误.
D、蔗糖和食盐均易溶于水,不能按溶解、过滤、蒸发的操作顺序分离,故选项错误.
故选:B.点评:
本题考点: 混合物的分离方法.
考点点评: 本题考查了混合物的分离,理解过滤的原理(是将不溶于液体的固体分离的方法)、掌握常见物质的溶解性是正确解答此类题的关键.1年前查看全部
- 取12.5g含杂质的石灰石,加到100g稀盐酸中恰好完全反应,过滤得滤液105.6g,则该石灰石的纯度为
 天下第一5211年前2
天下第一5211年前2 -
 ze123456 共回答了14个问题
ze123456 共回答了14个问题 |采纳率100%百分之八十
溶液中增加的质量其实是CaO的质量 因为碳酸钙和盐酸反应 二氧化碳挥发 真正留下来的是氧化钙
105.6-100=5.6 也就是说氧化钙5.6g 也就是0.1mol
所以碳酸钙有0.1mol 也就是10g
10/12.5=80%1年前查看全部
- 鉴别溶液和胶体最简单的方法是(过滤,还是电泳,还是丁铎尔现象,还是渗析)呢?
 TianYaClubber1年前1
TianYaClubber1年前1 -
 sdakejgrth 共回答了16个问题
sdakejgrth 共回答了16个问题 |采纳率81.3%既然问使用最简单的方法,就是不适用仪器或复杂的化学方法就可以容易判别的方法.答案中的四种方法,都可以鉴别电解质与胶体溶液,只有C丁达尔效应最简单,只用小手电筒即可.1年前查看全部
- 将KClO 3 和MnO 2 的混合物15.5克,加热完全反应后,剩余固体加水溶解,过滤,洗涤不溶物,洗涤液与滤液合并,
将KClO 3 和MnO 2 的混合物15.5克,加热完全反应后,剩余固体加水溶解,过滤,洗涤不溶物,洗涤液与滤液合并,得100克溶质质量分数为7.45%的溶液,
求:
(1)产生O 2 的质量;
(2)原混合物中MnO 2 的质量。 swq5021年前0
swq5021年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如图是实验室进行过滤操作的装置图,请回答下列问题.
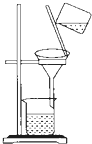 如图是实验室进行过滤操作的装置图,请回答下列问题.
如图是实验室进行过滤操作的装置图,请回答下列问题.
(1)过滤适用于分离______的混合物.
(2)过滤的操作要领可归纳为“一贴、两低、三靠”,其中“一贴”指______,否则会______.
(3)如果漏斗内的液面高于滤纸的边缘了,其后果是______.
(4)漏斗下端的管口要紧靠在烧杯______,作用是______.
(5)过滤过程中,玻璃棒的作用是______. wunaiOK1年前1
wunaiOK1年前1 -
 hbs6688 共回答了16个问题
hbs6688 共回答了16个问题 |采纳率81.3%解题思路:根据过滤的原理及注意的事项分析分析回答.过滤液体时,要注意一贴二低三靠的原则.熟悉常用仪器的用途.(1)过滤适用于分离液固混合物;
(2)过滤的操作要领可归纳为“一贴、两低、三靠”,“一贴”指滤纸紧贴漏斗的内壁,否则会使过滤的速率变慢;
(3)如果漏斗内的液面高于滤纸的边缘了,其后果是液体会从滤纸和漏斗之间流下,使滤液浑浊;
(4)漏斗下端的管口要紧靠在烧杯的内壁,作用是:防止液体迸溅;
(5)过滤过程中,玻璃棒的作用是引流.
故答为:(1)液固;(2)滤纸紧贴漏斗的内壁,使过滤的速率变慢;(3)滤液浑浊;(4)内壁,防止液体迸溅;(5)引流.点评:
本题考点: 过滤的原理、方法及其应用.
考点点评: 本题比较全面地考查了过滤操作,完成此题,可以依据已有的知识进行,要求同学们熟记过滤操作,以便灵活运用.1年前查看全部
- 把一定量的稀硫酸倒入盛有氧化铜和过量的铁粉的是试管微热,静置片刻后过滤,滤纸上留下的物质一定有———
把一定量的稀硫酸倒入盛有氧化铜和过量的铁粉的是试管微热,静置片刻后过滤,滤纸上留下的物质一定有———
滤纸上可能有的物质是———,滤液中留有溶质的是—————— 长一下1年前2
长一下1年前2 -
 homepeng 共回答了17个问题
homepeng 共回答了17个问题 |采纳率94.1%滤纸上可能有的物质是Cu 和Fe
滤液中留有溶质的是FeSO41年前查看全部
- 说明原因在铁粉和氧化铜粉的混合物中,加水一定质量的稀硫酸,充分反应后过滤,在滤渣中加入稀盐酸有气泡产生,下列说法正确的是
说明原因
在铁粉和氧化铜粉的混合物中,加水一定质量的稀硫酸,充分反应后过滤,在滤渣中加入稀盐酸有气泡产生,下列说法正确的是 ( ) A 滤渣中一定有Fe,可能含有Cu B 滤渣中一定含有Fe和Cu yzw19831年前1
yzw19831年前1 -
 未来的爱好 共回答了20个问题
未来的爱好 共回答了20个问题 |采纳率95%B 滤渣中一定含有Fe和Cu
氧化铜先与稀硫酸反应 CuO+H2SO4==CuSO4+H2O
铁再置换铜 Fe+CuSO4==FeSO4+Cu
最后铁再置换氢 Fe + H2SO4 === FeSO4 + H2↑
在滤渣中加入稀盐酸有气泡产生,说明滤渣中有铁,铜与盐酸不反应
所以 滤渣中一定含有Fe和Cu1年前查看全部
- 向铁粉和氧化铜的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入铁片,有气泡产生,则滤渣中一定含有____
向铁粉和氧化铜的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入铁片,有气泡产生,则滤渣中一定含有______;氧化铜与稀硫酸反应的化学反应方程式为______.实验室用浓硫酸配制一定量的稀硫酸,正确操作是将______,并不断搅拌.  rosemarying1年前1
rosemarying1年前1 -
 baoyuhai 共回答了19个问题
baoyuhai 共回答了19个问题 |采纳率84.2%根据氧化铜与硫酸反应生成硫酸铜和水;铁与硫酸反应生成硫酸亚铁和氢气;由题目给出的信息可知:向滤液中插入薄铁片,有气泡产生,说明滤液中一定含有硫酸,没有硫酸铜;也说明铁把硫酸铜中的铜置换出来,因此固体中一定有铜,其中氧化铜和硫酸反应的方程式为CuO+H 2 SO 4 =CuSO 4 +H 2 O;浓硫酸溶于水会释放大量的热,可能会溅出伤人,所以用浓硫酸配制一定量的稀硫酸时,要把浓硫酸沿容器壁慢慢注入水中,并不断搅拌.
故答案为:铜;CuO+H 2 SO 4 =CuSO 4 +H 2 O;要把浓硫酸沿容器壁慢慢注入水中;1年前查看全部
- 悬浊液的分散质可用过滤的方法从分散剂中分离出来 为什么这句话是对的
 lihaitie1年前1
lihaitie1年前1 -
 orgasmo1337 共回答了12个问题
orgasmo1337 共回答了12个问题 |采纳率91.7%当然是对的.
其定义为:
分散质粒子大于100纳米的固体小颗粒悬浮于液体里形成的混合物叫悬浊液,如泥水等.在这个粒径范围内,还包括了乳浊液,
乳浊液定义:由两种不相溶的液体所组成的分散系,即一种液体以小液滴的形式分散在另外一种液体之中形成的混合物叫乳浊液,如牛奶.
所以,要弄明白其与乳浊液的本质区别,那就是它们的分散质分别为:悬浊液是固体小颗粒,乳浊液是小液滴.
综上:悬浊液是固液体系,可以通过过滤的方法分离;而乳浊液却不可以通过过滤的方法分离.1年前查看全部
- 20℃时,向71克溶质的质量分数为20%的硫酸钠溶液中加入氯化钠和氯化钡的混合物30.6克,搅拌后恰好完全反应.过滤.
20℃时,向71克溶质的质量分数为20%的硫酸钠溶液中加入氯化钠和氯化钡的混合物30.6克,搅拌后恰好完全反应.过滤.
⑴求所得滤液中溶质的质量分数.
⑵求过滤后所得滤渣的质量.(20℃氯化钠的溶解度为36克,保留一位小数) 泡泡33661年前1
泡泡33661年前1 -
 八月妖儿 共回答了22个问题
八月妖儿 共回答了22个问题 |采纳率81.8%71g*20%=14.2g 71g-14.2g=56.8g
Na2SO4+BaCl2=BaSO4+2NaCl
142 208 233 117
14.2g x y z
142/14.2g=208/x=233/y=117/z
x=20.8g
y=23.3g
z=11.7g
氯化钠质量 11.7g+(30.6g-20.8g)=21.5g
反应后氯化钠有析出,形成饱和溶液.
所得滤液中溶质的质量 56.8g*36g/100g=20.448g1年前查看全部
- 为解压过滤举几个例子,2.纸层析法分离铁离子和铜离子实验中,展开剂的成分为丙酮。为什么?3.如何分离硝酸钾和氯化钠?
 wzsisgood1231年前1
wzsisgood1231年前1 -
 本-科尔 共回答了18个问题
本-科尔 共回答了18个问题 |采纳率72.2%第一个我看不太懂你的意思,其实很多都可以减压过滤的,特别是在强调得到干燥固体和速率方面,优先选择减压过滤第二个因为丙酮是有机物,不溶于水,所以在上升的过程中不会留在底部,同时由于两种离子在其中的溶解度不同,...1年前查看全部
- 某化学探究小组称取6g镁铜合金样品于烧杯中,然后将80g稀硫酸分四次加入,充分反映后过滤,洗涤,干燥,称重,得到的实验过
某化学探究小组称取6g镁铜合金样品于烧杯中,然后将80g稀硫酸分四次加入,充分反映后过滤,洗涤,干燥,称重,得到的实验过程中有关物质的用量及质量测定记录如下.
第一次加入稀硫酸的质量 20g
剩余固体的质量4.8g
第二次加入稀硫酸的质量 20g
剩余固体的质量mg
第三次加入稀硫酸的质量 20g
剩余固体的质量2.4g
第四次加入稀硫酸的质量 20g
剩余固体的质量1.8g
问题:
1.上述表格中m的值
2.该合金中Mg的质量分数
3.实验操作结束后的溶液中溶质的化学式
4.所用稀硫酸中溶质的质量分数
5.反映后所得溶液的总质量
希望能有人给出解答过程,不要只给答案,谢谢.
 发骚男人1年前1
发骚男人1年前1 -
 zihuoyanyan 共回答了13个问题
zihuoyanyan 共回答了13个问题 |采纳率100%第四次加入稀硫酸,剩余固体的质量还减小,所以第三次加入稀硫酸,镁还过量,
前后次加入稀硫酸,每次减小0.12克,所以
1.上述表格中m=3.6克
2.该合金中Mg的质量分数=(6-1.8)/6=70%
3.实验操作结束后的溶液中溶质的化学式:MgSO4
Mg + H2SO4 = MgSO4 + H2
24 98
6-4.8=1.2 X
X=4.9g
4.所用稀硫酸中溶质的质量分数=1.2/20=6%
Mg + H2SO4 = MgSO4 + H2
24 120 2
6-1.8=4.2 Y Z
Y=21g
Z=0.35g
5.反映后所得溶液的总质量=4.8+80-0.35=84.45g1年前查看全部
- 在学习碳酸钠知识时,张老师在做完碳酸钠溶液和澄清石灰水反应演示实验后,对浑浊液过滤,得到澄清的滤液.对于滤液的组成,课堂
在学习碳酸钠知识时,张老师在做完碳酸钠溶液和澄清石灰水反应演示实验后,对浑浊液过滤,得到澄清的滤液.对于滤液的组成,课堂上老师的提问和同学们的回答如下表:
(1)假设你是丁同学,请你也提出一个与甲、乙、丙同学不同的猜想,把猜想写在上面表格中.并对你自己的猜想设计一个简单的实验加以证明.人 员 对话 老 师 问:滤液里可能含有哪些溶质呢? 甲同学 答:可能是NaOH、Na2C03 乙同学 答:可能是NaOH、Na2C03、Ca(OH)2 丙同学 答:可能是NaOH 丁同学 答:可能是______
(2)你认为甲、乙、丙同学的猜想都合理吗?如有不合理的请说明理由.______.实验步骤 实验现象 实验结论 取样于试管中,______ ______ 自己的猜想成立
(3)甲同学针对自己的猜想进行了如下实验:
你认为甲同学的实验设计是否正确?请说明理由是______.实验步骤 实验现象 实验结论 取样于试管中,滴入足量稀盐酸 没有气体产生 甲的猜想不成立
(4)为了进一步证明甲同学的猜想,丁同学又进行了又下实验探究:
写出碳酸钠溶液与氯化钙溶液反应的化学方程式______.实验步骤 实验现象 实验结论 取样于试管中,再滴入氯化钙溶液 生成______ 甲的猜想成立  wondercom1年前1
wondercom1年前1 -
 dengjiege 共回答了14个问题
dengjiege 共回答了14个问题 |采纳率92.9%解题思路:物质之间发生化学反应时存在一定量的关系,如果某种反应物过量,会有剩余,然后结合其他同学的猜想及碳酸钠和澄清石灰水反应一定生成氢氧化钠进行回答;
(1)根据氢氧化钙的化学性质分析;
(2)根据碳酸钠和氢氧化钙可发生反应,剩余物中两种反应物不会同时剩余进行解答;
(3)根据碳酸盐的检验是采用加酸观察是否有气体产生的方法进行分析;
(4)根据碳酸钠的化学性质分析,碳酸钠会与氯化钙反应生成白色沉淀碳酸钙和氯化钠;由碳酸钠和氢氧化钙反应的方程式可知:反应后滤液中一定会有氢氧化钠存在,若碳酸钠过量,则含有碳酸钠,即甲同学的猜想,若氢氧化钙过量,则含有氢氧化钙,故丁同学的猜想:可能含有NaOH和Ca(OH)2;
(1)因为碳酸钠和氢氧化钙反应一定生成氢氧化钠,所以只需证明溶液中是否有氢氧化钙就可以了,氢氧化钙与二氧化碳和可溶性的碳酸盐反应会生成沉淀,所以可以根据氢氧化钙的这些性质设计实验进行证明;
(2)物质之间发生化学反应时存在一定量的关系,如果某种反应物过量,会有剩余,但是两种反应物不会同时剩余,因为二者可反应,所以乙同学的猜想不合理;
(3)要证明碳酸钠的存在,涉及到的就是碳酸盐的检验,所以可以采用加酸的方法,由于滤液中含有氢氧化钠,因此需要加入足量的盐酸,始终没有CO2气体放出,说明没有碳酸钠,甲的猜想不成立;
(4)取样于试管中,再滴入氯化钙溶液,如果该滤液中含有碳酸钠,则碳酸钠会与氯化钙反应生成白色沉淀碳酸钙,从而证明甲的猜想正确;碳酸钠溶液与氯化钙溶液反应生成碳酸钙和氯化钠,反应的化学方程式是Na2CO3+CaCl2=CaCO3↓+2NaCl.
故答案是:NaOH和Ca(OH)2
(1)滴加碳酸钠溶液;溶液变浑浊;
(2)乙同学的猜想不合理,因为氢氧化钙与碳酸钠在溶液中不能共存,二者能相互反应;
(3)正确,因为盐酸的量足量,始终没有CO2气体放出,说明没有碳酸钠;
(4)白色沉淀;Na2CO3+CaCl2=CaCO3↓+2NaCl.点评:
本题考点: 实验探究物质的组成成分以及含量;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 物质之间发生化学反应时会完全进行,存在量的关系,所以不会出现反应物同时剩余的情况.另外在设计实验方案时,为保证实验结果准确,需要控制加入的药品的用量.1年前查看全部
- 将50克CaCl2溶液和70克Na2CO3溶液混合后,恰好完全反应,过滤得到115克溶液,反应后生成CaCO3沉淀的质量
将50克CaCl2溶液和70克Na2CO3溶液混合后,恰好完全反应,过滤得到115克溶液,反应后生成CaCO3沉淀的质量?
 ling07051年前1
ling07051年前1 -
 www5574888 共回答了20个问题
www5574888 共回答了20个问题 |采纳率90%化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl2
因为50克CaCl2溶液和70克Na2CO3溶液混合后的质量为50+70=120因为质量守恒定律所以生成物也要是120克,由上化学方程式式可知,过滤得到的是2NaCl2
溶液115克,那么剩下的就是CaCO3,所以就是120-115=5克1年前查看全部
- N2so4,Baso4悬浊液过滤后证明沉淀洗涤干净的操作是?
 lucy璇1年前1
lucy璇1年前1 -
 件6113 共回答了18个问题
件6113 共回答了18个问题 |采纳率88.9%去沉淀夜加入可与沉淀所吸附离子反应的且有明显现象的溶液从而判断是否将沉淀洗涤干净1年前查看全部
- 为什么尿液里的尿素会比原尿中的尿素多,尿素不只是在过滤作用中再会到血中吗?
 宗师级**师1年前4
宗师级**师1年前4 -
 战斗人生9 共回答了14个问题
战斗人生9 共回答了14个问题 |采纳率92.9%1.尿素不会在过滤作用中再会到血中;书上原话“而剩下的水和无机盐、尿素等就形成了尿液.”
2.尿液中的尿素含量高于原尿中的尿素含量的原因:原尿在重合管中被重吸收水份,使得尿素的浓度升高,根据氨基酸脱氨基作用转化为尿素的量以及人体吸收水分的量的比值关系得知,每排出尿液的含量中有很高浓度的尿素含量,又由于尿素对一些细胞有毒害作用,尿素会主动运输使得血液中尿素全部运至尿液中.
3.初中不要求你掌握这些原理,你只需要去理解并背书上的理论就行了,不过你勇于提问的精神很不错!1年前查看全部
- 取2.9g生铁与足量的CuSO4溶液充分反应,过滤,得到3.2g铜单质,则所取铁合金中碳元素的质量分数
取2.9g生铁与足量的CuSO4溶液充分反应,过滤,得到3.2g铜单质,则所取铁合金中碳元素的质量分数
(假设该生铁中的杂质只有铁元素.) 何马1年前1
何马1年前1 -
 珊蔡姐 共回答了11个问题
珊蔡姐 共回答了11个问题 |采纳率90.9%CuSO4+Fe=Cu+FeSO4
56g 64g
mg 3.2g m=2.8g
碳的质量分数=(2.9-2.8)÷2.9×100%=3.4%1年前查看全部
- 下列各组物质中,可依次通过溶解、过滤、蒸发等操作进行分离的是( )
下列各组物质中,可依次通过溶解、过滤、蒸发等操作进行分离的是( )
A. 氯化钾、氯化银
B. 碳酸钠、硝酸钡
C. 水、酒精
D. 木炭、二氧化锰 caiqingbo81821年前1
caiqingbo81821年前1 -
 d05lgavro0smrwd 共回答了18个问题
d05lgavro0smrwd 共回答了18个问题 |采纳率88.9%解题思路:能够通过用水溶解、过滤、蒸发等操作分离的物质要具有以下特点:一种物质溶于水,一种物质不溶于水,两种物质都溶于水或都不溶于水是不能分离的.A、氯化钾与氯化银一种溶于水一种不溶于水,符合题干要求的分离特点,故正确.
B、两者均溶于水不能利用溶解过滤蒸发的操作分离,故错误.
C、酒精易溶于水,不能与水通过溶解过滤蒸发分离,故错误.
D、两者均不溶于水,故不能通过溶解过滤蒸发操作,故错误.
故选A点评:
本题考点: 混合物的分离方法;过滤的原理、方法及其应用;蒸发与蒸馏操作.
考点点评: 通过回答本题知道了一种物质溶于水,一种物质不溶于水的分离方法是用水溶解、过滤、蒸发.1年前查看全部
- 热过滤属于减压过滤还是常压过滤,为什么
 武林大会1年前2
武林大会1年前2 -
 办公室比尔 共回答了14个问题
办公室比尔 共回答了14个问题 |采纳率78.6%属于常压过滤
热过滤就是在普通过滤器外套上一个热滤漏斗,
某些热的浓溶液,过滤时,由于温度降低,晶体很容易在滤纸上析出,这将使滤出的固体杂质与晶体相混,因此该种溶液就需在保温的情况下进行过滤,即热过滤.
1.热过滤装置的准备:
热滤漏斗是铜制的,具有夹层和侧管.夹层内盛水,漏斗上沿有一注水口,侧管处用于加热.
热滤漏斗内的玻璃漏斗其大小应与热滤漏斗相匹配,且应为短颈(比热滤漏斗的底端稍长).
2.过滤操作:
(1)从注水口处向热滤漏斗夹层中注水,水不可盛得过满,以防水沸腾时溢出.
(2)将过滤器准备好后,开始加热漏斗侧管,使漏斗内的水温达到要求.过滤前还应把玻璃漏斗在水浴上用蒸气加热一下.
(3)过滤过程中若有结晶析出,应待过滤结束,将滤纸上的晶体再用溶剂溶解,然后用新滤纸重新过滤.
过滤的注意事项
(1)常压过滤时,如果滤纸和漏斗的隔层和漏斗管里有气泡或者漏斗管口(斜面背后)没有贴紧烧杯壁,就会使过滤受到空气的阻力而减慢.
(2)在热过滤时,要经常向保温漏斗中添加热水.
(3)抽滤的关键在于控制水的流量,开始时如果水的流速过大,会使滤纸穿孔.当固体物质增厚时,如果水的流速过小,将使抽滤速率减小.1年前查看全部
- 把氧化铜和铁粉的混合物放在一定量的稀硫酸中,反应停止后过滤除去不溶物,向滤液中加入一块薄铁片,观察不到
把氧化铜和铁粉的混合物放在一定量的稀硫酸中,反应停止后过滤除去不溶物,向滤液中加入一块薄铁片,观察不到
A.滤出的不溶物中只有铜,不可能含铁
B.滤出的不溶物中只有铁,不可能含铜
C.滤出的不溶物中一定含有铜,也可能含有铁
D.滤液中一定含有FeSO4,不可能有CuSO4和H2SO4
为什么答案上说C也是对的呢?哪有Cu? zhangyying1年前1
zhangyying1年前1 -
 若渝 共回答了22个问题
若渝 共回答了22个问题 |采纳率90.9%稀硫酸先和氧化铜反应生成CuSO4,因为稀硫酸是一定量的所以还有铁粉剩下,剩下的铁粉再和CuSO4发生反应,所以有Cu.1年前查看全部
- 混合物的分离与提纯 过滤适用于什么和什么的分离
 goodzw1年前3
goodzw1年前3 -
 JYSY_123 共回答了18个问题
JYSY_123 共回答了18个问题 |采纳率94.4%过滤的适用范围:适于分离固体和液体混合物的分离1年前查看全部
- 将Cu与CuO固体混合物粉末放入烧杯中,当加入100克稀硫酸时,CuO与H2SO4好完全反应,过滤后所得溶液的质量为10
将Cu与CuO固体混合物粉末放入烧杯中,当加入100克稀硫酸时,CuO与H2SO4好完全反应,过滤后所得溶液的质量为108克,(不考虑过滤过程中溶液质量的损失).请分析并计算
(1)反应后溶液增加的质量为参加反应▁▁▁的质量.
(2)稀硫酸中含H2SO4的质量分数. 逍遥灵子1年前1
逍遥灵子1年前1 -
 aiya3602 共回答了19个问题
aiya3602 共回答了19个问题 |采纳率89.5%(1)cuo
(2)9.8%
因为反应后的物质没有气体等会溢出的东西,故增加的即为cuo质量
因为刚好完全反应,故列出反应式即可求得h2so4有9.8g1年前查看全部
- 在地球轨道空间站中,为什么无法进行过滤液体中的难溶物
 lwp12301年前2
lwp12301年前2 -
 我想我是天使 共回答了23个问题
我想我是天使 共回答了23个问题 |采纳率82.6%普通的过滤是让液体流过密密的滤网,水和可溶物可以通过,难溶物过不来.这个使液体流过滤网的力一般是引力;而在空间站,引力充当向心力,物体差不多无重力,就没有力拉着物体通过滤网,所以过滤不了.
虽然靠重力不行,但还是可以靠气压的.有“抽滤”的机器可以用.1年前查看全部
- 热水溶性有机碳 包含了 水溶性有机碳吗?还是提取了水溶性有机碳后的土壤经震荡、水浴、震荡、离心、过滤
热水溶性有机碳 包含了 水溶性有机碳吗?还是提取了水溶性有机碳后的土壤经震荡、水浴、震荡、离心、过滤
热水溶性有机碳 包含了 水溶性有机碳吗?还是提取了水溶性有机碳后的土壤经震荡、水浴、震荡、离心、过滤后的提取液才称为 热水溶性有机碳?怎么提取热水溶性有机碳,请大概说下 zhaoyueboy1年前1
zhaoyueboy1年前1 -
 为爱独行 共回答了15个问题
为爱独行 共回答了15个问题 |采纳率100%抱歉,哦,我这些都还没教到了,不能帮你了,
我想你应该可以去请教你老师,这样才能更确切的得到一个最完美的解释,
希望,你能得到你满意的答案1年前查看全部
- 在一定温度下,将一包白色无水硫酸铜粉末投入到150g蒸馏水中,充分搅拌,过滤,得到一定质量的蓝色晶体和84g滤液,若此温
在一定温度下,将一包白色无水硫酸铜粉末投入到150g蒸馏水中,充分搅拌,过滤,得到一定质量的蓝色晶体和84g滤液,若此温度下无水硫酸铜的溶解度为40g,则此包无水硫酸铜的质量是多少?
 默儿爱李强1年前3
默儿爱李强1年前3 -
 光看不回帖 共回答了20个问题
光看不回帖 共回答了20个问题 |采纳率90%解题思路:根据饱和溶液中质量分数不变和溶解度计算出剩余饱和溶液中溶质和溶剂的质量,根据硫酸铜晶体组成计算晶体中溶质的质量,两者之和为此包无水硫酸铜的质量.把无水硫酸铜粉末加入150g蒸馏水中,得到一定量的蓝色晶体CuSO4•5H20,剩余溶液仍然是饱和溶液,设剩余溶液中的溶质为xg,
则[40g/100g+40g]=[xg/84g]得:x=24
结晶水的质量=150g-(84g-24g)=90g,设结晶中硫酸铜的质量为yg
CuSO4~5H20
160 90
yg90g
[160/90]=[yg/90g]
y=160,此包无水硫酸铜的质量为=160g+24g=184g.
答:此包无水硫酸铜的质量是184g.点评:
本题考点: 溶液中溶质的质量分数及相关计算.
考点点评: 本题考查质量守恒定律,质量分数的计算,解题时注意守恒思想的运用.1年前查看全部
- 判断物质种类一包白色粉末,可能有氯化银,碳酸钠,氢氧化镁,氯化钡,硫酸钠,硝酸钾.1.将少许粉末放入水中,过滤,静置,得
判断物质种类
一包白色粉末,可能有氯化银,碳酸钠,氢氧化镁,氯化钡,硫酸钠,硝酸钾.
1.将少许粉末放入水中,过滤,静置,得白色沉淀.
2.向沉淀中加入硝酸,全部溶解,无气体产生.
3.向其中加入硝酸银溶液,有白色沉淀,加入足量稀硝酸,不溶解.
粉末中一定含---,一定没-----,可能有-----
一定要说为什么啊! situer001年前1
situer001年前1 -
 永远君儿 共回答了15个问题
永远君儿 共回答了15个问题 |采纳率93.3%一定含氯化钡,硫酸钠 ;一定没碳酸钠;可能有硝酸钾,氢氧化镁,氯化银.
条件一:能说明必定有氯化钡——因为氯化银,氢氧化镁不溶于水被过滤后还是有沉淀则是硫酸钡或碳酸钡.再由条件二可知不是碳酸钡因为没有气体.条件三可得白色沉淀是氯化银——氯化钡和硝酸银反应.希望能看懂!1年前查看全部
- 关于化学推断题类型的几道题1.白色的粉末A,加入B后变成蓝色溶液.向期中加入试剂C,生成白色沉淀硫酸钡,过滤后滤液中加入
关于化学推断题类型的几道题
1.白色的粉末A,加入B后变成蓝色溶液.向期中加入试剂C,生成白色沉淀硫酸钡,过滤后滤液中加入试剂D,得到蓝色沉淀E.再次过滤,滤液是氯化钠溶液.根据以上现象判断A__ B__ C__ D__E__
2.A、B、C、D、E都是无色气体,F是无色液体,他们之间有如下反应关系:
(1)A+B→点燃→F
(2)A+Cl2→点燃→C;将C通入F,能使石蕊试剂变红
(3)B+D→点燃→E;将E通入澄清石灰水,能使石灰水变浑浊
试判断(化学式表示)
A___ B___ C___ D__ E___ F___ ddf6201年前3
ddf6201年前3 -
 jinxb 共回答了22个问题
jinxb 共回答了22个问题 |采纳率86.4%1.白色的粉末A,加入B后变成蓝色溶液.向期中加入试剂C,生成白色沉淀硫酸钡,过滤后滤液中加入试剂D,得到蓝色沉淀E.再次过滤,滤液是氯化钠溶液.根据以上现象判断
A__ CuSO4
B__ H2O
C__ BaCl2
D__NaOH
E__Cu(OH)2
2.A、B、C、D、E都是无色气体,F是无色液体,他们之间有如下反应关系:
(1)A+B→点燃→F
(2)A+Cl2→点燃→C;将C通入F,能使石蕊试剂变红
(3)B+D→点燃→E;将E通入澄清石灰水,能使石灰水变浑浊
试判断(化学式表示)
A___ H2
B___O2
C___ HCl
D__ CO
E___ CO2
F___H2O1年前查看全部
- 过滤中的一贴二低三靠是指什么
 IamHisoka1年前1
IamHisoka1年前1 -
 huan5yi6 共回答了19个问题
huan5yi6 共回答了19个问题 |采纳率94.7%一贴:指滤纸要紧贴漏斗壁,一般在将滤纸贴在漏斗壁时先用水润湿并挤出气泡,因为如果有气泡会影响过滤速度. 二低:一是滤纸的边缘要稍低于漏斗的边缘;二是在整个过滤过程中还要始终注意到滤液的液面要低于滤纸的边...1年前查看全部
- 过滤的一贴二低三靠1.滤纸边缘低于漏斗边缘.为什么?
 施翌1年前1
施翌1年前1 -
 盘点人生 共回答了20个问题
盘点人生 共回答了20个问题 |采纳率90%如果高于漏斗边缘,倾倒液体时会从滤纸高出漏斗边缘的地方渗出,影响过滤效果1年前查看全部
大家在问
- 11.男工24人,女工16人,男工是女工的()%,女工是男工人数()%
- 25元人民币和2元人民币共有200张.5元人民币的总值比2元人民币总值多160元,两种面值的人民币各有多少张?
- 3有硬币,一元、五角两种,其中一元的硬币比五角的硬币少8个,一元的钱数比5交的钱数多2元,一元硬币有几个
- 4长方体中最多有几条棱相等
- 5长方体最多有几条棱相等
- 6因为肺动脉和肺静脉分别是动脉和静脉血管,虽然肺动脉流静脉血,肺静脉流动脉血,但我不知道肺动脉和肺静脉的管腔分别是怎样的?
- 7人体的毛细血管分布广泛,下列有关毛细血管描述错误的是
- 8一个三角形三个内角度数的比是 1:3:5,这个三角形按角分类是( )三角形,最大的角是( )度
- 9““曲尺能成方圆气,直线调就栋梁才”意思?”
- 10纺织厂的女工占全厂为数的80%,一车间的男工占全厂男工的25%,问一车间的男工占全厂人数的几分之几?
- 11水果店上午进了100kg水果,其中苹果占5分之3,下午卖了3分之2的苹果,卖了多少千克苹果?怎么写啊
- 12轮船在水域中顺水航行的速度为18千米/小逆水航行的速度为15千米/小时这段水域水流的速度为____千米/小时
- 13求证菱形判定的几种方法及过程
- 14已知x-()=2x-y-3z+a,则括号中的式子为
- 15求证平行四边形判定的几种方法及过程
