0.5MOL的浓硫酸与1MOL的NAOH的稀溶液混合,放出的热量大于57.3KJ.为什么?
 monster翊2022-10-04 11:39:542条回答
monster翊2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 天下纷飞 共回答了15个问题
天下纷飞 共回答了15个问题 |采纳率93.3%- 因为-57.3kJ/mol 对应的是稀硫酸与稀氢氧化钠反应的焓变.
浓硫酸在稀释为稀硫酸的过程放出的热是巨大的.
98%H2SO4在20℃时与过量的水混合,溶解焓变为-85.5 kJ/mol,比中和放出的热还要多. - 1年前
 浪漫的龙 共回答了2个问题
浪漫的龙 共回答了2个问题 |采纳率- 浓硫酸稀释放热
- 1年前
相关推荐
- 将0.6molA和0.5molB充入0.4L密闭容器中发生反应:2A(g)+B(g)⇌mD(g)+E(g),经过5min
将0.6molA和0.5molB充入0.4L密闭容器中发生反应:2A(g)+B(g)⇌mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol.又知5min内用E表示的平均反应速率为0.1mol•L -1 •min -1 ,下列结论正确的是( ) A.B的转化率为20% B.m值为1 C.5min内用A表示的平均反应速率为0.1mol•L -1 •min -1 D.平衡时反应混合物总物质的量为1mol  outdo5291年前1
outdo5291年前1 -
 电脑学习03 共回答了14个问题
电脑学习03 共回答了14个问题 |采纳率100%5min内用E表示的平均反应速率为0.1mol•L -1 •min -1 ,依据反应速率计算反应消耗的物质的量=0.1mol•L -1 •min -1 ×0.4L×5min=0.2mol;
2A(g)+B(g)⇌mD(g)+E(g)
起始量(mol)0.60.5 0 0
变化量(mol) 0.40.2 0.20.2
平衡量(mol) 0.2 0.3 0.2 0.2
A、B的转化率=
0.2mol
0.5mol ×100%=40%,故A错误;
B、依据消耗量分析可知m=1,故B正确;
C、5min内用A表示的平均反应速率=
0.4mol
0.4L
5min =0.2mol/L•min,故C错误;
D、平衡时反应混合物总物质的量=0.2+0.3+0.2+0.2=0.9mol,故D错误;
故选B.1年前查看全部
- 2mol的二氧化碳质量为88g,其中约含几个氧原子?多少克的二氧化硫中含有0.5mol氧原子.我摩尔什么的搞bu
2mol的二氧化碳质量为88g,其中约含几个氧原子?多少克的二氧化硫中含有0.5mol氧原子.我摩尔什么的搞bu
搞不太清,老师就花了下课10分钟上完了.请帮我理一下思路. FEGE1年前1
FEGE1年前1 -
 水手_jame 共回答了21个问题
水手_jame 共回答了21个问题 |采纳率90.5%公式:物质的量n=m/M=N/NA
2mol的二氧化碳质量为88g的物质的量=88/44=2mol
N=nNA=2X6.02X10^23=1.204X10^24 个
1mol的SO2含有2mol 的氧原子,0.5mol的氧原子,SO2的物质的量=0.25mol,其物质=0.25X64=16 g1年前查看全部
- 49gH2SO4的物质的量为0.5mol,所含氧原子的物质的量为2mol
49gH2SO4的物质的量为0.5mol,所含氧原子的物质的量为2mol
我知道0.5mol乘以4=2mol,为什么这么算?
H2SO4中含有4个氧原子,然后嘞?总不能说一个氧原子的物质的量就是0.5mol吧?具体点,我不太懂. 楼主所言是真理1年前1
楼主所言是真理1年前1 -
 trainermi 共回答了18个问题
trainermi 共回答了18个问题 |采纳率94.4%1mol=6.02*10^23个,意思是1mol分子、原子或原子团的数量就是6.02*10^23个.0.5molH2SO4就是有3.01*10^23个硫酸分子.具体细化到硫酸中的氧原子,因为1个硫酸分子含有4个氧原子,所以0.5mol,即3.01*10^23个硫酸分子,就有1.204*10^24个氧原子,即2mol.初期理解确实有点难度,到后面就好了.1年前查看全部
- 2012 江苏 高考 ③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 混合物Y
2012 江苏 高考
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 混合物Y 均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图8 所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是 (填化学式).
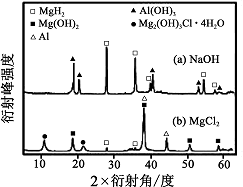
答案为在NaOH溶液中产生氢气的主要物质是铝.怎么氢化镁不是啊?图中产生氢气也多啊 happy250go1年前1
happy250go1年前1 -
 yuh0p 共回答了12个问题
yuh0p 共回答了12个问题 |采纳率83.3%图中是反应后残留固体物质的X-射线衍射谱图,也就是在图中氢化镁剩得比较多,而生成的含镁化合物在图中未看到,生成的含铝化合物比较多,所以答案是Al.1年前查看全部
- 0.5mol烃和足量氧气生成2.5mol 二氧化碳和3mol水的是什么烃?求该烃的分子式?
 无所畏3261年前3
无所畏3261年前3 -
 安儿囡囡 共回答了19个问题
安儿囡囡 共回答了19个问题 |采纳率68.4%很简单 既然是烃 所以只有 C、H两种元素
因为
0.5mol 烃 生成2.5mol CO2和3mol H2O
所以
该烃中含有 C原子个数是=2.5 / 0.5 = 5 个
含有H原子为:2 *( 3 / 0.5) = 12个(此处 乘以 2是 因为 一个H2O 含有2个H)
所以
求该烃的分子式:C5H121年前查看全部
- 已知8.5gNH3的物质的量为0.5mol. 问多少gH2O 含有相同的电子
已知8.5gNH3的物质的量为0.5mol. 问多少gH2O 含有相同的电子
要详细解答过程 wuyan52631年前2
wuyan52631年前2 -
 想飞的燕子_ss 共回答了24个问题
想飞的燕子_ss 共回答了24个问题 |采纳率79.2%水分子的电子和氨气分子一样都是10个,所以要想总电子相等,则水的物质的量也要是0.5mol,等于9克1年前查看全部
- 0.5mol氖气中含--个氖原子
 娃哈哈u3701年前2
娃哈哈u3701年前2 -
 绝望的土豆片 共回答了17个问题
绝望的土豆片 共回答了17个问题 |采纳率88.2%0.5mol氖气含约3.01*10^23个原子,也就是0.5NA1年前查看全部
- 48g硫酸中有( )A.0.5mol硫酸根离子B.0.5mol硫酸分子C.2mol氢原子D.4mol氧原子答案只给的B
48g硫酸中有( )
A.0.5mol硫酸根离子
B.0.5mol硫酸分子
C.2mol氢原子
D.4mol氧原子
答案只给的B A和D为什么不对呢? air02011年前4
air02011年前4 -
 masson6 共回答了17个问题
masson6 共回答了17个问题 |采纳率94.1%硫酸的分子式为H2SO4.
49g的硫酸的物质的量为49g/98(g/mol)= 0.5mol
解析:A.因为硫酸以分子形式存在,故硫酸分子中并没有硫酸根离子.(溶于水后才发生电离),所以A错误
B.正确
C.0.5硫酸分子中所含的氢原子为0.5×2=1mol
D.0.5硫酸分子中所含的氧原子为0.5×4=2mol1年前查看全部
- 离子浓度大小10mol 0.5mol CH3COONa 溶液与6ML IMOL盐酸混合; 个离子大小顺序比较 CH3CO
离子浓度大小
10mol 0.5mol CH3COONa 溶液与6ML IMOL盐酸混合; 个离子大小顺序
比较 CH3COO- H+ OH- CL- Na+ stve1年前1
stve1年前1 -
 之优1优 共回答了16个问题
之优1优 共回答了16个问题 |采纳率81.3%是10ml吧.
乙酸0.5%mol
钠离子0.005mol
氢离子0.001mol
氯离子0.006mol1年前查看全部
- 在无土裁培中,配制1L含0.5mol NH4Cl、0.16mol KCl、0.24mol
在无土裁培中,配制1L含0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4的某营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体配制,则需此三种固体的物质的量分别为( )
A. 0.40mol0.50mol0.12mol
B. 0.66mol0.50mol0.24mol
C. 0.64mol0.50mol0.24mol
D. 0.64mol0.02mol0.24mol foxbaby1年前2
foxbaby1年前2 -
 巴布娃娃 共回答了16个问题
巴布娃娃 共回答了16个问题 |采纳率87.5%解题思路:根据溶液中各离子的物质的量相等配制.①0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4中 n(NH4+)=n(NH4Cl)=0.5mol;
n( Cl- )=n(NH4Cl)+n( KCl)=0.5mol+0.16mol=0.66mol;
n( K+ )=n( KCl)+2n( K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n( K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制,
n((NH4)2SO4)=n(SO42-)=0.24mol;
n( KCl)=n( K+ )=0.64mol;
n(NH4Cl)=n( Cl- )-n( KCl)=0.66mol-0.64mol=0.02mol;
答案为:0.64mol;0.02mol;0.24mol;
故选D.点评:
本题考点: 配制一定物质的量浓度的溶液;物质的量的相关计算.
考点点评: 本题考查溶液配制的基本原则,题目难度不大,原溶液中离子物质的量和配制溶液中的离子物质的量相同.1年前查看全部
- 在Zn+H2SO4=ZnSO4+H2中,若锌失去了0.5mol电子,则生成的H2的量是(答案上给的是两个答案..为什么)
在Zn+H2SO4=ZnSO4+H2中,若锌失去了0.5mol电子,则生成的H2的量是(答案上给的是两个答案..为什么)
答案说是0.5mol和0.25mol dxwlwy1年前3
dxwlwy1年前3 -
 rickey 共回答了21个问题
rickey 共回答了21个问题 |采纳率95.2%0.5mol 1g 如果我没记错的话1年前查看全部
- 向一定量的铁,氧化亚铁,3氧化2铁,4氧化3铁的混合物中加入400毫升0.5mol每升的盐酸,恰好使混合物溶解,并放出标
向一定量的铁,氧化亚铁,3氧化2铁,4氧化3铁的混合物中加入400毫升0.5mol每升的盐酸,恰好使混合物溶解,并放出标准状况下的气体224ml,所得溶液中加入KSCN溶液无色血红出现,若用足量的CO在高温下还原质量相同的此混合物,得到铁的质量为?怎么算的?
 扁嘴嘟嘟1年前1
扁嘴嘟嘟1年前1 -
 xiaoyaT 共回答了17个问题
xiaoyaT 共回答了17个问题 |采纳率88.2%混合物中加入400毫升0.5mol每升的盐酸,恰好使混合物溶解,并放出标准状况下的气体224ml,表明铁把所有的其他价态的铁都反映生成Fe2+了,在加上液中加入KSCN溶液无色血红出现,表明溶液中只有Fe2+,所以溶液中只有FeCl2
根据电荷守恒:FeCL2=Fe2+ +2CL-
1 2
n 0.4*0.5 n=0.1mol
mFe=0.1*56=5.6g
如果不明白可以问我!1年前查看全部
- ph7的0.5mol l磷酸盐缓冲溶液怎么配置
 月夜馨香1年前1
月夜馨香1年前1 -
 湘江梦 共回答了25个问题
湘江梦 共回答了25个问题 |采纳率96%PH=PKa2-lgc(H2PO4^-)/c(HPO4^2-)
7=7.2-lgc(H2PO4^-)/c(HPO4^2-)
lgc(H2PO4^-)/c(HPO4^2-)=0.2
c(H2PO4^-)/c(HPO4^2-)=1.6/1
假设用磷酸二氢钠和氢氧化钠配制一升溶液,那么
需要磷酸二氢钠的质量是120×0.5×1.6/2.6=37克
需要氢氧化钠的质量是40×0.5×1/2.6=7.7克
即称取无水磷酸二氢钠37克,火碱7.7克,加水溶解,充分搅拌,再用水稀释到1升即可.1年前查看全部
- 将19.2g的铜屑投入到400mL浓度均为0.5mol.L-1HNO3和H2SO4的混合溶液中,当转移0.45mol电子
将19.2g的铜屑投入到400mL浓度均为0.5mol.L-1HNO3和H2SO4的混合溶液中,当转移0.45mol电子时溶液增加的质量为( )
A. 4.5g
B. 9.9g
C. 13.2g
D. 14.7g 飞花剪叶1年前1
飞花剪叶1年前1 -
 丑女1201 共回答了13个问题
丑女1201 共回答了13个问题 |采纳率92.3%解题思路:铜屑投入HNO3和H2SO4的混合溶液中发生的反应实质为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,根据转移电子的量来确定消耗的铜以及生成气体的量,根据差量法进而确定溶液增加的质量.反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O;
其中硝酸只提供H+但不参与氧化反应,Cu~Cu2+,转移2mol电子,0.45mol电子转移说明Cu反应的物质的量为为0.225mol,HNO3~NO,转移电子的量为3mol,0.45mol电子转移则放出的一氧化氮的物质的量为0.15mol,
对于溶液来说等于增加了0.225mol铜的质量,但减少了0.15mol一氧化氮的质量,
所以溶液增加的质量=0.225mol×64g/mol-0.15mol×30g/mol=9.9g.
故选B.点评:
本题考点: 氧化还原反应的电子转移数目计算.
考点点评: 本题是一道考查氧化还原反应中有关电子转移知识的题目,结合了溶液中差量法的应用知识,难度较大.1年前查看全部
- 0.5molNa2SO4中所含的Na+离子数为?(详解,
 dreamxu1年前3
dreamxu1年前3 -
 65089732 共回答了13个问题
65089732 共回答了13个问题 |采纳率69.2%0.5molNa2SO4中含Na+离子的物质的量为0.5mol*2=1mol
0.5molNa2SO4中所含的Na+离子数N=n*NA=1mol*6.02*10∧23mol∧-1=6.02*10∧23
答:0.5molNa2SO4中所含的Na+离子数为6.02*10∧231年前查看全部
- 将0.5mol钠放入足量的水中,1.求参加反应的水为多少摩尔?2.求生成氢气的体积是多少升?
将0.5mol钠放入足量的水中,1.求参加反应的水为多少摩尔?2.求生成氢气的体积是多少升?
3.求生成溶液中溶质的质量为多少? 哟嘿吖1年前1
哟嘿吖1年前1 -
 逸安居士 共回答了18个问题
逸安居士 共回答了18个问题 |采纳率94.4%这个可以直接用电子得失守恒来做:0.5molNa失去0.5mol电子,那么生成的氢气就得到0.5mol电子,1个氢气分子得到2个电子,所以只能生成0.25mol氢气(因为要求体积,所以我必须知道环境状体是多少,如果是标况:体积为0.25x22.4=5.6L).
写出这个化学反应方程式可以知道:0.5molNa可以与0.5mol水反应:参加反应的水为0.5mol.溶液的溶质为氢氧化钠:元素守恒知道生成的氢氧化钠为0.5mol,质量为0.5x40=20g1年前查看全部
- 向NaOH0.5mol的水溶液中通入标况下NO2气体11.2L,其化学方程式
 ten33071年前3
ten33071年前3 -
 chengxing2006 共回答了16个问题
chengxing2006 共回答了16个问题 |采纳率87.5%2NaOH+2NO2===NaNO2+NaNO3+H2O
因为氢氧化钠是0.5mol,NO2也是0.5mol,因此反应比例为1:1,歧化反应由+4价转化成+3价和+5价
若还有问题,欢迎追问哦1年前查看全部
- 0.5molHCl分子所含原子数
 石门一雄1年前0
石门一雄1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 请问:0.5mol的水含有的原子数目为0.5NA是错误的,正确解为1.5,为什么要乘3,0.5代表什么?谢谢!
 bnsjkpw668881年前0
bnsjkpw668881年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 0.5molSO2的质量为 ,其中含有 个SO2分子,共有
0.5molSO2的质量为 ,其中含有 个SO2分子,共有
0.5molSO2的质量为 ,其中含有 个SO2分子,共有 个原子. cuijian_01231年前1
cuijian_01231年前1 -
 天天性 共回答了18个问题
天天性 共回答了18个问题 |采纳率94.4%32克
3.01x10^23
9.03x10^231年前查看全部
- 11.2L H2和5.6L O2完全反应一定生成0.5mol H2o
 abc啦啦1年前1
abc啦啦1年前1 -
 jiuhan520 共回答了16个问题
jiuhan520 共回答了16个问题 |采纳率87.5%错误,必须说明是标准状况,如果是标准状况是对的.1年前查看全部
- 常温常压下X元素的单质是深棕红的液体,0.5mol的Y元素的离子得到6.02*10^23个电子,被还原为中性电子
常温常压下X元素的单质是深棕红的液体,0.5mol的Y元素的离子得到6.02*10^23个电子,被还原为中性电子
4g的Y单质同盐酸反应放出0.2gH2.X元素的原子比Y元素的原子核外多1个电子层.通过计算写出X与Y形成的化合物的化学式和电子式 等待男孩1年前1
等待男孩1年前1 -
 richkey 共回答了26个问题
richkey 共回答了26个问题 |采纳率84.6%判定X是溴单质Br2,Y是钙元素Ca.
CaBr2
【Br】-Ca²+【Br】-
其中“【Br】-”中的Br被8个点(或7个点1个叉包围)包围.1年前查看全部
- 标准状况下有三种物质①18gH2O ②11.2LH2s气体 ③0.5mol苯,下列顺序正确的是()
标准状况下有三种物质①18gH2O ②11.2LH2s气体 ③0.5mol苯,下列顺序正确的是()
A.密度①>③>② B体积①>②=③ C质量③>②>① D氢原子数①>②>③ caixiaohu1年前1
caixiaohu1年前1 -
 嘿嘿南方小猪 共回答了19个问题
嘿嘿南方小猪 共回答了19个问题 |采纳率94.7%首先确认摩尔数,①18g H2O是1 mol,② 11.2L H2气是0.5mol,③0.5mol 苯
苯是一种比水略轻的液体,而再轻也不会像气体,所以密度上,水最大,其次是苯,最小的是氢气,因此A正确.
氢气与苯摩尔数相同,但一个气体,一个液体,那体积相差千倍,显然B错误
水是18g,0.5mol H2的质量只有1g,0.5mol苯的质量为78g,答案C排列错误
苯是C6H6,显然0.5mol苯含氢原子3mol,应为最多,1mol水含2mol氢原子,0.5mol氢气含1mol氢原子,答案D排列错误1年前查看全部
- 0.5mol的硫酸铝中铝离子的物质的量?
 嘬了一大口1年前1
嘬了一大口1年前1 -
 阿修罗之吻 共回答了20个问题
阿修罗之吻 共回答了20个问题 |采纳率100%0.5mol的硫酸铝中铝离子的物质的量=1mol1年前查看全部
- 为什么在0.5molNa2SO4中含有Na+的数目是6.02*1023个而不是1个?是指粒子数吗
 goldflower1年前1
goldflower1年前1 -
 鼎发ee1 共回答了17个问题
鼎发ee1 共回答了17个问题 |采纳率82.4%这里显然是指总的钠离子的粒子个数,不是指一个Na2SO4中的钠离子数.1年前查看全部
- 往2L硫酸铁和硫酸铜的混合溶液中加入30g铁,反应完全后,得固体不溶物26g,在滤液中加入0.5mol氯化钡,恰使硫酸根
往2L硫酸铁和硫酸铜的混合溶液中加入30g铁,反应完全后,得固体不溶物26g,在滤液中加入0.5mol氯化钡,恰使硫酸根沉淀完全,求硫酸铁和硫酸铜的物质的量浓度.
 若空1年前1
若空1年前1 -
 zhuzhu888 共回答了18个问题
zhuzhu888 共回答了18个问题 |采纳率88.9%在滤液中加入0.5mol氯化钡,恰使硫酸根沉淀完全,说明恰好有0.5mol硫酸根离子考虑铁和混合溶液的作用,和三价铁离子作用完后才会和铜离子发生置换反应前者没耗1molFe,(与2mol三价铁作用)固体就减少56g;而后者每耗1mol...1年前查看全部
- 某反应在0.5L密闭容器中进行,反应物B的物质的量在5s从2.0mol变成0.5mol ,在这5s内B的化学反应速率为?
某反应在0.5L密闭容器中进行,反应物B的物质的量在5s从2.0mol变成0.5mol ,在这5s内B的化学反应速率为?
还有文科化学要求掌握的公式有哪些 简单又好记的 Google测试员30381年前2
Google测试员30381年前2 -
 想被幸福溢满 共回答了9个问题
想被幸福溢满 共回答了9个问题 |采纳率100%反应速率一般以单位时间反应物浓度减少或生成物浓度增加来表示,公式为v=ΔC/Δt,代入数据,v=(2.0-0.5)mol÷0.5L÷5s=0.6mol/(L·s).1年前查看全部
- 几个高一化学有机题1. 某有机物12g完全燃烧,生成7.2gH2O和8.96LCO2(标准状况下),0.5mol此有机物
几个高一化学有机题
1. 某有机物12g完全燃烧,生成7.2gH2O和8.96LCO2(标准状况下),0.5mol此有机物的质量为30g.
(1)求分子式
(2)又知此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,试写出它可能的结构简式
(解答过程写一下,谢谢)
HOOC-CH=CHCH2OH
1.它可以在一定条件下自身发生酯化反应,写出产物的结构简式
2.他可以发生类似乙烯的加聚反应,写出产物的结构简式 zhijiazhizi1年前4
zhijiazhizi1年前4 -
 平安成都 共回答了12个问题
平安成都 共回答了12个问题 |采纳率100%1.(1)生成的H2O的量为(7.2/18=)0.4mol,
生成的CO2量为(8.96/22.4=)0.4mol,
0.5mol此有机物的质量为30g,则该有机物的分子量为30/0.5=60;
假设该有机物的分子式为CxHyOz(若为烃类则z=0)
燃烧方程式为:
CxHyOz + m O2 ----> n H2O + n CO2 (生成的水和二氧化碳的物质的量相等)
12x+y+16z n n
60 0.4
根据C元素守恒:x=n
根据H元素守恒:y=2n
所以 (12n+2n+16z)/60=n/0.4
讨论:(1) 当z=0时,n=0 不合题意;
(2) 当z=1时,n不为整数解,也不合题意;
(3) 当z=2时,n=2,该分子式为C2H4O2;
(4) 当z>2时,均不合题意
综上,该分子式为C2H4O2
(2)具有若酸性的物质可能是羧酸或者酚类化合物,含有两个C,则只能是羧酸类.所以其结构简式为CH3COOH
2.(1) 如果是双聚脱两分子水成环,则应该是10元环,不稳定.
故只能是双聚脱一分子水:HOOC-CH=CHCH2O-OC-CH=CHCH2OH
(2) COOH CH2OH
| |
-(-CH---CH-)-n1年前查看全部
- 化学 气体体积有标准状况下的4种气体:①5.6L H2S ② 0.5mol NH3 ③6g C2H6 ④ 8g CH4按
化学 气体体积
有标准状况下的4种气体:①5.6L H2S ② 0.5mol NH3 ③6g C2H6 ④ 8g CH4
按下列要求从大到小排序.
(1)气体体积 (2)氢原子个数 (3)气体质量 (4)气体密度
过程是要的..哪位大虾帮帮忙啊!感激不尽呐! 谢谢! 黑色的你1年前1
黑色的你1年前1 -
 叶芙 共回答了14个问题
叶芙 共回答了14个问题 |采纳率92.9%第一问,0.5摩尔氨气标况下是11.2升,六克乙烷是0.2摩尔标况下是4.48升,八克甲烷是0.5摩尔标况下也是11.2升.大小顺序是2=4>1>3
第二问,5.6升硫化氢是0.25摩尔,含氢原子0.5摩尔,0.5摩尔氨气含氢原子1.5摩尔,0.2摩尔乙烷含氢原子1.2摩尔,0.5摩尔甲烷含氢原子两摩尔,大小顺序是4>2>3>1
第三问,5.6升硫化氢是0.25摩尔质量是8.5克,0.5摩尔氨气是8.5克,所以质量大小顺序是:1=2>4>3
第四问,气体在标况下摩尔体积是一样大的,密度可以是分子量除以摩尔体积,所以分子量大的密度大,密度大小是:1>3>2>41年前查看全部
- 1.在500摄氏度时,向甲容器中充入1mol SO3 ,向相同容积的乙容器中充入1mol SO2 和0.5mol O2,
1.在500摄氏度时,向甲容器中充入1mol SO3 ,向相同容积的乙容器中充入1mol SO2 和0.5mol O2,若甲容器保持容积不变,乙容器保持压强不变,分别达到平衡,下列说法正确的是:
A:平衡时容器中的压强:甲>乙
B:平衡时容器中的压强:甲 似是故人567891年前1
似是故人567891年前1 -
 地狱天使 共回答了21个问题
地狱天使 共回答了21个问题 |采纳率95.2%1,B.这是一个等效平衡的问题,乙相当于甲反应平衡后在缩小体积后再次达到的平衡,想到这里答案很容易从AB中选出B.由于加压后SO2与O2体积减少,容器体积减少,CD无法判断,
2这个是要知道比例的.
3NaOH与CO2,Fe3O4与H2等等,这些反应的一种反应物少量和过量时生成务不一样.1年前查看全部
- 今有甲烷和氧气的混合气体,其平均摩尔质量为20g/mol,0.5mol,该混合气体中各为多少摩?
 Angie雅芝1年前3
Angie雅芝1年前3 -
 阿乐华 共回答了16个问题
阿乐华 共回答了16个问题 |采纳率93.8%设混合气体中甲烷为xmol,则氧气为(0.5-x)mol
[16x+32*(0.5-x)]/0.5=20
解得x=0.375 0.5-x=0.125
混合气体中甲烷为0.375mol,氧气为0.125mol1年前查看全部
- 0.5mol水物质的质量是 用 n=m/M 结果是 9g
 yaqrain1年前1
yaqrain1年前1 -
 karamen 共回答了29个问题
karamen 共回答了29个问题 |采纳率89.7%0.5摩尔水的质量是18*0.5=9克1年前查看全部
- P4+2I2+8H2O==2HI+2H3PO4+2PH4I,当该反应转移0.5mol电子时,被磷自身氧化的白磷物质的量是
P4+2I2+8H2O==2HI+2H3PO4+2PH4I,当该反应转移0.5mol电子时,被磷自身氧化的白磷物质的量是?
 麦洁娃娃1年前2
麦洁娃娃1年前2 -
 快乐木叶 共回答了22个问题
快乐木叶 共回答了22个问题 |采纳率90.9%被磷自身氧化的白磷物质的量是0.1mol.根据得失电子守恒,该反应转移了10个电子,反应转移的电子量为0.5mol,反应中P4被氧化成H3PO4,其系数为2,设其物质量为x,根据物质量守衡有10x=2*0.5,解得x=0.1.1年前查看全部
- 某氨水中C(NH4+)=0.5MOL/L时达到电离平衡,若向其中加入C(NH4+)=0.5MOL/L的NH4CL溶液,氨
某氨水中c(nh4+)=0.5mol/l时达到电离平衡,若向其中加入c(nh4+)=0.5mol/l的nh4cl溶液,氨水的电离程度将
a 增大 b 减少 c不变 d无法判断
请给予解释.
答案是a baslilon1234561年前1
baslilon1234561年前1 -
 langjinhuren 共回答了23个问题
langjinhuren 共回答了23个问题 |采纳率95.7%NH4+ + H20=NH3H2O
氯化铵发生水解生成氨水,
NH3H2O=NH4+ +OH- 氨水的浓度大了,平衡向右移动,加大了电离程度.(上面的等号都是双箭头)
如果是因为氯化铵水解产生的氢离子的原因,加醋酸铵,氨水的电离程度也一样增大.
当然,氨水被稀释也是一个原因.注意题目所给条件,说的不是氨水浓度,是按根离子浓度.并且原溶液和加入溶液浓度相同.这就相当于将他在一定程度上稀释了(这个说起来比较烦,抓住题目所给条件理解).因此越稀越电离.浓度变大氨水这种弱电解质,浓度越小,电离程度越大.1年前查看全部
- 简述配制0.5mol/标准NaOH溶液1L的步骤及计算公式
 sita20021年前1
sita20021年前1 -
 xich423007 共回答了14个问题
xich423007 共回答了14个问题 |采纳率78.6%需要的NaOH溶液物质的量n=CV=0.5L×1mol/L=0.5mol,质量m=nM=0.5mol×40g/mol=20.0g
1、计算,称量:m=nM=cvM=0.25·0.1·40=0.1g 用天平准确称量出来
将NaOH溶解在烧杯中(注意烧杯的水不要太多30ml左右)
3、转移:将冷却后的NaOH溶液,用玻璃棒转移到250ml的洗干净的容量瓶中
4、洗涤:将装NaOH的烧杯洗干净2-3次,注意少量多次原则,洗涤液也转移到容量瓶中,因为容量瓶的容积有限,所以加进去的液体少量,不能超过250ml刻度线
5、定容:往容量瓶加水,至刻度线2cm左右,换用胶头滴管加水至凹液面刚好与刻度线相平
6、摇匀溶液1年前查看全部
- 镁铝合金5.1g溶于过量的盐酸中,完全反应后在标准状况下放出气体5.6L,该合金一共失电子0.5mol的原因
 faguangti1年前2
faguangti1年前2 -
 zonlin 共回答了17个问题
zonlin 共回答了17个问题 |采纳率94.1%生成n(H2)=5.6/22.4=0.25mol那么可知该合金一共失电子0.5mol,那么该合金一共得到氢氧根0.5mol.1年前查看全部
- 下列说法中正确的是( )A.1 mol•L-1的NaCl溶液是指此溶液中含有1 mol NaClB.1L 0.5mol
下列说法中正确的是( )
A.1 mol•L-1的NaCl溶液是指此溶液中含有1 mol NaCl
B.1L 0.5mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol•L-1
C.6.2gNa2O溶于1L水中所得溶液的物质的量浓度为0.2mol•L-1
D.1 mol•L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol•L-1 精灵鼠大哥1年前1
精灵鼠大哥1年前1 -
 lifurong1234 共回答了15个问题
lifurong1234 共回答了15个问题 |采纳率100%解题思路:A.根据物质的量浓度的含义;
B.根据溶液的浓度与所取溶液的体积无关;
C.先根据Na2O与水反应生成氢氧化钠,但水的体积不等于溶液的体积;
D.根据同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关;A.1 mol•L-1的NaCl溶液是1L溶液中含有1 mol NaCl,故A错误;
B.1L 0.5mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变仍为0.5mol•L-1,故B错误;
C.根据关系式Na2O→2NaOH可知,6.2g Na2O与水反应生成氢氧化钠的质量为8g,物质的量为[8g/40g/mol]=0.5mol,但水的体积不等于溶液的体积,所以无法计算出溶液的物质的量浓度,故C错误;
D.1 mol•L-1的CaCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(CaCl2)=2mol/L,故D错误;
故选:C;点评:
本题考点: 物质的量浓度.
考点点评: 本题主要考查了物质的量浓度的含义,难度不大,根据课本知识即可完成.1年前查看全部
- 在0.5Mol氧气中含有的氧原子数目为什么是NA? 求详解!
 1764760931年前1
1764760931年前1 -
 不信你还有 共回答了15个问题
不信你还有 共回答了15个问题 |采纳率86.7%1个O2分子,原子数 = 2,1 mol O2,原子数 = 2 mol,
所以 0.5 mol O2,原子数 = 1 mol,即NA个.
因为一个O2分子中有2个氧原子,所以1 mol O2分子就有2 mol 氧原子,
所以 0.5 mol O2就有 0.5 * 2 = 1 mol 氧原子,即 NA个氧原子.
还不明白,我也没招了1年前查看全部
- 2NO2N2O4转化2NO2N2O4 如果说20秒内生成N2O4 0.5mol 那么需要1mol No2 这句话对吗
 ckf_19811年前2
ckf_19811年前2 -
 onlylala 共回答了10个问题
onlylala 共回答了10个问题 |采纳率90%错误.
2NO2N2O4 是一个平衡体系,要生成N2O4 0.5mol ,需要的No2 一定大于1mol.1年前查看全部
- 标准状况下混合气体体积怎么算0.5mol的氢气跟0.5mol二氧化碳 混合体积是22.4L莫?
 llydyfl1年前1
llydyfl1年前1 -
 draculadon 共回答了16个问题
draculadon 共回答了16个问题 |采纳率100%对.标准状况下任何气体或混合气体1mol都等于22.4L1年前查看全部
- 有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和
有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________.
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________.
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为_____________. 长啸剑1年前1
长啸剑1年前1 -
 gilsa0870 共回答了15个问题
gilsa0870 共回答了15个问题 |采纳率86.7%(1)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,甲、乙为等效平衡,
若平衡时,甲、乙两容器中A的物质的量相等,则为完全等效平衡,将乙按化学计量数转化到左边满足n(A)=6mol、n(B)=2mol,则1.5+9/x=6,0.5+3/x=2,解得x=2;
若平衡时,甲、乙两容器中A的物质的量不相等,则压强不影响平衡移动,反应前后气体体积不变,则x=3+1=4,
故答案为:2;4;
(2)A与B的起始物质的量之比等于化学计量数之比,则平衡后A、B的物质的量之比为定值3:1;A、B的体积分数之和为1-0.2=0.8,故A的体积分数=0.8×0.75=0.6,
故答案为:相等;0.6;
(3)若平衡时两容器中的压强不相等,则压强不影响平衡移动,反应前后气体体积不变,则x=4,甲、乙混合气体的总的物质的量不变,压强之比等于物质的量之比,故甲、乙两容器内压强之比为(6+2)mol:(1.5+0.5+3)mol=8:5,
故答案为:P(甲):P(乙)=8:5.1年前查看全部
- 有H2SO4和Na2SO4混合溶液200ml,两者物质量浓度分别1mol每升和0.5mol每升
有H2SO4和Na2SO4混合溶液200ml,两者物质量浓度分别1mol每升和0.5mol每升
,要使两者物质量浓度分别变为2mol每升和0.2mol每升,应加入55.8%的硫酸溶液(密度为1.35g、cm3)多少?加蒸馏水稀释到多少? 54236161年前1
54236161年前1 -
 水郁蓝 共回答了21个问题
水郁蓝 共回答了21个问题 |采纳率95.2%4/[55.8%*1.35/98]
500mL1年前查看全部
- 0.5mol胆矾的质量是125g,含有____个结晶水分子,____molCu2+离子,____mol氧原子.
 lianglight1年前3
lianglight1年前3 -
 a12_333 共回答了22个问题
a12_333 共回答了22个问题 |采纳率81.8%0.5mol胆矾的质量是125g,含有(2.5NA)个结晶水分子,(0.5)molCu2+离子,(4.5)mol氧原子.
注:NA为阿伏伽德罗常数1年前查看全部
- 将含1mol HCl的稀盐酸,逐滴加入含0.2mol NaOH和0.5molNa2CO3的混合溶液中
将含1mol HCl的稀盐酸,逐滴加入含0.2mol NaOH和0.5molNa2CO3的混合溶液中,充分反应后溶液中各物质的量是( )
HCl/mol NaCl/mol NaOH/mol Na2CO3/mol NaHCO3/mol A 0 1 0.1 0 0.1 B 0 1 0 0.1 0.1 C 0.2 0.8 0 0 0.2 D 0 1 0 0 0.2
A.A
B.B
C.C
D.D 若然也1年前1
若然也1年前1 -
 pineapple_1 共回答了15个问题
pineapple_1 共回答了15个问题 |采纳率86.7%解题思路:将盐酸加入NaOH和Na2CO3的混合溶液中,首先发生反应NaOH+HCl=NaCl+H2O,再发生Na2CO3与稀盐酸发生分步反应,先发生Na2CO3+HCl=NaHCO3+NaCl,Na2CO3完全转化为NaHCO3后,再发生NaHCO3+HCl=NaCl+CO2↑+H2O,据此根据方程式进行计算判断.盐酸首先与氢氧化钠发生中和反应,则:
NaOH+HCl=H2O+NaCl,
0.2mol 0.2mol 0.2mol
0.2molNaOH完全反应,消耗0.2molHCl,生成0.2molNaCl,剩余HCl为1mol-0.2mol=0.8mol;
剩余盐酸再与碳酸钠发生分步反应,则:
Na2CO3+HCl=NaHCO3+NaCl
0.5mol 0.5mol 0.5mol 0.5mol
Na2CO3完全转化为NaHCO3,消耗0.5molHCl,生成0.5molNaCl、0.5molNaHCO3,剩余HCl为0.8mol-0.5mol=0.3mol,
NaHCO3+HCl=NaCl+CO2↑+H2O,
0.3mol 0.3mol
0.3molHCl完全反应需要0.3molNaHCO3,小于0.5mol,HCl完全反应,剩余NaHCO3为0.5mol-0.3mol=0.2mol,生成0.3molNaCl,
综上所述,反应后溶液中含有0.2molNaHCO3、NaCl为0.2mol+0.5mol+0.3mol=1mol,
故选D.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度中等,理解滴加过程中发生的反应是解题关键,注意碳酸钠与盐酸反应滴加顺序不同、反应不同,实质是反应物的量不同引起反应不同.1年前查看全部
- 在标准状况下,0.5mol任何气体的体积都约为______.
 stockking11211年前3
stockking11211年前3 -
 cjppbb 共回答了24个问题
cjppbb 共回答了24个问题 |采纳率91.7%解题思路:标准状况气体摩尔体积为22.4L/mol,结合n=
计算得到.V Vm 在标准状况下,气体摩尔体积为22.4L/mol,0.5mol任何气体的体积都约11.2L,故答案为:11.2L.
点评:
本题考点: 气体摩尔体积.
考点点评: 本题考查了气体摩尔体积的概念分析判断,掌握实质是关键,题目较简单.1年前查看全部
- 在0.5molna2so4中含有na+的数目是( )个?为什么?
 dddddd12341年前1
dddddd12341年前1 -
 白玉堂GHT 共回答了19个问题
白玉堂GHT 共回答了19个问题 |采纳率100%NA
一个硫酸钠中含2个钠离子,所以1molna2so4含2molNa+,在0.5molna2so4中含有na+的数目是1mol,即NA.
所求的数据=n*下脚标
多谢!1年前查看全部
- 在0.5molNa2SO4中含有Na离子的数目是多少个?
在0.5molna2so4中含有na离子的数目是多少个?
***中甲烷于氧气的质量比为1比4时极易***,此时甲烷与氧气的体积比为?
........ tzjx9991年前5
tzjx9991年前5 -
 q2hmsckbe 共回答了23个问题
q2hmsckbe 共回答了23个问题 |采纳率91.3%第一个,数目为6.02*10^23个,也就是一摩尔.一个分子含有两个Na离子 0,5mol分子就有1mol离子.二,体积比为1:2,质量比为1:4,那么分子总质量的比为16:64,16是一个甲烷,64刚好是两个氧分子,所以分子数目1:2,体积比也就为l:2.1年前查看全部
- 为什么1molH2O中有2mol氢原子,怎么不是0.5mol的H
 threedoctors1年前2
threedoctors1年前2 -
 gdgzzjh8888 共回答了26个问题
gdgzzjh8888 共回答了26个问题 |采纳率100%因为是H2,不是H0.25,离子数是用乘的.1年前查看全部
- H+(aq)+oH-(aq)=H2O(L) △H=-57.3KJ/MOL 含1mol NaoH的水溶液与含0.5mol的
H+(aq)+oH-(aq)=H2O(L) △H=-57.3KJ/MOL 含1mol NaoH的水溶液与含0.5mol的浓硫酸混合后放热57.3kj
为什么? lwh198211241年前3
lwh198211241年前3 -
 大锅掘起 共回答了18个问题
大锅掘起 共回答了18个问题 |采纳率88.9%不对.
浓硫酸中的H不是以H+形式存在.
反应的热效应应该加上硫酸稀释时的热效应.1年前查看全部
大家在问
- 1据报道:河南省商城县一位姓肖的老园艺师,培养的一棵梨树上能够结出24种形状不同,滋味各异的梨,有鸭梨、莱阳梨、雪花梨、砀
- 2小学四年级语文下册和我们一样享受春天,根据课文填空.
- 3What are youdoing,children?反翻成汉语?
- 4下列关于氧气的说法错误的是( ) A.氧气约占空气总体积的1/5 B.通常情况下,氧气是无色无味的气体 C.硫在空气中
- 5英语翻译高手请进!我许下的3个愿望已经实现用英语怎么说,
- 6为什么冬天的压强比夏天的压强大,而晴天的压强比阴天的压强大
- 7all connect cable with 0.15sgmm and for main extension cable
- 8行完一段路,甲用5小时,乙用4小时,甲乙两人的速度比是( )
- 9下列情况中的运动物体,能被看成质点的是( )
- 10多选题(分数: 8 分) 1 . 科学发展观的基本要求是( )。 ( 2 )分 1. 全面发展 2. 以人为本 3. 协
- 11quan这个音节怎样拆成声母和韵母
- 12英语翻译If i'm lucky enough to visit the Lake of Heaven with you
- 13将 彩旗借风飞扬,这何错之有?疑问句改为一般陈述句
- 14抛物线与x轴交于A(-1.0)B(3.0)两点,与y轴交于点C(0.-3)设抛物线的顶点为D,探究
- 15______,这种计数方法叫做十进制计数法.
