H+(aq)+oH-(aq)=H2O(L) △H=-57.3KJ/MOL 含1mol NaoH的水溶液与含0.5mol的
 lwh198211242022-10-04 11:39:543条回答
lwh198211242022-10-04 11:39:543条回答为什么?

已提交,审核后显示!提交回复
共3条回复
 大锅掘起 共回答了18个问题
大锅掘起 共回答了18个问题 |采纳率88.9%- 不对.
浓硫酸中的H不是以H+形式存在.
反应的热效应应该加上硫酸稀释时的热效应. - 1年前
 pengshuo2002 共回答了12个问题
pengshuo2002 共回答了12个问题 |采纳率- 不对,不能完全反应
- 1年前
 lang1046lp 共回答了16个问题
lang1046lp 共回答了16个问题 |采纳率75%- 不对,硫酸不完全电离,反应不能彻底
- 1年前
相关推荐
- 燃烧热和中和热是不是都不用写负号,直接写Qkj/mol和57.3kj/mol.反应热要写正负号?
燃烧热和中和热是不是都不用写负号,直接写Qkj/mol和57.3kj/mol.反应热要写正负号?
热值是不是都不写正负号,单位也有kj? wlgiet1年前1
wlgiet1年前1 -
 xadsey 共回答了17个问题
xadsey 共回答了17个问题 |采纳率88.2%燃烧热和中和热单位也是kj/mol
因为燃烧热和中和热就是反应热一种特殊 情况
至于要不要加负
我老师说要
但有些参考书上没加1年前查看全部
- (2009•四川)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5
(2009•四川)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-57.3kJ/mol
B.KOH(aq)+[1/2]H2SO4(aq)═[1/2]K2SO4(aq)+H2O(l)△H=-57.3kJ/mol
C.C8H18(l)+[25/2]O2(g)═8CO2(g)+9H2O(g)△H=-5518kJ/mol
D.2C8H18(g)+25O2(g)═16CO2(g)+18H2O(l)△H=-5518kJ/mol hywbby1年前1
hywbby1年前1 -
 夜的蓝采 共回答了15个问题
夜的蓝采 共回答了15个问题 |采纳率100%解题思路:在101kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热;在稀溶液中,稀的酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热.A、中和热的概念酸跟碱发生中和反应而生成1mo水时的反应热,所以2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-114.6kJ/mol,焓变值乘以2,故A错误;
B、在稀溶液中,酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热,故B正确;
C、水的稳定的氧化物应是液态水而不是气态水,故C错误;
D、燃烧热概念要求必须是lmol物质完全燃烧,即C8H18(g)+[25/2]O2(g)═8CO2(g)+9H2O(1)△H=-5518kJ/mol,故D错误.
故选B.点评:
本题考点: 热化学方程式;燃烧热;中和热.
考点点评: 本题主要考查学生对燃烧热和中和热的概念的理解和掌握以及热化学方程式的书写问题,难度不大.1年前查看全部
- 已知:稀溶液中,H+(aq)+OH-(aq)===H2O(l),△H=-57.3kJ/mol.
已知:稀溶液中,H+(aq)+OH-(aq)===H2O(l),△H=-57.3kJ/mol.
那么下面两句话,哪句是对的?
C.稀硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol.
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量.
请说明理由好吗? ntgongweiwei1年前1
ntgongweiwei1年前1 -
 欧吉 共回答了22个问题
欧吉 共回答了22个问题 |采纳率90.9%c 对.用定义检查就可.D是错的.因为醋酸是弱酸没有完全电离,反应中还要电离吸收热量.所以放出的热量要小于57.3KJ了.1年前查看全部
- 0.5MOL的浓硫酸与1MOL的NAOH的稀溶液混合,放出的热量大于57.3KJ.为什么?
 monster翊1年前2
monster翊1年前2 -
 天下纷飞 共回答了15个问题
天下纷飞 共回答了15个问题 |采纳率93.3%因为-57.3kJ/mol 对应的是稀硫酸与稀氢氧化钠反应的焓变.
浓硫酸在稀释为稀硫酸的过程放出的热是巨大的.
98%H2SO4在20℃时与过量的水混合,溶解焓变为-85.5 kJ/mol,比中和放出的热还要多.1年前查看全部
- 稀溶液中,H+(AQ)+OH-=H20(L);H=-57.3KJ/MOL,推测1mol的HCL的稀溶液与含1molNH3
稀溶液中,H+(AQ)+OH-=H20(L);H=-57.3KJ/MOL,推测1mol的HCL的稀溶液与含1molNH3的稀溶液反应放出的热量与57.3相比是大是小
 春天说再见1年前3
春天说再见1年前3 -
 心事重重的zz 共回答了23个问题
心事重重的zz 共回答了23个问题 |采纳率78.3%相比较小
∵氨水是弱电解质且发生电离:NH3·H2O==NH4++OH-,
正反应是吸热反应,所以要电离出OH-要吸收一部分热量,
所以相比较小.1年前查看全部
- 只要是中和反应,生成1mol水,其热效应均为57.3kJ/mol吗?为什么?
 Flyingwithyou1年前3
Flyingwithyou1年前3 -
 三中小生 共回答了16个问题
三中小生 共回答了16个问题 |采纳率93.8%一定要是强酸强碱稀释过的,弱酸或弱碱会电离吸热就小于57.3kJ/mol了,哈哈!1年前查看全部
- H+(aq) + OH-(aq) === H2O(l);△H = -57.3kJ/mol,含1molNaOH的烧碱溶液与
H+(aq) + OH-(aq) === H2O(l);△H = -57.3kJ/mol,含1molNaOH的烧碱溶液与含0.5molH2SO4的稀硫酸混合后
放热肯定为57.3KJ Gmgh1年前3
Gmgh1年前3 -
 北方时空 共回答了19个问题
北方时空 共回答了19个问题 |采纳率84.2%是错的.首先,两种溶液如果浓度不同,即使不发生化学反应,混合即可放热.其次,每个温度下,化学反应焓变的数值都不相同,化学反应焓变也会受其它环境因素的影响而改变.综上,这个结论是错的.1年前查看全部
- 强酸与强碱的稀溶液发生中和反应的热效应:H + (aq)+OH - (aq)=H 2 O(l);△H=-57.3kJ/m
强酸与强碱的稀溶液发生中和反应的热效应:H + (aq)+OH - (aq)=H 2 O(l);△H=-57.3kJ/mol, 向1L0.5
mol·L -1 的NaOH溶液中加入下列物质:①稀醋酸;②浓H 2 SO 4 ;③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是[ ]A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H1=△H3>△H2
D.△H1>△H3>△H2 左左笑颜1年前1
左左笑颜1年前1 -
 junshuyao 共回答了19个问题
junshuyao 共回答了19个问题 |采纳率84.2%D1年前查看全部
- 已知H++OH-=H2O生成1mol H2O放出热量57.3kJ,下列反应中放出57.3kJ热量的是( )
已知H++OH-=H2O生成1mol H2O放出热量57.3kJ,下列反应中放出57.3kJ热量的是( )
A.1mol稀H2SO4与足量NaOH溶液反应
B.稀盐酸与氨水反应生成1molH2O
C.稀盐酸与稀Ba(OH)2溶液反应生成1mol水
D.稀NaOH与95%浓硫酸生成1mol水 dingli10191年前1
dingli10191年前1 -
 啊喔哦 共回答了17个问题
啊喔哦 共回答了17个问题 |采纳率70.6%解题思路:A、1mol稀H2SO4与足量NaOH溶液反应会生成2mol的水;
B、氨水是弱碱,电离过程需要吸热;
C、稀盐酸与稀Ba(OH)2溶液反应生成1mol水的实质是:H++OH-=H2O;
D、浓硫酸的溶解过程释放热量.A、1mol稀H2SO4与足量NaOH溶液反应会生成2mol的水,放出热量114.6KJ,故A错误;
B、氨水是弱碱,电离过程需要吸热,稀盐酸与氨水反应生成1molH2O放出的热量会小于57.3KJ,故B错误;
C、稀盐酸与稀Ba(OH)2溶液反应生成1mol水的实质是:H++OH-=H2O,放出的热量是57.3KJ,故C正确;
D、浓硫酸的溶解过程释放热量,所以稀NaOH与95%浓硫酸生成1mol水放出的热量大于57.3KJ,故D错误.
故选C.点评:
本题考点: 中和热.
考点点评: 本题考查学生中和热的含义:强酸和强碱的稀溶液反应生成1mol水所放出的热量成为中和热.1年前查看全部
- 已知:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ/mol.请计算下列中和反应中放出的热量.
已知:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ/mol.请计算下列中和反应中放出的热量.
(1)0.1mol Ba(OH)2配成稀溶液,跟足量的稀硝酸反应,能放出______kJ热量;
(2)用10.0L 0.10mol/L醋酸溶液与20.0L 0.10mol/L NaOH溶液反应,放出的热量______(选填“大于”、“小于”或“等于”)57.3kJ,理由是______;
(3)用0.5L 2moL/L的硫酸0.25L 4mol/L的NaOH溶液反应,放出的热量______(选填“大于”、“小于”或“等于”)57.3kJ,理由是______. 活着的滋味1年前1
活着的滋味1年前1 -
 映月儿 共回答了23个问题
映月儿 共回答了23个问题 |采纳率87%解题思路:(1)0.1mol Ba(OH)2与足量的稀硝酸反应生成0.2mol水,根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(2)醋酸是弱电解质,电离时会吸收热量;
(3)硫酸和氢氧化钠是强电解质,二者稀溶液反应生成1mol水放出的热量等于中和热.(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,而0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2molH2O,所以放出的热量为57.3kJ×0.2=11.46kJ,
故答案为:11.46;
(2)醋酸的物质的量=0.5L×2mol/L=1mol,NaOH的物质的量=20.0L×0.10mol/L=2mol,醋酸完全反应,生成水约是1mol,由于醋酸是弱电解质,电离过程为吸热过程,所以用含1mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,
故答案为:小于;醋酸的电离过程吸热;
(3)硫酸的物质的量=10.0L×0.10mol/L=1mol,NaOH的物质的量=0.25L×4mol/L=1mol,由H+(aq)+OH-(aq)═H2O可知,生成1mol水,硫酸和氢氧化钠是强电解质,且是稀溶液,故生成1mol水放出的热量为57.3kJ,
故答案为:等于;硫酸和氢氧化钠是强电解质,二者稀溶液反应生成1mol水.点评:
本题考点: 有关反应热的计算;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查中和热的计算及对中和热的理解,难度不大,注意把握中和热概念:①应是稀溶液,②生成水为1mol,③发生反应的本质是氢离子与氢氧根反应生成水,④注意理解弱电解质、浓溶液对中和热的影响.1年前查看全部
- 下列说法正确的是( ) A.已知:HCl和NaOH反应的中和热:ΔH=-57.3kJ
下列说法正确的是( )
A.已知:HCl和NaOH反应的中和热:ΔH=-57.3kJ/mol,则H 2 SO 4 和Ca(OH) 2 反应的
中和热ΔH=2×(-57.3)kJ/molB.CO(g)的燃烧热是283.0kJ/mol,则2CO 2 (g)= 2CO(g)+O 2 (g)反应的ΔH=2×(+283.0)kJ/mol C.需要加热才能发生的反应一定是吸热反应 D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热  无言的雨1年前1
无言的雨1年前1 -
 北极狐oo 共回答了17个问题
北极狐oo 共回答了17个问题 |采纳率88.2%B
中和热是一个固定的数字只要求生成1moL水,A错误;燃烧热指的是1moL可燃物燃烧生成稳定氧化物时所放出的热量,根据燃烧热写出2CO(g)+O 2 (g)=2CO 2 (g) ΔH=2×(-283.0)kJ/mol,倒过来,焓变变为正值,B正确;需要加热的不一定时吸热反应如铝热反应,需要加热但是铝热反应是放热反应,C错误;燃烧热要求生成稳定的氧化物,要求水必须是液态水,D错误;所以答案选B。1年前查看全部
- ①HCl和NaOH反应的中和热△H=-57.3KJ/mol,则(H₂SO₄)和Ca(OH)
①HCl和NaOH反应的中和热△H=-57.3KJ/mol,则(H₂SO₄)和Ca(OH)₂反应的中和热△H=2×(-57.3)KJ/mol ②CO(g)的燃烧热是283.0KL/mol,则2CO₂(g)=2CO(g)+O₂反应的△H=2×(+283.0)KJ/mol ,①/②中哪个对?
 鄱阳湖静悄悄1年前3
鄱阳湖静悄悄1年前3 -
 robe1 共回答了23个问题
robe1 共回答了23个问题 |采纳率95.7%2对
1不对,中和热 是H+ +OH-==H2O 得到1 molH2O的热量
H2SO4 和Ca(OH)2得到的CaSO4微溶,会产生额外的热.1年前查看全部
- 已知(H+) + (OH-)======= H20生成1molH2O放出热量57.3KJ,下列反应中能放出57.3KJ热
已知(H+) + (OH-)======= H20生成1molH2O放出热量57.3KJ,下列反应中能放出57.3KJ热量的是
A.1mol稀H2SO4与足量NaOH溶液反应.
B.稀盐酸与氨水反应生成1molH2O
C.稀盐酸与稀Ba(OH)2溶液反应生成1mol水
D.稀NaOH与95%浓盐酸反应生成1mol水
可以的话 写下过程 cqf273771年前1
cqf273771年前1 -
 雪灵冰凋 共回答了19个问题
雪灵冰凋 共回答了19个问题 |采纳率100%C和D都可以,因为生成1mol水 消耗的H+和HO-都是1MOL1年前查看全部
- 下列有关H + (aq)+OH - (aq)=H 2 O(l);△H=-57.3kJ/mol的离子反应说法正确的是(
下列有关H + (aq)+OH - (aq)=H 2 O(l);△H=-57.3kJ/mol的离子反应说法正确的是( ) A.代表所有的酸碱中和反应 B.反应物一定是强酸与强碱 C.强酸与强碱的中和反应都可以这样表示 D.代表稀的强酸与稀的强碱反应生成1mol液态水时,放出热量57.3kJ  溪帆1年前1
溪帆1年前1 -
 缘来河南 共回答了22个问题
缘来河南 共回答了22个问题 |采纳率95.5%A、弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热,生成1mol液态水放出的热量小于57.3kJ,故A错误,
B、不一定是强酸与强碱反应,如也可以表示硫酸氢钠与氢氧化钠反应,故B错误;
C、不能表示强酸与强碱生成难溶的盐的反应,硫酸与氢氧化钡反应,故C错误;
D、H + (aq)+OH - (aq)=H 2 O(l);△H=-57.3kJ/mol,表示稀的强酸与稀的强碱反应生成1mol液态水时,放出热量57.3kJ,故D正确.
故选:D.1年前查看全部
- 所有的中和反应的中和热都是57.3kJ/mol吗?
 A冬之火A1年前3
A冬之火A1年前3 -
 q164887836 共回答了12个问题
q164887836 共回答了12个问题 |采纳率100%是的,定义说的!
中和热指1molH+和1molOH-中和生成1mol的H2O所产生的热量.1年前查看全部
- 强酸与强碱的稀溶液发生中和反应的热化学方程式为H + (aq)+OH - (aq)═H 2 O(l)△H=-57.3kJ
强酸与强碱的稀溶液发生中和反应的热化学方程式为H + (aq)+OH - (aq)═H 2 O(l)△H=-57.3kJ•mol -1 .醋酸、浓硫酸、稀硝酸分别与0.1mol•L -1 NaOH溶液恰好完全反应放出的热量与消耗NaOH溶液的体积的关系如图所示.则下列描述正确的是( ) A.A表示稀硝酸与NaOH溶液的反应 B.B表示醋酸与NaOH溶液反应 C.b=5.73 D.C表示浓硫酸与NaOH溶液反应 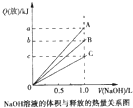
 心中的欢乐1年前1
心中的欢乐1年前1 -
 hotmop 共回答了23个问题
hotmop 共回答了23个问题 |采纳率95.7%强酸与强碱的稀溶液发生中和反应的热效应:H + (aq)十OH - (aq)=H 2 O;△H=一57.3kJ/mol,
分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H 2 SO 4 ;③稀硝酸,
醋酸的电离吸热,浓硫酸溶于水放热,则恰好完全反应时的放出的热量为②>③>①,所以A表示浓硫酸与氢氧化钠溶液的反应,B表示稀硝酸和氢氧化钠溶液的反应,C表示稀醋酸和氢氧化钠溶液的反应,稀硝酸溶于水不放热,电离时不吸热,所以稀硝酸反应时放出的热量是中和热,为5.73kJ,即b=5.73,所以C正确,
故选C.1年前查看全部
- 1L 1mol/L 稀盐酸跟1L 1mol/L NaOH溶液发生中和反应放出57.3KJ热量,写出热化学方程式
 zsp71381091年前2
zsp71381091年前2 -
 huanhuankaixin10 共回答了21个问题
huanhuankaixin10 共回答了21个问题 |采纳率100%HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) 三角号H=-57.3KJ/mol1年前查看全部
- 1mol/L稀HCI与1mol/L稀NaOH产生的热量是57.3KJ么?(都是溶液)
 sdhmhb1年前2
sdhmhb1年前2 -
 廷梅 共回答了15个问题
廷梅 共回答了15个问题 |采纳率86.7%不确定,因为你没有给出溶液体积.生成1mol水才会产生57.3KJ的热量.1年前查看全部
- 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol.向1L
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol.向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸③稀硝酸,恰好完全反应时,反应热△H1、△H2、△H3的关系正确的是( )
A.△H1>△H2>△H3
B.△H2>△H3>△H1
C.△H1>△H3>△H2
D.△H3>△H2>△H1 隐藏忧伤1年前1
隐藏忧伤1年前1 -
 789f117 共回答了17个问题
789f117 共回答了17个问题 |采纳率94.1%解题思路:在稀溶液中强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水放热来解答.强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)十OH-(aq)=H2O;△H=一57.3kJ/mol,
分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸,
醋酸的电离吸热,浓硫酸溶于水放热,则恰好完全反应时的放出的热量为②>③>①,所以△H1>△H3>△H2,
故选C.点评:
本题考点: 反应热的大小比较.
考点点评: 本题考查中和热,明确中和热的概念及弱电解质的电离、浓硫酸溶于水的热效应即可解答,需要注意的是放出的能量多,△H反而小.1年前查看全部
- 中和热弱酸弱碱反应的焓变还是57.3kJ/mol吗
 把西瓜咬哭1年前1
把西瓜咬哭1年前1 -
 dphn16b_ty2434 共回答了18个问题
dphn16b_ty2434 共回答了18个问题 |采纳率88.9%不是.只有强酸强碱稀溶液中和热才是57.3KJ/mol,弱酸弱碱溶液的中和热会低于这个值,因为中和中弱酸弱碱发生电离,而弱酸弱碱的电离是一个吸热过程1年前查看全部
- 强酸与强碱的稀溶液发生中和反应的热效应:H+ +OH- ==H2O;△H=-57.3kj/mol,向1L 0.5mol/
强酸与强碱的稀溶液发生中和反应的热效应:H+ +OH- ==H2O;△H=-57.3kj/mol,向1L 0.5mol/L的NaOH溶液中
加入下列物质:1.稀醋酸 2.浓硫酸 3.稀硝酸,恰好完全反应的热效应△H1 、△H2、△H3的关系正确的是
A.△H1 >△H2 >△H3
B.△H1 △H3 >△H2 szsjx1年前1
szsjx1年前1 -
 chenpei1108 共回答了20个问题
chenpei1108 共回答了20个问题 |采纳率100%稀醋酸是弱酸,水解不完全,因此完全反应需要消耗一部分热水解
浓硫酸先被稀释,然后完全反应,而浓硫酸被稀释会放出大量热
稀硝酸属于正常反应
注意,由于放热时的△H是负值,因此,放热少的△H反而大
earthlinye解答,
这是对回答者的支持和动力1年前查看全部
- 已知中和热的数值是57.3KJ/mol.下列反应物混合时,产生的热量等于57.3KJ 的是( )
已知中和热的数值是57.3KJ/mol.下列反应物混合时,产生的热量等于57.3KJ 的是( )
A.500mL1 mol/LHCl(aq)和500mL 1mol/LNaOH(aq)
B.500mL 1mol/LH2SO4(aq)和500mL 1mol/LBa(OH)2(aq)
C.1000mL1.0mol/L的CH3COOH(aq)和1000mL1.0mol/L的NaOH(aq)
D.1000mL1.0mol/L的HCl(aq)和1000mL1.0mol/L的NaOH(aq) akinglee1年前1
akinglee1年前1 -
 daliangpeng 共回答了20个问题
daliangpeng 共回答了20个问题 |采纳率95%解题思路:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热. 强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热均为57.3 kJ•mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,反应不能生成沉淀,生成沉淀会放出热量.A.500mL1 mol/LHCl(aq)和500mL 1mol/LNaOH(aq)生成的水的物质的量是0.1mol,放出的热量是28.65KJ,故A错误;
B.500mL 1mol/LH2SO4(aq)和500mL 1mol/LBa(OH)2(aq)反应生成的水的物质的量是1mol,但是有硫酸钡沉淀生成,放出的热量比57.3kJ小,故B错误;
C.1000mL1.0mol/L的CH3COOH(aq)和1000mL1.0mol/L的NaOH(aq)反应生成的水的物质的量是1mol,但是醋酸是弱酸,弱酸电离吸热,放出的热量小于57.3kJ,故C错误;
D.1000mL1.0mol/L的HCl(aq)和1000mL1.0mol/L的NaOH(aq)反应生成的水的物质的量是1mol,放出的热量是为57.3kJ,故D正确;
故选D.点评:
本题考点: 中和热.
考点点评: 本题考查了中和热的数值和概念理解,反应过程中热量变化是解题关键,题目难度中等.1年前查看全部
- 实验测得强酸强碱中和生成1mol水放出57.3kJ的热量,而有弱酸或弱碱参加的中和反应,中和热数值低于57.3kJ,这是
实验测得强酸强碱中和生成1mol水放出57.3kJ的热量,而有弱酸或弱碱参加的中和反应,中和热数值低于57.3kJ,这是为什么?
我觉得中和热测定嘛,氢离子浓度和氢氧根浓度肯定相等,如1mol/L醋酸与1mol/L的氢氧化钠反应,肯定完全反应.醋酸钠又水解放热,应该最后高于57.3kJ. 我叫冯1年前3
我叫冯1年前3 -
 aniel0304 共回答了21个问题
aniel0304 共回答了21个问题 |采纳率95.2%首先纠正你的一个错误:水解可看作中和反应的逆反应,中和反应放热,所以水解反应是吸热反应.
但是弱酸中和热的数值小于57.3kJ/mol并不是因为这个缘故.即使忽略醋酸钠水解的因素,其中和热数值仍然小于57.3kJ/mol.
我们来对比一下,
①1mol/L盐酸+1mol/L NaOH等体积混合
②1mol/L醋酸溶液+1mol/L NaOH等体积混合
在不考虑水解的情况下,最后都生成1mol水,这当然没错;但是注意,HCl和醋酸,一个是强电解质,完全电离;一个是弱电解质,可逆电离.因而在混合之前,盐酸中的H +已全部被释放出来,不存在HCl分子;而醋酸溶液中只有很少量的醋酸电离出了氢离子,大部分是以醋酸分子的状态存在的.
酸碱混合后,由于是强碱,NaOH中的OH-也完全释放;因而盐酸中的H +和NaOH溶液中的OH -直接中和生成1mol水,放热57.3kJ;而醋酸溶液中一开始只有极少量的游离H +可以和OH -中和.而且醋酸电离平衡如下【Ac代表醋酸根】:
HAc=[可逆]=(H +)+(Ac -)
在中和过程中,随着H +浓度不断减少,上述平衡要不断右移,使得HAc不断电离;而就在HAc电离的过程中,要吸收热量.因此最后虽然也生成1mol水,但实际上是先吸收一部分再放出57.3kJ,因此中和热数值小于57.3kJ.
如果你还没学平衡理解不了也没关系,简单地说,就是强酸强碱中和时不需要电离吸热,直接中和放热;而弱酸强碱中和时,是要先弱酸电离吸热,再中和放热.因此弱酸强碱中和热小于57.3kJ/mol.1年前查看全部
- (1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量.
(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量.
①实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热.请写出能表示该反应中和热的热化学方程式______;
②分别取100mL 0.50mol/L盐酸与100mL 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.假设盐酸和氢氧化钠溶液的密度都是1g/cm 3 ,中和后生成溶液的比热容c=4.18J/(g•℃).实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃.则实验测得的中和热△H=______(保留1位小数);
③如果用含1mol CH 3 COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热量______57.3kJ(填“大于”、“小于”或“等于”);理由是______.
(2)在催化剂的作用下CH 4 还原NO可以得到三种产物(该条件下均为气体),利用此反应能消除环境污染物NO.理论上每消耗标况下22.4L NO就能放出290kJ的热量.写出该反应的热化学方程式______. hahalvcha1年前1
hahalvcha1年前1 -
 saint999 共回答了24个问题
saint999 共回答了24个问题 |采纳率95.8%(1)①已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀盐酸和氢氧化钡稀溶液都是强酸和强碱的稀溶液,则
反应的热化学方程式为
1
2 Ba(OH) 2 (aq)+HCl (aq)═
1
2 BaCl 2 (aq)+H 2 O△H=-57.3 kJ/mol,
故答案为:
1
2 Ba(OH) 2 (aq)+HCl (aq)═
1
2 BaCl 2 (aq)+H 2 O△H=-57.3 kJ/mol;
②100mL 0.50mol/L盐酸与100mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.1L×0.50mol=0.05mol,
溶液的质量为:200ml×1g/ml=200g,温度变化的值为△T=24.9℃-21.5℃=3.4℃,
则生成0.05mol水放出的热量为Q=m•c•△T=200g×4.18J/(g•℃)×3.4℃=2842.4J,即2.842kJ,
所以实验测得的中和热△H=-
2.842kJ
0.05mol =-56.8 kJ/mol,
故答案为:-56.8 kJ/mol;
③醋酸为弱酸,电离过程为吸热过程,所以用含1mol CH 3 COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,
故答案为:小于;醋酸的电离过程吸热;
(2)在催化剂的作用下CH 4 还原NO可以得到三种产物(该条件下均为气体),则三种气体为N 2 、CO 2 、H 2 O,
反应的化学方程式为CH 4 +4NO=2N 2 +CO 2 +2H 2 O,
理论上每消耗标况下22.4L(即1mol) NO就能放出290kJ的热量,则消耗4molNO放出4×290kJ=1160kJ的热量,
所以反应的热化学方程式为CH 4 (g)+4NO(g)=2N 2 (g)+CO 2 (g)+2H 2 O(g)△H=-1160 kJ•mol -1 ,
故答案为:CH 4 (g)+4NO(g)=2N 2 (g)+CO 2 (g)+2H 2 O(g)△H=-1160 kJ•mol -1 ;1年前查看全部
- (1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量.
(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量.
①实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热.请写出能表示该反应中和热的热化学方程式______;
②分别取100mL 0.50mol/L盐酸与100mL 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃.则实验测得的中和热△H=______(保留1位小数);
③如果用含1mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热量______57.3kJ(填“大于”、“小于”或“等于”);理由是______.
(2)在催化剂的作用下CH4还原NO可以得到三种产物(该条件下均为气体),利用此反应能消除环境污染物NO.理论上每消耗标况下22.4L NO就能放出290kJ的热量.写出该反应的热化学方程式______. 我不是我了拉1年前1
我不是我了拉1年前1 -
 阿霉 共回答了25个问题
阿霉 共回答了25个问题 |采纳率88%解题思路:(1)①根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
②根据Q=m•c•△T计算;
③根据弱电解质电离吸热分析;
(2)根据题意书写化学方程式,根据生成NO的物质的量以及对应的热量书写热化学方程式.(1)①已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀盐酸和氢氧化钡稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为12Ba(OH)2(aq)+HCl (aq)═12BaCl2(aq)+H2O△H=-57.3 kJ/mol,故答...
点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 本题考查热化学方程式以及反应热的计算,题目难度中等,注意理解中和热的概念、把握热化学方程式的书写方法,以及利用化学方程式计算反应热等问题.1年前查看全部
- 25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518
25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518
kJ/mol。下列热化学方程式书写正确的是[ ]A.2H + (aq)+ SO 4 2- (aq)+ Ba 2+ (aq)+ 2OH - (aq)= BaSO 4 (s)+2H 2 O(l);△H= - 114.6 kJ/mol
B.KOH(aq) +1/2H 2 SO 4 (aq)=1/2K 2 SO 4 (aq)+ H 2 O(l); △H=-57.3 kJ/mol
C.C 8 H 18 (l)+25/2O 2 (g)=8CO 2 (g)+9H 2 O(g);△H= -5 518 kJ/mol
D.2C 8 H 18 (g)+25O 2 (g) =16CO 2 (g)+18H 2 O(1);△H= -5 518kJ/mol armoured1年前1
armoured1年前1 -
 黄炎炜 共回答了28个问题
黄炎炜 共回答了28个问题 |采纳率89.3%B1年前查看全部
- 已知:H + (aq) + OH — (aq)=H 2 O(l) △H=—57.3kJ/mol。向1L 0.5
已知:H + (aq) + OH — (aq)=H 2 O(l) △H=—57.3kJ/mol。向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀盐酸;②浓H 2 SO 4 ;③稀醋酸,恰好完全反应的热效应△H 1 、△H 2 、△H 3 的关系正确的是
A.△H 1 >△H 2 >△H 3 B.△H 3 >△H 1 >△H 2 C.△H 1 =△H 3 >△H 2 D.△H 2 >△H 1 >△H 3  hero_tianya1年前1
hero_tianya1年前1 -
 yzmdx 共回答了18个问题
yzmdx 共回答了18个问题 |采纳率94.4%B
1年前查看全部
- 稀硫酸,稀强碱反应生成1mol水时放出57.3kj的热量,写出稀硫酸和稀氢氧化钠溶液反应的和中热化学方程式
 selina3131年前0
selina3131年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,
向1L0.5mol·L-1的NaOH溶液中加入:①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系是(比较大小),原因
.A、△H1>△H2>△H3 B、△H1△H2 沈微凉1年前4
沈微凉1年前4 -
 buyaojinma16 共回答了13个问题
buyaojinma16 共回答了13个问题 |采纳率61.5%应是△H11年前查看全部
- 已知:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,回答下列问题
已知:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,回答下列问题
(1)用20gNaOH配成稀溶液与足量的稀盐酸反应,能放出______kJ的热量.
(2)用1L1.0mol•L-1的醋酸溶液与 2L1.0mol•L-1NaOH溶液反应,放出的热量(填“大于”或“小于”“等于”)______57.3kJ,理由是______. suro1年前1
suro1年前1 -
 狂风舞雨 共回答了15个问题
狂风舞雨 共回答了15个问题 |采纳率93.3%解题思路:(1)根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量即可;
(2)根据中和反应的H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1的含义结合醋酸是弱电解质,电离时会吸收热量分析.H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,
(1)20gNaOH即0.5mol氢氧化钠配成稀溶液后,氢氧根离子的浓度是0.5mol,和足量的酸之间反应会生成0.5mol水,所以放出热量为0.5×57.3kJ=28.65kJ,
故答案为:28.65;
(2)醋酸的物质的量=1L×1mol/L=1mol,NaOH的物质的量=2L×1mol/L=2mol,醋酸完全反应,生成水约是1mol,由于醋酸是弱电解质,电离过程为吸热过程,所以用含1mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,
故答案为:小于;醋酸的电离过程吸热.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查中和热的计算及对中和热的理解,注意热化学方程式中,反应热和方程式的系数成正比,注意把握中和热概念:①应是稀溶液,②生成水为1mol,③发生反应的本质是氢离子与氢氧根反应生成水,④注意理解弱电解质、浓溶液对中和热的影响.题目难度不大.1年前查看全部
- 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,向1L
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,向1L0.5mol·L-1的Ba(OH)2溶液中加入:①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是
A、△H1>△H2>△H3 B、△H1 yingbaby721年前3
yingbaby721年前3 -
 Franko 共回答了15个问题
Franko 共回答了15个问题 |采纳率93.3%选B.因为浓硫酸加入到硫酸钡中,肯定会放热,所以它的△H很定比稀硫酸和稀硝酸的小,但由于稀硫酸会和氢氧化钡反应生成水和硫酸钡沉淀,由于有沉淀生成了就不但有H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol的反应热,还有生成沉淀的反应热,因此稀硫酸的△H比稀硝酸小.因此选B1年前查看全部
- 己知强酸与强碱在稀溶液里发生中和反应生成1mol水时放出57.3kJ热量,用500ML0.6mol/L的稀硫酸跟稍过量的
己知强酸与强碱在稀溶液里发生中和反应生成1mol水时放出57.3kJ热量,用500ML0.6mol/L的稀硫酸跟稍过量的氢氧化钠稀溶液反应放出的能量是
 逛街的鱼PXF1年前1
逛街的鱼PXF1年前1 -
 洪宪 共回答了1个问题
洪宪 共回答了1个问题 |采纳率100%34.281年前查看全部
- 已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.
已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.
(1)写出表示硫酸与烧碱溶液反应的中和热的热化学方程式:[1/2]H2SO4(aq)+NaOH(aq)=[1/2]Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol[1/2]H2SO4(aq)+NaOH(aq)=[1/2]Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)某实验小组用 0.25mol/L的稀硫酸溶液与 0.55mol/L的稀烧碱溶液进行中和热的测定.
I.配制0.25mol/LH2SO4溶液
①若实验中大约要使用245ml 0.25mol/L H2SO4溶液,需要用量筒量取密度为1.8g/cm3,溶质质量分数为98%的浓硫酸______mL
②从下图中选择配制0.25mol/L H2SO4溶液所需要的仪器(填字母)______
II.实验小组用稀硫酸与稀烧碱溶液测定中和热装置如图.名称 托盘天平(带砝码) 小烧杯 容量瓶 玻璃棒 药匙 量筒 胶头滴管 仪器 




序号 a b c d e f g 
①该装置中仪器k的名称是______;装置中有一处错误是______,如果用
该错误装置测定,测得中和热数值会______(填“偏高”“偏低”“无影响”)
②该小组同学及时发现问题并解决后,决定选用50mL 0.25mol/L的稀
硫酸与50mL 0.55mol/L的稀烧碱溶液进行试验,实验中测得△t=3.2℃,
设反应前硫酸与烧碱溶液的密度均为1g/cm3,中和后溶液的比热容为4.18J/(g•℃).那么该小组测定中和热:△H=______.
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)______
a.量取H2SO4溶液和NaOH溶液前用待测液对量筒进行了润洗.
b.测量H2SO4溶液温度后,温度计没有用水冲洗干净直接测NaOH溶液的温度.
c.分多次把NaOH溶液倒入盛有H2SO4溶液的小烧杯中.
d.量取H2SO4溶液时仰视读数.
e.揭开硬纸板用玻璃棒搅拌. 爱在江湖梦冷清1年前1
爱在江湖梦冷清1年前1 -
 kalen813 共回答了14个问题
kalen813 共回答了14个问题 |采纳率85.7%解题思路:(1)依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;(2)Ⅰ①浓H2SO4的物质的量浓度C=,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积; ②实验室配制溶液操作步骤分别是计算、量取、溶解、移液、洗涤、定容、摇匀,根据各操作所需要使用的仪器;
Ⅱ①根据所给的装置图,可知k的名称和缺少硬纸板.大烧杯上如不盖硬纸板,会使一部分热量散失;
②根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
③a用量筒量取溶液前需要润洗,否则造成稀释.
b会导致实验测得中和热的数值偏小.c不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中.d量取H2SO4溶液的体积时仰视读数,会导致所量的H2SO4体积偏大,放出的热量偏高.e会造成热量的散失,可以通过环形玻璃棒慢慢搅拌,(1)在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热.定义要点:以生成1 mol水为基准依据中和热概念分析,稀硫酸与稀烧碱溶液中和热的热化学方程式为:[1/2] H2SO4(aq)+NaOH(aq)=[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:[1/2] H2SO4(aq)+NaOH(aq)=[1/2] Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)Ⅰ①质量分数为98%,密度为1.8g/cm3的浓硫酸,其物质的量浓度c=[1000×1.8×98%/98]mol/L=18.0mol/L
设需要上述浓硫酸的体积为VmL,根据稀释定律,则:18.0 mol/L×VmL=0.25 mol/L×245mL,解得V=3.5mL.故答案为:3.5mL
②验室配制溶液操作步骤分别是计算、量取、溶解、移液、洗涤、定容、摇匀,根据各操作所需要使用的仪器有bcdfg,故答案为:bcdfg.
Ⅱ①根据所给的装置图,可知k的名称为:环形玻璃搅拌棒;
实验装置保温、隔热效果必须好,否则影响实验结果,所以装置缺少硬纸板,故答案为:未用硬纸板(或塑料板)盖住烧杯.
大烧杯上如不盖硬纸板,会使一部分热量散失,导致测得中和热数值会偏低.故答案为:偏低.
②0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值△T为3.2℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.2℃=1337.6J,即1.337kJ,所以实验测得的中和热△H=-[1.337KJ/0.025mol]=-53.5 kJ/mol,
故答案为:-53.5 kJ/mol.
③a、用量筒量取溶液前需要润洗,否则对所量取的溶液造成稀释.导致中和热有误差,故a不符合题意.
b、测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故b符合题意.
c、尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则造成热量的散失,导致中和热有误差,故c符合题意.
d、量取H2SO4溶液的体积时仰视读数,会导致所量的H2SO4体积偏大,放出的热量偏高,中和热的数值偏大,故d符合题意.
e、揭开硬纸片用玻璃棒搅拌,会导致热量散失,影响测定结果,故e符合题意.
故答案为bcde.点评:
本题考点: 热化学方程式;中和热的测定.
考点点评: 本题综合考查了中和热的测定、误差分析以及中和热的热化学方程式的书写,综合性较强,难度较大.1年前查看全部
- 化学中和反应反应热计算已知H+ 和 OH- 生成 H2O 液态 放出57.3KJ/mol 问二十克NaOH配成稀溶液与足
化学中和反应反应热计算
已知H+ 和 OH- 生成 H2O 液态 放出57.3KJ/mol 问二十克NaOH配成稀溶液与足量稀HCL反应放出的热量为多少?TM我算到40.11 但答案是28.65 为什么? 曹草儿1年前1
曹草儿1年前1 -
 kk您为首 共回答了14个问题
kk您为首 共回答了14个问题 |采纳率92.9%NaOH +HCl=NaCl+H2O二十克NaOH ,生成的水 n(H2O)= n(NaOH)= 20g/40g/mol=0.5molH+ 和 OH- 生成 1mol H2O 液态 放出57.3KJ/mol Q = 0.5mol *57.3kJ/mol=28.65kJ1年前查看全部
- 25℃101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.
25℃101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( ) A.2H + (aq)+SO 4 2- (aq)+Ba 2+ (aq)+2OH - (aq)=BaSO 4 (s)+2H 2 O(l)△H=-57.3 kJ/mol B.C 8 H 18 (l)+
O 2 (g)=8CO 2 (g)+9H 2 O(g)△H=-5518 kJ/mol25 2 C.KOH(aq)+
H 2 SO 4 (aq)=1 2
K 2 SO 4 (aq)+H 2 O(l)△H=-57.3 kJ/mol1 2 D.2C 8 H 18 (g)+25O 2 (g)═16CO 2 (g)+18H 2 O(l)△H=-5518 kJ/mol  pdslf1年前1
pdslf1年前1 -
 jieyong07 共回答了20个问题
jieyong07 共回答了20个问题 |采纳率90%A、反应热化学方程式中生成的是2mol水,生成硫酸钡沉淀也放热,反应的中和热不是57.3kJ/mol,故A错误;
B、反应热化学方程式中生成的水是气体,不是稳定氧化物,故B错误;
C、符合中和热的概念,故C正确;
D、热化学方程式中不是1mol物质燃烧,故D错误;
故选C.1年前查看全部
- 有关中和热强酸和强碱稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l),△H=-57.3kJ·mol-1
有关中和热
强酸和强碱稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l),△H=-57.3kJ·mol-1
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H1 ,1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H2 HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3
上述反应均为在溶液中的反应,则△H1、△H2、△H3的关系正确的是 ( )
A.△H1=△H2=△H3 B.△H2<△H1<△H3
C.△H2<△H3<△H1 D.△H2=△H3<△H1 一剑霜寒震九州1年前1
一剑霜寒震九州1年前1 -
 cheroderuimen 共回答了26个问题
cheroderuimen 共回答了26个问题 |采纳率96.2%CH3COOH是弱酸所以△H1绝对值最小,反应热是负数,这点很重要
1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H2 HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3
都是强酸强碱的中和反应.△H2=△H3=△H=-57.3kJ·mol-1
所以选D1年前查看全部
- 中和热数值为57.3KJ/mol,1molNaoH的氢氧化钠固体与含0.5mol硫酸的稀硫酸混合后放出57.3KJ热量,
中和热数值为57.3KJ/mol,1molNaoH的氢氧化钠固体与含0.5mol硫酸的稀硫酸混合后放出57.3KJ热量,对么
 用户名只有七个字1年前2
用户名只有七个字1年前2 -
 yuki_bei 共回答了17个问题
yuki_bei 共回答了17个问题 |采纳率100%中和热的测定需要在溶液之间进行,氢氧化钠固体溶于水会放大量热,但这不是与稀硫酸反应出的中和热.如果用氢氧化钠固体与稀硫酸反应测定的话,放热会远远大于57.3KJ.1年前查看全部
- 判断正误稀硫酸与稀氢氧化钠溶液反应的中和热为-57.3kJ/mol植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能
判断正误
稀硫酸与稀氢氧化钠溶液反应的中和热为-57.3kJ/mol
植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 gilfer1年前2
gilfer1年前2 -
 冬天的龙井茶 共回答了20个问题
冬天的龙井茶 共回答了20个问题 |采纳率95%第一题:
在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热.
其中,中和热有三个要点:
1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热.
2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)====H2O(l)中和热均为57.3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·mol-1;
3.以生成1 mol水为基准.
所以,第一题应为错误,因为不符合第三条.
2楼的仁兄说中和热隐含了第三条,但是实际上氢氧化钠和硫酸反应比例应该是2:1.题目给的并不严格.
第二题:
由于二氧化碳和水在光的作用下生成葡萄糖,是光能转化为葡萄糖中化学键的键能,所以转换成热能是错误的,应该是转化为化学能. 反应比例1年前查看全部
- 已知中和反应的反应热△H=-57.3KJ/mol,若将含0.5mol硫酸的浓溶液与含1molNaOH的溶液混合
已知中和反应的反应热△H=-57.3KJ/mol,若将含0.5mol硫酸的浓溶液与含1molNaOH的溶液混合
放出的热量大于57.3KJ.这句话对么? huaipiqi795251年前1
huaipiqi795251年前1 -
 大别山188 共回答了19个问题
大别山188 共回答了19个问题 |采纳率84.2%对,另一部分热量是由浓硫酸被稀释放的热1年前查看全部
- 1,强酸和强碱在稀溶液中完全中和生成ImolH2O(l),放出57.3kJ热量,浓硫酸与NaOH溶液反应生成lmolH2
1,强酸和强碱在稀溶液中完全中和生成ImolH2O(l),放出57.3kJ热量,浓硫酸与NaOH溶液反应生成lmolH2O(l),反应放出57.3KJ的热量.2,C(s)+CO2(g)===2CO(g) 焓变
 duguzi_sdqy1年前2
duguzi_sdqy1年前2 -
 he66286628 共回答了15个问题
he66286628 共回答了15个问题 |采纳率86.7%(1)错,浓硫酸被稀释会放热
(2)错,这个反应只有在高温下才能反应,事实上焓变是正的,在高温下反应的原因是因为这个反应时熵增的1年前查看全部
- 高中化学简单HCl和NaOH反应的中和热为-57.3KJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57
高中化学简单
HCl和NaOH反应的中和热为-57.3KJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)KJ/mol
这句话对吗?我认为是错的,但不确定
望大家判断一下,谢谢!说明理由更好. tushyang1年前3
tushyang1年前3 -
 送379个拥抱 共回答了10个问题
送379个拥抱 共回答了10个问题 |采纳率90%不对~高中所学的中和热是酸碱中和(通常是强酸强碱)发生中和反应生成1molH2O所放出的热量.H2SO4与Ca(OH)2发生反应的中和热仍为-57.3KJ/mol.理解这句话主要是要弄懂中和热的定义.高中所学的中和热通常不考虑弱酸弱碱,强酸强碱的中和热通常均为-57.3KJ/mol.
如果这句话这样说“H2SO4与Ca(OH)2的反应热为2×(-57.3)KJ/mol”就是对的了.1年前查看全部
- 稀盐酸和氨水反应生成1mol水为什么不放出57.3kj热量?
 沙与水1年前3
沙与水1年前3 -
 su烨 共回答了16个问题
su烨 共回答了16个问题 |采纳率81.3%氨水是弱电解质,反应掉点OH-,再电离出一些OH-.而电离是吸热的.所以小于57.31年前查看全部
- 在稀溶液中,1molch3cooh和1molnaoh完全中和时放出的热量为57.3kj
在稀溶液中,1molch3cooh和1molnaoh完全中和时放出的热量为57.3kj
这句话错在哪?不是已经完全中和了么 冰及1年前1
冰及1年前1 -
 braveheart0 共回答了23个问题
braveheart0 共回答了23个问题 |采纳率87%不会放出全部反应热会被溶液吸收一部分1年前查看全部
- 中和热包括正负号吗中和热是正值还是带正负号?是57.3kj/mol还是-57.3kj/mol.
 诺亚方舟1681年前2
诺亚方舟1681年前2 -
 好人12345678 共回答了13个问题
好人12345678 共回答了13个问题 |采纳率100%中和热本来就是放热,没有正负号.直接说……中和热是…1年前查看全部
- 稀硫酸与氢氧化钠溶液反应的中和热为57.3KJ/mol.57.3前面要不要加负号?
 ZXCVBNM04561年前1
ZXCVBNM04561年前1 -
 zmgxw 共回答了30个问题
zmgxw 共回答了30个问题 |采纳率86.7%中和热不要加负号,如果是焓变就要带负号.1年前查看全部
- 强酸强碱稀溶液发生中和反应每生成一摩水都放出57.3kj吗
强酸强碱稀溶液发生中和反应每生成一摩水都放出57.3kj吗
若生成弱电解质时呢?
若生成不溶盐如ba(oh)2+h2so4==h2o+baso4呢? Vion_0441年前3
Vion_0441年前3 -
 都市守夜人 共回答了21个问题
都市守夜人 共回答了21个问题 |采纳率90.5%概念首先要搞清楚,中和反应的实质是氢离子和氢氧根离子反应生成水,而中和热的概念是1摩尔氢离子和1摩尔氢氧根离子反应生成一摩尔水所放出的热量.
只要是生成了1摩尔的水,放出的热量就肯定是57.3KJ,至于说生成弱电解质的时候,提到了水解.水解是中和反应的逆反应,所以水解是吸热的.但是,无论怎样,酸碱反应的时候,中和反应和水解反应本来就是在同一过程中的,所以生成了1摩尔水,放出的热量就肯定是57.3KJ.
学习化学要搞清楚概念,这个是很重要的.1年前查看全部
- 25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;
25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷(C8H18)的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol
B.KOH(aq)+[1/2]H2SO4(aq)=[1/2]K2SO4(aq)+H2O(l)△H=-57.3kJ/mol
C.C8H18(l)+[25/2]O2(g)=8CO2(g)+9H2O(g)△H=-5518 kJ/mol
D.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol 吃烤肉要喝啤酒1年前1
吃烤肉要喝啤酒1年前1 -
 ttp5858 共回答了10个问题
ttp5858 共回答了10个问题 |采纳率90%解题思路:A、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,醋酸是弱酸,电离要吸热;
B、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,
C、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量;
D、燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量,反应热与化学计量数成正比.A、因醋酸是弱酸,电离要吸热,所以该反应的反应热△H不是-57.3kJ/mol,故A错误;
B、符合中和热的概念,故B正确;
C、反应热化学方程式中生成的水是气体,不是稳定氧化物,故C错误;
D、热化学方程式中不是1mol物质燃烧,所以热化学方程式为:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036kJ/mol,故D错误;
故选B.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了中和热、燃烧热的概念应用,注意概念的内涵理解是解题关键.1年前查看全部
- 稀硫酸与氢氧化钡反应中和热等于-57.3kJ/mol吗
稀硫酸与氢氧化钡反应中和热等于-57.3kJ/mol吗
我资料上说因为生成硫酸钡会使中和热偏大于57.3kJ/mol(此处不含负号),而我试卷上说就等于57.3kJ/mol,到底哪个正确? mhj638134471年前1
mhj638134471年前1 -
 3djaah 共回答了13个问题
3djaah 共回答了13个问题 |采纳率92.3%因为1mol氢离子和1mol氢氧根反应的中和热是57.3k/mol,硫酸和氢氧化钡反应是2mol.另一方面,中和反应指酸和碱反应生成水的过程,硫酸钡的影响不应考虑在内.1年前查看全部
- 强酸和强碱在稀溶液中完全中和生成1molH2O(l),放出57.3kJ热量,浓硫酸与氢氧化钠溶液反应生成1molH2O(
强酸和强碱在稀溶液中完全中和生成1molH2O(l),放出57.3kJ热量,浓硫酸与氢氧化钠溶液反应生成1molH2O(l),
反应放出57.3kJ热量,这句话为什么不对 wewelove1年前1
wewelove1年前1 -
 最佳cc 共回答了19个问题
最佳cc 共回答了19个问题 |采纳率100%浓硫酸与氢氧化钠溶液反应生成1molH2O(l),反应放出大于57.3kJ热量
因为浓硫酸稀析会放出一部分热量1年前查看全部
大家在问
- 1若带正电的小球只受电场力的作用,则它在任意一段时间内( )
- 2初一英语课你应该一天吃三次这些药You should take the medicine three times ___
- 3初一英语课上的“?”有这样一个easy的英语问题:请修改下列病句:This is a “P”and that is a
- 450/5三相交流电度表,表数27,求电费.27*10=270*1.25=337.
- 5在普通梯形ABCD中 对角线AC,BD交与点O,AB平行CD AE垂直DC,BD垂直AC,BD等于15 AC等于20,求
- 6若a、b、c是三角形abc的三边,则根号(a-b-c)²+|b+a-c|=?
- 7描写绿色的和景色的四字词语
- 8英语翻译已经在筹备一家美容院,名字叫“名秀” 想为此名起个合适的英文名字,希望高人赐教.这个名字 含义,“名门闺秀” 或
- 9为什么现在地面塌陷的报道越来越多?
- 10地球上的矿产资源分为能源矿产资源 还有呢 两种
- 11求一篇英文信 letter to_____
- 12“钓鱼爱好者”在鱼饵—挖掘蚯蚓的过程中,多在潮湿、腐烂的有机物丰富,土质松软的环境中采集.这说明影响蚯蚓生态因素有哪些方
- 13-------you-----(wait)for your father here?David is singing i
- 14同济六版课后习题,
- 15夏天砍掉大树的枝叶有什么好处
