将铜粉和无水硫酸铜粉末的混合物32g,加入足量水,充分搅拌后,过滤,在滤液中加入一定量的锌粉恰好完全反应,得到不溶性物质
 gwe8882022-10-04 11:39:541条回答
gwe8882022-10-04 11:39:541条回答要一个一个对应起来,按正确格式

已提交,审核后显示!提交回复
共1条回复
 yinweidong 共回答了12个问题
yinweidong 共回答了12个问题 |采纳率91.7%- 生成铜的质量为3.2克
设生成3.2克铜需要X克Zn和Y克硫酸铜
Zn+CuSO4=ZnSO4+Cu
65------160-----------------64
X----------Y--------------3.2
X=3.25g,Y=8g
1.参加反应的锌粉的质量=3.25g
2.原混合物中铜元素的质量分数.
(32-8)/32=75% - 1年前
相关推荐
- 硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫
硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。 
(1)图中烧瓶内发生的离子反应方程式为_______________。
(2)反应时B瓶内的现象是________________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把Fe 2 (SO 4 ) 3 作催化剂加入到铜粉与稀硫酸的混合物中,并通入空气或氧气,即发生反应。反应完全后向其中加入物质甲调节pH,产生Fe(OH) 3 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu 2+ 、Fe 2+ 、Fe 3+ 分别生成沉淀的pH如下:
请回答下列问题:
①物质甲是________(填字母序号)。
a. NH 3 ·H 2 O b. CuCO 3 c. NaOH d. CuO
②该方案中调节pH的范围是________
第二组:过氧化氢氧化法
将铜丝放到稀硫酸中,加入10%的H 2 O 2 ,微热。充分反应后,经过滤、蒸发结晶、抽滤等操作,用少量
95%的酒精淋洗后晾干,得到硫酸铜晶体。 请回答下列问题:
③加热时温度不宜过高的原因是______________,晶体采用酒精淋洗的优点是______________ 普通新区11年前1
普通新区11年前1 -
 fangyu_gd 共回答了26个问题
fangyu_gd 共回答了26个问题 |采纳率92.3%(1)3Cu+8H + +2NO 3 - =3Cu 2+ +2NO↑+4H 2 O
(2)无色气体变为红棕色
(3)①bd;②3.2~4.7;③防止双氧水分解;酒精与水互溶且极易挥发,减少晶体溶解1年前查看全部
- 将一定质量的铜粉加入到100ml某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体449ml(标准
将一定质量的铜粉加入到100ml某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体449ml(标准状况).然后向上时混合物中加入足量稀硫酸至不再反应为止.容器中剩有铜粉m2g,则(m1-m2)为
第一步生成硝酸铜再加入酸的话相当于加入了硝酸,将第一次剩余的量又反应了,就这样加硫酸一直加下去,怎么还会有m2g固体剩余呢? zhangn19781年前3
zhangn19781年前3 -
 catmici 共回答了19个问题
catmici 共回答了19个问题 |采纳率89.5%很明显此题属于铜过量,根据化学方程式3Cu+8HNO3==3Cu(NO3)2 + 2NO + 4H2O,可知,最初449ml(0.02mol)的NO的产生同时使溶液中还剩余NO3- 0.06mol.而随着稀硫酸的加入至不再反应为止,此时剩余的0.06molNO3-离子完全转化成为NO气体.所以N 得电子数=0.06*3mol,这些电子都由Cu提供,已知1molCu能够失去2mol电子转化为Cu2+离子.所以计算可得从加入稀硫酸开始,共有0.09molCu失去了电子.既 有0.09molCu继续溶解.所以
m1-m2=0.09*63.5=5.715g.1年前查看全部
- 去处铜粉中的铁粉的方法
 hzr9581年前1
hzr9581年前1 -
 王嘉丫头 共回答了19个问题
王嘉丫头 共回答了19个问题 |采纳率63.2%1 最简单的用物理方法 少量铁粉用磁铁吸出来
2 加入硫酸铜溶液,让铁粉把铜置换出来,这样就不用过滤
简而言之方法不是用磁石去吸就是加酸!1年前查看全部
- 某同学将一定量铜粉与10ml的浓硫酸充分反应,生成的气体为1.12 L(已换算为标准状况下)
某同学将一定量铜粉与10ml的浓硫酸充分反应,生成的气体为1.12 L(已换算为标准状况下)
(2)若反应后溶液中滴加5mol •L^-1 NaOH溶液至铜离子恰好全部转变为Cu(OH)2沉淀,消耗NaOH52ml,则原浓硫酸的浓度为( )mol• L^-1
注:要过程,答案不是13,更不是26 mfmvl1年前1
mfmvl1年前1 -
 粉红色的糖糖 共回答了25个问题
粉红色的糖糖 共回答了25个问题 |采纳率88%硫酸根物质的量=硫元素物质的量
反应后硫元素存在于两种物质中
Na2SO4和SO2
Na2SO4物质的量=0.052*5/2=0.13mol
SO2物质的量=1.12/22.4=0.05mol
硫酸物质的量=0.18mol
物质的量浓度=0.18/0.01=18mol/L1年前查看全部
- 铜粉和锌的混合物49克恰好与49克20%的稀硫酸完全反应.混合物中含锌和铁各多少克
 lolozhang1年前1
lolozhang1年前1 -
 麦豆 共回答了24个问题
麦豆 共回答了24个问题 |采纳率95.8%设混合物中含锌的质量为*
Zn+H2SO4=ZnSO4+H2
65 98
* 9.8g
65/*=98/9.8g
*=6.5g
49g-6.5g=42.5g1年前查看全部
- 1.一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比是?(4:
1.一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比是?(4:1)
2.9gCaCO3和MgCO3组成混合物,与足量的盐酸反应,生成二氧化碳的质量可能是?
(4g或4.5g) wangmaomao801年前1
wangmaomao801年前1 -
 s89133765 共回答了18个问题
s89133765 共回答了18个问题 |采纳率88.9%1.开始是Cu,C
灼烧了以后变成了Cu
因为质量相同,所以原来C的质量就是后来的O的质量
即Cu:C=Cu:O=64:16=4:1
2.用极限法,设全部是CaCO3
CaCO3--CO2
100 44
9g x
解得x=3.96g
全部是MgCO3
MgCO3--CO2
84 44
9g y
解得y=4.71g
所以质量的范围是3.96-4.71g
你举出来的答案在这个范围之内,但是不全面1年前查看全部
- 向FeCl3溶液中加入a g铜粉,搅拌全部溶解,然后再向其中加入b g铁粉,经充分反应后得滤渣c g,若已知a>b>c,
向FeCl3溶液中加入a g铜粉,搅拌全部溶解,然后再向其中加入b g铁粉,经充分反应后得滤渣c g,若已知a>b>c,则推断c g滤渣是______,滤液中存在的阳离子是______(填化学式).
 loyaltysipu1年前1
loyaltysipu1年前1 -
 及时雨GSY 共回答了16个问题
及时雨GSY 共回答了16个问题 |采纳率100%解题思路:依据铜全部和铁离子反应生成铜离子和亚铁离子,铁离子可能过量;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,说明铁和铁离子反应后和铜离子反应,若已知 a>b>c,滤渣为铜,铁全部反应.向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,反应为:Cu+2Fe3+=2Fe2++Cu2+,溶液中一定含有阳离子为Fe2+、Cu2+,铁离子可能为全部反应,所以可能含有阳离子Fe3+;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式:2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu,若已知 a>b>c,说明铁和铁离子反应后和铜离子反应,无剩余,则 c克滤渣是Cu,
故答案为:Cu;Fe2+、Cu2+.点评:
本题考点: 铁盐和亚铁盐的相互转变.
考点点评: 本题考查了铁及其化合物性质的分析判断,主要是铁、铜在溶液中和铁离子、铜离子发生反应的顺序和共存判断,题目难度中等.1年前查看全部
- 铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标况下生成NO的体积和剩余金属的质量如下表(
铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
下列计算结果正确的是( )编号 ① ② ③ ④ 稀硝酸体积/mL 100 200 300 400 剩余金属/g 18.0 9.6 0 0 NO体积/mL 2240 4480 6720 v
A. 硝酸的浓度为0.4mol/L
B. ①中溶解了5.6gFe
C. ②中溶解了9.6gCu
D. ④中v=8960 刹小蛮1年前2
刹小蛮1年前2 -
 shimyee 共回答了12个问题
shimyee 共回答了12个问题 |采纳率91.7%解题思路:由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为
=0.15mol,参加反应金属的平均摩尔质量为[8.4g/1.5mol]=56g/mol,故该过程只有Fe参加反应,故实验①只有Fe参与反应,根据NO的体积结合方程式计算硝酸的物质的量、参加反应Fe的物质的量,根据c=[n/V]计算硝酸的物质的量浓度,根据m=nM计算参加反应Fe的质量.0.1mol×(5−2) 2
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量=
=0.15mol,Cu的质量=0.15mol×64g/mol=9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,再根据V=nVm计算该阶段生成NO的体积,进而计算V的值.0.1mol×(5−2) 2 由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为
0.1mol×(5−2)
2=0.15mol,参加反应金属的平均摩尔质量为[8.4g/1.5mol]=56g/mol,故该过程只有Fe参加反应,故实验①只有Fe参与反应,
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量=
0.1mol×(5−2)
2=0.15mol,Cu的质量=0.15mol×64g/mol=9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,
A.由上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为[2.24L/22.4L/mol]=0.1mol,根据方程式可知,参加反应的硝酸的物质的量为0.1mol×4=0.4mol,故硝酸的物质的量浓度=[0.4mol/0.1L]=4mol/L,故A错误;
B.由上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应的Fe的物质的量为0.1mol×[3/2]=0.15mol,故参加反应Fe的质量=0.15mol×56g/mol=8.4g,故B错误;
C.由上述分析可知,实验②中参加反应的金属为Fe,Cu没有参加反应,故C错误;
D.由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量=[4.48L/22.4L/mol]=0.2mol,由3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知,溶液中亚铁离子的物质的量为0.3mol,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据电子转移守恒可知,生成NO的物质的量=
0.3mol×(3−2)
5−2=0.1mol,故生成NO的体积为0.1mol×22.4L/mol=2.24L=2240mL,故V=6720+2240=8960,故D正确,
故选:D.点评:
本题考点: 有关混合物反应的计算;硝酸的化学性质.
考点点评: 本题考查混合物的有关计算,根据表中数据判断各阶段发生的反应是关键,侧重对学生综合能力的考查,过程复杂、计算量较大,为易错题目,难度较大.1年前查看全部
- 实验室将氧气和臭氧的混合气体0.896L(标准状况下)通入盛有20.0g铜粉(足量)的反应容器中,充分加热后,粉末的质量
实验室将氧气和臭氧的混合气体0.896L(标准状况下)通入盛有20.0g铜粉(足量)的反应容器中,充分加热后,粉末的质量变为21.6g,则原混合气体中的臭氧的体积分数为______(氧气和臭氧都能与铜发生反应)
 南河人家1年前1
南河人家1年前1 -
 yang8210931 共回答了16个问题
yang8210931 共回答了16个问题 |采纳率93.8%氧气与铜的反应为2Cu + O2 ==== 2CuO.
臭氧常温下生成氧化铜和氧气,加热时铜和氧气继续反应:
Cu+O3====CuO+O2
或3Cu+O3====3CuO
设混合气体中氧气为Xmol,臭氧为Ymol,所以有以下:
2Cu + O2 ==== 2CuO. 3Cu+O3====3CuO
2 1 2 3 1 3
2X X 2X 3Y Y 3Y
(X+Y)*22.4=0.896L
(2X+3Y)*80+《20-(2X+3Y)*64》=21.6g
由以上两个式子可以解出X=0.02mol、Y=0.02mol,所以臭氧的体积为:22.4*0.02=0.448L,混合气体中臭氧的体积
分数为0.448/0.896*100%=50%
+《20-(2X+3Y)*64》的目的是:因为有可能还有铜没有反应完,所以要加上未反应部分1年前查看全部
- ①氯化亚铁溶液中加入氯水 ②氯化铁溶液加入铁粉 ③氯化铁溶液中加入铜粉 ④氯化铁
①氯化亚铁溶液中加入氯水 ②氯化铁溶液加入铁粉 ③氯化铁溶液中加入铜粉 ④氯化铁
①氯化亚铁溶液中加入氯水
②氯化铁溶液加入铁粉
③氯化铁溶液中加入铜粉
④氯化铁溶液中加入硫氰化钾
四个化学方程式(如果又有离子方程式那就更好了哈) 风雨红楼1年前1
风雨红楼1年前1 -
 wx0516 共回答了25个问题
wx0516 共回答了25个问题 |采纳率92%2FeCl2+Cl2=2FeCl3 2FeCl3+Fe=3FeCl2
2FeCl3+Cu=2FeCl2+CuCl2
FeCl3+3KSCN=3KCl+Fe(SCN)31年前查看全部
- 除去铜粉中的氧化铜,可采用什么方法.至少两种.
 gg虚拟661年前1
gg虚拟661年前1 -
 兔兔骄傲 共回答了24个问题
兔兔骄傲 共回答了24个问题 |采纳率95.8%1、加入稀硫酸,过滤
2、把混合物放入试管中,通入氢气,加热1年前查看全部
- 下列物质的制备操作,可以达到实验目的是( ) A.向氯化铁溶液中不断加入氢氧化钠溶液制备氢氧化铁胶体 B.用铜粉和硫
下列物质的制备操作,可以达到实验目的是()
A.向氯化铁溶液中不断加入氢氧化钠溶液制备氢氧化铁胶体 B.用铜粉和硫粉混合加热制备硫化铜 C.用铁做阳极电解硫酸钠溶液可以制得氢氧化亚铁 D.向铝盐溶液中不断滴入过量烧碱溶液制备Al(OH) 3  luanjie1年前1
luanjie1年前1 -
 vd9p3ouim27df 共回答了15个问题
vd9p3ouim27df 共回答了15个问题 |采纳率86.7%C
A不正确,这样得到的是氢氧化铁沉淀;B不正确,得到对的是Cu 2 S;氢氧化铝钠溶解在氢氧化钠中,D不正确,答案选C。1年前查看全部
- 向稀硫酸中加入铜粉不发生反应,若再加入某种盐则铜粉可以逐渐溶解
向稀硫酸中加入铜粉不发生反应,若再加入某种盐则铜粉可以逐渐溶解
在①NANO3;②KCL;③ZNSO4;④FE2(SO4)3中符合此条件的盐是 A.②④ B.①③ C.①④ D.④ sj100001年前3
sj100001年前3 -
 无限期的等待 共回答了22个问题
无限期的等待 共回答了22个问题 |采纳率90.9%①可以 溶液中同时存在了H+和NO3-,相当于强氧化性的稀硝酸,可以和Cu反应 ②不行,Cl-和K+均无用 ③不行,Cu不能置换Zn ④可以,2Fe(3+)+Cu=2Fe(2+)+Cu(2+) 选C1年前查看全部
- 欲除去铜粉中的铁粉,有多种方法,请举出其中三个
 nanxzi1年前1
nanxzi1年前1 -
 璐一繁 共回答了13个问题
璐一繁 共回答了13个问题 |采纳率76.9%1.加氯化铜溶液:Fe+CuCI2===Cu+FeCI2
2.加盐酸:Fe+2HCI===H2↑+FeCI2
3.加稀硫酸:Fe+HSO4===H2↑+FeSO4
4.用吸铁石将铁吸出来.1年前查看全部
- 稀硫酸中加入铜粉,再加KN03的固体粉末
 流浪人4441年前3
流浪人4441年前3 -
 851002 共回答了19个问题
851002 共回答了19个问题 |采纳率89.5%解析:稀H2SO4电离出的H+ 与KNO3电离出的NO3-可以看作稀HNO3,稀HNO3把Cu氧化,离子方程式:
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO(^)+4H2O1年前查看全部
- 用氢气还原氧化铜得到的铜粉是什么颜色的?
用氢气还原氧化铜得到的铜粉是什么颜色的?
还有啊,为什么不是纳米铜呢? 大红帽1年前1
大红帽1年前1 -
 dani519 共回答了20个问题
dani519 共回答了20个问题 |采纳率85%是红色的
仅仅是铜1年前查看全部
- 将铜粉加入到氯化铁溶液中相关的离子方程式(要配平和注明反应条件)?
 buyuanqq1年前1
buyuanqq1年前1 -
 媚眼秋波 共回答了19个问题
媚眼秋波 共回答了19个问题 |采纳率89.5%Cu + 2Fe3+ =Cu2+ + 2Fe2+
常温下就可以了1年前查看全部
- 当三份铜粉分别与足量的稀硝酸、浓硝酸、热的浓硫酸反应后收集到的气体在相同状况下体积相等时,三份铜粉的质量比为( )
当三份铜粉分别与足量的稀硝酸、浓硝酸、热的浓硫酸反应后收集到的气体在相同状况下体积相等时,三份铜粉的质量比为( )
A. 3:1:2
B. 3:2:2
C. 1:1:2
D. 1:3:2 xinzhu18851年前1
xinzhu18851年前1 -
 南方的袄子 共回答了16个问题
南方的袄子 共回答了16个问题 |采纳率100%解题思路:铜粉与足量的稀硝酸反应,还原产物是NO气体;铜粉与足量的浓硝酸反应,还原产物是NO2气体;铜粉与热的浓硫酸反应,还原产物是SO2气体.根据阿伏加德罗定律,同温同压下相同体积的气体,具有相同的气体分子数.同气体分子数,气体的物质的量相同.当三份铜粉分别与足量的稀硝酸、浓硝酸、热的浓硫酸反应后收集到的气体在相同状况下体积相等时,我们假设所有的气体在标况下都是22.4L
根据n=[V
Vm,n=
22.4L/22.4L/mol]=1 mol,
根据公式n=[m/M],三份铜粉的质量比等于它们的物质的量比.
(1)当铜粉与足量的稀硝酸反应,生成1molNO时
3Cu+8HNO3=3 Cu (NO3)2+2NO↑+4H2O
3 2
n(Cu)1 mol
n(Cu)=1.5 mol
(2)当铜粉与足量的浓硝酸反应,生成1molNO2时
Cu+4HNO3=Cu (NO3)2+2NO2↑+2H2O
1 2
n(Cu) 1 mol
n(Cu)=0.5 mol
(3)当铜粉与热的浓硫酸反应,生成1molSO2时
Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O
1 1
n(Cu) 1 mol
n(Cu)=1 mol
三份铜粉的质量比为1.5:0.5:1=3:1:2
故选A.点评:
本题考点: 硝酸的化学性质;浓硫酸的性质;铜金属及其重要化合物的主要性质.
考点点评: 掌握铜与足量的稀硝酸、浓硝酸、热的浓硫酸的反应原理是解题的关键.应熟练应用上述三个反应的化学方程式.1年前查看全部
- 将铁粉和铜粉的混合物7g,加入到盛有58.1g稀盐酸的烧杯中,恰好完全反应.此时烧杯内各物质的总质量为64.9g.试计算
将铁粉和铜粉的混合物7g,加入到盛有58.1g稀盐酸的烧杯中,恰好完全反应.此时烧杯内各物质的总质量为64.9g.试计算:
(1)原混合物中铁粉的质量分数.
(2)反应后所得溶液中溶质的质量分数.(保留一位小数) 蔬菜20031年前1
蔬菜20031年前1 -
 sy1222 共回答了20个问题
sy1222 共回答了20个问题 |采纳率85%解题思路:根据金属的活动性顺序铁>氢>铜,混合物中铁与稀盐酸反应放出氢气而使反应后烧杯内各物质的总质量小于反应前各物质质量和,因此,利用质量守恒定律可求得恰好完全反应后放出氢气的质量;根据反应的化学方程式,由放出氢气质量计算参加反应的铁的质量及反应后生成氯化亚铁的质量,由反应后烧杯内各物质的总质量及混合物中不参加反应的铜的质量求得反应后溶液质量,即可完成计算.根据质量守恒定律,恰好完全反应放出氢气的质量=7g+58.1g-64.9g=0.2g
设混合物中铁的质量为x,反应生成氯化亚铁的质量为y
Fe+2HCl═FeCl2+H2↑
56 127 2
x y0.2g
[56/x]=[127/y]=[2/0.2g]
x=5.6g,y=12.7g
(1)原混合物中铁粉的质量分数=[5.6g/7g]×100%=80%
(2)反应后所得溶液中溶质的质量分数=
12.7g
64.9g−(7g−5.6g)×100%=20%
答:(1)原混合物中铁粉的质量分数为80%;
(2)反应后所得溶液中溶质的质量分数为20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 利用质量守恒定律,确定恰好完全反应后放出氢气的质量是解答问题有基础,也体现了分析问题的能力.1年前查看全部
- 在100ml某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入1.92g铜粉
在100ml某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入1.92g铜粉,微热,充分反应后溶液中c(Cu离子)为多少?
 头家的形象1年前4
头家的形象1年前4 -
 vgtmbb 共回答了22个问题
vgtmbb 共回答了22个问题 |采纳率90.9%需要考虑过量、不足的问题
n(H+) = 0.4*0.1+0.1*0.1*2 = 0.06 mol
n(NO3-) = 0.04 mol
n(Cu) = 1.92/64 = 0.03 mol
根据方程式 3 Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO + 4H2O
可见,H+不足,要根据H+计算
n(Cu2+) = 0.06*3/8 = 0.0225 mol
所以 c(Cu2+) = 0.225 mol/L1年前查看全部
- 一定质量的铜粉和木炭粉组成的混合物,在空气中充分灼烧后的固体与原混合物的质量相等,则原混合物中铜粉和木炭粉的质量比为(
一定质量的铜粉和木炭粉组成的混合物,在空气中充分灼烧后的固体与原混合物的质量相等,则原混合物中铜粉和木炭粉的质量比为( ).
 泰州袁奕枫1年前4
泰州袁奕枫1年前4 -
 秋天的巧克力 共回答了16个问题
秋天的巧克力 共回答了16个问题 |采纳率81.3%在反应过程中,碳粉和氧气结合成二氧化碳气体,铜粉和氧气结合成氧化铜,所以原来是碳粉和铜粉,铜元素的质量不变,反应后变成等质量的氧元素,实际上就是求出氧化铜中,铜元素和氧元素的质量之比,也就是相对原子质量之比64:16=4:11年前查看全部
- 某同学称取6.4克铜粉加入足量的硝酸银中,充分反应后过滤,洗涤,干燥滤渣.问得到滤渣的质量是多少?(实验过程损失的质量忽
某同学称取6.4克铜粉加入足量的硝酸银中,充分反应后过滤,洗涤,干燥滤渣.问得到滤渣的质量是多少?(实验过程损失的质量忽略不计)神啊!
 有宇的一片天1年前0
有宇的一片天1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将一氧化碳通入盛有12gCu和CuO粉末的试管中 加热至黑色粉末全部转变为红色后 冷却 称的试管中铜粉的质量为10g 求
将一氧化碳通入盛有12gCu和CuO粉末的试管中 加热至黑色粉末全部转变为红色后 冷却 称的试管中铜粉的质量为10g 求混合物中氧化铜质量
 还有单身好男人吗1年前2
还有单身好男人吗1年前2 -
 我在乎你的 共回答了15个问题
我在乎你的 共回答了15个问题 |采纳率86.7%设混合物中的氧化铜质量为x.
CO + CuO =(上面要有△,或加热!) Cu + CO2
80 64
x 10-(12-x)
80/x=64/10-(12-x)
x=10g
答:混合物中的氧化铜质量10g.
完了,
我也是初三的学生,
课真的好紧啊~好好学,考一个好高中啊,
咦,怎么会?对了,弄不好,那个80在CuO下面,64在 Cu下面,x在80下面,10-(12-x)在64下面,不知道为什么,空格不顶用了~1年前查看全部
- 高一化学暑假作业题目.将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应.试判断下列情况下,溶液中存在的
高一化学暑假作业题目.
将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应.试判断下列情况下,溶液中存在的金属离子和金属单质.
(1)某铁粉有剩余,则容器中______(填"有"、"无"或"可能有")Cu,不可能有______(离子);
(2)若CuCl2有剩余,则容器中不可能有_______,可能有_______;
(3)若FeCl3和CuCl2都有剩余,则容器中不可能有_______,一定有_______;
(4)若FeCl3有剩余,则容器中不可能有_______,一定有________. csdsjkk_reload1年前1
csdsjkk_reload1年前1 -
 ba5i 共回答了24个问题
ba5i 共回答了24个问题 |采纳率91.7%将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应.试判断下列情况下,溶液中存在的金属离子和金属单质.
(1)某铁粉有剩余,则容器中___有___(填"有"、"无"或"可能有")Cu,不可能有Cu2+,Fe3+(离子);
(2)若CuCl2有剩余,则容器中不可能有_铁粉,可能有__铜粉,Fe3+,Fe2+;
(3)若FeCl3和CuCl2都有剩余,则容器中不可能有_铜粉,铁粉,一定有Fe2+;
(4)若FeCl3有剩余,则容器中不可能有_铜粉,铁粉,一定有__Fe2+;1年前查看全部
- (2002•东城区)甲、乙、丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下: 甲 乙 丙 取用金属混
(2002•东城区)甲、乙、丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下:
计算:甲 乙 丙 取用金属混合物的质量(/g) 10 10 20 取用稀硫酸的质量(/g) 100 120 100 反应后过滤得到干燥固体的质量(/g) 2 2 12
(1)金属混合物铁的质量分数;
(2)甲制得硫酸亚铁的质量;
(3)该稀硫酸的质量分数. oria_wing1年前1
oria_wing1年前1 -
 kmmeiying 共回答了19个问题
kmmeiying 共回答了19个问题 |采纳率94.7%解题思路:根据铁和铜与酸的反应进行分析,铁能与稀硫酸反应生成氢气,铜不与稀硫酸反应生成氢气,取10g混合物,与100g硫酸和120g硫酸反应都剩余2g固体,则可以判断10g混合物中含有铜的质量为2g,含铁的质量为8g,取20g混合物,与100g硫酸反应剩余12g固体,则说明与8g铁反应需要硫酸的质量为100g,然后根据反应的化学方程式求硫酸亚铁和稀硫酸的质量.(1)取10g混合物,与100g硫酸和120g硫酸反应都剩余2g固体,说明混合物中的铁全部参加反应,可以判断10g混合物中含有铜的质量为2g,含铁的质量为8g,所以混合物中铁的质量分数为:[8g/10g]×100%=80%;
(2)取20g混合物,与100g硫酸反应剩余12g固体,则说明与8g铁反应需要硫酸的质量为100g,所以甲同学取的金属混合物与硫酸恰好完全反应,设生成硫酸亚铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56152
8gx
[56/8g]=[152/x],x=21.71g
(3)设与8g铁反应需要硫酸的质量为y
Fe+H2SO4═FeSO4+H2↑
5698
8g y
[56/8g]=[98/y],y=14g
稀硫酸的质量分数为:[14g/100g]×100%=14%
答:(1)金属混合物中铁的质量分数为80%,
(2)甲制得硫酸亚铁的质量为21.71g,
(3)该稀硫酸的质量分数为14%.点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质;根据化学反应方程式的计算.
考点点评: 本题考查了根据实验数据求混合金属中金属的含量以及所用酸的质量分数和生成物的质量,完成此题,首先要能够根据实验数据确定参加反应的物质的量,然后进行计算.1年前查看全部
- 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.请回答下列问题:
 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.请回答下列问题:
用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.请回答下列问题:
(1)实验前检查整套装置的气密性的方法是______.
(2)B中选用的试剂是______,其作用是______;C中选用的试剂是______,其作用是______.
(3)D中反应的化学方程式是Cu+Cl2
CuCl2△ .Cu+Cl2.
CuCl2△ .
(4)写出E中发生反应的化学方程式:______. farst011年前1
farst011年前1 -
 five5945 共回答了22个问题
five5945 共回答了22个问题 |采纳率90.9%解题思路:(1)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果,装置气密性检查的原理一般是通过压强差来产生明显的现象来判断;
(2)从A中制得的氯气含有杂质氯化氢、水蒸气,依次通过盛有饱和食盐水、和浓硫酸的洗气瓶除去;
(3)氯气和铜在高温条件下化合生成氯化铜;
(4)氯气有毒,用氢氧化钠进行尾气处理吸收过量的氯气.J(1)装置气密性检查的方法:装置连接好后,将导管末端放入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中的导管口有气泡冒出;停止加热,导管口部形成一段水柱,表明整套装置不漏气,
故答案为:装置连接好后,将导管末端放入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中的导管口有气泡冒出,停止加热,导管口部形成一段水柱,表明整套装置不漏气;
(2)从A中制得的氯气含有杂质氯化氢、水蒸气,依次通过盛有饱和食盐水、和浓硫酸的洗气瓶除去;
故答案为:饱和食盐水;除去Cl2中的HCl;浓硫酸;除去Cl2中的水蒸气;
(3)氯气和铜在高温条件下化合生成氯化铜方程式为:Cu+Cl2
△
.
CuCl2,故答案为:Cu+Cl2
△
.
CuCl2;
(4)氯气和氢氧化钠反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.点评:
本题考点: 氯气的实验室制法;氯气的化学性质.
考点点评: 本题是氯气的实验室和性质的检验试验,解题关键是熟记氯气的性质,和常见气体制备试验的设计、试验的分析,是高考的热点.1年前查看全部
- 除去铜粉中的少量氧化铜可以通入氢气或一氧化碳.请问反应要加热吗?
除去铜粉中的少量氧化铜可以通入氢气或一氧化碳.请问反应要加热吗?
这是初中化学题请大家帮帮我,谢谢了~ HUPHL1年前4
HUPHL1年前4 -
 这里混混 共回答了20个问题
这里混混 共回答了20个问题 |采纳率80%一般性都是放在两端开口的试管中进行加热1年前查看全部
- 某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为: 
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于______上(用以下所给仪器的编号填入,下同),取用坩埚应使用______,灼烧后的坩埚应放在______上,不能直接放在桌面上.
A.蒸发皿B.石棉网C.泥三角D.表面皿E.坩埚钳F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是______.
A.灼烧过程中部分氧化铜被氧化B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、______、______、冷却结晶、洗涤、自然干燥.
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的优点是:______.(答案合理即可得分) juzcdrx7781年前1
juzcdrx7781年前1 -
 王孙骄马 共回答了16个问题
王孙骄马 共回答了16个问题 |采纳率100%(1)用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却,
故答案为:C、E、B;
(2)铜在加热条件下易生成氧化铜,氧化铜稳定,难以分解,在灼烧过程中部分氧化铜被还原或者灼烧不充分铜未被完全氧化均会导致杂铜经灼烧后得到的产物含有少量铜,故答案为:B;
(3)由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体,故答案为:蒸发;过滤;
(4)比较反应的两个途径,途径Ⅰ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体,
故答案为:减少污染空气的气体二氧化硫产生;制备相同量的胆矾所需要的硫酸量少.1年前查看全部
- 写出除去下列物质中的少量杂质所用试剂的名称或化学式:铜粉中混有氧化铜______;氢气中混有氯化氢______;硫酸亚铁
写出除去下列物质中的少量杂质所用试剂的名称或化学式:铜粉中混有氧化铜______;氢气中混有氯化氢______;硫酸亚铁溶液中混有硫酸铜______.
 黑人的房间1年前4
黑人的房间1年前4 -
 微微的辣 共回答了21个问题
微微的辣 共回答了21个问题 |采纳率85.7%解题思路:本题属于除杂质题,除杂质题最少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.铜粉中混有氧化铜,氧化铜用稀酸可以除去;氢气中混有氯化氢,可以用碱溶液把氯化氢气体除去;硫酸亚铁溶液中混有硫酸铜,可以用铁粉除去.因为铜排在氢的后面,因此铜与酸不反应,氧化铜用稀盐酸或稀硫酸可以除去;氢气与碱不反应,可以用氢氧化钠溶液把氯化氢气体除去;铁排在铜的前面,因此硫酸铜可以用铁粉除去.故答案为:稀HCl或稀H2SO4;氢氧化钠溶液;铁粉
点评:
本题考点: 物质除杂或净化的探究.
考点点评: 本考点属于物质的分离和提纯,是中考的重点也是一个难点,同学们要认真分析,记住常见离子的溶解性和除去方法,根据两个必要条件综合把握.本考点经常出现在选择题、填空题和实验题中.1年前查看全部
- 有铁粉和铜粉的混合物16g与盐酸恰好反应生成氢气4L(氢气的密度微0.09g/L)、求混合物中铜的质量分数?
 my_girl_is_金刚1年前1
my_girl_is_金刚1年前1 -
 susanmarong 共回答了18个问题
susanmarong 共回答了18个问题 |采纳率94.4%Fe+2HCl=H2+FeCl2
56 2
X 0.09*4
解得X=10.08
铜的质量为16-10.08=5.92g.
混合物中铜的质量分数=5.92g
5.92/16*100%=?
答...
好好学习,天天向上.1年前查看全部
- 怎样从碳粉和铜粉的混合物中除去碳粉 .
 c123c1年前1
c123c1年前1 -
 羽儿菲菲 共回答了17个问题
羽儿菲菲 共回答了17个问题 |采纳率82.4%点燃,剩下的加热,通氢气1年前查看全部
- 除去铜粉中少量的铁粉,所用的试剂是 ,充分反应后,分离出铜粉的主要操作是 ,反应的方程式是 .
 弥虎1年前3
弥虎1年前3 -
 fordearest 共回答了20个问题
fordearest 共回答了20个问题 |采纳率80%加入稀硫酸
过滤
Fe+H2SO4===FeSO4+H2↑1年前查看全部
- 铜粉和铁粉的混合物20克,加入足量的20%的硫酸溶液,待完全反应后,得到氢气0.2 克.
铜粉和铁粉的混合物20克,加入足量的20%的硫酸溶液,待完全反应后,得到氢气0.2 克.
问:⑴混合物中铁为多少克 ⑵要使混合物中的铁完全反应,至少需20%的硫酸溶液多少克 zyzcb1年前1
zyzcb1年前1 -
 好好点 共回答了16个问题
好好点 共回答了16个问题 |采纳率81.3%铜不反应,只有铁反应
1.关系式:Fe---H2
56 2
x 0.2
得:m(Fe)=x=5.6 g
2.Fe + H2SO4 ==FeSO4 + H2
98 2
y 0.2
得:y=9.8 g
所以至少需H2SO4溶液质量=9.8/0.2=49 g1年前查看全部
- 某课外小组同学对均匀含碳的铜粉样品进行铜的质量分数测定,采用如图所示进行实验(气密性良好,图中铁架台等仪器已略去),他们
某课外小组同学对均匀含碳的铜粉样品进行铜的质量分数测定,采用如图所示进行实验(气密性良好,图中铁架台等仪器已略去),他们利用30%的双氧水和二氧化锰作用,制得实验中所需氧气(2H 2 O 2 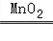 2H 2 O+O 2 ↑)请回答下列有关问题:
2H 2 O+O 2 ↑)请回答下列有关问题:
(1)仪器a的名称 ,c的名称 .
(2)A装置还可用于制备 (气体).
(3)装置D的作用是 .
(4)已知硬玻璃管b内装有铜和碳的混合物4g,当完全反应,停止加热,冷却后,称得装置质量增加2.2g,则样品铜的质量分数是 .
(5)实验完成后,教师评议说,按上述实验设计,即使b中完全反应,c中完全吸收,也不会得出准确的结果,经讨论有同学提出A、B之间加一装置,再次实验后,得到较准确的结果,请你判断,原来实验装置测得铜的质量分数偏 (填“大”或“小”),在A和B之间加入的实验装置可以是 ,其中盛放的药品是 . 雪月xueyue1年前1
雪月xueyue1年前1 -
 浮力 共回答了21个问题
浮力 共回答了21个问题 |采纳率90.5%(1)分液漏斗;锥形瓶;
(2)二氧化碳等;
(3)吸收空气中二氧化碳和水,防止进入C装置影响实验结果;
(4)85%;
(5)偏小;洗气瓶;浓硫酸.1年前查看全部
- 往1Lph=1的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成标准状况下的NO气体44ml.
往1Lph=1的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成标准状况下的NO气体44ml.
反应前混合溶液中硝酸的物质的量 瑞丫丫1年前2
瑞丫丫1年前2 -
 云528 共回答了19个问题
云528 共回答了19个问题 |采纳率94.7%3Cu+8H++2NO3-=3Cu2++2NO+4H2O
3 8 2 2
0.06 0.1 X 0.002(NO的体积是不是输错了)
X=0.002 反应前HNO3的物质的量就是0.002mol1年前查看全部
- (2009•天河区一模)现有 ①四氧化三铁,②甲烷,③铜粉,④氯酸钾,⑤氧气,⑥水,⑦
(2009•天河区一模)现有①四氧化三铁,②甲烷,③铜粉,④氯酸钾,⑤氧气,⑥水,⑦乙醇,⑧碳酸钠等物质,
(1)属于有机化合物的是(填编号,下同) ______;
(2)属于单质的是 ______;
(3)属于氧化物的是 ______;属于盐的是 ______. 狐媚天香1年前1
狐媚天香1年前1 -
 木而风 共回答了17个问题
木而风 共回答了17个问题 |采纳率100%解题思路:利用纯净物、有机物及化合物的分类可以解决此题,有机物是含碳的化合物;单质是含一种元素的纯净物;氧化物是由两种元素组成,其中一种是氧元素;盐是电离时生成金属离子与酸根离子的化合物.(1)有机物是含碳的化合物,故答案为:②⑦
(2)单质是纯净物,只含一种元素.故答案为:③⑤
(3)氧化物是含氧元素的化合物,且只有两种元素;盐是电离时生成金属离子与酸根离子的化合物.
故答案为:①⑥;④⑧点评:
本题考点: 有机物与无机物的区别;物质的简单分类;单质和化合物的判别;常见的氧化物、酸、碱和盐的判别.
考点点评: 此题是对物质分类知识的考查,通过对有机物、单质、氧化物、盐的选择,加深了对物质分类知识的理解.1年前查看全部
- 硝酸银溶液铜粉离子反应方程式 铁与稀盐酸反应的离子方程式
 量贩Baby1年前3
量贩Baby1年前3 -
 ii一切皆有可能 共回答了17个问题
ii一切皆有可能 共回答了17个问题 |采纳率94.1%CU+2Ag+ ===CU2+ 2Ag
Fe+2H+===Fe2+ + H21年前查看全部
- 铜粉放入稀硫酸溶液中,加热后无明显变化.当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )
铜粉放入稀硫酸溶液中,加热后无明显变化.当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )
A.Fe2(SO4)3 B.Na2CO3 C.KNO3 D.FeSO4
附:加入Fe2(SO4)3的现象及反应方程式是什么 zlb09121年前1
zlb09121年前1 -
 guoshichun 共回答了11个问题
guoshichun 共回答了11个问题 |采纳率90.9%答案是C
加入KNO3 就相当于溶液中有了硝酸(原来有氢离子,又加了硝酸根离子)
所以铜和硝酸会发生氧化还原反应
加入Fe2(SO4)3只能是 铜和Fe2(SO4)3反应
Cu + Fe2(SO4)3 = CuSO4 + 2FeSO4
溶液是蓝色和浅绿色的混合颜色
注意:加入Fe2(SO4)3是不会有铜和硫酸的反应的
因为硫酸的浓度很低 铜只能和浓硫酸!加热时反应.1年前查看全部
- 向AgNO3溶液中放入一定量的铁粉和铜粉,充分反应后过滤,向滤渣中滴入稀盐酸,有气泡冒出.则下列对滤渣成分的判断中,正确
向AgNO3溶液中放入一定量的铁粉和铜粉,充分反应后过滤,向滤渣中滴入稀盐酸,有气泡冒出.则下列对滤渣成分的判断中,正确的是( )
A. Fe、Cu、Ag都有
B. 只有Fe和Ag
C. 只有Ag
D. 只有Fe nancylg1年前4
nancylg1年前4 -
 afeng_1982 共回答了16个问题
afeng_1982 共回答了16个问题 |采纳率100%解题思路:根据金属活动性顺序表的应用分析判断.根据题意向滤渣中滴入稀盐酸,有气泡冒出,说明所加入铁粉的量是过量的.向AgNO3的溶液中加入一定量的铁粉和铜粉,在铁和铜同时存在时,由于铁的活泼性大于铜,铁首先与硝酸银反应生成硝酸亚铁和银,铁全部反应完全了,铜再与硝酸银反应.由题意可知,滤渣中加入稀盐酸,发现有气泡产生,则滤渣中含有铁,说明铁是过量的,硝酸银全部与铁参加反应,铜没有参加反应,故滤渣中含有铁、铜和银,滤液中含有硝酸亚铁.由以上分析可知:
A、滤渣成分中含有Fe、Cu、Ag.故A正确;
B、滤渣成分中不仅含有Fe和Ag,还含有Cu,故B不正确;
C、滤渣成分中不只含有Ag,还含有Cu、Fe,故C不正确;
D、滤渣成分中不只含有Fe,还含有Cu、Ag,故D不正确.
故选A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 1.实验室有一包混有铁粉的铜粉,请迩设计两种化学方法除去铜粉中的铁粉.( 用方程式表示)2.某银白色固体A在氧气中燃烧,
1.实验室有一包混有铁粉的铜粉,请迩设计两种化学方法除去铜粉中的铁粉.( 用方程式表示)2.某银白色固体A在氧气中燃烧,火星四射,生成黑色固体B,如果把A放入稀盐酸中,则生成浅绿色的溶液C和气体D,把A投入蓝色溶液E中,发现A表面覆盖一层红色物质F.则 (1)写出A、B、D、的化学式.(2)写出A燃烧的化学方程式.写出A与稀盐酸反应的化学方程式.写出A与E反应的化学方程式.
 一缕dd了无痕1年前1
一缕dd了无痕1年前1 -
 杨振宁 共回答了15个问题
杨振宁 共回答了15个问题 |采纳率100%1.第一种:加入稀盐酸反应,然后过滤,剩余的是铜粉,铜与稀盐酸常温不反应;第二种:加入CuSO4溶液中,然后过滤,剩余为铜粉,原理是置换.
2.(1)A:Fe B:Fe3O4 D:H2
(2)A燃烧:3Fe+2O2=Fe3O4 条件是点燃
与盐酸:Fe+2HCl=FeCl2+H2 H2后面别忘了气体符号
A与E :Fe+CuSO4=Cu+FeSO41年前查看全部
- 将1.28g 铜粉全部溶解在硝酸中.假设产生气体不含N2O4,则参加反应的硝酸物质的量可能为?
将1.28g 铜粉全部溶解在硝酸中.假设产生气体不含N2O4,则参加反应的硝酸物质的量可能为?
05 老娘就是看不惯1年前4
老娘就是看不惯1年前4 -
 云风飘流 共回答了23个问题
云风飘流 共回答了23个问题 |采纳率87%首先n(cu)=0.02mol,反应生成cu(no3)2所需hno3为0.04mol
假设产生气体是no,由转移电子数守恒得n(no)*3=0.02*2 得n(no)=0.013mol,所需hno3为0.04+0.013=0.053mol
假设是no2,同理所需hno3是0.04+0.04(no2的物质的量)=0.08mol
所以介于0.053mol与0.08mol之间1年前查看全部
- 问一道化学题,急!某校化学兴趣小组用下图所示装置测定铜粉样品(含杂质碳)中铜的质量分数。 (1)装置A中发生反应的化
问一道化学题,急!
某校化学兴趣小组用下图所示装置测定铜粉样品(含杂质碳)中铜的质量分数。

(1)装置A中发生反应的化学方程式为 。
(2)装置B的作用是 。
(3) 装置C增重2g,装置D增重4.4g,装置D发生反应的化学方程式为 。
(4)样品中铜的质量分数为 。(结果保留一位小数)
(5)该实验存在一定误差,导致误差的原因有 。(写一条即可)
答案我知道,主要是求(4)的具体过程,应该是91.4%,我算不出来。
 钰泉1年前1
钰泉1年前1 -
 sailormu 共回答了13个问题
sailormu 共回答了13个问题 |采纳率92.3%C + O2 = CO2;D装置增重4.4g,说明含碳1.2g。
2Cu + O2 = 2CuO;C装置增重2g,说明增重氧的质量是:2+1.2=3.2g,
被氧化的铜的质量就是12.8g。
Cu%=12.8/(12.8+1.2)=91.4%1年前查看全部
- 甲醛与氧化铜能反应吗不是氢氧化铜在加热条件下与氧化铜粉反应,化学方程式是什么?以及条件。
 海边螃蟹1年前3
海边螃蟹1年前3 -
 漂浮的狼 共回答了20个问题
漂浮的狼 共回答了20个问题 |采纳率80%可以,反应后生成甲酸和铜1年前查看全部
- 在120℃时.将2L水、1L一氧化碳、1L氧气和2L二氧化碳组成的混合气体依次缓缓通过过量的热铜粉、过量的过氧化钠和过量
在120℃时.将2L水、1L一氧化碳、1L氧气和2L二氧化碳组成的混合气体依次缓缓通过过量的热铜粉、过量的过氧化钠和过量的炽热木炭粉的三个反应管.经充分反应后,恢复到原来温度和压强.其气体体积是( )
A 6L B 5L C 3.5L D 2.5L Breepeng1年前1
Breepeng1年前1 -
 boc7 共回答了26个问题
boc7 共回答了26个问题 |采纳率92.3%过量热铜粉的反应式是:2Cu+O2=2CuO,这样,1L O2全部被吸收没有气体剩余
但是还有CO,别忘了,所以CuO+CO=Cu+CO2,所以1LCO产生1LCO2
再通过过量Na2O2,发生两个反应
2Na2O2+2H2O=4NaOH+O2 2L的H2O被吸收,生成0.5*2=1L 的氧气
2Na2O2+2CO2=2Na2CO3+O2 3L(原来有2L,后来CO生成1L)的CO2被吸收,生成0.5*3=1.5L的氧气
最后,过量炙热的木炭
2C+O2=2CO,2.5L的氧气,发生反应生成5L的CO
最后答案5L
估计是答案错了,我觉得是不太现实的1年前查看全部
- (2012•闵行区二模)硫酸铜是一种应用广泛的化工原料.实验室中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使
(2012•闵行区二模)硫酸铜是一种应用广泛的化工原料.实验室中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).

(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3)和______mL蒸馏水.配制所需仪器除烧杯、量筒、胶头滴管外,还需要的仪器有______.
(2)图1中烧瓶中发生的离子反应方程式为______.
(3)图2是图1的改进装置,其优点有:①______;②______.
为符合绿色化学的要求,某研究性学习小组进行了如下设计:
方案1:以空气为氧化剂.将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O晶体.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加Fe2(SO4)3,即发生反应.反应完全后向其中先后加入物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用.[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7和6.4.]
(4)方案l中的A仅器名称是______.晶体采用酒精淋洗的优点是______.
(5)方案2中物质甲可以是______(选填答案编号,下同),物质乙可以是______.
a.Cub.CuCO3c.CuOd.氨水e.氯水f.双氧水
取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液
指出你认为不合理的方法及存在的问题______.
(6)用铜粉制硫酸铜,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜粉反应,其化学方程式是2Cu+O2+2H2SO4
2CuSO4+2H2O△ .2Cu+O2+2H2SO4.
2CuSO4+2H2O△ . kjh19821年前1
kjh19821年前1 -
 天堂衣 共回答了23个问题
天堂衣 共回答了23个问题 |采纳率91.3%解题思路:(1)根据配制溶液前后溶质的质量不变计算,浓硫酸配制稀硫酸注意利用玻璃棒不断搅拌;
(2)烧瓶中发生Cu与稀硝酸的氧化还原反应;
(3)图2中中间的装置可防止倒吸,并发生氮的氧化物与水的反应;
(4)由铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜分析;酒精与水互溶,除去晶体中的水并减少晶体溶解;
(5)加入的甲为氧化剂,能氧化亚铁离子;物质乙起调节pH的作用并除杂;确认Fe3+是否除净应注意铜离子的颜色造成的干扰;
(6)在氧气存在时用热稀硫酸与铜粉反应生成硫酸铜,以此书写化学反应方程式.(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3),设需要水xmL,
由配制溶液前后溶质的质量不变,则[100×1.84×98%/100×1.84+x×1]×100%=20%,解得x=717.6,浓硫酸稀释放出大量的热,应利用玻璃棒不断搅拌,
故答案为:717.6;玻璃棒;
(2)烧瓶中发生Cu与稀硝酸的氧化还原反应,离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)由装置比较可知,装置2中多出的装置能①溶液不导管不直接接触,防止倒吸,②NO与氧气及碱反应,使有害气体能被完全吸收,故答案为:防止倒吸;有害气体能被完全吸收;
(4)由铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,则A为坩埚,酒精与水互溶,除去晶体中的水并减少晶体溶解,则晶体采用酒精淋洗的优点是酒精与水互溶且极易挥发,减少晶体溶解,
故答案为:坩埚;酒精与水互溶且极易挥发,减少晶体溶解;
(5)由方案可知,Cu与Fe2(SO4)3反应,应除去亚铁离子,则加入f将亚铁离子氧化为铁离子,再利用bc促进铁离子水解转化为沉淀而除去,确认Fe3+是否除净的方法①中Cu2+的蓝色对检验有干扰,故答案为:f;bc;方法①中Cu2+的蓝色对检验有干扰;
(6)在氧气存在时用热稀硫酸与铜粉反应生成硫酸铜,该化学反应为2Cu+O2+2H2SO4
△
.
2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4
△
.
2CuSO4+2H2O.点评:
本题考点: 制备实验方案的设计;硝酸的化学性质;铜金属及其重要化合物的主要性质;配制一定物质的量浓度的溶液.
考点点评: 本题考查硫酸铜制备实验方案的设计,明确装置的作用及发生的氧化还原反应是解答本题的关键,注意除杂的方法及物质的成分、性质的差异、盐类水解的知识来解答,综合性较强,题目难度较大.1年前查看全部
- 在空气中加热铜粉有气体生成吗下列各组物质,在敞口容器里发生反应,容器内物质的总质量在反应前后不变的是( )A.镁条放入盐
在空气中加热铜粉有气体生成吗
下列各组物质,在敞口容器里发生反应,容器内物质的总质量在反应前后不变的是( )
A.镁条放入盐酸中
B.高锰酸钾固体受热分解
C.硫酸铜溶液中加入氢氧化钠溶液
D.在空气中加热铜粉 珍韶华_ff1年前4
珍韶华_ff1年前4 -
 uu的文学青年 共回答了16个问题
uu的文学青年 共回答了16个问题 |采纳率81.3%C,加热铜粉生成氧化铜,黑色固体1年前查看全部
- 铜粉和铁粉的混合物20克,加如足量的20%的硫酸溶液,待完全反应后,得到氢气0.2克.
铜粉和铁粉的混合物20克,加如足量的20%的硫酸溶液,待完全反应后,得到氢气0.2克.
1,混合物中铁为多少克?
2,要使混合物中的铁完全反应,至少需20%的硫酸溶液多少克? youhuo231年前1
youhuo231年前1 -
 a26606 共回答了23个问题
a26606 共回答了23个问题 |采纳率91.3%(1)5.6g
(2)20%是质量分数还是体积分数?
质量:49g
体积:不知密度,没法做1年前查看全部
- 将a克铜粉和木炭粉的混合物在空气中充分灼烧后,生成a克剩余物,求混合物中木炭粉和氧化铜质量
 11603656591033881年前3
11603656591033881年前3 -
 teachertan 共回答了12个问题
teachertan 共回答了12个问题 |采纳率91.7%生成CuO,得到的黑色物质与原混合物的质量相同,可知铜粉和木炭粉的质量=CuO的质量,所以混合物中铜与木炭的质量比=CuO中铜的质量:氧的质量=64:16=4:1.1年前查看全部
- 关于铜片和稀硫酸的反应铜粉和稀硫酸加热不反应,但加入化合物X后,溶液逐渐变色.且质量增加,还放出气体,则X可能是?氯化钠
关于铜片和稀硫酸的反应
铜粉和稀硫酸加热不反应,但加入化合物X后,溶液逐渐变色.且质量增加,还放出气体,则X可能是?
氯化钠 硝酸钾 硫酸钠 碳酸钠? 长青131年前2
长青131年前2 -
 korla31g 共回答了21个问题
korla31g 共回答了21个问题 |采纳率81%硝酸钾
NO3-在酸性环境下具有硝酸性质,具有强氧化性
故加入硝酸钾后,会发生氧化还原反应
3Cu+8H+ +3NO3-=2Cu2+ +2NO+4H2O1年前查看全部
大家在问
- 1fx=x^2-2x+2,x∈[t,t+1],t∈R,求函数fx最小值g(t)的表达式
- 2(1)某实验需要用1.0mol/LNaOH溶液500mL.配制该溶液所需要的玻璃仪器有烧杯、玻璃棒、______、和__
- 3英语中hear后加动名词还是动词原形或动词不定式?
- 4shuttle lower
- 5已知x=2,y=-1是方程组4mx-x+y=13,2x-ny+1=2的解,求2m+3n的值
- 6收获西瓜和授粉有关系.改为否定句
- 7物体做匀变速直线运动,通过某一距离x的时间为t1,通过下段距离x的时间为t2,物体的加速度为多少
- 8高一数学 在线等! 基本不等式及其应用
- 9作文根据漫画亡羊补牢写300字作文
- 10无脊椎动物小结帮忙列表总结一下无脊椎动物部分的特征吧(原生动物、多孔动物、腔肠动物、扁形动物、线虫动物、环节、软体、节肢
- 11一列火车从甲地到乙地,已经行驶了全程的百分之二十五离乙地还有二百七十千米甲乙两地的铁路长多少千米?
- 12(1)7个氮原子( )(2)4个氯离子( )(3)氧化镁(
- 13请问1/s2(s-1)的拉氏逆变换(请给出过程)谢谢
- 14写作文怎样塑造好老师的形象 写好的也行
- 15(2001•河南)图是锅炉上的保险阀,当阀门受到的蒸气压强超过安全值时,阀门就会被顶开,让蒸气跑出一部分,使锅炉内的蒸气
