用惰性电极电解Na2SO4溶液,电解后,Na2SO4的浓度怎么变?为什么?
 没有文化2022-10-04 11:39:542条回答
没有文化2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 zhangbxb 共回答了19个问题
zhangbxb 共回答了19个问题 |采纳率100%- 阳极:OH--4e=2H2O+O2
阴极:4H++4e=2H2
总反应:2H2O=2H2+O2
用惰性电极电解Na2SO4溶液,相当于电解水.电解后,Na2SO4的浓度变大. - 1年前
 zhuzhunihao 共回答了1578个问题
zhuzhunihao 共回答了1578个问题 |采纳率- 用惰性电极电解Na2SO4溶液相当于电解水,因此电解后,水变少了,硫酸钠溶液浓度变大。
- 1年前
相关推荐
- 用惰性电极电解M(NO3)x的水溶液,当阴极增重a g时,在阳极上产生了b L氧气(标况)则M的相对原子质量为
用惰性电极电解M(NO3)x的水溶液,当阴极增重a g时,在阳极上产生了b L氧气(标况)则M的相对原子质量为
为什么是5.6ax/b 或 2.5ax/b telnett1年前1
telnett1年前1 -
 微斯人12 共回答了16个问题
微斯人12 共回答了16个问题 |采纳率100%Mx+-xe- =M 4OH-4e-=2H2O+O2
X 1 4 1
4b/22.4 a/M 4b/22.4 b/22.4 ax/M=4b/22.4 M=5.6ax/1年前查看全部
- 惰性电极电解溴化铜溶液电极反应式
 flyinginhell1年前2
flyinginhell1年前2 -
 g_ryd866hg08_70 共回答了14个问题
g_ryd866hg08_70 共回答了14个问题 |采纳率92.9%阴极:Cu2++2e-=Cu;
阳极:2Br--2e-=Br2;
总反应:Cu2++2Br-=Cu + Br2(q)1年前查看全部
- 根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是 [
根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是  [ ]
[ ]A.利用该反应可持续生产硫酸铜,直至硫酸耗尽
B.甲中b电极的电极反应为:4OH - -4e - ===2H 2 O+O 2 ↑
C.通电初期乙中的总反应为:Cu+H 2 SO 4 CuSO 4 +H 2 ↑
CuSO 4 +H 2 ↑
D.反应过程中甲、乙中溶液的pH都逐渐减小 xiangyu_321年前1
xiangyu_321年前1 -
 晤昧 共回答了23个问题
晤昧 共回答了23个问题 |采纳率95.7%C1年前查看全部
- 用惰性电极电解某溶液时,发现两极只有H2和O2生成,则溶液的浓度可能不变,这句话对吗?如果正确,请给出实例,最好是附以电
用惰性电极电解某溶液时,发现两极只有H2和O2生成,则溶液的浓度可能不变,这句话对吗?如果正确,请给出实例,最好是附以电极反应式
如果在1小时内回答,并正确,另加50分! majunsong81年前1
majunsong81年前1 -
 alexaqiu 共回答了18个问题
alexaqiu 共回答了18个问题 |采纳率100%应该是溶液中的溶质物质的量可能不变吧,像电解硫酸一样,实际上电解的是水啊,所以只是水的量的减少,而硫酸的量并不减少,且用惰性电极像铂电极电解,两极只有H2和O2生成.
至于溶液浓度不变的,这个好像说法不对吧~1年前查看全部
- 问一下化学里面的电解镀锌~电镀的时候,假如电解液用硫酸锌,阳极用锌棒,阴极用惰性电极,那锌能被镀到阴极上去吗?阴极为什么
问一下化学里面的电解镀锌~
电镀的时候,假如电解液用硫酸锌,阳极用锌棒,阴极用惰性电极,那锌能被镀到阴极上去吗?阴极为什么不先产生氢气?水里面的氢离子氧化性应该比锌离子强啊?不解... roziho19861年前4
roziho19861年前4 -
 郁闷De蚂蚁 共回答了27个问题
郁闷De蚂蚁 共回答了27个问题 |采纳率88.9%在溶液浓度大时,氢离子的放电顺序就要排到锌离子的后面.这样,工业上就可以实现镀锌,镀镍等一些活动性比较强的金属.1年前查看全部
- 用惰性电极电解HCL.Na2SO4.NaOH.H2SO4,请写出总反应方程式
用惰性电极电解HCL.Na2SO4.NaOH.H2SO4,请写出总反应方程式
xiexie 我要考律1年前3
我要考律1年前3 -
 yong_so_long 共回答了16个问题
yong_so_long 共回答了16个问题 |采纳率100%不好意思,这些溶液的电解实质上都是电解水,
总反应方程是2H2O=2H2+O2(条件是通电).
阴离子只有硫氟氯溴碘可以变成游离态,阳离子只有在金属活动性顺序表中在氢后面的才可以成为游离态
只有2HCl=H2+2Cl2,因为氯可以变成游离态1年前查看全部
- 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.

请回答:
(1)B极是电源的______极,一段时间后,甲中溶液颜色______,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明______在电场作用下向Y极移动;
(2)电解一段时间内甲、乙装置中的C、D、E、F电极均分别只有一种单质生成时,对应单质的物质的量之比为______,乙中发生反应的离子方程式为2Cl-+2H2O
2OH-+H2↑+Cl2↑通电 .2Cl-+2H2O,若要使电解后的甲装置中的溶液恢复到原浓度则需加入一定量的______;(填物质的化学式)
2OH-+H2↑+Cl2↑通电 .
(3)现用丙装置给铜件镀银,则H应该是______(填“镀层金属”或“镀件”).当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为______,甲中溶液的pH______(填“变大”、“变小”或“不变”);
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是Fe+Cu2+
Cu+Fe2+通电 .Fe+Cu2+.
Cu+Fe2+通电 . 双眼皮毛毛1年前1
双眼皮毛毛1年前1 -
 殷潇潇潇 共回答了24个问题
殷潇潇潇 共回答了24个问题 |采纳率91.7%解题思路:(1)将直流电源接通后,F极附近呈红色,可知道氢离子在该电极放电,所以F即是阴极,并得到其他各个电极的名称,硫酸铜中铜离子减少导致溶液颜色的变化,胶体的胶粒带点电,即电泳实验证明的结论;
(2)C、D、E、F电极转移的电子数目相等,根据转移电子数可计算生成的单质的量,电解池中电解质复原的原则:出啥加啥;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,各个电极上转移的电子数是相等的;
(4)铁电极做阳极则该电极放电的是金属铁本身.将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;
(1)B电极是电源的负极,在A池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,故答案为:逐渐变浅;氢氧化铁胶体粒子带正电荷;
(2)C、D、E、F电极发生的电极反应分别为:4OH-═O2↑+2H2O+4e-、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2,乙中电解饱和食盐水发生的离子方程式为2Cl-+2H2O
通电
.
2OH-+H2↑+Cl2↑,甲装置的电解方程式为:2CuSO4+2H2O
通电
.
2H2SO4+2Cu+O2↑,析出铜和氧气,电解后的甲装置中的溶液恢复到原浓度则需加入一定量的CuO,故答案为:1:2:2:2;2Cl-+2H2O
通电
.
2OH-+H2↑+Cl2↑;CuO;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H++2e-═H2↑,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,电解硫酸铜的过程中氢氧根减少,所以氢离子浓度增大,所以酸性增强,甲中溶液的pH 变小,故答案为:镀件;5.4g;变小;
(4)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池反应为:Fe+Cu2+
通电
.
Cu+Fe2+,故答案为:Fe+Cu2+
通电
.
Cu+Fe2+.点评:
本题考点: 电解原理.
考点点评: 本题考查学生有关电解池的工作原理知识,综合性很强,难度较大,要求学生熟记教材知识,学以致用.1年前查看全部
- 用惰性电极点解硫酸铜,过一段时间,向所得溶液加入0.1molCU(OH)2恰好恢复到点解前的浓度和PH,为什么点解过程转
用惰性电极点解硫酸铜,过一段时间,向所得溶液加入0.1molCU(OH)2恰好恢复到点解前的浓度和PH,为什么点解过程转移电子是0.4MOL
 小二xr1年前1
小二xr1年前1 -
 念我所爱 共回答了14个问题
念我所爱 共回答了14个问题 |采纳率85.7%2CuSO4+2H2O=电解=2Cu+O2+2H2SO4
1个Cu降2价,2个就降4价.而一个O升2价,2个就升4价.
所以1molCuSO4应该转移2mol电子,所以加入0.1molCu(OH)2就应该补充了0.1mol的Cu,也就是转移了0.2mol电子.
我觉得不会是0.4mol吧.1年前查看全部
- 如图用惰性电极电解CuCl2溶液的装置,下列判断中正确的是( )
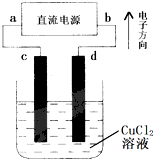 如图用惰性电极电解CuCl2溶液的装置,下列判断中正确的是( )
如图用惰性电极电解CuCl2溶液的装置,下列判断中正确的是( )
A.a是正极、b是负极
B.c是阴极、d是阳极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变 贾明智1年前1
贾明智1年前1 -
 越唱越爱 共回答了15个问题
越唱越爱 共回答了15个问题 |采纳率93.3%解题思路:根据电子的方向可知a为负极,b为正极,则c为阴极,d为阳极,电解CuCl2溶液,在阴极铜离子放电生成Cu,阳极氯离子放电生成Cl2,以此解答该题.A.根据电子的方向可知a为负极,b为正极,故A错误;
B.c连接电源的负极,c为阴极,d连接电源的正极,d为阳极,故B正确;
C.在阴极生成Cu,则c电极质量增加,故C错误;
D.阳极氯离子放电生成Cl2,电解过程中,氯离子浓度降低,故D错误,
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,题目难度不大,本题注意根据电子的方向判断电解池的两极,为解答该题的关键,注意电解时两极的变化.1年前查看全部
- 若以铅蓄电池为电源,用惰性电极电解硫酸铜溶液,在点解过程中生成11.2L氧气,标况下,铅蓄电池中消耗硫酸的物质的量为多少
若以铅蓄电池为电源,用惰性电极电解硫酸铜溶液,在点解过程中生成11.2L氧气,标况下,铅蓄电池中消耗硫酸的物质的量为多少?
 lbewjhrj1年前1
lbewjhrj1年前1 -
 joe6000 共回答了20个问题
joe6000 共回答了20个问题 |采纳率85%0.5摩尔,电解槽里面生成等摩尔的铜和氧气,都是二价,电池里消耗铅和硫酸,也是二价,等摩尔,所以都是0.5摩尔1年前查看全部
- 电化学,求转移电子数用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1MOLCu2(OH)2CO
电化学,求转移电子数
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1MOLCu2(OH)2CO3后恰能恢复到电解钱的浓度和PH(不考虑CO2的溶解).则电解过程中转移电子的总物质的量为多少?答案是0.6MOL 怨念丛生的蓝1年前1
怨念丛生的蓝1年前1 -
 喷火兵 共回答了21个问题
喷火兵 共回答了21个问题 |采纳率81%电解是分两步的,首先消耗铜离子和氢氧根生成硫酸溶液,然后是电解水的过程.加入0.1MOLCu2(OH)2CO3后恰能恢复到电解钱的浓度,说明消耗了0.2mol铜离子,则有0.4mol电子转移.而生成硫酸会降低溶液PH,加入0.2mol氢氧根及0.1mol碳酸根恢原复PH,说明电解最终产生了0.4mol氢离子,而消耗铜离子时产生的氢离子恰好是0.4mol,说明没有氢离子得到电子,也就是电解水的反应没有发生.所以答案是0.4mol1年前查看全部
- 以惰性电极点解500ml浓度为0.1mol/l的cuso4溶液 若生成标准以8状态下氧气1120...
以惰性电极点解500ml浓度为0.1mol/l的cuso4溶液 若生成标准以8状态下氧气1120...
以惰性电极点解500ml浓度为0.1mol/l的cuso4溶液 若生成标准以8状态下氧气1120ml析出铜多少克 点解一段时间 取出电极溶液质量减轻0.32克 则此时溶液氢气离子浓度为多少 佑you尔er1年前1
佑you尔er1年前1 -
 k-钥匙 共回答了18个问题
k-钥匙 共回答了18个问题 |采纳率94.4%设析出铜的质量为a
(1)2CuSO4+2H2O(电解)=2Cu+O2↑+2H2SO4
128g 22.4L
a 1.12L
解得a=6.4g
设电极溶液质量减轻0.32克,生成硫酸的物质的量为b
(2)(2Cu+O2↑)~2H2SO4
160g 2mol
0.32g b
解得b=0.004mol
c(H+)=0.004molX2/0.5L=0.016mol/L1年前查看全部
- 在水中加入等物质的量的Ag+、Na+、Ba2+、CL-、SO42-,用惰性电极进行电解,一段时间后,在两极上得到的氧化产
在水中加入等物质的量的Ag+、Na+、Ba2+、CL-、SO42-,用惰性电极进行电解,一段时间后,在两极上得到的氧化产物和还原产物的质量之比为8:1,我想要相关的解题思路,
那么怎样确定它们的比值是8:1.放电顺序我也知道 小小月光精灵1年前2
小小月光精灵1年前2 -
 gongxiying 共回答了16个问题
gongxiying 共回答了16个问题 |采纳率87.5%楼主注意!
这道题有陷阱,光知道放电顺序不够的,楼下解题就是错了!
你要知道,所给的这些离子是不共存的!而且你少给一个阴离子
等物质的量的Ag+、Na+、Ba2+、CL-、SO42-,生成AgCl、BaSO4沉淀!
所以最后溶液转化为电解水!
所以两极上得到的氧化产物和还原产物的质量之比为8:1(O2:H2)1年前查看全部
- 500ml混有氢氧化钠的饱和食盐水,ph=10,用惰性电极电解一段时间后,阴极产生5.6L氢气,则电解后溶液pH.
 yq21181年前1
yq21181年前1 -
 让时间说话 共回答了13个问题
让时间说话 共回答了13个问题 |采纳率69.2%电解前溶液PH=10,即氢离子浓度c(H+)=10(-10)mol/L,因为c(H+)·c(OH-)=10(-14)【电离平衡】,所以c(OH-)=10(-4)mol/L,电解前溶液中氢氧根离子的物质的量=c(OH-)*0.5L=5*10(-5)mol,电解后产生氢气5.6L即0.25mol,所...1年前查看全部
- 下列离子方程式中,正确的是 A.用惰性电极电解MgCl 2 溶液:2Cl — +H 2 O 通电 2OH — +
下列离子方程式中,正确的是
A.用惰性电极电解MgCl 2 溶液:2Cl — +H 2 O 通电 2OH — +Cl 2 ↑+H 2 ↑ B.碳酸钠溶液显碱性:CO 3 2— +H 2 O  HCO 3 — +OH —
HCO 3 — +OH — C.氯气通入冷水中:Cl 2 +H 2 O  Cl - +ClO - +2H +
Cl - +ClO - +2H + D.碳酸镁悬浊液中加醋酸:CO 3 2 - +2CH 3 COOH = 2CH 3 COO - +CO 2 ↑+H 2 O  井柏然的锁骨1年前1
井柏然的锁骨1年前1 -
 奈我何356 共回答了16个问题
奈我何356 共回答了16个问题 |采纳率87.5%B
1年前查看全部
- (1/2)在25摄氏度时,用惰性电极电解1LCuCl和NaCl混合溶液,一段时间后,测得阴极增重6.4克,阳极只收集..
(1/2)在25摄氏度时,用惰性电极电解1LCuCl和NaCl混合溶液,一段时间后,测得阴极增重6.4克,阳极只收集...
(1/2)在25摄氏度时,用惰性电极电解1LCuCl和NaCl混合溶液,一段时间后,测得阴极增重6.4克,阳极只收集到黄绿色气体3.36L(标准 大海浪1年前1
大海浪1年前1 -
 zch_03 共回答了17个问题
zch_03 共回答了17个问题 |采纳率70.6%阴极:Cu2+ +2e --->Cu;2H+ + 2e --->H2
阳极:2Cl- - 2e ---> Cl2
n(Cu)=6.4/64=0.1mol
n(Cl2)=3.36/22.4=0.15mol
还得到H2:n(H2)=0.05mol
pH=131年前查看全部
- 用惰性电极电解某金属硫酸盐溶液时,在阴极析出a g金属,同时在阳极上放出0.8g气体,如果该金属的相对原子质量
用惰性电极电解某金属硫酸盐溶液时,在阴极析出a g金属,同时在阳极上放出0.8g气体,如果该金属的相对原子质量为b,则其化合价是( )
A. ab
B. [b/a]
C. [20b/a]
D. [b/10a] 眨眼微笑1年前2
眨眼微笑1年前2 -
 crossboe 共回答了12个问题
crossboe 共回答了12个问题 |采纳率100%解题思路:电解硫酸盐溶液时,阳极上氢氧根离子放电生成氧气,如果金属元素的活动性小于氢元素,则阴极上析出金属单质,根据转移电子守恒计算该金属的化合价.电解硫酸盐溶液时,阳极上氢氧根离子放电生成氧气,如果金属元素的活动性小于氢元素,则阴极上析出金属单质,
设金属阳离子的化合价为x,根据转移电子守恒得,
[0.8g/32g/mol×4=
ag
bg/molx,x=
0.8g×4×bg/mol
32g/mol×ag]=[b/10a],
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,根据转移电子守恒来分析解答即可,难度中等.1年前查看全部
- 下列叙述正确的是( )A.在原电池的负极和电解池的阴极上都发生氧化反应B.用惰性电极电解Na2SO4溶液,阴阳两极产物
下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都发生氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH
D.原电池中,活泼金属只能作负极 jiaopi1681年前1
jiaopi1681年前1 -
 才云hh 共回答了17个问题
才云hh 共回答了17个问题 |采纳率82.4%解题思路:A.电解池的阴极发生还原反应;
B.用惰性电极电解Na2SO4溶液,阴阳两极产物分别为H2和O2;
C.用惰性电极电解饱和NaCl溶液,发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑;电解 .
D.原电池中,活泼金属也可作正极,应是较强的金属为负极.A.原电池的负极发生氧化反应,电解池的阴极发生还原反应,故A错误;
B.用惰性电极电解Na2SO4溶液,阴阳两极产物分别为H2和O2,阴阳两极产物的物质的量之比为2:1,故B错误;
C.用惰性电极电解饱和NaCl溶液,发生2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,若有1mol电子转移,则生成1mol NaOH,故C正确;
D.Mg、Al碱性原电池中,Mg为正极,Al为负极,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池的工作原理,为高考常见题型,注意把握工作原理以及电极方程式的书写,易错点为D,注意能举出反例,题目难度中等.1年前查看全部
- 银是惰性电极吗
 艾滋1年前2
艾滋1年前2 -
 伪装者 共回答了26个问题
伪装者 共回答了26个问题 |采纳率88.5%惰性电极:不易得失电子的,一般不与电解液反应的电极.
在电解池中,电极本身不参与反应的电极称为惰性电极,反之称为非惰性电极.
高中的考试里面 基本上要判断惰性电极的话 石墨和铂一看就是惰性的 其他的金属基本都不是惰性电极 单独的说银是不是就不好说了 按照金属的活泼顺序排才能判断 但银一般不是惰性的
你看下,明白没?没得话,我再解释!
这里说实在的最主要的还是方法,方法掌握了,类似的问题都能解决了!
希望我的回答对你有帮助,祝你好运!像这样的问题自己多尝试下,下次才会的!
祝你学业进步!1年前查看全部
- 用惰性电极分别电解下列物质的水溶液一段时间后,氢离子浓度不会改变的是( )
用惰性电极分别电解下列物质的水溶液一段时间后,氢离子浓度不会改变的是( )
A. NaCl
B. CuSO4
C. AgNO3
D. Na2SO4 ff士1年前3
ff士1年前3 -
 taojianping 共回答了13个问题
taojianping 共回答了13个问题 |采纳率100%解题思路:用惰性电极分别电解物质的水溶液,在阴极上放电的离子是电解质中的阳离子,如果不是氢离子放电,氢离子浓度就不会改变.A、用惰性电极电解氯化钠的水溶液,在阴极上放电的离子是电解质中的氢离子,氢离子浓度会减小,故A错误;
B、用惰性电极电解硫酸铜的水溶液,最后的生成物是铜、氧气和硫酸,氢离子浓度会增大,故B错误;
C、用惰性电极电解硝酸银的水溶液,最后的生成物是银、氧气和硝酸,氢离子浓度会增大,故C错误;
D、用惰性电极电解硫酸钠的水溶液,电解的实质是电解水,电解前后一直是硫酸钠的中性溶液,氢离子浓度不会改变,故D正确.
故选D.点评:
本题考点: 电解原理.
考点点评: 本题考查学生电解规律,尅根据电解池的工作原理知识来回答,难度不大.1年前查看全部
- 下列离子方程式正确的是( )A.用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ 电解 . H2↑+Cl2↑B.碳酸氢钙
下列离子方程式正确的是( )
A.用惰性电极电解饱和氯化钠溶液:2Cl-+2H+
H2↑+Cl2↑电解 .
B.碳酸氢钙溶液与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O
C.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓
D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- haiyou20071年前1
haiyou20071年前1 -
 ouyf 共回答了14个问题
ouyf 共回答了14个问题 |采纳率100%解题思路:A.用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近有氢氧根离子生成;
B.二者反应生成碳酸钙和水;
C.自由移动的溴离子能和硝酸银溶液反应生成溴化银沉淀;
D.苯酚钠和二氧化碳反应生成苯酚和碳酸氢钠.A.用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近有氢氧根离子生成,离子方程式为2Cl-+2H2O
电解
.
H2↑+Cl2↑+2OH-,故A错误;
B.二者反应生成碳酸钙和水,离子方程式为HCO3-+Ca2++OH-═CaCO3↓+H2O,故B正确;
C.自由移动的溴离子能和硝酸银溶液反应生成溴化银沉淀,溴乙烷中没有自由移动的溴离子,所以溴乙烷和硝酸银溶液不反应,故C错误;
D.苯酚钠和二氧化碳反应生成苯酚和碳酸氢钠,离子方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故D错误;
故选B.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的书写,涉及电解原理、溴代烃中溴元素检验、苯酚的性质等知识点,注意C中溴元素检验方法、步骤,注意D中碳酸氢根离子酸性小于苯酚,无论二氧化碳是否过量,都生成碳酸氢钠,为易错点.1年前查看全部
- 用惰性电极插入500mlNaCl溶液中, 通电电解,当阴极析出的氢气……
用惰性电极插入500mlNaCl溶液中, 通电电解,当阴极析出的氢气……
1.用惰性电极插入500mlNaCl溶液中, 通电电解,当阴极析出的氢气为56ml(标况,设电解前后体积变化忽略)时,此时溶液中的PH(氢离子浓度的负对数)约为:
A.10 B.11 C.12 D.13
2.用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标况),从而可知M的相对原子质量为:
A. 22.4ax/b B.11.2ax/b C.5.6ax/b D.2.5ax/b
3.用两支惰性电极插入500mlAgNO3溶液中,通电电解.当电解液的PH从6.0变成3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银质量大约是:
A.27mg B.54mg C.108mg D.216mg 完颜孤鸿1年前1
完颜孤鸿1年前1 -
 闲超 共回答了23个问题
闲超 共回答了23个问题 |采纳率91.3%1.析出氢气56ml,即0.0025mol,所以阴极产生氢氧根离子0.005mol,浓度为0.01mol/L,pH为12,选C.
2.阳极发生:4OH- - 4e- ===2H2O + O2.
故答案选C.
3.阳极仍然是氢氧根离子放电:4OH- - 4e- ===2H2O + O2.pH从6.0变为3.0,可视为H+浓度增加了10^-3mol/L,即5*10^-4molOH-放电,转移5*10^-4mol电子,所以阴极产生5*10^-4molAg,质量为54mg.答案选B.1年前查看全部
- 常温下,用惰性电极电解饱和碳酸钠溶液,下列说法中不正确的()
常温下,用惰性电极电解饱和碳酸钠溶液,下列说法中不正确的()
A.溶液的pH不变
B.溶液中碳酸钠的物质的量不变
C.碳酸钠溶液的浓度不变
D.碳酸钠的水解程度不变
没有一个选项我能想得通的.单选题.给我讲讲吧. 希望沉默的P1年前3
希望沉默的P1年前3 -
 大眼丁丁 共回答了17个问题
大眼丁丁 共回答了17个问题 |采纳率100%选
B电解饱和碳酸钠溶液就相当于是电解水
由于是饱和的 肯定有晶体析出 所以剩余的溶液仍为饱和溶液 溶质浓度不变 PH显然也不会变 水解程度也不会变 但是溶质物质的量减少
如果还有疑问 百度HI找我 详谈1年前查看全部
- 急 用惰性电极电解RSO4水溶液
急 用惰性电极电解RSO4水溶液
用惰性电极电解RSO4水溶液,当阴极上增重mg时,(无气体产生)阳极上产生xL气体(标准状况),同时溶液PH由原来6.5变为2.0,(设电解前后溶液体积不变).则R的相对原子质量为
A 100m/V B 2×10的5次方m/V
C 22.4m/x D 11.2m/x
这题选B和D
请告诉我B怎么算的 心雨xingyu1年前1
心雨xingyu1年前1 -
 笨大海 共回答了21个问题
笨大海 共回答了21个问题 |采纳率100%那是用水的PH算转移的电子
你给的题目不够完全……
V是什么,单位是是什么(L还是mL)?
PH=6.5 H+可以忽略,PH=2,H+=0.01mol.L
e=0.01*体积(单位是L)
M=m/(0.01*体积/2)
如果你给的V的单位是mL
计算时要换算成L
那就是对的1年前查看全部
- 当用惰性电极电解含等物质的量的Na+,Ba+、Cl-、Ag+、SO4 2-、NO3-的溶液时,其氧化产物与还原产物的质量
当用惰性电极电解含等物质的量的Na+,Ba+、Cl-、Ag+、SO4 2-、NO3-的溶液时,其氧化产物与还原产物的质量比是多少(请详解)
 一只老虫1年前2
一只老虫1年前2 -
 栖心馆主 共回答了16个问题
栖心馆主 共回答了16个问题 |采纳率87.5%阳离子放电顺序为Ag+>H+>Na+,>Ba2+
阴离子放电顺序为Cl->OH->含氧酸根离子
阳极:2Cl-2e-=Cl2↑
阴极:2Ag++2e-=2Ag
氧化产物与还原产物的物质的量之比为1:2
氧化产物与还原产物的质量比1*71:2*108=71:216
答:氧化产物与还原产物的质量比为71:2161年前查看全部
- 在盛有水的电解槽中加入等物质的量的Ag+ ,Pb+ ,Na+,SO42-,NO3-,Cl-摇匀后用惰性电极进行电解
在盛有水的电解槽中加入等物质的量的Ag+ ,Pb+ ,Na+,SO42-,NO3-,Cl-摇匀后用惰性电极进行电解
问的是通电片刻后,氧化产物与还原产物的质量比为多少? 香如故袭白衣1年前2
香如故袭白衣1年前2 -
 52yq 共回答了22个问题
52yq 共回答了22个问题 |采纳率86.4%首先,硫酸根与铅不共存,氯与银不共存.剩下硝酸根和钠,结果就是电解水…… 质量比为81年前查看全部
- 用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
A. CuCl2(CuSO4)
B. NaOH(NaOH)
C. NaCl(盐酸)
D. CuSO4(CuO) mapodoufu1年前3
mapodoufu1年前3 -
 gge9 共回答了21个问题
gge9 共回答了21个问题 |采纳率90.5%解题思路:电解池中,要想使电解质溶液复原,遵循的原则是:电解后从溶液中减少的物质是什么就利用元素守恒来加什么.A、电解氯化铜时,阳极放氯气,阴极生成金属铜,所以应加氯化铜让电解质溶液复原,故A错误;
B、电解氢氧化钠时,阳极产生氧气,阴极产生氢气,所以应加水让电解质溶液复原,故B错误;
C、电解氯化钠时,阳极产生氯气,阴极产生氢气,所以应加氯化氢让电解质溶液复原,故C错误;
D、电解硫酸铜时,阳极产生氧气,阴极产生金属铜,所以应加氧化铜让电解质溶液复原,故D正确.
故选D.点评:
本题考点: 电解原理.
考点点评: 根据电解池原理,分析两个电极上产生的物质,本着“出什么加什么”的思想来让电解质复原.1年前查看全部
- 在盛有饱和碳酸钠溶液的烧杯中,插入惰性电极,保持温度不变,通电一定时间后,下列判断正确的是:
在盛有饱和碳酸钠溶液的烧杯中,插入惰性电极,保持温度不变,通电一定时间后,下列判断正确的是:
A、溶液的PH增大
B、钠离子数和碳酸根数的比值变小
C、溶液中碳酸钠浓度保持不变,有碳酸钠晶体析出
D、溶液中碳酸钠浓度逐渐减小,有碳酸钠晶体析出 葛吱葛吱1年前4
葛吱葛吱1年前4 -
 竹林湾 共回答了19个问题
竹林湾 共回答了19个问题 |采纳率84.2%实际是电解水.
A、溶液的PH增大
错.是不变的
B、钠离子数和碳酸根数的比值变小
错,不变
C、溶液中碳酸钠浓度保持不变,有碳酸钠晶体析出
对.
D、溶液中碳酸钠浓度逐渐减小,有碳酸钠晶体析出
错,浓度不变.
C是对的1年前查看全部
- 请教几个离子方程式1用惰性电极电解硫酸铜溶液2在硫酸铝溶液中加入偏铝酸钠溶液3在酸性高锰酸钾溶液中滴加双氧水产生气体4金
请教几个离子方程式
1用惰性电极电解硫酸铜溶液
2在硫酸铝溶液中加入偏铝酸钠溶液
3在酸性高锰酸钾溶液中滴加双氧水产生气体
4金属镁和氯化铁溶液共热
(能写几个都可以) 含笑31年前3
含笑31年前3 -
 我只喜欢ァ 共回答了17个问题
我只喜欢ァ 共回答了17个问题 |采纳率94.1%1用惰性电极电解硫酸铜溶液
2Cu(2+)+2H2O==2Cu+4H(+)+O2
2在硫酸铝溶液中加入偏铝酸钠溶液
Al(3+)+3AlO2(-)+6H2O=4Al(OH)3
3在酸性高锰酸钾溶液中滴加双氧水产生气体
5H2O2+2MnO4(-)+6H(+)=2Mn(2+)+5O2+8H2O
4金属镁和氯化铁溶液共热
2Fe(3+)+Mg=2Fe(2+)+Mg(2+)
2Fe(3+)+3H2O===2Fe(OH)3+6H(+)
Mg+2H(+)=Mg(2+)+H21年前查看全部
- 下列反应的离子方程式正确的是( ) A.用惰性电极电解MgCl 2 溶液:2Cl - +2H 2 O═Cl 2 ↑+H
下列反应的离子方程式正确的是( ) A.用惰性电极电解MgCl 2 溶液:2Cl - +2H 2 O═Cl 2 ↑+H 2 ↑+2OH - B.硫化钠发生水S 2- +H 2 O=HS - +OH - C.少量小苏打溶液滴入Ba(OH) 2 溶液中:HCO - 3 十Ba 2+ +OH - =BaCO 3 ↓+H 2 O D.向NH 4 HSO 4 溶液中加入NaOH溶液至混合液为中性:H + +OH - =H 2 O  佳易20061年前1
佳易20061年前1 -
 喜欢吃葡萄的女孩 共回答了20个问题
喜欢吃葡萄的女孩 共回答了20个问题 |采纳率80%A、因电解时在阴极附近产生了大量OH - ,OH - 能与Mg 2+ 反应:Mg 2+ +2OH - =Mg(OH )2 ↓,故A错误;
B、因水解反应为可逆反应,S 2- 的水解用“⇌”而不用“=”,故B错误;
C、因HCO - 3 +OH - =CO 3 2- +H 2 O,所以少量小苏打溶液滴入Ba(OH) 2 溶液中发生NaHCO 3 +Ba(OH) 2 =BaCO 3 ↓+H 2 O+NaOH,故C正确;
D、因NH 4 HSO 4 溶液中NH + 4 与OH - 反应:NH + 4 +OH - =NH 3 •H 2 O,故D错误;
故选C.1年前查看全部
- 如图所示的装置,C、D、E、F均为惰性电极.将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:(1)电
 如图所示的装置,C、D、E、F均为惰性电极.将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:(1)电极A是______填“正极”或“负极”)
如图所示的装置,C、D、E、F均为惰性电极.将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:(1)电极A是______填“正极”或“负极”)
(2)甲装置中C极的电极反应式为______.
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,所得溶液在25℃时的pH=______.
(4)欲用丙装置给铜镀银,G应该是______(填“铜”或“银”),电镀液的主要成分是(填化学式)______. 专为看点ee1年前1
专为看点ee1年前1 -
 美丽红 共回答了18个问题
美丽红 共回答了18个问题 |采纳率100%解题思路:(1)该装置中,将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色,说明F为阴极,阴极连接原电池负极;
(2)甲中C电极上氢氧根离子放电、阴极D上铜离子放电;
(3)用惰性电极电解饱和NaCl溶液时,阳极上氯离子放电生成氯气,根据氯气和氢氧化钠之间的关系式计算NaOH的物质的量,再根据pH公式计算溶液的pH;
(4)电镀时,镀层作阳极、镀件作阴极,电解质溶液为可溶性的银盐.(1)该装置中,将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色,说明F电极上氢离子放电,同时电极附近有氢氧根离子生成,则F为阴极,B是原电池负极,则A是原电池正极,故答案为:正极;
(2)甲中C电极上氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)用惰性电极电解饱和NaCl溶液时,阳极上氯离子放电生成氯气,电池反应式为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,根据氯气和NaOH之间的关系式得n(NaOH)=2n(Cl2)=[0.056L/22.4L/mol×2=0.005mol,c(OH-)=c(NaOH)=
0.005mol
0.5L]=0.01MOL/l,
c(H+)=
10−14
0.01mol/L=10-12 mol/L,则溶液的pH=12,故答案为:12;
(4)电镀时,镀层作阳极、镀件作阴极,电解质溶液为可溶性的银盐,丙装置给铜镀银,G应该是银,电镀液的主要成分是AgNO3,故答案为:银;AgNO3.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,根据F电极附近溶液颜色变化确定阴阳极、正负极,再结合各个电极上反应来分析解答,注意溶液pH的计算方法.1年前查看全部
- 某溶液中存在等物质的量浓度的下列离子,用惰性电极电解该溶液,最先得电子的离子是?A.H+ B.Ag+ C.Fe2+ D.
某溶液中存在等物质的量浓度的下列离子,用惰性电极电解该溶液,最先得电子的离子是?A.H+ B.Ag+ C.Fe2+ D.Cu2+
 高ff传大使1年前2
高ff传大使1年前2 -
 其实俺不孬 共回答了19个问题
其实俺不孬 共回答了19个问题 |采纳率73.7%选B,在这里银是最不活泼金属,所以他的离子的得电子能力最强1年前查看全部
- 如下图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞液,在F极附近显红色.
如下图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞液,在F极附近显红色.
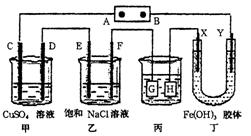
1.电源A极的名称是____.
2.甲装置中电解反应的总化学方程式:____.
3.如果收集乙装置中产生的气体,两种气体的体积比是____.
4.装置丁中的现象是_________________________________. dengyunzi1年前5
dengyunzi1年前5 -
 白雪红颜 共回答了10个问题
白雪红颜 共回答了10个问题 |采纳率100%装置为电解池,
1,乙中是电解饱和NaCl,
阳极:2Cl- - 2e-= Cl2
阴极:2H2O+2e-= H2 +2OH-
F极附近显红色,酚酞碱性显红色,说明F极附近有大量氢氧根离子,所以F极是阴极这样电源B极是负极,A为正极
2,甲电解硫酸铜
阳极:4OH- -4e-=2H2O+O2气体
阴极:Cu2+ +2e-=Cu
2CuSO4+2H2O=通电=2H2SO4+2Cu+O2气体
3,2 NaCl+2H2O=Cl2气体+ H2气体+2NaOH
生成气体的比例1:1
4,因为氢氧化铁胶粒带正电荷 这样在Y电极是阴极,Y极附近红褐色变深.1年前查看全部
- 课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。
课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色。试回答下列问题:

(1)电源A极的名称是 。
(2)甲装置中电解反应的总化学方程式: 。
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该是 (填“铜”或“银”),电镀液的溶质是 (填化学式)。
(5)装置丁中的现象是 。 几度樱花开1年前1
几度樱花开1年前1 -
 gaoyen2001 共回答了18个问题
gaoyen2001 共回答了18个问题 |采纳率88.9%1年前查看全部
- 用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,
用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,切断电源,使电极仍浸在溶液中.
1)写出开始电解时反应式(两条)
2)电解后电极在溶液经充分反应后,阴极比原来增重多少g?溶液的H+浓度时多少(溶液体积保持不变) 5493381681年前1
5493381681年前1 -
 虚掩的门yoyo 共回答了27个问题
虚掩的门yoyo 共回答了27个问题 |采纳率88.9%cu+ + 2e- =cu
2H2o -- 4e- = O2 + 4H+
2Cu+ 2 H2O2 = 2Cu +O2 + 4H+ 0.896L/22.4L/mol=0.04mol(O2) 可推出阳极一共失去0.04*4=0.16摩尔电子,一摩尔铜有2摩尔电子,所以依照对因关系有0.08摩尔铜生成,即为0.08*64=5.12g铜,即阴极增重5.12g
在阳极增加0.16摩尔H+原子,除以液体体积0.1L得1.6摩尔每升,即H+离子的浓度为1.6摩尔每升
总体是这样了,你在组织下语言,这道题就能得分了1年前查看全部
- 用惰性电极电解硫酸铜溶液,若阴极上析出的铜的质量为3.2g.则阳极上产生的气体在标准状况下的体积?
 wjh20081年前1
wjh20081年前1 -
 zhglen 共回答了24个问题
zhglen 共回答了24个问题 |采纳率91.7%根据电荷守恒原理,阴极消耗0.1mol电荷,所以阳极消耗0.05,阳极电解oh根,产生氧气,所以最后产生0.025氧气,再乘以22.4即可得0.561年前查看全部
- 用惰性电极电解亚硫酸钠溶液的电极方程式如何写
 martliu1231年前1
martliu1231年前1 -
 TS尚品 共回答了12个问题
TS尚品 共回答了12个问题 |采纳率100%2SO3^2- - 4e^ = 2SO2+O2 追问:可材料上为什么说“当电解质为活泼金属的含氧酸盐时,相当于电解水” 回答:我的理解是这样的·当电解质为强酸强碱盐的时候 相当于水的电解·· 如果是强碱弱酸盐的时候情况有所变化· 我们可以列出 水中的离子···NA+ ,SO3^2- ,OH- ,H+ 所以我们也可以认为水中含有 氢氧化钠与亚硫酸··· 所以电解过程中会有 二氧化硫溢出·· 追问:你能告诉我碘离子、亚硫酸根离子、氯离子、二价硫离子、氢氧根离子还原性的强弱吗 回答:碘离子、亚硫酸根离子、氯离子、二价硫离子、氢氧根离子
二价硫离子>碘离子>亚硫酸根离子>氢氧根离子 >氯离子 6年不碰化学·我不敢保证对错·但是可以肯定的是非金属单质的氧化性越强,其阴离子的还原性就越弱 追问:我现在真有点晕!回答:比如说 氯气的氧化性很强 那么氯离子的还原性就很弱··硫 以前我们学习的时候最出名的一个实验就是硫在氧气中燃烧 所以硫相对来说还原性比较强·所以硫离子的氧化性就弱了 而相对它的还原性就强些··· 追问:你是干什么工作的啊,都这么多年了你还记得,佩服!回答:我是学计算机的··上大学以后就没碰过化学·不过以前很喜欢罢了· 其实个人感觉化学学的很多都是我们生活中经常遇到的东西 ··高中化学就是看着元素周期表来把那些经常用到的元素归纳起来就能学好了·算术题很多都是些初中数学的知识··· 追问:你就读那所大学啊,这么厉害!回答:=.=!1年前查看全部
- 将两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是(
将两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( )
A. 阳极上析出5.6mL O2(标准状况)
B. 阴极上析出64mg Cu
C. 阴极上析出11.2mL H2(标准状况)
D. 阳极和阴极质量都无变化 3vq8wfz61年前4
3vq8wfz61年前4 -
 dna2sh 共回答了21个问题
dna2sh 共回答了21个问题 |采纳率85.7%解题思路:以惰性电极电解CuSO4溶液,阳极发生4OH--4e-═2H2O+O2↑,阴极发生2Cu2++4e-═2Cu,溶液显浅蓝色,说明只有部分铜离子放电,结合电子的转移计算该题.A.阳极发生4OH--4e-═2H2O+O2↑,当有1×10-3mol的OH-放电时,生成氧气的体积为1×10-3mol×[1/4]×22.4L/mol=5.6mL,故A正确;
B.当有1×10-3mol的OH-放电时,转移1×10-3mol电子,则在阴极析出5×10-4molCu,质量为32mg,故B错误;
C.转移1×10-3mol电子,阴极析出铜,溶液显浅蓝色,说明铜离子部分放电,没有氢气析出,故C错误;
D.阴极析出铜,质量变化,故D错误.
故选A.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理及计算,明确发生的电极反应及硫酸铜的物质的量是解答本题的关键,为易错题,题目难度中等.1年前查看全部
- 将含有0.4molNaCl和0.5mol Cu(N03)2的水溶液1L,用惰性电极电解一段时间后,在一个电极上
将含有0.4molNaCl和0.5mol Cu(N03)2的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol Cu,则在另一个电极上析出的气体(标准状况下)的体积是( )
A.4.48L
B.5.6L
C.6.72L
D.11.2L Cappuccino10281年前1
Cappuccino10281年前1 -
 zhlnn 共回答了21个问题
zhlnn 共回答了21个问题 |采纳率85.7%解题思路:根据电解的原理分析电极反应,写出电极反应,依据电子守恒计算;混合溶液中阴离子Cl-、OH-移向阳极,阳离子Cu2+、H+移向阴极,依据离子放电顺序写出电极反应,根据溶液中的离子物质的量和电解过程中电子守恒进行计算判断;将含有0.4mol NaCl和0.5mol Cu(N03)2的水溶液1L,用惰性电极电解,溶液中的阳离子有Cu2+、H+、Na+;移向阴极,发生的电极反应为:Cu2++2e-=Cu
阴离子Cl-、OH-、NO3-;移向阳极;电极反应为:2Cl--2e-=Cl2↑,0.3molCu生成转移电子为0.6mol;溶液中氯离子物质的量为0.4mol,全部反应失去电子物质的量为0.4mol,生成氯气为0.2mol,还有0.2mol电子是氢氧根离子失去发生电极反应为:4OH--4e-=2H2O+O2↑生成氧气为0.05mol,所以共生成气体标准状况下生成气体体积为(0.05mol+0.2mol)×22.4L/mol=5.6L;
故选B.点评:
本题考点: 电解原理;氧化还原反应的计算.
考点点评: 本题考查了电解原理的应用,混合电解电极产物的判断与计算,主要是离子放电顺序和电子守恒的应用书写电极反应和进行有关计算.1年前查看全部
- 用惰性电极分别电解NAOH,H2SO4溶液后,PH分别有什么变化。为什么?? 求大神
 8750121年前1
8750121年前1 -
 lqxj_123 共回答了109个问题
lqxj_123 共回答了109个问题 |采纳率24.8%碱ph变大1年前查看全部
- 用惰性电极电解FeBr2的电极反应分别是
 陈琪qiqi1年前1
陈琪qiqi1年前1 -
 小月99 共回答了18个问题
小月99 共回答了18个问题 |采纳率100%主反应:阴极 Fe2+ + 2e = Fe,阳极 2Br- -2e = Br2.但反应得到的Br2会氧化Fe2+.方程式不写了.副反应:阴极 2H+ +2e = H2(与极化电压,就是电解电压,以及电极材料有关系),阳极Fe2+ -e = Fe3+1年前查看全部
- 某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)作系列探究,装置如图所示:
某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)作系列探究,装置如图所示:

(1)电解时,甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因______.
(2)一段时间后,你认为C中溶液可能出现的现象是______,请用离子方程式表示原因______.
(3)实验结束后,乙同学将A中的物质冷却后加入到H2S溶液中发现有气泡出现,但加入到稀盐酸中却没有任何现象.请用化学方程式和简要的文字解释原因:______.
(4)随着反应的进行,兴趣小组的同学们都特别注意到D中溶液红色逐渐褪去.他们对溶液红色褪去的主要原因提出了如下假设,请你完成假设二.
假设一:B中逸出气体与水反应生成的物质有强氧化性,使红色逐渐褪去;
假设二:______.
(5)请你设计实验验证上述假设一,写出实验步骤及结论______. lucky8201年前1
lucky8201年前1 -
 autumn1944 共回答了18个问题
autumn1944 共回答了18个问题 |采纳率88.9%解题思路:电解饱和食盐水产生的气体为氢气和氯气,氯气具有强氧化性,而氢气在加热条件下具有较强还原性,根据装置图可知a、b分别阴极和阳极,a极产生的氢气将氧化银还原为单质银,而b极产生的氯气可氧化硫化钠.过量的氯气通入含酚酞的NaOH溶液中,溶液褪色的原因可能为H+中和了OH-,也可能是氯气与水反应生成的次氯酸的强氧化性所致.依据装置图分析可知,电解饱和食盐水产生的气体为氢气和氯气,氯气具有强氧化性,而氢气在加热条件下具有较强还原性,根据装置图可知a、b分别阴极和阳极,a极产生的氢气将氧化银还原为单质银,电极附近水的电离平衡被破坏,氢离子放电减少,氢氧根在内的增大,结合溶液中的镁离子生成氢氧化镁沉淀;而b极产生的氯气可氧化硫化钠.过量的氯气通入含酚酞的NaOH溶液中,溶液褪色的原因可能为H+中和了OH-,也可能是氯气与水反应生成的次氯酸的强氧化性所致;
(1)电解时,甲同学发现电极a附近溶液出现浑浊,依据判断可知,a电极为电解池的阴极,溶液中氢离子放电生成氢气,破坏了电极附近水的电离平衡,氢氧根离子浓度增大,结合溶液中镁离子生成氢氧化镁沉淀,溶液变浑浊,反应的离子方程式为:2H++2e-═H2↑,Mg2++2OH-═Mg(OH)2↓;
故答案为:2H++2e-═H2↑,Mg2++2OH-═Mg(OH)2↓;
(2)B装置中的b电极为电解池阳极,溶液中氯离子失电子发生氧化反应生成氯气,氯气通过硫化钠溶液把硫离子氧化为硫单质,溶液变浑浊出现淡黄色沉淀,反应的离子方程式为:Cl2+S2-═2Cl-+S↓;
故答案为:有淡黄色沉淀;Cl2+S2-═2Cl-+S↓;
(3)电解饱和食盐水产生的气体为氢气和氯气,氯气具有强氧化性,而氢气在加热条件下具有较强还原性,根据装置图可知a、b分别阴极和阳极,a极产生的氢气将氧化银还原为单质银,将A中的物质冷却后加入到H2S溶液中发现有气泡出现,但加入到稀盐酸中却没有任何现象,说明固体中无氧化银,银单质和盐酸不反应,和氢硫酸反应生成沉淀只能是硫化银沉淀,表明Ag2S的溶解度比AgCl小很多,反应的化学方程式为:2Ag+H2S═Ag2S+H2;
故答案为:Ag与H2S的反应式为2Ag+H2S═Ag2S+H2,表明Ag2S的溶解度比AgCl小很多;
(4)过量的氯气通入含酚酞的NaOH溶液中,溶液褪色的原因可能为H+中和了OH-,也可能是氯气与水反应生成的次氯酸的强氧化性所致.题干中假设一是氯气和水反应生成的次氯酸的氧化性主要作用,假设二是氢氧根离子被氢离子中和反应造成了溶液褪色,
故答案为:可能是H+中和了OH-造成褪色;
(5)过量的氯气通入含酚酞的NaOH溶液中,溶液褪色的原因可能为H+中和了OH-,也可能是氯气与水反应生成的次氯酸的强氧化性所致,证明假设是否正确,可以取用褪色的溶液与试管中,再滴入酚酞试液,若变红色证明假设一正确,
故答案为:取少量D中褪色后的溶液于试管中,滴加1~2滴酚酞溶液,如果又显红色,则假设一正确.点评:
本题考点: 电解原理;性质实验方案的设计.
考点点评: 本题考查了电解原理应用,物质性质的实验设计方法和实验验证的方案设计,电解池电极判断,生成产物及其物质性质的熟练掌握是解题关键,题目难度中等.1年前查看全部
- 用惰性电极电解CuSO4和NaCl 的混合溶液,开始时阴极和阳极上分别析出的物质是
用惰性电极电解CuSO4和NaCl 的混合溶液,开始时阴极和阳极上分别析出的物质是
请解析~ free_air191年前1
free_air191年前1 -
 zx910731 共回答了16个问题
zx910731 共回答了16个问题 |采纳率93.8%Cu、Cl2
根据离子反应顺序.1年前查看全部
- 将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段
将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体体积(标准状况)为( )
A. 4.48L
B. 5.6L
C. 6.72L
D. 7.84L yj19819221年前3
yj19819221年前3 -
 RETSRA 共回答了20个问题
RETSRA 共回答了20个问题 |采纳率80%解题思路:Ag+和Cl-反应生成AgCl沉淀,电解时溶液中不存在Ag+,阴离子放电顺序为Cl->OH-,若在一极析出0.3molCu,阴极得到电子为0.3mol×2=0.6mol,结合两极转移电子数目相等以及电极方程式计算.Ag+和Cl-反应生成AgCl沉淀,电解时溶液中不存在Ag+,
反应后溶液中存在0.4molCu2+、0.4molCl-,
若在一极析出0.3molCu,阴极得到电子为0.3mol×2=0.6mol,
阳极首先发生:2Cl--2e-=Cl2↑,然后发生4OH--4e-=O2+2H2O,
则0.4molCl-生成0.2molCl2,失去0.4mol电子,在反应中4OH--4e-=O2+2H2O,转移0.2mol电子,生成0.05molO2,
则气体的体积为(0.2mol+0.05mol)×22.4L/mol=5.6L,
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,为高考常见题型,侧重于学生的分析能力的考查,注意把握离子的放电顺序,为解答该题的关键,难度不大.1年前查看全部
- 用惰性电极点解下列电解质溶液,求阳极反应式,阴极反应式,总反应方程式,溶液复原所需物质,Na2So4,H2SO4。
用惰性电极点解下列电解质溶液,求阳极反应式,阴极反应式,总反应方程式,溶液复原所需物质,Na2So4,H2SO4。
若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是? huxinan1231年前3
huxinan1231年前3 -
 6517556 共回答了17个问题
6517556 共回答了17个问题 |采纳率94.1%1、楼上说的不错,电解Na2SO4和H2SO4事实上就是【电解水】
不过楼上写的反应式有点问题,应该是:
阳极:4OH- - 4e- ==== 2H2O + O2
阴极:2H+ + 2e- ==== H2
总反应:2H2O ==== 2H2 + O2
【要复原溶液,需要补充被电解掉的水即可】
2、若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是?
【这个题楼上答错了】
阳离子交换膜的作用是【使阴阳离子隔绝,避免其相互反应】.
2NaCl + 2H2O ==== 2NaOH + H2 + Cl2而这样的产物极易反应.所以如果没有阳离子交换膜,这些产物就会继续反应.
具体如下:2NaCl + 2H2O ==== 2NaOH + H2(气体) + Cl2(气体)
2NaOH + Cl2 ==== NaCl + NaClO + H2O
【所以最终的结果是:NaCl + H2O ==(通电)== NaClO + H2(气体)】1年前查看全部
- 用惰性电极电解200mL1.5mol/L的Na2SO3溶液,一段时间后,测得两极放出的气体体积之和为20.16L(标准状
用惰性电极电解200mL1.5mol/L的Na2SO3溶液,一段时间后,测得两极放出的气体体积之和为20.16L(标准状况)
则在整个电解过程中转移的电子的物质的量为多少? jacky_cq7411021年前1
jacky_cq7411021年前1 -
 06级311MCT 共回答了16个问题
06级311MCT 共回答了16个问题 |采纳率87.5%设生成氧气的物质的量为X,则生成H2的物质的量为2X
用惰性电极电解活泼金属的含氧酸盐,就是电解水.
则X+2X=20.16L/22.4L/mol
解得X=0.3mol
在反应过程中每生成1摩尔O2失去4摩尔电子,
在整个电解过程中转移的电子的物质的量为0.3mol*4=1.2mol1年前查看全部
- 用惰性电极电解某浓度的200mlCuSO4,在两极均收集到336ml(S.T.P)气体时停止(溶液体积不变,则原溶液浓度
用惰性电极电解某浓度的200mlCuSO4,在两极均收集到336ml(S.T.P)气体时停止(溶液体积不变,则原溶液浓度时___mol/l
我的解答是这样的
硫酸铜电解完了电解水,因为阴极只有水放出H2.所以H2物质的量0.336/22.4=0.015
mol
H2O=电解=2H2+O2
2 1
0.015 0.015/2
所以硫酸铜电解出O2是0.015—0.015/2=0.0075mol
2CuSO4+2H2O==2Cu+O2
2 1
0.0075x2 0.0075
所以原溶液浓度c=0.015/0.2=0.075mol/l
可是正确答案是0.15 我哪里做错了,我看了很久都不知道错在哪里,请帮忙指出, 为伊ll1年前2
为伊ll1年前2 -
 二酋山 共回答了21个问题
二酋山 共回答了21个问题 |采纳率85.7%电解中化合价升降总数相等.阳极只有氧气放出.物质的量为0.015 化合价升高0.06
阴极先析出铜 在放出氢气 氢气物质的量0.015 化合价降低 0.03 所以铜的化合价共降低0.03 即铜的物质的量也为0.015 所以是答案错了1年前查看全部
- 惰性电极,电解串联电路中甲乙俩个烧杯中的200ml 0.3mol每升的氯化钠溶液和300ml 0.2mol每升的硝酸银溶
惰性电极,电解串联电路中甲乙俩个烧杯中的200ml 0.3mol每升的氯化钠溶液和300ml 0.2mol每升的硝酸银溶液,产生0.56升氯气时停止电解(标况),将俩杯溶液混合,求混合后氢离子的浓度.混合后体积为500ml
 梅冷1年前6
梅冷1年前6 -
 达观淡然 共回答了13个问题
达观淡然 共回答了13个问题 |采纳率100%2Cl- - 2e- = Cl2
2mol 2mol 22.4L
X X 0.56L X=0.05mol
Ag+ + e- = Ag
1mol 1mol
y 0.05mol y=0.05mol
所以剩余Cl-和Ag+都是0.06-0.05=0.01mol,将两杯溶液混合,恰好得到硝酸钠溶液,其中氢离子的浓度=1×10^-7mol/L1年前查看全部
- 电解CuSO4的几个问题用惰性电极电解CuSO4溶液为什么相当于电解CuO.另外,
 zb20061年前1
zb20061年前1 -
 dd之刀 共回答了18个问题
dd之刀 共回答了18个问题 |采纳率94.4%电解质复原是恢复到电解前的状态,浓度必须与反应前一致.电解CuSO4的化学方程式是2CuSO4+2H2O=通电=2H2SO4+O2↑+2CuCuO+H2SO4=CuSO4+H2O将CuO+H2SO4=CuSO4+H2O乘以2与电解CuSO4的化学方程式合并得到2CuO=2Cu+O2↑,所...1年前查看全部
大家在问
- 1若函数f(x)=ln(x+1)-[2/x]的零点在区间(k,k+1)(k∈z)上,则k的值为( )
- 2英语翻译A Wonderful Instrument for Performance whenever you need
- 3(2011•昌平区二模)已知等差数列{an}的公差为3,若a1,a3,a4成等比数列,则a2等于( )
- 4Are there any foreign teacher in your school?(中文)
- 5老师发红包啦 作文
- 6机械制图 这题有点难在我的图上涂改
- 7爱因斯坦在20世纪20年代初,曾两次途经上海,总共停留不到3天时间,却对上海产生了深刻的印象。他在日记中写道:“(上海)
- 8诺言 默读文章最后一自然段,想一想它与前面的故事有什么关系,起到了什么作用
- 9寒假生活 作文
- 10每一步都写出来(+45.3)+(-9.5)+(+4.7)帮我做啊
- 11高二椭圆题‘很急!已知椭圆:x^2/5+y^2=1中,F1、F2分别为左右焦点,过F2作椭圆的弦AB, (1)求证:1/
- 12将一负电荷从A移至B,电场力做正功,则此负电荷在A,B两点中的那点电势能小?
- 13你必须关门 用英语怎么说
- 14一些初中的数学题平方差公式 (a-nb)(nb-a)=?(-1-a)(a+1)=?(-m+n)(-m-n)=?(m的二次
- 15乙的年龄相当于甲的[5/6],甲的年龄又相当于丙的[4/3],已知乙比丙大4岁,求甲的年龄.

