Al(oh)3 经灼烧后生成5.1克Al2O3,问有多少克氢氧化铝.为什么我用质量守恒做出来的答案是错的啊?
 杨丽晖2022-10-04 11:39:541条回答
杨丽晖2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 有个地方 共回答了19个问题
有个地方 共回答了19个问题 |采纳率89.5%- 设、写、找、列、答
你先看看方程式写对了没,特别要注意配平!
找就是找元素的相对原子质量然后再根据质量守恒列出等式方程求解
如果你懂怎么做只是算出来不对,多检查检查吧,仔细一点就没问题 - 1年前
相关推荐
- KAl(SO4)2转化成Al(OH)3
 jimtan1881年前4
jimtan1881年前4 -
 hh人98 共回答了21个问题
hh人98 共回答了21个问题 |采纳率81%加入强碱容易过量使得氢氧化铝变成偏铝酸盐
一般用氨水可以控制在氢氧化铝这一步
2KAl(SO4)2+6NH3.H2O=2Al(OH)3+K2SO4+3(NH4)2SO41年前查看全部
- 为什么制取AL(OH)3时用氨水和AL2(SO4)3而不用氢氧化钠?
 39215931年前2
39215931年前2 -
 雷蹴 共回答了18个问题
雷蹴 共回答了18个问题 |采纳率88.9%过量的氢氧化钠会与AL(OH)3反映生成四羟基和铝酸钠1年前查看全部
- HClO4,KOH,Al(OH)3相互反应的化学方程式
 lioi1年前1
lioi1年前1 -
 20070407白狐 共回答了12个问题
20070407白狐 共回答了12个问题 |采纳率83.3%3HClO4+Al(OH)3=Al(ClO4)3+3H2O
HClO4+KOH=KClO4+H2O
KOH+Al(OH)3=KAlO2+2H2O1年前查看全部
- 若100mL 0.1mol/L的Al2(SO4)3溶液和NaOH溶液反应,得到1.17g Al(OH)3沉淀,
若100mL 0.1mol/L的Al2(SO4)3溶液和NaOH溶液反应,得到1.17g Al(OH)3沉淀,则需0.5mol/L NaOH溶液的体积为( )
A.130mL
B.100mL
C.65mL
D.50mL zhyzz1年前1
zhyzz1年前1 -
 心灵原唱 共回答了22个问题
心灵原唱 共回答了22个问题 |采纳率86.4%解题思路:根据Al2(SO4)3溶液与NaOH溶液的反应计算分析,100mL0.1mol/LAl2(SO4)3全转化为沉淀的质量为:0.1L×0.1mol/L×2×78g/mol=1.56g,
由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,可知NaOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.在100ml 0.1mol/L的Al2(SO4)3溶液中加入0.5mol/L的NaOH溶液,如硫酸铝完全生成Al(OH)3,则沉淀的质量为:0.1L×0.1mol/L×2×78g/mol=1.56g,
而此时为1.17g,说明硫酸铝并没有完全转化为Al(OH)3,此时n(Al(OH)3)=[1.17g/78g/mol]=0.015mol,NaOH可能有两种情况,一是不足,二是使Al(OH)3部分溶解,
当NaOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 1mol
x 0.015mol
则x=0.045mol,
V1(NaOH溶液)=[0.045mol/0.5mol/L]=0.09L=90mL,
如使Al(OH)3部分溶解,则
①Al3++3OH-=Al(OH)3↓
0.02mol 0.06mol
②Al(OH)3+OH-=AlO2-+2H2O
1mol 1mol
(0.02-0.015)mol (0.02-0.015)mol=0.005mol
两步反应共需要0.06mol+0.005mol=0.065mol,
V2(NaOH溶液)=[0.065mol/0.5mol/L]=0.13L=130mL,
即所加的NaOH溶液体积是90毫升或130毫升,
故选A.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题考查化学方程式的相关计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意判断硫酸铝反应的程度,为解答本题的关键,用讨论法解答.1年前查看全部
- (2009•汕头二模)Al(OH)3难溶于水,某温度下,只要溶液中Al3+物质的量浓度(mol/L)和OH-物质的量浓度
(2009•汕头二模)Al(OH)3难溶于水,某温度下,只要溶液中Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方的乘积大于1.9×10-33,就会析出Al(OH)3沉淀,则0.10mol/L AlCl3不产生沉淀的最大OH-物质的量浓度(mol/L)为( )
A.1.9×10-33
B.2.7×10-11
C.8.7×10-8
D.1.2×10-11 kin5191年前1
kin5191年前1 -
 大棵酸白菜 共回答了22个问题
大棵酸白菜 共回答了22个问题 |采纳率95.5%解题思路:溶液中Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方为Al(OH)3的溶度积常数,Ksp=1.9×10-33,当Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方的乘积小于1.9×10-33时,溶液中不产生沉淀,以此计算OH-物质的量浓度.由题意知Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=1.9×10-33,若溶液中不产生沉淀,则有c(Al3+)×c3(OH-)<1.9×10-33,
即0.1×c3(OH-)<1.9×10-33,c(OH-)<
3
1.9×10−33
0.1
=2.7×10-11(mol/L),即0.10mol/L AlCl3不产生沉淀的最大OH-物质的量浓度为2.7×10-11mol/L,
故答案为B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡的相关计算,题目难度不大,本题注意从溶度积常数入手计算.1年前查看全部
- 下列离子方程式正确的是( )A.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al
下列离子方程式正确的是( )
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O→AlO2-+4NH4++2H2O
D.H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+H2O zhangbin_211年前1
zhangbin_211年前1 -
 潇湘中年女 共回答了20个问题
潇湘中年女 共回答了20个问题 |采纳率100%解题思路:A.二者反应生成氢氧化铝沉淀和碳酸氢钠;
B.二者发生氧化还原反应生成亚铁离子和碘单质;
C.二者反应生成氢氧化铝沉淀和铵根离子;
D.二者反应生成硫酸钡和水,且水的计量数是2.A.二者反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故A正确;
B.二者发生氧化还原反应生成亚铁离子和碘单质,离子方程式为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.二者反应生成氢氧化铝沉淀和铵根离子,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.二者反应生成硫酸钡和水,且水的计量数是2,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选A.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子方程式正误判断,明确物质的性质及离子方程式书写规则即可解答,注意弱电解质、气体、沉淀、单质、氧化物等写化学式,易错选项是B,注意二者发生氧化还原反应,不是单纯的酸和碱的反应,为易错点.1年前查看全部
- 已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O.向含有等物质的量的NH4Cl、AlCl3和HCl混
已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O.向含有等物质的量的NH4Cl、AlCl3和HCl混合溶液中慢慢滴加NaOH溶液至过量,并不断搅拌,可能发生以下离子反应:①H++OH-=H2O;②Al(OH)3+OH-=AlO2-+2H2O;③Al3++3OH-=Al(OH)3↓;④NH4++OH-=NH3•H2O;⑤NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O.其正确的离子反应顺序是( )
A.①③②④
B.①③④②
C.①③②⑤
D.①④③② 诚挚诚实1年前1
诚挚诚实1年前1 -
 望春名 共回答了25个问题
望春名 共回答了25个问题 |采纳率96%解题思路:氢氧根离子先与氢离子反应,再与铝离子反应,然后与铵根离子反应,最后与Al(OH)3反应.氢氧根离子先与氢离子反应①H++OH-=H2O,再与铝离子反应③Al3++3OH-=Al(OH)3↓,再与铵根离子反应④NH4++OH-=NH3•H2O,最后与Al(OH)3反应②Al(OH)3+OH-=AlO2-+2H2O,正确的离子反应顺序是①③④②;
故选B.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应发生的顺序,注意先与铝离子反应,再与铵根反应,最后与Al(OH)3反应,题目难度中等.1年前查看全部
- 下列关于Al(OH)3的性质叙述错误的是( )
下列关于Al(OH)3的性质叙述错误的是( )
A.是两性氢氧化物
B.难溶于水
C.受热能分解
D.既溶于氨水,又能溶于盐酸 1688781年前1
1688781年前1 -
 uu爱石头 共回答了17个问题
uu爱石头 共回答了17个问题 |采纳率88.2%解题思路:根据氢氧化铝的性质:是两性氢氧化物能和强酸强碱反应、难溶于水的白色胶状物质、具有吸附作用来回答.A、Al(OH)3是既能和强酸反应又能和强碱反应的两性氢氧化物,故A正确;
B、根据物质的溶解性,可知Al(OH)3是难溶于水的白色胶状沉淀物质,故B正确;
C、Al(OH)3是难溶于水的白色胶状沉淀物质,受热易分解生成氧化铝和水,故C正确;
D、氢氧化铝能和强酸以及强碱之间发生反应,但是不能和弱酸以及弱碱之间发生反应,一水合氨是弱碱,和氢氧化铝不反应,故D错误;
故选D.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查学生氢氧化铝的性质,可以根据所学知识来回答,注意氢氧化铝只能和强酸以及强碱发生反应.1年前查看全部
- 由Fe(OH)3、NaCl、Ag2CO3、CaCO3、Al(OH)3组成的混合物,要求用五种试剂将这五种物质溶解而分离,
由Fe(OH)3、NaCl、Ag2CO3、CaCO3、Al(OH)3组成的混合物,要求用五种试剂将这五种物质溶解而分离,这五种试剂是?
 旧人旧衣1年前1
旧人旧衣1年前1 -
 dashan1981 共回答了22个问题
dashan1981 共回答了22个问题 |采纳率86.4%按以下顺序:
1、水(H2O):溶解掉NaCl,其余不溶解.之后过滤……
2、氨水(NH3):溶解掉Ag2CO3,其余不溶解.之后过滤……
3、氢氧化钠溶液(NaOH):溶解掉Al(OH)3,其余不溶解.之后过滤……
4、水和CO2:将最后的Fe(OH)3和CaCO3混合物置于水中,并通入过量CO2,CaCO溶解,Fe(OH)3不溶解.
5、加盐酸溶解掉Fe(OH)3.
用到的试剂包括:水、氨水、氢氧化钠溶液、CO2、HCl1年前查看全部
- 牙膏的成分有活性物质、摩擦剂、甘油等物质.牙膏中的摩擦剂一般由CaC03、Al(OH)3、SiO2中的一种或几种物质组成
 牙膏的成分有活性物质、摩擦剂、甘油等物质.牙膏中的摩擦剂一般由CaC03、Al(OH)3、SiO2中的一种或几种物质组成.为探究某品牌牙膏中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适量牙膏样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现沉淀减少但仍有少量不溶物.为进一步探究牙膏中摩擦剂的成分,同学们进行了以下探究:
牙膏的成分有活性物质、摩擦剂、甘油等物质.牙膏中的摩擦剂一般由CaC03、Al(OH)3、SiO2中的一种或几种物质组成.为探究某品牌牙膏中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适量牙膏样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现沉淀减少但仍有少量不溶物.为进一步探究牙膏中摩擦剂的成分,同学们进行了以下探究:
【提出假设】根据题目信息同学们提出了如下假设:
假设一:牙膏磨擦剂的成分为Al(OH)3、SiO2和CaCO3;
假设二:牙膏磨擦剂的成分为Al(OH)3,和SiO2;
假设三:牙膏磨擦剂的成分为______.
【实验验证】
该小组同学拟通过实验检验假设一是否成立.
请你帮助该小组完成以下实验报告.(限选试剂:稀盐酸、6mol•L-1NaOH溶液、澄清石灰水)
【交流提高】实验步骤 预期现象和结论 步骤1:取适量牙膏样品,加水充分搅拌、过滤. 步骤2:取适量沉淀于试管中,______ 步骤3:
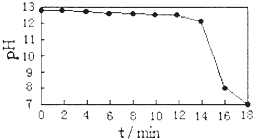
该小组同学了解到一些牙膏中的摩擦剂使用了纳米级碳酸钙.查阅资料:工业上常将电石渣进行处理.得到Ca(OH)2悬浊液,再不断通入CO2,即可制得纳米级碳酸钙.通过传感器测得反应过程中溶液pH与反应时间的关系如图.试回答:反应开始一段时间内,pH变化很小的原因是______. vanhalenzr1年前1
vanhalenzr1年前1 -
 allfusdo 共回答了21个问题
allfusdo 共回答了21个问题 |采纳率90.5%解题思路:【提出假设】牙膏摩擦剂的主要成分有CaCO3、Al(OH)3、SiO2,根据由上边物质中的两种组成,进行两种物质的组合考虑;根据预期实验结论猜想1正确,用猜想1的成分与盐酸反应考虑实验现象;根据若摩擦剂部分溶解,不产生气泡,说明不存在碳酸钙考虑哪一猜想正确;
【实验验证】碳酸钙可以和盐酸之间反应产生二氧化碳气体,氯化铝中逐滴加入氢氧化钠,会出现的现象:先生成白色胶状沉淀,后沉淀逐渐溶解,据此来检验即可;
【交流提高】根据随着过程的原理:反应中Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,据此来回答.【提出假设】牙膏摩擦剂的主要成分有CaCO3、Al(OH)3、SiO2,根据由上边物质中的两种组成,假设二:摩擦剂的成分为Al(OH)3和SiO2,所以还缺少SiO2和CaCO3的组合;所以假设三是SiO2和CaCO3,故答案为:SiO2和CaCO3;
【实验验证】成分物质中,碳酸钙可以和盐酸之间反应产生二氧化碳气体,若无气泡产生,说明无CaCO3,氢氧化铝可以和盐酸反应生成氯化铝,氯化铝中逐滴加入氢氧化钠,会出现的现象:先生成白色胶状沉淀,后沉淀逐渐溶解,故答案为:
实验步骤 预期现象和结论
步骤2:滴加过量稀盐酸 若无气泡产生,说明无CaCO3,则假设一不成立;若产生气泡,则继续进行步骤3
步骤3:取步骤2的上层清液,逐滴加入6 mol•L-1NaOH溶液至过量 若先生成白色胶状沉淀,后沉淀逐渐溶解,说明含有Al(OH)3,则假设一成立,若无明显现象,则假设一仍然不成立【交流提高】
Ca(OH)2悬浊液中不断通入CO2,随着反应的进行,溶液中的Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,整个溶液中的Ca(OH)2浓度无明显变化,pH变化很小,
故答案为:随着反应的进行,溶液中的Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,整个溶液中的Ca(OH)2浓度无明显变化,故pH变化很小.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 解答本题关键是要知道氢氧化铝与碳酸钙都不溶于水,但能与盐酸反应,并且碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,要根据实验结论能反推出实验现象,根据实验现象推出物质组成,得出实验结论.1年前查看全部
- 用1molAl制Al(OH)3各种方案中各个物质的消耗情况
用1molAl制Al(OH)3各种方案中各个物质的消耗情况
酸用盐酸 碱用NaOH 李小农1年前1
李小农1年前1 -
 tian0xue 共回答了19个问题
tian0xue 共回答了19个问题 |采纳率94.7%若先用盐酸溶解铝,耗盐酸3mol,再用氢氧化钠也耗3mol;
若用氢氧化钠溶解铝耗1mol,再用盐酸产氢氧化铝耗1mol
若用偏铝酸钠1/4mol和氯化铝3/4mol反应制1氢氧化铝的话,产偏铝酸钠耗氢氧化钠1/4mol:,产氯化铝耗3/4mol:1年前查看全部
- 急求Al制Al(OH)3的方案 多多益善
 yanguijun1年前1
yanguijun1年前1 -
 鱼一条5966 共回答了14个问题
鱼一条5966 共回答了14个问题 |采纳率92.9%方法一:铝与盐酸反应:2Al+6HCl=2AlCl3+3H2 AlCl3溶液与适量的NaOH溶液:AlCl3+3NaOH==Al(OH)3↓+3NaCl 方法二:铝与盐酸反应:2Al+6HCl=2AlCl3+3H2 AlCl3溶液与氨水:AlCl3+3NH3*H2O==Al(OH)3↓+3NH4Cl 方法三:铝与氢氧化钠反应:2Al+2NaOH+2H2O=2NaAlO2+3H2 NaAlO2溶液与适量HCl反应:NaAlO2+ HCl+ H2O= Al(OH)3↓+NaCl 方法四:铝与氢氧化钠反应:2Al+2NaOH+2H2O=2NaAlO2+3H2 NaAlO2溶液中通入二氧化碳:CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 方法五:铝与盐酸反应:2Al+6HCl=2AlCl3+3H2 铝与氢氧化钠反应:2Al+2NaOH+2H2O=2NaAlO2+3H2 NaAlO2溶液与AlCl3溶液反应:AlCl3+3NaAlO2+ 6H2O= 4Al(OH)3↓+3NaCl1年前查看全部
- 牙膏是生活中常见的物质,其配料成份有摩擦剂、增白剂、发泡剂等,其中摩擦剂的类型有很多,如CaCO3、Al(OH)3、Si
牙膏是生活中常见的物质,其配料成份有摩擦剂、增白剂、发泡剂等,其中摩擦剂的类型有很多,如CaCO3、Al(OH)3、SiO2或这些物质的混合物.我校兴趣小组想研究牙膏摩擦剂的成分.
【提出问题1】某品牌牙膏中是否含有碳酸钙?
【查阅资料】二氧化硅不与稀盐酸反应
【实验方案】
①取少量牙膏于试管中,加入过量稀盐酸,出现气泡,将气体通入澄清石灰水中,石灰水变浑浊,证明摩擦剂中含有______离子;
②取实验①中的溶液,加入草酸铵溶液,生成白色沉淀-草酸钙,请写出该反应的化学方程式______.
【提出问题2】该牙膏中碳酸钙的含量是多少?
【实验步骤】
(1)按图连接好装置后,发现一处明显的错误,改正为______;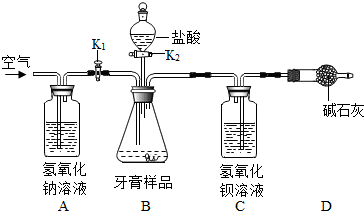
(2)重新连接好装置,并______;
(3)在B装置中加入牙膏样品8.00克;
(4)______K1,______K2(填“打开”或“关闭”),向牙膏样品中滴入10%的盐酸,至______,停止滴加盐酸;
(5)______,至C中不再产生沉淀;
(6)将C装置中的固体混合物过滤、______、烘干后称量其质量;
(7)重复实验.
(已知此品牌牙膏中的摩擦剂为碳酸钙,且其他成分不和盐酸反应,装置内试剂均足量.)
【实验数据】重复实验,3次数据记录如下:
【实验分析及数据处理】实验次数 实验1 实验2 实验3 C装置中沉淀质量(g) 3.93 3.94 3.95
(1)上述数据能否由托盘天平测得?______.
(2)若没有A装置,则测定结果将______. (填“偏大”、“偏小”或“不变”)
(3)D装置的作用是______.
(4)据上表数据,计算该牙膏样品中碳酸钙的含量是多少?
写出计算过程.
【实验反思】
(1)重复实验,取平均值的意义在于______.
(2)下列各项措施中,能提高测定准确度的是______(填序号)
a.在装置A、B之间增加盛有浓硫酸的洗气瓶
b.在装置B、C之间增加盛有饱和碳酸氢钠的洗气瓶
c.缓缓滴加稀盐酸. berry891年前1
berry891年前1 -
 diswing 共回答了14个问题
diswing 共回答了14个问题 |采纳率100%解题思路:【实验方案】依据碳酸根离子的检验方法分析解答,并据反应原理书写方程式;
(1)洗气装置中导管应长进短出;
(2)实验前应检查装置的气密性,防止装置漏气;
(4)依据装置设计原理和实验目的分析解答;
(5)再次打开K1,关闭K2,缓缓通入一段时间空气,使生成的二氧化碳充分反应;
(6)将C装置中的固体混合物过滤、洗涤、烘干后称量其质量更准确;
【实验分析及数据处理】
(1)根据天平的精确度分析解答;
(2)A装置的作用是吸收空气中的二氧化碳,防止测量结果不准确;
(3)D装置的作用是吸收空气中的二氧化碳,防止测量结果不准确;
(4)依据所测生成沉淀数据的平均值,计算反应的二氧化碳的质量,并进而计算参加反应的碳酸钙的质量;
【实验反思】
(1)多次测量,求其平均值是实验的常用方法,可减少误差;
(2)在装置B、C之间增加盛有饱和碳酸氢钠的洗气瓶,可以防止挥发出的氯化氢气体等进入C装置,碳酸氢钠与盐酸反应生成二氧化碳;缓缓滴加稀盐酸可使生成的二氧化碳反应完全,使测量结果更准确.【实验方案】①取少量牙膏于试管中,加入过量稀盐酸,出现气泡,将气体通入澄清石灰水中,石灰水变浑浊,说明生成二氧化碳,从而证明摩擦剂中含有碳酸根离子;
②实验①中的溶液中含有氯离子,加入草酸铵溶液,生成白色沉淀-草酸钙,说明该溶液中含有钙离子,反应的化学方程式是(NH4)2C2O4+CaCl2=CaC2O4↓+2NH4Cl;
(1)C的作用是吸收反应生成的二氧化碳,装置中导管应长进短出;
(2)实验前应检查装置的气密性,防止装置漏气;
(4)关闭K1,打开K2,向牙膏样品中滴入10%的盐酸,至不再生成气体,停止滴加盐酸;
(5)再次打开K1,关闭K2,缓缓通入一段时间空气,使生成的二氧化碳全部排出,充分反应,至C中不再产生沉淀;
(6)将C装置中的固体混合物过滤、洗涤,除去表面的其他物质,然后烘干后称量其质量更准确;
【实验分析及数据处理】
(1)天平只能精确到0.1g,故用天平无法测量;
(2)A装置的作用是吸收空气中的二氧化碳,若没有该装置,则进入C的气体还有空气中的二氧化碳,使测量结果偏大;
(3)D装置的作用是吸收空气中的二氧化碳,防止空气中二氧化碳进入,使测量结果不准确;
(4)依据所测生成沉淀数据的平均值,计算反应的二氧化碳的质量,并进而计算牙膏中碳酸钙的质量,计算过程如下;
【实验反思】
(1)多次测量,求其平均值是实验的常用方法,可减少误差;
(2)在装置A、B之间增加盛有浓硫酸的洗气瓶,是吸收水蒸气,而水蒸气对于二氧化碳无影响;在装置B、C之间增加盛有饱和碳酸氢钠的洗气瓶,则由B中挥发出来的氯化氢气体会与洗气装置中的NaHCO3反应,生成二氧化碳气体,使测定结果偏高;缓缓滴加稀盐酸可使生成的二氧化碳反应完全,使测量结果更准确;
故答案为:【实验方案】①碳酸根;②(NH4)2C2O4+CaCl2=CaC2O4↓+2NH4Cl;
(1)C装置中进气管伸入液面以下,出气管稍露出橡皮塞即可;
(2)检查装置的气密性;
(4)关闭;打开;不再有气泡产生;
(5)再次打开K1,关闭K2,缓缓通入一段时间空气;
(6)洗涤;
【实验分析及数据处理】
(1)不能;(2)偏大;(3)吸收空气中的二氧化碳,防止干扰;
(4)设二氧化碳的质量为x
Ba(OH)2+CO2═BaCO3↓+H2O
44 197
x 3.94g
[44/x]=[197/3.94g]
x=0.88g
设碳酸钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
y 0.88g
[100/x]=[44/0.88g]
y=2g
答:该牙膏样品中碳酸钙的质量是2g.
【实验反思】
(1)可以减小误差;(2)c.点评:
本题考点: 实验探究物质的组成成分以及含量.
考点点评: 本题难度较大,属于盐的性质中实验方法和过程的探究,根据物质的化学性质,要认真分析,不仅要把握实验设计的每一个步骤中的实验目的,装置的用途等知识,还要对有关的计算准确,能考查学生综合分析、解决问题的能力.1年前查看全部
- (2012•东城区模拟)牙膏是由摩擦剂和一些可溶于水的物质组成.常用的摩擦剂主要有:CaCO3、Al(OH)3、SiO2
(2012•东城区模拟)牙膏是由摩擦剂和一些可溶于水的物质组成.常用的摩擦剂主要有:CaCO3、Al(OH)3、SiO2•nH2O、Ca3(PO4)2.资料显示:Ca3(PO4)2高温不分解;Ca3(PO4)2和CaHPO4不溶于水;Ca(H2PO4)2溶于水;Ca3(PO4)2+4H+=3Ca2++2H2PO4-.
(1)为测定某牙膏的酸碱性和摩擦剂的主要成分,甲同学设计并完成以下实验:
①取一小段牙膏与一定量蒸馏水充分搅拌后过滤,用pH试纸测定滤液酸碱性的方法是______(填相应操作),读出其pH接近8;
②若向①所得不溶物中加入适量稀盐酸,得到澄清溶液,有气体产生,则产生气体的离子方程式是______;若向①所得不溶物中加入NaOH溶液,经测定,不溶物的质量不发生变化;
③取②中加稀盐酸后所得溶液,加入过量NaOH溶液,观察到最终有沉淀生成,生成该沉淀的离子方程式是______;根据上述实验,摩擦剂中一定含有的物质是______.
(2)乙同学用如下装置(已检验气密性,夹持装置略)通过测CO2的质量来计算牙膏不溶物中CaCO3的含量.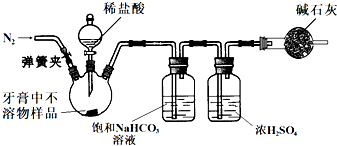
①滴加稀盐酸之前的部分操作:…打开弹簧夹,通入N2一段时间;再将盛有碱石灰的干燥管连接在整套装置上….按此顺序进行操作的原因是______;
②用上述装置重复几次实验,所测样品中CaCO3的含量均偏高,若实验过程中的操作没有失误,分析可能的原因是______或______;
③设计实验不用其他任何试剂(仪器可任选),仅用牙膏不溶物样品测定摩擦剂中CaCO3含量的方法是______(不必填具体操作). 一分钟都不能等1年前1
一分钟都不能等1年前1 -
 梦里花落不知道 共回答了17个问题
梦里花落不知道 共回答了17个问题 |采纳率94.1%解题思路:(1)①依据pH试纸的使用方法简答过程和操作;
②依据摩擦剂成分分析,和盐酸反应生成气体的物质是碳酸钙;
③取②中加稀盐酸后所得溶液,加入过量NaOH溶液,观察到最终有沉淀生成是Ca(H2PO4)2和氢氧化钠反应生成磷酸钙沉淀;
(2)①碱石灰会吸收空气中水蒸气和二氧化碳使测量结果产生误差;
②偏高说明测定的二氧化碳质量增大,可能是干燥管吸收了空气中的二氧化碳,或气体通过饱和碳酸氢钠溶液中会生成二氧化碳气体;
③利用高温下碳酸钙分解,可以称量分解前后的质量计算.(1)①用pH试纸测定滤液酸碱性的方法是用干燥玻璃棒蘸取待测液滴在PH试纸的中间,依据变色和比色卡对比得到溶液pH,
故答案为:用干燥洁净的玻璃棒蘸滤液,滴在pH试纸上,经与标准比色卡比较后;
②若向①所得不溶物中加入适量稀盐酸,得到澄清溶液,有气体产生,依据摩擦剂成分可知是碳酸钙和盐酸反应生成二氧化碳气体,则产生气体的离子方程式是CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
③取②中加稀盐酸后所得溶液,加入过量NaOH溶液,观察到最终有沉淀生成,则是磷酸钙和盐酸反应生成磷酸二氢钙与碱反应生成磷酸钙沉淀,反应生成该沉淀的离子方程式是2H2PO4-+3Ca2++4OH-=Ca3(PO4)2+4H2O,依据实验现象和物质变化分析判断,牙膏中一定含CaCO3、Ca3(PO4)2;
故答案为:2H2PO4-+3Ca2++4OH-=Ca3(PO4)2+4H2O;CaCO3、Ca3(PO4)2;
(2)①滴加稀盐酸之前的部分操作:…打开弹簧夹,通入N2一段时间;再将盛有碱石灰的干燥管连接在整套装置上的目的是避免空气中的二氧化碳被碱石灰吸收,使测定结果偏高;
故答案为:避免碱石灰吸收装置中原有空气中的CO2;
②用上述装置重复几次实验,所测样品中CaCO3的含量均偏高,若实验过程中的操作没有失误,则产生误差的原因是最后的干燥管会吸收空气中的二氧化碳和水蒸气,生成二氧化碳的青提子含有氯化氢气体,通过饱和碳酸氢钠溶液时会多生成二氧化碳气体;
故答案为:干燥管中的碱石灰吸收空气中的CO2或H2O;NaHCO3溶液除HCl时产生了CO2;
③设计实验不用其他任何试剂(仪器可任选),仅用牙膏不溶物样品测定摩擦剂中CaCO3含量的方法是可以利用碳酸钙受热分解,依据分解前后的质量变化计算得到;
故答案为:称量不溶物样品在高温下完全分解前后的质量.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质性质的实验验证和物质组成的实验探究实验方案设计和应用,题目难度中等.1年前查看全部
- 在下列几种物质中①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥Al2O3其中跟HCl溶
在下列几种物质中①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥Al2O3其中跟HCl溶液和NaOH溶液都能发生反应的是( )
A.只有②④⑥
B.只有①⑤⑥
C.只有①②③⑤⑥
D.全部都可以 菊残1年前1
菊残1年前1 -
 c18ee 共回答了22个问题
c18ee 共回答了22个问题 |采纳率81.8%解题思路:根据Al、Al2O3、Al(OH)3、弱酸的酸式盐、弱酸对应的铵盐、蛋白质、氨基酸等既能跟NaOH溶液反应,又能跟盐酸反应来解答.①NaHCO3溶液能与酸反应生成二氧化碳气体,与碱反应生成碳酸钠,故①正确;
②Al(OH)3既能跟NaOH溶液反应,又能跟盐酸反应,故②正确;
③(NH4)2CO3溶液属于弱酸的铵盐溶液,既能跟NaOH溶液反应,又能跟盐酸,故③正确;
④SiO2只能与碱反应,不与酸反应(氢氟酸除外),故④错误;
⑤Al既能跟NaOH溶液反应,又能跟盐酸反应,故⑤正确;
⑥Al2O3既能跟NaOH溶液反应,又能跟盐酸反应,故⑥正确;
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查物质的性质,明确物质的组成过构成来判断物质之间的反应是解答本题的关键,并注意在平时的学习中归纳规律来解答.1年前查看全部
- Ca 与Al(OH)3反应的方程式.
 cpmy2131年前1
cpmy2131年前1 -
 害虫666 共回答了12个问题
害虫666 共回答了12个问题 |采纳率91.7%Ca +2Al(OH)3=Ca(AlO2)2+H2+2H2O1年前查看全部
- 已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液
已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应:发生反应的先后顺序正确的是( )
①H++OH-=H2O ②Al(OH)3+OH-=AlO2-+2H2O ③Al3++3OH-=Al(OH)3↓④NH4++OH-=NH3•H2O.
A.①→④→③→②
B.①→③→②→④
C.①→③→④→②
D.①→②→③→④ fenjiexing1年前1
fenjiexing1年前1 -
 fanfengx 共回答了19个问题
fanfengx 共回答了19个问题 |采纳率73.7%解题思路:氢氧根离子先与氢离子反应,再与铝离子反应,然后与铵根离子反应,最后与Al(OH)3反应.氢氧根离子先与氢离子反应①H++OH-=H2O,再与铝离子反应③Al3++3OH-=Al(OH)3↓,再与铵根离子反应④NH4++OH-=NH3•H2O,最后与Al(OH)3反应②Al(OH)3+OH-=AlO2-+2H2O.
故选C.点评:
本题考点: 离子反应发生的条件;镁、铝的重要化合物.
考点点评: 本题考查离子反应发生的顺序,注意先与铝离子反应,再与铵根反应,最后与Al(OH)3反应.1年前查看全部
- 如何化合制取AL(OH)3?这是一道浙江竞赛选择题,答案是可以.那么我们想了很久没有个答案希望浙江或是其他的化学同仁可以
如何化合制取AL(OH)3?
这是一道浙江竞赛选择题,答案是可以.
那么我们想了很久没有个答案
希望浙江或是其他的化学同仁可以告诉我们
针对下面回答
AL2O3 不溶于水 加热也没有用
第二个不是化合反应 该反应我们也知道
第三个我们也有考虑,但我们在各类文献中都没有找到。请第三个回答的人给予文献以证明 botaoxongyong1年前7
botaoxongyong1年前7 -
 是我的拉 共回答了21个问题
是我的拉 共回答了21个问题 |采纳率100%常规途径:
1、AlCl3 + NH3.H2O或NaOH
2、NaAlO2 + CO2或HCl
3、AlCl3 + NaAlO2
但都不属于化合
只能走非常规途径
能否是:Al-O2在中性条件下构成燃料电池
类似于Fe的电化学腐蚀中的吸氧腐蚀1年前查看全部
- 1、一块铁铝合金与足量盐酸反应,加入过量NaOH溶液后,最终产物是( )A、Fe(OH)2和Al(OH)3 B、Fe(O
1、一块铁铝合金与足量盐酸反应,加入过量NaOH溶液后,最终产物是( )A、Fe(OH)2和Al(OH)3 B、Fe(OH)3和Al(OH)3 C.Fe(OH)3和NaAlO2 D.Fe(OH)2和NaAlO2答案C
 hismsc1年前5
hismsc1年前5 -
 似猫乃虎 共回答了18个问题
似猫乃虎 共回答了18个问题 |采纳率94.4%铁铝合金与足量盐酸反应:
Fe + 2 HCl = FeCl2 + H2↑
2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
加入 过量 NaOH
FeCl2 + 2 NaOH = Fe(OH)2 ↓ + 2 NaCl
4 Fe(OH)2 +O2 + 2 H2O = 4 Fe(OH)3(氢氧化亚铁不稳定,极易氧化)
AlCl3 + 3 NaOH = Al(OH)3 ↓ + 3 NaCl
Al(OH)3 + NaOH = NaAlO2 + 2 H2O
选择C1年前查看全部
- Al在水中会产生AlO2-吗?是不是al和水会产生al(oh)3,然后al(oh)3会水解产生alo2-?H+ + AI
Al在水中会产生AlO2-吗?
是不是al和水会产生al(oh)3,然后al(oh)3会水解产生alo2-?H+ + AIO2- + H2O AI(OH)3 AI3+ + 3OH-会适用于此吗?al(oh)3不是在强酸强碱条件下才转化吗?al(oh)3水解,h2o不是强酸强碱怎么会H+ + AIO2- + H2O AI(OH)3?大神们教教我 2005060891年前1
2005060891年前1 -
 gzlez 共回答了19个问题
gzlez 共回答了19个问题 |采纳率73.7%首先,Al 与冷水几乎不反应,与热水缓慢反应,产生Al(OH)3与H2.Al(OH)3电离方程式为:H+ + AIO2- + H2O AI(OH)3 AI3+ + 3OH-,其中以碱性电离为主,所以有Al(OH)3两性偏碱性这个说法.水解一般是盐类才发生.盐类水解是指盐...1年前查看全部
- 1.向NaAlO2溶液通入过量的 CO2的离子方程式:2(AlO2)- + CO2+3(H2O)====2Al(OH)3
1.向NaAlO2溶液通入过量的 CO2的离子方程式:2(AlO2)- + CO2+3(H2O)====2Al(OH)3↓+(CO3)2-这个离子方程式错在哪里呢?
2.请选出不能利用置换反应通过Y得到W的一组化合物是:A.Y:CO2 W:MgO
B.Y:Fe2O3 W:Al2O3 C.Y:C2H5OH W:C2H5Na D.Y:FeCl3 W:CUCl2
答案是选D,我也知道D为什么错,但是我不知道ABC是怎么通过置换反应得到的,学长们,能给我讲讲么, 昏睡之男1年前2
昏睡之男1年前2 -
 文飞321 共回答了22个问题
文飞321 共回答了22个问题 |采纳率72.7%若二氧化碳过量:
NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3(沉淀),不会产生碳酸跟,为碳酸氢跟
A 镁条在CO2中燃烧可以满足,Mg+CO2=MgO+C
B 这是铝热反应,书上有的,Fe2O3+2Al=2Fe+Al2O3
C验证C2H50H羟基的H活性时用的,2C2H50H+2Na=2C2H5Na+H2
D你已经知道了,不说了吧1年前查看全部
- (2002•长沙)人的胃液中含有少量盐酸,胃酸过多时常服用“胃舒平”[其有效成分为Al(OH)3]来治疗,其治疗的原理是
(2002•长沙)人的胃液中含有少量盐酸,胃酸过多时常服用“胃舒平”[其有效成分为Al(OH)3]来治疗,其治疗的原理是(用化学方程式表示)______.
 yhrlovesxx1年前1
yhrlovesxx1年前1 -
 liangcai 共回答了17个问题
liangcai 共回答了17个问题 |采纳率82.4%解题思路:书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据客观事实、遵守质量守恒定律.氢氧化铝与稀盐酸反应生成氯化铝和水.
该反应的化学方程式为:3HCl+Al(OH)3═AlCl3+3H20.
故答案为:3HCl+Al(OH)3═AlCl3+3H20.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;酸的化学性质.
考点点评: 本题主要考查化学方程式的书写,难度较小.1年前查看全部
- 在下列几种物质中①NaHCO3 ②Al(OH)3 ③(NH4)2CO3 ④苯酚钠 ⑤氨基乙酸 ⑥蛋白质,其中跟HCl和N
在下列几种物质中①NaHCO3 ②Al(OH)3 ③(NH4)2CO3 ④苯酚钠 ⑤氨基乙酸 ⑥蛋白质,其中跟HCl和NaOH溶液都发生反应的是( )
A.①②④⑥
B.①④⑤⑥
C.①②③④⑥
D.①②③⑤⑥ baker21年前0
baker21年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- AL(OH)3与胃酸的离子方程式
AL(OH)3与胃酸的离子方程式
离子离子离子 斯潘1年前2
斯潘1年前2 -
 忧郁骑士 共回答了29个问题
忧郁骑士 共回答了29个问题 |采纳率89.7%我写的就是离子方程式.
Al(OH)3+3H+=Al3+ +3H2O1年前查看全部
- 下列关于Al(OH)3的性质叙述中错误的是( )
下列关于Al(OH)3的性质叙述中错误的是( )
A.Al(OH)3与过量的浓氨水反应生成NH4AlO2
B.Al(OH)3是难溶于水的白色胶状物质
C.Al(OH)3胶体能凝聚水中的悬浮物
D.Al(OH)3受热能分解 小江08111年前1
小江08111年前1 -
 sunnylucy 共回答了27个问题
sunnylucy 共回答了27个问题 |采纳率88.9%解题思路:A.氢氧化铝能不能和弱酸、弱碱之间发生反应;
B.Al(OH)3的物理性质;
C.Al(OH)3胶体的吸附性;
D.Al(OH)3不稳定受热能分解.A.氢氧化铝能和强酸以及强碱发生反应,但是不能和弱酸、弱碱发生反应,氨水是弱碱,和氢氧化铝不反应,故A错误;
B.根据物质的溶解性,可知Al(OH)3是难溶于水的白色胶状物质,故B正确;
C.Al(OH)3胶体具有吸附性,能凝聚水中的悬浮物,故C正确;
D.难溶性氢氧化物加热分解为相应的氧化物与水,氢氧化铝加热分解为氧化铝与水,故D正确;
故答案为:A点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查学生氢氧化铝的性质,可以根据所学知识来回答,注意氢氧化铝只能和强酸以及强碱发生反应.1年前查看全部
- (2009•汕头模拟)下列各组物质相互反应得到Al(OH)3的是( )
(2009•汕头模拟)下列各组物质相互反应得到Al(OH)3的是( )
A.A12(SO4)3和过量的NH3•H2O
B.Al(NO3)3跟过量的NaOH溶液
C.A12O3和水共热
D.Al跟过量的NaOH溶液共热 云朵上的假期1年前1
云朵上的假期1年前1 -
 水滴之舞 共回答了24个问题
水滴之舞 共回答了24个问题 |采纳率87.5%解题思路:氢氧化铝是两性氢氧化物,溶于强酸、强碱,不溶于弱酸、弱碱;氧化铝不溶于水,不能与水反应生成氢氧化铝.据此判断解答.A、氢氧化铝不溶于弱碱,A12(SO4)3和过量的NH3•H2O反应得到氢氧化铝,故A正确;
B、氢氧化铝是两性氢氧化物,溶于强酸、强碱,Al(NO3)3跟过量的NaOH溶液生成偏铝酸盐,得不到氢氧化铝,故B错误;
C、氧化铝不溶于水,不能与水反应生成氢氧化铝,故C错误;
D、Al跟过量的NaOH溶液共热生成偏铝酸钠,得不到氢氧化铝,故D错误.
故选A.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查铝、氧化铝、氢氧化铝的性质,比较基础,注意基础知识的掌握.1年前查看全部
- 以硫酸铝溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )
以硫酸铝溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )
A. 氢氧化钠溶液
B. 氢氧化钡溶液
C. 氨水
D. 澄清的石灰水 絶恋1年前1
絶恋1年前1 -
 暗黑火焰 共回答了22个问题
暗黑火焰 共回答了22个问题 |采纳率81.8%解题思路:氢氧化铝溶于强碱不溶于弱碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与硫酸铝反应生成氢氧化铝与硫酸铵,再通过过滤就可以得到氢氧化铝.氢氧化铝溶于强碱不溶于弱碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与硫酸铝反应生成氢氧化铝与硫酸铵,再通过过滤就可以得到氢氧化铝,故选:C.
点评:
本题考点: 镁、铝的重要化合物.
考点点评: 主要考查氢氧化铝的制备方法,关键是理解氢氧化铝的两性.1年前查看全部
- 关于弱碱能否溶解Al(OH)3的问题!
关于弱碱能否溶解Al(OH)3的问题!
强碱和弱碱究竟差别在哪了?二者的电离程度是不是相差非常大?
如果说NaOH在某一浓度下可以溶解Al(OH)3的话,那么有没有可能通过提到弱碱的浓度使它的OH浓度也达到可以溶解Al(OH)3的程度?
那酸式电离的情况可不可能与弱碱相互溶解了呢 得意的蛋1年前1
得意的蛋1年前1 -
 wxy6678 共回答了18个问题
wxy6678 共回答了18个问题 |采纳率88.9%严格来说强碱和弱碱并没有本质的区别,只不过强碱的电离常数很大,可以认为强碱在水中完全电离.而弱碱电离常数较小,表现为很多分子没有电离.
若将碱表示为R(OH)n,那么电离常数为K=c(R+)c(OH-),即碱溶液中R+与OH-的浓度的乘积为常数.若溶液中R+与OH-全来自R(OH)n,那么nc(R+)=c(OH-),所以c(OH-)=√(nK),又由于K只与温度有关,所以当温度一定时,弱碱溶液的OH-浓度的最大值为一常数,与所加的碱的多少无关.因此在弱碱溶液中不能通过提高弱碱的浓度而使OH-浓度升高,唯一的做法就是提高温度.
由于Al(OH)3酸式电离很微弱,因此只有强碱才能将其溶解.从以上的分析来看,弱碱中OH-的最大浓度为一常数,就拿最常见的氨水来说,常温下离子积K=1.78×10^(-5),所以c(OH-)=0.0042mol/L,这种浓度的OH-是不能溶解Al(OH)3的.1年前查看全部
- AL3+和ALO3(-)双水解,AL3+ + 3OH-=AL(OH)3↓ ALO3-+ H+ +H2O=AL(OH)3↓
AL3+和ALO3(-)双水解,AL3+ + 3OH-=AL(OH)3↓ ALO3-+ H+ +H2O=AL(OH)3↓
ALO3-不是直接加H+就能到AL(OH)3沉淀吗?为什么方程式还要加水? 猪猪恋1年前1
猪猪恋1年前1 -
 xx后土 共回答了13个问题
xx后土 共回答了13个问题 |采纳率84.6%ALO2-吧
ALO2-+ H+ +H2O=AL(OH)3↓
式子电荷要平衡1年前查看全部
- Al(OH)3是两性氢氧化物,他能和弱酸弱碱反应吗
 love-qq9201年前1
love-qq9201年前1 -
 你怎么样 共回答了18个问题
你怎么样 共回答了18个问题 |采纳率94.4%不反应.
两性物质:能和强酸强碱反应.
氢氧化铝就不能和弱酸弱碱反应.1年前查看全部
- 1mol/LAlCl3溶液75mL与2mol/LNaOH溶液120mL相混合,可得Al(OH)3沉淀多少克?
 卖花姑娘-1年前1
卖花姑娘-1年前1 -
 dafeixiang 共回答了25个问题
dafeixiang 共回答了25个问题 |采纳率92%n(Al3+) = 1*0.075 = 0.075mol
n(OH-) = 2*0.12 = 0.24mol
Al3+ +3 OH- = Al(OH)3↓,
1 3 1
0.075 0.225 0.015
若Al3+完全沉淀则需要OH-的量为0.075*3 = 0.225 mol1年前查看全部
- al(oh)3与与过量氨水为什么不生成alo2-
al(oh)3与与过量氨水为什么不生成alo2-
为什么与naoh可以 UpoUp1年前2
UpoUp1年前2 -
 zxcvjsadkgoisuad 共回答了15个问题
zxcvjsadkgoisuad 共回答了15个问题 |采纳率100%金属铝和氢氧化钠溶液反应生成的化合物曾被认为是NaAlO2,但科学研究证明该产物实际上是Na[Al(OH)4],它属于配位化合物.NaAlO2即Na[Al(OH)4]在酸性条件下或者是与CO2反应可生成AL(OH)3:%D%ANa[Al(OH)4]+HCl=NaCl+AL(OH)3+H2O或者NaAlO2+HCl+H2O=NaCl+AL(OH)3%D¢Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3+H2O或者2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3%D%A在2Al(OH)3再加沉淀符号1年前查看全部
- 以硫酸铝溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )
以硫酸铝溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )
A. 氢氧化钠溶液
B. 氢氧化钡溶液
C. 氨水
D. 澄清的石灰水 睡蛇1年前1
睡蛇1年前1 -
 来一口果冻 共回答了25个问题
来一口果冻 共回答了25个问题 |采纳率96%解题思路:氢氧化铝溶于强碱不溶于弱碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与硫酸铝反应生成氢氧化铝与硫酸铵,再通过过滤就可以得到氢氧化铝.氢氧化铝溶于强碱不溶于弱碱,实验室通常用弱碱氨水与铝盐制备氢氧化铝沉淀,氨水与硫酸铝反应生成氢氧化铝与硫酸铵,再通过过滤就可以得到氢氧化铝,故选:C.
点评:
本题考点: 镁、铝的重要化合物.
考点点评: 主要考查氢氧化铝的制备方法,关键是理解氢氧化铝的两性.1年前查看全部
- Al3++3H2O=Al(OH)3+3H+在平衡体系中加入NaOH
Al3++3H2O=Al(OH)3+3H+在平衡体系中加入NaOH
为什么平衡正向移动?氢氧根离子不和Al离子反应么. 朱DiDi1年前1
朱DiDi1年前1 -
 keenty 共回答了16个问题
keenty 共回答了16个问题 |采纳率100%平衡正向移动?这种说法存在争议,但是殊途同归,正向与逆向的结果是一样的.
按照浓度大小,应先与Al3+反应,按照反应难易(离子结合的稳定性),应先与H+反应.
实际两者都存在.
理论上的争辩不影响该反应的结果.1年前查看全部
- 氢氧化铝制备(离子方程式)化学方程式:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4变成
氢氧化铝制备(离子方程式)
化学方程式:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4变成离子方程式.顺便问一下,NH3·H2O离子方程式时能拆么?怎么拆? 2834199961年前1
2834199961年前1 -
 jskaaa 共回答了27个问题
jskaaa 共回答了27个问题 |采纳率85.2%2Al3+ + 6NH3·H2O = 2Al(OH)3↓ + 6NH4+
NH3·H2O离子方程式时不能拆1年前查看全部
- 有些胃药中有{AL(OH)3},它在人的胃内起什么作用?写出化学方程式?
 qw77271年前1
qw77271年前1 -
 luodeman084 共回答了10个问题
luodeman084 共回答了10个问题 |采纳率90%{AL(OH)3}主要是给胃酸过多的人服用的,目的是中和过多的盐酸,{AL(OH)3}+3HCl=AlCl3+3H2O1年前查看全部
- HClO4,KOH,Al(OH)3相互反应的离子方程式
 cngri1年前1
cngri1年前1 -
 wsnboo 共回答了13个问题
wsnboo 共回答了13个问题 |采纳率92.3%Al(OH)3+3(H+)==(Al3+)+3H2O
(H+)+(OH-)==H2O
Al(OH)3+(OH-)==(AlO2-)+2H2O1年前查看全部
- 硫酸铝的制取 我知道可以用AL2S3+H2SO4和al(oh)3+h2so4制取但是方程式如何
 qijianhao1年前4
qijianhao1年前4 -
 tonypanzhangqing 共回答了17个问题
tonypanzhangqing 共回答了17个问题 |采纳率82.4%Al2S3+3H2SO4=Al2(SO4)3+3H2S,
2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O1年前查看全部
- C.向偏铝酸钠溶液中通人过量CO2:2AlO2-+CO2+3H2O 2Al(OH)3↓+CO32- D.碳酸氢钙溶液中加
C.向偏铝酸钠溶液中通人过量CO2:2AlO2-+CO2+3H2O 2Al(OH)3↓+CO32- D.碳酸氢钙溶液中加人少量NaOH溶
C.向偏铝酸钠溶液中通人过量CO2:
2AlO2-+CO2+3H2O 2Al(OH)3↓+CO32-
D.碳酸氢钙溶液中加人少量NaOH溶液:
Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
为什么C、D错 河南文化1年前1
河南文化1年前1 -
 清浊墨 共回答了18个问题
清浊墨 共回答了18个问题 |采纳率94.4%C、过量的二氧化碳的话生成碳酸氢根;
D、少量NaOH的话Ca2++HCO3-+OH- == CaCO3↓+H2O1年前查看全部
- 为什么ALO2-与H+或AL3+在水溶液中可生成AL(OH)3沉淀?
 lyz11041年前2
lyz11041年前2 -
 一夜yy 共回答了23个问题
一夜yy 共回答了23个问题 |采纳率95.7%酸性条件下Al只能以铝离子的形式存在,不能以偏铝酸根存在 加上ALO2-和AL3+会发生双水解,总之都是氢氧化铝沉淀.1年前查看全部
- Al(OH)3是如何凝聚水中的悬浮物,吸附色素.的
 pureant1年前1
pureant1年前1 -
 i_tanya 共回答了17个问题
i_tanya 共回答了17个问题 |采纳率88.2%Al(OH)3在水中易形成胶体,从而吸附水中杂质.1年前查看全部
- 为什么Al(OH)3中通入CO2沉淀不会溶解于碳酸生成碳酸氢铝
 wyl8204171年前2
wyl8204171年前2 -
 多米齐 共回答了16个问题
多米齐 共回答了16个问题 |采纳率93.8%氢氧化铝,化学式Al(OH)3,是铝的氢氧化物.是一种碱,由于又显一定的酸性,所以又可称之为铝酸(H3AlO3),但实际与碱反应时生成的是偏铝酸盐.
此化合物性质稳定,可与强酸碱发生反应,但不能与弱酸碱发生反应1年前查看全部
- (2014•丹阳市一模)小组同学查资料知道泡沫灭火器原理是:AlCl3+3NaHCO3═3NaCl+Al(OH)3↓+3
(2014•丹阳市一模)小组同学查资料知道泡沫灭火器原理是:AlCl3+3NaHCO3═3NaCl+Al(OH)3↓+3CO2↑

【提出问题】此反应发生的原因是否由于AlCl3呈酸性?
【实验】测定AlCl3溶液的酸碱性
(1)用______测定溶液的酸碱性.
【提出问题】NH4Cl溶液呈酸性,它是否也能与NaHCO3溶液反应?
【实验】按如图1进行实验:观察到的现象是:湿润的红色石蕊试纸变蓝,石灰水变浑浊
(2)说明生成的气体有______和______
(3)C中浓硫酸吸收水蒸气和______
(4)A中的反应方程式是______.
【实验反思】Ⅰ、Na2CO3和 NaHCO3 的性质区别
按如图2进行实验:
取适量的NaHCO3 粉末加到a试管中,加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊.持续加热直至两试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末.
(5)小文猜测白色固体粉末可能是:①NaOH;②Na2CO3;③NaCl.小燕认为猜想③一定不正确,理由是______,小燕从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,她判断该固体为NaOH,小美认为她的实验设计不合理,因为______.
(6)他们继续探究固体成分,设计了如表实验:
通过实验证明:2NaHCO3操作步骤 实验现象 结论 取少量白色固体于试管中,加水溶解,向其中滴加足量______溶液, ______ 剩余的固体有Na2CO3 静置,继续滴加酚酞 不变红 剩余的固体没有NaOH
Na2CO3+CO2↑+H2O,NaHCO3热稳定性较Na2CO3差.△ . zikay1年前1
zikay1年前1 -
 一夕816 共回答了24个问题
一夕816 共回答了24个问题 |采纳率100%解题思路:(1)根据用酸碱指示剂测定溶液的酸碱性进行解答;
(2)根据氨气溶于水呈碱性,能使湿润的红色石蕊试纸变蓝;二氧化碳能使石灰水变浑浊进行解答;
(3)根据浓硫酸具有吸水性且能和氨气反应生成硫酸铵进行解答;
(4)根据氯化铵和碳酸氢钠溶液反应生成氯化钠、二氧化碳、氨气和水进行解答;
(5)根据质量守恒定律及化学反应的实质进行分析并完成解答即可;
(6)根据碳酸钠溶液能和氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,氢氧化钠溶液呈碱性,能使酚酞试液变红进行解答.(1)用紫色石蕊试液测定溶液的酸碱性;故填:紫色石蕊试液;
(2)氨气溶于水呈碱性,能使湿润的红色石蕊试纸变蓝;二氧化碳能使石灰水变浑浊,所以湿润的红色石蕊试纸变蓝,石灰水变浑浊,说明生成的气体有氨气和二氧化碳;故填:NH3;CO2;
(3)浓硫酸具有吸水性且能和氨气反应生成硫酸铵,所以C中浓硫酸吸收水蒸气和氨气;故填:氨气;
(4)氯化铵和碳酸氢钠溶液反应生成氯化钠、二氧化碳、氨气和水,反应方程式是NaHCO3+NH4Cl=NaCl+NH3↑+CO2↑+H2O;故填:NaHCO3+NH4Cl=NaCl+NH3↑+CO2↑+H2O;
(5)根据质量守恒定律及化学反应的实质可以知道反应前后元素的种类不变,反应小苏打中没有氯元素,所以反应后剩余的物质不可能为氯化钠,即猜想③不正确;碳酸钠溶液呈碱性,可以使酚酞变红,所以不能根据溶液变红就判断该物质为氢氧化钠;故填:小苏打中不含氯元素;碳酸钠溶液也可以使酚酞变红;
(6)碳酸钠溶液能和氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,氢氧化钠溶液呈碱性,能使酚酞试液变红,所以实验方案为:
操作步骤实验现象结论
取少量白色固体于试管中,加水溶解,向其中滴加足量氯化钙溶液,出现白色沉淀剩余的固体有Na2CO3
静置,继续滴加酚酞不变红剩余的固体没有NaOH.故填:氯化钙;出现白色沉淀.点评:
本题考点: 实验探究物质变化的条件和影响物质变化的因素;气体的净化(除杂);溶液的酸碱性测定;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了盐类的应用,溶液酸碱性分析判断,化学方程式的书写产物判断,题目难度中等.1年前查看全部
- Al2O3和NaOH怎么反应?不可以生成Al(OH)3吗?
 翻过书页451年前4
翻过书页451年前4 -
 头晕眼花301 共回答了18个问题
头晕眼花301 共回答了18个问题 |采纳率94.4%氧化铝是一种两性氢氧化物,可以和氢氧化钠反应生成偏铝酸钠:
AL2O3+2NAOH=2NAAL02+H20
氧化铝是氢氧化铝脱水后的产物,自然是不能通过和氢氧化钠反应升成.1年前查看全部
- 为什么Mg(HCO3)2溶液蒸干后的产物不是MgO而是Mg(OH)2,AlCl3溶液蒸干后的产物不是Al(OH)3,而是
为什么Mg(HCO3)2溶液蒸干后的产物不是MgO而是Mg(OH)2,AlCl3溶液蒸干后的产物不是Al(OH)3,而是Ai2O3呢?
 摩登6781年前1
摩登6781年前1 -
 pukuai77 共回答了31个问题
pukuai77 共回答了31个问题 |采纳率100%Mg(HCO3)2溶液蒸干后变成MgO,跟空气中水蒸气反应成为Mg(OH)2,而AlCl3溶液蒸干后的Al(OH)3被空气氧化成为Al2O3,如果我记得没错应该是这样的1年前查看全部
- 下列说法中,不正确的是( )A.NH3的水溶液可以导电,说明NH3是电解质B.明矾水解形成Al(OH)3胶体有吸附性,
下列说法中,不正确的是( )
A.NH3的水溶液可以导电,说明NH3是电解质
B.明矾水解形成Al(OH)3胶体有吸附性,可用于水的净化
C.二氧化硅可用于制造光导纤维
D.向淀粉碘化钾溶液中加溴水,溶液变为蓝色,说明Br2的氧化性强于I2 dt9481年前1
dt9481年前1 -
 耗子018382 共回答了18个问题
耗子018382 共回答了18个问题 |采纳率88.9%解题思路:A.电解质指:水溶液中或熔融状态下能够导电的化合物,注意能导电,必须是电解质自身电离出自由移动的离子;在上述两种情况下都不能导电的化合物称为非电解质;
B.明矾中的铝离子水解生成氢氧化铝胶体,具有吸附悬浮杂质的作用;
C.光导纤维的主要成分是二氧化硅;
D.卤素单质的氧化性顺序是:Br2>I2,离子的还原性顺序是:I->Br-,Br2强氧化性比碘强,可与KI发生氧化还原反应生成I2;碘遇淀粉显蓝色;A.氨气是化合物,溶于水,氨气和水反应生成一水和氨,NH3•H2O⇌NH4++OH-导电,但这些离子不是氨气电离,氨气是非电解质,故A错误;
B.明矾中的铝离子水解生成氢氧化铝胶体,具有吸附悬浮杂质的作用;可用于水的净化;故B正确;
C.光导纤维是利用光反射原理制成的,光导纤维的主要成分是二氧化硅,故C正确;
D.碘遇淀粉显蓝色,说明有碘单质生成,这是因为溴强氧化性比碘强,可与KI发生氧化还原反应生成I2,反应的离子方程式为Br2+2I-=2Br-+I2,故D正确;
故选A.点评:
本题考点: 电解质与非电解质;盐类水解的应用;硅和二氧化硅.
考点点评: 本题考查了氨气是非电解质、明矾净水、光导纤维的主要成分、碘遇淀粉显蓝色等知识点,掌握基础知识是解题关键,题目难度不大.1年前查看全部
- 下列说法不正确的是( )①Al2O3用作耐火材料、Al(OH)3用作阻燃剂②硫粉在过量的纯氧中燃烧可以生成SO3③少量
下列说法不正确的是( )
①Al2O3用作耐火材料、Al(OH)3用作阻燃剂
②硫粉在过量的纯氧中燃烧可以生成SO3
③少量SO2通过浓的CaCl2溶液能生成白色沉淀
④工业上生产水泥和玻璃均用到的原料是石灰石
⑤在工业生产中用银和浓硝酸反应制取硝酸银
⑥工业上常用硅制造光导纤维
⑦镁的冶炼MgCl2(熔融)
Mg+Cl2↑电解 .
⑧用热的纯碱溶液清洗油污CO32-+2H2O⇌H2CO3+2OH
⑨用氢氟酸刻蚀玻璃:4HF+SiO2═SiF4↑+2H2O
⑩自然界中不存在游离态的硅,硅主要以二氧化硅和硅酸盐的形式存在.
A.②③⑤⑥⑧
B.①③⑥⑨
C.④⑤⑨⑩
D.②③⑥⑦ billfoxf21年前1
billfoxf21年前1 -
 tygg3 共回答了21个问题
tygg3 共回答了21个问题 |采纳率85.7%解题思路:①Al2O3熔点高、Al(OH)3加热易分解;
②硫粉在过量的纯氧中燃烧可以生成SO2;
③SO2通与CaCl2溶液不反应;
④水泥和玻璃均含有硅酸钙;
⑤工业生产中制取硝酸银应尽量避免环境污染,且节约原料;
⑥制造光导纤维的主要原料为二氧化硅;
⑦工业用电解熔融的氯化镁的方法冶炼镁;
⑧用热的纯碱溶液呈碱性,可用于除去油污;
⑨氢氟酸与二氧化硅反应;
⑩硅为亲氧元素.①Al2O3熔点高、Al(OH)3加热易分解,可用于阻燃剂,故正确;
②硫粉在过量的纯氧中燃烧可以生成SO2,不能生成三氧化硫,应在催化作用下生成,故错误;
③亚硫酸酸性比盐酸弱,SO2通与CaCl2溶液不反应,故错误;
④水泥和玻璃均含有硅酸钙,可用石灰石为原料,故正确;
⑤工业生产中制取硝酸银应尽量避免环境污染,且节约原料,可用氧化银和硝酸反应,故错误;
⑥制造光导纤维的主要原料为二氧化硅,故错误;
⑦工业用电解熔融的氯化镁的方法冶炼镁,故正确;
⑧用热的纯碱溶液呈碱性,可用于除去油污,但水解以一步为主,应为CO32-+H2O⇌HCO3-+OH-,故错误;
⑨氢氟酸与二氧化硅反应,可用于雕刻玻璃,故正确;
⑩硅为亲氧元素,在自然界中主要以二氧化硅和硅酸盐的形式存在,故正确.
故选A.点评:
本题考点: 硅和二氧化硅;含硫物质的性质及综合应用;镁、铝的重要化合物.
考点点评: 本题综合考查硅及其化合物的考查,为高考高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.1年前查看全部
- 向FeCl3和AlCl3混合溶液中先加入过量的NaI溶液,再加入足量的Na2S溶液,可生成FeS、S和Al(OH)3
向FeCl3和AlCl3混合溶液中先加入过量的NaI溶液,再加入足量的Na2S溶液,可生成FeS、S和Al(OH)3
问为什么会有Al(OH)3和FeS?还有Al2S3和Fe2S3为什么不可以?
请写出具体的方程式 nanli11年前2
nanli11年前2 -
 宝贝爱佬公 共回答了11个问题
宝贝爱佬公 共回答了11个问题 |采纳率90.9%主要是碘离子有还原性,会把三价的Fe,还原为二价
而硫化铝在水中完全水解生成氢氧化铝沉淀和硫化氢
所以你所说的两个都是不会产生的
我帮你写出离子方程式
先产生二价铁
2Fe3+ + 2I- ==2Fe2+ + I2
再二价铁和硫离子反应
Fe2+ + S2- =FeS
关于铝的
2Al3+ + 3S2- =A l2S3
再水解
Al2S3 +6H2O=2Al(OH)3 + 3H2S
然后再鄙视一下楼上的,回答问题和分数又没关系1年前查看全部
- 把这些化学方程式写完整Hcl+ca(oh)2=hcl+al(oh)3=hcl+NaOH=H2So4+NaOH=H2So4
把这些化学方程式写完整
Hcl+ca(oh)2=
hcl+al(oh)3=
hcl+NaOH=
H2So4+NaOH=
H2So4+Ca(OH)2=
H2so4+AL(OK)3=
HNO3+Ca(OH)2= 旖欣1年前1
旖欣1年前1 -
 acacia01 共回答了20个问题
acacia01 共回答了20个问题 |采纳率90%2Hcl+ca(oh)2=cacl2+2h2o
6hcl+2al(oh)3=2alcl3+3h20
hcl+NaOH=nacl+h2o
H2So4+2NaOH=na2so4+2h2o
H2So4+Ca(OH)2=caso4(沉淀)+2h2o
3H2so4+2AL(OK)3=al2(so4)3+3h2o
2HNO3+Ca(OH)2= ca(no3)2+2h2o1年前查看全部
大家在问
- 1一块500g的冰放入一容器中,熔化成水后,它的质量 ______,密度 ______,体积 ______(前三空选填“变
- 2浸在水中的木球密度小于水的密度,固定在弹簧的一端,弹簧另一端固定在容器底部,当系统自由下落时,弹簧
- 3已知函数f(x)=ax^2+bx(ab不等于0)满足f(x1)=f(x2),且x1不等于x2,求f(x1+x2)的值.
- 4四川青川怎么老是地震啊?
- 5下面这个函数在x=1处的左极限和右极限各是多少?
- 6硫酸铝加热蒸干灼烧后,为什么不能得到氢氧化铝
- 7电解氢氧化铝没生成一摩尔铝生成多少摩尔水
- 8用何方法可以解除或避免金属离子对酶的抑制作用?
- 9设xyz是三个连续正整数的平方( x
- 10小孔成像为什么是倒立的实像?
- 11象棋比赛中,每位选手都与其他选手赛一场,赢者得2分,负者得0分,平局两人各得1分.现在有两位学生统计全部选手总分,分别为
- 12某瀑布,从50米高处落下,如果这个瀑布的水全部用来对水轮做功,每分钟做功2.21*10^8焦,能产生__瓦功率
- 13为什么日界线要东减西加
- 14数学题如图,将纸面折过去,是角顶点A落在A’;处,BC为折痕,BD为∠A‘BE的平分线,求∠CB
- 15如图 已知 c b e 三点在一条直线上 ac垂直cb de垂直be 角abd=90° ab=bd 证明ac+de=ce
