无机化学如何分析确定分子的几何形状
 duguanji2022-10-04 11:39:541条回答
duguanji2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 jingwei2008 共回答了17个问题
jingwei2008 共回答了17个问题 |采纳率100%- ①对于ABm型共价分子:中心原子周围电子对排布的几何形状,主要取决于中心原子的价电子对数,而价电子数等于成键电子对和未成键的孤电子对之和. ②价电子对要尽量远离,减小排斥 两对————180°最远 三对————平面三角形最远 四对————四面体 五对————三角双锥 六对————正八面体 一般说来,孤电子对、成键电子对之间斥力大小的顺序为 孤电子对~孤电子对>孤电子对~成键电子对>成键电子对~成键电子对 ③价层电子对排布方式与分子构型有关 只有σ键才能撑起分子骨架,所以分子构型与价对构型有时一致有时不一致,根据键对与孤对数目判断构型.
B.计算方法
m+n规则:m为中心原子周围B原子个数. n=(中心原子价电子数-直接相连原子数×该原子达稳定结构所需电子数)÷2 特别注意:当算出的n值不是整数值时,有2种取值方法. ①n>3时,只取整数位.(例如n=3.9只取n=3) ②n - 1年前
相关推荐
- 组成生物的各种物质都来自于生物有选择的从无机自然界吸收 A 对 B 错
组成生物的各种物质都来自于生物有选择的从无机自然界吸收 A 对 B 错
急 ares魔1年前2
ares魔1年前2 -
 舒服家 共回答了19个问题
舒服家 共回答了19个问题 |采纳率78.9%错,如血红细胞会在水中吸水过多而裂解1年前查看全部
- 四种反应类型能概括所有无机反应方程式么?
四种反应类型能概括所有无机反应方程式么?
四种反应类型——
置换
复分解
化合 dike5201年前3
dike5201年前3 -
 jmmfn 共回答了16个问题
jmmfn 共回答了16个问题 |采纳率93.8%不能,如CO+CuO=△=Cu+CO2不是基本反应类型,属于氧化还原反应.
氧化还原反应和非氧化还原反应可以包含所有的反应.1年前查看全部
- 大学无机化学,第10-13题 我没有思路 我真心想学习
大学无机化学,第10-13题 我没有思路 我真心想学习
大学无机化学,
第10-13题
我没有思路
希望可以写在纸上,真诚相待,

 幽居长安1年前0
幽居长安1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 谁能帮忙推荐几种亲水亲油的小分子物质,有机无机的,都可以,但要分子量比较小的,不要那种高聚物哦,谢
 chixinmumao1年前1
chixinmumao1年前1 -
 真想1 共回答了22个问题
真想1 共回答了22个问题 |采纳率100%甲醇、乙醇、甲酸、乙酸、甲醛、乙醛等等碳数少的且含有亲水基团的有机物
无机的好像没有亲脂性的……1年前查看全部
- 大一无机化学,第7题
大一无机化学,第7题

 billy841年前1
billy841年前1 -
 高二小孩 共回答了19个问题
高二小孩 共回答了19个问题 |采纳率94.7%1)由于Ag+浓度不是标准,因此要注明实际浓度
(-)Ag,Ag2C2O4|C2O42-(1.00mol/L)||Ag+(0.1mol/L)|Ag (+)
正极:Ag+ +e-=Ag
负极:Ag2C2O4+ 2e-=2Ag+ C2O42-
显然:负极是标准,而正极不是标准
因此
正极:Ag+ +e-=Ag
φ(Ag+/Ag)=φ(Ag+/Ag)+0.0591v *lg[Ag+]/c0
=0.799v +0.0591v *lg0.10
=0.740v
则:电池电动势
E=φ(Ag+/Ag)-φ0(Ag2C2O4/Ag)
=0.740v -0.49v
=0.25v
2)要计算Ksp,要用标准电极电势来求
可以设计电池
令:
正极:Ag2C2O4+ 2e-=2Ag+ C2O42-
负极:Ag+ +e-=Ag
总反应::Ag2C2O4=2Ag+ C2O42-
K0即为Ksp
lgK0=nE0/0.0591v=2*(0.49-0.799)v/0.0591v=-10.50
K0=3.1*10^-11
===
当然也可下列设计
正极:Ag+ +e-=Ag
负极:Ag2C2O4+ 2e-=2Ag+ C2O42-
总反应: 2Ag+ + C2O42-=Ag2C2O4
K0=1/Ksp
lgK0=nE0/0.0591v=2*(0.799-0.49)v/0.0591v=10.50
K0=3.2*10^10
Ksp=1/K0=3.1*10^-111年前查看全部
- 一道大一无机化学,当有两个非标准状态的物质时,我就无从下手了……求高手指点!可以只写个式子,我揣摩揣摩.感激不尽!
 rbnum11年前0
rbnum11年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 大学简明无机化学~¥%求救中…………
大学简明无机化学~¥%求救中…………
[Co(NO2)6]4-化合物的磁距为1.8,试分析它的原子杂化情况,所成化学键的性质,配位单元的几何形状
谁懂的教教,有空请你吃饭 铂利德钻石1年前1
铂利德钻石1年前1 -
 steph99 共回答了15个问题
steph99 共回答了15个问题 |采纳率93.3%首先你得看一下 它是6配 所以是sp3d2杂化或者d2sp3杂化,再看它带有4个电子的负电荷,因此可以看成4 2结构,因此是平面正方形.好久没有看无机了 差不多都忘了 呵呵1年前查看全部
- 高分子无机化合物聚合氯化铝在什么条件下分解为小分子
高分子无机化合物聚合氯化铝在什么条件下分解为小分子
高分子无机化合物聚合氯化铝(氯化羟铝)([A12(OH)nC16-n·xH2O]m )在什么条件下分解为小分子,希望知道的朋友帮一下 茶庄的螳螂1年前2
茶庄的螳螂1年前2 -
 swlhyang 共回答了14个问题
swlhyang 共回答了14个问题 |采纳率100%目前大部分聚合氯化铝都是用氯化铝或者含氯和铝成分的原料通过加入氢氧化钠或者其他碱性物质调节pH使氯化铝发生水解聚合而得到的.工业生产时的氯化铝溶液pH小于2,通过加入碱性物质使pH上升至3到5,在这个范围内便可生成聚合氯化铝,所以通过加入强酸使pH值下降,聚合氯化铝便会分解成小分子氯化铝,在溶液中就是氯离子和铝离子.或者加入大量的碱性物质使pH上升,从而生成氢氧化铝沉淀.1年前查看全部
- 醇与羧酸的的反应醇不是可以和无机含氧酸反应么,但脂化反应中H2SO4为什么没参加反应、只做催化剂?
 一切要向前看1年前1
一切要向前看1年前1 -
 山行者 共回答了13个问题
山行者 共回答了13个问题 |采纳率84.6%事实上有部分硫酸的确参加了反应的 这是不可避免的副反应 但是量很少忽略不计
酯化反应发生都需要特定的温度 温度适宜的话反应就能较快进行 温度不适宜的话反应就会很慢 所以控制温度可以让反应朝着想要的方向进行并减少副反应1年前查看全部
- 两个无机化学的题,1、欲配置250ml PH=5的缓冲溶液,问应向125ml 1mol/l NaAc溶液中加入6.0mo
两个无机化学的题,
1、欲配置250ml PH=5的缓冲溶液,问应向125ml 1mol/l NaAc溶液中加入6.0mol/l HAc和水各多少毫升
2、将相对分子质量为120的某那挥发物质A 3g溶于100g水中,在100kpa下测得沸点为100.14℃,计算是不是非电解质,如果是溶解度多少?
第二题中水的Kb=0.512 森林里的小魔女1年前1
森林里的小魔女1年前1 -
 任重道远多艰辛 共回答了17个问题
任重道远多艰辛 共回答了17个问题 |采纳率82.4%1、缓冲溶液PH计算公式:pH=pKa+lg[c(NaAc)/c(HAc)]
5=4.74+lg[c(NaAc)/c(HAc)],lg[0.05/c(HAc)]=0.26,0.05/c(HAc)=1.82,c(HAc)=0.027摩尔/升
6X=250*0.027,X=1.1毫升,即 1.1毫升HAc和水124毫升
2、该物质的质量摩尔浓度=(3/120)*1000/100=0.25摩尔/千克.
根据ΔTf=Tf°-Tf=KfmB,100.14-100=0.5122*0.25*B,B=1.09,不是电解质.1年前查看全部
- (2013•常州一模)气孔的开闭与保卫细胞的渗透压有关,气孔运动的无机离子吸收学说认为,在光照的条件下,保卫细胞质膜上的
 (2013•常州一模)气孔的开闭与保卫细胞的渗透压有关,气孔运动的无机离子吸收学说认为,在光照的条件下,保卫细胞质膜上的某种酶被激活,使H+分泌到保卫细胞外,驱动K+进入保卫细胞,引起保卫细胞渗透压升高,吸水膨胀,从而气孔开放.将新鲜的蚕豆叶采摘后,黑暗处理1h,分别置于一定pH的某种溶液中,进行A、B、C、D四组实验,如表一所示,1h后,撕取蚕豆叶下表皮,制成临时装片,用显微镜观察并统计气孔的开闭情况,结果如表二所示.
(2013•常州一模)气孔的开闭与保卫细胞的渗透压有关,气孔运动的无机离子吸收学说认为,在光照的条件下,保卫细胞质膜上的某种酶被激活,使H+分泌到保卫细胞外,驱动K+进入保卫细胞,引起保卫细胞渗透压升高,吸水膨胀,从而气孔开放.将新鲜的蚕豆叶采摘后,黑暗处理1h,分别置于一定pH的某种溶液中,进行A、B、C、D四组实验,如表一所示,1h后,撕取蚕豆叶下表皮,制成临时装片,用显微镜观察并统计气孔的开闭情况,结果如表二所示.
表一 实验对照组设计表
表二 实验结果统计表组别 溶液 pH 是否有光 A KCl 7 黑暗 B KCl 7 光照 C KCl 4.5 光照 D NaCl 7 光照
请回答下列问题:组别 完全开放 半开放 关闭 A 0.7% 11.7% 87.6% B 37.1% 38.7% 24.2% C 21.3% 41.9% 36.8% D 18.5% 26.7% 54.8%
(1)A和B组的实验数据进行对比分析,可以得出的结论是______.
(2)B和D组的实验数据进行对比分析,可以得出的结论是______.
(3)B和C组的实验数据进行对比分析,可以得出的结论是______.请将其表格中对气孔开闭影响的数据转换成柱状图.
(4)从气孔运动的角度分析,酸雨对植物光合作用的影响是______. 舞者1211年前1
舞者1211年前1 -
 澜儿小筑 共回答了18个问题
澜儿小筑 共回答了18个问题 |采纳率94.4%解题思路:解答本题的关键是将表格中的实验分组分析.表格中A和B组、B和D组、B和C组均可认为是一组对照实验,都遵循单一变量原则,实验的观察变量为气孔的开度,因此可以通过表二中的数据可以得出相应结论.(1)表一中可以看出,实验中的A组和B组可认为是一组对照实验,实验的自变量为是否有光.在黑暗条件下有87.6%的气孔是关闭的,而在光照条件下,有37.1%的气孔是完全开放的,有38.7%的气孔是半开放的.
(2)表一中可以看出,实验中的B组和D组可认为是一组对照实验,实验的自变量为溶液的种类.在KCl溶液中有37.1%的气孔是完全开放的,有38.7%的气孔是半开放的,而在NaCl溶液中,只有18.5%的气孔是完全开放的,有26.7%的气孔是半开放的.
(3)实验中的B组和C组可认为是一组对照实验,实验的自变量为PH.在PH值为7的条件下,有24.2%的气孔是关闭的,而在PH值为4.5的条件下,有36.8%的气孔是关闭的.在转换成柱形图时,B组用黑色表示,C组用白色表示,分完全开放、半开放、关闭三个值画图.
(4)实验中的B组和C组可以得出,酸性环境对气孔的开放具有一定的抑制作用,这会影响光合作用原料CO2的吸收,使光合作用的效率下降.
故答案为:
(1)光照能够促进蚕豆叶下表皮气孔开放
(2)K+对气孔的开放具有促进作用
(3)酸性环境对气孔的开放具有一定的抑制作用 如右图
(4)酸雨导致气孔大量关闭,从而影响光合作用原料CO2的吸收,使光合作用的效率下降
点评:
本题考点: 影响光合作用速率的环境因素.
考点点评: 本题通过实验探究了光照、离子和PH对气孔开度的影响,意在考查考生能从表格中获取有效信息的能力;理解所学知识的要点,把握知识间的内在联系的能力;能运用所学知识与观点,通过比较、分析与综合等方法对某些生物学问题进行解释、推理,做出合理的判断或得出正确的结论的能力.1年前查看全部
- 微量元素无机转化为有机人体为什么容易吸收
 天平的左端1年前1
天平的左端1年前1 -
 冷慧野 共回答了16个问题
冷慧野 共回答了16个问题 |采纳率93.8%胃肠道对微量元素的吸收需要透过粘膜上皮细胞和毛细血管内皮细胞,细胞膜对微量元素的被动扩散和主动转运都是有机态更容易些.1年前查看全部
- 无机化学教学中如何介绍分子轨道理论
 如果爱相信爱1年前1
如果爱相信爱1年前1 -
 移动101 共回答了13个问题
移动101 共回答了13个问题 |采纳率100%共价键理论中,分子轨道理论发展得很快,应用也越来越广.在,已成为一个引人注目和值得研讨的课题.本文试就达一问题加以粗浅地阐述.(一)怎样讲授分子轨道理论 简言之,在大一无机化学中所讲授的分子轨道理论,应为“简单分子轨道理论”.即着重讲授以下各点:1.分子轨道理论的基本耍点;2.分子轨道的分布特点和分类;3.分子轨道的能量次序,4.键级、键长和键解离能.在阐述时,目前的无机化学教材大多数以第二周期元素的“同核双原子分子”为例,略提一下简单而典型的“异核双原子分子”,如Co或HF等.一个较为普遏的认识是,分子轨道理论和价键理论在给定的条件下各有特色,可以各自取长补短,相辅相成,二者都不可偏废.但实际上,由于经典化学键理论中价键概念的影响较深,价键法仍受到化学家的偏爱,以至于在无机化学教学中分子轨道理论的应用还很不广泛.随着计算技术的不断进步,分子轨道法能借助于电子计算机较方便地进行定量计算1年前查看全部
- 无机化合物可根据其组成和性质进行分类。 (1)上图所示的物质分类方法属于___ (填序号)。
无机化合物可根据其组成和性质进行分类。 
(1)上图所示的物质分类方法属于___ (填序号)。
A.交叉分类法 B.树状分类法
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下列中②、⑤、⑧后面。
(3)写出Cu与②的浓溶液反应的化学方程式:___。
(4)实验室检验气体⑨是否收集满的简单方法是:_______。 lhl03201年前1
lhl03201年前1 -
 hydsfm408 共回答了17个问题
hydsfm408 共回答了17个问题 |采纳率82.4%(1)B
(2)②HNO 3 ;⑤KNO 3 (或K 2 SO 4 、NaNO 3 中任意一种);⑧H 2 S(或H 2 O)
(3) Cu +4HNO 3 (浓)=Cu(NO 3 ) 2 +2NO 2 ↑+2H 2 O
(4)方法一:用湿润的红色石蕊试纸靠近容器口,若 试纸变蓝,则证明气体已经收集满。
方法二:用一洁 净的玻璃棒蘸取少量浓盐酸,靠近容器口,若产生白烟,则证明气体已经收集满1年前查看全部
- 生物知识求解在生物群落中的碳进入无机环境的途径包括化石燃料的燃烧吗?急!在线等答案
 synaonao19981年前2
synaonao19981年前2 -
 r5bca 共回答了17个问题
r5bca 共回答了17个问题 |采纳率76.5%化石燃料是生物的遗体以化石的形式储存起来了,早已不属于生物群落的成分,故其燃烧不是您所说的“生物群落中的碳进入无机环境的途径”.
生物群落中的碳进入无机环境的途径主要考虑生物(生产者、消费者和分解者)的呼吸作用.1年前查看全部
- 无机含氧酸的正盐热稳定性好于酸式盐,什么原因
 人头马身1年前2
人头马身1年前2 -
 得好吗 共回答了16个问题
得好吗 共回答了16个问题 |采纳率87.5%酸式盐中有一个体积较小的H原子,可以对酸根离子极化,使其不稳定易分解.1年前查看全部
- 高中化学方程式书写规律(有机和无机的都要)
高中化学方程式书写规律(有机和无机的都要)
比如考试考一个没见过的化学反应,需要写方程式,怎么知道该写什么条件得到什么产物呢? hopgmhe1年前1
hopgmhe1年前1 -
 北卡的蓝 共回答了12个问题
北卡的蓝 共回答了12个问题 |采纳率100%看题目对他的描述,把每种物质的特性要记住,就是与其他物质不一样的,还要考虑化合价的升降,是没有人会告诉你是哪类1年前查看全部
- 有关碱土金属化合物的热稳定性无机化学上面说从铍到钡,他们的氧化物热稳定性是降低的,熔点也降低,又说他们的碳酸盐的热稳定性
有关碱土金属化合物的热稳定性
无机化学上面说从铍到钡,他们的氧化物热稳定性是降低的,熔点也降低,又说他们的碳酸盐的热稳定性从铍到钡是依次递增,这究竟是怎么比较出来的啊?为什么氧化物和碳酸盐的变化趋势相反呢? 南山种菜1年前1
南山种菜1年前1 -
 jojoboli 共回答了15个问题
jojoboli 共回答了15个问题 |采纳率86.7%是大学无机化学吧,我想你要学会从规律的角度理
1、熔点降低-----都是RO结构,属于离子晶体,熔点即阴阳离子分开,所以与离子键有关,O^2-相同,离子键与R^2+有关,带的正电荷相等,但是半径增大,即阴阳离子间距增大,离子键作用减弱,即熔沸点降低
2、氧化物热稳定性是降低
碳酸盐的热稳定性从铍到钡是依次递增
--------这两个都是稳定性,所以从阴阳离子是否匹配的角度理解,你学过软硬酸碱理论吗,若学过,应该知道“软软结合、硬硬结合的较稳定;软硬结合的不稳定”,而软、硬与离子的大小有关
R^2+半径增大,所以,越来越软
O^2-半径小,属于硬
CO3^2-是复杂离子,半径大,属于软
所以,RO中,Be2+最硬,BeO最稳定
RCO3中,Be2+最硬,则BeCO3最不稳定
若你没有学过软硬酸碱理论,就从另一个角度理
Be与Al是对角线规则,很相似,所以,没有Al2(CO3)3,也就没有BeCO3,即BeCO3很不稳定
而存在CaCO3、BaCO3,所以,RCO3稳定性增强
而RCO3越来越稳定,即分解越来越难,则分解生成的RO越来越不稳定
MgCO3加热分解
CaCO3高温煅烧分解
说明,RCO3的分解温度越来越高,即稳定性增强1年前查看全部
- 为生命的诞生准备必要的物质条件的是【 】 A 从有机小分子到生物大分子 B 紫外线 雷电 C 从无机小分子到有
为生命的诞生准备必要的物质条件的是【 】 A 从有机小分子到生物大分子 B 紫外线 雷电 C 从无机小分子到有
为生命的诞生准备必要的物质条件的是【 】
A 从有机小分子到生物大分子 B 紫外线 雷电
C 从无机小分子到有机小分子 D原始生命的出现
为什么选C不选A nbswgs11年前1
nbswgs11年前1 -
 木子诃 共回答了22个问题
木子诃 共回答了22个问题 |采纳率90.9%从无机到有机是一个质的改变.1年前查看全部
- 无机反应 求二价铁和碳酸氢根离子反应及三价铁和碳酸氢根离子反应的方程式及分析
 0a11o1年前3
0a11o1年前3 -
 Vicky0127 共回答了18个问题
Vicky0127 共回答了18个问题 |采纳率88.9%Fe2+ +2HCO3- ==Fe(OH)2 沉淀 +2CO2 气体
Fe3+ +3HCO3- ==Fe(OH)3 沉淀+ 3CO2 气体
都是双水解,Fe(OH)2和 Fe(OH)3都是难容沉淀.
而HCO3- 得到不稳定的H2CO3分解成 CO2气体
沉淀和气体都有助于反应的进行.
另外 Fe(OH)2容易被空气氧化,4Fe(OH)2 +O2 + 2H2O===4Fe(OH)31年前查看全部
- 大学无机化学----反应速率题对于一个给定条件下的反应,随着反应的进行A.k变小 B.平衡常数K变小 C.V变小 D.逆
大学无机化学----反应速率题
对于一个给定条件下的反应,随着反应的进行
A.k变小 B.平衡常数K变小 C.V变小
D.逆反应速率变小 E.反应浓度变小 朕龙四1年前1
朕龙四1年前1 -
 曲云庙 共回答了16个问题
曲云庙 共回答了16个问题 |采纳率87.5%B.平衡常数K变小1年前查看全部
- 无机化学试题:欲配置0.2mol/L的HCl溶液500ml,需密度为1.19g/ml,质量分数为37%的浓盐酸多少毫升
 黑狐20071年前1
黑狐20071年前1 -
 sun556 共回答了14个问题
sun556 共回答了14个问题 |采纳率100%用物质的量相等来做
设需要V2毫升
c1V1=m(HCL)/M(HCL)=密度* V2 * 37%/M(HCL)
0.2mol/L * 0.5L=1.19g/ml * V2* 37%/36.5
解出V2即可1年前查看全部
- (2014•河南一模)有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂.纯E为无色油状液体;B、C
(2014•河南一模)有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂.纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同.现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶.
根据上述实验信息,请回答下列问题:
(1)写出下列溶液中溶质的化学式:A______,C______,E______,F______.
(2)E的浓溶液与Cu应的化学方程式是Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .Cu+2H2SO4(浓);该反应中氧化剂与还原剂的物质的量之比为______;该反应的还原产物与少量B溶液反应的离子方程式是______.
CuSO4+SO2↑+2H2O△ .
(3)如何通过实验进一步确定D溶液的溶质?写出简要的操作及现象______. 八月瘦马1年前1
八月瘦马1年前1 -
 大斜 共回答了11个问题
大斜 共回答了11个问题 |采纳率81.8%解题思路:①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾,说明A为NH3•H2O;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,可能为Al(OH)3或Mg(OH)2,F中沉淀完全溶解,则F为AgNO3,D可能为Al2(SO4)3或MgSO4;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出,该气体为CO2,说明E为酸溶液,且纯E为无色油状液体,说明E为H2SO4;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,则该沉淀可能为BaSO4或AgCl,则C应为BaCl2,B可能为Na2CO3或K2CO3.以此解答该题.(1)①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾,说明A为NH3•H2O;
②A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,可能为Al(OH)3或Mg(OH)2,F中沉淀完全溶解,则F为AgNO3;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出,该气体为CO2,说明E为酸溶液,且纯E为无色油状液体,说明E为H2SO4,B可能为Na2CO3或K2CO3;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,则该沉淀可能为BaSO4或AgCl,则C应为BaCl2,
根据B、C、D和F是盐溶液,且他们的阴离子均不同,D可能为Al2(SO4)3或MgSO4,
所以能确定的是A:NH3•H2O;E:H2SO4; F:AgNO3; C:BaCl2,
故答案为:NH3•H2O;BaCl2;H2SO4;AgNO3;
(2)E的浓溶液为浓硫酸,铜与浓硫酸在加热加热条件下反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O,该反应中氧化剂为浓硫酸,还原剂为铜,反应过程中1mol铜完全反应还原了1mol硫酸,所以氧化剂与还原剂的物质的量之比为1:1;B溶液中含有碳酸根离子,通入少量的二氧化硫后,反应的离子方程式为:H2O+2SO2+CO32-=CO2↑+2HSO3-,
故答案为:Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O;1:1;H2O+2SO2+CO32-=CO2↑+2HSO3-;
(3)D可能为Al2(SO4)3或MgSO4,进一步确定D溶液的溶质飞方法为:取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液,
故答案为:取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液.点评:
本题考点: 几组未知物的检验.
考点点评: 本题考查了未知物的检验,题目难度中等,涉及了物质检验、离子方程式书写等知识,注意掌握常见物质的检验方法,能够根据反应现象判断未知物成分,试题培养了学生的分析、理解能力.1年前查看全部
- 二氧化碳作为尾气的处理方法有机无机都可以,要反应方程式,越详细越好,论文需要,复制黏贴也无所谓,集思广益.另外也请介绍下
二氧化碳作为尾气的处理方法
有机无机都可以,要反应方程式,越详细越好,论文需要,复制黏贴也无所谓,集思广益.另外也请介绍下工业上比较经济实用的二氧化碳处理流程,最好是可以废气利用的.
求求各位大虾了,分数不是问题, gyyyyy1年前1
gyyyyy1年前1 -
 moygana 共回答了25个问题
moygana 共回答了25个问题 |采纳率88%NaOH溶液吸收,最终变为小苏打,可回收利用,其它碱性物质也可,但回收不便.也可用生物方法吸收:微藻除以简单分裂方式进行繁殖,细胞生长周期较短,易于大规模培养,只要阳光充足就可以进行大量繁殖的特性外,还能大量吸收CO2.以微藻为原料,既可以生产可再生的生物燃料,又可以吸收石化燃料所释放的CO2.微藻生物柴油作为一种可再生能源,解决传统能源不足问题.最近还说把二氧化碳像核废料一样掩埋……或者直接收集降温加压变为固体,用于人工降雨和灭火器
手打,希望对你有些帮助1年前查看全部
- 非生物的物质和能量 与 无机环境 是不是等同的概念?
非生物的物质和能量 与 无机环境 是不是等同的概念?
如果不是 区别在哪? 黄黎黎1年前4
黄黎黎1年前4 -
 鱼在水中流泪 共回答了20个问题
鱼在水中流泪 共回答了20个问题 |采纳率100%无机环境不仅仅为生物提供了物质能量,还有栖息环境等其他东西1年前查看全部
- 能量在生物群落与无机环境中的流动特点是逐级减少 为什么?
 热带鱼71381年前1
热带鱼71381年前1 -
 yuchan051027 共回答了17个问题
yuchan051027 共回答了17个问题 |采纳率88.2%因为好多能量不能被动物完全吸收,随着动物的粪便,能量流失,还有一部分是呼吸作用消耗的能量
本人在线,欢迎追问1年前查看全部
- 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
1mol该物质含有9个共价键为什么不对

 5523495361年前1
5523495361年前1 -
 fulll 共回答了18个问题
fulll 共回答了18个问题 |采纳率88.9%mol摩尔,物质的量单位,旧称克分子、克原子,是国际单位制7个基本单位之一,表示物质的量,符号为mol.每1摩尔任何物质含有阿伏加德罗常数(约6.02×10^23)个微粒.使用摩尔时基本微粒应予指明,可以是原子、分子、离子及其他粒子,或这些粒子的特定组合体.
共价键应该还要乘以阿伏加德罗常数1年前查看全部
- (2014•仪征市二模)活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品,近几年有关该物质的制
(2014•仪征市二模)活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品,近几年有关该物质的制备成为化工行业研究的热点.某校化学兴趣小组的同学参观了某厂用粗ZnO制备活性ZnO的生产流程,做如下探究.
制备活性氧化锌一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如图: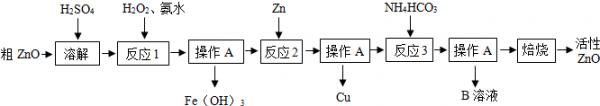
查阅资料:(1)粗ZnO中常含杂质FeO、CuO
(2)反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
(3)已知:几种物质沉淀时的pH如下表:
请问答下列问题:物质 Fe(OH)2 Fe(OH)3 Zn(OH)2 Cu(OH)2 开始沉淀时pH 6.34 1.48 6.2 5.2 完全沉淀时pH 9.7 3.2 8.0 6.4 Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去.
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是______.
(2)写出在粗ZnO样品中加硫酸发生反应的化学方程式______(选写一个).
(3)反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是______.
(4)操作A的名称是______,该过程中使用的玻璃仪器有烧杯、______、______.
(5)反应2中加入锌发生的反应属于______反应(填化学反应的基本类型).
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+的方法为______. Kemissvin1年前1
Kemissvin1年前1 -
 Jim_peng 共回答了18个问题
Jim_peng 共回答了18个问题 |采纳率88.9%解题思路:(1)考虑反应物的接触面积;
(2)考虑ZnO样品与硫酸的反应;
(3)由表格中的数据,推测溶液pH的范围;
(4)操作a是将固体与溶液分离,应采取过滤的方法,过滤所用的主要玻璃仪器有:烧杯、漏斗、玻璃棒;
(5)考虑锌与稀硫酸的反应;
(6)根据氨根与碱反应,生成刺激性气味的气体生成.(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是增大反应物的接触面积或加快溶解速率I制备活性氧化锌.
(2)在粗ZnO样品中加硫酸发生反应的化学方程式 ZnO+H2SO4═ZnSO4+H2O等(写CuO或FeO与硫酸反应也正确);
(3)由表格可知:反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是 3.2到5.2;
(4)操作a是将固体与溶液分离,应采取过滤的方法,过滤所用的主要玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:过滤;烧杯、漏斗、玻璃棒;
(5)反应2中加入锌发生的反应为锌与稀硫酸反应,属于置换反应;
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+的方法为可加入NaOH浓溶液加热,观察现象,如有刺激性气味的气体生成,则说明含有NH4+,
故答案为:
(1)增大反应物的接触面积或加快溶解速率;
(2)ZnO+H2SO4═Zn SO4+H2O等(写CuO或FeO与硫酸反应也正确);
(3)3.2到5.2;(4)过滤;玻璃棒、漏斗;
(5)置换;(6)可加入NaOH浓溶液加热,观察现象,如有刺激性气味的气体生成,则说明含有NH4+点评:
本题考点: 物质的相互转化和制备;酸的化学性质;盐的化学性质;铵态氮肥的检验;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化学计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.1年前查看全部
- 无机推断题X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子.下列叙述中正确的是 (
无机推断题
X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子.下列叙述中正确的是 ( )
A.X元素的最高氧化物对应的水化物是强碱
B.Y元素的最高氧化物对应的水化物的分子式可表示为HYO4
C.电解Y的钠盐溶液可制备Y的单质?
D.Y的单质与H2O反应在同类元素中最剧烈
我觉得选B,为什么? 资深书棍1年前1
资深书棍1年前1 -
 trtrtrtrtr 共回答了21个问题
trtrtrtrtr 共回答了21个问题 |采纳率85.7%由题目可知,X为Mg,Y为F.
选择答案D.
A:元素的最高氧化物对应的水化物是中强碱(或者是弱碱)
B:的氧化性比O还强,不可能形成HFO4
C:能由NaF制备单质F2
D:F能从水中迅速发生不可逆置换出氧气,而其他的则是发生可逆的歧化反应1年前查看全部
- 一道无机化学判断题!已 知 MX 是 难 溶 盐,可 推 知 E ( M2+ / MX ) < E ( M2+ / M+
一道无机化学判断题!
已 知 MX 是 难 溶 盐,可 推 知 E ( M2+ / MX ) < E ( M2+ / M+ ) 悬崖边mm1年前2
悬崖边mm1年前2 -
 诡异123 共回答了16个问题
诡异123 共回答了16个问题 |采纳率93.8%根据能斯特方程
E=E0+0.0592/n*lg(氧化型/还原型)
由於还原型M+受到X-的影响形成沉淀,电对中还原型浓度下降,那麼lg(氧化型/还原型)变大,所以E>E0
你大於小於号反了1年前查看全部
- 能量在生物群落与无机环境中的流动特点是
 炮二平五1年前3
炮二平五1年前3 -
 游宏懿 共回答了15个问题
游宏懿 共回答了15个问题 |采纳率86.7%能量在生物群落与无机环境中的流动特点是:能量是单向流动、逐级递减的.1年前查看全部
- 低沸点的稳定液体沸点只有五六十度左右.而且在高温下稳定不和金属反应的液体.可以是有机或无机液体.
 dhsifhea1年前1
dhsifhea1年前1 -
 refresh508 共回答了22个问题
refresh508 共回答了22个问题 |采纳率100%己烷. 沸点(℃):68.71年前查看全部
- 化学无机框图怎么做啊...
 静心MM1年前1
静心MM1年前1 -
 socfe 共回答了17个问题
socfe 共回答了17个问题 |采纳率76.5%这个就是循环渐近的 一环扣一环的 先把已知的东西写出来 然后根据条件寻找突破口 还有一些隐藏的条件你得知道 所谓的隐藏条件就是题里面没有给出的 我们都知道的 就好比物理中的g=9.81年前查看全部
- 含氨基羧基的有机物与无机酸碱反应么?
含氨基羧基的有机物与无机酸碱反应么?
同时含有羧基和氨基.因为它们分别具有一定酸碱的性质.同时有这两个原子团的有机物会和无机酸碱反应么? 王波1年前1
王波1年前1 -
 wanxinliang 共回答了14个问题
wanxinliang 共回答了14个问题 |采纳率92.9%当然反应,羧基会和碱反应失去质子生成羧基负离子,氨基可以和酸反应得到质子生成季铵离子1年前查看全部
- 无机化学中标定 概念
 90801年前1
90801年前1 -
 蚩尤之魂 共回答了21个问题
蚩尤之魂 共回答了21个问题 |采纳率81%标定就是用已知浓度的试剂去滴定未知浓度的溶液,根据反应式之间的数量关系来计算未知浓度的溶液的浓度.1年前查看全部
- 三氟乙酸属于有机氟化物还是无机氟化物?
 zhengjie10151年前2
zhengjie10151年前2 -
 口阿口我 共回答了17个问题
口阿口我 共回答了17个问题 |采纳率88.2%有机氟化物.
因为 CF3COOH 属于有机物,
可视为乙酸CH3COOH中的3个H被F取代的产物1年前查看全部
- 一道无机化学题!为什么锂的电离能比铯的大,而Li+|Li的电势比Cs+|Cs的小?
 aaaaaa_3331年前2
aaaaaa_3331年前2 -
 灵山信之镇 共回答了14个问题
灵山信之镇 共回答了14个问题 |采纳率100%这个嘛..个人不负责任地稍微解释一下...
Li的电离能比Cs大这是没问题的吧?
然后就是电势问题 首先这种情况在电极电势里是很常见的
电离能是 纯气态下 原子失去一个电子需要的能量 电极电势的测定却是在溶液中 测定的条件不同 是产生这种差异的主要原因
例如Li+ 其极化作用较强 水中会水合成为较稳定的水合离子 要想让整个水合离子变为Li原子消耗的能量肯定与单个Li+的不同 Cs+就没有这种效果(就算有肯定也很弱可忽略) 但是纯气相中就没有这种问题 当然纯气相和溶液的差别可能还有很多
大致就是这样了 可以认为是多了一步气态离子水合的过程1年前查看全部
- 第一种p区元素是硼还是氦做一无机题,说是第一种p区元素是硼,个人感觉不怎么对
 落光流云1年前2
落光流云1年前2 -
 上网的猫A 共回答了20个问题
上网的猫A 共回答了20个问题 |采纳率85%第一种p区元素是硼,氦的电子构型是1S2,不是p区的1年前查看全部
- 是不是比无机难?我们老师说,他就有机化学没学明白才投身文科,所以想询问一下,要是难,就提前点学.
 liuying71年前1
liuying71年前1 -
 橙色啦啦 共回答了17个问题
橙色啦啦 共回答了17个问题 |采纳率82.4%相对来说,有机化学比无机化学难点,不过只要多用心去学,其实挺好学的,对于理综来说,化学应该属于简单的.1年前查看全部
- 什么叫无机环境?是不是有自然的作用呢?
 小rr1年前1
小rr1年前1 -
 guaizhi 共回答了15个问题
guaizhi 共回答了15个问题 |采纳率93.3%生物环境的因子中的非有机环境,即森林中的光、气温、降水 、风等气候因子土壤因子中都是无机性.无机环境是生物生存的基础环境.动物最终依赖植物作为营养来源,植物则依赖阳光、水分、肥料成分等自然资源而生长繁殖1年前查看全部
- 连接生命和无机环境不可缺少的成分是什么
 iamjay3521年前2
iamjay3521年前2 -
 文转工 共回答了22个问题
文转工 共回答了22个问题 |采纳率86.4%生产者是把无机环境的一些元素合成有机物,供消费者利用,没有生产者就没有其他的一切生命,生产者是所有生命的基础,是无机环境到生命的开始,所以生产者时不可或缺的.
分解者,把有机体的尸体、遗物等等物质分解成无机的元素,是返回无机环境,使得物质可以循环,如果没有分解者那么地球上会到处尸体堆积如山,不能进行正常的循环,生命元素就回不了无机环境,所以分解这是不可或缺的.
综上所述,不可或缺的是生产者和分解者1年前查看全部
- 请判断正误 与小麦有关的生态因素有阳光、青蛙、昆虫等.( )生物的环境就是生物周围对生物有影响的无机环境.( )环境中所
请判断正误
与小麦有关的生态因素有阳光、青蛙、昆虫等.( )
生物的环境就是生物周围对生物有影响的无机环境.( )
环境中所有的因素都是生态因素.( ) asdasgd4e1年前6
asdasgd4e1年前6 -
 Emily_lan 共回答了25个问题
Emily_lan 共回答了25个问题 |采纳率92%对 错 错1年前查看全部
- 垃圾可分为有机垃圾、无机垃圾与有害垃圾三类.为了有效保护环境,居委会倡议将日常生活中产生的垃圾分三类投放到相应的垃圾箱里
垃圾可分为有机垃圾、无机垃圾与有害垃圾三类.为了有效保护环境,居委会倡议将日常生活中产生的垃圾分三类投放到相应的垃圾箱里.请你写出必要的过程,完成下列问题:
(1)若小刚把一袋有机垃圾随机投放,恰好能放对的概率是多少?
(2)小刚把三类不同垃圾分装到三个袋中,如果任意投放,三袋都放对的概率是多少? 12222221年前1
12222221年前1 -
 66114605 共回答了14个问题
66114605 共回答了14个问题 |采纳率85.7%本题简答如下:
垃圾箱分为:有机垃圾、无极垃圾和有害垃圾三类,(1)小刚把一袋有机垃圾随机投放,共有三种相等的可能性,其中,恰好放对的概率只有一种,所以,小刚恰好放对的概率为1/3;(2)小刚把三袋不同类的垃圾任意投放,需要画树状图,所有相等的可能性共有27种,其中三袋都放对的概率只有一种,因此其概率为1/27,祝好!1年前查看全部
- 一道大学无机综合化学题,已知某矿石的主要成分是SiO2、MnO2、Fe3O4,请设计方案综合利用该矿石,要求写出相应的操
一道大学无机综合化学题,
已知某矿石的主要成分是SiO2、MnO2、Fe3O4,请设计方案综合利用该矿石,要求写出相应的操作步骤、反应条件和反应方程式等. yjy5111年前3
yjy5111年前3 -
 cpawen 共回答了16个问题
cpawen 共回答了16个问题 |采纳率87.5%1、矿物粉碎
2、磁选法:强磁Fe3O4,弱磁MnO2,无磁SiO2;将三种主成份分开;
3、SiO2:用Na2CO3高温处理制水玻璃
SiO2 + Na2CO3 = Na2SiO3
水浸取就得到水玻璃
4、Fe3O4送冶炼厂直接炼铁:
Fe3O4 + 4CO = 3Fe + 4CO2
5、MnO2用碱处理生产高锰酸钾
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O (电解) = 2KMnO4 + H2 + 2KOH
解决方案不可能是唯一的,仅提供一种.1年前查看全部
- 钠10则镁10则铝10则铁10则铜10则碳10则氮10则硅10则硫10则氯10则最好是无机反应~
 chemf9741年前2
chemf9741年前2 -
 52034NANA 共回答了15个问题
52034NANA 共回答了15个问题 |采纳率86.7%方程式还是自己总结比较好
4Na+O2=2Na2O
2Na+O2=Na2O2
2Na+S=Na2S
2Na+2H2O=2NaOH+H2↑
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
2Na2O2 + 2CO2 ══ 2Na2CO3 + O2
2Na2O2 + 4HCl ══ 4NaCl + 2H2O + O2↑
2Na2O2 + 2H2O ══ 4NaOH +O2↑
2Na2O2 + 2SO3══2Na2SO4 + O2
2Mg+O2=2MgO
3Mg+N2=Mg3N2
Mg+2H2O=Mg(OH)2+H2↑(加热)
Mg+2HCl=MgCl2+H2 ↑
Mg+H2SO4=MgSO4+H2 ↑
2Mg+CO2=2MgO+C
MgO+2H+=Mg2++H2O
MgO+2NH4+=Mg2++2NH3↑+H2O
Mg(OH)2+2H+=Mg2++2H2O
MgCO3+2H+=Mg2++H2O+CO2↑
2Al+3H2SO4(稀)=Al2(SO4)3+3H2↑
2Al2+2NaOH+2H2O=2NaAlO2+3H2↑
Al+3AlO2- +6H2O=4Al(OH)3↓
Al₂O₃+ 2NaOH ==== 2NaAlO₂+ H₂O
NaAlO₂+ CO₂+ 2H₂O ==== Al(OH)₃↓+ NaHCO₃
2Al(OH)₃==高温== Al₂O₃+ 3H₂O
2Al₂O₃==通电== 4Al + 3O₂↑
2Al(OH)3=加热=Al2O3+3H2O
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+3H+=Al3++3H2O
3Fe+2O2=点燃=Fe3O4
CuSO4+Fe===FeSO4+Cu
Fe+H2SO4===FeSO4+H2↑
2 Fe+6H2SO4(浓)===Fe2(SO4)3+3SO2↑+6H2O
3Fe+4H2O(g)===Fe3O4+4H2↑
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe2O3+3CO=2Fe+3CO2(高温)
Fe2O3+3H2=2Fe+3H2O(高温)
2Fe2O3+3C=4Fe+3CO2(气)(高温)
Fe2O3+6HCl=2FeCl3+3H2O
2Cu+O2==2CuO
4Cu+O2==2Cu2O
Cu2(OH)2CO3=加热=2Cu+O2+H2O+CO2
2Cu+4HCl+O2=2CuCl2+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+Cl2=点燃=CuCl2
Cu+2FeCl3=2FeCl2+CuCl2
Cu(OH)2+H2SO4=CuSO4+2H2O
Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O
Cu2++H2S=CuS+2H+
C+O2=CO2
2C+O2=2CO
2CO+O2=2CO2
Fe3O4+CO==高温==3FeO+CO2
H2O+C=高温=CO+H2↑
CO2+C=高温=2CO
CO₂+Ca(OH)₂==CaCO₃↓+H₂O
2NaOH+CO₂==Na₂CO₃+H₂O
CO₂+H₂O=H₂CO₃
CaCO₃+CO₂+H₂O=Ca(HCO3)2
3NO2+H2O4HNO3
N2+O2===2NO
2NO+O2==2NO2
N2O4 ==2NO2
NH₃+ 5O₂= 4NO+ 6H2O
Fe+4HNO3稀==Fe(NO3)3+NO↑+2H2O
3Fe+ 8HNO₃稀=3Fe(NO3)₂+ 2NO+ 4H2O
3Ag+4HNO3稀=3AgNO3+NO+2H2O
Ag+2HNO3(浓)=AgNO3+NO2+H2O
SiO2 + 2C =高温= Si + 2CO ↑
Si + 2OH- + H2O == SiO32- + 2H2↑
SiO32- + CO2 + 2H2O == H4SiO4↓+ CO32-
H4SiO4 ==H2SiO3 + H2O
Na2CO3 + SiO2 =高温= Na2SiO3 + CO2
SiO2 + 2OH- == SiO32- + H2O
Si+O2==(△)SiO2
Si+4HF==SiF4↑+H2 ↑
SiO2 + CaO =(高温) CaSiO3
SiO2 + 2NaOH = Na2SiO3 + H2O
S + O₂==点燃==SO2
3S+ 6KOH ==Δ== 2K₂S +K₂SO₃+ 2H₂O
SO₂+ Cl₂+ 2H₂O ====2Cl- +2H+ + SO₄2-
SO₂+ 2Fe3+ +2H₂O ==== 2Fe2+ + SO₄2- + 4H+
SO₂+ 2OH ==== SO₃2-+ H₂O
3S2- + 2Al3+ + 6H₂O ==== 2Al(OH)₃↓ +3H₂S↑
3SO₂ + 2NO₃- + 2H₂O ==== 3SO₄2- + 2NO↑ + 4H+
2H₂SO₃+O₂==== 2H₂SO₄
5SO₂ + 2MnO₄- + 2H₂O ==== 2Mn2+ + 5SO₄2- + 4H+
2H₂S + SO₂==== 3S↓+ 2H₂O(点燃)
2Na+Cl2=2NaCl
CL2+H2=2HCL
2Fe+3CL2=2FeCL3
Cl2+H2O=HCl+HClO
Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O制漂白粉
Cl2+2FeCl2=2FeCl3
2NaCl+2H2O=(通电) H2↑+Cl2↑+2NaOH
4HCl(浓)+MnO2 =(加热)MnCl2+Cl2↑+2H2O
2HClO=光照=2HCl+O2
2KClO3=(△MnO2催化剂)2KCl+3O2↑1年前查看全部
- 大学化学实验的基本操作有哪些,有机,无机,分析
 臭zz1年前1
臭zz1年前1 -
 牛奶红豆 共回答了20个问题
牛奶红豆 共回答了20个问题 |采纳率80%这可太多了,有机中主要有熔点及沸点的测定,重结晶及过滤,蒸馏,水蒸气蒸馏,减压蒸馏,分馏,萃取,以及制备各种化合物,无机比较简单,主要是对物质性质的鉴定,一些鉴别反应,分析中,化学分析部分主要是滴定还有热分析法,仪器分析部分是对一些仪器的操作,如高效液相色谱,气相色谱,红外紫外分光光度计,核磁,大概就这些了.1年前查看全部
- 有机的 无机的都要
 w0101011年前1
w0101011年前1 -
 amrican 共回答了12个问题
amrican 共回答了12个问题 |采纳率83.3%必修1化学方程式总结
1、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
2、碳酸根离子的检验:CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
4、木炭还原氧化铜:2CuO + C 高温 2Cu + CO2↑
5、铁片与硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu
6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl
7、钠在空气中燃烧:2Na + O2 △ Na2O2
钠与氧气反应:4Na + O2 = 2Na2O
8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑
9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2
10、钠与水反应:2Na + 2H2O = 2NaOH + H2↑
11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑
12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
13、氧化钙与水反应:CaO + H2O = Ca(OH)2
14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O
15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O
16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O
17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4
19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
20、氢氧化铁加热分2Fe(OH)3 △ Fe2O3 + 3H2O↑
21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH3)2SO4
22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O
23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O
24、氢氧化铝加热分2Al(OH)3 △ Al2O3 + 3H2O
25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2
26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3
27、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O
硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑
28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO3
29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O
30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
32、氯气与金属铁反应:2Fe + 3Cl2 点燃 2FeCl3
33、氯气与金属铜反应:Cu + Cl2 点燃 CuCl2
34、氯气与金属钠反应:2Na + Cl2 点燃 2NaCl
35、氯气与水反应:Cl2 + H2O = HCl + HClO
36、次氯酸光照分2HClO 光照 2HCl + O2↑
37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O
38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3
40、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO
41、二氧化硫与水反应:SO2 + H2O ≈ H2SO3
42、氮气与氧气在放电下反应:N2 + O2 放电 2NO
43、一氧化氮与氧气反应:2NO + O2 = 2NO2
44、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO
45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂 2SO3
46、三氧化硫与水反应:SO3 + H2O = H2SO4
47、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑
48、浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2O
49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑
50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑
51、氨水受热分NH3•H2O △ NH3↑ + H2O
52、氨气与氯化氢反应:NH3 + HCl = NH4Cl
53、氯化铵受热分NH4Cl △ NH3↑ + HCl↑
54、碳酸氢氨受热分NH4HCO3 △ NH3↑ + H2O↑ + CO2↑
55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O
56、氨气的实验室制取:2NH4Cl + Ca(OH)2 △ CaCl2 + 2H2O + 2NH3↑
57、氯气与氢气反应:Cl2 + H2 点燃 2HCl
58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O
59、SO2 + CaO = CaSO3
60、SO2 + 2NaOH = Na2SO3 + H2O
61、SO2 + Ca(OH)2 = CaSO3↓ + H2O
62、SO2 + Cl2 + 2H2O = 2HCl + H2SO4
63、SO2 + 2H2S = 3S + 2H2O
64、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O
65、Si + 2F2 = SiF4
66、Si + 2NaOH + H2O = NaSiO3 +2H2↑
67、硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO
(石英沙)(焦碳) (粗硅)
粗硅转变为纯硅:Si(粗) + 2Cl2 △ SiCl4
SiCl4 + 2H2 高温 Si(纯)+ 4HCl1年前查看全部
- 大学无机化学题 电化学部分Fe的元素电势图为 FeO4 2- 1.9V Fe3
大学无机化学题 电化学部分

Fe的元素电势图为 FeO4 2- 1.9V Fe3+ 0.771V Fe2+ -0.414V Fe
(1)问酸性溶液中Fe3+ 能否将过氧化氢 氧化为氧气
已知O2+2H+ +2e =H2O2 &=0.682v
(2)计算下列反应应得平衡常(酸性溶液,298K) Fe(s)+2Fe3+(aq)=3Fe2+(aq)
 linlin78781年前2
linlin78781年前2 -
 xll_1122 共回答了16个问题
xll_1122 共回答了16个问题 |采纳率87.5%(1)能将过氧化氢氧化为氧气
原因如下:
三价铁与过氧化氢的反应,全反应式为:
4Fe3+ + 2H2O2 ----》 4Fe2+ + 2O2 + 4H+
该反应可以分为两个半反应,分别为:
Fe3+ + e- ---》 Fe2+ 依题意,φ = +0.77
O2 + 2H+ + 2e- ---》 H2O2 依题意,φ = +0.682
另有全反应的自由能量G= - vFφ (F为法拉第常数,v为移动电荷数)
自由能量为负时,反应会自发发生
又,全反应 φ的变化为两个半反应的 φ的差
此题中,该差为正数,全反应自由能量为负,反应自发进行.
(2)⊿G=-RTlnK= -vFφ
可得K=exp(-⊿G/RT) = exp(vFφ/RT)
全反応式:Fe + 2Fe3+ ----> 3Fe2+ + H2
半反応式分别为:
Fe3+ + e- ----> Fe2+ φ= +0.771
Fe2+ + H2 ----> Fe + 2H+ φ= -0.414
半反应的上式减下式即得到全反应式.
所以该反应全反应的φ为+0.771-(-0.414)= 1.185
另外,反应中有两个三价铁,每个三价铁对应一个电荷移动,所以电荷移动数为2,即v=2
法拉第常数为F= 96.485 kC/mol
所以K= exp(2 * 96.485 kC/mol * 1000/k * 1.185 V/ (8.3145 J/Kmol * 298 K))
另外,1J = 1CV,
上式可以计算得出K=1.2054 * 10^401年前查看全部
- 无机化学问题(与轨道有关)在形成分子轨道时,原子轨道应达到最大重叠,这才能使体系的能量下降最大,使体系更稳定,这是为什么
无机化学问题(与轨道有关)
在形成分子轨道时,原子轨道应达到最大重叠,这才能使体系的能量下降最大,使体系更稳定,这是为什么?重叠大,能量下降快的原因?
波函数正负代表什么? 还是分手吧1年前1
还是分手吧1年前1 -
 缎带舞鞋 共回答了9个问题
缎带舞鞋 共回答了9个问题 |采纳率100%原子轨道达到最大重叠时,成键最稳定,分子键 电极电势小
也可以用波函数解释 +与+叠加-与-叠加 使波函数振幅增大
-与+叠加 会使波函数振幅减小 而且 重叠部分越大 波函数幅度减小越多
所以分子很稳定
如果在 波函数图像中(Y 角度分布函数)
+区内 Y函数 取正值
-区内 Y函数 取负值1年前查看全部
大家在问
- 1气候变暖可能给我国长江流域带来的影响
- 2光明小学羽毛球队中有4名队员的身高在140~150之间.君君身高170㎝,如果他加入羽毛球队后,
- 3一件衬衣标记220元,如果以9折降价出售,仍可获利10%,求这件衬衣的进价
- 4LINGO疑问,一下这个为什么调不出来呢.
- 5隐函数求导法中,椭圆(x²/16)+(y²/9)=0,两端求导怎么就得(2x/16)+(2yy'/9
- 6增根和检验是此方程无解是不是一个意思啊要详细
- 7英语翻译亲爱的朋友们 我的秋天到了,无法再陪伴你们了,一个完结,一个开始,要么赢一个世界,要么输一个自己.词霸的不要 人
- 8举例说明液体分子间作用力比固体分子间作用力要小
- 9tan2a=三分之一,求tana的值
- 10《浣溪沙》 中被誉为"情致缠绵,音调谐婉,对仗工整,宛如天成“的诗句是什么?
- 113x+4+x=64求X如何得15
- 12这句怎么翻,如何意译呢?Consultation,openness and companionship must be
- 13每一部成功的钢琴音乐作品本身都富有深刻的思想内涵和文化底蕴,充满了想象力和表现力.钢琴家的任务是通过十分娴熟的演奏技融合
- 14不知不觉生活中形成惯性思维了,该怎么克服?
- 15如何克服十大管理定理带来的惯性思维
