原电池中电子流出负极,该电极被还原?这句话不对吗?
 看到你就爱了2022-10-04 11:39:542条回答
看到你就爱了2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 就是过客 共回答了19个问题
就是过客 共回答了19个问题 |采纳率84.2%- 必须不对啊,失去电子是被氧化,就像na失去电子变成na+,成为被氧化
- 1年前
 zhuzhunihao 共回答了1578个问题
zhuzhunihao 共回答了1578个问题 |采纳率- 电子从负极流出,通过导线流到正极,该电极失去电子,是还原剂,被氧化 所以错
- 1年前
相关推荐
- Al-Cu-浓HNO3 形成的原电池谁是负极?
Al-Cu-浓HNO3 形成的原电池谁是负极?
我知道 Al在浓HNO3中发生钝化,由于钝化Al不会接触NO3-而成为原电池负极,即电子不能从氧化膜中出去,同样NO3-在Cu作负极时也不能在Al处得到电子,故不存在电极方程式,而直接是Cu和HNO3反应的方程式
请问我哪里说错了?请各位指出,并教我该怎么看
学生先谢谢了 amylase1年前1
amylase1年前1 -
 dcryf 共回答了22个问题
dcryf 共回答了22个问题 |采纳率100%这里由于铜的活动性小于铝,所以铝做负极,失电子,不过这电子是跑到铜上面才失去的,不会受到钝化的影响,溶液中会出现铝离子!1年前查看全部
- 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是 [ ] ①
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是  [ ]
[ ]①Zn是负极 ②Cu是正极 ③Zn -2e- ==Zn 2+ ④Cu 2+ +2e - == Cu
A.①②
B.①②③
C.②③④
D.①②③④ ffxxqhd1年前1
ffxxqhd1年前1 -
 dey14_c3cr_1ec9 共回答了18个问题
dey14_c3cr_1ec9 共回答了18个问题 |采纳率83.3%B1年前查看全部
- 在物理电路中怎样保持电压稳定?在化学原电池的试验中,老师叫我们测输入电压两端的电压,发现要是我们将输入电压调到2V,那么
在物理电路中怎样保持电压稳定?
在化学原电池的试验中,老师叫我们测输入电压两端的电压,发现要是我们将输入电压调到2V,那么电压表显示的是2.68V.但当我进行第二次实验,再次将输入电压调到2V时,电压表显示的就是2.53V了.
请问怎样才能将输入电压保持不变?
 yyq151年前1
yyq151年前1 -
 兴风 共回答了22个问题
兴风 共回答了22个问题 |采纳率86.4%首先,你的测量仪表是什么样的精度.误差是多少?
其次是你是怎样测的?表笔碰吗?这就有个接触电阻的问题.
再次就是干扰的问题,你测量的环境有没有电磁干扰?
你调电压是2V,真实电压是多少?你是如何确定2V的?
一般的原电池电压是稳定的或变化不大,是你的测量问题.1年前查看全部
- 铁锈的生成过程主要是Fe—C原电池发生吸氧腐蚀的过程:
 失落上海1年前1
失落上海1年前1 -
 biaoge534 共回答了18个问题
biaoge534 共回答了18个问题 |采纳率77.8%钢材,生铁,熟铁都不是纯铁,是铁和碳的合金.在有水和空气的条件下,铁和碳形成原电池,铁充当负极,碳充当正极,吸收氧气,铁被氧化.原电池反应要比单纯的化学腐蚀快很多,所以铁锈的生成过程主要是Fe—C原电池发生吸氧腐蚀的过程.
负极 Fe-2e=Fe2+
正极 2H2O+O2+4e=4OH-1年前查看全部
- 在铜-锌原电池中,理论上应观察到的现象是:铜片上:______锌片上:______.此时原电池的电极反应式是:正极:__
在铜-锌原电池中,理论上应观察到的现象是:铜片上:______锌片上:______.此时原电池的电极反应式是:正极:______负极:______.但在实际实验中,锌片上也有______、表面变黑等现象,其原因是______.
在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率______(选填“要快”、“要慢”、“相等”、“无法确定”),其微观解释是______. 最后一个大佬1年前1
最后一个大佬1年前1 -
 nnbestgame 共回答了15个问题
nnbestgame 共回答了15个问题 |采纳率86.7%解题思路:根据得失电子判断电极反应现象并写出电极反应式;
根据实验现象分析形成此现象的原因;
在相同条件下,通过对比实验,判断含杂质的锌与纯锌哪个反应快,根据同性电荷、异性电荷的关系分析.该原电池中,铜片上,氢离子得电子生成氢气,所以看到的现象是:表面产生大量气泡;锌片上,锌失去电子生成锌离子进入溶液,锌片逐渐溶解,所以看到的现象是:表面无气泡,但锌片逐渐溶解;铜片作正极,锌片作负极,正极上的电极反应式为:2H++2e-=H2↑;负极上的电极反应式为:Zn-2e-=Zn2+;
但在实际实验中,由于锌不纯,混有碳等杂质,锌、碳、稀硫酸构成微小的原电池,且锌、碳混在一起,所以看到锌片上有气泡、表面变黑等现象;
在相同条件下,粗锌比纯锌反应速率快,氢离子在锌片上得电子生成氢气,首先要克服锌离子对它的排斥力,在在铜片上得电子生成氢气,而是通过静电引力,相对叫容易些,所以在相同条件下纯锌比纯锌反应速率快.
故答案为:表面产生大量气泡;表面无气泡,但锌片逐渐溶解;2H++2e-=H2↑;Zn-2e-=Zn2+;气泡;锌不纯,混有碳等杂质,本身在稀硫酸中形成许多微电池;要快;氢离子不需要克服锌离子对它的排斥力到锌片上得电子,而是通过静电引力到铜片上得电子.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的正负极的判断及电极反应式的书写等知识点,写电极反应式时要注意电解质溶液的成分,电解质溶液不同,电极反应式可能不同,如氢氧燃料电池中电解质为酸或碱时,电极反应式就不同.1年前查看全部
- 原电池负极失电子的实质是什么?zn cu 硫酸电池,zn失电子与电解质硫酸有关吗?如果无关为什么Mg Al NaOH电池
原电池负极失电子的实质是什么?
zn cu 硫酸电池,zn失电子与电解质硫酸有关吗?如果无关为什么Mg Al NaOH电池中Al做负极?不明白失电子是与活泼性有关还是电解质有关 阳光无线1年前1
阳光无线1年前1 -
 huaquqq 共回答了23个问题
huaquqq 共回答了23个问题 |采纳率87%看能不能自发的进行氧化还原反应,Zn能与硫酸反应,Al能与氢氧化钠反应.1年前查看全部
- 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池,写出电极反应式.
 hansonleon1年前0
hansonleon1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在理论上不能用于设计成原电池的化学反应是( )
在理论上不能用于设计成原电池的化学反应是( )
A.HCl+NaOH═NaCl+H2O
B.2CH3OH+3O2═2CO2+4H2O
C.4Fe(OH)2+2H2O+O2═4Fe(OH)3
D.2H2+O2═2H2O 我也博客1年前1
我也博客1年前1 -
 gjq62 共回答了20个问题
gjq62 共回答了20个问题 |采纳率85%解题思路:自发的放热的氧化还原反应能设计成原电池,以此来解答.A、属于复分解反应,不是氧化还原反应,不能用于设计原电池,故A正确;
B、属于自发的氧化还原反应,能设计成原电池,故B错误;
C、属于自发的氧化还原反应,能设计成原电池,故C错误;
D、属于自发的氧化还原反应,能设计成原电池,故D错误.
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生设计成原电池的反应具备的条件,可以根据所学知识进行回答,难度不大.1年前查看全部
- 高一必修二化学原电池的练习试题有人设计以pt 和zn为电极材料 埋入人体内作为某种心脏病人的心脏起搏器的能源 它依靠人体
高一必修二化学原电池的练习试题
有人设计以pt 和zn为电极材料 埋入人体内作为某种心脏病人的心脏起搏器的能源 它依靠人体内体液中含有一定浓度的溶解氧 氢离子 锌离子进行工作 请写出两极反应的方程式 狼狼的天1年前4
狼狼的天1年前4 -
 yinbaokang 共回答了20个问题
yinbaokang 共回答了20个问题 |采纳率85%负极:2Zn - 4e- =2Zn2+
正极:4OH- + 4e- = 2H2O + O21年前查看全部
- Cu片碳棒共同组成原电池Cu片碳棒同时进入到稀硫酸中,并连接好闭合回路会形成原电池,阴极和阳极的反应式是什么?总反应方程
Cu片碳棒共同组成原电池
Cu片碳棒同时进入到稀硫酸中,并连接好闭合回路会形成原电池,阴极和阳极的反应式是什么?总反应方程式?
实验证明会发生原电池反应 zljlily1年前1
zljlily1年前1 -
 南kk木棉jewel 共回答了15个问题
南kk木棉jewel 共回答了15个问题 |采纳率80%...
不能发生原电池反应.铜的电极电势比氢高.1年前查看全部
- 11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子________
11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子_________m
11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子_________mol,锌片质量减少_________g。铜片表面析出氢气_________L。 楚辛1年前1
楚辛1年前1 -
 诺木 共回答了22个问题
诺木 共回答了22个问题 |采纳率81.8%导线上通过电子3.01*1022个,为0.05mol,即转移电子0.05mol,锌失去0.05mol电子,Zn-2e=Zn2+,1molZn转移2mol电子,锌片质量减少65gmol-1*0.05mol/2=1.625g,电池反应为Zn+2H+=Zn2++H2(转移2e),生成H2为:22.4Lmol-1*0.05mol/2=0.56L1年前查看全部
- 原电池中两极的质量变化有什么规律?
 djmax8107011年前1
djmax8107011年前1 -
 心心3712 共回答了13个问题
心心3712 共回答了13个问题 |采纳率92.3%原电池中两极的质量变化没有规律,要看具体的反应物和产物.
无论正极还是负极,其质量都可以增加或减少.
如:PbO2 + Pb = 2PbO,这铅蓄电池中的反应;正极质量减少,而负极质量增加;
再如:Zn + Cu(2+) = Zn(2+) + Cu,这是铜锌原电池;正极质量增加,而负极质量减少.1年前查看全部
- 化学原电池电子流动为何只能流经导线而不流经溶液
 MUtd大口马牙1年前4
MUtd大口马牙1年前4 -
 娃哈哈adm 共回答了12个问题
娃哈哈adm 共回答了12个问题 |采纳率100%因为电子是金属内部的,溶液里没有单独的电子.溶液导电是靠离子.
BTW 有一定电压下,电流最走阻力小的线路.如果两条路阻力差大了,就可是看作一条是断路.有金属导体的情况下,当然走金属过.溶液导电比起金属,还是阻力很大的.1年前查看全部
- 为什么原电池可以增快反应速度.为什么镁和铝与氢氧化钠溶液形成的原电池 与铁和铜与浓硝酸形成的原电池 都是不活泼的金属做负
为什么原电池可以增快反应速度.
为什么镁和铝与氢氧化钠溶液形成的原电池 与铁和铜与浓硝酸形成的原电池 都是不活泼的金属做负极? hwspring1年前6
hwspring1年前6 -
 Ncauchy 共回答了24个问题
Ncauchy 共回答了24个问题 |采纳率87.5%1.因为形成闭合回路,两极又存在电势差,这样就加快了电子的得失和运动速度,从而加快化学反应速率
2.因为形成原电池的条件为自发的进行反应且失电子的一极为负极,在这两个反应中活泼金属不能自发进行反应,而不活泼金属可以自发进行且反应中失电子,故不活泼金属做负极.这只是特例,大多数是活泼金属作负极.1年前查看全部
- 原电池中活泼金属做正极还是负极
 JohnnyBeAR1年前1
JohnnyBeAR1年前1 -
 beta113 共回答了22个问题
beta113 共回答了22个问题 |采纳率86.4%一般作负极.但不是绝对的,应该视具体情况而定.如Mg、Al,NaOH溶液组成的原电池中,Al作负极,Mg作正极.
严格应该是这样说:失去电子的一极充当负极.得到电子的一极作正极.1年前查看全部
- 利用反应Zn+2FeCl3=ZnCl2+2FeCl2设计原电池装置.
 利用反应Zn+2FeCl3=ZnCl2+2FeCl2设计原电池装置.
利用反应Zn+2FeCl3=ZnCl2+2FeCl2设计原电池装置.
(1)在框图中画出实验装置图,并指出:
负极材料为______,电极反应式为:______;
正极材料为______,电极反应式为:______;
(2)若反应过程中有0.2mol电子通过,则溶解Zn的质量为______g. 因轮亦舞1年前1
因轮亦舞1年前1 -
 看那女子 共回答了14个问题
看那女子 共回答了14个问题 |采纳率92.9%解题思路:根据反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,以此画出实验装置图并书写有关的电极反应式;
根据反应的电极方程式计算溶解Zn的质量.(1)由反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
电极反应为Zn-2e-=Zn2+,正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,
电极反应式为Fe3++e-=Fe2+,电解质溶液为FeCl3,实验装置图可设计如下: ,
,
故答案为:Zn;Zn-2e-=Zn2+;比Zn不活泼金属或碳;2Fe3++2e-=2Fe2+;
(2)若反应过程中有0.2mol电子通过,则溶解Zn的物质的量为0.1mo,质量为6.5g,故答案为:6.5.点评:
本题考点: 设计原电池.
考点点评: 本题综合考查原电池的设计及原电池的工作原理,为高考常见题型,侧重于学生的分析能力和计算能力的考查,有利于培养学生的良好的科学素养,难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.1年前查看全部
- 电解熔融碳酸盐的产物麻烦问下 电解熔融态的碳酸盐生成什么?阴极是什么 阳极是什么 记住 是 电解池 而非原电池 还有 电
电解熔融碳酸盐的产物
麻烦问下 电解熔融态的碳酸盐生成什么?
阴极是什么 阳极是什么
记住 是 电解池 而非原电池
还有 电子是怎么移动的?
烦劳诸位 stakistaki1年前1
stakistaki1年前1 -
 writer71529 共回答了19个问题
writer71529 共回答了19个问题 |采纳率84.2%产物 相应的阳离子金属 一氧化碳和氧气 阴极 与电源负极相连 阳极与电源正极连接 电子由负极向正极 移动1年前查看全部
- 如果在Fe和C组成的原电池中,N acl溶液为电解质溶液,那么N acl溶液的作用是什么?
 月半女古女良1年前2
月半女古女良1年前2 -
 jiasi9128 共回答了18个问题
jiasi9128 共回答了18个问题 |采纳率88.9%就是起到电解质溶液的作用
以铁为负极,碳棒为正极,NaCl溶液为电解质溶液,则空气中的氧气溶解在电解质溶液中,并在正极放电,则铁在负极放电从而电极反应式为
负极 Fe-2e-=Fe2+
正极O2+4e-+2H20=4OH-1年前查看全部
- 电极与标准氢电极组成的原电池怎样判断正负极?
电极与标准氢电极组成的原电池怎样判断正负极?
是不是在不同的原电池组合中正负极不是一成不变的!也就是说,标准氢电极可以为负极也可以为正极? yiyilinyoyo1年前1
yiyilinyoyo1年前1 -
 joision 共回答了20个问题
joision 共回答了20个问题 |采纳率95%另一个电极的电极电势是负数那麼就是负极,正数就是正极1年前查看全部
- 黄铜为什么不生锈?如果是因为原电池的话青铜为什么有有铜绿生成?
 cowalai1年前1
cowalai1年前1 -
 喜随 共回答了14个问题
喜随 共回答了14个问题 |采纳率100%全都错了,就是因为原电池原理
黄铜主要是由铜和锌所组成的合金,而青铜主要是由铜和锡所组成的合金
锌比铜活泼,根据原电池原理铜不易被氧化
而铜比锡活泼,根据原电池原理铜易被氧化1年前查看全部
- 举一个带盐桥的原电池并写出正极负极的反应方程式和总的
 tangyan111年前1
tangyan111年前1 -
 evsq 共回答了18个问题
evsq 共回答了18个问题 |采纳率100%两个烧杯,一个装硫酸铜,一个装硫酸锌,硫酸铜里插铜棒,硫酸锌里插锌棒,盐桥是硫酸钾,锌棒与铜棒用导线相连!
锌棒为负极,反应式是Zn - 2e- ==== Zn2+
铜棒为正极,反应式为Cu2+ + 2e- ==== Cu
总反应为Zn + Cu2+ ==== Zn2+ + Cu1年前查看全部
- 关于如图所示的原电池,下列说法正确的是( )
关于如图所示的原电池,下列说法正确的是( )

A.锌电极发生还原反应,铜电极发生氧化反应
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.电子从锌电极通过电流计流向铜电极
D.铜电极上发生的电极反应为2H++2e-═H2↑ a2cdetc1年前1
a2cdetc1年前1 -
 站在风中 共回答了19个问题
站在风中 共回答了19个问题 |采纳率78.9%解题思路:该原电池中,Zn易失电子作负极、Cu作正极,正、负极电极反应式分别为Cu2++2e-=Cu、Zn-2e-=Zn2+,电子从负极沿导线流向正极,盐桥中阳离子向正极移动、阴离子向负极移动,据此分析解答.A.锌失电子发生氧化反应,铜电极上得电子发生还原反应,故A错误;
B.锌作负极、铜作正极,则盐桥中阴离子向硫酸锌溶液迁移,故B错误;
C.锌作负极、铜作正极,电子从锌电极通过电流计流向铜电极,故C正确;
D.铜电极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,明确正负极上发生的反应、电子及离子移动方向即可解答,注意电子不能进入电解质溶液,为易错点.1年前查看全部
- Zn.Cu和H2SO4组成的原电池的电极反应式 负极:正极:
 彻底hpl1年前1
彻底hpl1年前1 -
 blueyong 共回答了18个问题
blueyong 共回答了18个问题 |采纳率88.9%2H+ + 2e- =H2 Zn-2e- =Zn2+1年前查看全部
- 原电池里,正负级的氧化还原反应和电解质溶液到底有什么关系啊?
 都察御史1年前2
都察御史1年前2 -
 九九归 共回答了17个问题
九九归 共回答了17个问题 |采纳率94.1%原电池里,负极发生氧化反应,相当于阳极.
正极发生还原反应,相当于阴极.
电解质溶液是否参与反应要看具体是何种离子.有四种情况,分别是阳离子反应、阴离子反应、阴阳离子都反应,阴阳离子都不反应(电解水)1年前查看全部
- 书上有说明,但是我看不懂,(现以铜锌原电池为例来分析原电池的电流是怎样产生的.锌片上和ZnSO4溶液中都存在锌离子.在锌
书上有说明,但是我看不懂,(现以铜锌原电池为例来分析原电池的电流是怎样产生的.锌片上和ZnSO4溶液中都存在锌离子.在锌片和溶液的接触面上,水分子与金属表面的锌离子相互吸引,发生水合作用,使部分锌离子离开锌片进入溶液:Zn→锌离子+2电子.)就是这段话,里面一直都在说的是锌离子,为什么到最后的方程式却是锌原子变成锌离子和两个电子?我觉得可能是锌片表面的锌离子与水发生水合作用后,锌片上的锌原子变成锌离子来补充空缺的位置,
 桃桃淘气1年前3
桃桃淘气1年前3 -
 远方远足 共回答了22个问题
远方远足 共回答了22个问题 |采纳率90.9%锌离子不与水发生反应.首先你要了解这个原电池的方程式,本质就是:
Zn+2H+ → Zn2+ + H2↑
但分步写便会体现电子的转移:
Zn - 2e- → Zn2+
2H+ + 2e- → H2↑
也就是说.电子从锌那一及跑出来,锌变成锌离子,因为金属之间存在可以自由移动的电子(你们以后会学到),所以自由电子沿着金属导线跑到铜那里,水电离出的H+在铜那里得到锌失去的电子,变成氢气.这就是铜极产生了气体而锌极却没有.
如果中间没有导线.铜极不会有气体产生的.
注意:铜极产生气体是实验现象,不是本质.1年前查看全部
- 原电池与置换反应假设在一个稀硫酸溶液中,插入铁片和锌片,两片金属有导线连接,请问一下电流方向,以及氢气会哪产生?铁片和锌
原电池与置换反应
假设在一个稀硫酸溶液中,插入铁片和锌片,两片金属有导线连接,请问一下电流方向,以及氢气会哪产生?铁片和锌片都会和稀硫酸产生置换反应吗?还是只是有一段会变成离子溶入溶液? 日落雨1年前1
日落雨1年前1 -
 13660277804 共回答了20个问题
13660277804 共回答了20个问题 |采纳率90%电流:Fe是正极,Zn是负极;
Fe上产生H2;
Zn变成离子进入溶液.1年前查看全部
- 若某装置中发生如下反应:Cu+2H+=Cu2++H2↑,则该装置为什么不是原电池
 lixiayang1年前3
lixiayang1年前3 -
 gravestone 共回答了24个问题
gravestone 共回答了24个问题 |采纳率91.7%组成原电池的基本条件:
1.将两种活泼性不同的金属(或导电单质)(Pt和石墨为惰性电极,即本身不会得失电子)(一种是相对较活泼金属一种是相对较不活泼金属)
2.用导线连接后插入电解质溶液中,形成闭合回路.
3.要发生自发的氧化还原反应.
这些条件都没有,不是原电池.1年前查看全部
- .原电池产生电流的本质原因是………………………………………………………( ) A.原电池中溶液能电离出
 yjilyfych1年前4
yjilyfych1年前4 -
 bobopp 共回答了21个问题
bobopp 共回答了21个问题 |采纳率100%由于两极金属的活泼性不同,从而导致电势差的形成,电子由低电势移动到高电势自然就产生了电流1年前查看全部
- 求高二电解、原电池方程式的总结就是常用的电解某物质的阴极和阳极分别的离子方程式……,我是想要写出来的,可以拿上背的 ,我
求高二电解、原电池方程式的总结
就是常用的电解某物质的阴极和阳极分别的离子方程式……,
我是想要写出来的,可以拿上背的 ,我在书上找不全常用电解方程式 AmNothing1年前1
AmNothing1年前1 -
 liufenghuixue 共回答了19个问题
liufenghuixue 共回答了19个问题 |采纳率89.5%电解水和精炼铜,还有就是它们的分解式(就是要标明失去多少个电子,电子怎样走的化学式)书上有一个图,是关于电解氯化钠的,记住要背下来,包括氢气在哪边出,钠在哪里出,哪个得电子,哪个失去电子,有水和无水的情况下产物是什么;只要记住这些就差不多得了1年前查看全部
- 原电池中为何会有电子从导线中流过
原电池中为何会有电子从导线中流过
假设是铜锌硫酸原电池,为何氢气不在锌极形成而要通过外电路转移电子到铜极反应,帮下, A型蟹蟹1年前1
A型蟹蟹1年前1 -
 sanfrancasly 共回答了15个问题
sanfrancasly 共回答了15个问题 |采纳率86.7%我是这样理解的,Zn失去了电子变成了正价(电子是负价的),失去的电子聚集就产生一定的电势,回路中,一端有了电势,两端就有电势差,有了电势差,电子就会在回路中运动了.1年前查看全部
- 某原电池总反应的离子方程式为2Fe 3+ +Fe=3Fe 2+ ,可以实现上述反应的原电池是( ) A.正极:Fe负极
某原电池总反应的离子方程式为2Fe 3+ +Fe=3Fe 2+ ,可以实现上述反应的原电池是( ) A.正极:Fe负极:Zn电解质溶液:Fe 2 (SO 4 ) 3 B.正极:Sn负极:Fe电解质溶液:FeCl 2 C.正极:Ag负极:Fe电解质溶液:CuSO 4 D.AB正极:Cu负极:Fe电解质溶液:Fe 2 (SO 4 ) 3  水中漫游1年前1
水中漫游1年前1 -
 人正废第二 共回答了16个问题
人正废第二 共回答了16个问题 |采纳率100%A、锌的活泼性大于铁,锌作负极,铁作正极,电解质溶液为Fe 2 (SO 4 ) 3 溶液,所以是不能实现该反应的原电池,故A错误.
B、铁的活泼性大于Sn,铁作负极,Sn作正极,电解质溶液为FeCl 2 溶液不是含Fe 3+ 的盐溶液,但氯化亚铁和铁不反应,所以不能形成原电池,故B错误.
C、铁的活泼性大于银,铁作负极,银作正极,电解质溶液为CuSO 4 溶液不是含Fe 3+ 的盐溶液,所以是不能实现该反应的原电池,故C错误.
D、铁的活泼性大于铜,铁作负极,铜作正极,电解质溶液为Fe 2 (SO 4 ) 3 溶液,所以是能实现该反应的原电池,故D正确.
故选D.1年前查看全部
- 若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( )
 若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( )
若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( )
A.d溶液是稀硫酸
B.c溶液颜色变蓝
C.b极发生氧化反应
D.a极是铜棒 innia1年前1
innia1年前1 -
 xjf888xjf 共回答了15个问题
xjf888xjf 共回答了15个问题 |采纳率80%解题思路:Zn+H2SO4=ZnSO4+H2↑设计成原电池,根据化合价变化知,负极是锌,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应生成氢气,电子从负极沿大小流向正极,根据图片中电子的流向知,a是原电池负极,b是原电池正极,该原电池中含有盐桥,则c溶液是硫酸锌溶液,d溶液是稀硫酸.Zn+H2SO4=ZnSO4+H2↑设计成原电池,根据化合价变化知,负极是锌,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应生成氢气,电子从负极沿大小流向正极,根据图片中电子的流向知,a是原电池负极,b是原电池正极,该原电池中含有盐桥,则c溶液是硫酸锌溶液,d溶液是稀硫酸.
A.通过以上分析知,d是稀硫酸,故A正确;
B.c溶液是硫酸锌溶液,为无色溶液,故B错误;
C.b是正极,正极上发生还原反应,故C错误;
D.a是锌棒,故D错误;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池原理,明确电子的流向是解本题的关键,再结合电池反应式来分析解答即可,难度不大.1年前查看全部
- Cu能做原电池负极,那为什么Pt不能做负极?
 阿鸭1年前2
阿鸭1年前2 -
 四级受骗者 共回答了17个问题
四级受骗者 共回答了17个问题 |采纳率94.1%原电池的负极要参与电化学反应,要有电子的得失
铜虽然不很活泼,但能得失电子变成正2价铜离子,所以能做负极,比铜不活泼的物质做正极,譬如Pt.
而Pt 非常不活泼,不容易得失电子
所以不能做原电池中的负极
写的有点乱
参考一下1年前查看全部
- 铜银硝酸银原电池电极反应式是什么?
 xiaolan05041年前1
xiaolan05041年前1 -
 Adi10 共回答了13个问题
Adi10 共回答了13个问题 |采纳率92.3%原电池中负极氧化,正极还原,该原电池中负极锌被氧化,方程Zn-2e—=Zn2+,正极则是电解质溶液中银离子被还原,方程Ag++e—=Ag,1年前查看全部
- 如图为某原电池的结构示意图,下列说法正确的是( )
如图为某原电池的结构示意图,下列说法正确的是( )

A.原电池工作时,电子从铜极流向锌极
B.原电池工作时,铜电极上发生氧化反应
C.正极反应为Zn-2e-=Zn2+
D.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应 随风落絮1年前1
随风落絮1年前1 -
 summer5290 共回答了18个问题
summer5290 共回答了18个问题 |采纳率100%解题思路:锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,以此解答.A.锌为负极,铜为正极,电子从负极经外电路流向正极,故A错误;
B.铜为正极,发生还原反应,故B错误;
C.铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,故C错误;
D.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该装置能将化学能转化为电能,说明为放热反应,故D正确.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理和电极方程式的书写,难度不大.1年前查看全部
- 原电池是直接把化学能转化为电能的装置.
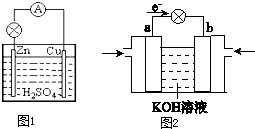 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.
(1)如图1所示:在Cu-Zn原电池中,Zn极发生______反应(填“氧化”或“还原”),写出电极反应式______.Cu极为______极;发生的电极反应为______.
(2)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点.其放电时的电池总反应方程式为:2H2+O2=2H2O.
图2是氢-氧燃料电池的装置图.则:
①溶液中OH-移向______电极(填“a”或“b”).
②b电极周围通入的气体为______,发生的电极反应为:______. scrach_cat1年前1
scrach_cat1年前1 -
 南海山 共回答了19个问题
南海山 共回答了19个问题 |采纳率89.5%解题思路:(1)Cu-Zn原电池中Zn在负极发生氧化反应,Zn失电子生成Zn2+;Cu为正极,正极上氢离子得电子,生成氢气;
(2)原电池中电子从负极流向正极;溶液中阴离子向负极移动;氢-氧燃料电池中氧气在正极上得电子生成氢氧根离子.(1)Cu-Zn原电池中Zn在负极发生氧化反应,Zn失电子生成Zn2+,其电极反应为:Zn-2e-=Zn2+;Cu为正极,正极上氢离子得电子,生成氢气,其电极反应为:2H++2e-=2H2↑;
故答案为:氧化;Zn-2e-=Zn2+;正;2H++2e-=2H2↑;
(2)①原电池中电子从负极流向正极,已知图中电子从a流向b,则a 为负极,b为正极;溶液中阴离子向负极移动,则溶液中OH-移向a,
故答案为:a;
②氢-氧燃料电池中氧气在正极上得电子,即O2在b电极反应生成氢氧根离子,其电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2;O2+2H2O+4e-=4OH-.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理的应用,注意把握导线中电子的移动方向及溶液中离子的移动方向,明确电极方程式的书写方法是解决本题的关键,题目难度中等.1年前查看全部
- 设计一测定水的离子积Kw 的原电池,并写出相应的电极反应和电池反应.计算Kw需要什么数据
 米老鼠爱大米1年前3
米老鼠爱大米1年前3 -
 sadglkjwrlkgrh 共回答了24个问题
sadglkjwrlkgrh 共回答了24个问题 |采纳率91.7%东师学子……1年前查看全部
- 下列有关电化学知识的叙述正确的是( ) A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极
下列有关电化学知识的叙述正确的是( )
A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极 C.电解池中,阳极本身一定不参加反应 D.电解池工作时,阳极上不一定析出物质  幸福村的不幸福哦1年前1
幸福村的不幸福哦1年前1 -
 wang_god 共回答了22个问题
wang_god 共回答了22个问题 |采纳率72.7%BD
原电池中,阴离子移向负极,阳离子移向正极;电解池中,如果阳极是活泼金属,那么阳极就参加反应;电解池工作时,阳极上可能有物质析出,如Cl - 放电生成Cl 2 ,也可能没有物质析出。1年前查看全部
- 将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H
将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H2S04恰好反应完全.
(1)该原电池的负极反应式为______
(2)原稀硫酸的物质的量浓度是______mol•L-1
(3)列式计算锌片减少的质量. ttQWERss1年前1
ttQWERss1年前1 -
 轩辕行素311 共回答了12个问题
轩辕行素311 共回答了12个问题 |采纳率100%解题思路:(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,写出相应的电极反应式.
(2)锌和稀硫酸反应生成氢气,根据氢气体积和硫酸的关系式计算硫酸的物质的量浓度.
(3)根据锌和氢气之间的关系式计算锌减少的质量.(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,正极上氢离子得电子生成氢气,所以负极上的电极反应式为:Zn-2e-=Zn2+,电池反应式为:Zn+2H+=Zn2++H2↑.
故答案为:Zn-2e-=Zn2+.
(2)设硫酸的物质的量浓度是C.
Zn+H2SO4=ZnSO4+H2↑
1mol22.4L
0.25Cmol 6.72L
C=1.2mol/L.
故答案为:1.2.
(3)设锌减少的质量为m.
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
m6.72L
m=19.5g
故答案为:19.5g.点评:
本题考点: 原电池和电解池的工作原理;氧化还原反应的计算.
考点点评: 本题考查了电极反应式的书写及物质的量的有关计算,难度不大,根据物质的物质的量之间的关系式来解答即可.1年前查看全部
- 如下图所示的原电池,一段时间后某极析出1.28克的固体.求:
如下图所示的原电池,一段时间后某极析出1.28克的固体.求:
上述过程中共需转移电子 mol.锌片的质量_______(填”增加”或”减少”)____克

 轻弹流年1年前2
轻弹流年1年前2 -
 等待世界末日 共回答了10个问题
等待世界末日 共回答了10个问题 |采纳率90%这个原电池锌是负极,所以质量会减少,(锌失电子,成为锌离子,跑到溶液里了).而铜离子得电子,成为铜单质 所以析出的就是铜单质 物质的量为0.02moi 因为铜和锌都是二价金属,所以锌减少0.02mol锌的物质的量是65吧貌似 知道物质的量求质量不是很好求吗 那个转移电子数是0.04mol 因为1mol二价金属对应2mol电子.1年前查看全部
- 麻烦化学原电池一张学的好的人进来 帮我解决2个问题
麻烦化学原电池一张学的好的人进来 帮我解决2个问题
1 钢铁的 析氢腐蚀 和 吸氧腐蚀 原电池反应(总反应)相同吗?是怎么写的
2 原电池一张好多反应式不知道怎么写的 如镁 铝放入氢氧化钠中反应电极式不知道怎么回事的 写不来配不来平.诸如此类很多 怎么弄? 从角落看世界1年前2
从角落看世界1年前2 -
 tomychen10 共回答了17个问题
tomychen10 共回答了17个问题 |采纳率76.5%1.不一样啊,析氢是析出氢气,一般是酸性环境;吸氧是吸收氧气,一般在弱酸、中性、碱性环境
析氢:Fe + 2H+=Fe2+ + H2
吸氧:2Fe + O2 + 2H2O = 2Fe(OH)2
后续反应:4Fe(OH)2 + O2 + 2H2O =4Fe(OH)3
2.原电池是一个自发的氧还反应,所以关键是看会不会反应
比如镁铝放入氢氧化钠,主要是铝会与之反应生成偏铝酸根,而镁就是充当了一个导体的作用 这类东西,一般先写总反应,就是铝和氢氧化钠生成偏铝酸根的反应,这都是氧还反应,很好配平的 然后写那个明显的,比如这里写铝失电子(因为化合价升高被氧化啊)生成偏铝酸根的负极反应,剩下的用总反应式去减就行了(把两个式子中的铝系数变一致,以便于消去)
原电池是跟两级材料的电势差有关系的
应该没错吧1年前查看全部
- 原电池中如何比较金属活动性强弱
 小媚儿1年前1
小媚儿1年前1 -
 上树的pig 共回答了15个问题
上树的pig 共回答了15个问题 |采纳率80%1、原电池中,作为正负极的选择
负极反应:失去电子,金属越活泼,越容易失去电子,作为负极
正极反应:得到电子.
所以,金属活动性越强,越容易失去电子,作为负极.
2、金属电极与氢电极组成电池
金属离子/金属电极,与H+/H2组成电池的二极,若金属活动性强于H2的,与氢电级组成电池时,作为负极,电极电势为负值.
金属活动性弱于H2的,作为电池正极,电极电势为正值.1年前查看全部
- 原电池中如何判断电解质有没有参与反应 如:C-Zn 原电池 电解质为HCl 那么:Zn-2e=Zn 2+ H+ +2e=
原电池中如何判断电解质有没有参与反应 如:C-Zn 原电池 电解质为HCl 那么:Zn-2e=Zn 2+ H+ +2e=H2 这个中
 无功不返1年前3
无功不返1年前3 -
 yishiwenrou 共回答了22个问题
yishiwenrou 共回答了22个问题 |采纳率86.4%得失电子后的离子如果和电解质反应,那就是反应
例如这个电解质如果是NaOH,那生成的Zn 2+会和OH-反应1年前查看全部
- 高一化学两道选择题 只要答案下列物质属电解质的是 A胆矾B二氧化碳C新制的氯水D石墨 在铜-锌原电池中,锌片为A正极B负
高一化学两道选择题 只要答案
下列物质属电解质的是 A胆矾B二氧化碳C新制的氯水D石墨 在铜-锌原电池中,锌片为A正极B负极C阴极D阳极 yhq102251年前4
yhq102251年前4 -
 5201979100 共回答了15个问题
5201979100 共回答了15个问题 |采纳率93.3%下列物质属电解质的是 A胆矾B二氧化碳C新制的氯水D石墨(答案是A)
在铜-锌原电池中,锌片为A正极B负极C阴极D阳极(答案是B)补充:请问电极有阴阳极之分吗?哪个ZHU选C!1年前查看全部
- 一个有关原电池和电解池的问题如何根据离子方程式来判断是电解池还是原电池.例如Cu+2H+=Cu2+ +H2,是电解池还是
一个有关原电池和电解池的问题
如何根据离子方程式来判断是电解池还是原电池.
例如Cu+2H+=Cu2+ +H2,是电解池还是原电池? huangpulaohua1年前4
huangpulaohua1年前4 -
 蒸发空气 共回答了17个问题
蒸发空气 共回答了17个问题 |采纳率82.4%电解池.
原电池中发生的反应一定都是自发的,而Cu不能和H+自发进行反应,所以一定要通过电解才能进行.1年前查看全部
- 在标准状态下,用下列电对组成原电池,写出电池符号,电极反应和电池反应 AsO4^3-/AsO3^3-和I2/I-
在标准状态下,用下列电对组成原电池,写出电池符号,电极反应和电池反应 AsO4^3-/AsO3^3-和I2/I-
CO2/C2O4^2-和MnO4-/Mn2- -相忘于江湖-1年前2
-相忘于江湖-1年前2 -
 幻想一百 共回答了25个问题
幻想一百 共回答了25个问题 |采纳率88%写出电池符号,Pt| I2| I- || AsO4 3-| AsO3 3- |Pt
电极反应
正极:AsO4 3- + 2e +2H+ =AsO3 3- +H2O
负极:2I- - 2e = I2
电池反应
AsO4 3- + I- + 2H+ = AsO3 3- + I2 + H2O
电池符号,Pt| MnO4-|Mn2+ || CO2|C2O4 2- |Pt
电极反应
正极:MnO4- +5e+8H+ = Mn2+ +4H2O
负极:C2O4 2- -2e = 2CO2
电池反应
2MnO4- +5C2O4 2- +16 H+ =2Mn2+ +10CO2 + 8H2O1年前查看全部
- 判断原电池的正负极和正负极的化学方程式书写
判断原电池的正负极和正负极的化学方程式书写
正负极是单质的话会判断可是要是化合物和单质要怎么办?还有关于正极的反应方程式,对于碱性和中性O2+2H2O+4e=4OH- 酸性的是O2+4H+4e=2H2O 是不是所有原电池的正极反应都是其中一个,要是不是的话怎么判断?求 xyz_12341年前1
xyz_12341年前1 -
 寄悠采菊 共回答了22个问题
寄悠采菊 共回答了22个问题 |采纳率95.5%比如Fe+CuSO4=Cu+FeSO4这个构成的原电池怎么写(⊙o⊙)?找失电子的元素,得电子的元素,分开写就行.
负极:Fe - 2e- =Fe2+
正极:Cu2+ +2e- = Cu
你说的那个还是一样的,跟氧化还原反应差不多,找到氧化剂还原剂和其所对应的产物,再分开写就行,只不过如果氧化剂中只有一种元素变价,它又可以拆成离子的形式,(就像我举的例里面的硫酸铜样.),就写成离子赛.
另外一个就是结合环境了,你要注意你的产物能不能与你的环境共存,会不会发生反应?1年前查看全部
- 锌铜原电池取下盐桥后会怎样?锌铜原电池取下盐桥后,会使得锌半电池变正,铜半变副,那么为什么此时反应停止,而不是电子从铜半
锌铜原电池取下盐桥后会怎样?
锌铜原电池取下盐桥后,会使得锌半电池变正,铜半变副,那么为什么此时反应停止,而不是电子从铜半流向流向锌半,达到平衡后,再从锌半流向铜半,从而形成交变电流? shasha_hit20001年前1
shasha_hit20001年前1 -
 firefoxfire 共回答了17个问题
firefoxfire 共回答了17个问题 |采纳率88.2%(原)电池导电的基本要求:电极、外回路、电解质溶液中离子的迁移.
取下盐桥后,离子无法迁移,就无法形成导电回路.1年前查看全部
- 一道原电池的计算题(写出详细过程)
一道原电池的计算题(写出详细过程)
现取等质量的锌片和铜片,选不同的电解质溶液组成原电池.
以硫酸铜溶液为电解质溶液组成Zn-Cu-CuSO4原电池,工作一段时间后,当电池两极的质量差为12.9g时,求从电池中流出的电子的物质的量. 漫山的杜鹃1年前1
漫山的杜鹃1年前1 -
 福王QQ 共回答了21个问题
福王QQ 共回答了21个问题 |采纳率95.2%Zn+CuSO4=ZnSO4+Cu 两极的质量差
65 64 129
6.5 6.4 12.9
Zn - 2e- = Zn2+
65g 2mol
6.5g 0.2mol
所以转移的电子为 0.2mol1年前查看全部
大家在问
- 1填声动词.比如:哗哗读书声( ),念经声( ),称赞声( ),心跳声( ).急用!
- 2一定值电阻与一可变电阻并联,且考虑电源内阻,如何求定值电阻的最大功率?
- 3被减数、减数、差的和是240.减数是差的2倍,差是多少?
- 4被减数、减数和差三者的和是240,被减数是______.
- 5一个长方体的长与宽的比是2:1,高与长的比是4:5,已知棱长总和是184分米,求长方体的体积?
- 61,测得一块电板3次,332mm.338mm.335mm.求它的分度值,和实际值,如果用dm的刻度尺测是多少?2,小敏在
- 7一个长方体的棱长总和是120厘米,长、宽、高的比是5:3:2,这个长方体长______厘米,宽______厘米,高___
- 8x平方-2倍根号3x=2=0 怎么解.速度回答各种谢,木马~
- 9当均匀变化的电流方向改变时,产生的磁场方向也变了,为什么还是稳定的磁场
- 10哈代温伯格定律是如何得到的?
- 11从李白的《望天门山》你会想到王之涣的那首诗?
- 12愿为你画地为牢、英语怎么说
- 13高中化学关于物质分类的概念问题...共价化合物共价单质…由分子组成由原子组成- -
- 14十个苹果,小明吃了一个,请问太阳的质量是多少?
- 15现有大小油瓶共50个,每个大瓶可装油4千克,每个小瓶可装油2千克,大瓶比小瓶共多装20千克,问大瓶%B
