甲种矿石含铁54%,乙种矿石含铁36%,将两种矿石若干吨进行混合得到含铁48%的矿石,如果混合时甲种矿石比原来少取12吨
 caibinbupt2022-10-04 11:39:544条回答
caibinbupt2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 GONGSHUYUAN 共回答了16个问题
GONGSHUYUAN 共回答了16个问题 |采纳率93.8%- 解题思路:设原来混合时,甲种矿石x吨,乙种矿石y吨,第二次混合时甲变为(x-12),乙变为(y+10),根据每次混合时含铁混合前后是一样的,可得到方程组从而得解.
设来混合时,甲种矿石x吨,乙种矿石y吨,
根据题意得:
54%x+36%y=48%(x+y)
54%(x−12)+36%(y+10)=45%(x−12+y+10),
解得:
x=44
y=22,
则原来混合时甲有44吨,乙有22吨.点评:
本题考点: 二元一次方程组的应用.
考点点评: 本题考查理解题意能力,类似溶液问题无论怎么混合里面的溶质不变,这里矿石力的含铁量混合前后不变作为等量关系,列方程求解. - 1年前
 qhyi3230 共回答了2个问题
qhyi3230 共回答了2个问题 |采纳率- 甲为44吨,乙为22吨。
- 1年前
 去那里看看 共回答了11个问题
去那里看看 共回答了11个问题 |采纳率- 设甲乙分别为x,y
所以甲含铁 54%*x
乙含铁 36%*y
(54%x+36%*y)/(x+y)=48%(x+y)
[54%(x-12)+36%(y+10)]/(x+y-12+10)=45%(x+y-12+10)
联立方程可解得 x y - 1年前
 lily22800328 共回答了2个问题
lily22800328 共回答了2个问题 |采纳率- 设第一次取甲x吨,乙y吨
列方程:54%x+36%y=48%(x+y)
54%(x-12)+36%(y-10)=45%(x=y-22)
解方程得x=4,y=2
所以原来取甲4吨,乙2吨 - 1年前
相关推荐
- 砖瓦用页岩就是煤矸石吗?热卡在2000左右的矿石会是页岩吗?
砖瓦用页岩就是煤矸石吗?热卡在2000左右的矿石会是页岩吗?
矿区露天开挖点矿石为黑色石块 3712375971年前1
3712375971年前1 -
 弓虽哥1982 共回答了16个问题
弓虽哥1982 共回答了16个问题 |采纳率100%煤矸石是采煤过程和洗煤过程中排放的固体废物,是一种在成煤过程中与煤层伴生的一种含碳量较低、比煤坚硬的黑灰色岩石.包括巷道掘进过程中的掘进矸石、采掘过程中从顶板、底板及夹层里采出的矸石以及洗煤过程中挑出的...1年前查看全部
- 氧化亚铜(Cu2O)是不溶于水的碱性氧化物,能溶于酸发生自身氧化还原反应生成单质铜和Cu2+.测定一种含氧化亚铜的矿石中
氧化亚铜(Cu2O)是不溶于水的碱性氧化物,能溶于酸发生自身氧化还原反应生成单质铜和Cu2+.测定一种含氧化亚铜的矿石中氧化亚铜的含量的方法是:将矿石溶于足量的硫酸铁和硫酸的混合液中,然后用高锰酸钾溶液滴定,反应后锰元素以+2价形式存在.
(1)写出配平的化学反应方程式.
①Cu2O与Fe2(SO4)3、H2SO4反应为____________________________.
②滴加高锰酸钾溶液时发生的反应为_____________________________.
(2)Cu2O与上述两反应中氧化剂的氧化性强弱顺序是_____________________.
(3)若某次测定中称取5.0g矿样,用高锰酸钾溶液滴定时,消耗0.1mol·L-1KMnO4的体积为100mL,则矿样中氧化亚铜的质量分数为______________.
说一下方程式是怎么算出来的 小溪里的泥鳅1年前1
小溪里的泥鳅1年前1 -
 wobuhuiwugong 共回答了13个问题
wobuhuiwugong 共回答了13个问题 |采纳率84.6%1.
仔细读题目提示,方程实际上是分两步进行的:
首先是Cu2O在酸中的歧化:Cu2O + H2SO4 = CuSO4 + Cu + H2O
生成的Cu再被Fe2(SO4)3溶Cu + Fe2(SO4)3 = CuSO4 + 2FeSO4
综合起来就是总反应:Cu2O + H2SO4 + Fe2(SO4)3 = 2CuSO4 + 2FeSO4 + H2O
可以看成是Cu2O为还原剂、Fe2(SO4)3为氧化剂的氧化还原反应
高锰酸钾可以与生成的FeSO4反应,这是普通的氧化还原反应,根据题中提示Mn被还原成+2价,由此写出方程式:2KMnO4 + 10FeSO4 + 8H2SO4 = K2SO4 + 2MnSO4 + 5Fe2(SO4)3 + 8H2O
2.
氧化性显然是 KMnO4 > Fe2(SO4)3 > Cu2O
3.
根据上述方程式得出 1mol Cu2O~0.4mol KMnO4
可得样品中Cu2O共计0.025mol,3.6g,含量72%1年前查看全部
- 自然界有一种含镁矿石,其化学式是xMgCO3·yMg(OH?/
 sd2141年前2
sd2141年前2 -
 riiwtapkk 共回答了12个问题
riiwtapkk 共回答了12个问题 |采纳率83.3%假设两份质量相等均是A 克
xMgCO3·yMg(OH)2分解产生的气体是CO2,反应式:
xMgCO3·yMg(OH)2+2(x+y)HCl=(x+y)MgCl2+(x+y)H2O +XCO2↑
84x+58Y 44x
Ag 8.8 g
所以(84x+58Y)/44X=A/8.8 .①
xMgCO3·yMg(OH)2 =△=(x+y)MgO +y H2O + xCO2↑
84x+58y 40 (x+y)
Ag 10g
所以(84x+58y)/40(x+y)=A/10 .②
由①和②得到x:y=4:1
x、y为最小正整数比,因此x=4,y=1
所以化学式为:4MgCO3·Mg(OH)21年前查看全部
- 一辆卡车运矿石,晴天运16次,雨天运11次,这辆卡车运了195天,平均每天运13次.雨天有几天
 抽号1年前3
抽号1年前3 -
 斌天雪地 共回答了19个问题
斌天雪地 共回答了19个问题 |采纳率89.5%一共195/13=15天
假设全是晴天
可运16*15=240次
多了240-195=45个
有雨天45/(16-11)=9天
晴天15-9=6天1年前查看全部
- 有一位同学调节好托盘天平侧一块矿石的质量,操作时错把矿石放在了右盘中,在左盘中……
有一位同学调节好托盘天平侧一块矿石的质量,操作时错把矿石放在了右盘中,在左盘中……
有一位同学调节好托盘天平侧一块矿石的质量,操作时错把矿石放在了右盘中,在左盘中放入100g砝码一只,20g砝码2只,再移动游码至4g处恰好平衡,那么这块矿石的质量是
分别是148g,144g,140g,136g. 天炎宝宝1年前1
天炎宝宝1年前1 -
 wcj3713865 共回答了13个问题
wcj3713865 共回答了13个问题 |采纳率100%左盘=右盘+游码
现在左盘=100+20+20=140g
游码=4g
那么右盘=左盘-游码=140-4=136g
所以右盘中矿石质量为136g1年前查看全部
- 关于金属铁、铜,下列说法中:①自然界中均有游离态单质存在②炼铁的矿石主要有赤铁矿、磁铁矿、硫铁矿
关于金属铁、铜,下列说法中:①自然界中均有游离态单质存在②炼铁的矿石主要有赤铁矿、磁铁矿、硫铁矿
③工业炼铁的主要设备是沸腾炉④炼铁中所用还原剂是CO⑤生铁、钢、黄铜都属于合金⑥铁的颜色是银白色,铜显紫红色⑦铜常温下可溶于稀硝酸,
上述说法正确的是( )
A①④⑤⑥⑦
B②④⑥
C③④⑥⑦
D全部
求详解.谢谢.
 只讲标准普通话1年前1
只讲标准普通话1年前1 -
 eeeliu 共回答了21个问题
eeeliu 共回答了21个问题 |采纳率85.7%错误.Fe、Cu都没有游离态.正确.赤铁矿Fe2O3,磁铁矿Fe3O4,硫铁矿FeS2错误.沸腾炉主要应用于接触法制硫酸,作为FeS2制SO2的发生装置正确.Fe2O3 + 3 CO ==高温== 2 Fe + 3 CO2
正确.生铁、钢、黄铜分别属于铁合金、铁合金、铜合金.错误.纯铁是银白色,铁粉是黑色.以偏概全.正确.3 Cu + 8 HNO3(稀) = 3 Cu(NO3)2 + 2 NO↑+ 4 H2O
不知道选哪个.你看着办吧1年前查看全部
- 铁的含量换算如果知道FE2O3在矿石中的比例(56%),是否可以推论出TFE含量也是56%呢?
 止水2321年前1
止水2321年前1 -
 bm_qiuyan 共回答了23个问题
bm_qiuyan 共回答了23个问题 |采纳率87%全铁(摩尔质量55.845g/mol)的含量是
56%*55.845*2/160=39.09%
三氧化二铁的摩尔质量是160g/mol
2是三氧化二铁中的两个铁原子1年前查看全部
- (2010•无锡二模)小王用天平和量筒测量矿石的密度,做了如下一些实验步骤:
(2010•无锡二模)小王用天平和量筒测量矿石的密度,做了如下一些实验步骤:
①用调节好的天平测出矿石的质量m;
②向量筒中倒进适量的水,测出这些水的体积V1;
③根据密度的公式,求出矿石的密度ρ;
④将矿石浸没在置筒内的水中,测出矿石和水的总体积V2.
(1)他应采用的正确的实验步骤顺序为______
A.①②③④; B.①②④③; C.②③①④; D.②③④①
(2)由图可知,矿石的质量为______g,矿石的体积为______cm3.矿石的密度为______kg/m3.
(3)小王测出矿石密度后,想用图中的器材照此方法测出家中一枚戒子的密度,检验戒子是不是纯金的.已知戒子的质量约为5g,ρ金=19.3×103kg/m3,他能检验得出来吗?______;为什么?______. tmmjzetac1年前1
tmmjzetac1年前1 -
 lysuu888 共回答了19个问题
lysuu888 共回答了19个问题 |采纳率94.7%解题思路:(1)实验的正确顺序应是先测质量,再测体积,最后计算;
(2)读取天平的示数应将砝码的质量与游码的示数相加,量筒中两次的体积差就是矿石的体积,用密度的公式进行计算;
(3)可能过公式进行初步计算,估算戒子的体积,若太小则无法通过量筒得出它的体积.(1)实验中应先测矿石的质量,再测矿石的体积,最后进行计算,因此,选项B是正确的;
(2)矿石的质量=20g+5g+2.2g=27.2g,矿石的体积=40ml-30ml=10ml,矿石的密度ρ=[m/V]=[27.2g
10cm3=27.2×103kg/m3;
(3)戒子的体积V=
m/ρ]=
5g
19.3g/cm3≈0.26cm3,体积小于量筒最小分度值,无法测量,当然也就无法检验其是不是纯金的了.
故答案为:(1)B;(2)27.2,10,2.72×103;
③不能;体积小于量筒最小分度值,无法测量.点评:
本题考点: 固体的密度测量实验.
考点点评: 此题中主要对测固体密度的实验步骤、天平、量筒的读数、密度公式的灵活运动进行了考查,这都是我们应该掌握的重要知识点.1年前查看全部
- 某磁铁矿矿石四氧化三铁500吨,经测得含铁217.3吨,求该铁矿石中含有四氧化三铁的质量分数
 会计小生1年前1
会计小生1年前1 -
 看云在奔跑 共回答了14个问题
看云在奔跑 共回答了14个问题 |采纳率100%FE3O4
168/232*X=217.3
X=300T
300/500%100%=60%
答:该铁矿石中含有四氧化三铁的质量分数是60%1年前查看全部
- (2001•吉林)测定矿石密度的实验中,用天平测出矿石的质量为90g,用量筒测矿石的体积,如图所示,矿石体积为_____
 (2001•吉林)测定矿石密度的实验中,用天平测出矿石的质量为90g,用量筒测矿石的体积,如图所示,矿石体积为______cm3,并计算出矿石的密度为______.
(2001•吉林)测定矿石密度的实验中,用天平测出矿石的质量为90g,用量筒测矿石的体积,如图所示,矿石体积为______cm3,并计算出矿石的密度为______.  西电浪人1年前0
西电浪人1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某矿石铝含量17%,硅含量57%,请问是何矿物,有何用途?
 power_2111年前1
power_2111年前1 -
 zhangjin268 共回答了15个问题
zhangjin268 共回答了15个问题 |采纳率66.7%由硅含量57%,铝含量17%,可以推知该硅酸铝矿的化学式大体为Na2O·Al2O3·6SiO2或者NaAlSi3O8,该物质天然矿石叫做钠长石
钠长石是长石的一种,是常见的长石矿物,为钠的铝硅酸盐(NaAlSi3O8).钠长石一般为玻璃状晶体,可以是无色的,也可以有白、黄、红、绿或黑色.它是制造玻璃和陶瓷的原料.很多岩石中都有钠长石的成分,人们称这样的矿物为造岩矿物.钠长石主要用于制造陶瓷、肥皂、瓷砖、地板砖、玻璃、磨料磨具等,在陶瓷上主要用于釉料.1年前查看全部
- 有一块20m3的矿石,为了测出它的质量,从它上面取10cm3样品,测得样品的质量为26g,根据以上数据求出矿石的密度和质
有一块20m3的矿石,为了测出它的质量,从它上面取10cm3样品,测得样品的质量为26g,根据以上数据求出矿石的密度和质量?
 wanhuier1年前0
wanhuier1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有一块20m3的矿石,为了测出它的质量,从它上面取10cm3样品,测得样品的质量为26g,根据以上数据求出矿石的密度和质
有一块20m3的矿石,为了测出它的质量,从它上面取10cm3样品,测得样品的质量为26g,根据以上数据求出矿石的密度和质量?
 梦唤霞785次1年前0
梦唤霞785次1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 现有天平、量筒和足量的水,要求设计一个测量小矿石密度的实验
现有天平、量筒和足量的水,要求设计一个测量小矿石密度的实验
实验原理:
小矿石密度的表达式: isabelgan1年前2
isabelgan1年前2 -
 吾为锋狂 共回答了18个问题
吾为锋狂 共回答了18个问题 |采纳率88.9%实验原理:密度等于质量除以体积.
主要步骤:
1.用天平称出小矿石的质量 m,
2.在量筒中装上一定量的水,读出示数 v1,
3.将小矿石用细线系着慢慢浸没在水中,读出此时量筒的示数 v2,
4.算出小矿石的密度为 m/(v2-v1).
小矿石密度的表达式:p=m/(v2-v1).1年前查看全部
- 硫化原矿石加入药剂反应过程硫化原矿石加入丁基钠黄药,乙基钠黄药,25#黑药,乙硫氮,乙铵黑药,硫酸铜,硫酸锌,松醇油,纯
硫化原矿石加入药剂反应过程
硫化原矿石加入丁基钠黄药,乙基钠黄药,25#黑药,乙硫氮,乙铵黑药,硫酸铜,硫酸锌,松醇油,纯碱.最后生成镍与其他什么物质.
那剩下的物质分别是什么,需要加入那些物质达到国家标准 tomgao1年前1
tomgao1年前1 -
 成熟的香蕉 共回答了19个问题
成熟的香蕉 共回答了19个问题 |采纳率84.2%硫化原矿石加入丁基钠黄药,乙基钠黄药,25#黑药,乙硫氮,乙铵黑药,硫酸铜,硫酸锌,松醇油,纯碱.1年前查看全部
- (2014•揭阳)在测矿石密度时,选用了天平、量筒、小矿石、细线、烧杯和水等器材进行实验:
 (2014•揭阳)在测矿石密度时,选用了天平、量筒、小矿石、细线、烧杯和水等器材进行实验:
(2014•揭阳)在测矿石密度时,选用了天平、量筒、小矿石、细线、烧杯和水等器材进行实验:
(1)在调节天平时,发现指针位置如图甲所示,此时应将平衡螺母向______调(选填“左”或“右”).
(2)用调节好的天平秤小矿石的质量.天平平衡时,放在右盘中的砝码和游码的位置如图乙所示,则被测物体的质量是______g;量筒量出小矿石的体积如图丙所示,体积为______cm3,则小矿石的密度ρ=______kg/m3. c4diy1年前0
c4diy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 经过一个半衰期,放射性元素矿石的质量为什么大于原来矿石质量的一般?
经过一个半衰期,放射性元素矿石的质量为什么大于原来矿石质量的一般?
不是半衰期质量会减半的吗? kkxx771年前1
kkxx771年前1 -
 见信如晤 共回答了20个问题
见信如晤 共回答了20个问题 |采纳率90%经过一个半衰期,矿石中包含 放射性元素以及 它的衰变产物.
如果 衰变子核的质量 大于 衰变母核的质量,那么衰变以后,放射性元素的质量含量虽然减少了,但衰变产物的质量含量却增加了,矿石的总质量就会增加.
如果 衰变子核的质量 小于 衰变母核的质量,那么情况与上述相反.
到底 衰变子核的质量 大于还是小于 衰变母核的质量?这是不一定的.决定于具体的衰变是怎样的.
经过一个半衰期,矿石的质量是增加还是减少,也不是普遍一样的.有的矿石衰变后质量增加,有的则减少.
要知道 你所说的矿石质量是增加还是减少,必须先知道那矿石的成分.然后找到相关的衰变方程.1年前查看全部
- 某钢铁厂检验员为了检测赤铁矿中氧化铁的质量分数,取矿石样品20g,加入稀盐酸,完全反映后,共用去稀盐酸
某钢铁厂检验员为了检测赤铁矿中氧化铁的质量分数,取矿石样品20g,加入稀盐酸,完全反映后,共用去稀盐酸
共用去稀盐酸219g,过滤得到滤渣4g(假设杂质既不溶于水也不与酸发生反应).请你和检验员一起完成下列计算 昙之馨1年前1
昙之馨1年前1 -
 繁花过后 共回答了14个问题
繁花过后 共回答了14个问题 |采纳率92.9%要计算什么,盐酸的浓度?方程式是Fe2O3+6HCl=2FeCl3+H2O实际反映的氧化铁是20-4=16g带入方程式计算就行了1年前查看全部
- 物质的密度一份矿石样品,质量为0.32g,体积为0.08cm³,则这份样品的密度为_____kg/m³
物质的密度
一份矿石样品,质量为0.32g,体积为0.08cm³,则这份样品的密度为_____kg/m³ 行者无疆7211年前1
行者无疆7211年前1 -
 biaobiaolmanman 共回答了20个问题
biaobiaolmanman 共回答了20个问题 |采纳率100%密度=0.32*10^-3kg÷(0.08*10^-6m³)=4000kg/m³1年前查看全部
- 如图所示是用滑轮组来提升矿石的装置示意图,矿石重G为5×104N,滑轮组机械效率η为80%,拉力F的功率为2kW,要把矿
如图所示是用滑轮组来提升矿石的装置示意图,矿石重G为5×104N,滑轮组机械效率η为80%,拉力F的功率为2kW,要把矿石匀速提升1m,则下列哪组量均可求出( )
 A. W有用、F、G动
A. W有用、F、G动
B. W有用、G动、绳子与滑轮间的摩擦
C. W额、G动、矿石上升的高度
D. W总、提升1m所用时间t、矿石上升的速度V yzzhlx1年前4
yzzhlx1年前4 -
 zzzaao 共回答了13个问题
zzzaao 共回答了13个问题 |采纳率76.9%解题思路:(1)在已知物重和提升高度的情况下,利用公式W=Gh可直接计算有用功的大小;
(2)根据有用功与机械效率可得出总功的大小,
(3)有用功占80%,则额功外占20%,可求出额外功;
(4)求出总功的大小,再根据拉力移动的距离,可利用公式W=Fs的变形,求出拉力F的大小;
(5)知道功率,根据公式P=Fv的变形,可求出绳子自由端移动的速度,进而求矿石上升的速度.
(6)利用速度公式求提升1m所用时间(1)有用功:W有=Gh=5×104N×1m=5×104J;
(2)∵η=
W有
W总,
∴总功:W总=
W有
η=
5×104J
80%=6.25×104J
(3)额外功:W额=W总-W有=6.25×104J-5×104J=1.25×104J.
使用滑轮组时,额外功包括克服摩擦、提升动滑轮、提升绳子做的功,只知道额外功的总和,不能单独求出克服摩擦、提升动滑轮做的功;
(4)读图可知,s=3h=3×1m=3m,
∵W总=Fs,
∴拉力F=
W总
s=[6.25×104J/3m]≈2.1×104N.
(5)∵P=Fv,
∴绳端移动的速度:
v=[P/F]=[2000W
2.1×104N≈0.1m/s,
矿石上升的速度:
v′=
1/3]v=[1/3]×0.1m/s≈0.03m/s,
(6)∵v=[s/t],
∴提升1m所用时间t=[h/v′]=[1m
1/3×0.1m/s]=30s.
综合上述分析,可知ABC错、D正确.
故选D.点评:
本题考点: 滑轮(组)的机械效率.
考点点评: 本题主要考查了有用功、总功、额外功的求法,机械效率、功率、速度的计算等,虽然也用到的都是基本的常见公式,但考查的角度较为特殊,尤其额外功包括克服摩擦、提升动滑轮、提升绳子做的功,只知道额外功的总和,不能单独求出克服摩擦、提升动滑轮做的功,值得我们关注.1年前查看全部
- 工业上生产MnO2和Zn的主要反应有:①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O ②M
工业上生产MnO2和Zn的主要反应有:①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O ②MnSO4+ZnSO4+2H2O
工业上生产MnO2和Zn的主要反应有:①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O =(通电)MnO2+Zn+2H2SO4 .
问:MnSO4和Zn的还原性强弱 具体理由.我不会这个啊
 mengziyou20051年前1
mengziyou20051年前1 -
 ku泡泡 共回答了13个问题
ku泡泡 共回答了13个问题 |采纳率76.9%第二个反应反过来就可以自动发生,不需要通电.通过第一个式子可以看出MnSO4和ZnSO4是可以共存的,第二个式子将他们通电了,于是生成了MnO2+Zn,所以可以推测MnO2+Zn+2H2SO4 可以直接反应生成MnSO4+ZnSO4.1年前查看全部
- 现有一批赤铁矿石(主要成分Fe2O3)100t.为测定该矿石中Fe2O3的含量,取样品粉末10g,加入7.3%的稀盐酸(
现有一批赤铁矿石(主要成分Fe2O3)100t.为测定该矿石中Fe2O3的含量,取样品粉末10g,加入7.3%的稀盐酸(矿石中的其它成分不与稀盐酸反应),当当加入150g时恰好完全反映.试计算:(1)10g样品中含多少克Fe2O3?(2)该铁矿石中Fe2O3的质量分数.(3)这样的铁矿石100t可炼出含铁96%的生铁的质量多少
 黑夜里1年前1
黑夜里1年前1 -
 独孤_无情 共回答了18个问题
独孤_无情 共回答了18个问题 |采纳率83.3%Fe2O3+6HCl=2FeCl3+3H2O
160 219
X 150*7.3%
X=8克------(1)
8/10=80%----(2)
100t*80%*70%/96%=58.33t------(3) 注:70%是Fe2O3中铁的质量分数.1年前查看全部
- 某学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来一些矿石的样品,并取稀盐酸200g,平
某学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来一些矿石的样品,并取稀盐酸200g,平
分成4份,进行实验,结果如下
1 2 3 4
加入样品的质量 5 10 15 20
生成二氧化碳的质量 1.76 m 4.4 n
1 哪 几次反映中矿石有剩余
2 m,n的值为
3这种石灰石矿石中碳酸钙的质量分数
要详细过程
 天黑zz多1年前1
天黑zz多1年前1 -
 yan2575 共回答了15个问题
yan2575 共回答了15个问题 |采纳率80%这个问题没有那么难吧,怎么没有人回答呢?
碳酸钙的分子式为CaCO3,加入盐酸后产生1个CO2,即CaCO3+2HCl-CaCl2+H2O+CO2
如果盐酸充足,CaCO3与生成CO2的质量比为100:44.
4.4*100/44=10克,1.76*100/44=4克.
1、四组反应所加入HCl量一致,而上述加入5克样品后4克样品完全反应,15克样品10克参与反应.说明15克样品不能完全反应,10/5*1.76=3.52克,3.52小于4.4.
则后两次反应中矿石有剩余.
2、m=10*1.76/5=3.52克,四次反应中HCl量不变,则n=4.4克
3、4/5=80%,则石灰石矿石中碳酸钙的质量分数为80%.
加几句啊,出这个题的人有点脑残,首先来说,碳酸钙的含量只占80%,则石灰石的品位只有44.8%,这根本就不是矿石,最多只能用来做碎石.溶剂灰岩的最低工业品位也要51%(四级品).还有就是灰岩矿石中一般有白云石,白云石一样和HCl产生反应,如果考虑了白云岩的情况下根本没法算——因此,出这个题的老师就是脑子进水了.1年前查看全部
- 一辆卡车运矿石,晴天每天可运十八次,雨天每天可运十次.一连运了若干天,其中雨天比晴天多两天,但运的次数却比晴天运的次数少
一辆卡车运矿石,晴天每天可运十八次,雨天每天可运十次.一连运了若干天,其中雨天比晴天多两天,但运的次数却比晴天运的次数少28次.这几天中有几个晴天?
 数着泡泡的鱼1年前1
数着泡泡的鱼1年前1 -
 apfs 共回答了15个问题
apfs 共回答了15个问题 |采纳率100%您好,寒樱暖暖为你
设晴天X天,雨天X+2天
18X-28=10(X+2)
18X-28=10X+20
8X=48
X=6
这几天中有6个晴天
如果你认可我的回答,
请及时采纳,(点击我的答案上面的【满意答案】图标)
手机用户,请在客户端右上角评价点“满意”即可
你的采纳,
是我前进的动力! 你的采纳也会给你带去财富值的.
如有不明白,
可以追问,直到完成弄懂此题!如还有新的问题,
请另外向我求助,(但不要在这里追问)答题不易,敬请谅解……1年前查看全部
- 小强同学前往当地的石灰石矿区进行调查.他取回了,若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的方法:取
小强同学前往当地的石灰石矿区进行调查.他取回了,若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的方法:取用8克这种石灰石样品,把40克稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
序号
加入稀盐酸质量/g
剩余固体质量/g
第一次
10
5.5
第二次
10
M
第三次
10
1.2
第四次
10
n
(1)8克的石灰石样品中含有杂质多少克?
(2)样品中碳酸钙的质量分数是多少?
(3)上表中m的数值应为多少?n的数值应为多少?
(4)求盐酸溶液中溶质的质量分数
重点给讲讲第一个问号 cy_dong1年前1
cy_dong1年前1 -
 zrw537 共回答了21个问题
zrw537 共回答了21个问题 |采纳率85.7%(1)1.2g 杂质都不溶于酸,而后两次加盐酸剩余物质的质量都没有改变,所以剩下的都为杂质 (2)85% (3)3 (4) 68.5%1年前查看全部
- 牙膏是生活中的必需品,在牙膏生产过程中常常添加一种摩擦剂.这种摩擦剂是由一种矿石经过加工而制成的极细小的碳酸钙粉末,其生
牙膏是生活中的必需品,在牙膏生产过程中常常添加一种摩擦剂.这种摩擦剂是由一种矿石经过加工而制成的极细小的碳酸钙粉末,其生产过程如图,请回答:
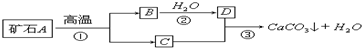
(1)写出A、B、C、D的化学式:A______;B______;C______; D______.
(2)写出生产过程中发生的化学反应方程式:①CaCO3
CaO+CO2↑高温 .CaCO3②______③______.
CaO+CO2↑高温 . adam69631年前1
adam69631年前1 -
 lsq726com 共回答了11个问题
lsq726com 共回答了11个问题 |采纳率90.9%解题思路:(1)大理石或石灰石的主要成分是碳酸钙,高温煅烧时能生成氧化钙和二氧化碳,氧化钙和水反应能生成氢氧化钙,氢氧化钙和二氧化碳反应能生成碳酸钙和水,所以A、B、C、D四种物质分别是碳酸钙、氧化钙、二氧化碳、氢氧化钙;
(2)根据(1)中推出的反应物、生成物书写化学方程式.(1)矿石高温分解成两种物质B和C,B与水反应成D,C与D生成碳酸钙和水,突破口在最后一步反应,DC分别为氢氧化钙、二氧化碳,进而推出AB分别为碳酸钙、氧化钙;
(2)碳酸钙在高温条件下生成氧化钙和水,化学方程式为:CaCO3
高温
.
CaO+CO2↑;氧化钙和水反应生成氢氧化钙,化学方程为:CaO+H2O═Ca(OH)2;氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故答案为:
(1)CaCO3;CaO;CO2;Ca(OH)2;
(2)①CaCO3
高温
.
CaO+CO2↑;②CaO+H2O=Ca(OH)2;③Ca(OH)2+CO2=CaCO3↓+H2O.点评:
本题考点: 物质的鉴别、推断.
考点点评: 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质题中的转换关系推导剩余的物质,最后进行验证即可.1年前查看全部
- 实验测得某磁铁矿石中四氧化三铁的质量分数为80%.利用该磁铁矿石5000吨.(假设杂质不含铁元素).炼铁厂理论上可以练出
实验测得某磁铁矿石中四氧化三铁的质量分数为80%.利用该磁铁矿石5000吨.(假设杂质不含铁元素).炼铁厂理论上可以练出含铁98%的生铁的质量是多少?
 tom02261年前1
tom02261年前1 -
 柯柯盐湖 共回答了21个问题
柯柯盐湖 共回答了21个问题 |采纳率95.2%设炼铁厂理论上可以练出含铁98%的生铁的质量为X
5000吨磁铁矿石含四氧化三铁的质量=5000吨*80%=4000吨.
4CO+ Fe3O4= 高温= 3Fe + 4CO2
232 168
4000吨 X*98%
232:168=4000吨:X*98%
解得:X=2955.7吨
答:炼铁厂理论上可以练出含铁98%的生铁的质量是2955.7吨1年前查看全部
- 间:2010-4-25 16:32 取矿石样品10克,加入足量稀盐酸,完全反应后,共用...
间:2010-4-25 16:32 取矿石样品10克,加入足量稀盐酸,完全反应后,共用...
间:2010-4-25 16:32
取矿石样品10克,加入足量稀盐酸,完全反应后,共用去稀硫酸154.5克,过滤得到滤渣2克(杂质不溶于水,也不与酸反应)算出赤铁矿石中氧化铁的质量分数和反应后盐酸中溶质质量分数. 正庄红花油1年前1
正庄红花油1年前1 -
 优雅的老鼠 共回答了19个问题
优雅的老鼠 共回答了19个问题 |采纳率100%氧化铁的质量=10-2=8克
赤铁矿石中氧化铁的质量分数=32/40=80%
Fe2O3+6HCl=2FeCl3+3H2O
160-------------------325
8----------------------X
X=16.25g
反应后盐酸中溶质质量分数=16.25/(154.5+8)=10%1年前查看全部
- (2013•鄂尔多斯)张华在测量某种矿石的密度时,选用的器材有天平、量筒、小矿石、细线、烧杯和水.
(2013•鄂尔多斯)张华在测量某种矿石的密度时,选用的器材有天平、量筒、小矿石、细线、烧杯和水.

(1)在调节天平横梁平衡时,发现指针位置如图甲所示,此时应将右端的平衡螺母向______(填“左”或“右”)调.
(2)用调节好的天平称小矿石的质量,天平平衡时,放在右盘中的砝码和游码的位置如图乙所示,量筒测量小矿石的体积如图丙所示,由此可知,小矿石的质量为______ g,小矿石的体积为______cm3,小矿石的密度为______kg/m3. wonwoo1年前0
wonwoo1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 14.某铝土矿里含氧化铝的质量分数为88%,计算理论上要用多少吨该矿石才能制取15吨的金属铝?
 梅花5211年前1
梅花5211年前1 -
 左左左28 共回答了15个问题
左左左28 共回答了15个问题 |采纳率86.7%根据化学式Al2O3计算,15吨金属铝需要氧化铝质量=15*102/54=28.33吨,需要铝土矿质量=28.33/88%=32.2吨.1年前查看全部
- 19G赤铁矿样品经试验测得,其中含有氧化铁9G,则该矿石中铁的质量分数是
 jj36682971年前1
jj36682971年前1 -
 贾伯 共回答了12个问题
贾伯 共回答了12个问题 |采纳率91.7%先求Fe元素的质量 9x 112/160=6.3g
因此矿石中Fe的质量分数为 6.3/19 x100%=33.2%1年前查看全部
- 小明在登山时发现了一块矿石,有些部位无色透明,有些部位红褐色或灰褐色.专家说这块矿石可能含有明矾氧化铁和泥沙等杂质.求如
小明在登山时发现了一块矿石,有些部位无色透明,有些部位红褐色或灰褐色.专家说这块矿石可能含有明矾氧化铁和泥沙等杂质.求如何检验矿石中含有K+(正一价钾离子)AL3+(正三价铝离子).FE+(正一价铁离子)SO4 2+(正二价硫酸根离子) 假设杂质对这些离子的检验无干扰
 石头鉴1年前2
石头鉴1年前2 -
 屠晚 共回答了17个问题
屠晚 共回答了17个问题 |采纳率88.2%正1价铁离子?氧化铁是正3价的铁吧?你搞错了
先把样品进行焰色反应,如果通过钴玻璃可以观察到紫色,说明有K+离子
再把样品用HCl溶解,过滤掉不溶物.得到溶液
把溶液取出少量样品,往样品里加入KSCN,如果溶液变为血红色,说明有Fe3+
另外取少量样品,加入Ba(NO3)2,如果生成白色沉淀,而且沉淀不溶于稀HNO3,则说明沉淀是BaSO4,说明有(SO4)2ˉ
PS:这里就不担心亚硫酸根的干扰了,因为前面溶解的一步等于酸化,基本排除亚硫酸干扰
再取样品,往里面加入NaOH,如果在滴加过程中先有沉淀,然后沉淀溶解,可以考虑有Al3+存在了
---
多谢楼上的提醒,开始我没注意,直接就打用硫酸酸化了,修正一下1年前查看全部
- 浮选一吨矿石需要多少浮选液?主要是矿石和浮选药剂的比重是多少(答得具体,追加40分)
 recltheb1年前1
recltheb1年前1 -
 奴才成堆忒恶 共回答了19个问题
奴才成堆忒恶 共回答了19个问题 |采纳率89.5%不同的矿石用量不一样,如果是有色金属单一矿种浮选时一般来说起泡剂不超过100克,捕收剂不超过300克,其它调整剂几百克到两三千克,要看什么矿,譬如钼矿要用石灰几百克,有的还要用水玻璃2000-3000克,因此,浮选一吨矿石需要多少浮选药剂?不同的矿石是不同,要通过选矿试验来确定.1年前查看全部
- 请问 在《贵州地质》杂志中,我发现有很多地方写道某某矿石的品位是**×10的负六次方.比如:矿石量208818吨,金属量
请问
在《贵州地质》杂志中,我发现有很多地方写道某某矿石的品位是**×10的负六次方.
比如:
矿石量208818吨,金属量1626千克,平均品位金6.72×10的负6次方,平均厚度金4.55米.
请问这个"10的负六次方"在地质学中是什么意思? liudingjun1年前9
liudingjun1年前9 -
 buyb 共回答了20个问题
buyb 共回答了20个问题 |采纳率100%10的6次方分之一
0.000001
他表示的是矿石中有用成分的质量比例1年前查看全部
- (2010•玄武区一模)炉甘石、金刚石、赤铁矿是三种矿石,请你依照示例填空.(物质类别填“单质”、“氧化物”、“酸”、“
(2010•玄武区一模)炉甘石、金刚石、赤铁矿是三种矿石,请你依照示例填空.(物质类别填“单质”、“氧化物”、“酸”、“碱”或“盐”)
示例:金刚石主要成分--碳--C--单质
炉甘石主要成分--______--ZnCO3--______
赤铁矿主要成分---氧化铁-______--______ 为欣赏你们而来1年前1
为欣赏你们而来1年前1 -
 sorme 共回答了20个问题
sorme 共回答了20个问题 |采纳率90%解题思路:弄清单质、化合物、酸、碱、盐的概念,即物质的命名.ZnCO3有金属离子和酸根离子构成,因此属于盐类物质,而氧化铁中应是+3价的铁的化合物,为Fe2O3,由铁元素和氧元素两种元素组成,故为氧化物.
故答案为:碳酸锌,盐;Fe2O3,氧化物.点评:
本题考点: 物质的简单分类;常见的氧化物、酸、碱和盐的判别;化学式的书写及意义.
考点点评: 主要考查了纯净物的分类及物质的命名,培养学生应用知识的能力.1年前查看全部
- 生活在个旧矿山的小蕊同学学习了密度知识后,在化验室工作的妈妈拿了一块小矿石让小蕊测定密度.由于没有量筒,她用一玻璃杯装满
生活在个旧矿山的小蕊同学学习了密度知识后,在化验室工作的妈妈拿了一块小矿石让小蕊测定密度.由于没有量筒,她用一玻璃杯装满水后用天平测出总质量m1为200g,然后用细线系着小矿石将其慢慢放入玻璃杯中后测出总质量m2为215g,把小矿石取出后再测总质量m3为190g.求(不计细线的质量和体积):
(1)小矿石的质量;
(2)小矿石的体积;
(3)小矿石的密度. wefg2231年前0
wefg2231年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 利用浮力测矿石密度时,为什么漂浮时是用p水gv而沉底时用p物gv?
 dajiacn1年前2
dajiacn1年前2 -
 prado_lee 共回答了20个问题
prado_lee 共回答了20个问题 |采纳率75%漂浮时重力等于浮力,由阿基米德定律可知浮力等于排开水的重量,所以矿石重量是ρ水gV,
沉底时重力不等于浮力,所以矿石重量=mg=ρ物Vg.1年前查看全部
- (2010•扬州模拟)已知某种稀有矿石的价值y(单位:元)与其重量ω(单位:克)的平方成正比,且3克该种矿石的价值为54
(2010•扬州模拟)已知某种稀有矿石的价值y(单位:元)与其重量ω(单位:克)的平方成正比,且3克该种矿石的价值为54000元.
(1)写出y(单位:元)关于ω单位:克)的函数关系式;
(2)若把一块该种矿石切割成重量比为1:3的两块矿石,求价值损失的百分率;
(3)把一块该种矿石切割成两块矿石时,切割的重量比为多少时,价值损失的百分率最大.(注:价值损失的百分率=[原有价值−现有价值/原有价值]×100%;在切割过程中的重量损耗忽略不计) hurtheart11年前1
hurtheart11年前1 -
 D弦托卡 共回答了22个问题
D弦托卡 共回答了22个问题 |采纳率95.5%解题思路:(1)价值y与其重量ω的平方成正比,设出函数解析式,用待定系数法可以求得;
(2)根据价值y与其重量ω的函数解析式,求出分割前的原有价值,分割后的现有价值,代入公式,价值损失的百分率=[原有价值−现有价值/原有价值]×100%,即得;
(3)由“价值损失的百分率=[原有价值−现有价值/原有价值]×100%=1−
”;现有价值 原有价值
解法1:若把一块该种矿石按重量比为m:n切割成两块,价值损失的百分率可以表示出来,求其最大值,得m,n的关系;
解法2:若把一块该种矿石按重量比为x:1切割成两块,价值损失的百分率也可以表示出来,求其最大值,得x:1的值;
两种设法,实际上是一种解法.解(1)依题意,设y=kω2(ω>0),
当ω=3时,y=54000,代入上式,得:k=6000,
故y=6000ω2(ω>0).
(2)设这块矿石的重量为a克,由(1)可知,
按重量比为1:3切割后的价值为;6000(
1
4a)2+6000(
3
4a)2,
价值损失为;6000a2−(6000(
1
4a)2+6000(
3
4a)2),
价值损失的百分率为;
6000a2−[6000(
1
4a)2+6000(
3
4a)2]
6000a2×100%=37.5%.
(3)解法1:若把一块该种矿石按重量比为m:n切割成两块,价值损失的百分率应为;1−[(
m
m+n)2+(
n
m+n)2]=
2mn
(m+n)2,又
2mn
(m+n)2≤
2•(
m+n
2)2
(m+n)2=
1
2,
当且仅当m=n时取等号,即重量比为1:1时,价值损失的百分率达到最大.
解法2:设一块该种矿石切割成两块,其重量比为x:1,则价值损失的百分率为;1−[(
x
1+x)2+(
1
1+x)2]=
2x
x2+2x+1,又x>0,∴x2+1≥2x,
故[2x
x2+2x+1≤
2x/2x+2x=
1
2],当且仅当x=1时等号成立.
答:(1)函数关系式y=6000ω2(ω>0);
(2)价值损失的百分率为37.5%;
(3)故当重量比为1:1时,价值损失的百分率达到最大.点评:
本题考点: 函数模型的选择与应用.
考点点评: 本题通过建立函数模型,考查正比例函数;通过所给公式,求价值损失率;通过求价值损失的百分率的最大值,考查基本不等式,属于综合性题目.1年前查看全部
- (2013•郴州)把一块重为G=3.4N的矿石,挂弹簧测力计上,并把他浸没在水中.静止时弹簧测力计的示数为F=2.9N,
(2013•郴州)把一块重为G=3.4N的矿石,挂弹簧测力计上,并把他浸没在水中.静止时弹簧测力计的示数为F=2.9N,g取10N/kg.求:
(1)矿石浸没在水中时受到的浮力;
(2)矿石的体积;
(3)矿石的密度. 西哒1年前0
西哒1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下面是小明测量矿石密度时的主要步骤.
下面是小明测量矿石密度时的主要步骤.
(1)请你帮他按正确的操作顺序将序号排列出来______.
A将一部分水倒入量筒中,记下这些水的体积V1;
B用天平称出矿石的质量m.
C将矿石用细线拴住放入量筒中,记下矿石和水的总体积V2;
D将各步测得的数据填入表格,利用密度公式求出矿石的密度.
(2)请你帮他将表中空缺的数据填齐并计算出结果
矿石质量
m/g量筒中水的体积V1/cm3 矿石和水的总体积V2/cm3 矿石的体积
(V2-V1)/cm3矿石的密度
g/cm3140 100 150 ______ ______  崔139129588251年前1
崔139129588251年前1 -
 uulijiao1234 共回答了17个问题
uulijiao1234 共回答了17个问题 |采纳率88.2%解题思路:(1)在用天平和量筒测固体密度的实验中,先测质量、再测体积、最后利用公式进行计算,是一般遵循的步骤.(2)测固体的密度用到的器材是天平和量筒,用天平测出固体的质量m,根据排水法用量筒测出固体的体积V,将物理量和数据记录在表中,用公式ρ=mV计算出固体的密度.(1)先用天平测矿石的质量,是为了减小在矿石沾水后,对质量和体积测量结果造成的误差;测矿石体积是要利用排水法,因此,应该先B后A,再将矿石用细线拴住放入量筒中,记下矿石和水的总体积V2;测量结束后就应该是相关的计算了.
(2)测定矿石密度的实验,先调节好天平,用其测出矿石的质量m,再在量筒中倒入适量(适量的含义是:没放入矿石前水的液面超过最小刻度值,放入矿石后液面不超过最大测量值)的水,读出体积为V1,再将矿石没入量筒内的水中,读出液面刻度为V2,矿石的体积V矿=V2-V1=150cm3-100cm3=50cm3;
然后利用密度公式ρ=[m/V],求出矿石的密度;
即:ρ矿=[m/V]=
140g
50cm3=2.8g∕cm3.
故答案为:(1)BACD;
(2)见下表:
矿石质量
m/g 量筒中水的体积V1/cm3 矿石和水的总体积V2/cm3 矿石的体积
(V2-V1)/cm3 矿石的密度
g/cm3
140 100 150 50 2.8点评:
本题考点: 固体的密度测量实验.
考点点评: 测固体、液体的密度是初中物理《密度》部分要求掌握的实验,各有一种基本的测量方法,用到的原理是ρ=mV,两种测量方法应达到理解且熟练背诵的程度.1年前查看全部
- (2008•宁波)小科在实验室里测量一块形状不规则、体积较大的矿石的密度.
(2008•宁波)小科在实验室里测量一块形状不规则、体积较大的矿石的密度.

(1)测得矿石的质量是210g;
(2)因矿石体积较大,她按如图所示方法进行测量,求得矿石的体积为______cm3;
(3)矿石的密度为______g/cm3. 特立独行的猪w21年前1
特立独行的猪w21年前1 -
 yxl840206 共回答了23个问题
yxl840206 共回答了23个问题 |采纳率87%解题思路:矿石的体积等于量筒中倒出水的体积,我们可以根据量筒中倒水前后的示数求出倒出水的体积;
根据密度公式,已知矿石质量、矿石体积,求出矿石的密度.(2)根据根据量筒的读数方法,视线与液面凹面底部平行,如图,量筒的分度值是10ml,量筒原有水的体积V1=200ml,量筒中剩下的水的体积V2=120ml,
则量筒中倒出的水的体积V=V1-V2=200ml-120ml=80ml=80cm3.
∵矿石的体积等于量筒中倒出水的体积,
∴V矿=80cm3.
故答案为:80;
(3)根据密度公式ρ=[m/v],已知矿石的质量m矿=210g,矿石的体积V矿=80cm3,
∴ρ矿=
210g
80cm3=2.625g∕cm3
故答案为:2.625.点评:
本题考点: 固体的密度测量实验;密度的计算;量筒的使用.
考点点评: 本题中固体密度的测量属基础问题,因初中物理对固体密度的测量要求较高,体积用到补充水的方法,给本题带来了一定难度.1年前查看全部
- 欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示.已知:碳酸不能溶解Al(OH)
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示.已知:碳酸不能溶解Al(OH)3沉淀.
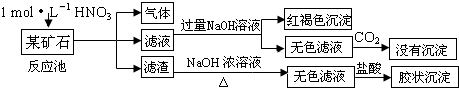
(1)Si在周期表中的位置是______.
(2)下列说法正确的是______.
a.酸性:H2CO3>H2SiO3b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4d.离子半径:O2-<Al3+
(3)该矿石的组成是______,滤渣和NaOH溶液反应的离子方程式是______.
(4)该矿石和1mol L-1HNO3反应的离子方程式______.
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是______;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1mol L-1 HNO3的体积为______L. 劫啊劫1年前1
劫啊劫1年前1 -
 心中的海豚 共回答了17个问题
心中的海豚 共回答了17个问题 |采纳率100%解题思路:(1)根据硅的原子核外电子排布确定在周期表中的位置;
(2)a.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
b.根据同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大判断;
c.元素的非金属性越强,对应的氢化物越稳定;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小;
(3)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2;
(4)矿石含有FeCO3,可与HNO3反应;
(5)处理该矿石,逸出的气体为NO,可与氧气反应生成硝酸,可循环利用,结合反应的方程式计算.(1)硅的原子核外有3个电子层,最外层电子数为4,则应位于周期表第三周期、ⅣA族,
故答案为:第三周期、ⅣA族;
(2)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
b.同周期元素从左到右原子半径逐渐减小,O<C、Si<Al,同主族元素从上到下原子半径逐渐增大,则C<Si,故b正确;
c.非金属性O>C>Si,元素的非金属性越强,对应的氢化物越稳定,故c正确;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小,则O2->Al3+,故d错误;
故答案为:abc;
(3)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2,
滤渣和NaOH溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
故答案为:FeCO3和SiO2;SiO2+2OH-=SiO32-+H2O;
(4)矿石含有FeCO3,可与HNO3反应,离子方程式为3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O,
故答案为:3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O;
(5)由于NO是有毒气体,不能随意排放,所以这样做的目的是NO循环使用能减少环境污染,且NO跟H2O、O2反应后又得到硝酸提高原料利用率.根据以上分析可知,该矿石中含有碳酸亚铁和二氧化硅,其中碳酸亚铁的质量是2.36×103 kg-1.2×103 kg=1.16×103kg,物质的量是10000mol,则根据(4)中的方程式可知,消耗硝酸的物质的量是
105
3mol,所以理论上至少需要1molL-1 HNO3的体积为3.0×104L.
故答案为:NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率;3×104.点评:
本题考点: 探究物质的组成或测量物质的含量;元素周期律的作用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 该题综合考查粗硅的制备、元素周期律的应用、物质的检验、氧化还原反应方程式的书写、尾气处理和原料的使用以及有关计算,是高考中的常见题型,难度较大,试题综合性强,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.该试题还通过鼓励学生去大胆的猜想及拓展探究实验,考查学生的基本科学素养.该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.1年前查看全部
- 有一块20m3的矿石,为了测出它的质量,从它上面取10cm3样品,测得样品的质量为26g,根据以上数据求出矿石的密度和质
有一块20m3的矿石,为了测出它的质量,从它上面取10cm3样品,测得样品的质量为26g,根据以上数据求出矿石的密度和质量?
 姜平平1年前0
姜平平1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为什么地球内部会有矿石?
 峡谷冬雪1年前2
峡谷冬雪1年前2 -
 hb0801 共回答了21个问题
hb0801 共回答了21个问题 |采纳率95.2%矿石只不过是元素和成矿矿物的富集1年前查看全部
- 欲探究某矿石可能是由FeCO 3 、SiO 2 、Al 2 O 3 中的一种或几种组成,探究过程如下图所示。(已知:碳酸
欲探究某矿石可能是由FeCO 3 、SiO 2 、Al 2 O 3 中的一种或几种组成,探究过程如下图所示。(已知:碳酸不能溶解Al(OH) 3 沉淀)
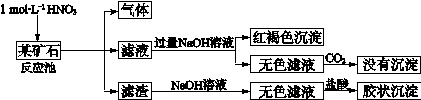
(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H 2 CO 3 >H 2 SiO 3 b.结合质子的能力:CO> AlO 2 - >HCO 3 -
c.稳定性:H 2 O>CH 4 >SiH 4 d.离子半径:O 2 - <Al 3+
(3)滤渣和NaOH溶液反应的离子方程式是
通过 现象说明此矿山中不含Al 2 O 3
(4)该矿石和稀HNO 3 发生氧化还原反应的离子方程式为
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O 2 混合循环通入反应池中,主要两个目的是 , ;
若处理该矿石2.36×10 3 kg,得到滤渣1.2×10 3 kg ,理论上至少需要1 mol L - 1 HNO 3 的体积为 L。 1314-Crystal1年前1
1314-Crystal1年前1 -
 marym2 共回答了18个问题
marym2 共回答了18个问题 |采纳率83.3%1年前查看全部
- 一块含铀的矿石质量为M,其中铀元素的质量为m.铀发生一系列衰变,最终生成物为铅.已知铀的半衰期为T,那么下列说法中正确的
一块含铀的矿石质量为M,其中铀元素的质量为m.铀发生一系列衰变,最终生成物为铅.已知铀的半衰期为T,那么下列说法中正确的有( )
A.经过两个半衰期后这块矿石中基本不再含有铀了
B.经过两个半衰期后原来所含的铀元素的原子核有[m/4]发生了衰变
C.经过三个半衰期后,其中铀元素的质量还剩[m/8]
D.经过一个半衰期后该矿石的质量剩下[M/2] chenyiwei1年前1
chenyiwei1年前1 -
 水之仙 共回答了23个问题
水之仙 共回答了23个问题 |采纳率82.6%解题思路:解答本题的关键是熟练掌握有关半衰期的运算,弄清总质量、衰变质量、衰变时间,半衰期之间关系.总质量m、衰变质量m1、衰变时间,半衰期之间关系为:m1=m([1/2])n,n为半衰期次数,即n=[t
t0,t0为半衰期,t为衰变时间,所以在本题中有:
A、经过2T剩余U为:m1=m(
1/2])n,发生衰变的为[3/4]m;经过时间2T后该矿石的质量为:M′=M-m+[m/4]=M-[3/4]m,故AB错误;
C、由上分析可知,经过三个半衰期后,其中铀元素的质量还剩m1=m([1/2])3=[m/8],故C正确.
D、经过一个半衰期后该矿石的质量剩下M-[1/2]m,故D错误;
故选:C.点评:
本题考点: 爱因斯坦质能方程;原子核衰变及半衰期、衰变速度.
考点点评: 本题考查了有关半衰期的理解及运算,要注意对基本概念和规律的理解及应用.1年前查看全部
- 某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化镁等化合物,
某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化镁等化合物,
经测定各元素质量分数的模型如图甲,由此可推测,该样品中不可能含有的化合物是 .

某矿石样品中吭含有碳酸钙、二氧化钙,氧化铝、氧化镁等化合物. 糗gg你1年前1
糗gg你1年前1 -
 haogui123456 共回答了17个问题
haogui123456 共回答了17个问题 |采纳率88.2%一定没有碳酸钙
因为这图里根本就没有碳元素的质量分数
没有碳元素怎么会有碳酸钙呢.1年前查看全部
- 一道大学无机综合化学题,已知某矿石的主要成分是SiO2、MnO2、Fe3O4,请设计方案综合利用该矿石,要求写出相应的操
一道大学无机综合化学题,
已知某矿石的主要成分是SiO2、MnO2、Fe3O4,请设计方案综合利用该矿石,要求写出相应的操作步骤、反应条件和反应方程式等. yjy5111年前3
yjy5111年前3 -
 cpawen 共回答了16个问题
cpawen 共回答了16个问题 |采纳率87.5%1、矿物粉碎
2、磁选法:强磁Fe3O4,弱磁MnO2,无磁SiO2;将三种主成份分开;
3、SiO2:用Na2CO3高温处理制水玻璃
SiO2 + Na2CO3 = Na2SiO3
水浸取就得到水玻璃
4、Fe3O4送冶炼厂直接炼铁:
Fe3O4 + 4CO = 3Fe + 4CO2
5、MnO2用碱处理生产高锰酸钾
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O (电解) = 2KMnO4 + H2 + 2KOH
解决方案不可能是唯一的,仅提供一种.1年前查看全部
- 如何判断矿石重选分离的难易程度?
 yoyosky9131年前2
yoyosky9131年前2 -
 wendy302 共回答了16个问题
wendy302 共回答了16个问题 |采纳率100%根据所需矿石的密度来判断.
如果所需矿石和其他矿渣的密度相近那么进行离心分离的时候就很难区别开来.1年前查看全部
大家在问
- 1一台彩电,将定价的百分之10可盈利215元,如果按定价百分之20,就亏损125元.问:定价是多少?
- 22008*二的二零零八次方+2008*二的二零零八次方-2008*二的二零零九次方
- 3甲乙两人各有若干本书若甲给乙45本则二人的书相等若乙给甲45本则甲的本数是乙的2倍甲乙原本各有多少本
- 43.40万精确到哪一位?2.1×10的4次方精确到哪一位?
- 5某学校实验室的废液缸中收集了学生在实验室制取二氧化碳后残留的废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答
- 6改为被动语态 Do people plant a lot of trees every year?
- 7分解因式:①x³-9 ②x³-4x²+4x
- 8请教下句型转换I’d like to be her penfriend.(一般疑问句并作肯定回答)______ ____
- 9谁能帮我总结HCLO化学性质?
- 10大熊猫急忙忙地跑过去,勇敢地冲进屋里,救出了小山羊.这句中表示大熊猫救小山羊时的动作的词语有哪些?
- 11几道英语语法题1We( )that you would fix the TV set this week.I am so
- 12阅读《谢天》(作者:陈之藩),完成第1—6题。
- 13孟子的名人名言解释尽信书则不如无书
- 14照样子,先换偏旁成新字,再组词。
- 15跪求这句英语谚语的深层含义He is a real stud .A stud is a man who is extre

