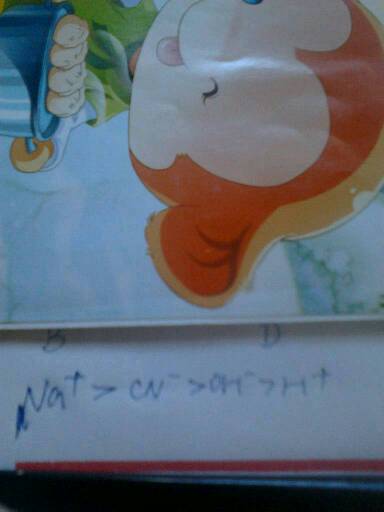离子原子分子化学常用还是物理常用
 henrydddd2022-10-04 11:39:544条回答
henrydddd2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 lamar168 共回答了21个问题
lamar168 共回答了21个问题 |采纳率95.2%- 离子 分子是化学
原子在高级物理用得多 - 1年前
 shb1019 共回答了5个问题
shb1019 共回答了5个问题 |采纳率- 化学
- 1年前
 tmt77 共回答了52个问题
tmt77 共回答了52个问题 |采纳率- 化学
- 1年前
 zlhljy 共回答了6个问题
zlhljy 共回答了6个问题 |采纳率- 物理
- 1年前
相关推荐
- 设计分离鉴定混合离子Ag Cu Al Ba Na
设计分离鉴定混合离子Ag Cu Al Ba Na
设计分离银离子,铜离子,铝离子,3价铁离子,钡离子和钠离子 wxguo8881年前1
wxguo8881年前1 -
 huang2007a 共回答了13个问题
huang2007a 共回答了13个问题 |采纳率100%1:加入盐酸,生成AgCl沉淀,过滤分离出Ag+,滤液继续下面步骤
2:加入硫酸,生成BaSO4沉淀,过滤分离出Ba2+,滤液继续下面步骤
3:加入过量硫氰酸H2S,生成CuS,和FeS沉淀(H2S使三价铁还原),过滤分离出Cu2+,Fe3+,将沉淀溶于稀盐酸,FeS溶解,CuS不溶,于是Cu,Fe分离
4:加入适量的KOH,生成AlOH3沉淀,过滤分离出Al3+
5:滤液里剩余Na+1年前查看全部
- 化学离子
 软懒散kkk1年前1
软懒散kkk1年前1 -
 重庆黎亮 共回答了24个问题
重庆黎亮 共回答了24个问题 |采纳率87.5%离子是指原子由于自身或外界的作用而失去或得到一个或几个电子使其达到最外层电子数为8个或2个的稳定结构.这一过程称为电离.电离过程所需或放出的能量称为电离能.与分子、原子一样,离子也是构成物质的基本粒子.
基本概念:在化学变化中,电中性的原子经常会得到或者失去电子而成为带电荷的微粒,这种带电的微粒叫做离子. 原子是由原子核和核外电子构成,原子核带正电荷,绕核运动的电子则带相反的负电荷.原子的核电荷数与核外电子数相等,因此原子显电中性.如果原子从外获得的能量超过某个壳层电子的结合能,那么这个电子就可脱离原子的束缚成为自由电子.一般最外层电子数小于4的原子、或半径较大的原子,较易失去电子(一般为金属元素,如:钾K,钙Ca等);而最外层电子数不少于4的原子(一般为非金属元素,如:硼B,碳C等)则较易获得电子.当原子的最外层电子轨道达到饱和状态(第一周期元素2个电子、第二第三周期元素8个电子)时,性质最稳定,一般为稀有气体.
分类:
阴离子
当原子得到一个或几个电子时,核外电子数多于核电荷数,从而带负电荷,称为阴离子.
阳离子
当原子失去一个或几个电子时,核外电子数少于核电荷数,从而带正电荷,称为阳离子.
络离子
络离子是指由某些分子、原子或阳离子通过配位键与电中性分子或阴离子形成的复杂离子,例如水合离子.络离子本身可以属于阳离子或阴离子.1年前查看全部
- [Cu(CN)4]3-中心离子杂化轨道
[Cu(CN)4]3-中心离子杂化轨道
是什么,为什么 qmarco1年前1
qmarco1年前1 -
 hh的计划hh 共回答了20个问题
hh的计划hh 共回答了20个问题 |采纳率85%显然是sp3杂化 d轨道全满
祝学习进步,满意请采纳,谢谢.1年前查看全部
- cuso4+h2s cus h2so4 离子浓度
cuso4+h2s cus h2so4 离子浓度
理论:反应的方向是向着溶液中离子浓度减少的方向进行.
但为什么老师说反应看做CU2+SO42-生成2H+ 和SO42-
离子浓度增大 不是矛盾了么 zcl5050gyh1年前1
zcl5050gyh1年前1 -
 天边的那朵云上 共回答了16个问题
天边的那朵云上 共回答了16个问题 |采纳率93.8%楼主好!
呃……楼主是想说 CuSO4 + H2S == CuS↓ + H2SO4 吧!楼上,你的解释不准确哦,H2S在水中的确会电离出H+,但是!H2S是弱酸,它电离出的离子浓度是很小的,所以说“H+离子浓度不变”是不正确的,这个要纠正一下.
将该反应写成离子方程式:H2S + Cu2+ == CuS↓ + 2H+,在这个反应中,离子浓度的确是增大了没错,我不晓得楼主所说的“反应看做CU2+SO42-生成2H+ 和SO42-”原话是什么,但就这句话来说,肯定是错误的!因为这个反应从始至终,和硫酸根半毛钱关系都没有.
这个反应本质是复分解反应,而复分解反应指的是由两种化合物相互交换成分,生成另外两种化合物的反应.按照复分解反应的发生条件,必须有气体、沉淀、水(狭义,广义为弱电解质)三者之一生成.我们一般都认为,复分解反应的实质是化合物电离生成的离子在溶液中相互发生了反应,反应的方向是向着溶液中离子浓度减少的方向进行.这个放在绝大多数复分解反应上是没错的.但,呵呵,这是特例.
要解释这个特例,首先从我们熟悉的强酸制弱酸说起.其实,为什么我们说弱酸制强酸不行呢?就像 H2CO3 + CaCl2 = 2HCl + CaCO3.这个反应不可能就是因为生成物CaCO3能继续和HCl反映,到最后就什么也没有生成了,所以就是不能进行这个反应.而H2S+CuSO4=CuS↓+H2SO4,CuS实在太难溶于H2SO4中了(就是不反应),所以能够变成沉淀,并沉淀于H2SO4中,不像上面的CaCO3能溶于HCl.
因此,一个复分解反应其实是与其逆反应竞争的过程,比较科学的解释就是平衡常数K——复分解反应之所以能进行,就是因为在一部分离子很多的同时,另一部分离子能大量减少,拉动了平衡.而CuSO4 + H2S == CuS↓ + H2SO4 中,由于 CuS 溶解度实在太小,无法提供逆反应所需的大量 S2- ,而却能提供正反应所需的大量 Cu2+,并且在生成 CuS 的同时,满足Cu2+的大量减小,因此能够发生.至于最科学的解释涉及焓与熵,这个就不要细究了.
嗯,就这样,楼主有问题的话再问吧!1年前查看全部
- Al+H2O+NaOH氧化还原离子得失
 beautyty1年前2
beautyty1年前2 -
 crosscall 共回答了19个问题
crosscall 共回答了19个问题 |采纳率94.7%2Al + 2H2O + 2OH- → 2(AlO2)- + 3H2
Al失去6个电子
H2O 得到6个电子1年前查看全部
- so32- cl-反应离子方程
 zqli0091年前1
zqli0091年前1 -
 迷茫青年 共回答了19个问题
迷茫青年 共回答了19个问题 |采纳率73.7%SO32-+Cl2+H2O=SO42-+2Cl-+2H+1年前查看全部
- 化学离子浓度大小如何判断
 pbl6521年前1
pbl6521年前1 -
 野辣烟开滴花 共回答了21个问题
野辣烟开滴花 共回答了21个问题 |采纳率95.2%考虑粒子在溶液中是否完全电离,如果完全电离再看其粒子在溶液中的浓度大小,随后考虑其弱酸弱碱根的水解程度,判断其粒子浓度大小,最后看溶液呈酸性还是碱性判断氢离子和氢阳根的浓度大小.
最后在比较其正粒子与负离子是否近似相等.(原因是因为溶液不带电)1年前查看全部
- Fe3+ Cu2+ Fe2+ 离子溶液颜色
Fe3+ Cu2+ Fe2+ 离子溶液颜色
含Fe3+的溶液为黄色的除FeCl3、Fe2(SO4)3外还有哪些
含Cu2+的溶液为蓝色的除CuCl2、CuSO4外还有哪些
含Fe2+的溶液为浅绿色的除FeCl2、FeSO4外还有哪些
要两个 linpingzhi1年前2
linpingzhi1年前2 -
 shst999 共回答了30个问题
shst999 共回答了30个问题 |采纳率86.7%含Fe3+的溶液为黄色的除FeCl3、Fe2(SO4)3外还有Fe(NO3)3
含Cu2+的溶液为蓝色的除CuCl2、CuSO4外还有Cu(NO3)2
含Fe2+的溶液为浅绿色的除FeCl2、FeSO4外还有Fe(NO3)21年前查看全部
- 原子,分子,离子,质子,
 李帅风1年前1
李帅风1年前1 -
 jyes826fk1da0 共回答了18个问题
jyes826fk1da0 共回答了18个问题 |采纳率94.4%原子是由原子核和核外电子组成的.原子核是由质子和中子组成的.其中,中子不显电性,每个电子先一个单位负电荷,每个质子现一个单位正电荷.原子的质子数与电子书相等,原子不显电性.电子是失去或得到电子的原子.1年前查看全部
- 阴阳离子放电顺序
 几唯1年前1
几唯1年前1 -
 gg蝴蝶 共回答了20个问题
gg蝴蝶 共回答了20个问题 |采纳率80%阴离子放电顺序S2-,I-,Br-,Cl-,OH-,含氧酸根,F-.
阳离子放电强弱顺序与金属活动顺序表相反,即由强到弱的顺序为::Ag+>Hg+>Fe3+>Cu2+>H+(酸中的H)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水中)>Al3+>Mg2+>Na+>Ca2+>K+1年前查看全部
- 离子沉淀这个概念
 明明0811年前1
明明0811年前1 -
 毒冷丁 共回答了21个问题
毒冷丁 共回答了21个问题 |采纳率90.5%一般就是溶液里滴入另一种溶液让其中的某些离子发生沉淀.例如往Cuso4溶液中滴入NaoH,就会发生Cu2+ +2 OH-==Cu(oH)2 (氢氧化铜为沉淀)1年前查看全部
- 混合溶液离子浓度比较
混合溶液离子浓度比较

 一声裂帛长吟1年前1
一声裂帛长吟1年前1 -
 yzx7777777 共回答了17个问题
yzx7777777 共回答了17个问题 |采纳率88.2%1年前查看全部
- 化学怎样区分阴阳离子
 LINDA81121年前2
LINDA81121年前2 -
 被oo的一块石头 共回答了19个问题
被oo的一块石头 共回答了19个问题 |采纳率94.7%得到电子的就是阴离子,失去电子的就是阳离子1年前查看全部
- 常规金属离子多少纳米?
 _闲情闲绪_1年前1
_闲情闲绪_1年前1 -
 风铃草_12 共回答了13个问题
风铃草_12 共回答了13个问题 |采纳率92.3%1金属离子浓度,CM更大越大突变的浓度;
2.K“效应:
K'的值增加,从而增加了突起;因此
取决于KMY,字母A(印花)A(ML);
LGK'= lgKMY-LGA(H)-lga(M)
所以PH降低或其它分布以及金属离子浓度增加的EDTA络合物本身有影响的稳定性.
准确滴定的条件lgCspK'> = 61年前查看全部
- _H2C2O4+_MnO4" +_H离子---_Mn2++_CO2+_H2O配平
 tian_客1年前2
tian_客1年前2 -
 寻求手** 共回答了20个问题
寻求手** 共回答了20个问题 |采纳率100%5H2C2O4+2(MnO4 -) +6(H +)---2(Mn2+)+10CO2+8H2O1年前查看全部
- 高三化学PH温度影响离子浓度问题
高三化学PH温度影响离子浓度问题

这题该怎么解? familybruin1年前5
familybruin1年前5 -
 hanghangli 共回答了26个问题
hanghangli 共回答了26个问题 |采纳率84.6%看清各个点对应的情况,进行分析.
A,a点是加入10ml HCl,这时NH3·H2O一半与HCl反应生成NH4Cl,剩余一半NH3·H2O.
明显,有NH4Cl和NH3·H2O的混合溶液,呈碱性.说明NH3·H2O电离为主.
NH4Cl==NH4+ + Cl-,再加上 NH3·H2O==NH4+ + OH-
所以,NH4+ > Cl- > OH- > H+
B、b点是呈中性,所以 c(H+)=c(OH-),
而任何时刻溶液一定电荷守恒:c(Na+) + c(H+) = c(Cl-) + c(OH-)
呈中性,所以,c(Na+)=c(Cl-)
C、B答案说了,任何时刻溶液一定电荷守恒:c(Na+) + c(H+) = c(Cl-) + c(OH-)
D、NH3·H2O早电离了,这时NH3·H2O也被HCl中和的快没了.所以,温度下降与NH3·H2O电离没关系.而是因为之前溶液温度高于常温,加入新的溶液是常温的,把温度降了下来.
选D1年前查看全部
- 分子,原子,质子,离子,电子,中子关系
分子,原子,质子,离子,电子,中子关系
这几个容易混了,而且我还不是很明白他们之间的关系,希望有可以解答的清楚点的,最好使用结构图来说明. bleachsong1年前3
bleachsong1年前3 -
 斗秀街区 共回答了21个问题
斗秀街区 共回答了21个问题 |采纳率95.2%简单说:分子可以由多种元素组成
原子只有一种元素
原子有两个部分:1原子核 2核外电子=上述的电子
原子核内有质子和中子
质子,电子,中子都在原子内 电子在核外 .质子中子在核内
离子是某个原子失去或得到核外电子后形成的带电微粒1年前查看全部
- 化学离子概念
 帝王心1年前2
帝王心1年前2 -
 rose_101 共回答了21个问题
rose_101 共回答了21个问题 |采纳率85.7%带有电荷的原子或分子,或组合在一起的原子或分子团.带正电荷的离子称“正离子”,带负电荷的离子称“负离子”.1年前查看全部
- 怎么鉴别这些离子?Mg,Al,Ba,CO3,HCO3?
 下大鱼1年前1
下大鱼1年前1 -
 xx9966xx 共回答了28个问题
xx9966xx 共回答了28个问题 |采纳率85.7%滴加稀HCl,直接产生气泡的是HCO3-,一段时间后产生气泡的是CO32-.
在剩下的3个中,滴加NaOH溶液至过量,产生白色沉淀的是Mg2+,先产生沉淀后来又溶解的是Al3+,没有沉淀产生的是Ba2+1年前查看全部
- 鉴别so4,co3,oh,cl离子
鉴别so4,co3,oh,cl离子
取一次液,
要有理由,
谢谢~ ducun1年前1
ducun1年前1 -
 萧程 共回答了22个问题
萧程 共回答了22个问题 |采纳率95.5%先加酚酞,鉴别出OH,变红
在加硝酸,鉴别出CO3,有气泡(不可用硫酸和盐酸否则下面将无法鉴别)
加入硝酸钡,白色沉淀加入硝酸后沉淀不溶解,鉴别出SO4
最后加入AGNO3,白色沉淀加硝酸沉淀不溶解,鉴别出CL1年前查看全部
- Na2co3 nahco3 nahso3 nh4cl电荷守恒物料守恒质子守恒离子浓度关系
 zhaobo77881年前1
zhaobo77881年前1 -
 忽略忽略再忽略 共回答了14个问题
忽略忽略再忽略 共回答了14个问题 |采纳率100%Na2CO3
电荷守恒,cNa+ +cH+=2cCO32-+cHCO3-+cOH-
物料守恒,2cCO32-+2cHCO3-+2cH2CO3=cNa+
质子守恒,cH+ +cH2CO3=cOH-+cCO32-
NaHCO3
电荷守恒,cNa+ +cH+=2cCO32-,+cHCO3-+cOH-
物料守恒,cNa+=cHCO3-+cCO32-+cH2CO3
质子守恒,cH++cH2CO3=cCO32-+cOH-
NaHSO3与NaHCO3几乎完全一样,就不书写了
NH4Cl,电荷守恒,
cCl-+cOH-=cNH4+ +cH+
物料守恒,cNH4+ +cNH3.H2O=cCl-
质子守恒,cH+ =cNH3.H2O+cOH-
质子守恒,即电荷守恒与物料守恒式子的相减可得1年前查看全部
- 离子浓度大小如何比较
 zhengshibing1年前1
zhengshibing1年前1 -
 hujiafei2008 共回答了18个问题
hujiafei2008 共回答了18个问题 |采纳率77.8%要掌握解此类题的三个思维基点:电离、水解和守恒(电荷守恒、物料守恒及质子守恒).对有关电解质溶液中离子浓度大小比较的题,在做时首先搞清溶液状况,是单一溶液还是混合溶液,然后再根据情况分析.
1、单一溶质的溶液中离子浓度比较
① 多元弱酸溶液中,由于多元弱酸是分步电离(注意,电离都是微弱的)的,第一步的电离远远大于第二步,第二步远远大于第三步.由此可判断多元弱酸溶液中离子浓度大小顺序.例H3PO4溶液中:c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)
② 多元弱酸的强碱正盐溶液中,要根据酸根离子的分步水解(注意,水解都是微弱的)来分析.第一步水解程度大于第二步水解程度,依次减弱.如Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
③ 多元弱酸的酸式盐溶液中:由于存在弱酸的酸式酸根离子的电离,同时还存在弱酸的酸式酸根离子的水解,因此必须搞清电离程度和水解程度的相对大小,然后判断离子浓度大小顺序.常见的NaHCO3 NaHS,Na2HPO4溶液中酸式酸根离子的水解程度大于电离程度,溶液中c(OH-)>c(H+)溶液显碱性,例NaHCO3中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
反例:NaHSO3,NaH2PO4溶液中弱酸根离子电离程度大于水解程度,溶液显酸性c(H+) >c(OH-).例在NaHSO3中:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
规律:① 第一步水解生成的粒子浓度在[OH-]和[H+]之间,第二步水解生成的粒子浓度最小 例:Na2S溶液中的各离子浓度大小的顺序:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
②不同溶液中同种离子浓度的比较:既要考虑离子在溶液中的水解因素,又要考虑其它离子的影响,是抑制还是促进,然后再判断.
例;常温下物质的量浓度相等的a.(NH4)2CO3 b.(NH4)2SO4.c.(NH4)2Fe(SO4)2三种溶液中c(NH4+)的大小;NH4+在水溶液中发生水解显酸性,CO32-离子水解显碱性,两离子水解相互促进,Fe2+水解显酸性与NH4+水解相互抑制,因此三溶液中c(NH4+):c>b>a.
2、 混合溶液中离子浓度的比较
① 强酸与弱碱溶液混合后溶液中离子浓度大小比较,首先要考虑混合后溶液的状况及溶液的酸碱性.酸过量:溶液为强酸和强酸弱碱盐的混合溶液,溶液中c(H+) >c(OH-)呈酸性
酸碱恰好完全反应:溶液为单一盐溶液,弱碱根离子水解,溶液呈酸性
碱少量过量:溶液为弱碱和强酸弱碱盐的混合溶液,溶液中c(OH-)= c(H+)呈中性
碱大量过量:溶液为大量弱碱和强酸弱碱盐的混合溶液,溶液中c(OH-)>c(H+)呈碱性.根据这几种情况可判断溶液中离子大小情况.
②强碱和弱酸溶液混合后,溶液中离子浓度的大小比较
呈碱性包括两种情况;强碱和强碱弱酸盐的混合溶液及单一强碱弱酸盐溶液.
呈中性:强碱弱酸盐和少量弱酸的混合溶液
呈酸性:强碱弱酸盐和大量弱酸的混合溶液
3理解掌握电解质溶液中的几种守恒关系;
①溶质守恒:(物料守恒)溶质在溶液中某种离子的各种存在形式总和不变.
如:在CH3COONa溶液中c(CH3COO-)+ c(CH3COOH)= c(Na+)=c( CH3COONa)
②溶剂守恒:(质子守恒)溶液中溶剂水电离的c(H+)和c(OH-)浓度相等,
如:在CH3COONa溶液中,水所电离的H+被部分CH3COO-结合生成CH3COOH,因此:c(H+)+ c(CH3COOH)= c(OH-)
③电荷守恒:任何溶液中都呈电中性,溶液中阳离子所带的正电荷总和等于阴离子所带的负电荷总和.在CH3COONa溶液中:c(CH3COO-)+ c(OH-)=c(Na+)+c(H+)
利用好守恒关系也可以达到事半功倍的效果.1年前查看全部
- 怎么鉴别这些离子?SiO3,NO3,SO4,SO3?
 t7town1年前3
t7town1年前3 -
 fhongb 共回答了26个问题
fhongb 共回答了26个问题 |采纳率84.6%先加稀HCl,SiO32-会生成H2SiO3沉淀;
在剩余的3个中,再加BaCl2溶液,有沉淀的是SO42-;
在剩余的2个中,再加入稀HNO3,产生沉淀的是SO32-;
剩下的最后一个就是NO3-1年前查看全部
- 离子鉴定
离子鉴定

 jieze1年前1
jieze1年前1 -
 飞机昆仑山1 共回答了17个问题
飞机昆仑山1 共回答了17个问题 |采纳率100%①:说明有CO32-,没有Ba2+,Ag+,Al3+.无色溶液,没有MnO4-.
②:沉淀乙就是Al(OH)3.
③:沉淀丁就是BaCO3,可能含有BaSO4.
(1)Ba2+,Ag+,Al3+,MnO4-.
(2)CO32-,SO42-,AlO2-,Na+.
(3)Al3+ + 3HCO3- = Al(OH)3 + 3CO2
(4)BaCO3.BaSO4.加入稀盐酸,沉淀溶解就是BaCO3,不溶解就是BaSO4.1年前查看全部
- CrO4 2- 离子 怎么称呼
 王总的hh1年前2
王总的hh1年前2 -
 zcszdfsf 共回答了20个问题
zcszdfsf 共回答了20个问题 |采纳率90%铬酸根离子1年前查看全部
- 如何评价金属离子螯合能力
 fenghu20071年前1
fenghu20071年前1 -
 过往心程 共回答了17个问题
过往心程 共回答了17个问题 |采纳率94.1%金属离子没有螯合能力.多齿配体具有螯合能力.多齿配体对不同金属离子的螯合能力是由它们的稳定常数 Kf 描述的.1年前查看全部
- 高中化学离子反应先后顺序?谢谢.
 mimimao8112191年前3
mimimao8112191年前3 -
 春天32 共回答了13个问题
春天32 共回答了13个问题 |采纳率92.3%阴离子:S2->SO32->碘离子>Br-1年前查看全部
- 怎样区分原子,离子,分子.
 blue_flower1年前1
blue_flower1年前1 -
 lihong19780602 共回答了23个问题
lihong19780602 共回答了23个问题 |采纳率95.7%1.分子是构成物质的一种粒子.
大多数的物质都是由分子构成的.如氧气由氧分子构成;水由水分子构成;硫酸由硫酸分子构成等.
2.分子是保持物质化学性质的最小粒子
(1)“保持”是指构成物质的每个分子与该物质的化学性质相同.如保持氧气的化学性质的最小粒子是氧分子.
(2)物质的性质有物理性质和化学性质,分子只能保持其化学性质,不能说成是物质的性质,因为物质的物理性质(如熔点、沸点、硬度、密度等)都是该物质大量分子聚集体所表现的属性.如大量氧分子聚集成的液态氧呈淡蓝色.
(3)分子是由原子构成的.如1个氧分子由2个氧原子构成.
二.原子
1.原子也是构成物质的一种粒子.
金属、稀有气体、金刚石和石墨等都是由原子直接构成的物质.如汞由汞原子构成,氦气由氦原子构成.
2.原子是化学变化中的最小粒子.在化学反应中分子可分成原子,但原子在化学反应中不能再分成更小的粒子,而是原子又重新组合成新的分子,这就是化学反应的本质.如加热红色氧化汞时,氧化汞分子分解为氧原子和汞原子,每2个氧原子结合成1个氧分子,许多汞原子聚集成金属汞.
三.离子
1.离子也是构成物质的一种粒子.
由离子构成的物质有:大多数盐、碱和活泼金属氧化物.如氯化钠由钠离子和氯离子构成,氢氧化钾由钾离子和氢氧根离子构成.
2.离子是带电的原子或原子团
带正电荷的原子或原子团叫做阳离子,带负电荷的原子或原子团叫做阴离子.典型阳离子有等,典型阴离子有、等.阳离子和阴离子是不能独立存在的,它们必须共存于离子化合物或溶液中,并且由于阳离子所带正电荷总数和阴离子所带负电荷总数相等,因此化合物或溶液不显电性.
3.离子在化学反应中有可能再分.
当离子为单原子的离子时,在化学反应中不能再分;当离子为原子团时,它在许多化学反应中好像一个原子一样作为一个整体参加反应,反应前后保持不变,但它毕竟不是一个原子,在某些化学反应中,原子团也可能发生变化.如碱式碳酸铜、氯酸钾等物质中的会因受热而发生变化.1年前查看全部
- 离子交换原理
 zshaiming1年前1
zshaiming1年前1 -
 糖糖棒 共回答了16个问题
糖糖棒 共回答了16个问题 |采纳率100%借助于固体离子交换剂中的离子与稀溶液中的离子进行交换,以达到提取或去除溶液中某些离子的目的,是一种属于传质分离过程的单元操作.离子交换是可逆的等当量交换反应.1年前查看全部
- 怎么判断离子共存
 老_茂1年前1
老_茂1年前1 -
 夕夕鱼 共回答了23个问题
夕夕鱼 共回答了23个问题 |采纳率73.9%主要是离子间①生成难容物,沉淀或是难电离物(如弱碱的阳离子不与氢氧根共存,弱酸根离子不与氢离子共存)
②若离子间发生氧化还原反应则不能大量共存(如铁离子与碘离子,高锰酸根离子与碘离子和溴离子均不能大量共存)
③弱酸式酸是酸根离子(如碳酸氢根离子亚硫酸氢根离子)与氢离子和氢氧根离子均不能大量共存
最后要注意溶液的颜色如铁离子亚铁离子高锰酸根离子铜离子都是有颜色的1年前查看全部
- 离子 l怎样达到稳定结构
 jivvuy1年前2
jivvuy1年前2 -
 dalesaqqro 共回答了19个问题
dalesaqqro 共回答了19个问题 |采纳率94.7%不一定.稀有气体本身就是具有稳定结构的原子,所以不带电.而其他原子会通过得电子或失电子的方式变成稳定结构,就会带负电荷或者正电荷.1年前查看全部
- 离子半径,原子半径怎么比较大小
 mmlhy1年前1
mmlhy1年前1 -
 4cjql4ln 共回答了26个问题
4cjql4ln 共回答了26个问题 |采纳率88.5%首先看你的原子周期表,同周期的原子,从左到右,半径原来远大,同主族的原子,从上到下,半径越来远大,而离子分阳离子与阴离子,有时也会让你进行离子与原子的比较,这个较为麻烦,我这只有一点点::不同原子:根据『同周期:原子半径从左到右逐渐减小,同主族:原子半径从上到下原子半径逐渐增大』.
不同离子:1:电子层数相同的根据『荷电荷数越大的原子半径越小』,2:不同电子层的:根据『电子层数越多的半径越大』
离子和原子:根据『阴离子的半径大于相应的原子半径,杨离子半径小于相应的原子半径』.,对于离子的比较,我劝你还是到学校问问老师,这样会更清楚,也有保证1年前查看全部
- 离子半径大小怎样判断?离子半径大小怎样判断
 网欲1年前1
网欲1年前1 -
 lmeon 共回答了16个问题
lmeon 共回答了16个问题 |采纳率81.3%不管是原子还是离子半径,都只需看两条:
1、 电子层数 越多,半径越大;
2、电子层数相同,看质子数,质子数越多,半径越小
绝对好事1年前查看全部
- 怎么判断离子半径大小?
 yumikite1年前1
yumikite1年前1 -
 所望于群 共回答了14个问题
所望于群 共回答了14个问题 |采纳率78.6%外层电子层数相当于穿的衣服,层数越多,衣服穿得多,一般都比较大,核电荷数是束缚电子乱跑的,电荷数越大,把衣服包得越紧,则半径越小.例:钠原子跟钾原子,三层衣服跟四层衣服的比较…钠原子跟铝原子,都是三层衣服,铝的束缚性比较强.1年前查看全部
- 盐类水解,离子怎么排序?
 summerlele1年前2
summerlele1年前2 -
 fdlxw 共回答了26个问题
fdlxw 共回答了26个问题 |采纳率76.9%以Na2CO3溶液为例.1.首先,由于一般盐的水解都是比较微弱的,所以,溶液中Na+和CO32-最多.在此基础上,显然Na+>CO32-2.CO32-是弱酸根,会发生水CO32-+H2O==(可逆号)HCO3-+OH-由于OH-的生成,使溶液显碱性,...1年前查看全部
- 离子守恒概念
 天之涯q1年前1
天之涯q1年前1 -
 在ll休息 共回答了17个问题
在ll休息 共回答了17个问题 |采纳率100%离子守恒:是指化合物或溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等.
离子守恒又称为电中性原理,在解溶液离子的物质的量或物质的量浓度问题时有妙用.1年前查看全部
- 原子,分子,离子怎么区别
 8aca82661年前2
8aca82661年前2 -
 cc的肋骨007 共回答了21个问题
cc的肋骨007 共回答了21个问题 |采纳率100%分子是由原子组成的,比如氢气是由两个氢原子组成的.而离子则是原子得电子或失电子形成的,比如氢原子得一个电子形成氢离子.在书面进行区分时,原子一般只有一个,如H、P、O.分子则有两个或两个以上原子,如Hcl、CaO.离子在右上角有正负号1年前查看全部
- 怎样区分原子,离子,分子.
 xinjieyy1年前1
xinjieyy1年前1 -
 zl20001216 共回答了22个问题
zl20001216 共回答了22个问题 |采纳率86.4%1.分子是构成物质的一种粒子.
大多数的物质都是由分子构成的.如氧气由氧分子构成;水由水分子构成;硫酸由硫酸分子构成等.
2.分子是保持物质化学性质的最小粒子
(1)“保持”是指构成物质的每个分子与该物质的化学性质相同.如保持氧气的化学性质的最小粒子是氧分子.
(2)物质的性质有物理性质和化学性质,分子只能保持其化学性质,不能说成是物质的性质,因为物质的物理性质(如熔点、沸点、硬度、密度等)都是该物质大量分子聚集体所表现的属性.如大量氧分子聚集成的液态氧呈淡蓝色.
(3)分子是由原子构成的.如1个氧分子由2个氧原子构成.
二.原子
1.原子也是构成物质的一种粒子.
金属、稀有气体、金刚石和石墨等都是由原子直接构成的物质.如汞由汞原子构成,氦气由氦原子构成.
2.原子是化学变化中的最小粒子.在化学反应中分子可分成原子,但原子在化学反应中不能再分成更小的粒子,而是原子又重新组合成新的分子,这就是化学反应的本质.如加热红色氧化汞时,氧化汞分子分解为氧原子和汞原子,每2个氧原子结合成1个氧分子,许多汞原子聚集成金属汞.
三.离子
1.离子也是构成物质的一种粒子.
由离子构成的物质有:大多数盐、碱和活泼金属氧化物.如氯化钠由钠离子和氯离子构成,氢氧化钾由钾离子和氢氧根离子构成.
2.离子是带电的原子或原子团
带正电荷的原子或原子团叫做阳离子,带负电荷的原子或原子团叫做阴离子.典型阳离子有等,典型阴离子有、等.阳离子和阴离子是不能独立存在的,它们必须共存于离子化合物或溶液中,并且由于阳离子所带正电荷总数和阴离子所带负电荷总数相等,因此化合物或溶液不显电性.
3.离子在化学反应中有可能再分.
当离子为单原子的离子时,在化学反应中不能再分;当离子为原子团时,它在许多化学反应中好像一个原子一样作为一个整体参加反应,反应前后保持不变,但它毕竟不是一个原子,在某些化学反应中,原子团也可能发生变化.如碱式碳酸铜、氯酸钾等物质中的会因受热而发生变化.1年前查看全部
- 怎样区分离子,原子,分子
 的确良931年前1
的确良931年前1 -
 柠檬se泡沫 共回答了21个问题
柠檬se泡沫 共回答了21个问题 |采纳率85.7%说很难说清楚的,举个例子吧
分子:如O2;O3;分别是氧分子和臭氧分子.O2是两个氧原子够成的;O3是由3个氧原子构成的
原子:O:氧原子;
离子:原子失去或得到电子就成了离子
离子一般在右上角标有价态.离子还有离子团1年前查看全部
- 如何区分元素,分子,原子,离子
 1727261411年前1
1727261411年前1 -
 xieping520 共回答了15个问题
xieping520 共回答了15个问题 |采纳率86.7%没错,答案是元素.
这个化学方程式里面Fe出现了两次,第一次是单质,第二次是铁离子.
另外,凡是出现Fe的都可以称为铁元素,包括单质啊,离子啊所有的.
元素是有相同核电荷数的原子,这里的原子包括离子,例如氯化钠是由氯元素和钠元素组成的.
而离子就是带电的原子或原子团.也就是说,元素符号旁边有加号或者是减号的.
有些物质是由离子直接构成比如NaCl,属于离子晶体.有些物质是由分子构成的,比如水.
分子跟离子的区别就是分子基本是电子对的偏移,而离子多是电子完全失去.
分子靠共价键结合在一起,离子靠正负电荷相吸靠在一起.
也就是说氯化钠中不存在分子,它是一堆离子堆在一起,而同样的水中也不存在氢离子(其实是存在的,因为水有少量的电离,而这个氢离子的浓度就是pH值)
另外,金属单质和稀有气体都是由原子直接构成的,他们之中既没离子也没分子.1年前查看全部
- 原子,分子,离子这些属于化学还是物理?
原子,分子,离子这些属于化学还是物理?
那么对于这一类,我们称为什么? 星宇99981年前4
星宇99981年前4 -
 爱宋 共回答了27个问题
爱宋 共回答了27个问题 |采纳率77.8%和物理、化学都有关系
物理化学 或 化学物理学1年前查看全部
- 怎样判断离子能否共存
 ywp20031231年前1
ywp20031231年前1 -
 独醉倚斜阳 共回答了20个问题
独醉倚斜阳 共回答了20个问题 |采纳率95%主要是离子间会反应的.反应一般在高中就是生成沉淀.水.和气体的.就是由强电解质相互反应生成难电离的物质.还有的就是要注意水解.注意题目给出的离子.比如叫你确定某溶液种存在的离子、你能排除的要马上排除1年前查看全部
- 怎样判断离子共存
 湖北胖子1年前1
湖北胖子1年前1 -
 vdjk43t 共回答了21个问题
vdjk43t 共回答了21个问题 |采纳率90.5%总结如下
1.由于发生复分解反应,离子不能大量共存.
(1)有气体产生.如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存.
(2)有沉淀生成.如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、 Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存.
(3)有弱电解质生成.如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN -、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存.
*(4)一些容易发生水解的离子,在溶液中的存在是有条件的.如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在.这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应.如3AlO2-+ 3Al3++6H2O=4Al(OH)3↓等.
2.由于发生氧化还原反应,离子不能大量共存.
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存.如S2-、HS-、SO32-、I-和Fe3+不能大量共存.
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存.如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32 -、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+= 3S↓+3H2O反应不能共在.H+与S2O32-不能大量共存.
*3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存.
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存.
思维技巧点拨
1.首先必须从化学基本理论和概念出发,搞清楚离子反应的规律和“离子共存”的条件.在中学化学中要求掌握的离子反应规律主要是离子间发生复分解反应和离子间发生氧化反应,以及在一定条件下一些微粒(离子、分子)可形成络合离子.“离子共存”的条件是根据上述三个方面统筹考虑、比较、归纳整理而得出.因此解决“离子共存”问题可从离子间的反应规律入手,逐条梳理.
2.审题时应注意题中给出的附加条件.
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等.
②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+.
③MnO4-,NO3-等在酸性条件下具有强氧化性.
④S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”.
3.审题时还应特别注意以下几点:
(1)注意溶液的酸性对离子间发生氧化还原反应的影响.如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存; MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存.
(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存.
如HCO3-+OH-=CO32-+H2O(HCO3-遇碱时进一步电离);
HCO3-+H+=CO2↑+H2O1年前查看全部
- 离子 (24 18:17:31)
离子 (24 18:17:31)
NH4+、OH-、NH3、H2O、H3+O、Al3+中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓苛性钠溶液,产生的现象有:a、溶液中出现白色沉淀b、有刺激性气味的气体放出c、沉淀逐渐增多d、沉淀完全消失e、沉淀逐渐减少
(1) 该复盐在溶液中的电离方程式是?
(2) 上述各实验现象由先到后出现的正确顺序是(填写序号) ul841年前4
ul841年前4 -
 nmghh1970 共回答了17个问题
nmghh1970 共回答了17个问题 |采纳率88.2%(1)Al(NH4)(SO4)2=Al3+ + NH4+ + SO42-
(2)Al3+ + 3OH- = Al(OH)3↓
NH4+ + OH- =NH3·H2O
NH3·H2O=NH3↑+H2O
Al(OH)3 + OH- = AlO2- +2H2O
acbed1年前查看全部
- 怎样比较离子,原子半径大小
 189312261年前1
189312261年前1 -
 黎孝春 共回答了15个问题
黎孝春 共回答了15个问题 |采纳率80%比较微粒半径大小的依据——“三看规则”
一看电子层数:在电子层数不同时,电子层数越多,半径越大;
二看核电荷数:在电子层数相同时,核电荷数越大,半径越大;
三看电子数:在电子层数和核电荷数都相同时,电子数越多,半径越大.1年前查看全部
- 分子,原子,离子写法
 哪有哪有1年前3
哪有哪有1年前3 -
 可爱小豆豆 共回答了18个问题
可爱小豆豆 共回答了18个问题 |采纳率83.3%O2,氧分子
O,氧原子
O2-,氧离子1年前查看全部
大家在问
- 1一个函数方程如下,y=x^2+kx+3,求当K为何值时该函数得最小值为整数?
- 2金钱等于一切 的英文翻译
- 3朋友多等于没有朋友 英文翻译
- 4英语翻译3,少喝点酒,4,你忙吧
- 5六年级下册的数学暑假作业的第34页思考题怎么做苏教版
- 6五年级下册数学长江作业本答案
- 7五年级上册长江作业本同步练习册 多边形的面积 第二,第三课时答案.
- 8圣诞老人的礼物会是什么?请问这句话的英文怎么写..
- 9用一根绳子环绕一棵大树,若环绕大树4周,则绳子还多3.5尺;若环绕大树6周,则绳子还少2.5尺
- 10非常需要您的付款用英语怎么说
- 11光滑的平面左边有m个小球以v向右运动 右边n个小球以同样的速度向左运动 球的质量相同 且发生完全弹性碰撞
- 12它负责,慈爱,勇敢,辛苦,是因为它有了一群鸡雏.这一句话都是表示___关系的句子
- 13质量为m的物体,以速度v运动,在水平面上经一段位移而停止,若将此物体用力拉回原位
- 14太阳刚出来时是离人近还是离人远
- 15化学中决定元素种类的是什么呢?