亚硝酸根的鉴定中,加醋酸作用什么
 hgjybn2022-10-04 11:39:542条回答
hgjybn2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 wss235 共回答了18个问题
wss235 共回答了18个问题 |采纳率88.9%- 提供H+啊.你是做棕色环实验吗?要发挥亚硝酸根的氧化性,得在酸性环境下,弱酸性就行了,醋酸就是提供这个酸性环境.
- 1年前
 99flyant 共回答了20个问题
99flyant 共回答了20个问题 |采纳率95%- 防氧化
- 1年前
相关推荐
- 亚硝酸银的颜色别跟我说是硝酸银和亚硝酸,是个人都知道这是错的.
 lyy884591年前2
lyy884591年前2 -
 冰之风云 共回答了11个问题
冰之风云 共回答了11个问题 |采纳率100%淡黄色,难溶于水1年前查看全部
- 一氧化氮与二氧化氮和水反应生成亚硝酸的方程式
一氧化氮与二氧化氮和水反应生成亚硝酸的方程式
是可逆反应吗? 阿紫71年前1
阿紫71年前1 -
 也凑个热闹2 共回答了13个问题
也凑个热闹2 共回答了13个问题 |采纳率100%NO + NO2 + H2O = 2HNO2
不是可逆反应1年前查看全部
- 下列事实能说明亚硝酸是弱电解质的是:
下列事实能说明亚硝酸是弱电解质的是:
①亚硝酸钠溶液的PH大于7②用HNO 2 溶液做导电试验,灯泡很暗
③HNO 2 溶液不与Na 2 SO 4 溶液反应④0.1mol·L —1 HNO 2 溶液的PH=2.1A.①②③ B.②③④ C.①④ D.①②④  黑影01201年前1
黑影01201年前1 -
 5201314ZXY 共回答了16个问题
5201314ZXY 共回答了16个问题 |采纳率87.5%C
1年前查看全部
- 酸与亚硝酸反应释放的氮气中,氨基酸的贡献是多少
 asdffd1年前2
asdffd1年前2 -
 gongyingzheng 共回答了15个问题
gongyingzheng 共回答了15个问题 |采纳率86.7%氨基酸与亚硝酸反应所释放的氮气中,氨基酸的贡献是 50%.1年前查看全部
- 氨气在微生物的作用下分部反映 就是先生成亚硝酸,在生成硝酸
 极目天下1年前2
极目天下1年前2 -
 珍惜对方 共回答了21个问题
珍惜对方 共回答了21个问题 |采纳率95.2%当然不一定的
微生物
太多种类了
固氮菌如根瘤菌 异养需氧型 消费者 有机物 将N2转换成 有机物
N2 + 6H+ + nMg-ATP +6e-(酶)→2NH3+nMg-ADP+nPi
然而还有很多硝化微生物和反硝化微生物
非常复杂的1年前查看全部
- 邻氨基苯甲酸与呋喃在亚硝酸中反应的机理
邻氨基苯甲酸与呋喃在亚硝酸中反应的机理
产物就像苯炔与呋喃D-A反应的产物一样,就是不知道怎么反应上去的 差强人意1年前1
差强人意1年前1 -
 cestlavie77 共回答了19个问题
cestlavie77 共回答了19个问题 |采纳率100%能不能给点提示线索?反应生成什么或者大概是什么类型的反应?翻了半天书也没找到……
嗯找到了,首先那个氨基会和亚硝酸发生重氮化反应,生成一个邻重氮基苯甲酸根,就是在苯环上连一个COO-和一个NN+,处于邻位.然后这个物质会脱去一个CO2和一个N2,生成苯炔.然后你就知道了,苯炔和呋喃发生D-A反应.
具体的你可以去找邢其毅的基础有机化学看看,在重氮化那部分提到苯炔的生成机理.1年前查看全部
- 亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解.
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解.
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为______(填化学式).
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是______(填序号).
a.稀硫酸b.二氧化碳c.二氧化硫d.磷酸
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列横线上:______+______
上述反应后废水的pH值将______(填“增大”、“减小”或“不变”).
(4)向20mL 0.01mol•L-1的NaNO2溶液中加入10mL 0.01mol•L-1的AgNO3溶液,一段时间后,溶液中的c(Ag+)=______.(已知:KSP(AgNO2)=2×10-8 mol2•L-2) 飞的sakura1年前1
飞的sakura1年前1 -
 kittyleelu 共回答了13个问题
kittyleelu 共回答了13个问题 |采纳率92.3%解题思路:(1)亚硝酸钠是强碱弱酸盐,其溶液呈碱性,向亚硝酸钠溶液中加入酸,会促进亚硝酸钠水解;HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;
(2)根据强酸制取弱酸分析,亚硝酸具有强氧化性,能氧化具有还原性的物质;
(3)亚硝酸钠具有氧化性,金属铝具有还原性,碱性条件下,二者发生氧化还原反应生成偏铝酸盐和一水合氨;根据反应方程式中氢氧根离子浓度变化来判断溶液pH变化;
(4)亚硝酸根离子与银离子反应生成亚硝酸银沉淀,可以根据KSP(AgNO2)反应的银离子的量计算.(1)碘离子被氧化为碘单质时,所有的碘元素化合价升高了2价,消耗碘离子是2mol,亚硝酸钠中氮元素化合价是+3价,2mol的亚硝酸钠得到2mol电子时,则需氮元素的化合价降为+2价,所以产物中含氮的物质为NO;
故答案为:NO;
(2)浓NaNO2溶液中通入二氧化碳,会发生反应生成碳酸钠,在酸性条件下会发生化学反应;如果通入二氧化硫,会被亚硝酸氧化为硫酸,即二氧化硫具有还原性,亚硝酸具有氧化性导致;
故答案为:bc;
(3)亚硝酸钠具有氧化性,金属铝具有还原性,碱性条件下,二者发生氧化还原反应生成偏铝酸盐和一水合氨,离子反应方程式为:2Al+NaNO2+NaOH+2H2O=2NaAlO2+NH3.H2O;该反应中氢氧根离子参加反应,导致溶液中氢氧根离子浓度减小,则溶液的pH减小;
故答案为:NaNO2;2Al;减小;
(4)根据题给数据可判断亚硝酸钠过量,银离子将被尽可能的沉淀,剩余NaNO2的物质的量浓度c=
20×10−3L×0.01mol/L−10×10−3L×0.01mol/L
(20+30)×10−3L=0.2mol/L,根据KSP(AgNO2)=c(NO2-)•c(Ag+)=0.2mol/L•c(Ag+)=2×10-8 mol2•L-2,解得c(Ag+)=6×10-6mol/L.
故答案为:6×10-6mol/L.点评:
本题考点: 亚硝酸盐;氧化还原反应方程式的配平;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了氧化还原反应、根据离子反应方程式进行计算等知识点,会根据元素化合价变化确定反应物、生成物,再结合原子守恒、转移电子守恒书写方程式,正确书写方程式是解本题关键,难度中等.1年前查看全部
- 为什么二氧化氮与氢氧化钠会发生歧化反应,为什么会生成亚硝酸根呢,
为什么二氧化氮与氢氧化钠会发生歧化反应,为什么会生成亚硝酸根呢,
碱歧化酸归中,那么二氧化氮与氢氧化钠的水溶液呈碱性么
还有,一氧化氮,二氧化氮和氢氧化钠的反应是归中反应吧,那么
他们的水溶液呈酸性? 启富ee1年前1
启富ee1年前1 -
 面包妹妹 共回答了16个问题
面包妹妹 共回答了16个问题 |采纳率93.8%题目提得有点混乱,看不大明白
2NO2+2NaOH=NaNO2+NaNO3+H2O,歧化;水溶液应该偏碱性,因为硝酸钠不水解,亚硝酸钠水解呈弱碱性;
NO+NO2+2NaOH=2NaNO2+H2O,归中;水溶液同样显弱碱性,因为NaOH为强碱而HNO2为中强酸,水解显弱碱性.
你理解的或者说你背诵的知识点有问题,高中范围内盐溶液的酸碱性主要通过水解来判断,你应该温习一下水解那一节1年前查看全部
- 亚硝酸使酸性高锰酸钾溶液褪色的方程中,高锰酸钾是强氧化剂,而氢离子遇硝酸根亚硝酸根时不是具有氧化性吗
亚硝酸使酸性高锰酸钾溶液褪色的方程中,高锰酸钾是强氧化剂,而氢离子遇硝酸根亚硝酸根时不是具有氧化性吗
两个氧化剂放一起怎么氧化还原反应啊,还是说一个氧化性较弱的就可以当做还原剂啊?还是他不是氧化还原反应?如果不是那是什么反应 wdl19771年前4
wdl19771年前4 -
 君0616 共回答了18个问题
君0616 共回答了18个问题 |采纳率88.9%分享知识,传递感动,【云水意】团队为您竭诚解答!这个和中国的一句古话很相似,“狭路相逢勇者胜”,他们是谁的氧化性强谁就是氧化剂,但是有一个前提,就是弱的必须还能被氧化.从电极电势来看,亚硝酸的氧化性可以比硝酸...1年前查看全部
- 氨在微生物作用下,与溶解在水中的氧气反应,生成亚硝酸和水
 克雷四波1年前2
克雷四波1年前2 -
 波自强 共回答了17个问题
波自强 共回答了17个问题 |采纳率82.4%2NH3+3O2=2HNO2+2H2O1年前查看全部
- 硝酸、亚硝酸、硫酸、亚硫酸、高锰酸、磷酸等高中常见酸,由什么氧化物溶于水生成
 sinba19801年前4
sinba19801年前4 -
 tempta 共回答了16个问题
tempta 共回答了16个问题 |采纳率87.5%3NO2+H2O===2HNO3+NO
N2O3+H2O===2HNO2
SO3+H2O===H2SO4
SO2+H2O===H2SO3
Mn2O7(绿色油状物)+H2O===2HMnO4(紫色)
P2O5+3H2O===2H3PO41年前查看全部
- (2012•太原三模)亚硝酸钠是一种工业盐,在生产、生活中应用广泛.现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸
(2012•太原三模)亚硝酸钠是一种工业盐,在生产、生活中应用广泛.现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分.
已知:
①NO+NO2+2OH-═2NO
+H2O−2
②气体液化的温度:NO2:21℃、NO:-152℃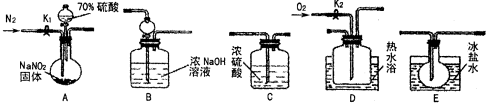
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):A→C→______→→______→______.
(2)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO.依据的现象是______.
②装置E的作用是______.
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为______.如果没有装置C,对实验结论造成的影响是______.
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是______.
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则CH4直接将NO2还原为N2的热化学方程式为______. twister11年前1
twister11年前1 -
 sfqrno1 共回答了16个问题
sfqrno1 共回答了16个问题 |采纳率100%解题思路:(1)根据各部分装置的作用进行连接;
(2)根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断,温度低于二氧化氮液化温度时,二氧化氮变成液态;
(3)氧气过量,进入B中可理解为先生成硝酸,硝酸再与氢氧化钠反应生成硝酸钠和水;
(4)根据反应物和生成物写出反应方程式;
(5)根据盖斯定律进行计算.(1)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,所以装置的连接为A→C→E→D→B,故答案为:E;D;B;
(2)①D中无色气体变成红色,说明含有NO气体,故答案为:D中出现红棕色气体;
②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,故答案为:冷凝使NO2完全液化;
(3)如果向D中通入过量O2,则装置B中二氧化氮、氧气和氢氧化钠反应生成硝酸钠和水,其反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O,如果没有装置C,二氧化氮和水反应生成一氧化氮,造成干扰,
故答案为:4NO2+O2+4NaOH=4NaNO3+2H2O;水蒸气存在,会与NO2反应产生NO,影响NO的检验;
(4)通过以上分析知,该反应中生成二氧化氮、一氧化氮,同时还有硫酸钠、水生成,所以反应方程式为2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O,
故答案为:2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O;
(5)CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1 ①
CH4(g)+4NO(g)═2 N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1 ②
将方程式[①+②/2]得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-[−574kJ/mol−1160kJ/mol/2]=-867kJ•mol-1 ,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1 .点评:
本题考点: 氮的氧化物的性质及其对环境的影响;用盖斯定律进行有关反应热的计算;探究物质的组成或测量物质的含量.
考点点评: 本题考查了实验方案设计、物质的检验、盖斯定律,明确物质的性质是解本题关键,根据实验现象确定物质的性质,注意仪器的连接顺序,为易错点.1年前查看全部
- 分子式为C6H15N的有机物A,与亚硝酸反应是放出氮气,还得到几种其他有机物;
分子式为C6H15N的有机物A,与亚硝酸反应是放出氮气,还得到几种其他有机物;
其中之一B可发生碘仿反应,B与浓硫酸作用生成分子式为C6H12的化合物C;C可被KMnO4氧化,生成乙酸和2-甲基丙酸.试写出A,B,C的构造式及有关反应式 cmyqc1年前1
cmyqc1年前1 -
 各地方嘎 共回答了26个问题
各地方嘎 共回答了26个问题 |采纳率88.5%由不饱和度可知A是脂肪伯胺.
由A与HNO2反应得到B,且B能发生碘仿反应,所以B一定是2位醇.
所以C是烯.
而C被KMnO4切断碳链后得到乙酸和2-甲基丙酸,推出C应该是4-甲基-2-戊烯.
逆推,得到B是4-甲基-2-戊醇,A是4-甲基-2-氨基戊烷.1年前查看全部
- 下列食品添加剂与其说明错误的是( ) A.食醋--酸味剂 B.亚硝酸铀--咸味剂 C.碳酸氢钠--疏松剂 D.苯甲酸-
下列食品添加剂与其说明错误的是( ) A.食醋--酸味剂 B.亚硝酸铀--咸味剂 C.碳酸氢钠--疏松剂 D.苯甲酸--防腐剂  comingfish1年前1
comingfish1年前1 -
 luyancui 共回答了23个问题
luyancui 共回答了23个问题 |采纳率100%A.醋酸具有酸性,具有酸味,能作调味品,具有调味的作用,对人体健康没有危害,故A正确;
B.亚硝酸盐具有毒性,不能用作调味品,故B错误;
C.碳酸氢钠受热能分解生成二氧化碳,可以使食品变得疏松,能用作疏松剂,故C正确;
D.苯甲酸具有防腐性,可以用作防腐剂,故D正确.
故选B.1年前查看全部
- 亚硝酸在反应中既可以做氧化剂又可做还原剂当它做氧化剂时其还原产物可能是1、NO 2,NO2 3HNO3 4 N2
亚硝酸在反应中既可以做氧化剂又可做还原剂当它做氧化剂时其还原产物可能是1、NO 2,NO2 3HNO3 4 N2
5 NH3
A1 3 B1 2 4 C1 4 5 D全部 csy19878221年前1
csy19878221年前1 -
 赖吻司机 共回答了20个问题
赖吻司机 共回答了20个问题 |采纳率85%C,氧化物化合价降低,得电子,被还原,亚硝酸中氮的化合价是+3,因此是1451年前查看全部
- 硝酸根 与亚硝酸根或亚硫酸跟在酸性条件下可以共存么?能写一下方程式么?
 龙行天下3271年前1
龙行天下3271年前1 -
 大雁想飞 共回答了14个问题
大雁想飞 共回答了14个问题 |采纳率92.9%不能.2NO3 - + 3SO3 2- + 2H+ = 2NO + 3SO4 2- + H2O1年前查看全部
- 亚硝酸(HNO2)的酸酐是什么
 OKLONG20041年前2
OKLONG20041年前2 -
 qingfengxl 共回答了8个问题
qingfengxl 共回答了8个问题 |采纳率87.5%HNO2是亚硝酸,其中N是+3价.故亚硝酸酐中的
N也是+3价,为N2O31年前查看全部
- 亚硝酸是弱电解质的依据有哪些?越多越好
 zhaoyiyt1年前1
zhaoyiyt1年前1 -
 hdftgr 共回答了19个问题
hdftgr 共回答了19个问题 |采纳率94.7%1,常温下,1mol/L 的亚硝酸溶液pH>1
2,亚硝酸钠(即亚硝酸的强碱弱酸盐)显示弱碱性1年前查看全部
- 用亚硝酸做导电实验,灯泡暗,则可以说明亚硝酸是弱电解质吗,为什么?
 delphicg1年前1
delphicg1年前1 -
 不填就不填 共回答了18个问题
不填就不填 共回答了18个问题 |采纳率83.3%不能
原因:没有与等浓度的强电解质如HCl对比,因为影响导电能力有电离程度,也有溶液的浓度1年前查看全部
- 亚硝酸生成硝酸是氧化还是还原 亚硝酸分解,对於生成的硝酸来说,是被氧化了还是被还原了
 flyses1年前4
flyses1年前4 -
 天心maggie 共回答了20个问题
天心maggie 共回答了20个问题 |采纳率80%亚硝酸生成硝酸,其中N的化合价升高了,被氧化了.
被氧化还是被还原,指的都是反应物,而不是生成物.
不论什么反应,只要元素的化合价升高了,就是不氧化了,化合价降低了,就是被还原了.
对于同一元素,有升高,有降低时,是化合价升高了的元素被氧化了,化合价降低了的元素被还原了.1年前查看全部
- 在强酸条件下,硫酸根、硫离子、硫代硫酸根、亚硫酸根、亚硝酸根、硝酸跟、氯离子、溴离子、碘离子、磷酸根十种离子中哪些可以大
在强酸条件下,硫酸根、硫离子、硫代硫酸根、亚硫酸根、亚硝酸根、硝酸跟、氯离子、溴离子、碘离子、磷酸根十种离子中哪些可以大量共存
 tiansha1年前1
tiansha1年前1 -
 qqjie520 共回答了22个问题
qqjie520 共回答了22个问题 |采纳率86.4%硫酸根硝酸根氯离子1年前查看全部
- 亚硝酸根与二价铁离子反应生成NO,为什么不能生成氮气
 lanbing1231年前1
lanbing1231年前1 -
 lejiashu 共回答了21个问题
lejiashu 共回答了21个问题 |采纳率95.2%二价铁的还原性不够强吧.要把亚硝酸根还原成氮气,得多强的还原性啊1年前查看全部
- 氨基苯、氨基环己烷都能和亚硝酸反应产生氮气 为什么说可以用亚硝酸来呢?
 bedf1年前2
bedf1年前2 -
 lkjhgfdsamnbvcx 共回答了17个问题
lkjhgfdsamnbvcx 共回答了17个问题 |采纳率94.1%是都能产生氮气.氨基环己烷在通常状态下反应就可以得到氮气;而氨基苯则是要到加热状态下才可以,实际上这里包含两个步骤:第一氨基苯与亚硝酸在0-5℃反应生成重氮盐,现象是氨基苯溶解在亚硝酸中了,第二步是重氮盐受热分解得到氮气.
----------------------------------------
可以用亚硝酸鉴别这两个,条件就是低温.在低温下氨基苯是得不到氮气的1年前查看全部
- 滴定亚硝酸根 亚铁 菲罗啉指示剂的配置方法
 lqw6661年前1
lqw6661年前1 -
 ranwd 共回答了11个问题
ranwd 共回答了11个问题 |采纳率90.9%1,10-菲罗啉-硫酸亚铁铵混合指示液
称取1.6g1,10-菲罗啉及1g硫酸亚铁铵(或0.7g硫酸亚铁),溶于100mL水中,贮存于棕色瓶中.
希望能帮助你!
其他指示剂和指示液的制备
8.1 百里香酚蓝-酚酞混合指示液
取3份体积百里香酚蓝溶液(1g/L)和2份体积酚酞溶液(1g/L)混合均匀.
8.2 甲基红-亚甲基蓝混合指示液
将50mL甲基红溶液(2g/L)和50mL亚甲基蓝溶液(1g/L)混合.
8.3 酸性铬蓝K-萘酚绿B混合指示剂
称取0.1g酸性铬蓝K,0.1g萘酚绿B和20g干燥氯化钾,置于研钵中,充分研磨混匀,贮存于棕色广口瓶中.
8.4 溴百里(香)酚蓝-苯酚红混合指示液
0.08g溴百里酚蓝和0.1g苯酚红溶于20mL乙醇中,加水50mL,用氢氧化钠溶液(4g/L)调至pH为7.5(红紫色),再以水稀释至100mL.
8.5 溴甲酚绿-甲基橙混合指示液
6份体积溴甲酚绿溶液(1g/L)和1份体积甲基橙溶液(1g/L)混合.
8.6 溴甲酚绿-甲基红混合指示液
3份体积溴甲酚绿溶液(1g/L)与1份体积甲基红溶液(1g/L)混合,摇匀,贮存于棕色瓶中.
8.7 1,10-菲罗啉-硫酸亚铁铵混合指示液
称取1.6g1,10-菲罗啉及1g硫酸亚铁铵(或0.7g硫酸亚铁),溶于100mL水中,贮存于棕色瓶中.
8.8 甲基红指示液(1g/L)
称取0.10g甲基红,溶于乙醇,用乙醇稀释至100mL.
8.9 溴甲酚绿指示液(2g/L)
称取0.20g溴甲酚绿溶解于6mL氢氧化钠溶液(4g/L)和5mL乙醇中,用水稀释至100mL.
8.10 甲基橙指示液(1g/L)
称取0.10g甲基橙,溶于70℃水中,冷却,用水稀释至100mL.
8.11 酚酞指示液(10g/L)
称取1.0g酚酞,溶于乙醇,用乙醇稀释至100mL.
8.12 溴(甲)酚蓝指示液(1g/L)
称取0.10g溴酚蓝,溶于乙醇,用乙醇稀释至100mL.
8.13 钙指示液(钙羧酸指示剂)
称取0.20g钙指示剂〔2-羟基-1-(2-羟基-4-磺酸-1-萘偶氮)-3-萘甲酸〕(C21H14N2O7S)或其钠盐与10g在105℃干燥的氯化钠,置于研钵中研细混匀.贮存于棕色磨口瓶中.
8.14 铬黑T指示剂
将1.0g铬黑T与100.0g干燥的氯化钠,置于研钵中,研细混匀.贮存于棕色磨口瓶中.
8.15 铬黑T指示液(5g/L)
称取0.50g铬黑T和4.5g氯化羟胺,溶于乙醇中,用乙醇稀释至100mL,贮存于棕色瓶中.可保持数月不变质.
8.16 百里香酚蓝指示液(1g/L)
溶解0.10g百里香酚蓝于2.2mL氢氧化钠溶液(4g/L)和5mL乙醇中,稀释至100mL.
8.17 孔雀绿指示液(1g/L)
称取0.10g孔雀绿,溶于水,稀释至100mL.
8.18 二甲酚橙指示液(2g/L)
称取0.20g二甲酚橙,溶于水,稀释至100mL.
8.19 二苯偶氮碳酰肼指示液(5g/L)
将0.50g二苯偶氮碳酰肼(C13H12ON4)溶于乙醇,用乙醇稀释至100mL.溶液贮存于冰箱中.
8.20 对硝基苯酚指示液(1g/L)
称取0.10g对硝基苯酚,溶于乙醇,用乙醇稀释至100mL.
8.21 苯酚红指示液(0.2g/L)
将0.05g苯酚红,2.85mL氢氧化钠溶液(2g/L)和5mL乙醇一起温热,待溶解后,加入50mL乙醇,用水稀释至250mL.
8.22 达旦黄指示液(0.4g/L)
称取0.04g达旦黄,溶于乙醇中,用乙醇稀释至100mL.
8.23 硫酸铁铵指示液(80g/L)
溶解8.0g硫酸铁铵〔NH4Fe(SO4)2.12H2O〕在约75mL水中,过滤,加几滴硫酸,稀释至100mL.
8.24 淀粉指示液(10g/L)
8.24.1 1g可溶性淀粉与5mg红色碘化汞混合,并用足够冷的水调成稀薄的糊状,在不断搅拌下,慢慢注入100mL沸水中,煮沸混合物,充分搅拌至稀薄透明的流动形式,冷却后使用.
8.24.2 将1g可溶性淀粉与5mL水制成糊状,搅拌下将糊状物加入100mL水中,煮沸几分钟后冷却,使用期限二周.溶液中加入几滴甲醛溶液,使用期限可延长数月.1年前查看全部
- 硝酸和盐酸反应生成亚硝酸和氯气 求配平
 19901321年前1
19901321年前1 -
 jorker0923 共回答了19个问题
jorker0923 共回答了19个问题 |采纳率89.5%其实是可以反应的.王水是浓硝酸和浓盐酸按1:3的比例混合而成的溶液.在王水中硝酸和盐酸发生这样的反应:HNO3+3HCl=NOCl+Cl2+2H2O,生成亚硝酰氯NOCl等强氧化性物质,所以才可以将金、铂等金属溶解.1年前查看全部
- 亚硝酸纳溶液PH大于七,为什么说明它是弱电解质
 胭脂奴1年前1
胭脂奴1年前1 -
 一介小生 共回答了16个问题
一介小生 共回答了16个问题 |采纳率87.5%亚硝酸钠溶液的PH>7,根据质子酸碱理论,有水解方程式:
(NO2-)+H2O=HNO2+HO-
所以是弱酸跟,强酸强碱盐是不水解的.1年前查看全部
- 可以用亚硝酸来鉴别 氨基苯和氨基环己烷
 风雨道人1年前1
风雨道人1年前1 -
 hudixin 共回答了15个问题
hudixin 共回答了15个问题 |采纳率80%可以,亚硝酸与氨基苯作用生成重氮盐,现象是溶解了.亚硝酸与氨基环己烷反应,放出N2,现象是有气泡,可以鉴别1年前查看全部
- 一氧化氮和二氧化氮如何反应生成亚硝酸?
 lovey1231年前2
lovey1231年前2 -
 bluebirdwxy 共回答了12个问题
bluebirdwxy 共回答了12个问题 |采纳率83.3%两种物质共同和水反应,也可以是单种和氧、水一起反应1年前查看全部
- 亚硝酸钠和磷酸反应,生成亚硝酸,为何能证明亚硝酸是弱电解质?
 fatboat1年前2
fatboat1年前2 -
 zdl6b 共回答了16个问题
zdl6b 共回答了16个问题 |采纳率81.3%磷酸就是弱电解质,说明亚硝酸比磷酸还弱.1年前查看全部
- 亚硝酸的反应亚硝酸根和高锰酸根还有氢离子为什么可以反应?亚硝酸根和氢离子在一起不是有比硝酸还强的氧化性吗为什么可以被高锰
亚硝酸的反应
亚硝酸根和高锰酸根还有氢离子为什么可以反应?
亚硝酸根和氢离子在一起不是有比硝酸还强的氧化性吗为什么可以被高锰酸根氧化? sl1601年前2
sl1601年前2 -
 zhangyongyue 共回答了17个问题
zhangyongyue 共回答了17个问题 |采纳率100%高锰酸根中锰为+7价,是金属中罕见的价态.它极容易得电子,所以表现强氧化性.亚硝酸根和氢离子生成的亚硝酸具有一定的还原性,所以可以反应.(对比高氯酸中+7价氯)1年前查看全部
- 浅绿色亚硝酸铁与稀盐酸反应 颜色变化
 红色粉末1年前1
红色粉末1年前1 -
 xile92 共回答了27个问题
xile92 共回答了27个问题 |采纳率81.5%是硝酸亚铁吧..
硝酸亚铁遇到盐酸之后,溶液中就含有了氢离子和硝酸根离子,就相当于溶液里面有了硝酸,于是亚铁离子将会被氧化为3价铁离子,于是颜色由浅绿色变为黄色,反应如下
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O1年前查看全部
- 加热硝酸和亚硝酸分别能分解生成什么?
 幸福的水滴1年前1
幸福的水滴1年前1 -
 森林狼966 共回答了15个问题
森林狼966 共回答了15个问题 |采纳率80%加热硝酸:生成NO2+O2+H2o
加热亚硝酸浓溶液分解生成NO和NO21年前查看全部
- 硝酸和亚硝酸银怎么反应硝酸银和亚硝酸不是都易溶的吗
 一凡20001年前2
一凡20001年前2 -
 hlxshan 共回答了27个问题
hlxshan 共回答了27个问题 |采纳率96.3%楼上,亚硝酸是+3价~
在酸性条件,怎么会生成AgOH ?
2HNO3+ AgNO2 = 2NO2+ AgNO3+H2O1年前查看全部
- 亚硫酸、碳酸、次氯酸、硅酸、亚硝酸.这几种酸的强度.
 gyele1年前1
gyele1年前1 -
 restone-zdh 共回答了22个问题
restone-zdh 共回答了22个问题 |采纳率86.4%酸性由强到弱为:亚硫酸,亚硝酸,碳酸,次氯酸,硅酸1年前查看全部
- 亚硫酸和亚硝酸是强酸还是弱酸
 地狱里的妖精1年前2
地狱里的妖精1年前2 -
 lovelovevicki 共回答了18个问题
lovelovevicki 共回答了18个问题 |采纳率94.4%都为弱酸,亚硫酸有对应Ka1和Ka2,亚硝酸有Ka.你不能确定可以查书本上附表有ka就是弱酸,同理有Kb代表弱碱而有几个Ka或Kb值代表该物质能几步电离1年前查看全部
- 亚硝酸和硝酸氧化性谁更强?亚硝酸为什么有时候在稀溶液时氧化性强?为什么?还有,为什么硝酸在加入二氧化氮之后氧化性会变强?
 iuiuioio1年前1
iuiuioio1年前1 -
 tuiguangyuan 共回答了15个问题
tuiguangyuan 共回答了15个问题 |采纳率80%亚硝酸氧化性更强.
硝酸还原的机理有一步是到NO2,因此加入NO2可以使反应变快(相当于催化剂,可以参考硝酸还原机理)1年前查看全部
- 溴水和亚硝酸氧化性谁强
 张三青青1年前1
张三青青1年前1 -
 生灵泪多 共回答了15个问题
生灵泪多 共回答了15个问题 |采纳率100%酸性由大到小:
高氯酸,硫酸,氯酸,硝酸,溴酸,碘酸,亚磷酸,亚硫酸,亚氯酸,磷酸,亚硝酸,碳酸,次氯酸,硼酸.
氧化性大小:(这里部分酸表现为H+的性质,氧化性一致.而亚磷酸则表现为强还原性)
HClO≈HClO2>HClO3>HClO4>HBrO3>HNO3>HIO3>HNO21年前查看全部
- 化学因素如亚硝酸为什么使基因突变呢?
 寒秋草1年前1
寒秋草1年前1 -
 疯之力九头蛇公 共回答了16个问题
疯之力九头蛇公 共回答了16个问题 |采纳率93.8%亚硝酸使碱基脱氨,导致突变.如C-U,A-I等.1年前查看全部
- 亚硝酸和硝酸哪个氧化性强
 suntinsquare1年前6
suntinsquare1年前6 -
 f6g5hj11 共回答了19个问题
f6g5hj11 共回答了19个问题 |采纳率89.5%根据标准电极电势可知
亚硝酸中,氮元素为+3价,数据为0.98
硝酸中,氮元素为+5价,数据为0.957
亚硝酸的氧化性略强于硝酸.
HNO2可发生分
2HNO2 ==== HNO3 + NO
这是HNO2既是还原剂又是氧化剂,此反应放热且是熵增反应.一切表明此反应是自发的.所以可以证明HNO3氧化性没有HNO2强.1年前查看全部
- 在某钠盐溶液中含有亚硫酸根离子、亚硝酸根离子,向溶液中加入盐酸,亚硫酸根与亚硝酸根如何反应?请...
在某钠盐溶液中含有亚硫酸根离子、亚硝酸根离子,向溶液中加入盐酸,亚硫酸根与亚硝酸根如何反应?请...
在某钠盐溶液中含有亚硫酸根离子、亚硝酸根离子,向溶液中加入盐酸,亚硫酸根与亚硝酸根如何反应?请求亲们~ 于杰的天空1年前1
于杰的天空1年前1 -
 超级替补999 共回答了21个问题
超级替补999 共回答了21个问题 |采纳率90.5%SO32- + 2NO2- + 2H+ = SO42- + 2NO↑ + H2O
应该是这样……1年前查看全部
- 25℃时,2L0.1mol亚硝酸溶液中含亚硝酸分子0.186mol则此条件下亚硝酸溶液的pH=其电离度α=稀释10倍后,
25℃时,2L0.1mol亚硝酸溶液中含亚硝酸分子0.186mol则此条件下亚硝酸溶液的pH=其电离度α=稀释10倍后,α将
25℃时,2L 0.1mol亚硝酸溶液中,含亚硝酸分子0.186mol,则此条件下亚硝酸溶液的pH=____,其电离度α=______;稀释10倍后,α将______(选填增大、减小或不变) yangshabecomegun1年前1
yangshabecomegun1年前1 -
 hongly 共回答了29个问题
hongly 共回答了29个问题 |采纳率89.7%pH=__2.2__,其电离度α=__0.07;稀释10倍后,α将_增大__(选填增大、减小或不变)1年前查看全部
- 下列反应不属于氧化还原反应的是A.3氯气+6KOH〓5KCL+KCLO3+3水B.2二氧化氮+2NaOH〓硝酸钠+亚硝酸
下列反应不属于氧化还原反应的是
A.3氯气+6KOH〓5KCL+KCLO3+3水
B.2二氧化氮+2NaOH〓硝酸钠+亚硝酸钠+水
C.SnCl4+2水〓SnO2+4HCl
D.NaOH+HCl〓水+NaCl guirongzhang12111年前3
guirongzhang12111年前3 -
 小不点wll 共回答了21个问题
小不点wll 共回答了21个问题 |采纳率90.5%C.SnCl4+2水〓SnO2+4HCl
D.NaOH+HCl〓水+NaCl
化合价前后不变1年前查看全部
- NO、NO2为什么属于不成盐氧化物?亚硝酸根是怎么形成的?
 普通宁1年前2
普通宁1年前2 -
 糜烂yy 共回答了18个问题
糜烂yy 共回答了18个问题 |采纳率100%不能跟酸起反应,又不能跟碱起反应而生成中心元素同价态盐和水,这类氧化物叫做不成盐氧化物.
但是NO2和NAOH反应生成两种盐(歧化) 故也看作
亚硝酸酸酐是N2O3 溶于水生成亚硝酸
(仅限于高中1年前查看全部
- 向呈碱性的NaNO2溶液中滴加稀亚硝酸至中性,问滴加过程中水电离平衡的移动?
向呈碱性的NaNO2溶液中滴加稀亚硝酸至中性,问滴加过程中水电离平衡的移动?
参考答案是水电离平衡往逆方向移动,急求解答 御景园1年前2
御景园1年前2 -
 ispark 共回答了20个问题
ispark 共回答了20个问题 |采纳率90%必须是逆向好吧.
由於加入水解的盐,会促进水的电离,因此实际上H2O所电离出来的H+=OH->10-7mol/L
当溶液中性的时候,H+=OH-=10-7mol/L,那明显是H2O被抑制了呀.1年前查看全部
- 硝酸和盐酸反应可以生成亚硝酸吗硝酸和盐酸反应生成亚硝酸 怎么配平?HNO3+HCL===HNO2+CL2这个怎么 配平?
 gsb199612231年前1
gsb199612231年前1 -
 p5280058 共回答了23个问题
p5280058 共回答了23个问题 |采纳率91.3%生成氯化钠和亚硝酸
NaNO2 + HCl = HNO2 + NaCl
亚硝酸不稳定,很快分解,放出气体.
2HNO2 = H2O + NO↑ + NO2↑1年前查看全部
- 再麻烦您一下,还想问一个亚硝酸根分解的问题
再麻烦您一下,还想问一个亚硝酸根分解的问题
生产中溶液需保持弱碱性,在酸性溶液中亚硝酸钙会发生分解,产物之一是一氧化氮,写出其离子反应方程式.我写的时候觉得是正三价的N变成了正二价的N,说明N是氧化剂,还需要找一个还原剂,我觉得氢离子没有还原性,所以是负二价的O体现还原性,所以认为生成的是氧气、水和一氧化氮.但答案上是生成一氧化氮、硝酸根和水.麻烦您帮指出以下我思路不对的地方. jasminesweet1年前1
jasminesweet1年前1 -
 kk依梦 共回答了12个问题
kk依梦 共回答了12个问题 |采纳率100%不麻烦滴^_^
你前面的思路很好——N从+3到+2,氧化剂已经有了,现在要找还原剂了.
-2价的氧元素(尤其是在酸根中的)的还原性是极差的,所以应该不是氧元素作为还原剂.
你需要记住一个事实,那就是,对于一个酸根来说,能把其中的-2价氧氧化的,一般是这样两种情况:
(1)如果中心元素不是最高价,那么它必须是非常强的氧化剂才行——高中常见的也只有氯元素(氯酸根、次氯酸根)能做到.
(2)除了这种情况,那就是当元素呈最高价时也能做到——像是硝酸根、高锰酸根这类.
而且这两种情况,一般都要在较高的温度下才能明显的发生.在溶液中是较为困难的.
亚硝酸根中的+3价氮是做不到的.
其实还有一个问题——氮自身被氧化到+4价,还是+5价呢?
容易发现,氮为+4的NO2在水中会发生反应,生成+2价的NO和+5价的硝酸.
这样看来,即使生成了+4价的NO2,也不能在水中存在,而会转化成硝酸.
所以总方程式是: 3NO2 - + 2H+ ==== 2NO↑ + NO3- + H2O1年前查看全部
- 亚硝酸根和氢碘酸的反应式
 yicai07581年前1
yicai07581年前1 -
 mapleH 共回答了13个问题
mapleH 共回答了13个问题 |采纳率100%NO2—+ 2I― + 4H+ == 2NO + I2 + 2H2O
您好,很高兴为您解答,OutsiderL夕为您答疑解惑
如果本题有什么不明白可以追问,如果满意记得采纳,手机客户端右上角评价点满意即可.
如果有其他问题请采纳本题后另发点击向我求助,答题不易,请谅解,谢谢.
祝学习进步1年前查看全部
- 亚硝酸(HNO2)既可做氧化剂也可做还原剂
亚硝酸(HNO2)既可做氧化剂也可做还原剂
当它在反应中作氧化剂时,可能生成的产物是( )
A.N2 B.NH3 C.N2O3 D.NO2
为什么
B错那意思就是说在NH3中N显+3价,H显-1价,那在NH4+中为什么N又显-3价呢?到底在NH3中N显+3价还是显-3价?预言家Mt - 魔法师 五级 说是+3,大浪淘沙留真金 - 千总 四级 说是-3 和你去看雪1年前3
和你去看雪1年前3 -
 kxgd 共回答了22个问题
kxgd 共回答了22个问题 |采纳率77.3%亚硝酸(HNO2)的N是正三价做氧化剂化合价降低 所以C D错
已知NH3中N显-3价 因为亚硝酸是弱氧化剂 不可能一下就从+3价降到—3价 所以B错 选A1年前查看全部
大家在问
- 1观察下列算式:3^2-1^2=8;4^2-2^2=12;5^2-3^2=16;6^2-4^2=20…… 由此你发现什么样
- 21.I have been studying computer for several years and I stil
- 3淮上喜会梁州故人 颔联运用了什么修辞手法,有什么效果? 尾联采用了何种抒情方式?表达了怎样的思想
- 4(m^2+i)(1+mi)要更仔细的讲解求M?更仔细讲解 =m^2+m^3i+i-m =m^2-m+(m^3+1)i 为
- 5找一些形容人心情急切却无能为力的诗句?
- 6证明积分收敛,但不一致收敛第3题
- 7如图,在 内部有两点 ,试确定在 内部再找一点P,使P到AO,BO的距离相等,且PM=PN.
- 8What()this?的()里用动词be怎么填
- 9印刷机双面印,我要问客户正印是几色,反印是几色,用英语怎么说
- 10要连线的聪明者 求知者 勤奋者 有志者赢得时间 利用时间 珍惜时间 抓紧时间 懒惰者 无为者 闲聊者 自满者放弃时间 丧
- 11a/7=b/8 a/b=
- 12失败乃成功之母的下一句是什么
- 13(2012•道外区二模)如果正五边形绕着它的中心旋转α角后与它本身重合,那么α角的大小可以是( )
- 14145×32-55×32简便方法怎么计算?
- 15日思夜想的东西得到了,如今时过境迁,得到后却又百无一用.请问用一两个成语该如何表述?
