水是很的弱电解质,为什么盐类还会水解形成比水更强一些的电解质
 etcentera2022-10-04 11:39:543条回答
etcentera2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 zz雄起 共回答了13个问题
zz雄起 共回答了13个问题 |采纳率76.9%- 很多反应都有一定的可逆性,盐类水解形成的电解质还是比水少得多.当然更详细的解释需根据平衡常数,水的离子积,和电离常数去分析.
- 1年前
 000119 共回答了3个问题
000119 共回答了3个问题 |采纳率- 水解过程为共轭酸生成共轭碱或共轭碱生成共轭酸的过程酸性越强,则共轭碱的碱性越弱,反之则相反水解程度越弱,则生成的共轭酸(碱)越强
- 1年前
 其实我不想走 共回答了12个问题
其实我不想走 共回答了12个问题 |采纳率- 你想问的是盐类为什么会在水中水解吧
水解的实质是某些离子能与水电离出的H+或OH-离子结合,从而促进水的电离,呈现出酸碱性
如NH4+ + H2O = NH3H2O + H+的实质是
1,H2O=H+ + OH-
2,NH4+ + OH- = NH3H2O 铵根离子与水电离出的OH-结合,根据平衡移动原理,减小生成物OH- 从而促进水的电离,多余的H+... - 1年前
相关推荐
- 在离子反应中 弱电解质 难溶物 为反应物时可拆吗?
 清枫晓月7092101年前1
清枫晓月7092101年前1 -
 巡城夜叉 共回答了14个问题
巡城夜叉 共回答了14个问题 |采纳率92.9%解析:不可以拆,
在化学反应的离子方程式中,凡是在水溶液中不能完全电离子都不可以拆,只有全部电离的才可以拆.
“氧化物 沉淀 弱酸 弱碱 水 气体 单质 过氧化物(如过氧化钠等)”不管是在反应物还是生成物中均不可以拆.1年前查看全部
- 弱电解质中的氢离子和氢氧根离子为啥抑制电离
 foxinlove1年前4
foxinlove1年前4 -
 高蹈名士 共回答了13个问题
高蹈名士 共回答了13个问题 |采纳率84.6%抑制什么电离?应该是抑制水的电离吧!因为弱酸中电离出来的氢离子,使水电离出来的氢离子浓度增大,水电离平衡左移,水的电离就受抑制.同理弱碱也是,电离出来的氢氧根同样使水电离平衡左移,水解程度减小,受抑制!1年前查看全部
- 怎么样一看就能判断出强电解质和弱电解质?我尤其是想知道怎么一下判断出是否完全电离?
 uome1年前3
uome1年前3 -
 遗体 共回答了13个问题
遗体 共回答了13个问题 |采纳率100%强电解质包括 1强酸 像H2SO4 HCl HNO3 等
2强碱 像NaOH BaOH CaOH KOH 等
3绝大部分的盐
弱电解质包括 1 弱酸(极弱酸 像醋酸 HF H2S 等 中强酸 H2SO3
2 弱碱 如 氨水 Fe(OH)2 Fe(OH)3 等
3 水 ,
参考别人的答案1年前查看全部
- 电解质强弱BaCO3,Na2CO3,Al,Fe(OH)3,石墨,KOH中哪些是强电解质哪些又是弱电解质,易导电的是?易与
电解质强弱
BaCO3,Na2CO3,Al,Fe(OH)3,石墨,KOH中哪些是强电解质哪些又是弱电解质,易导电的是?易与HCl反应? 好好地生活1年前2
好好地生活1年前2 -
 猪哈亮 共回答了24个问题
猪哈亮 共回答了24个问题 |采纳率100%强电解质:BaCO3、Na2CO3、Fe(OH)3、KOH
易导电的是:Al、石墨(其它都不是)
易与HCl反应的:除石墨外全部
电解质前提是化合物,强酸强碱和大多数盐都是强电解质
上述电解质不形成溶液,或不是熔融态均不可导电1年前查看全部
- 高中化学!有哪些酸属于弱电解质?
 whxnn1年前3
whxnn1年前3 -
 ee区长 共回答了15个问题
ee区长 共回答了15个问题 |采纳率86.7%草酸(乙二酸),亚硫酸,磷酸,丙酮酸,亚硝酸(以上五种为中强酸),柠檬酸,氢氟酸,苹果酸,葡萄糖酸,甲酸,乳酸,苯甲酸,丙烯酸,乙酸,丙酸,硬脂酸,碳酸,氢硫酸,次氯酸,硼酸,硅酸.1年前查看全部
- 有关弱电解质的问题醋酸是弱电解质,存在电离平衡.如果让醋酸溶液不断和金属镁反应,破坏电离平衡,最终可以让氢离子全部反应么
有关弱电解质的问题
醋酸是弱电解质,存在电离平衡.如果让醋酸溶液不断和金属镁反应,破坏电离平衡,最终可以让氢离子全部反应么?接替穆时候发现好像可以,但是有点想不通诶,既然是弱电解质,怎么能全部反应掉呢?求详解, 针鱼宝贝1年前1
针鱼宝贝1年前1 -
 kjkhkgjh 共回答了23个问题
kjkhkgjh 共回答了23个问题 |采纳率91.3%电离方程式为CH3COOH可逆CH3COO- + H+ 根据可逆反应的反应程度原理推 右侧生成物减少会促进反应进一步进行
其实就相当于有人将H+取走 溶液中仅剩CH3COOH和CH3COO- 所以CH3COOH会继续反应
而且反过来想 如果加入过量镁没有完全电离 则溶液中还会留下CH3COOH 和镁不可能共存 矛盾 所以继续电离1年前查看全部
- 工业五强酸中弱电解质是否含有氢碘酸,氢溴酸.能否被电离.
 花拈叶1年前1
花拈叶1年前1 -
 红景天 共回答了26个问题
红景天 共回答了26个问题 |采纳率92.3%氢碘酸,氢溴酸酸性比盐酸强,属于强酸,完全电离.1年前查看全部
- 电离,电解质,非电解质,强电解质,弱电解质,离子反应的定义分别是什么?
 sqzhang1年前0
sqzhang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 因为碳酸钙不溶于水,所以它是弱电解质,为什么?
 kamejin19841年前1
kamejin19841年前1 -
 slwslwslw 共回答了18个问题
slwslwslw 共回答了18个问题 |采纳率88.9%不对.
强弱电解质和溶解性没有必然的联系.
电解质的强弱要看在水中发生电离的程度,与是否溶解无关.
比如说,硫酸钡难溶于水,但溶解的那部分硫酸钡完全电离,是强电解质.1年前查看全部
- CH3COOH溶液的导电能力很弱,所以CH3COOH是弱电解质哪里错了
 luyihan1111年前3
luyihan1111年前3 -
 ff你 共回答了17个问题
ff你 共回答了17个问题 |采纳率94.1%如果CH3COOH是强电解质,但是他的溶液很稀,那么它导电性也很弱.
所以无法用导电性强弱,判断电解质类型.
应该说,
CH3COOH电离不完全,所以CH3COOH是弱电解质1年前查看全部
- 醋酸铅是弱电解质的原因?
 偶尔低调1年前1
偶尔低调1年前1 -
 孤独东半球 共回答了25个问题
孤独东半球 共回答了25个问题 |采纳率96%醋酸铅是弱电解质
是因为醋酸铅的金属阳离子Pb2 不是典型的活泼金属的阳离子,极化能力比较强,而且Pb2 是9~17电子构型,具有一定的变形性,使化合物从离子化合物转变为共价化合物,在水中电离不完全
反驳1F2F的
1F:Na2S,Na2CO3这些都是弱酸盐,但是它们都是强电解质
2F:醋酸铅就是弱电解质,不是所有的盐都是强电解质的,像HgCl2也不是1年前查看全部
- 浓度对弱电解质的电离平衡的影响很典型的一道,就是醋酸的电解平衡中,如加同浓度的醋酸,平衡为什么不移动?PH为什么不变?还
浓度对弱电解质的电离平衡的影响
很典型的一道,就是
醋酸的电解平衡中,如加同浓度的醋酸,平衡为什么不移动?PH为什么不变?
还有,为什么在一水合氨的电离平衡中加NH3平衡向逆反应方向移动?可否从多角度回答?
加溶质使平衡向逆反应方向移动,那么如加不等量的醋酸为什么平衡还向正反应反向移动? 楚程阳1年前4
楚程阳1年前4 -
 江边行 共回答了23个问题
江边行 共回答了23个问题 |采纳率95.7%影响电离平衡的直接因素就是温度和浓度,其他因素如体积、压强等只要不影响温度和浓度变化,电离平衡仍然是不变的.
向醋酸溶液中加入同浓度的醋酸后,浓度不变,温度也不变,因此电离平衡不改变,氢离子浓度自然也不变,PH值就不变.
NH3·H2O=可逆=(NH4+)+OH-,加入NH3后,与水反应生成NH3·H2O,增大反应物浓度,平衡向正反应方向移动.1年前查看全部
- 类盐是强电解质还是弱电解质?如NaH、Na2O2、CaC2、Mg3N2等
 大风801年前1
大风801年前1 -
 mmmh 共回答了15个问题
mmmh 共回答了15个问题 |采纳率93.3%强电解质吧,熔融完全电离的.1年前查看全部
- 强弱电解质的比较┏━━━━┳━━━━━━━┳━━━━━━━━┓┃\\\\┃\强电解质\\┃\\弱电解质\\┃┣━━━━╋
强弱电解质的比较
┏━━━━┳━━━━━━━┳━━━━━━━━┓
┃\\\\┃\强电解质\\┃\\弱电解质\\┃
┣━━━━╋━━━━━━━╋━━━━━━━━┫
┃组成结构┃离子化合物,某┃某些共价化合物\┃
┃\\\\┃此①__________┃\\\\\\\\┃
┣━━━━╋━━━━━━━╋━━━━━━━━┫
┃电离条件┃溶于水或②____┃溶于水\\\\\┃
┣━━━━╋━━━━━━━╋━━━━━━━━┫
┃电离程度┃③_电离,不可逆┃④___电离,不可逆┃
┣━━━━╋━━━━━━━╋━━━━━━━━┫
┃溶液中的┃⑤____________┃分子和⑥__共存主┃
┃存在形式┃(水和离子)\┃要以分子形式存在┃
┗━━━━┻━━━━━━━┻━━━━━━━━┛ 休旧1年前1
休旧1年前1 -
 比猪上树 共回答了12个问题
比猪上树 共回答了12个问题 |采纳率91.7%①强酸.强碱
②熔融状态
③完全
④部分
⑤离子
⑥离子1年前查看全部
- 为什么在弱电解质的电离中,增大溶液的物质的量浓度,电离平衡将向电离方向移动,那为什么电解质的
为什么在弱电解质的电离中,增大溶液的物质的量浓度,电离平衡将向电离方向移动,那为什么电解质的
电离程度却减小呢? xt8145041年前4
xt8145041年前4 -
 青羊区kk局 共回答了14个问题
青羊区kk局 共回答了14个问题 |采纳率100%从分子的角度可以这样分析:因浓度越大,离子间互相碰撞而结合成分子的机会越大,电离度就越小.相反浓度越稀,离子间互相碰撞而结合成分子的机会越少,电离度就越大.1年前查看全部
- 化学反应原理 - 同离子效应在弱电解质溶液中加入同弱电解质电离产生相同离子的强电解质,使电离平衡向逆反应方向移动.
 趁蛾1年前1
趁蛾1年前1 -
 poruo 共回答了19个问题
poruo 共回答了19个问题 |采纳率89.5%两种含有相同离子的盐(或酸、碱)溶于水时,它们的溶解度(或酸度系数)都会降低,这种现象叫做同离子效应.在弱电解质的溶液中,如果加入含有该弱电解质相同离子的强电解质,就会使该弱电解质的电离度降低的效应.同理,在电解质饱和溶液中,加入含有与该电解质相同离子的强电解质,也会降低该电解质的溶解度.1年前查看全部
- 关于弱电解质的电离为什么弱电解质加水稀释后离子浓度减小我能明白加水后会促进电离,但是为什么离子浓度减小
 我应该怎么办1年前4
我应该怎么办1年前4 -
 破烂王子 共回答了22个问题
破烂王子 共回答了22个问题 |采纳率86.4%这个很好理解,我尽量解释的浅显易懂一些.在水中所形成的离子其实都是水合离子,比如说氯化钠在水中的电离,其实就是一部分水分子包裹住钠元素,另一些水分子包裹住氯元素,促使钠元素和氯元素分离开来,产生了钠离子和氯离子.也就是说,对于弱电解质来说的话,本来就是电解质分子与其所形成的离子共存的,当稀释后,水分子增多了,当然促使原本的电解质分子更多的形成水合离子,也就是说促进了电解质的电离.因为这种电离的程度不如稀释的程度大,即,增加的水分子比形成的水合离子要多的多,故离子浓度反而越来越小.1年前查看全部
- 弱电解质中包括的极少数的盐有哪些?
 Rachelzero1年前1
Rachelzero1年前1 -
 ra5sg 共回答了21个问题
ra5sg 共回答了21个问题 |采纳率90.5%HgCl2氯化汞Pb(CH3COO)2醋酸铅1年前查看全部
- 关于纯水导电性的问题?高一书上说水是弱电解质,那么意味着纯水中有 氢离子,和氢氧根离子,那么纯水应该是导电的,为什么大家
关于纯水导电性的问题?
高一书上说水是弱电解质,那么意味着纯水中有 氢离子,和氢氧根离子,那么纯水应该是导电的,为什么大家都说纯水是不导电的? shareme_0011年前4
shareme_0011年前4 -
 卡哮 共回答了22个问题
卡哮 共回答了22个问题 |采纳率100%仅仅是在通常情况下.
水中的离子很少,电阻很大,通过的电流很小.所以说水是不导电的.
可以说基本上是不存在严格的绝缘体的,所谓的绝缘体仅仅是没有达到他通电的电压要求.1年前查看全部
- 化学NH4HCO3是不是弱电解质?SO2算不算共价化合物?
 京19681年前4
京19681年前4 -
 耍键盘的 共回答了17个问题
耍键盘的 共回答了17个问题 |采纳率88.2%NH4HCO3是盐,强电解质
SO2是共价化合物1年前查看全部
- 下列物质的分类正确的是单质 非电解质 强电解质 弱电解质A 氧气 乙醇 盐酸 醋酸B 液氧 CO2 H2SO4 NH3·
下列物质的分类正确的是
单质 非电解质 强电解质 弱电解质
A 氧气 乙醇 盐酸 醋酸
B 液氧 CO2 H2SO4 NH3·H2O
C 碘酒 NaCl 烧碱 H2CO3
D 液氧 Na2O HNO3 Ba(OH)2 lgmql1711年前1
lgmql1711年前1 -
 宁夏的夜 共回答了12个问题
宁夏的夜 共回答了12个问题 |采纳率58.3%A1年前查看全部
- 弱电解质包括弱酸弱碱少部分盐和水,其中少部分盐都有哪些?
 sljpt1年前1
sljpt1年前1 -
 犹豫守望 共回答了21个问题
犹豫守望 共回答了21个问题 |采纳率95.2%醋酸铅(中学中唯一的)1年前查看全部
- 如果是浓硫酸是电解质,那么是强电解质还是弱电解质呢?
 狄墨龙1年前7
狄墨龙1年前7 -
 linmingkang 共回答了13个问题
linmingkang 共回答了13个问题 |采纳率100%不是,首先,电解质是化合物,这是一个大的前提条件,就像为什么铁可以导电,却不是电解质是一码事,那么,你再看看,浓硫酸中的浓字!这说明它是混合物!是硫酸和少量水的混合物!硫酸是强电解质,或H2SO4是强电解质,但浓硫酸绝不是电解质!这不是一码事.1年前查看全部
- 漂白粉中滴加稀盐酸,生成次氯酸的话,可以理解成中和反应生成弱电解质吗?离子方程式怎么写
 泪如雨下19841年前1
泪如雨下19841年前1 -
 cayan104 共回答了19个问题
cayan104 共回答了19个问题 |采纳率84.2%中和反应是指酸和碱反应生成盐和水
你这生成次氯酸不是中和反应
如果只看生成次氯酸,离子方程式就是[H+]+ClO-==HClO1年前查看全部
- HF是强电解质还是弱电解质 强酸还是弱酸 HI是强电解质还是弱电解质 强酸还是弱酸
 noloveu1年前1
noloveu1年前1 -
 chigenxu 共回答了20个问题
chigenxu 共回答了20个问题 |采纳率90%氢氟酸的稀溶液呈弱酸性,氢氟酸的Ka等于3.5×10-4,在浓的氢氟酸溶液中,存在的缔合现象是H—F…H—F,氢氟酸的浓度增大,酸性逐渐加大,一旦达到5mol•L-1时,它将变成相当强的酸.因为在浓溶液中,一部分F-离子通过氢键与未曾解离的HF分子形成缔合离子HF2-,其中HF2-离子比水合F-更稳定.其K值为5.1.
PS:中学阶段认为HF是弱酸,弱电解质.
HI是强酸,Ka=7.52*10的十次方,是强电解质1年前查看全部
- 为什么强电解质电离是放热,而弱电解质电离是吸热
 andyAR1年前1
andyAR1年前1 -
 njust 共回答了21个问题
njust 共回答了21个问题 |采纳率85.7%其实强电解质水和过程大,因为是离子已在水溶液中形成水合离子.这个过程是放热的所以强电解质大于弱电解质.所以强电解质一般是放热的,而弱电解质一般是吸热的.
温馨提示:有些强电解质也是吸热的如氯化铵等.1年前查看全部
- 醋酸铅 为什么是弱电解质?它有什么特殊的结构么?
 0201091年前1
0201091年前1 -
 本龙 共回答了23个问题
本龙 共回答了23个问题 |采纳率82.6%由复分解反应 PbSO4+2CH3COONH4=(NH4)2SO4+(CH3COO)2Pb
可以判定醋酸铅为弱电解质,因为复分解反应实质是降低离子浓度,一定要生成非电解质或弱电解质,硫酸铵是强电解质,那么醋酸铅一定为弱电解质1年前查看全部
- 弱电解质电离后离子浓度怎么判断比如一水合氨溶液中 为什么 NH3H2O 要比 NH4+ 弱电解质中是分子大还是离子大?
 sujiawan1年前1
sujiawan1年前1 -
 黄点点有点傻 共回答了26个问题
黄点点有点傻 共回答了26个问题 |采纳率92.3%若是学过化学反应原理的话,就应该知道碱性溶液水解程度大于电离程度,酸性条件下电离程度大于水解程度,氨水显碱性,所以nh3.h2o的浓度大一些,弱电解质的电离程度是不同的,弱电解质中是分子大还是离子大不能一概而论1年前查看全部
- 弱电解质溶液中存在两种共价化合物?
弱电解质溶液中存在两种共价化合物?
为什么这句话正确?
一种是水一种是弱电解质? angelica101年前2
angelica101年前2 -
 风雨夜55 共回答了15个问题
风雨夜55 共回答了15个问题 |采纳率93.3%水是一种极弱的电解质,电离度1*10^-14 很小很小的.
应该是对的吧,弱电解质到溶液中,弱电解质没有电离的算一种,水也算一种,就2种共价化合物了.1年前查看全部
- 弱电解质那一节,相同物质的量浓度.相同体积的HCl和CH3COOH的比较,C(H+)得比较,与Zn反应的速率的比较.
弱电解质那一节,相同物质的量浓度.相同体积的HCl和CH3COOH的比较,C(H+)得比较,与Zn反应的速率的比较.
相同C(H+)相同体积的HCl,醋酸又是怎样的.这些不太懂, shimgo1年前2
shimgo1年前2 -
 清幽一族 共回答了19个问题
清幽一族 共回答了19个问题 |采纳率100%这个题目是弱电解质这一块比较重要的题目关键就是这个弱电解质的分析.
对于相同体积的HCl和CH3COOH的比较,由于量浓度一样,所以物质的量一样.关键是下一步,由于盐酸是完全电离,醋酸是部分电离,所以,对于相同的物质的量的两种酸来说,盐酸电离出来的氢离子要多于醋酸,即氢离子的浓度:盐酸大于醋酸.
现在又是相同体积的氢离子,反过来想,盐酸是全部电离,而醋酸是部分电离,而电离出来的氢离子浓度却是相同的,所以盐酸的物质的量小于醋酸的物质的量.(不知道这个地方你可想清楚,若不懂可以追问).
下面一步就是对上面分析的应用.与锌反应的比较.
第一种情况:相同物质的量的盐酸与醋酸,由于盐酸中氢离子浓度高于醋酸,所以,刚开始的反应速率是盐酸大于醋酸.而消耗的锌的量是一样的.
第二种情况:开始时氢离子的浓度相同,所以开始的反应速度相同,但是由于醋酸是一边反应一边电离,氢离子浓度降低的速率比盐酸的慢,所以后来就是醋酸大于盐酸.而且,由于醋酸的物质的量大于盐酸,所以消耗的氢离子醋酸比盐酸多.这就是这种题目的解法,若有不懂,可以追问.1年前查看全部
- 下列事实中一定不能证明CH3COOH是弱电解质的是( )
下列事实中一定不能证明CH3COOH是弱电解质的是( )
下列事实中一定不能证明CH3COOH是弱电解质的是( ) ①常温下某CH3COONa溶液的pH=8 ②用CH3COOH溶液做导电实验,灯泡很暗 ③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 ④0.1 mol·L-1 CH3COOH溶液的pH=2.1 ⑤CH3COONa和H3PO4反应,生成CH3COOH ⑥0.1 mol·L-1的CH3COOH溶液稀释至100倍,pH 十弦1年前1
十弦1年前1 -
 虚有的梦镜 共回答了14个问题
虚有的梦镜 共回答了14个问题 |采纳率85.7%②极稀的HCl溶液 做导电实验,灯泡也很暗,但HCl是强电解质.
所以CH3COOH的灯泡很暗,什么问题也说明不了
⑤能说明CH3COOH的酸性比H3PO4弱,
H3PO4是弱酸,CH3COOH一定是弱酸,就一定是弱电解质.
所以⑤正确.
选择A,你的答案可能有误1年前查看全部
- 在离子反应式中,弱电解质不能拆,为什么醋酸和氨水可以拆?还有没有什么特别的可以拆的弱电解质?
在离子反应式中,弱电解质不能拆,为什么醋酸和氨水可以拆?还有没有什么特别的可以拆的弱电解质?
是说弱电解质所谓的不能拆指的是在反应中不能拆,而在生成物中可以拆, hy90281年前2
hy90281年前2 -
 paul5240 共回答了16个问题
paul5240 共回答了16个问题 |采纳率87.5%CH3COOH+NH3=CH3COONH4 完全反应
离子式:CH3COOH+NH3=CH3COOH +NH4+
CH3COOH和NH3都是弱电解质
离子式不可以拆的
但是两者反应之后生成的CH3COONH4是强电解质
是可以拆的
你说的可拆的应该是它们的电离反应吧
CH3COOH=CH3COO- + H+ 这是个可逆反应
不是化学反应 就是一个电离反应式
你要记住,离子反应式中
弱电解质什么时候都不可以拆1年前查看全部
- 离子方程式里 弱电解质写化学式?
 雪謦1年前1
雪謦1年前1 -
 V某人 共回答了16个问题
V某人 共回答了16个问题 |采纳率93.8%对 醋酸 强硫酸1年前查看全部
- 苯磺酸钠和氢氧化钠为什么能反应 看到有人说强碱制弱碱 但是亚硫酸钠和苯酚钠都不是弱电解质或沉淀啊
 云飘海1年前1
云飘海1年前1 -
 走叉路的猪 共回答了19个问题
走叉路的猪 共回答了19个问题 |采纳率84.2%苯磺酸钠和氢氧化钠(在溶液中)不能发生反应.
在加热熔融这样比较强烈的条件下,二者才可以发生反应,生成苯酚钠:
C6H5-SO3Na + NaOH → C6H5ONa + Na2SO3
这个反应的发生与“强碱制弱碱”没有任何关系,不要被误导.
在高中阶段,这个反应的原理是比较难解释的,可以把它当做工业上制苯酚的方法记下来.1年前查看全部
- 物资的量 溶液浓度 弱电解质 缓冲作用 有机化合物 官能团 的名词解释.
 zhoubingbing20041年前3
zhoubingbing20041年前3 -
 睿少 共回答了21个问题
睿少 共回答了21个问题 |采纳率95.2%物质的量:基础物理量
溶液浓度:溶质的含量
弱电解质:电离度1年前查看全部
- 强、弱电解质的比较,包括定义、化合物类别、电离程度、溶液中微粒的种类和电离方程式?
 cindy_yhy1年前2
cindy_yhy1年前2 -
 SUAD3491 共回答了14个问题
SUAD3491 共回答了14个问题 |采纳率85.7%1、定义
强电解质:在水溶液中能完全电离的电解质.
弱电解质:在水溶液中部分电离的电解质.
注意,区别的标准是能不能完全电离,与溶解度没有关系,与溶液的浓度没有必然关系,与溶液的导电性没有必然关系.
即存在难溶性的强电解质,如CaCO3、BaSO4等等,也存在易溶性的弱电解质,如CH3COOH等.
2、化合物类别
强电解质:离子化合物,部分共价化合物
弱电解质:部分共价化合物
强电解质:强酸,强碱,大多数的盐
弱电解质:弱酸,弱碱,水,极少数的盐
3、电离程度,溶液中微粒的种类,电离方程式
强电解质:完全电离,溶液中只存在离子,电离方程式完全,用=,一步到底
弱电解质,不完全电离,溶液中既有离子,也有分子,电离方程式用可逆符号,多元弱酸的电离分步.1年前查看全部
- 化学:有机物是不是弱电解质?详细!
 颜鱼飞飞1年前2
颜鱼飞飞1年前2 -
 zjw720909 共回答了16个问题
zjw720909 共回答了16个问题 |采纳率93.8%有机物的定义是含碳的大部分化合物,因而不一定是弱电解质,只有少数是,比如羧酸类物质,酚类物质等.但大部分不是电解质,如烃类物质,醇类物质.还有一小部分是强电解质,如羧酸盐.1年前查看全部
- 介绍一下过氧化氢的化学性质!顺便问一下:双氧水是弱电解质吗?
 好月1年前2
好月1年前2 -
 luyi0507 共回答了15个问题
luyi0507 共回答了15个问题 |采纳率86.7%过氧化氢,俗称双氧水,分子式H2O2,是除水外的另一种氢的氧化物.化学性质不稳定,一般以30%或60%的水溶液形式存放.过氧化氢有很强的氧化性,且具弱酸性.
过氧化氢是非常强的氧化剂,它和其他氧化剂的标准电极电势值列在右面,值越高代表氧化性越强:
分解反应
过氧化氢可自发分解歧化生成水和氧气:
2 H2O2 → 2 H2O + O2
该反应在热力学上自发进行:ΔHo为−98.2 kJ·mol−1,ΔGo为−119.2 kJ·mol−1,ΔS为70.5 J·mol−1·K−1.重金属离子Fe2+、Mn2+、Cu2+等对过氧化氢的分解有催化作用.过氧化氢在酸性和中性介质中较稳定,在碱性介质中易分解.用波长为320~380nm的光照射会使过氧化氢分解速度加快,故过氧化氢应盛于棕色瓶中并放在阴凉处.
H2O2与Fe2+的混合溶液称为Fenton试剂.某些离子如Fe2+、Ti3+催化下,过氧化氢分解反应会生成自由基中间体HO·(羟基自由基)和HOO·.
一般使用的双氧水中都会含有一定量的稳定剂,以减少过氧化氢的分解.常用的稳定剂包括:锡酸钠、焦磷酸钠和有机亚磷酸酯.
氧化还原反应
过氧化氢可在水溶液中氧化或还原很多无机离子.用作还原剂时产物为氧气,用作氧化剂时产物为水.例如酸性溶液中,过氧化氢可将Fe2+氧化为Fe3+:
2 Fe2+(aq) + H2O2 + 2 H+(aq) → 2 Fe3+(aq) + 2H2O(l)
与过氧化氢作用,亚硫酸根(SO32−)可被氧化为硫酸根(SO42−),高锰酸钾在酸性溶液中会被还原为Mn2+.由于标准电极电势的缘故,反应在不同pH环境下进行的方向可能不同,如碱性溶液中,过氧化氢会将Mn2+氧化为MnIV,以MnO2形式生成.
过氧化氢还原次氯酸钠的反应可用于在实验室中制备氧气:
NaOCl + H2O2 → O2 + NaCl + H2O
有机化学中,过氧化氢常用作氧化剂,可将硫醚氧化为亚砜.甲基苯基硫醚与其反应时,会被氧化为甲基苯基亚砜,以甲醇作溶剂或三氯化钛催化,产率为99%:
Ph-S-CH3 + H2O2 → Ph-S(O)-CH3 + H2O
过氧化氢的碱性溶液可用于富电子烯烃(如丙烯酸)的环氧化反应,以及在硼氢化-氧化反应第二步中氧化烷基硼至醇.
过氧化氢与很多无机或有机化合物反应时,过氧链保留并转移到另一分子上,生成新的过氧化物:
过氧化氢在低温下与铬酸或重铬酸盐酸性溶液反应时,会生成不稳定的蓝色过氧化铬CrO(O2)2,可用乙醚或戊醇萃取.水溶液中过氧化铬很快分解为氧气和含铬离子.
过氧化氢与硼砂反应会生成过硼酸钠,可用作消毒剂:
Na2B4O7 + 4 H2O2 + 2 NaOH → 2 Na2B2O4(OH)4 + H2O
过氧化氢可生成很多含有O22-过氧根离子的无机盐类,其中比较重要的如过氧化钙、过氧化钠和过氧化镁.
与羧酸(RC=O-OH)反应,生成具氧化性的过氧酸(RC=O-O-OH),可用于烯烃环氧化反应等用途.与丙酮反应生成炸药三过氧化三丙酮(TATP),与臭氧反应生成三氧化二氢,与尿素反应生成过氧化尿素.
过氧化氢与三苯基氧化膦生成酸碱加合物,有些反应中用作过氧化氢的等同试剂.
与水相比,过氧化氢的碱性要弱得多,只有与很强的酸反应才会生成加合物.超强酸HF/SbF5可将过氧化氢质子化,生成含[H3O2]+离子的产物.1年前查看全部
- 下列关于弱电解质的说法正确的是: ( ) A.电解质越弱,则其溶液的导电能力就越差 B.同一弱电解质,浓度越
下列关于弱电解质的说法正确的是:()
A.电解质越弱,则其溶液的导电能力就越差 B.同一弱电解质,浓度越大,电离程度越大 C.升高温度,弱电解质的电离程度减小 D.弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断  liangwanru1年前1
liangwanru1年前1 -
 unique830101 共回答了25个问题
unique830101 共回答了25个问题 |采纳率96%D
A错误,电解质的强弱与其在溶液中导电能力的大小没有直接关系,溶液中导电能力大小只与溶液中的离子浓度和离子所带电荷数目有关。
B错误,对于弱电解质,浓度越大,电离程度越小。
C错误,电离过程是吸热,升高温度,弱电解质的电离平衡正向移动,电离程度增大。
D正确。1年前查看全部
- 关于弱电解质电离的问题氯化钠溶液在电流作用下电离成钠离子和氯离子为什么错啊?
 hhkk子1年前1
hhkk子1年前1 -
 daniel2535 共回答了19个问题
daniel2535 共回答了19个问题 |采纳率94.7%电解质是指在水溶液中或熔融状态下能够导电的化合物.电离是电解质在水溶液或熔融状态下能够离解出自由移动的离子的过程,电离不一定是在有电流的的情况下发生.
氯化钠溶液在电流作用下会发生电解,产物是氢气、氯气和氢氧化钠.1年前查看全部
- 弱电解质的电离平衡同体积的PH相同的盐酸 硫酸 醋酸 与足量的锌粉或碳酸钠溶液反应 问反应刚开始时和进行后的反应速率?望
弱电解质的电离平衡
同体积的PH相同的盐酸 硫酸 醋酸 与足量的锌粉或碳酸钠溶液反应 问反应刚开始时和进行后的反应速率?
望详解
刚开始 醋酸快? 大二男生1年前3
大二男生1年前3 -
 liang_wz 共回答了24个问题
liang_wz 共回答了24个问题 |采纳率83.3%刚刚开始时速度是一样的,因为各溶液的PH是一样的,所以其H+浓度是一样的.
反应一段时间以后,因为醋酸为弱酸,在H+反应后,醋酸会电离产生H+,而盐酸和硫酸为强酸,是完全电离的,所以醋酸中H+浓度会高于盐酸和硫酸.所以反应一段时间后,醋酸反应会快些.1年前查看全部
- 化学:下列说法正确的一组是①不溶于水的盐(CaCO3,BaSO4等)都是弱电解质②可溶于水的盐都是强电解质③所有一元酸中
化学:下列说法正确的一组是
①不溶于水的盐(CaCO3,BaSO4等)都是弱电解质
②可溶于水的盐都是强电解质
③所有一元酸中氢离子浓度都相等
④强酸溶液中氢离子浓度不一定大于弱酸溶液中氢离子浓度.
⑤强电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电 自游游自在在1年前4
自游游自在在1年前4 -
 Kylin755 共回答了13个问题
Kylin755 共回答了13个问题 |采纳率76.9%①不溶于水的盐(CaCO3,BaSO4等)都是弱电解质
错,CaCO3,BaSO4都可完全电离,是强电解质.
②可溶于水的盐都是强电解质
错,醋酸铅可溶于水,是弱电解质.
③所有一元酸中氢离子浓度都相等
错,没有指明酸的浓度和电离度相同的酸.
④强酸溶液中氢离子浓度不一定大于弱酸溶液中氢离子浓度.
对,当强酸溶液浓度极其低时.
⑤强电解质溶液导电的原因是溶液中有自由移动的阴阳离子
对
⑥熔融的电解质都能导电
错,只有离子化合物才能这么说.比如水,导电能力极弱,忽略不计.1年前查看全部
- 在含有弱电解质的溶液中,往往有多个化学平衡共存.
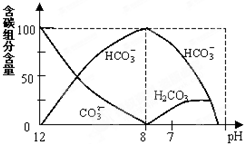 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是______
A.c(HA)<c(A-)B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-)D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示.
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”)______大量共存.
②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:______.
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.c(H
)c(OH)CO −3c(
)CO 2−3 upbbq1年前1
upbbq1年前1 -
 绝对欠揍 共回答了21个问题
绝对欠揍 共回答了21个问题 |采纳率95.2%解题思路:(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,得到溶液溶质为NaA和HA,溶液pH大于7,说明A-离子水解程度大于HA电离程度;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,以此分析解答.(1)0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,反应后得到等量的HA、NaA,溶液pH大于7,则盐类水解大于酸的电离,
A. 水解生成HA,则c(HA)>c(A-),故A错误;
B.因等体积混合,则反应后c(HA)一定小于0.1mol/L,故B错误;
C.反应后得到等量的HA、NaA,则2c(Na+)=c(HA)+c(A-),故C错误;
D.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),又2c(Na+)=c(HA)+c(A-),则c(OH-)=c(H+)+[1/2][c(HA)-c(A-)],故D正确;
故答案为:D;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故答案为:不能;
②当pH=7时,溶液中溶质为碳酸氢钠、氯化钠,离子浓度大小为:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)>c(CO32-);
故答案为:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)>c(CO32-);
③水解常数Kh=
c(HCO3−)c(OH−)
c(CO32−)=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以pH=10,
故答案为:10.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;离子方程式的有关计算;pH的简单计算.
考点点评: 本题考查较综合,涉及溶液中离子浓度大小分析,化学平衡常数的计算及溶液中酸碱之间的反应,题目难度较大,综合考查学生分析问题、解决问题的能力,注重能力的考查.1年前查看全部
- 写离子方程式时 什么不能拆?只说特殊的 除了弱电解质 沉淀 气体 水 还有什么浓盐酸什么的求解答
 乐乐_桃1年前1
乐乐_桃1年前1 -
 shui2007shui 共回答了26个问题
shui2007shui 共回答了26个问题 |采纳率84.6%浓硫酸不能拆成离子形式.
单质、氧化物、多数有机物也不能拆成离子形式.
弱酸,弱碱不能拆成离子形式.
好像还有Ca(OH)2这个比较特殊,做反应物时不可拆,生成物时可以拆 ,好像因为浓度吧,具体的就不太记得了1年前查看全部
- 离子间生成弱电解质为什么不能在溶液中大量共存
 8wy7342481年前1
8wy7342481年前1 -
 121384 共回答了17个问题
121384 共回答了17个问题 |采纳率70.6%弱电解质是指在水溶液中不能完全电离成为阴、阳离子的物质,一部分在溶液中以分子的形式存在,其电离程度因物质的不同而不同.如果形成弱电解质的离子同时出现在溶液中,那么会有部分的离子之间抱团形成分子形式存在.所以一般认为其不能再溶液中大量共存1年前查看全部
- 谁可以帮我总结一下高中化学的强电解质与弱电解质都具体的能用到哪些.
 papix20081年前1
papix20081年前1 -
 wt279952492 共回答了18个问题
wt279952492 共回答了18个问题 |采纳率88.9%强酸高中阶段的(硫酸,盐酸,硝酸,高氯酸)
强碱高中阶段的(氢氧化钠,氢氧化钡,氢氧化钾,氢氧化钙)记住氢氧化镁是中强碱,但不属于强电解质,沉淀同样也是电解质
高中接触的有机物都是非电解质
除醋酸铅以外所有高中接触的盐都是电解质
强电解质:在水溶液或熔融状态完全电离的是强电解质
弱电解质:在水溶液或融融状态下不能完全电离的是弱电解质
最好还是把书吃透1年前查看全部
- 列有关强、弱电解质的叙述正确的是( )
列有关强、弱电解质的叙述正确的是( )
A. 强电解质溶液的导电性一定比弱电解质溶液的导电性强
B. 强电解质的水溶液中不存在溶质分子
C. 强电解质都是离子化合物,而弱电解质都是共价化合物
D. 不同的弱电解质只要物质的量浓度相同,电离程度也相同 gaoyan1420261年前1
gaoyan1420261年前1 -
 Junglee 共回答了16个问题
Junglee 共回答了16个问题 |采纳率93.8%解题思路:A、溶液导电能力取决于溶液中离子浓度大小,与电解质强弱无关;
B、强电解质完全电离成离子;
C、某些共价化合物是强电解质;
D、不同弱电解质电离程度不同;A、溶液导电能力取决于溶液中离子浓度大小,强电解质溶液的导电性不一定比弱电解质溶液的导电性强,故A错误;
B、强电解质的特征是水溶液中完全电离,所以不存在溶质分子,故B正确;
C、离子化合物都是强电解质,但强电解质不一定是离子化合物;弱电解质都是共价化合物,但共价化合物不一定是弱电解质;故C错误;
D、不同弱电解质电离程度由本性决定,浓度相同的弱电解质溶液中电离程度不一定相同,故D错误;
故选B.点评:
本题考点: 强电解质和弱电解质的概念.
考点点评: 本题考查了溶液导电性分析判断,强弱电解质的组成特征分析,弱电解质的性质应用,掌握理解概念是解题关键,题目难度中等.1年前查看全部
- 怎样区分强电解质和弱电解质?
 lianna200109291年前1
lianna200109291年前1 -
 liduokayin77 共回答了12个问题
liduokayin77 共回答了12个问题 |采纳率83.3%首先,如果你是高中生,那么你见到的所有盐都是强电解质,包括难溶如CaCO3,AgCl,也一样是强电解质,另外,强碱强酸是强电解质,如氢氧化钠,氯化氢,硝酸硫酸等,弱碱弱酸和水是弱电解质,如氢氧化铝,乙酸(醋酸),次氯酸等1年前查看全部
- 强电解质 和 弱电解质 因为什么被区分
 芝麻萤11年前7
芝麻萤11年前7 -
 zlsh82顺 共回答了16个问题
zlsh82顺 共回答了16个问题 |采纳率100%强电解质是在水溶液中完全电离的化合物,主要包括:强酸、强碱、大多数的盐(醋酸铅,氯化汞除外.比如KCl,在水溶液中完全电离为K+和Cl+ ;
弱电解质是在水溶液中只有部分电离的物质,主要包括:弱酸、弱碱、水等;比如CH3COOH,在水溶液中部分电离为H+和CH3COO-;
非电解质主要包括:单质、气体;
实际上,我觉得区分本质是指电解质溶解的部分是否可以完全电离,比如BaSO4,它虽然在溶液中只能溶解一小部分,但它却属于强电解质.所以不能陷入否完全电离与是否完全溶解一样的误区.只要好好掌握强弱电解质分类范围即可准确判断.1年前查看全部
大家在问
- 1初二上学期物理题(第三章 透镜及其应用),
- 2大一英语课情景对话.话题是NBA,要求有4个人参加,每个人都得说话,难度别太大.
- 3英语翻译when you are learning English ,listening ,speaking and w
- 4我正好住在超市旁边,很方便。翻译成英语
- 5It's an orange jacket同义句
- 60到9数字组成一个加法等式***+***=**** 数字不重复
- 7美丽的铁塔公园 作文
- 8英文单词的过去式,怎么读?加了d 或ed后怎么读?有什麽规律?2、e+d liked wasted 怎么读?
- 9任意画出四个点(其中任意,三点不在同一条直线上),经过每点用直尺画条直线,一共可以画几条?试画出来
- 10关于进制转换,原码补码反码等的转换
- 11Lake Ponkapog什么意思?
- 12英语翻译13981 Industry AveBecker,MN 55308一个美国地址,不知道那个Becker,MN 是
- 13英语翻译100个单词左右.1.鸟巢体育馆 2.水立方体育馆
- 14两根木条,一根60cm,另一根100cm,将它们的一端重合,放在同一条直线上,此时两根木条的中点距离是多少?
- 15线性回归分析中为什么把解释变量假设为非随机变量,
