金属锂与氧气的反应锂在空气中与氧气放应吗?生成什么 在氧气中燃烧条件生成什么?有的人说都只生成Li2O 有个人说有Li2
 89333582022-10-04 11:39:541条回答
89333582022-10-04 11:39:541条回答锂在空气中与氧气放应吗?生成什么 在氧气中燃烧条件生成什么?有的人说都只生成Li2O 有个人说有Li2O2 哪个正确呢?为什么?

已提交,审核后显示!提交回复
共1条回复
 blue纸鸢 共回答了20个问题
blue纸鸢 共回答了20个问题 |采纳率85%- Li2O,因为碱金属活动性虽原子序数增大而增强.钾和氧气燃烧可以生成超氧化钾,而钠只能生成过氧化钠,所以锂只能生成氧化锂,锂在空气中缓慢氧化和在氧气中燃烧都是生成氧化锂,我记得应该是这样的.
- 1年前
相关推荐
- 金属锂(元素符号Li)在通信和航天领域中有重要用途.氢氧化锂(化学式LiOH)是一种易溶于水的白色固体,有辣味;化学性质
金属锂(元素符号Li)在通信和航天领域中有重要用途.氢氧化锂(化学式LiOH)是一种易溶于水的白色固体,有辣味;化学性质与NaOH相似,有强碱性和腐蚀性.
(1)“辣味”属于氢氧化锂的______性质(填“化学”或“物理”):
(2)LiOH属于______类(填“氧化物”“酸”“碱”或“盐”);
(3)LiOH利NaOH都呈碱性,是因为它们在水溶液中都能解离出______离子(填“金属”“氢”或“氢氧根”);
(4)载人航天飞船中常用LiOH代替NaOH来吸收航天员呼吸产生的CO 2 ,则LiOH与CO 2 反应的化学方程式为______. calthy1年前1
calthy1年前1 -
 billfire 共回答了21个问题
billfire 共回答了21个问题 |采纳率81%(1)物质没有发生化学变化就表现出来到性质.通常物质的物理性质就是指色味态密熔沸以及溶解度.
(2)根据氢氧化锂(化学式LiOH)的化学性质与NaOH相似,NaOH属于碱,故它也属于碱;
(3)根据碱的定义,结合LiOH和NaOH都呈碱性,所以水溶液中都能电离出OH-;
(4)根据氢氧化钠和二氧化碳反应的化学方程式可推断,CO 2 +2LiOH═Li 2 CO 3 +H 2 O
故正确答案:(1)物理(2)碱(3)氢氧根(4)CO 2 +2LiOH═Li 2 CO 3 +H 2 O1年前查看全部
- (2008•惠州模拟)有一种锂电池,它是由金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiALCL4)溶解在亚硫酰
(2008•惠州模拟)有一种锂电池,它是由金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiALCL4)溶解在亚硫酰氯(
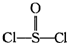 )中形成的,电池的总反应方程为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述正确的是( )
)中形成的,电池的总反应方程为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述正确的是( )
A.电池工作过程中,SOCl2被还原为Li2SO3
B.外电路中,电子从石墨电极流向锂电极
C.若电解质溶液中混有少量水,对电池反应无影响
D.电池工作过程中,锂失去的电子与析出硫的物质的量比为4:1 morris131年前1
morris131年前1 -
 shadowfax79 共回答了17个问题
shadowfax79 共回答了17个问题 |采纳率94.1%解题思路:A.SOCl2生成Li2SO3,硫元素的化合价不变,都是+4价;
B.原电池放电时,电子从负极沿导线流向正极;
C.锂是活泼金属,能和水反应生成氢气;
D.根据同一氧化还原反应中得失电子数相等计算.A.SOCl2生成Li2SO3,硫元素的化合价不变,都是+4价,所以SOCl2不是被还原生成Li2SO3,故A错误;
B.原电池放电时,电子从负极沿导线流向正极,该原电池中,锂易失电子而作负极,石墨作正极,则电子从锂沿导线流向正极石墨,故B错误;
C.锂是活泼金属,能和水反应生成氢气和氢氧化锂,所以若电解质溶液中混有少量水,对电池反应有影响,故C错误;
D.根据电池反应式8Li+3SOCl2=6LiCl+Li2SO3+2S知,锂失去的电子与析出硫的物质的量比=[8×(1-0)]:2=4:1,故D正确;
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了化学电源新型电池,根据元素得失电子来判断正负极,再结合电子的移动方向、物质的性质及物质之间的关系式来分析解答即可,难度中等.1年前查看全部
- 金属锂在空气中的黑色物质是什么金属锂片在常温潮湿的环境下,生成黑色物质,是什么呢?据说是氮化锂,但不知道反应机理和条件,
金属锂在空气中的黑色物质是什么
金属锂片在常温潮湿的环境下,生成黑色物质,是什么呢?据说是氮化锂,但不知道反应机理和条件,锂片和氧气与氮气分别都同时进行反应吗?
 紫穗的ss1年前1
紫穗的ss1年前1 -
 ZSeal 共回答了18个问题
ZSeal 共回答了18个问题 |采纳率94.4%锂的化合物一般都是白色,如果锂在空气中生成黑色物质,应该是很少量的吧。那么,可能是锂与二氧化碳反应生成碳单质吧。氮化锂应该不是黑色的,是红色。但是,氮气能与锂反应生成氮化锂的。6Li +N2=2Li3N1年前查看全部
- 金属锂与水反应不如金属钠与水反应剧烈?
 琴胆剑心1年前4
琴胆剑心1年前4 -
 痛苦菲儿 共回答了17个问题
痛苦菲儿 共回答了17个问题 |采纳率94.1%是的,虽然Li的活泼性强于Na,但与水反应时Li竟然不如Na.
对于这一现象的解释是:1、可能是因为Li不象Na那样在反应过程中熔化;2、LIOH在水中溶解度较小,它摄盖在金属Li的表面上,使反应速度降低.1年前查看全部
- 锂水电池以金属锂和钢板为电极材料,以LiOH为电解质,则放电时正极有氢气生成.
锂水电池以金属锂和钢板为电极材料,以LiOH为电解质,则放电时正极有氢气生成.
我以为是吸氧腐蚀,结果答案是析氢,咋个判断出来的? id-yan1年前3
id-yan1年前3 -
 怎么都被占用了啊 共回答了12个问题
怎么都被占用了啊 共回答了12个问题 |采纳率91.7%总反应是 2Li +2H2O ==2LiOH +H2
O2没它的事,放出H2是析氢腐蚀1年前查看全部
- 一种锂水电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.下列说法正确的是( )
一种锂水电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.下列说法正确的是( )
A 钢板是电池的负极 B该电池中锂被氧化,铁被还原 C放电时负极生成氢氧根离子,向正极移动 D电池总反应式为2LI+2H2O=2LiOH+H2 利记1年前3
利记1年前3 -
 顺春哥 共回答了19个问题
顺春哥 共回答了19个问题 |采纳率89.5%A、电池以金属锂和钢板为电极材料,LiOH 为电解质,锂做负极,钢板为正极,钢板上发生还原反应,故A正确;
B、放电时电子流向为负极--导线--正极,故B错误;
C、原电池中,阴离子移向原电池的负极,即放电时OH-向负极移动,故C错误;
D、锂水电池中,自发的氧化还原反应是金属锂和水之间反应生成氢氧化锂和氢气,即总反应为:2Li+2H2O═2LiOH+H2↑,故D错误.
故选:A1年前查看全部
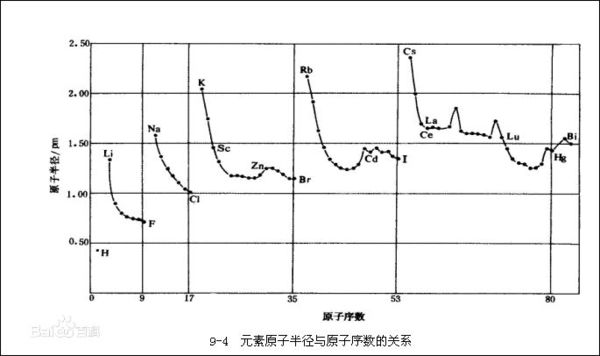
- 金属锂的半径为0.152 Cl的半径为0.099 可是判断半径时不是看电子层数嘛
金属锂的半径为0.152 Cl的半径为0.099 可是判断半径时不是看电子层数嘛
氯在第三周期 可锂在第二周期 第三周期的原子半径大于第二周的 因为电子层数多 可这又该怎么解释 boystay1年前2
boystay1年前2 -
 惜君如命2005 共回答了21个问题
惜君如命2005 共回答了21个问题 |采纳率95.2%1年前查看全部
- 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,
以LiOH为电解质
,使用时加入水即可放电.关于该电池的下列说法不正确的是
A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成
C.放电时OH-向正极移动 D.总反应为:2Li+2H2O=2LiOH+H2
正确答案为C,请帮我写一下正负极反应式, hq26708471年前1
hq26708471年前1 -
 马爱利 共回答了18个问题
马爱利 共回答了18个问题 |采纳率88.9%看这个锂水电池的名称,总反应就是2Li+2H2O=2LiOH+H2
负极:Li-e-+OH-=LiOH
正极:H2O+2e-=H2+2OH-(2H++2e-=H2)1年前查看全部
- 金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi 2 O 6 ,含有少量钙、镁杂
金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi 2 O 6 ,含有少量钙、镁杂质)制备金属锂,其生产流程如下:
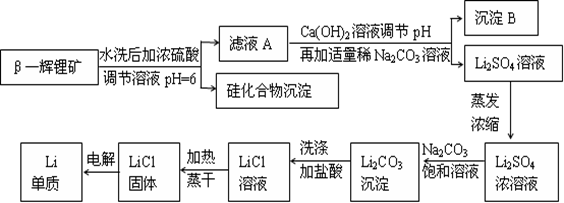
已知Li 2 CO 3 微溶于水。请回答下列问题:
(1)写出LiAlSi 2 O 6 与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li 2 SO 4 溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li 2 SO 4 溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF 3 作其正极的活性物质,FeF 3 常用FeCl 3 与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H 2 =2LiH,②LiH+H 2 O=LiOH+H 2 ↑。若已知LiH的密度为0.82g·cm -3 ,用金属锂吸收224L H 2 (标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。 blueskyhoo1年前1
blueskyhoo1年前1 -
 billheick 共回答了27个问题
billheick 共回答了27个问题 |采纳率92.6%(1) 2LiAlSi 2 O 6 +4H 2 SO 4 =Li 2 SO 4 +Al 2 (SO 4 ) 3 +4H 2 SiO 3 ↓(2分)。
(2) Al(OH) 3 和CaCO 3 (2分) (3)酒精灯(1分) 玻璃棒(1分)。
(4)碳酸锂微溶于水,蒸发浓缩的目的是增大溶液中锂离子浓度,使锂离子浓度与碳酸根离子浓度之积大于Ksp(Li 2 CO 3 ),以便产生碳酸锂沉淀。(3分)
(5)SiO 2 +4HF=SiF 4 ↑+2H 2 O(2分)。(6) 1148(2分)。
1年前查看全部
- 金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途.单质锂是银白色固体,密度为0.534g/cm3,是已知
金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途.单质锂是银白色固体,密度为0.534g/cm3,是已知金属中最轻的金属; 金属锂与空气接触易被氧化为氧化锂(Li2O),它遇水会与水反应生成氢气和氢氧化锂[LiOH],它与矿物油不反应.它的化合物氢氧化锂是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性.
(1)写出金属锂的一点物理性质______;
(2)写出金属锂与水反应的化学方程式______.
(3)在实验室里,如何保存锂?______.
(4)载人航天飞船中通常用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则LiOH与CO2反应的化学方程式______. hijee1年前1
hijee1年前1 -
 blueteeth628 共回答了20个问题
blueteeth628 共回答了20个问题 |采纳率85%解题思路:(1)由题意“单质锂是银白色固体,密度为0.534g/cm3,是已知金属中最轻的金属”为锂的物理性质;
(2)根据“锂遇水会与水反应生成氢气和氢氧化锂[LiOH],”则可书写其化学方程式;
(3)化学试剂的存放与化学试剂的物理性质和化学性质有关,易挥发的物质要密封保存,见光易分解的物质要避光保存,易与氧气、水、二氧化碳反应的物质要隔绝空气保存,以此解答该题.
(4)由题意,用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则反应物为CO2、LiOH,生成物为Li2CO3、H2O,故根据质量守恒定律,可以书写化学方程式.(1)物质的“色、味、态”为物理性质;则金属锂的一点物理性质 单质锂是银白色固体,密度为0.534g/cm3,是已知金属中最轻的金属;
(2)根据“锂遇水会与水反应生成氢气和氢氧化锂[LiOH],”则可书写其化学方程式为2Li+2H2O=2LiOH+H2↑;
(3)已知“金属锂与空气接触易被氧化为氧化锂(Li2O),它遇水会与水反应生成氢气和氢氧化锂[LiOH],它与矿物油不反应”,所以可用煤油保存.
(4)由题意,知反应物为CO2、LiOH,生成物为Li2CO3、H2O,故根据质量守恒定律,可以书写化学方程式CO2+2LiOH=Li2CO3+H2O.
故答案为:
(1)单质锂是银白色固体,密度为0.534g/cm3,是已知金属中最轻的金属;
(2)2Li+2H2O=2LiOH+H2↑.
(3)可用煤油保存.
(4)CO2+2LiOH=Li2CO3+H2O.点评:
本题考点: 金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 由题意,找出反应物和生成物、反应条件,根据质量守恒定律,正确书写化学方程式;了解化学性质与物理性质的差别及其应用.1年前查看全部
- 金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体
金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性.
(1)“辣味”属于氢氧化锂的(填“物理”或“化学”,下同)______性质;“腐蚀性”属于氢氧化锂的______性质.
(2)LiOH中锂元素的化合价为______.
(3)载人航天飞船中通常用LiOH代替NaOH来吸收航天员呼吸产生的CO 2 ,则LiOH与CO 2 反应的化学方程式______. llzx11211年前1
llzx11211年前1 -
 f_fox 共回答了19个问题
f_fox 共回答了19个问题 |采纳率89.5%(1)氢氧化锂的“辣味”不需要通过化学变化表现出来,属于物理性质.故填:物理.
氢氧化锂的“腐蚀性”需要通过化学变化表现出来,属于化学性质.故填:化学.
(2)氢氧化锂中,氢氧根的化合价是-1,可以求出锂元素的化合价是+1.故填:+1.
(3)氢氧化锂和二氧化碳反应的化学方程式为:2LiOH+CO 2 ═Li 2 CO 3 +H 2 O.1年前查看全部
- 金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途。它的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体
金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途。它的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性。
(1)“辣味”属于氢氧化锂的(填“物理”或“化学”,下同)_________性质;“腐蚀性”属于氢氧化锂的__________性质。
(2)LiOH中锂元素的化合价为_________。
(3)载人航天飞船中通常用LiOH代替NaOH来吸收航天员呼吸产生的CO 2 ,则LiOH与CO 2 反应的化学方程式_______________________。 流浪小柚子1年前1
流浪小柚子1年前1 -
 为梦起舞 共回答了20个问题
为梦起舞 共回答了20个问题 |采纳率85%(1)物理;化学
(2)+1
(3)CO 2 +2LiOH==Li 2 CO 3 +H 2 O1年前查看全部
- 有一种锂水电池,可作为鱼雷和潜艇的储备电源.电池以金属锂和钢板为电极材料,LiOH 为电解质,使用时加入水即可
有一种锂水电池,可作为鱼雷和潜艇的储备电源.电池以金属锂和钢板为电极材料,LiOH 为电解质,使用时加入水即可放电.关于该电池的说法正确的是( )
A.钢板为正极,钢板上发生还原反应
B.放电时电子的流动方向是”正极→导线→负极”
C.放电过程中OHˉ向正极作定向移动
D.总反应为:2Li+2 H+═2Li++H2↑ 哭泣的小害虫1年前1
哭泣的小害虫1年前1 -
 山关行足_山关望 共回答了13个问题
山关行足_山关望 共回答了13个问题 |采纳率100%解题思路:锂水电池中,自发的氧化还原反应是金属锂和水之间反应生成氢氧化锂和氢气的过程,根据原电池的工作原理以及电极反应特点和规律来回答.A、电池以金属锂和钢板为电极材料,LiOH 为电解质,锂做负极,钢板为正极,钢板上发生还原反应,故A正确;
B、放电时电子流向为负极--导线--正极,故B错误;
C、原电池中,阴离子移向原电池的负极,即放电时OH-向负极移动,故C错误;
D、锂水电池中,自发的氧化还原反应是金属锂和水之间反应生成氢氧化锂和氢气,即总反应为:2Li+2H2O═2LiOH+H2↑,故D错误.
故选:A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查电化学的热点-锂离子电池,根据总反应式判断出正负极和阴阳极的反应,从化合价变化的角度分析.1年前查看全部
- 金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体
金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性.
(1)“辣味”属于氢氧化锂的(填“物理”或“化学”,下同) ______性质;“腐蚀性”属于氢氧化锂的 ______性质.
(2)LiOH中锂元素的化合价为 ______.
(3)载人航天飞船中通常用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则LiOH与CO2反应的化学方程式 ______. 偶素ff包1年前1
偶素ff包1年前1 -
 ilvft 共回答了14个问题
ilvft 共回答了14个问题 |采纳率85.7%解题思路:(1)由题意“氢氧化锂[LiOH]是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性”,“辣味”属于氢氧化锂的物理性质;“腐蚀性”属于氢氧化锂的化学性质;
(2)LiOH中,氢氧根的化合价为-1价,根据化合价的规律“化合物中化合价的代数和为零”,则可求锂元素的化合价;
(3)由题意,用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则反应物为CO2、LiOH,生成物为Li2CO3、H2O,故根据质量守恒定律,可以书写化学方程式.(1)物质的“色、味、态”为物理性质;“腐蚀性”属于氢氧化锂的化学性质;
(2)氢氧根的化合价为-1价,根据化合价的规律“化合物中化合价的代数和为零”,则设锂元素的化合价为x,
则x+(-1)=0,故x=+1,故LiOH中锂元素的化合价为+1价;
(3)由题意,知反应物为CO2、LiOH,生成物为Li2CO3、H2O,故根据质量守恒定律,可以书写化学方程式CO2+2LiOH=Li2CO3+H2O.
故答为:(1)物理;化学;
(2)+1;
(3)CO2+2LiOH=Li2CO3+H2O点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关元素化合价的计算;化学性质与物理性质的差别及应用.
考点点评: 由题意,找出反应物和生成物、反应条件,根据质量守恒定律,正确书写化学方程式;了解化学性质与物理性质的差别及其应用.1年前查看全部
- 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成 C.放电时OH - 向正极移动 D.总反应为:2Li+2H 2 O="==" 2LiOH+H 2 ↑  kaijie7263131年前1
kaijie7263131年前1 -
 tinaming 共回答了17个问题
tinaming 共回答了17个问题 |采纳率100%C
考生可能迅速选出C项是错误,因为原电池放电时OH - 是向负极移动的。这个考点在备考时训练多次。这种电池名称叫锂水电池。可推测其总反应为:2Li+2H 2 O="==" 2LiOH+H 2 ↑。再写出其电极反应如下:(—)2Li—2e — =2Li + (+)2H 2 O+2e — =2OH — +H 2 ↑
结合选项分析A、B、D都是正确的。此题情景是取材于新的化学电源,知识落脚点是基础,对原电池原理掌握的学生来说是比较容易的。1年前查看全部
- 11.在元素周期表中位于对角线的元素性质有相似性,如锂和镁,下列关于金属锂的说法不正确的是( ).
11.在元素周期表中位于对角线的元素性质有相似性,如锂和镁,下列关于金属锂的说法不正确的是( ).
A.金属锂是最轻的金属 B.锂可以和冷水反应放出氢气
C.碳酸锂可以溶于水 D.氢氧化钠碱性强于氢氧化锂
12.下列说法正确的是 ( ).
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素
C.稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
13.X+、Y+、Z2-是3种主族元素的离子,X+和Z2-具有相同的电子层结构,Y和Z处于同一周期,关于元素X、Y、Z的下列叙述中不正确的是 ( ).
A.原子序数:X>Z>Y B.原子半径:Y>Z>X
C.离子半径:Z2->X+>Y+ D.一定能形成化合物X2Z
14.下列离子方程式书写正确的是( ).
A.向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B.氢氧化钠溶液中通入过量的二氧化硫:SO2+OH-==HSO3-
C.碳酸氢钙溶液中加足量的氢氧化钠液:Ca2++OH-+HCO3-==CaCO3↓+H2O
D.稀硫酸和氢氧化钡溶液:Ba2++SO42-==BaSO4↓
15.在一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若再通入另一种气体,有沉淀生成,则该气体不可能是( ).
A.Cl2 B.NH3 C.H2S D.HCl 邓楚雄1年前2
邓楚雄1年前2 -
 yun203009 共回答了16个问题
yun203009 共回答了16个问题 |采纳率100%CBBBD1年前查看全部
- 有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂( LiAlCl 4 )溶解在亚硫酰氯 (SOCl
有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂( LiAlCl 4 )溶解在亚硫酰氯 (SOCl 2 )中形成的,电池总反应方程式为:8Li+3SOCl 2 ==6LiCl+Li 2 SO 3 +2S。下列有关叙述中,正确的是 [ ]A.金属锂做电池的正极,石墨做电池的负极
B.电池工作过程中,亚硫酰氯(SOCl 2 )被还原为Li 2 SO 3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 隔世狂人1年前1
隔世狂人1年前1 -
 www0371 共回答了16个问题
www0371 共回答了16个问题 |采纳率100%D1年前查看全部
- 金属锂的保存方法还有它和空气中的氧气的反应
金属锂的保存方法还有它和空气中的氧气的反应
感谢帮我的朋友. 落满星辰的夏夜1年前1
落满星辰的夏夜1年前1 -
 zzchizzc 共回答了15个问题
zzchizzc 共回答了15个问题 |采纳率86.7%金属锂化学性质活泼,并且密度很小,所以保存在液体石蜡油中.
4Li + 02 = 2Li2O1年前查看全部
- 金属锂与二氧化碳反应后,锂元素和锰元素化合价变化
 未激活1641年前1
未激活1641年前1 -
 8000008 共回答了14个问题
8000008 共回答了14个问题 |采纳率78.6%打错了吧,是“二氧化锰”
方程式
Li + MnO2 = LiMnO2
锂,0变为+1,氧不变-2
锰,+4变为+3
这是手机锂电池的反应原理1年前查看全部
- 金属锂能在液态石蜡中保存吗?如果能,为什么石蜡的密度比锂大,还能在液态石蜡中
 不aa你的梦-5241年前3
不aa你的梦-5241年前3 -
 wenzi3030 共回答了20个问题
wenzi3030 共回答了20个问题 |采纳率90%锂不可能保存在煤油中,它比煤油轻,保存在液体石蜡中.
石蜡的的主要成分是C、H两种元素的物质混合而成.(可能含有氧元素,但这不主要)其化学式CxHy 相对分子质量一般都金属锂小 在液态下密度更小 所以锂可以融入其中.
石蜡常温下以固体状态存在 在液态下才能对锂起到包袱作用 然后冷却即可1年前查看全部
大家在问
- 1听录音,给下列图片用数字(1~8)标序。
- 2雪,南国松软美丽的雪啊 这句话是拟人吗?
- 3将等物质的量的X2和Y2置于一密闭容器中,在一定条件下发生反应mX2(g)+nY2(g) pZ(g),达平衡时,测得容器
- 4句型转换:(1)It's mad of you to go there alone in such bad weathe
- 5这句话中的第一个die怎样理解?
- 6关于中考的随笔 作文
- 7雪上加霜雪和霜是什么意思5年纪质量检测上有雪上加霜的
- 8地理必修3第一章第一节‘活动’答案
- 9有一块岩石体积为40m³,为了测量它的质量,取一小块作为样品,测出样品的质量为70g,用量筒
- 10表示名词性所有格时,'s和of的区别是什么?
- 11Mary is as heavy as John.《改为比较级》
- 12电源的电动势为8V.内电阻为1欧姆,外电阻有三个电阻,R1为5.8欧姆R2为2欧姆R3为3欧姆.
- 13Many Japanese's lives___(change)because of the earthquake la
- 14作文摘抄20篇,好词8个,好句2个,好段1个,主要内容
- 15在一墙之隔的大门内,夹竹桃却在那里悄悄地一声不响.悄悄的和一声不响不是重复吗、?去掉悄悄的会有什么不同