1L0.2mol/lH2SO4溶液含H2SO40.2mol,(H+)为多少mol/l.
 tzczj2022-10-04 11:39:543条回答
tzczj2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 一灯萤燃 共回答了16个问题
一灯萤燃 共回答了16个问题 |采纳率93.8%- 0.4mol/L.H+是从H2SO4里面电解出来的,一个H2SO4里面有2个H+.所以H+的浓度是H2SO4浓度的2倍.
- 1年前
 28106832 共回答了1个问题
28106832 共回答了1个问题 |采纳率- 0.4mol/L
1mol的H2SO4电离产生2molH+离子,水的电离基本可以忽略了 - 1年前
 出来玩完 共回答了3个问题
出来玩完 共回答了3个问题 |采纳率- 浓度的话不用管溶液的体积,分子式里面H的下标是2,电离会产生2倍溶质H的浓度就是0.4mol/L
- 1年前
相关推荐
- 高二化学期中题用0.01mol/LH2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml.若滴定时终点判
高二化学期中题
用0.01mol/LH2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml.若滴定时终点判断有误差:①多加了一滴H2SO4②少加了一滴H2SO4(设一滴为0.05ml).则①和②c(H+)之比的值为( )
A 10
B 50
C 5*103
D 104 大不流士1年前1
大不流士1年前1 -
 kung_fu 共回答了19个问题
kung_fu 共回答了19个问题 |采纳率94.7%:①多加了一滴H2SO4 (设一滴为0.05mL),
c(H+)=0.01mol/L*2*0.05mL/100mL=0.00001mol/L=10^-5mol/L
②少加了一滴H2SO4(设一滴为0.05mL),
c(OH-)=0.01mol/L*2*0.05/100=10^-5mol/L
c(H+)=10^-14/10^-5=10^-9mol/L
则①和②c(H+)的比值是?
10^-5/10^-9=5*10^41年前查看全部
- 大学化学问题2称取含硫酸铜试样0.6500g,置于250ml锥形瓶中,加入5ml 1mol/LH2SO4和100mlH2
大学化学问题2
称取含硫酸铜试样0.6500g,置于250ml锥形瓶中,加入5ml 1mol/LH2SO4和100mlH2O使之溶解,加入10ml10%的KI溶液,反应完全后,调节酸度至酸性,用C(Na2S2O3)=0.1000mol/L Na2S2O3标液滴定至终点,消耗Na2S2O3体积为25.00ml,计算试样中CuSO4.5H2O的含量?已知CuSO4.5H2O的相对分子质量为249.63 可爱天使猪1年前1
可爱天使猪1年前1 -
 role0915 共回答了19个问题
role0915 共回答了19个问题 |采纳率84.2%太多了,懒得打了,典型的碘量法,利用氧化还原反应测定物质的含量
提示一下就是利用物料守恒,和价态升降的平衡,就是电子守恒
一个一个对比过去,就可以得到铜和硫代硫酸钠的关系,然后算出硫代硫酸钠的量,一比,就可以得到硫酸铜的含量了.1年前查看全部
- 配制0.2mol/lH2SO4溶液500ml,需98%的浓H2SO4(密度1.84g/cm³)____ml
 风中有梦1年前1
风中有梦1年前1 -
 新云山雾罩 共回答了13个问题
新云山雾罩 共回答了13个问题 |采纳率92.3%0.2*0.5=1.84*0.98*x/98,0.5是500ml换算到L,x即为所求1年前查看全部
- (2010•中山模拟)将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1m
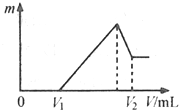 (2010•中山模拟)将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH
(2010•中山模拟)将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH
溶液.请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.
当V1=160mL时,则金属粉末中n(Mg)=______mol,
V2=______mL.
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)=______mL.
(3)若混合物仍为0.1mol,其中Mg粉的物质的量分数为a,用100mL 2mol/L的硫酸溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3.满足此条件的a的取值范围是:______. nmbn1年前1
nmbn1年前1 -
 Andy-eater 共回答了11个问题
Andy-eater 共回答了11个问题 |采纳率54.5%解题思路:(1)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,令MgSO4为xmol,Al2(SO4)3为ymol,根据守恒列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据守恒,有n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al),据此求出n(NaOH),再利用V=[n/c]计算;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4),据此求出n(NaOH),再利用V=[n/c]计算;
(3)反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则a<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用x表示出n(NaAlO2),据此确定a的取值范围.(1)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=[1/2]n(NaOH)=[1/2]×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.1×2-0.08
联立方程,解得:x=0.06、y=0.02
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L+0.04mol=0.44mol,
所以,V2=[0.44mol/1mol/L]=0.44L=440ml,
故答案为:0.06mol,440 mL;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)=[0.4mol/1mol/L]=0.4L=400ml
故答案为:400ml;
(3)由于为金属混合物,则a<1,Al的物质的量为0.1(1-a)mol,反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.1(1-a)mol,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.45×1≥2×0.1×2+0.1(1-a),解得a≥0.5,故0.5≤a<1,
故答案为:0.5≤a<1.点评:
本题考点: 有关混合物反应的计算;镁的化学性质;铝的化学性质.
考点点评: 本题以图象形式考查混合物计算,难度中等,清楚每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化.1年前查看全部
- 配制500ml,0.1mol/LH2SO4溶液需要10mol/LH2SO4的溶液体积是多少?
 ytyt361年前1
ytyt361年前1 -
 cdwulian 共回答了18个问题
cdwulian 共回答了18个问题 |采纳率94.4%n(H2SO4)=0.1*0.5=0.05mol
V(H2SO4)=0.05/10=0.005L=5mL1年前查看全部
- 实验室需要2mol/LH2So4溶液250ml.
实验室需要2mol/LH2So4溶液250ml.
1.配制时需要物质的量浓度为18mol/L浓H2S04_____ ml
2.配制时不需要用到的仪器是____
A.托盘天平 B.烧杯 C.量筒 D.烧瓶 E.500ml容量瓶 F.250ml容量瓶
G.胶头滴管 H.、铁架台 I.玻璃棒 枫霜红叶1年前1
枫霜红叶1年前1 -
 More2003 共回答了11个问题
More2003 共回答了11个问题 |采纳率90.9%浓H2S04___2.7__ ml
A.托盘天平D.烧瓶E.500ml容量瓶H.、铁架1年前查看全部
- 配置下列物质的0.2mol/lH2SO4溶液50ml,需下列物质的质量分别是多少?
 qinqin96111年前1
qinqin96111年前1 -
 zhuzhimin4 共回答了25个问题
zhuzhimin4 共回答了25个问题 |采纳率92%感觉题目不太明确,题目是不是:
配置0.2 mol/L 的硫酸溶液50 ml所需要的硫酸的质量?
如果是这样的,解法如下:
n=c*V=0.2*0.05=0.01 (mol)
m=n*M=0.01*98=9.8 (g)
2个公式.1年前查看全部
- 把2mol/LCuSo4溶液和1mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)计
把2mol/LCuSo4溶液和1mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)计算:1混合液中Cuso4和H2So4的物质的量浓度 2混合液中H+ CU2+ SO2-4的物质的量浓度
 uncleblack1年前1
uncleblack1年前1 -
 黄97043023 共回答了21个问题
黄97043023 共回答了21个问题 |采纳率90.5%1.因为是等体积混合,所以混合后CuSO4和H2SO4的物质的量的浓度1.0mol/L.2.因为混合后H2SO4的物质的量的浓度1.0mol/L,所以H+为2mol/L.cu2+为1.0mol/L.SO42- 的2mol/L.1年前查看全部
- 把2.0mol/L CuSO4溶液和1.0mol/LH2SO4溶液各100mL混合(假设混合后溶液的体积等于混
把2.0mol/L CuSO4溶液和1.0mol/LH2SO4溶液各100mL混合(假设混合后溶液的体积等于混合前两种溶液的体积之和).计算:
(1)混合液中SO42−的物质的量浓度______mol/L;
(2)向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时,生成气体的体积(标准状况)为______L,溶液中Fe2+的物质的量浓度是______mol/L;
(3)向混合溶液中滴加1mol/L的NaOH溶液,使Cu2+恰好完全沉淀,所需NaOH溶液的体积______mL. kgdqumd1年前1
kgdqumd1年前1 -
 白天是hhwh 共回答了15个问题
白天是hhwh 共回答了15个问题 |采纳率93.3%解题思路:(1)计算硫酸根的总的物质的量,再根据c=[n/V]计算混合溶液中SO42-的物质的量浓度;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铁、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-).
(3)滴加氢氧化钠先是和硫酸之间中和,然后再和硫酸铜之间反应,根据反应量的关系:2NaOH~H2SO4,2NaOH~CuSO4进行计算.(1)2.0mol/L CuSO4溶液和1.0mol/LH2SO4溶液各100mL混合后硫酸根的总的物质的量是0.2mol+0.1mol=0.3mol,混合溶液中SO42-的物质的量浓度=[0.3mol/0.2L]=1.5mol/L,故答案为:1.5mol/L;
(2)向溶液中加入足量铁粉,Fe+2H+=Fe2++H2↑,氢离子的物质的量是0.2mol,所以产生出氢气的物质的量是0.1mol,体积是2.24L,向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铁、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,故答案为:2.24;1.5;
(3)滴加氢氧化钠先是和硫酸之间中和,然后再和硫酸铜之间反应,根据反应量的关系:2NaOH~H2SO4,2NaOH~CuSO4,所以消耗氢氧化钠的物质的量=1.0mol/L×0.1L×2+2.0mol/L×0.1L=0.4mol,体积是V=[n/c]=[0.4mol/1mol/L]=0.4L=400mL,故答案为:400.点评:
本题考点: 物质的量浓度的相关计算;化学方程式的有关计算.
考点点评: 本题考查学生金属铁以及化合物的性质,注意氢氧化钠和硫酸铜、硫酸混合物反应时的先后顺序是关键,难度不大.1年前查看全部
- 100ml,0.1mol/lH2SO4与100ml,0.15mol/lNaOH混合,求PH值!
 2440174331年前1
2440174331年前1 -
 晓丁当 共回答了15个问题
晓丁当 共回答了15个问题 |采纳率86.7%H2SO4 + 2NaOH = H2O + NA2SO4
0.01mol 0.015mol
所以反应结束后还剩0.005mol的H+,除以溶液体积可得CH+=0.025mol/l 取10的对数:PH=-1.61年前查看全部
- 将3.84克Fe3O4完全溶解在100毫升1mol/LH2SO4中,然后加入K2Cr2O7溶液25ml,恰好使溶液中Fe
将3.84克Fe3O4完全溶解在100毫升1mol/LH2SO4中,然后加入K2Cr2O7溶液25ml,恰好使溶液中Fe2+全部转化为Fe3+,(Cr2O7)2-离子全部还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为多少
1mol/L, 开心辣子1年前1
开心辣子1年前1 -
 shzwm723 共回答了18个问题
shzwm723 共回答了18个问题 |采纳率94.4%3.48gFe3O4为0.015mol,100ml 1mol/L的硫酸中硫酸的含量为0.1mol
3.48gFe3O4完全反映需要硫酸 0.015mol*4=0.06mol
硫酸足量,所以Fe3O4完全反映
生成Fe2+ 0.015mol Fe3+ 0.03mol
在氧化还原反应中,0.015molFe2+变为Fe3+,电子转移0.015mol.
Cr由原来的+6价降为+3价,所以参加反应的Cr为 0.015/(6-3)=0.005mol
而K2Cr2O7的mol量就应该为0.005mol/2=0.0025mol
质量浓度就是 0.0025mol/25ml=0.1mol/L1年前查看全部
- 配制250mL 1.0mol/LH2SO4溶液,需要18mol/LH2SO4溶液的体积是多少?
 zyxjxs43211年前1
zyxjxs43211年前1 -
 周周庭 共回答了22个问题
周周庭 共回答了22个问题 |采纳率90.9%设需要的体积是v
250ml=0.25l
0.25l X 1.omol/L = 18mol/L X v
v=1/72L1年前查看全部
- 求下列溶液的pH(常温条件下混合溶液忽略体积的变化)K;(已知lg2=0.3)。 1. 0.005mol/LH2SO4溶
求下列溶液的pH(常温条件下混合溶液忽略体积的变化)K;(已知lg2=0.3)。 1. 0.005mol/LH2SO4溶液
2. 0.1mol/LCH3COOH溶液(已知CH3COOH溶液电离常数Ka=1.8×10 -5)
3. 0.1mol/LNH3。H2O溶液(NH3。H2O的电离度为a=1%,电离度=已电离的弱电解质浓度/弱电解质的初始浓度×100%)
4.将pH=8的NaOH与pH=10的NaOH溶液等体积混合
5.常温下将pH=5的盐酸与pH=9的NaOH溶液以体积比11:9等体积混合
6.将pH=3的HCl与pH=3的H2SO4等体积混合
7.0.001mol/L的NaOH溶液
8.pH=2的盐酸与等体积的水混合
9.pH=2的盐酸加水稀释到1000倍
 zhuzhu0081年前0
zhuzhu0081年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将500ml4mol/LH2SO4与 1000ml1mol/LNaSO4溶液混合,混合液总体积为1500ml,则次混合液
将500ml4mol/LH2SO4与 1000ml1mol/LNaSO4溶液混合,混合液总体积为1500ml,则次混合液中硫酸根的物质的量的浓度是多少?
 smm5551年前3
smm5551年前3 -
 sxczhsg 共回答了16个问题
sxczhsg 共回答了16个问题 |采纳率81.3%n=0.5*4 + 1.0*1 =3 mol
c=n/v =3/1.5 =2 mol/L1年前查看全部
- 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L N
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH
溶液.请回答:

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.
当V1=160mL时,则金属粉末中n(Mg)=______mol,
V2=______mL.
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)=______mL.
(3)若混合物仍为0.1mol,其中Mg粉的物质的量分数为a,用100mL 2mol/L的硫酸溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3.满足此条件的a的取值范围是:______. qingsad1年前1
qingsad1年前1 -
 hounut 共回答了14个问题
hounut 共回答了14个问题 |采纳率92.9%解题思路:(1)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,令MgSO4为xmol,Al2(SO4)3为ymol,根据守恒列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据守恒,有n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al),据此求出n(NaOH),再利用V=[n/c]计算;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4),据此求出n(NaOH),再利用V=[n/c]计算;
(3)反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则a<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用x表示出n(NaAlO2),据此确定a的取值范围.(1)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=[1/2]n(NaOH)=[1/2]×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.1×2-0.08
联立方程,解得:x=0.06、y=0.02
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L+0.04mol=0.44mol,
所以,V2=[0.44mol/1mol/L]=0.44L=440ml,
故答案为:0.06mol,440 mL;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)=[0.4mol/1mol/L]=0.4L=400ml
故答案为:400ml;
(3)由于为金属混合物,则a<1,Al的物质的量为0.1(1-a)mol,反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.1(1-a)mol,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.45×1≥2×0.1×2+0.1(1-a),解得a≥0.5,故0.5≤a<1,
故答案为:0.5≤a<1.点评:
本题考点: 有关混合物反应的计算;镁的化学性质;铝的化学性质.
考点点评: 本题以图象形式考查混合物计算,难度中等,清楚每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化.1年前查看全部
- 1等量的镁铝合金粉末分别于下列4种过量的溶液充分反应,放出氢气最多的是A2mol/LH2SO4 B18MOL
1等量的镁铝合金粉末分别于下列4种过量的溶液充分反应,放出氢气最多的是A2mol/LH2SO4 B18MOL/LH2SO4 C6MOL/LKOH D3MOL/LHNO3 2.铁和铜的混合粉末投入到稀硝酸中,带反应停之后 铜有剩余 则溶液中一定存在的阳离子A 铜离子 亚铁离子b亚铁离子c亚铁离子铁离子d铜离子铁离子 3.在10ML0.01MOL/L的纯碱溶液中不断搅拌并加1.2ML0.05MOL/L的盐酸 完全反映后,在标况下生成的CO2为什么是0? 4.CuCO3和Cu(OH)2CO3的混合物34.6g可恰好完全溶解于300ML2MOL/L的盐酸中 加热分解等质量的这种混合物可得氧化铜的质量是A16g b19.2g c24g d30.6g 5.将铝和过氧化钠混合溶于足量的水中 得到澄清溶液 同时产生3.5g气体 向所得的溶液中加入200ML 3.5MOL/L的盐酸 现有沉淀出现 随后沉淀恰好溶解 则铝和过氧化钠的物质的量之比A1;2 b1;4 c11;2 d2;11 6.向一定量的铁 氧化铁 四氧化三铁 氧化亚铁的混合物中加入100ML 1MOL/L的盐酸,恰好是混合物完全溶解 在所得的溶液中加入KSCN溶液 无血红色出现 若用足量的CO在高温下还原相同质量的此混合物 能得到的铁的质量为A 11.2g b 5.6g c 2.8g d无法确定 7.将钠镁铝各0.3MOL 分别放入100ML 1MOL/L的盐酸中 同温同压下产生的气体之比A 1;2;3 b 6;3;2 c 3;1;1 d 1;1;1 8.足量的铜与一定量的浓硝酸反映 得到硝酸铜溶液和二氧化氮 四氧化二蛋 一氧化氮的混合气体 这些气体与1.68L氧气混合后通入水中 所有气体恰好被水吸收生成硝酸 项所得的硝酸铜溶液中加入5MOL/L的氢氧化钠溶液至铜离子恰好完全沉淀 消耗的NaOH 的体积A 60ML B45ML C30ML D15ML 9 洗掉氯化钠晶体表面的少量氯化钾 为什么用75%的乙醇? 打这些符号不容易 拜谢!
 mao_271年前1
mao_271年前1 -
 思斑芽7 共回答了11个问题
思斑芽7 共回答了11个问题 |采纳率90.9%1 A,镁铝均与稀H2SO4反应,生成H2量多;铝与18mol/LH2SO4钝化,不生成H2;镁不与KOH反应;镁铝与HNO3反应生成NO,不生成H2
2 B,有铜剩余,溶液中不可能有铁离子,若铁与硝酸恰好反应完,溶液中没有铜离子.
3 盐酸是后滴加的,少量的盐酸先与纯碱反应,Na2CO3+HCl=NaHCO3+NaCl,纯碱为0.0001mol,HCl为0.00006mol,纯碱过量,不发生盐酸与碳酸氢钠的反应,不生成CO2
4 C,两种盐与盐酸反应均生成CuCl2,恰好反应,根据元素守恒,由盐酸的量可求Cu2+=0.3mol,第二个反应中两种盐均生成CuO,质量为0.6*0.3=24g
5 A,根据反应方程式可知,Na2O2:O2=2:1,Al:H2=2:3,设Na2O2为xmol,O2为ymol,则O2为x/2,H2为3y/2,列方程为x/2*16+3y/2*2=3.5,另由于反应后Na变成NaCl,Al变为AlCl3,根据氯元素守恒,列方程为2x+3y=0.7,解得x=0.2,y=0.1,作比,y:x=1:2
6 C,该混合物与盐酸反应,加KSCN不变红,说明铁元素均生成FeCl2,由盐酸为0.1mol ,可知铁原子为0.05mol.混合物与CO反应均生成铁,即0.05mol*56g/mol=2.8g
7 C,Na全部反应生成H2(酸不足可与水反应),即0.15mol,镁铝与酸反应时均过量,利用盐酸的量进行计算,即0.1*1/2=0.05mol,三个数作比,为3:1:1
8 A 不太好解释,对付看吧.硝酸与铜反应时得电子生成氮的氧化物,氮的氧化物与O2反应又生成硝酸,所以第一个反应转移的电子数与第二个反应中转移的电子数相等,且第一个反应中电子是由Cu失去的,故Cu失电子数等于O2得电子数,2molCu失4mol电子,1molO2得4mol电子,由O2为0.075mol可知Cu为0.15mol,若最后生成Cu(OH)2,可知NaOH为0.3mol,除以浓度,体积为60mL.1年前查看全部
- 将20ml0.1mol/LH2SO4和30ml0.15mol/LNaOH溶液混合,则混合溶液pH为多少?
将20ml0.1mol/LH2SO4和30ml0.15mol/LNaOH溶液混合,则混合溶液pH为多少?
为什么不是11? ttr401年前1
ttr401年前1 -
 happy34a 共回答了16个问题
happy34a 共回答了16个问题 |采纳率100%2NaOH+H2SO4=Na2SO4+H2O
2 1
0.03*0.15 X
X=0.03*0.15/2=0.00225
反应后溶液中氢离子的浓度【H+】=2*(0.02*0.1-0.00225)/(0.02+0.03)=0.01
故PH=21年前查看全部
- 有关高中化学的一道题25℃,0.01mol/LH2SO4溶液中,水电离出的氢离子浓度是:A、0.01mol/LB、0.0
有关高中化学的一道题
25℃,0.01mol/LH2SO4溶液中,水电离出的氢离子浓度是:
A、0.01mol/L
B、0.02mol/L
C、10-12mol/L
D、10-12mol/L
求答案和详解,谢啦~! 00久久1年前1
00久久1年前1 -
 mywqq 共回答了14个问题
mywqq 共回答了14个问题 |采纳率85.7%因为水和稀溶液中存在Kw=c(H+)·c(OH-)=1×10^-14;0.01mol/LH2SO4溶液中,c(H+)=0.01×2=0.02mol/L,所以c(OH-)=1×10^-14/0.02,=5×10^-13mol/L,水电离出1个OH-,同时出1个H+,所以水电离出的氢离子浓度是5×10^-13mol/L1年前查看全部
- 需配制1mol/LH2SO4溶液500ml需用质量分数为98%,密度为1.84的H2SO4多少ml?
 aa专用aa1年前1
aa专用aa1年前1 -
 电影评介 共回答了16个问题
电影评介 共回答了16个问题 |采纳率81.3%需要硫酸的物质的量是0.5摩尔,所以硫酸的质量需要0.5摩尔*98=49克,所以需要溶液质量49克/98%=50克,所以体积就是50克/1.84=27.1ml1年前查看全部
- (1)25℃时,0.05mol/LH2SO4溶液的PH=______;0.05mol/LBa(OH)2溶液PH=____
(1)25℃时,0.05mol/LH2SO4溶液的PH=______;0.05mol/LBa(OH)2溶液PH=______;
(2)已知100℃时,KW=1×10-12.在该温度下,将100ml0.001mol/L的NaOH溶液加水稀释至1L,则该溶液的PH=______. njwangbais1年前1
njwangbais1年前1 -
 羡慕女孩 共回答了22个问题
羡慕女孩 共回答了22个问题 |采纳率95.5%解题思路:(1)酸溶液中PH=-lg(H+),碱溶液中先计算氢氧根离子浓度,再根据氢离子浓度与氢氧根离子浓度和离子积常数之间的关系式计算;
(2)先计算稀释后溶液中氢氧根离子浓度,再根据离子积常数计算氢原子浓度,从而计算溶液的pH.(1)25℃时,0.05mol/LH2SO4溶液中氢离子浓度=0.05 mol/L×2=0.1mol/L,PH=-lg(H+)=-lg0.1=1,0.05mol/LBa(OH)2溶液中氢氧根离子浓度=0.05 mol/L×2=0.1mol/L,根据离子积常数知,溶液中氢离子浓度=
10−14
0.1mol/L=10-13 mol/L,所以溶液的ph=13,
故答案为:1;13;
(2)稀释后氢氧化钠溶液的浓度=[0.001mol/L×0.1L/1L]=0.0001mol/L,则溶液中氢离子浓度=
10−12
10−4mol/L=10-8 mol/L,则溶液的pH=8,
故答案为:8.点评:
本题考点: pH的简单计算.
考点点评: 本题考查了pH的有关计算,注意温度改变,水的离子积常数改变,明确氢离子浓度、氢氧根离子浓度和离子积常数之间的关系是解本题关键.1年前查看全部
- 将0,1mol镁铝混合物溶于100mL2mol/LH2SO4溶液中,再在混合液中滴加1mol/L的NaOH溶液,
将0,1mol镁铝混合物溶于100mL2mol/LH2SO4溶液中,再在混合液中滴加1mol/L的NaOH溶液,
在滴加溶液的过程中,沉淀质量m随滴加NaOH溶液的体积V变化如图所示.
当V1=160mL时,金属粉末中n(Mg)=_____mol
V2=_____mol
我的解答也在下面.
为什么不对?

 axyz000001年前1
axyz000001年前1 -
 不理狗 共回答了23个问题
不理狗 共回答了23个问题 |采纳率95.7%V2时:Mg(OH)2 + NaAlO2.
n(OH-)=0.06*2 + 0.04*4=0.28mol
V2=160+280=440mL1年前查看全部
- 200mL0.8mol/LH2SO4溶液(d=1.08g/cm3)和100mL98%浓硫酸(d=1.84g/cm3)混合
200mL0.8mol/LH2SO4溶液(d=1.08g/cm3)和100mL98%浓硫酸(d=1.84g/cm3)混合,所得稀溶液的密度为1.2g/cm3,则混合后稀H2SO4的物质的量浓度是多少?
 savechen1年前1
savechen1年前1 -
 后退 共回答了18个问题
后退 共回答了18个问题 |采纳率77.8%本体题目错误
两个密度低于1.2g/cm3的溶液混合后密度一定低于1.2g/cm31年前查看全部
- 将4ml 5mol/LH2SO4用水稀释至100ml,求稀释后硫酸的浓度?
 chengyangl1年前1
chengyangl1年前1 -
 现实就是现实 共回答了15个问题
现实就是现实 共回答了15个问题 |采纳率80%c=4*5/100=0.2mol/L1年前查看全部
- 50ml0.1mol/lbacl2与100ml0.75mol/lh2so4混合,反应后溶液的ph
 54lz1年前2
54lz1年前2 -
 宝贝双星 共回答了28个问题
宝贝双星 共回答了28个问题 |采纳率100%c(H+)===0.75*2*0.1/(0.1+0.05)=1
氢离子没有参与反应的
ph=O1年前查看全部
- 中和20mL0.1mol/LNaOH溶液需要0.05mol/LH2SO4溶液几mL
 warsaw19831年前1
warsaw19831年前1 -
 0独行者0 共回答了18个问题
0独行者0 共回答了18个问题 |采纳率72.2%2NaOH+H2SO4=Na2SO4+2H2O,设0.05mol/LH2SO4溶液为x mL
2 1
20*0.1 x*0.05
故2/20*0.1=1/x*0.05
解得:x=20
所以中和20mL0.1mol/LNaOH溶液需要0.05mol/LH2SO4溶液20mL1年前查看全部
- 25℃时,0.05mol/LH2SO4溶液的pH=______;0.05mol/LBa(OH)2溶液c(H+)=____
25℃时,0.05mol/LH2SO4溶液的pH=______;0.05mol/LBa(OH)2溶液c(H+)=______;某温度下纯水中的c(H+)=2×10-7mol/L,则此时溶液中的c(OH-)=______;若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,则溶液中c(OH-)=______,此时溶液中由水电离产生的c(H+)=______.
 alaome1年前1
alaome1年前1 -
 安东浪子 共回答了22个问题
安东浪子 共回答了22个问题 |采纳率90.9%解题思路:酸溶液中PH=-lgc(H+),碱溶液中先计算氢氧根离子浓度,再根据氢离子浓度与氢氧根离子浓度和离子积常数之间的关系式计算;根据纯水中c(OH-)=c(H+),溶液显示中性进行分析;根据该温度下纯水中氢离子浓度和氢氧根离子浓度,计算出水的离子积,根据水的离子积计算出溶液中氢氧根离子的浓度;25℃时,0.05mol/LH2SO4溶液中氢离子浓度=0.05mol/L×2=0.1mol/L,pH=-lgc(H+)=-lg0.1=1;0.05mol/LBa(OH)2溶液中氢氧根离子浓度=0.05 mol/L×2=0.1mol/L,根据离子积常数知,溶液中氢离子浓度=
10−14
0.1mol/L=1×10-13 mol/L;
纯水显示中性,c(OH-)=c(H+)=2×10-7mol/L;
水的离子积为:2×10-7×2×10-7=4×10-14,溶液中氢离子浓度c(H+)=5.0×10-4mol/L,c(OH-)=
4.0×10−14
5.0×10−4=8×10-11mol/L,
氢氧根离子全部由水电离,纯水中c(OH-)=c(H+),c(OH-)=8×10-11mol/L,所以此时溶液中由水电离产生的c(H+)=8×10-11mol/L;
故答案为:1;1×10-13 mol/L;2×10-7mol/L;8×10-11mol/L;8×10-11mol/L.点评:
本题考点: pH的简单计算;物质的量浓度的相关计算.
考点点评: 本题考查了pH的有关计算,注意温度改变,水的离子积常数改变,明确氢离子浓度、氢氧根离子浓度和离子积常数之间的关系是解本题关键,本题难度不大.1年前查看全部
- 实验室要用18.4mol/LH2SO4溶液配制1.0mol/LH2SO4溶液250mL.
实验室要用18.4mol/LH2SO4溶液配制1.0mol/LH2SO4溶液250mL.
(1)需准确量取18.4mol/L的硫酸______mL.
(2)若配制1.0mol/LH2SO4溶液的其它操作都正确,但出现下列错误操作,其中将使所配制的溶液中H2SO4的物质的量浓度偏低的是(填写序号)______(多选扣分).
A.将稀释后的硫酸转移至容量瓶中后,未洗涤烧杯和玻璃棒.
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外.
C.用胶头滴管向容量瓶中加水时,溶液凹液面高于容量瓶刻度线,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度线相切.
D.用胶头滴管加水时,俯视容量瓶刻度线来定容.
E.若在配制前用另有的1.0mol/LH2SO4溶液润洗容量瓶.
F.未将溶液冷却,移入容量瓶中. iamjj1年前1
iamjj1年前1 -
 守护宁静 共回答了17个问题
守护宁静 共回答了17个问题 |采纳率88.2%解题思路:(1)根据溶液稀释过程中溶质的物质的量不变计算出配制1.0mol/LH2SO4溶液250mL需要浓硫酸的体积;
(2)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)配制1.0mol/LH2SO4溶液250mL,需要浓硫酸的体积为:[1.0mol/L×0.25L/18.4mol/L]≈0.0136L=13.6mL,
故答案为:13.6;
(2)A.将稀释后的硫酸转移至容量瓶中后,未洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,根据c=[n/V]可得,配制的溶液浓度偏低,故A正确;
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外,导致配制的溶液中溶质的物质的量偏小,根据c=[n/V]可得,配制的溶液浓度偏低,故B正确;
C.用胶头滴管向容量瓶中加水时,溶液凹液面高于容量瓶刻度线,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度线相切,导致配制的溶液中溶质的物质的量偏小,根据c=[n/V]可得,配制的溶液浓度偏小,故C正确;
D.用胶头滴管加水时,俯视容量瓶刻度线来定容,导致加入的蒸馏水体积偏小,根据c=[n/V]可得,配制的溶液浓度偏高,故D错误;
E.若在配制前用另有的1.0mol/LH2SO4溶液润洗容量瓶,导致配制的溶液中溶质的物质的量偏大,根据c=[n/V]可得,配制的溶液浓度偏高,故E错误;
F.未将溶液冷却,移入容量瓶中,热的溶液体积偏大,冷却后溶液体积变小,根据c=[n/V]可得,配制的溶液浓度偏高,故F错误;
故答案为:ABC.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- 25℃时,分别求0.05mol/LH2SO4溶液和0.05mol/L Ba(OH)2溶液的PH值.
 9流浪鱼1年前2
9流浪鱼1年前2 -
 631206 共回答了16个问题
631206 共回答了16个问题 |采纳率93.8%0.05mol/LH2SO4溶液的PH=-lg0.1=1
0.05mol/L Ba(OH)2溶液的PH=14+lg0.1=131年前查看全部
- 0.2mol/L的HNO3和0.1mol/LH2SO4溶液的PH大小比较
 xuelian13141年前1
xuelian13141年前1 -
 哈哈袋 共回答了19个问题
哈哈袋 共回答了19个问题 |采纳率89.5%PH值是一样的,因为他们的氢离子浓度相同1年前查看全部
- 0.5mol/LH2SO4(ap) 中氢离子和硫酸根离子物质的量浓度怎么算
 bgcolor1年前1
bgcolor1年前1 -
 comafish 共回答了10个问题
comafish 共回答了10个问题 |采纳率80%1个 H2SO4 里面有 2 个氢离子和 1个 硫酸根离子 所以氢离子 0.5×2=1mol/L 硫酸根离子物质的量浓度 0.5×1=0.5mol/L1年前查看全部
- 求室温条件下,0.05mol/LH2SO4溶液中,水电离出的H+和OH-的浓度
 wgang82081年前3
wgang82081年前3 -
 eFay 共回答了19个问题
eFay 共回答了19个问题 |采纳率78.9%10负十三次方摩尔每升(常温下,H+和OH-的浓度 积等于10的负14次方,由硫酸浓度可知
H+的浓度为0.1,水电离出的H+浓度可忽略,OH-的浓度全由水提供,且水电离出的H+和OH-的浓度 相等,就可以求得答案了1年前查看全部
- 400ml 2mol/lH2SO4溶液中 溶质的质量是多少
 xiaobei07271年前1
xiaobei07271年前1 -
 uen35 共回答了23个问题
uen35 共回答了23个问题 |采纳率82.6%要求对物质的量里的公式熟悉运用.
先根据C=n/v求出溶液的物质的量,再根据n=m/M可求出质量.
即溶液的物质的量n(H2SO4)=Cxv=2mol/Lx0.4L=0.8mol,质量为m(H2SO4)=nxM=0.8molx98g/mol=78.4g1年前查看全部
- 配制250mL0.1mol/LH2SO4溶液,需用18mol/L的H2SO4溶液的体积为多少?
 走走脚没了1年前1
走走脚没了1年前1 -
 wpal 共回答了22个问题
wpal 共回答了22个问题 |采纳率90.9%需要硫酸的n=0.25mL×0.1mol/L=0.025mol v=0.025mol÷18mol/L=1.39ml1年前查看全部
- 将0.06mol/LH2SO4与0.1mol/LNaOH溶液等体积混合后,说的溶液PH为
将0.06mol/LH2SO4与0.1mol/LNaOH溶液等体积混合后,说的溶液PH为
A.1.7 B.2 C.12 D.12.3 香草wawa1年前3
香草wawa1年前3 -
 andywangwei 共回答了21个问题
andywangwei 共回答了21个问题 |采纳率81%设体积各为1L,中和后还有0.2mol/L的H+,所以选B1年前查看全部
- 把2.0mol/LCuSO4溶液和2.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等于混合
把2.0mol/LCuSO4溶液和2.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等于混合
把2.0mol/LCuSO4溶液和2.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前的两种溶液体积之和)
计算:1 混合液中CuSO4和H2SO4的物质的量的浓度
2 混合液中H+ CU2+ SO42- 的物质的量浓度
3 向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余 求此时溶液中Fe2+的物质的量浓度 jfs7711年前3
jfs7711年前3 -
 snoopy129 共回答了17个问题
snoopy129 共回答了17个问题 |采纳率94.1%1.因为是等体积混合,所以混合后CuSO4和H2SO4的物质的量的浓度1.0mol/L.
2.因为混合后H2SO4的物质的量的浓度1.0mol/L,所以H+为2mol/L.cu2+为1.0mol/L. SO42- 的2mol/L.
3.H2SO4+Fe=FeSO4+H2,CuSO4+Fe=FeSO4+Cu.可知均是1:1反应,所以铁离子浓度几位硫酸根离子浓度.即为2mol/L1年前查看全部
- 20℃,将0.10mol/LNa2S203溶液10ml和0.10mol/LH2SO4溶液10ml混合,2min后溶液中明
20℃,将0.10mol/LNa2S203溶液10ml和0.10mol/LH2SO4溶液10ml混合,2min后溶液中明显出现浑浊.
已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃是,同样的反映要明显地出现浑浊,所需时间是( )A.40s B.15s C.48s D.20s zhanleizheng1年前3
zhanleizheng1年前3 -
 kuailekaixin 共回答了14个问题
kuailekaixin 共回答了14个问题 |采纳率78.6%应该是选B吧,假设初始时的反应速率为a,这30°时反应速率为2a,40时为4a,50时为8a,然后120/8等于15.1年前查看全部
- 化学题一道(不难的)把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等
化学题一道(不难的)
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前的两种溶液体积之和)计算:
1)混合液中CuSO4和H2SO4物质的量浓度
2)混合液中氢离子,铜离子,硫酸根离子的量浓度
3)向溶液中加入足量铁粉,经足够长的时间后,有铁粉剩余.此时溶液中的亚铁离子的量浓度. websnow1年前2
websnow1年前2 -
 横刀夺-1 共回答了22个问题
横刀夺-1 共回答了22个问题 |采纳率86.4%等体积混合则溶液总体积为1+1=2L
(1)其中nCuSO4=3.0mol
所以c=n/V=3/2=1.5mol/L
(2)因为nH2SO4=2.0mol
所以nH+=2x2=4mol
所以cH+=4/2=2mol/L
(3)Fe+CuSO4=FeSO4+Cu
Fe+H2SO4=FeSO4+H2
因为铁粉有剩余,知上述两反映均完全反应,此时溶液中nFeSO4=3.0+2.0=5.0mol
所以cFe2+=5/2=2.5mol/L1年前查看全部
- 化学 常温下将10ml0.2mol/LNaOH溶液与10ml0.02mol/LH2SO4溶液充分混合
化学 常温下将10ml0.2mol/LNaOH溶液与10ml0.02mol/LH2SO4溶液充分混合
常温下将10ml0.2mol/LNaOH溶液与10ml0.02mol/LH2SO4溶液充分混合,若混合后溶液的体积为20ml,则混合后溶液的PH=2, 是对的吗/
 amyzhouchang1年前1
amyzhouchang1年前1 -
 贝文劳尔 共回答了18个问题
贝文劳尔 共回答了18个问题 |采纳率88.9%不对
0.2mol/l*0.01l=0.002mol
0.02mol/l*0.01l=0.0002mol
2NAOH+ H2SO4=NA2SO4+2H2O
2MOL 1MOL
0.002MOL 0.0002MOL从反应看出氢氧化钠过量PH值大于71年前查看全部
- 0.5mol/LH2SO4溶液中,H+的物质的量浓度为多少
 manbanp1年前3
manbanp1年前3 -
 China_rock 共回答了21个问题
China_rock 共回答了21个问题 |采纳率100%物质的量浓度的算法与前面学的原子的算法是一样的.就是浓度*下标的个数
0.5mol/LH2SO4中 H+的浓度=0.5mol/L *2=1mol/L1年前查看全部
- 配制250ml1.0mol/LH2SO4溶液,需要5mol/LH2SO4溶液的体积是多少?具体点.
 applegirl1年前1
applegirl1年前1 -
 8天让我爱上你 共回答了22个问题
8天让我爱上你 共回答了22个问题 |采纳率81.8%用 C1 * V1 = C2 * V2 公式:
1.0mol/L * 250ml = 5mol/L * V2
V2 = 0.05L = 50ml
即需要 5mol/L H2SO4 溶液的体积是 50ml .1年前查看全部
- 纯锌棒,纯铜棒,500mL0.5mol/LH2SO4溶液和导线.总质量60,实验后两电极总质量为47.
纯锌棒,纯铜棒,500mL0.5mol/LH2SO4溶液和导线.总质量60,实验后两电极总质量为47.
计算:
(1)收集的氢气体积(标准状况).(2)通过导线的电荷量(已知NA=6.02×10^23mol-1电子的电荷量为1.60×10-19C) 黑老板1年前1
黑老板1年前1 -
 13959865 共回答了12个问题
13959865 共回答了12个问题 |采纳率100%纯锌棒,纯铜棒,总质量60,实验后两电极总质量为47.500mL0.5mol/LH2SO4溶液和导线减少的质量为溶解的锌=60g-47g=13g 负极反应式
Zn - 2e- = Zn2+
65g 2mol
13g 0.4mol
正极反应式
2H+ +2e- = H2
2mol 22.4 L
0.4mol 4.48 L
以上用Zn+H2SO4=ZnSO4+H2做更方便.
Q= 0.4mol *6.02×10^23mol-1*1.60×10^-19C
=3.85*10^4 C1年前查看全部
- 1mol/LCaCL2、1mol/LNaCl、1mol/LH2SO4 比较导电能力大小
 梦萦相思雨1年前2
梦萦相思雨1年前2 -
 gaoqi77 共回答了24个问题
gaoqi77 共回答了24个问题 |采纳率83.3%1mol/LH2SO4 中有4mol/L的导电能力:1×2(两个氢离子)+1×2(硫酸根可以带两个电)
1mol/LCaCL2中有接近4mol/L的导电粒子:同理
1mol/LNaCl中有2mol/L的导电粒子
所以第一个和第二个比较难比较,因为要比较离子或者是离子团的大小.1年前查看全部
- 配制250ml1.0mol/LH2SO4溶液,需用98%的浓硫酸溶液体积为多少?取50ml1.0mol/LH2SO4溶液
配制250ml1.0mol/LH2SO4溶液,需用98%的浓硫酸溶液体积为多少?取50ml1.0mol/LH2SO4溶液与足量的锌反应,在标准状况下产生多少升H2?假设反应前后溶液体积不变,求硫酸锌的物质的,量浓度?
 树根树皮树叶1年前1
树根树皮树叶1年前1 -
 姐夫范干迪1 共回答了20个问题
姐夫范干迪1 共回答了20个问题 |采纳率100%浓硫酸的浓度是:18.4 mol/L
V(浓) = 250*1.0/18.4 = 13.6 mL
V(H2) = 22.4*0.05*1.0 = 1.12 L
c(ZnSO4) = c(H2SO4) = 1.0 mol/L1年前查看全部
- 将镁,铝的混合物1.32克溶于100mol/LH2SO4溶液中,然后低价1mol/NaOH溶液,在
将镁,铝的混合物1.32克溶于100mol/LH2SO4溶液中,然后低价1mol/NaOH溶液,在
将镁、铝的混合物1.32克溶于100mol/LH2SO4溶液中,然后低价1mol/NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量随加入NaOH溶液的体积变化如下图所示,请回答:
(1)当V1=60ml时,则金属粉末中铝的质量百分数是多少?(保留一位小数)
(2)若滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好完全沉淀,则需要加入NaOH溶液的体积是多少毫升?
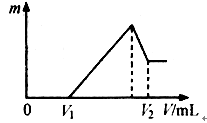 (横坐标是加入NaOH的体积,纵坐标是沉淀的质量)
(横坐标是加入NaOH的体积,纵坐标是沉淀的质量)
H2SO4的浓度是1mol/L qianlimeng1年前1
qianlimeng1年前1 -
 ldp1127 共回答了24个问题
ldp1127 共回答了24个问题 |采纳率87.5%H2SO4的浓度或体积漏写了.补上
0---V1 60mLNaOH是与过量的H2SO4反应, 2NaOH--H2SO4 所以H2SO4过量的30mL.即过量的物质的量为0.03mol.则与混合物反应掉0.07mol
设xmolMg ymoLAl
根据质量:24x+27y=1.32
根据H2SO4:x+1.5y=0.07 解出xy 就可得到答案
(2)当Mg2+ Al3+完全沉淀的时候,溶液中只剩余Na2SO4.所以此时Na+的物质的量是SO42-物质的量2倍.就是NaOH的物质的量是H2SO4的物质的量2倍.H2SO4的物质的量是0.1mol,则此时NaOH的物质的量为0.2mol,NaOH的体积=0.2/1=0.2L=200mL1年前查看全部
- "标况下,在100毫升2mol/LH2SO4溶液加入足量NA2SO3希溶液,可收集到0.2NA个SO2气体分"请问为什么
"标况下,在100毫升2mol/LH2SO4溶液加入足量NA2SO3希溶液,可收集到0.2NA个SO2气体分"请问为什么是错的
 木野完一1年前1
木野完一1年前1 -
 砖如雨下 共回答了19个问题
砖如雨下 共回答了19个问题 |采纳率89.5%SO2可溶于水,逸出的气体一定小于0.2mol1年前查看全部
- 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L N
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH
溶液.请回答:

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.
当V1=160mL时,则金属粉末中n(Mg)=______mol,
V2=______mL.
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)=______mL.
(3)若混合物仍为0.1mol,其中Mg粉的物质的量分数为a,用100mL 2mol/L的硫酸溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3.满足此条件的a的取值范围是:______. pepsi051年前1
pepsi051年前1 -
 马是一个甲 共回答了20个问题
马是一个甲 共回答了20个问题 |采纳率95%解题思路:(1)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,令MgSO4为xmol,Al2(SO4)3为ymol,根据守恒列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据守恒,有n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al),据此求出n(NaOH),再利用V=[n/c]计算;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4),据此求出n(NaOH),再利用V=[n/c]计算;
(3)反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则a<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用x表示出n(NaAlO2),据此确定a的取值范围.(1)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=[1/2]n(NaOH)=[1/2]×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.1×2-0.08
联立方程,解得:x=0.06、y=0.02
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L+0.04mol=0.44mol,
所以,V2=[0.44mol/1mol/L]=0.44L=440ml,
故答案为:0.06mol,440 mL;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)=[0.4mol/1mol/L]=0.4L=400ml
故答案为:400ml;
(3)由于为金属混合物,则a<1,Al的物质的量为0.1(1-a)mol,反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.1(1-a)mol,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.45×1≥2×0.1×2+0.1(1-a),解得a≥0.5,故0.5≤a<1,
故答案为:0.5≤a<1.点评:
本题考点: 有关混合物反应的计算;镁的化学性质;铝的化学性质.
考点点评: 本题以图象形式考查混合物计算,难度中等,清楚每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化.1年前查看全部
- 如何在实验室配制100毫升 2.0mol/LH2SO4溶液
 你的猫头1年前3
你的猫头1年前3 -
 MELONI 共回答了21个问题
MELONI 共回答了21个问题 |采纳率71.4%如果原溶液为浓硫酸 一般的浓硫酸大概是c1=18mol/L如果要求不是很精确的话 可以用量筒和烧杯配制,具体步骤为,1.计算c1v1=c2v2 即 18*v=100*2 解得需要浓硫酸的体积为 11.11ml2.在烧杯内加入约(100-11.11)=88.89ml的...1年前查看全部
- 2.7g铝与100mL2mol/LH2SO4反应.加25mL4mol/LNaOH.其结果不会是 A.所得溶液呈碱性 B得
2.7g铝与100mL2mol/LH2SO4反应.加25mL4mol/LNaOH.其结果不会是 A.所得溶液呈碱性 B得澄清透明溶液 C.取少量溶液,通CO2无现象 D.取少量溶液,加NaOH,有白色沉淀
2.7g铝与100mL2mol/LH2SO4反应。再加25mL4mol/LNaOH。其结果不会是 A.所得溶液呈碱性 B得澄清透明溶液 C.取少量溶液,通CO2无现象 D.取少量溶液,加NaOH,有白色沉淀
(注意是先加H2SO4,反应后再加NaOH) 5519731年前4
5519731年前4 -
 zhenaiyongyua 共回答了23个问题
zhenaiyongyua 共回答了23个问题 |采纳率91.3%C是对的啊,如果说C有现象,就是说明A正确了,在碱性溶液里,通co2会发生双水解反应.有沉淀产生1年前查看全部
- 配制0.184mol/L的硫酸时,向1000ml容量瓶中注入10ml18.4mol/LH2SO4,不断振荡,加水至刻度.
配制0.184mol/L的硫酸时,向1000ml容量瓶中注入10ml18.4mol/LH2SO4,不断振荡,加水至刻度.为什么不对?
 业务流程1年前2
业务流程1年前2 -
 tvrynifqp 共回答了12个问题
tvrynifqp 共回答了12个问题 |采纳率75%因为容量瓶是有温度限制的,而浓硫酸稀释时会大量放热,使得容量瓶受热膨胀,导致刻度不准确,因此不能直接在容量瓶里稀释定容,而应该先用蒸馏水在烧杯中稀释浓硫酸后再加入容量瓶定容.1年前查看全部
大家在问
- 1怎样开某人的玩笑用英语怎么说
- 2谓其人曰,谓的意忠
- 3see sb to doing
- 4四条直线相交如图:已知:∠1=70°,∠2=110°,∠4=80°,则求∠3
- 5小明利用物理课本与铅笔进行实验得出滚动摩擦比滑动摩擦小得多的结论,问他怎样实
- 6用4B铅笔和4H铅笔效果有什么不同?为什么大多数人写字选择HB而不使用4B或4B呢
- 7英语翻译是“想念你们大家”还是“我想念你的全部?”
- 82mol CH4中含___个C,含____个H 顺便写下解题过程
- 9关于绿化铁水解平衡移动的问题1在氯化铁溶液中加入铁粉,其平衡移动方向是?氢离子的物质的量会增大还是减少?PH值?现象?2
- 10只看第4小题
- 11一本多功能字典打九折后的售价是63元.你知道这本多功能字典的原价是多少元吗?
- 12一本字典降价30%后每本售价18.2元.这本字典原价多少元
- 13电气设计中照度计算,如下图.维护系数、利用系数取值?
- 14圆形角都是90°的扇形OAB与扇形OCD叠放在一起(如图)连接AC,BD
- 15请解析如何看图得出答案,并说明甲和乙的运动轨迹是如何运动的,
