把2mol/LCuSo4溶液和1mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)计
 uncleblack2022-10-04 11:39:541条回答
uncleblack2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 黄97043023 共回答了21个问题
黄97043023 共回答了21个问题 |采纳率90.5%- 1.因为是等体积混合,所以混合后CuSO4和H2SO4的物质的量的浓度1.0mol/L.2.因为混合后H2SO4的物质的量的浓度1.0mol/L,所以H+为2mol/L.cu2+为1.0mol/L.SO42- 的2mol/L.
- 1年前
相关推荐
- 配置1mol/LCuSO4溶液100mL,需要CuSO4的质量为多少?需要CuSO4,5H2O为多少?(求过程)
 简单心静1年前1
简单心静1年前1 -
 jill929 共回答了22个问题
jill929 共回答了22个问题 |采纳率90.9%n=cV=1×0.1=0.1mol
mCuSO4=160×0.1=16g
mCuSO4·5H2O=250×0.1=25g
160,250分别是两个物质的相对分子量1年前查看全部
- 把1.0mol/LCUSO4溶液、1.0mol/LFe2(so4)3溶液等体积混合,向溶液加入足量铁粉,经足够长时间后铁
把1.0mol/LCUSO4溶液、1.0mol/LFe2(so4)3溶液等体积混合,向溶液加入足量铁粉,经足够长时间后铁粉有剩余 此时溶液中Fe2+的物质的量浓度为
 fsdf254441年前1
fsdf254441年前1 -
 zb630 共回答了16个问题
zb630 共回答了16个问题 |采纳率100%电荷守恒就知道了,在这之前必须要知道铜离子可以被铁置换出来,铁离子可以氧化铁,成为亚铁离子.由题可知铁粉有剩余.CFe2+=4,mol/L1年前查看全部
- 0.1mol/LCuSO4、Na2SO4、Al2(SO4)3三种溶液各50mL,若上述三种溶液中硫酸根离子完全沉淀,所用
0.1mol/LCuSO4、Na2SO4、Al2(SO4)3三种溶液各50mL,若上述三种溶液中硫酸根离子完全沉淀,所用相同浓度的氯化钡溶液体积比为()
A.1:2:3 B.3:1:1 C.6:3:2 D.1:1:3 theoneonly-1年前2
theoneonly-1年前2 -
 吹笛子的猞猁 共回答了22个问题
吹笛子的猞猁 共回答了22个问题 |采纳率90.9%0.1mol/L的三种溶液各50mL,那么其中SO42-的物质的量之比是1:1:3;又因为Ba2+与SO42-是1:1沉淀,对应的物质的量之比也是1:1:3,因此体积比自然是1:1:3咯1年前查看全部
- 配制1mol/LCuSO4溶液250ml需要溶质质量分数为16%,密度为1g/cm3的CuSO4溶液
配制1mol/LCuSO4溶液250ml需要溶质质量分数为16%,密度为1g/cm3的CuSO4溶液
多少ml ruby19851年前1
ruby19851年前1 -
 留个人给我 共回答了21个问题
留个人给我 共回答了21个问题 |采纳率95.2%溶质质量分数为16%,密度为1g/cm3的CuSO4溶液,其物质的量浓度为
c1=1000ρw/M=1000*1*16%/160=1(mol/L)
正好需要250mL1年前查看全部
- 将1L含有0.4mol/LCuSO4和0.2mol/LNaCl的水溶液用惰性电极电解一段时间后.
将1L含有0.4mol/LCuSO4和0.2mol/LNaCl的水溶液用惰性电极电解一段时间后.
将1L含有0.4mol/LCuSO4和0.2mol/LNaCl的水溶液用惰性电极电解一段时间后,在一个电极上得0.3molCu,另一电极上析出气体(在标准状况下)的体积是( )
A4.48L B5.6L C6.72L D13.44L
选什么?为什么?请详细说明. wishmerill1年前2
wishmerill1年前2 -
 cc人惹谁啦 共回答了14个问题
cc人惹谁啦 共回答了14个问题 |采纳率85.7%因为得失电子守恒,所以生成0.3molCu得到0.6mol电子,那么失去电子的先为Cl-有0.2mol共失去0.2mol电子.生成0.1mol气体.然后又有OH-失去电子0.4mol,得到0.1mol氧气,所以气体共得到0.2mol,共4..48L.
答案为:A1年前查看全部
- 在25℃时,用石墨电极电解2.0l,2.5mol/lcuso4溶液
在25℃时,用石墨电极电解2.0l,2.5mol/lcuso4溶液
在25℃时,用石墨电极电解2.0L,2.5mol/LCuSO4溶液,如有0.2mol电子发生转移,试回答下列问题:
(1)阴极发生 反应,电极反应为 .
(2)阳极发生 反应,电极反应为 .
(3)电解后得到的Cu的质量是 ,得到O2的体积(标准状况)是 ,溶液的PH是 .
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的PH
(填“变小”、“变大”或“不变”) changjinw1年前1
changjinw1年前1 -
 阿弥陀佛54429 共回答了13个问题
阿弥陀佛54429 共回答了13个问题 |采纳率100%(1)阴极发生还原反应:Cu2+ + 2e === Cu;
(2)阳极发生氧化反应:2H2O - 4e === 4H+ + O2↑
(3)m(Cu)=64*0.2/2=6.4g;V(O2)=22.4*0.2/4=1.12L;c(H+)=0.2/2=0.1mol/L,pH=1;
(4)12.8g;不变.1年前查看全部
- 将铜丝插入浓度为1mol/LCuSO4溶液,银丝插入浓度为1mol/L的AgNO3溶液,组成原电池(E ag+/ag=0
将铜丝插入浓度为1mol/LCuSO4溶液,银丝插入浓度为1mol/L的AgNO3溶液,组成原电池(E ag+/ag=0.779V E cu2+/cu=0.34V Kf(Cu(NH3)4)2+)=4.8*10∧12)
(1)用电池符号表示该原电池并计算其电池电动势
(2)若加氨气于CuSO4溶液,使达到平衡时氨的浓度为1mol/L,计算电池电动势(忽略加氨后溶液体积的变化) 无脑小资1年前2
无脑小资1年前2 -
 CoreDump_ 共回答了16个问题
CoreDump_ 共回答了16个问题 |采纳率100%(1)
(-)Cu|Cu2+(1mol/L)||Ag+(1mol/L)|Ag(+) 由于浓度都是1mol/L,所以电极电势等于标准电极电势
E=E+-E-=0.779V-0.34V=0.44V
(2)
由Kf算出此时Cu2+浓度为2.1x10^-13mol/L
根据能斯特方程 E=Eo+(0.0592V/2)xlg2.1x10^-13=-0.035V
E=E+-E-=0.779V-(-0.035V)=0.814V1年前查看全部
- 把50ml2mol/LCuso4溶液和50ml1mol/LFe2(so4)3溶液混合,需加入2mol/L的Bacl2溶液
把50ml2mol/LCuso4溶液和50ml1mol/LFe2(so4)3溶液混合,需加入2mol/L的Bacl2溶液多少mL才能使混合溶液中的硫酸根全部沉淀?产生沉淀质量多少克
 流浪半生1年前1
流浪半生1年前1 -
 东长西忘 共回答了17个问题
东长西忘 共回答了17个问题 |采纳率88.2%根据浓度和体积得到硫酸根的物质的量总和为0.05x2+0.05x1x3=0.25mol,所以需要氯化钡体积v=n/ c=0.25/2=0.125mol/L,产生硫酸钡0.25mol质量0.25gx233g/mol=58.25g1年前查看全部
- 将30mL0.2mol/LNaOH溶液加入20mL0.2Mol/LCuSO4溶液中 得到绿色沉淀和无色溶液 如何判断出沉
将30mL0.2mol/LNaOH溶液加入20mL0.2Mol/LCuSO4溶液中 得到绿色沉淀和无色溶液 如何判断出沉淀的化学式?
 wangzilun_lu1年前3
wangzilun_lu1年前3 -
 QQwanghuei 共回答了14个问题
QQwanghuei 共回答了14个问题 |采纳率85.7%NaOH的物质的量是0.2*0.03=0.006mol
CuSO4的物质的量是0.2*0.02=0.004mol
CuSO4+ 2NaOH=Cu(OH)2↓+Na2SO4
1 2
0.03x0.2 0.02x0.2
1x0.02x0.2 >2x0.03x0.2 所以CuSO4过量
CuSO4+ 2NaOH= Cu(OH)2↓+Na2SO4
2 1
0.2x0.03 X
X=0.03mol
无色溶液代表溶液里面不含Cu2+离子 还剩0.2x0.2-0.03=0.01mol CuSO4晶体
3Cu(OH)2·CuSO41年前查看全部
- 下列四种装置中,均盛200mL的溶液.①0.005mol/LCuSO4溶液②0.01mol/LH2SO4③ZnCl2溶液
下列四种装置中,均盛200mL的溶液.①0.005mol/LCuSO4溶液②0.01mol/LH2SO4③ZnCl2溶液 ④KCl溶液.
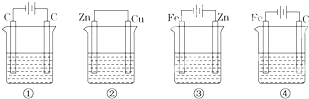
(1)上述四种装置中,为电解池的是______(用编号回答),装置①中两电极的电极反应式分别是阴极:______,阳极:______;
(2)若将装置④中的外加电源拆去,用导线将两个电极连接,则Fe极上发生的反应是______,C极上发生的反应是______.
(3)工作一段时间后,测得导线上均通过0.003mol电子,则上述四种装置中溶液pH最小的是______(用编号回答,溶液体积变化忽略不计). xdx1631年前1
xdx1631年前1 -
 笑天行 共回答了15个问题
笑天行 共回答了15个问题 |采纳率93.3%解题思路:(1)有外接电源的属于电解池,没有外接电源的属于原电池,装置①中是用惰性电极电解硫酸铜溶液,阳极上氢氧根离子放电,阴极上铜离子放电;
(2)装置④中的外加电源拆去,用导线将两个电极连接,该装置中电解质溶液呈中性,铁发生吸氧腐蚀,铁易失电子作负极,碳作正极;
(3)根据各个装置中氢离子或氢氧根离子浓度变化判断.(1)有外接电源的属于电解池,没有外接电源的属于原电池,所以属于电解池的是①③④,
装置①中是用惰性电极电解硫酸铜溶液,阳极上氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2↑,阴极上铜离子放电,电极反应式为Cu2++2e-=Cu,
故答案为:①③④;Cu2++2e-=Cu;4OH--4e-=2H2O+O2↑;
(2)装置④中的外加电源拆去,用导线将两个电极连接,该装置中电解质溶液呈中性,铁发生吸氧腐蚀,铁易失电子作负极,碳作正极,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe,
正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:Fe-2e-=Fe;O2+2H2O+4e-=4OH-;
(3)①电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,导致溶液酸性增强;
②中锌失电子发生氧化反应,氢离子得电子发生还原反应,导致溶液中氢离子浓度减小,溶液的PH增大;
③中阳极上锌失电子发生氧化反应,阴极上氢离子放电,导致溶液中氢离子浓度减小,溶液的pH增大;
④中阳极上氯离子放电,阴极上氢离子放电,导致溶液中氢离子浓度减小,溶液的PH增大,
所以则上述四种装置中溶液pH最小的是①,
故选①.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,难度不大.1年前查看全部
- 10ml.01mol/LCuSo4溶液中加入10mL0.15mol/LNaOH溶液产生蓝色沉淀,铜离子和氢氧根离子完全沉
10ml.01mol/LCuSo4溶液中加入10mL0.15mol/LNaOH溶液产生蓝色沉淀,铜离子和氢氧根离子完全沉淀,沉淀成分是
 十六野人1年前3
十六野人1年前3 -
 推诚相见 共回答了17个问题
推诚相见 共回答了17个问题 |采纳率82.4%氢氧化铜,1年前查看全部
- :在下列溶液中通入H2S气体至饱和,(大约0.1mol/L).分析剩下Cu离子浓度(1)0.1mol/LCuSO4 (2
:在下列溶液中通入H2S气体至饱和,(大约0.1mol/L).分析剩下Cu离子浓度(1)0.1mol/LCuSO4 (2)0.1mol/LCuSO4和0.1mol/L HCL的混合溶液
 Wo wo_oo1年前1
Wo wo_oo1年前1 -
 秋天的枫与栀 共回答了13个问题
秋天的枫与栀 共回答了13个问题 |采纳率92.3%用Ksp,Ka1,Ka2计算呀1年前查看全部
- 把50mL0.2mol/LCuSO4溶液和50ml1mol/LFe2(SO4)3溶液混合,需加入2mol/L的BaCl2
把50mL0.2mol/LCuSO4溶液和50ml1mol/LFe2(SO4)3溶液混合,需加入2mol/L的BaCl2溶液多少ml才能使混合溶液
中的SO42-全部沉淀?产生沉淀质量多少g? 昕虞1年前2
昕虞1年前2 -
 我是BQLJ 共回答了21个问题
我是BQLJ 共回答了21个问题 |采纳率90.5%50mL0.2mol/LCuSO4溶液和50ml1mol/LFe2(SO4)3溶液混合后n(SO42-)===0.05*0.2 + 0.05*1*3==0.16 mol又BaSO4~SO42-~BaCl21 10.16 xx==0.16 mol则0.16 mol BaCl2体积为 0.16/2==0.08 L ==80 ml1年前查看全部
- 把2mol/lCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液体积等于混合前两种溶液的体积之和)
把2mol/lCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液体积等于混合前两种溶液的体积之和).计算:
1)混合液中CuSO4和H2SO4的物质的量浓度?
2)混合液中H+,Cu2+,硫酸根的物质的量浓度?
3)向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度? 深蓝一色1年前1
深蓝一色1年前1 -
 mm欺负我 共回答了17个问题
mm欺负我 共回答了17个问题 |采纳率64.7%因为是等体积,所以设体积为1L n(CuSO4)=0.2mol/L*1L=0.2mol n(H2SO4)=1.0mol/L*1L=1.0mol 假如混合后总体积不变,则c(CuSO4)=0.2mol/2L=0.1mol/L c(H2SO4)=1.0mol/2L=0.5mol/L c(Cu2+)=c(CuSO4)=0.1mol/L c(H+)=2c(H2...1年前查看全部
- 在盛有500ml,0.1mol/LCuSO4和0.4mol/LH2SO4混合溶液的大烧杯中,用锌,铜做电极,用导线连接形
在盛有500ml,0.1mol/LCuSO4和0.4mol/LH2SO4混合溶液的大烧杯中,用锌,铜做电极,用导线连接形成原电池,
锌,铜做电极,用导线连接形成原电池,当电极消耗6.5g时
1.写出正负极的电极反应式
2.电极上共析出氢气的质量
我要详细的解题步骤 谢谢 小赖的小张1年前3
小赖的小张1年前3 -
 盖思特 共回答了19个问题
盖思特 共回答了19个问题 |采纳率89.5%正极:Cu2+ +2e === Cu
2H+ +2e H2
2mol 2g
0.1mol z=0.1g
电极上共析出氢气的质量为0.1g1年前查看全部
- 一道高二化学题将500ml0.1mol/LCuSO4和1mol/LNaCl混合溶液,用石墨为电极电解
一道高二化学题将500ml0.1mol/LCuSO4和1mol/LNaCl混合溶液,用石墨为电极电解
将500ml0.1mol/LCuSO4和1mol/LNaCl混合溶液,用石墨为电极电解一段时间后在阳极收集到4.48L(标况)气体,溶液体积几乎没有变化,求:
(1)阴极析出铜的质量.
(2)电解后溶液中NaCl的物质的量浓度.
(3)电解后溶液中c(OH-)的浓度.
答案是(1)3.2g(2)0.2mol/L(3)0.6mol/L 蜓鸢莘莘1年前3
蜓鸢莘莘1年前3 -
 却是那般年华 共回答了13个问题
却是那般年华 共回答了13个问题 |采纳率92.3%(1)4.48L的气体为0.2mol的Cl2,根据得失电子守恒,Cu应为0.2mol,
但是混合溶液中Cu的总物质量为0.5×0.1=0.05mol
故阴极析出的Cu为0.05×64=3.2g
(2)氯离子总物质量0.5×1=0.5mol
故剩余的氯离子物质的量为0.5-0.2×2=0.1mol
电解后溶液中NaCl的物质的量浓度为0.1÷0.5=0.2mol/L
(3)电解后,溶液中的阳离子只有Na,为0.5mol,硫酸根的物质的量为0.5×0.1=0.05mol
故n(OH-)=0.5-0.05×2(硫酸根)-0.1(氯离子)=0.3mol
电解后溶液中c(OH-)的浓度为0.3/0.5=0.6mol/L1年前查看全部
- 在0.1moi/lHAC和0.1mol/lCUSO4溶液中通入H2S达饱和 是否有CUS沉淀生成
 魔音娃娃1年前1
魔音娃娃1年前1 -
 hl1975530 共回答了16个问题
hl1975530 共回答了16个问题 |采纳率93.8%不会~~
如果生成的话 CuSO4就会马上变成硫酸 就会立刻把CuS反应了~~
离子过程~不会~~~1年前查看全部
- 把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和).
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和).
(1)溶液中H+的物质的量浓度为______,SO42-的物质的量浓度为______.
(2)向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余.此时,溶液中的Fe2+物质的量浓度为______. bdt5551年前1
bdt5551年前1 -
 cxvksodfupoas 共回答了19个问题
cxvksodfupoas 共回答了19个问题 |采纳率89.5%解题思路:(1)根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中CuSO4和H2SO4的物质的量浓度;混合后溶液中c(H+)=2c(H2SO4),溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)=c(CuSO4)+c(H2SO4);(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-).(1)把2.0mol•L-1CuSO4和1.0mol•L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=[1/2]×1.0mol/L=1.0 mol/L,c(H2SO4)=[1/2]×1.0mol/L=0.5mol/L,
混合后溶液中c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,溶液中硫酸根来源于硫酸铜与硫酸电离,故c(SO42-)=c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,
故答案为:1mol/L;1.5mol/L;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
故答案为:1.5mol/L.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,注意理解稀释定律.1年前查看全部
- 在25℃时,用石墨电极电解2.0L 2.5mol/LCuSO4溶液,若有0.2mol电子发生转移,请回答下列问
在25℃时,用石墨电极电解2.0L 2.5mol/LCuSO4溶液,若有0.2mol电子发生转移,请回答下列问题:
(1)阴极发生______反应(填“氧化”或“还原”),该电极反应式为______.电解反应的化学方程式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4电解 .2CuSO4+2H2O
2Cu+O2↑+2H2SO4电解 .
(2)电解后得到的铜的质量是______g,得到氧气的体积是______L(标准状况),溶液中的氢离子浓度为______mol/L(假定溶液体积仍为2.0L).
(3)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差______g. liaoyifeng1年前1
liaoyifeng1年前1 -
 晓燕非非 共回答了17个问题
晓燕非非 共回答了17个问题 |采纳率88.2%解题思路:(1)根据得失电子判断反应类型;根据离子放电顺序书写阴极电极反应式;根据阴阳极上发生的电极反应式书写电池反应式;
(2)根据铜、氧气与转移电子的关系计算铜的质量、氧气的体积;根据氧气与氢离子的关系计算氢离子的浓度;
(3)根据溶解的铜、析出的铜与电子的关系计算,然后两数值相加即得电解后两铜片的质量差.(1)阴极上得电子,发生还原反应;阴极上铜离子的放电能力大于氢离子的放电能力,所以阴极上析出铜,故电极反应式为Cu2++2e-═Cu;阳极上氢氧根离子失电子生成氧气,所以其电池反应方程式为2CuSO4+2H2O
电解
.
2Cu+O2↑+2H2SO4 .
故答案为:还原;Cu2++2e-═Cu;2CuSO4+2H2O
电解
.
2Cu+O2↑+2H2SO4 ;
(2)2CuSO4+2H2O
电解
.
2Cu+O2↑+2H2SO4 转移电子
2×64g 4mol
6.4g 0.2mol
所以铜的质量为6.4g;
2CuSO4+2H2O
电解
.
2Cu+O2↑+2H2SO4 转移电子
22.4L 4mol
1.12 L 0.2mol
所以生成氧气的体积为1.12 L;
2CuSO4+2H2O
电解
.
2Cu+O2↑+2H2SO4 转移电子
2mol4mol
0.1mol 0.2mol
所以硫酸的物质的量为0.1mol,氢离子的物质的量为 0.2mol,
氢离子的物质的量浓度为c=
n
V=
0.2mol
2L=0.1mol/L.
故答案为:6.4;1.12;0.1;
(3)当以铜片作电极时,阳极上铜失电子变成离子进入溶液,所以铜片质量减少;阴极上铜离子得电子生成铜单质,铜片质量增加,
两极的质量差=阳极上减少的质量+阴极上增加的质量.
阳极 Cu-2e-═Cu2+
64g 2mol
6.4g 0.2mol
所以阳极质量减少6.4g;
阴极 Cu2++2e-═Cu
2mol 64g
0.2mol 6.4g
所以阴极质量增加6.4g;
所以两极质量相差 6.4g+6.4g═12.8g,
故答案为:12.8.点评:
本题考点: 电解原理;氧化还原反应的计算.
考点点评: 本题考查了电解池中氧化还原反应的有关计算,根据方程式中各物质间的关系式计算即可;知道两极的质量差=阳极上减少的质量+阴极上增加的质量是解(3)题的关键.1年前查看全部
- 向0.1ml0.1mol/LCuSo4溶液中加入10ml0.15mol/LNaOH溶液时,产生一种蓝色沉淀,经测定溶液中
向0.1ml0.1mol/LCuSo4溶液中加入10ml0.15mol/LNaOH溶液时,产生一种蓝色沉淀,经测定溶液中CU离子和氢氧跟
 leishao521001年前2
leishao521001年前2 -
 xigua1768 共回答了12个问题
xigua1768 共回答了12个问题 |采纳率91.7%蓝色沉淀是Cu(OH)2,生成0.00001molCu(OH)21年前查看全部
- 向0.1mol/LCuSO4溶液中通H2S至饱和,计算溶液中残留的Cu2+浓度?求看思路是否正确
向0.1mol/LCuSO4溶液中通H2S至饱和,计算溶液中残留的Cu2+浓度?求看思路是否正确
向0.1mol/LCuSO4溶液中通H2S至饱和,计算溶液中残留的Cu2+浓度
(考虑Cu(2+)+H2S→CuS+2H+;H(+)+SO4(2-)→HSO(4-))
我是这样想的,Cu(2+)+H2S→CuS+2H+这个反应看做完全,即产生0.2mol/L的H+
然后再带入H+ + SO4 2- → HSO(4-)
(0.2-x) (0.1-x) (x)
解出x,求出H+浓度,用H2S→2H+ + S(2-)解出[S2-],再带入ksp,CuS中求[Cu2+]
我的舍友在第一步就考虑了Cu2+的减少量,我俩算出来差不少.想问我的这种算法是否行的通? 大大近视眼1年前1
大大近视眼1年前1 -
 泡咖啡暖手 共回答了18个问题
泡咖啡暖手 共回答了18个问题 |采纳率94.4%正确;
但是不能理解你们为什么差很多;应该来说剩余Cu2+量很小,所以开始的0.2mol/LH+不会有什么差别;
开始就考虑剩余应该会很难算,结果可能出错;
忘了,这里你还需要比较一下H2S与HSO4-的K,必须差几个数量级,不然后来的电离会影响H+浓度1年前查看全部
- ksp的问题,速求要使0.2mol/LCuSO4 溶液中Cu2+ 沉淀较为完全(即使Cu2+ 浓度降至原来的千分之一),
ksp的问题,速求
要使0.2mol/LCuSO4 溶液中Cu2+ 沉淀较为完全(即使Cu2+ 浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH≥多少 写出计算过程:...KSP=2*10^-20mol/L 音乐米1年前1
音乐米1年前1 -
 只做3件事 共回答了20个问题
只做3件事 共回答了20个问题 |采纳率90%最终[Cu2+]=2*10^-4 mol/L
根据溶度积规则,此时 [Cu2+][OH-]^2=Ksp=2*10^-20
求得[OH-]=10^-8 mol/L
也就是说,只要保证[OH-]≥10^-8 mol/L,即可使Cu2+沉淀比较完全
此时 pH≥61年前查看全部
- 配制0.5mol/LNaOH溶液50ml需NaOH( )g,配制 0.1mol/LCuSO4溶液500mL,需胆矾(Cu
配制0.5mol/LNaOH溶液50ml需NaOH( )g,配制 0.1mol/LCuSO4溶液500mL,需胆矾(CuSO4·5H2O)( )g,配制0.2mol/LH2SO4溶液500ml,需98%的浓H2SO4(密度1.84g/cm³)( )ml
 6m2m1年前1
6m2m1年前1 -
 alvin1982 共回答了18个问题
alvin1982 共回答了18个问题 |采纳率94.4%①配制0.5mol/L NaOH溶液50mL
m(NaOH)=cV*M=0.5*50*10^-3*40=1(g)
②配制0.1mol/L CuSO4溶液500mL
n(CuSO4·5H2O)=n(CuSO4)=cV=0.1*500*10^-3=0.05(mol)
m(CuSO4·5H2O)=n(CuSO4·5H2O)*M=0.05*250=12.5(g)
③配制0.2mol/L H2SO4溶液500mL
m(H2SO4)=cV*M=0.2*500*10^-3*98=9.8(g)
设需98%的浓H2SO4 V mL
ρV*98%=m(H2SO4)
V=m(H2SO4)/(ρ*98%)=9.8/(1.84*98%)=5.4(mL)1年前查看全部
- 将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过
将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过程中共有0.2mol的电子通过,则阴极可析出Cu多少克?阳极产生气体多少升?
 月光寒_zy1年前2
月光寒_zy1年前2 -
 wesonchen 共回答了14个问题
wesonchen 共回答了14个问题 |采纳率78.6%Cu总共只有0.05mol,3.2g
阳极Cl2有0.1mol,2.24L1年前查看全部
- (2005•白山一模)某学生用2mL 1mol/LCuSO4溶液和4mL 0.5mol/LNaOH溶
(2005•白山一模)某学生用2mL 1mol/LCuSO4溶液和4mL 0.5mol/LNaOH溶液混合,然后加入40%的甲醛溶液0.5mL加热到沸腾,未见红色沉淀产生,主要原因是( )
A.甲醛的量太少
B.硫酸铜的量太少
C.氢氧化钠的量太少
D.加热时间太短 mmxqwert1年前1
mmxqwert1年前1 -
 林被来了 共回答了20个问题
林被来了 共回答了20个问题 |采纳率95%解题思路:乙醛和新制的Cu(OH)2反应,该反应的本质是:乙醛中的醛基具有还原性,新制的氢氧化铜具有氧化性,醛基与氢氧化铜中的+2价的铜发生氧化还原反应,操作的关键是碱要过量,据此,即可解答.该反应的本质是:甲醛中的醛基具有还原性,新制的氢氧化铜具有氧化性,醛基与氢氧化铜中的+2价的铜发生氧化还原反应,只要有醛基即可反应,
n(CuSO4)=1mol/L×0.002L=0.002mol,根据反应CuSO4+2NaOH═Cu(OH)2↓+2NaSO4可知,n(NaOH)=2n(CuSO4)=0.004moln(NaOH)=0.5mol/L×V
V=8mL,应该加0.5mol/L NaOH溶液8mL,实际只加了4mL,NaOH溶液的量不够,导致实验中未见红色沉淀产生,
故选C.点评:
本题考点: 有机物(官能团)的检验.
考点点评: 本题考查醛基和新制的Cu(OH)2反应,碱要过量的条件是解答的关键,难度中等.1年前查看全部
- 将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过
将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过程中共有0.2mol的电子通过,则阴极可析出Cu多少克,阳极产生气体多少 升(标况),电解后溶液的PH值为多少 (设电解过程中溶液体积变化不计)
怎么考虑
 ii是唐唐的1年前2
ii是唐唐的1年前2 -
 hujizhou2003 共回答了15个问题
hujizhou2003 共回答了15个问题 |采纳率86.7%Cu2+ +2e-=Cu
2Cl- +2e-=Cl2↑
因为有0。2摩尔电子转移,所以转化到上面两个式子可得:生成0。1摩尔氯气,2.24升;0.1摩尔铜,因为只有0.05molCu,所以只生成0.05*64gCu换算是3.2克铜。PH值:?1年前查看全部
- 把2.0mol/LCuSO4溶液和2.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等于混合
把2.0mol/LCuSO4溶液和2.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等于混合
把2.0mol/LCuSO4溶液和2.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前的两种溶液体积之和)
计算:1 混合液中CuSO4和H2SO4的物质的量的浓度
2 混合液中H+ CU2+ SO42- 的物质的量浓度
3 向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余 求此时溶液中Fe2+的物质的量浓度 jfs7711年前3
jfs7711年前3 -
 snoopy129 共回答了17个问题
snoopy129 共回答了17个问题 |采纳率94.1%1.因为是等体积混合,所以混合后CuSO4和H2SO4的物质的量的浓度1.0mol/L.
2.因为混合后H2SO4的物质的量的浓度1.0mol/L,所以H+为2mol/L.cu2+为1.0mol/L. SO42- 的2mol/L.
3.H2SO4+Fe=FeSO4+H2,CuSO4+Fe=FeSO4+Cu.可知均是1:1反应,所以铁离子浓度几位硫酸根离子浓度.即为2mol/L1年前查看全部
- 化学题一道(不难的)把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等
化学题一道(不难的)
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前的两种溶液体积之和)计算:
1)混合液中CuSO4和H2SO4物质的量浓度
2)混合液中氢离子,铜离子,硫酸根离子的量浓度
3)向溶液中加入足量铁粉,经足够长的时间后,有铁粉剩余.此时溶液中的亚铁离子的量浓度. websnow1年前2
websnow1年前2 -
 横刀夺-1 共回答了22个问题
横刀夺-1 共回答了22个问题 |采纳率86.4%等体积混合则溶液总体积为1+1=2L
(1)其中nCuSO4=3.0mol
所以c=n/V=3/2=1.5mol/L
(2)因为nH2SO4=2.0mol
所以nH+=2x2=4mol
所以cH+=4/2=2mol/L
(3)Fe+CuSO4=FeSO4+Cu
Fe+H2SO4=FeSO4+H2
因为铁粉有剩余,知上述两反映均完全反应,此时溶液中nFeSO4=3.0+2.0=5.0mol
所以cFe2+=5/2=2.5mol/L1年前查看全部
- 将0.483g金属钠投入0.1mol/LCuSO4溶液100mL中(设反应前后溶液总体积不变),求反应后溶液的pH
 阿词1年前1
阿词1年前1 -
 xiwangzhicheng 共回答了19个问题
xiwangzhicheng 共回答了19个问题 |采纳率100%2Na+2H2O=2NaOH+H2
n(Na)=0.021mol
所以生成n(OH^-)=0.021mol
CuSO4+2NaOH=Cu(OH-)+Na2SO4
n(CuSO4)=0.01mol
所以反应掉n(OH-)=0.02mol
还剩余n(OH-)=0.021-0.02=0.001mol
c(OH-)=O.O1mol
所以pH=121年前查看全部
- 用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,
用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,切断电源,使电极仍浸在溶液中.
1)写出开始电解时反应式(两条)
2)电解后电极在溶液经充分反应后,阴极比原来增重多少g?溶液的H+浓度时多少(溶液体积保持不变) 5493381681年前1
5493381681年前1 -
 虚掩的门yoyo 共回答了27个问题
虚掩的门yoyo 共回答了27个问题 |采纳率88.9%cu+ + 2e- =cu
2H2o -- 4e- = O2 + 4H+
2Cu+ 2 H2O2 = 2Cu +O2 + 4H+ 0.896L/22.4L/mol=0.04mol(O2) 可推出阳极一共失去0.04*4=0.16摩尔电子,一摩尔铜有2摩尔电子,所以依照对因关系有0.08摩尔铜生成,即为0.08*64=5.12g铜,即阴极增重5.12g
在阳极增加0.16摩尔H+原子,除以液体体积0.1L得1.6摩尔每升,即H+离子的浓度为1.6摩尔每升
总体是这样了,你在组织下语言,这道题就能得分了1年前查看全部
- 在25℃时,用石墨电极点解2.0L 0.5mol/LCuSO4溶液.5min后,在一个石墨电极上有6.4g克铜生成
在25℃时,用石墨电极点解2.0L 0.5mol/LCuSO4溶液.5min后,在一个石墨电极上有6.4g克铜生成
若电解后的体积不变,则电解后溶液的PH值为?
若将溶液恢复到与点解前一样,则需加入 mol的氧化铜
若用等质量的两块铜片代替石墨 电解后两铜片的质量差为?电解液的PH (变小/不变/变大)
 敏敏不乖1年前2
敏敏不乖1年前2 -
 wad_312 共回答了19个问题
wad_312 共回答了19个问题 |采纳率94.7%pH=1
0.1molCuO
12.8g,不变1年前查看全部
大家在问
- 1为了开辟新航道,某科学探测船装有回声探测仪器,探测水下有无暗礁,、探测船发出的声音信号0.6s被探测
- 2辨析 理想的形式是主观的,内容是客观的?
- 3我市某校的几位同学对生物学知识情有独钟,经常做一些有关生物学的小实验,这次他们对“探究种子萌发的外界条件”实验作了如下改
- 4在△ABC中,∠C=90°,∠A=30°,AB=6√3cm,求△ABC的面积
- 5食堂运进一批大米,第一天用去28千克,第二天用去总数的三分之一少三千克.这是还剩下这批大米的二分之一.
- 6二十一世纪是海洋开发与利用的世纪,我市规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。以下是
- 7x(x-1)-(x的平方 –y)=-2 问二分之x的平方加y的平方减xy的值?
- 8谁能给我说5个歇后语啊
- 9由象棋引申的词语或成语有哪些?例如'马后炮'类的?
- 10圆周率π的值( )A. 等于3.14B. 大于3.14C. 小于3.14
- 11计算下列各题.(1)(+[1/3])+(-4)+(+[2/3])+(+4)(2)(+4[1/5])+(-[5/6])+(
- 12She can (play)the piano.
- 13创作一首儿童诗
- 14第一式:1×2×3×4+1;第二式:2×3×4×5+4;第三式:3×4×5×6+9;第四式:4×5×6×7+16;用含字
- 15一条山路,从上下到山顶,走了1小时还差1km,从山顶到山下,用50分钟可以走完.已知下山速度是上山速度的1.5倍.问上山
