在25℃时,用石墨电极点解2.0L 0.5mol/LCuSO4溶液.5min后,在一个石墨电极上有6.4g克铜生成
 敏敏不乖2022-10-04 11:39:542条回答
敏敏不乖2022-10-04 11:39:542条回答若电解后的体积不变,则电解后溶液的PH值为?
若将溶液恢复到与点解前一样,则需加入 mol的氧化铜
若用等质量的两块铜片代替石墨 电解后两铜片的质量差为?电解液的PH (变小/不变/变大)

已提交,审核后显示!提交回复
共2条回复
 wad_312 共回答了19个问题
wad_312 共回答了19个问题 |采纳率94.7%- pH=1
0.1molCuO
12.8g,不变 - 1年前
 huoyan1979 共回答了3个问题
huoyan1979 共回答了3个问题 |采纳率- 电解硫酸铜的方程式 2CuSO4+2H2O=(条件电解)2Cu+O2+2H2SO4 所以当生成6.4gCu即0.1molCu时得到硫酸0.1mol即c(H+)=0.2MOL/2L=0.1mol/L 所以PH=1
- 1年前
相关推荐
- 近年来,科学家们在氦的气氛中对石墨电极通电,石墨发生挥发,在它挥发的黑烟中发现一种新的碳分子——C 60 ·C 60 分
近年来,科学家们在氦的气氛中对石墨电极通电,石墨发生挥发,在它挥发的黑烟中发现一种新的碳分子——C 60 ·C 60 分子的构型像个足球,相对分子质量为 ;C 60 与金刚石之间互为 ;C 60 的熔点比金刚石的熔点 (填 “高”、“低”).
 大豆小米1年前1
大豆小米1年前1 -
 exue000 共回答了21个问题
exue000 共回答了21个问题 |采纳率100%720、同素异形体、低
略1年前查看全部
- 在25 ℃时,用石墨电极电解1000mL一定浓度的CuCl 2 溶液。5 min后电解完全,在一个石墨电极上只有1.28
在25 ℃时,用石墨电极电解1000mL一定浓度的CuCl 2 溶液。5 min后电解完全,在一个石墨电极上只有1.28 g Cu生成。试回答下列问题:
(1)总反应式为 。
(2)电解过程中转移的电子数为 mol, 同时生成标准状况下气体的体积为
(3) 该CuCl 2 溶液的物质的量浓度为 。
(4)有铜生成的是 (填“阳极”或“阴极”) 灌水专用1年前1
灌水专用1年前1 -
 libinbin6069 共回答了23个问题
libinbin6069 共回答了23个问题 |采纳率82.6%1年前查看全部
- 用石墨电极电解100mL 0.1mol/L的氯化钾溶液时,若生成标况下5.6mL氧气,则溶液的PH为多少?(假定溶液体积
用石墨电极电解100mL 0.1mol/L的氯化钾溶液时,若生成标况下5.6mL氧气,则溶液的PH为多少?(假定溶液体积仍为100mL)(为什么?怎么算的?)
 冷枚1年前1
冷枚1年前1 -
 83猪猪猪 共回答了12个问题
83猪猪猪 共回答了12个问题 |采纳率83.3%此实为电解水的试验
首先算得生成的氧气为0.25/1000mol
然后根据电子守恒
O2——4H+ 每生成一molO2会生成4molH+
由以上可算溶液中生成的H+为(0.25/1000)*4mol即为0.001mol
又溶液体积为0.1L所以0.001/0.1=0.01即溶液的PH为21年前查看全部
- 工业电解冶炼铝,石墨电极为什么会被消耗
 梁风徐来1年前1
梁风徐来1年前1 -
 独孤求胜只为何 共回答了17个问题
独孤求胜只为何 共回答了17个问题 |采纳率88.2%在高温下阳极产生的氧气与电极材料石墨发生氧化反应,故阳极会损耗而阴极不会1年前查看全部
- 某同学按如图装置进行电解实验,其中A、B均为石墨电极
某同学按如图装置进行电解实验,其中A、B均为石墨电极
1.B电极是?(阳极或阴极),Fe电极的电极反应式为? 溶液中Ag+的浓度变化
2.当甲装置中Ag电极的质量减少5.4g时,乙装置中某电极上析出1.6g某金属,则乙装置中的盐M可能是
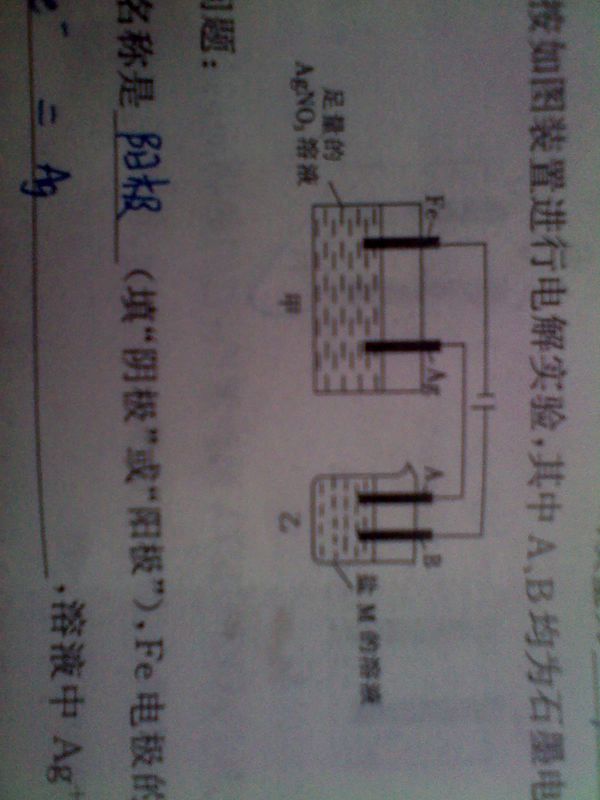
 苏子叶1年前1
苏子叶1年前1 -
 who06 共回答了11个问题
who06 共回答了11个问题 |采纳率90.9%(1)阳极 Ag+ +e-=Ag
(2)铜1年前查看全部
- 在20 ℃时,用石墨电极电解饱和硫酸铜溶液(阳极放出氧气),如有0.20 mol e - 发生转移,试回答以下问题:
在20 ℃时,用石墨电极电解饱和硫酸铜溶液(阳极放出氧气),如有0.20 mol e - 发生转移,试回答以下问题:
(1)在阴极发生什么反应?写出电极反应式,阴极得到铜的质量是多少?
(2)在阳极发生什么反应?写出电极反应式,阳极得到氧气的体积(标准状况)是多少?
(3)电解质溶液的pH发生了什么变化,为什么?
(4)如用铜片代替石墨作阳极,阳极发生什么反应?产物是什么?电解液的pH将如何变化? 卢娣米1年前0
卢娣米1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时
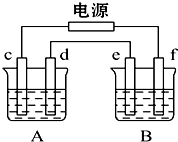 如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )
如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )
A.该电路中通过的电子的物质的量为0.4mol
B.向A池中通入4.48L HCl气体可恢复到电解前的状态
C.e电极应为粗铜板材料且质量减少6.4g
D.停止通电后恢复至室温A池中溶液的pH值为14 shoen20001年前1
shoen20001年前1 -
 不浪漫De罪名 共回答了21个问题
不浪漫De罪名 共回答了21个问题 |采纳率81%解题思路:A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体在标准状况下为2.24L.电解饱和KCl溶液在阳极生成氯气具有氧化性,判断d极为电解池阳极,所以c为阴极,e电极为阴极;f电极为阳极;推断得到A池电解饱和KCl溶液,d电极生成氯气;c电极生成氢气;B池精炼铜,阳极f为粗铜,e电极为精铜.A、标准状况下为2.24L氯气,该电路中通过的电子的物质的量为0.2mol,故A错误;
B、A池中c极生成0.1mol的氢气,d极产生0.1mol的氯气,通入4.48L HCl气体可恢复到电解前的状态,故B正确;
C、阳极f为粗铜,e电极为精铜,故C错误;
D、c极生成0.2mol的氢气的同时,电离出0.2mol的OH-,c(OH-)=[0.2mol/0.2L]=1mol/L,所以c(H+)=1×10-14mol/L,所以溶液的pH值为14,故D正确;
故选BD.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解池的原理应用,电解氢氧化钠溶液,电解精炼,电极判断,电极产物分析,电极反应,电子守恒的计算应用,电极判断是解题关键,题目难度中等.1年前查看全部
- (2014•温州模拟)如图是电解CuCl2溶液的装置,其中c、d为石墨电极.下列说法不正确的是( )
(2014•温州模拟)如图是电解CuCl2溶液的装置,其中c、d为石墨电极.下列说法不正确的是( )
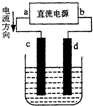
A.a为正极、b为负极
B.c为阳极、d为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变 寿比山1年前1
寿比山1年前1 -
 杜宗宗 共回答了14个问题
杜宗宗 共回答了14个问题 |采纳率85.7%解题思路:该电解池中,根据电流方向知,a是电源正极、b是负极,c是阳极、d是阴极,阳极上电极反应为2Cl-2e-=Cl2↑、阴极上电极反应为Cu2++2e-=Cu,据此分析解答.A.根据电流方向知,a是正极、b是负极,故A正确;
B.根据电流方向知,a是电源正极、b是负极,连接正极的c是阳极、连接负极的d是阴极,故B正确;
C.电解过程中,d电极电极反应式为Cu2++2e-=Cu,所以d电极质量增加,故C正确;
D.电解过程中阳极电极反应式为2Cl-2e-=Cl2↑,所以氯离子浓度降低,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解原理,根据电流分析确定电极名称,再结合阴阳极上电极反应式分析解答,题目难度不大.1年前查看全部
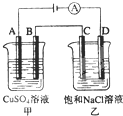
- 将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过
将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过程中共有0.2mol的电子通过,则阴极可析出Cu多少克?阳极产生气体多少升?
 月光寒_zy1年前2
月光寒_zy1年前2 -
 wesonchen 共回答了14个问题
wesonchen 共回答了14个问题 |采纳率78.6%Cu总共只有0.05mol,3.2g
阳极Cl2有0.1mol,2.24L1年前查看全部
- 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
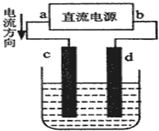 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
A.a为负极、b为正极
B.电解过程中,c电极发生还原反应
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变 残雪冰蓝1年前1
残雪冰蓝1年前1 -
 何必这样子 共回答了13个问题
何必这样子 共回答了13个问题 |采纳率84.6%解题思路:在电解池中,电流的流向和电子的移动方向相反,根据电子或电流的流向可以确定电解池的阴阳极,进而确定电极反应.在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极.
A、a是正极,b是负极,故A错误;
B、电解池中,电流是从正极流向阳极,所以c是阳极,发生氧化反应,故B错误;
C、电解过程中,d电极是阴极,该电极上铜离子得电子析出金属铜,电极质量增加,故C正确;
D、电解过程中,氯离子在阳极上失电子产生氯气,氯离子浓度减小,故D错误.
故选C.点评:
本题考点: 电解原理.
考点点评: 本题考查电解池的工作原理,难度不大,会根据电子流向和电流流向判断电源的正负极,从而确定电极的阴阳极,再根据所学知识进行回答.1年前查看全部
- 如图所示,a、b、c、d均为石墨电极,通电进行电解.下列说法正确的是( )
如图所示,a、b、c、d均为石墨电极,通电进行电解.下列说法正确的是( )
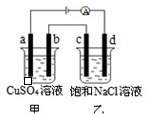
A.乙烧杯中d的电极反应为 2Cl--2e-=Cl2↑
B.a、c两极产生气体的物质的量相等
C.乙烧杯中发生的反应为2NaCl+2H2O
H2↑+Cl2↑+2NaOH通电 .
D.甲、乙两烧杯中溶液的pH均保持不变 浮生偷梦1年前1
浮生偷梦1年前1 -
 stay66 共回答了20个问题
stay66 共回答了20个问题 |采纳率95%解题思路:该装置是电解池,a、c是阳极,b、d是阴极,a电极上氢氧根离子放电、c电极上氯离子放电,b电极上铜离子放电、d电极上氢离子放电,甲中发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O电解 .
2NaOH+H2↑+Cl2↑,据此分析解答.电解 .A.乙烧杯中d的电极反应为 2H++2e-=H2↑,故A错误;
B.a电极反应式为4OH--4e-=2H2O+O2↑,c电极反应式为2Cl--2e-=Cl2↑,a,c两极产生气体的物质的量为1:2,不相等,故B错误;
C.乙中发生2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,故C正确;
D.甲中发生2CuSO4+2H2O
电解
.
2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,所以甲中溶液变为酸、乙中溶液变为碱,所以二者的pH都改变,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,明确离子放电顺序是解本题关键,根据各个电极上发生的反应、电池反应来分析解答,难点是电极反应式的书写,题目难度不大.1年前查看全部
- 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
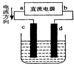
A.a为负极、b为正极
B.d为阳极,电极反应为:2Cl--2e-=Cl2↑
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变 草莓20061年前1
草莓20061年前1 -
 九月鸿飞 共回答了16个问题
九月鸿飞 共回答了16个问题 |采纳率81.3%解题思路:在电解池中,电流的流向和电子的移动方向相反,根据电子或电流的流向可以确定电解池的阴阳极,进而确定电极反应.在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极.
A、a是正极,b是负极,故A错误;
B、电解池中,电流是从正极流向阳极,所以c是阳极,d是阴极,阴极上铜离子得电子生成铜,故B错误;
C、电解过程中,d电极是阴极,该电极上铜离子得电子析出金属铜,电极质量增加,故C正确;
D、电解过程中,氯离子在阳极上失电子产生氯气,氯离子浓度减小,故D错误.
故选C.点评:
本题考点: 电解原理.
考点点评: 本题考查电解池的工作原理,难度不大,会根据电子流向和电流流向判断电源的正负极,从而确定电极的阴阳极,再根据所学知识进行回答.1年前查看全部
- 用石墨电极电解84.75mL的NaOH溶液 经过一段时间后电解质溶液浓度为19.5%
用石墨电极电解84.75mL的NaOH溶液 经过一段时间后电解质溶液浓度为19.5%
电解84.75mL16%的NaOH溶液(密度1.18g/cm3),用石墨作电极经过一段时间后电解质溶液浓度为19.5%,这是因为( )
A.溶质增加了3.5g
B.放出22.4LH2和11.2LO2
C.NaOH比水消耗少
D.消耗18g水 fanuu1年前1
fanuu1年前1 -
 婷婷屁 共回答了18个问题
婷婷屁 共回答了18个问题 |采纳率94.4%电解却溶液中溶质的质量:84.75*1.18*16% =16g 水:84g
电解后溶质质量不变,因为只是电解水,所以有:16/19.5%=82g
因此消耗水为:84.75*1.18=100-82=18g水1年前查看全部
- 用石墨电极电解饱和食盐水的离子方程式
 忘又如何1年前2
忘又如何1年前2 -
 quzhaojie 共回答了19个问题
quzhaojie 共回答了19个问题 |采纳率84.2%2Cl-+2H2O=2OH-+Cl2!+H2!1年前查看全部
- 用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液.一段时间后,溶液颜色变浅.此时若要使溶液中的Na2SO4
用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液.一段时间后,溶液颜色变浅.此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度,应向电解后的溶液中加入适量的( )
A. H2O和CuO
B. CuO
C. Na2O和CuO
D. H2O和CuSO4 yangyang8109021年前3
yangyang8109021年前3 -
 LY-黄锦明 共回答了19个问题
LY-黄锦明 共回答了19个问题 |采纳率94.7%解题思路:用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液,阳极电极反应为4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;反应的总反应为2CuSO4+2H2O
2Cu+2H2O+O2↑此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度,电解放出或析出的是铜和氧气,所以需要加入氧化铜.通电 .用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液,阳极电极反应为4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;溶液颜色变浅,反应的总反应为2CuSO4+2H2O
通电
.
2Cu+2H2O+O2↑此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度,电解放出或析出的是铜和氧气,所以需要加入氧化铜,
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解池的反应原理的分析判断,电解过程中离子浓度的变化和溶液PH的计算判断,恢复溶液浓度需要加入从溶液中分离出的物质组成,题目难度中等.1年前查看全部
- 如图是甲醇燃料电池工作的示意图1,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的
如图是甲醇燃料电池工作的示意图1,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.

(1)甲中负极的电极反应式为______.
(2)乙中A极析出的气体在标准状况下的体积为______.
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2,则图中②线表示的是______离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要______mL 5.0mol/L NaOH溶液. wangqsh1年前1
wangqsh1年前1 -
 plm12qaz 共回答了21个问题
plm12qaz 共回答了21个问题 |采纳率95.2%解题思路:(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,注意电解质溶液是碱性溶液;
(2)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气;A电极为阳极,溶液中的氢氧根离子失电子生成氧气;阳极电极反应和电子守恒计算得到;
(3)C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4xx
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L,故答案为:2.24L;
(3)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(2)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为,[1.4mol/5mol/L]=0.28L=280ml,
故答案为:Fe2+;280.点评:
本题考点: 化学电源新型电池.
考点点评: 本题综合原电池电解原理乙级原电池知识,综合性强,难度大,主要考查学生分析问题的能力,是高考的热点习题.1年前查看全部
- 某乙醇燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少.
某乙醇燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少.
请回答下列问题:
(1)M电极名称是______;N极的电极反应式为______,加入乙醇的铂电极的电极反应式为______.
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气______L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为______.
(3)若在常温常压下,1g C 2 H 5 OH燃烧生成CO 2 和液态H 2 O时放出29.71kJ热量,表示该反应的热化学方程式为______.
 scutcjq1年前1
scutcjq1年前1 -
 beacons 共回答了20个问题
beacons 共回答了20个问题 |采纳率85%碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,
(1)通过以上分析知,M是阴极,N极是阳极,N上电极反应式为4OH - -4e - =O 2 ↑+2H 2 O,乙醇电极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C 2 H 5 OH-12e - +16OH - =2CO 3 2- +11H 2 O,
故答案为:阴极,4OH - -4e - =O 2 ↑+2H 2 O,C 2 H 5 OH-12e - +16OH - =2CO 3 2- +11H 2 O;
(2)n(Ag)=
4.32g
108g/mol =0.04mol,根据Ag + +e - =Ag可知转移电子为0.04mol,
甲池中通入氧气的一极为正极,反应式为2O 2 +8H + +8e - =4H 2 O,则消耗n(O 2 )=
1
4 ×0.04mol=0.01mol,
V(O 2 )=0.01mol×22.4L/mol=0.224L;
乙池中某一电极析出金属银4.32g时,同时产生氢离子的物质的量是0.04mol,则其浓度是0.1mol/L,所以溶液的pH=1,故答案为:0.224,1;
(3)1g C 2 H 5 OH燃烧生成CO 2 和液态H 2 O时放出29.71kJ热量,则1mol乙醇燃烧放出的热量=
29.7kJ
1g
46g/mol =1366.66kJ,所以其热化学反应方程式为:C 2 H 5 OH(l)+3O 2 (g)=2CO 2 (g)+3H 2 O(l)△H=-1366.66kJ/mol,
故答案为:C 2 H 5 OH(l)+3O 2 (g)=2CO 2 (g)+3H 2 O(l)△H=-1366.66kJ/mol.1年前查看全部
- 在饱和的NACL溶液中,滴入KI淀粉溶液和石蕊溶液,然后插入石墨电极进行电解,经一定时间后,两极附近溶液的颜色变为 阳极
在饱和的NACL溶液中,滴入KI淀粉溶液和石蕊溶液,然后插入石墨电极进行电解,经一定时间后,两极附近溶液的颜色变为 阳极变蓝 阴极变蓝 为什么?
 勾魂帮副帮主1年前4
勾魂帮副帮主1年前4 -
 yingzi1972 共回答了22个问题
yingzi1972 共回答了22个问题 |采纳率95.5%反应式为 2NaCl+2H2O=通电=2NaOH+H2+Cl2
Cl2是在阳极生成的,因为Cl-失电子 所以有Cl2+2KI=I2+2KCl
而在阴极则是生成H2和NaOH
因为NaOH是碱性的,所以加入石蕊是变蓝1年前查看全部
- 用石墨电极电解1mol*L-1的CuSO4溶液。若当电路中通过0.5mol电子时,则理论上在两极可以得到多少Cu和O2
 好糟1年前1
好糟1年前1 -
 soq956 共回答了15个问题
soq956 共回答了15个问题 |采纳率86.7%0.25molCu 0.125mol氧气
阳极:2H20-4e+o2-=4OH-
阴极:(Cu2+)+2(e-)=Cu1年前查看全部
- 25摄氏度时,用石墨电极电解饱和食盐水,当电源提供0.2mol电子时.
25摄氏度时,用石墨电极电解饱和食盐水,当电源提供0.2mol电子时.
25摄氏度时,用石墨电极电解饱和食盐水,当电源提供0.2mol电子时,停止通电.若此时溶液的体积为2L,则所得溶液的PH是( )
A1
B8
C13
D14
选C,为什么? guoguo67891年前1
guoguo67891年前1 -
 浪四方 共回答了7个问题
浪四方 共回答了7个问题 |采纳率100%电源提供0.2mol电子,则生成0.2mol氢氧根,所以c(OH-)=0.1mol/L,在25摄氏度时,C(H+)*C(OH-)=10^-14,所以C(H+)=10^-13,所以PH为131年前查看全部
- 用自动铅笔芯可以代替石墨电极来电解硫酸铜溶液制硫酸吗?为什么
 丫头妙妙1年前1
丫头妙妙1年前1 -
 一生无忧 共回答了24个问题
一生无忧 共回答了24个问题 |采纳率91.7%可以,成分是一样的.
但不好,自动铅笔芯的石墨没有压实,所以容易散,也就是碎掉进入溶液.
我做过这个实验,刚开始时正常,一段时间之后铅笔芯就散掉了.
有哪里不懂的话欢迎追问~1年前查看全部
- 将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过
将500mL0.1mol/LCuSO4溶液和 500mL4mol/LNaCl溶液相混合,然后用石墨电极进行电解.若电解过程中共有0.2mol的电子通过,则阴极可析出Cu多少克,阳极产生气体多少 升(标况),电解后溶液的PH值为多少 (设电解过程中溶液体积变化不计)
怎么考虑
 ii是唐唐的1年前2
ii是唐唐的1年前2 -
 hujizhou2003 共回答了15个问题
hujizhou2003 共回答了15个问题 |采纳率86.7%Cu2+ +2e-=Cu
2Cl- +2e-=Cl2↑
因为有0。2摩尔电子转移,所以转化到上面两个式子可得:生成0。1摩尔氯气,2.24升;0.1摩尔铜,因为只有0.05molCu,所以只生成0.05*64gCu换算是3.2克铜。PH值:?1年前查看全部
- 用石墨电极电解硫酸铝溶液的方程式
 feixiang14091年前1
feixiang14091年前1 -
 jenny_Chan 共回答了20个问题
jenny_Chan 共回答了20个问题 |采纳率85%就是电解水的方程.1年前查看全部
- (1/3) 常温下用石墨电极电解100 ml 0.1mol /l CU(NO3 )2 2和0.1
 anyi19801年前2
anyi19801年前2 -
 一芬尼 共回答了19个问题
一芬尼 共回答了19个问题 |采纳率84.2%先被电解的离子为Cu2+和Cl-
电极上得到0.3molCu,则反应转移电子为0.6mol
所以0.2molCl-全部转化为0.1molCl2,还有0.4molOH-转化为0.1molO2
另一电极析出的气体在标准状况下的体积=(0.1+0.1)*22.4=4.48L1年前查看全部
- 常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的
常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为112mL时,假设溶液体积不变,下列说法正确的是( )
A.阴极增重1.4 g B.所得溶液 pH1
我明白是0.02mol的Cl2 和0.01mol的氧气 0.02mol的氯气同时生成0.04mol氢氧根 0.01mol的氧气同时消耗 0.04mol氢氧根 然后如何推出ph值呢?
 kevin0212191年前1
kevin0212191年前1 -
 fxq_qhd 共回答了12个问题
fxq_qhd 共回答了12个问题 |采纳率83.3%因为0.01mol的Cu2+生成cu单质转移0.02mol的电子,0,01mol的Ag+生成Ag单质转移0.01mol的电子,所以一共转移了0.03mol的电子,
又因为1mol的电子相当于1mol的OH-,OH-=H+
所以H+浓度=0,03/0.01L=0,31年前查看全部
- 电解饱和食盐水用铜电极和石墨电极为什么效果不同
电解饱和食盐水用铜电极和石墨电极为什么效果不同
铜电极化了溶液像橙汁一样 lucklululu1年前1
lucklululu1年前1 -
 hougongbar 共回答了19个问题
hougongbar 共回答了19个问题 |采纳率73.7%石墨和铂都是惰性电极,即不会失去电子,而用其他的金属作为电极时,他们会首先失去电子,因此现象不同1年前查看全部
- 将两个石墨电极插入100mL3mol/L的NaCl溶液中进行电解,通电一段时间后,在其中一个电极上收集到的标准状况
 小铃儿11年前1
小铃儿11年前1 -
 xinxiyewu 共回答了20个问题
xinxiyewu 共回答了20个问题 |采纳率95%该问题的可以分为两种情况:
1,假设是阳极的气体,阳极生成的是氯气,
反应方程式为
2NaCl+2H2O=2NaOH+H2+Cl2
通过计算可以得到,氯气的物质的量是0.02
则可以计算出氢氧化钠的物质的量是0.04mol
可以计算出氢氧化钠的物质的量浓度=0.04mol/0.1L=0.4mol/L
2.假设收集了阴极生成的气体,是氢气,
同理也可以计算出,生成氢氧化钠的浓度时0.4mol/L1年前查看全部
- 常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的
常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的
常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L- 1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为112mL时,假设溶液体积不变,下列说法正确的是( )
A.阴极增重1.4 g B.所得溶液 pH1 小百无忌J1年前1
小百无忌J1年前1 -
 若尘心 共回答了18个问题
若尘心 共回答了18个问题 |采纳率94.4%因为0.01mol的Cu2+生成cu单质转移0.02mol的电子,0,01mol的Ag+生成Ag单质转移0.01mol的电子,所以一共转移了0.03mol的电子,
又因为1mol的电子相当于1mol的OH-,OH-=H+
所以H+浓度=0,03/0.01L=0,31年前查看全部
- 二氧化氮的电子式?用铝作阳极,石墨电极阴极点解碳酸氢钠溶液,电解一段时间后,在阳极区会有白色沉淀
 kk额会更好1年前2
kk额会更好1年前2 -
 swainsz 共回答了21个问题
swainsz 共回答了21个问题 |采纳率95.2%::O::N::O::,N上还有一个电子,会有白色沉淀,但是一会儿会溶解,因为Al(OH)3会和OH根离子反应生成ALO2离子,高中是不要求写SO2的电子式吧1年前查看全部
- 等物质的量浓度硫酸铜和氢氧化钠混合用石墨电极电解ph怎么变化
 1fmxmeo1年前3
1fmxmeo1年前3 -
 wangzhilin 共回答了18个问题
wangzhilin 共回答了18个问题 |采纳率94.4%降低,通电时,CU2+移向阴极.OH-移向阳极,这是根据不同离子的氧化还原能力不同知道的,OH-被消耗,PH当然要减小了1年前查看全部
- 用石墨电极电解饱和食盐水发现出现不溶固体 两极气泡产生正常 溶液变为黄绿色 请给出化学方程式离子方程式
 岁月胡胡匆匆1年前2
岁月胡胡匆匆1年前2 -
 draculahdw 共回答了17个问题
draculahdw 共回答了17个问题 |采纳率94.1%2Cl-+2H2O=Cl2+H2+2OH-
变黄绿色是因为部分Cl2溶于水1年前查看全部
- 用石墨电极电解500ml饱和食盐水,在阴极得到的气体在标准状况下体积转为56ml
用石墨电极电解500ml饱和食盐水,在阴极得到的气体在标准状况下体积转为56ml
假设溶液体积保持不变,求电解后溶液的ph 无论_kk1年前1
无论_kk1年前1 -
 dakey 共回答了20个问题
dakey 共回答了20个问题 |采纳率90%设电解氢离子的物质的量为X
阴极:2H^++2e^+=H2↑
2 22.4
x 0.056L
X=0.005mol
溶液中生成氢氧根离子的物质的量=反应氢离子的物质的量=0.005mol
溶液中氢氧根离子的浓度=0.005mol/0.5L=0.01mol/L
氢离子的浓度=10^-14/0.01=10^-12
所以电解后溶液的PH=121年前查看全部
- 1.用石墨电极电解下列溶液一段时间后,两极质量不变,溶液ph升高的是?
1.用石墨电极电解下列溶液一段时间后,两极质量不变,溶液ph升高的是?
A.AgNO3 B .Na2SO4 C.CuSO4 D.HCL
为什么答案是b?
2.做电解水的实验时,为了增强水的导电性,下列电解质不适宜加入的是?
A.H2SO4 B.NaOH C.NaCL D.NaSO4
又为什么选c?(因为氯气?)
不好意思。第一题的b选项应该是氢氧化钠。 tinyfan1年前6
tinyfan1年前6 -
 tashizhuba 共回答了19个问题
tashizhuba 共回答了19个问题 |采纳率84.2%1.
思路:
----据电解方程式,分析是否有金属析出,分析是否有酸碱生成,分析酸碱浓度的变化,从而确定pH值的变化.
A.AgNO3
4AgNO3..+..2H2O ..=电解=..4Ag..+..O2↑..+..4HNO3
----阴极析出银,质量增加
----有硝酸生成,溶液PH值减小.
不合题意.
B .NaOH
2H2O ..=电解=..2H2↑+..O2↑
----两极质量不变
----水被消耗,溶质未反应,氢氧化钠浓度增加,溶液PH值增大.
符合题意.
C.CuSO4
2CuSO4..+..2H2O ..=电解=..2Cu..+..O2↑..+..2H2SO4
----阴极析出铜,质量增加
----有硫酸生成,溶液PH值减小.
不合题意.
D.HCL
2HCl ..=电解=..H2↑..+..Cl2↑
----两极质量不变
----溶质被消耗,水未反应,盐酸浓度减,溶液PH值增大.
符合题意.
答案:BD
2.
思路:
----加入的电解质不参加反应,如果电解质起反应,就不是电解水了,加入的电解质只电离出离子,起增强导电性的作用.
A.H2SO4
----2H2O ..=电解=..2H2↑+..O2↑
B.NaOH
----2H2O ..=电解=..2H2↑+..O2↑
C.NaCL:
----Cl-比OH-易放电.
----2NaCl..+..2H2O ..= 电解 =..Cl2↑..+ ..H2↑..+ ..2NaOH
D.Na2SO4
----2H2O ..=电解=..2H2↑+..O2↑
符合题意的是C.1年前查看全部
- 在熔融状态下 用石墨电极电解氯化镁 如有一摩尔电子发生转移 求得到镁的质量 和氯气的体积
 waeroroiwo1年前1
waeroroiwo1年前1 -
 276881403 共回答了16个问题
276881403 共回答了16个问题 |采纳率100%根据方程式Mgcl2=Mg cl2当有2mol电子发生转移时有1摩尔镁和2摩尔cl2产生,所以当有1摩尔电子转移,产生0.5摩尔镁和0.5摩尔cl2.所以镁的质量为0.5*24=12g,cl2体积v=0.5*22.4=11.2ml1年前查看全部
- 某温度下,将一定量密度为1.15g/cm^3的NaCl溶液用石墨电极通电电解.设NaCl恰好完全反应,氧元素的质量分数为
某温度下,将一定量密度为1.15g/cm^3的NaCl溶液用石墨电极通电电解.设NaCl恰好完全反应,氧元素的质量分数为80%.则:(1)溶质物质的量:溶剂物质的量=?(2)原溶液中c(NaCl)=?
 123726611年前1
123726611年前1 -
 woaihj 共回答了18个问题
woaihj 共回答了18个问题 |采纳率94.4%1)电解后只有NaOH和H2O, 其中O的质量分数分别为16/40=2/5, 16/18=8/9设溶质为1mol, 溶剂为xmol(16+16x)/(40+18x)=80%解得 x=10∴溶质物质的量:溶剂物质的量=1:102)2NaCl+2H2O==电解=H2↑+Cl2↑+2NaOHn(NaCl)=n(NaOH)=1moln(H2O)=电解的+剩下的=1mol+10mol=11mol溶液质量m=1×58.5+11×18=256.6g溶液体积V=256.5g/1.15g/mol=223ml=0.223Lc(NaOH)=1mol/ 0.223L=4.48mol/L1年前查看全部
- 右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL
右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL
左池中Pt电极上电极反应方程式为——————————.a电极上电极反应方程式为————————————.如果想使反应溶液恢复到原来状态,应该加入——————,加入——————g.硫酸溶液的浓度-————(变大,变小,不变).硫酸溶液的PH————(同上).硝酸溶液的PH————.硝酸溶液的浓度——————.
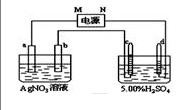
 夜的碎片1年前3
夜的碎片1年前3 -
 fanneth 共回答了15个问题
fanneth 共回答了15个问题 |采纳率80%(10分)(1)正;(2分)(2)4OH――4e―2H2O+O2↑ (2分)
(3)Ag、2.19 (每空1分)
(4)不变、增大;(每空1分) (5)45.18 (2分)1年前查看全部
- 下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336 mL(标
下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体.
(1)直流电源中,M为____________极.

我想知道M为什么是正级? yangleisb1年前1
yangleisb1年前1 -
 Lucifer_Cheng 共回答了27个问题
Lucifer_Cheng 共回答了27个问题 |采纳率92.6%图太小了,看不到.1年前查看全部
- 某工厂采用石墨电极电解na2cro4 na移动方向
某工厂采用石墨电极电解na2cro4 na移动方向
选项B 溶液中钠离子从负极移向正极 为什么是错的 电解池阳极不是又叫负极吗?
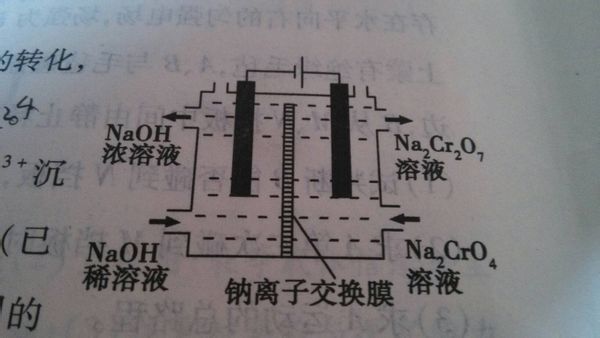
 jianew9981年前1
jianew9981年前1 -
 carpenter33 共回答了24个问题
carpenter33 共回答了24个问题 |采纳率91.7%电解池中电极叫阴阳,不叫正负,钠离子带正电移向阴极.1年前查看全部
- 在玻璃圆筒中盛有两种无色的互不相容的中性液体.上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以
在玻璃圆筒中盛有两种无色的互不相容的中性液体.上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅拌棒上下剧烈搅动.静置后液体又分为两层,下层液体呈紫红色,上层液体几乎无色.根据上述实验回答:
(1)阳极上的电极反应式:
(2) 阴极上的电极反应式:
(3)原上层液体是:
(4)原下层液体是:
(5)搅拌后两层液体颜色发生变化的原因是:
(6)要检验上层液体中含有的金属离子,其方法是:------- .现象是:-------
四个不同的小球放入四个不同的盒中且恰有一个空盒的放法有多少种 冷冷皓月1年前1
冷冷皓月1年前1 -
 kitty0521 共回答了17个问题
kitty0521 共回答了17个问题 |采纳率88.2%运用学过的电解原理相关知识,推知在阳极周围生成了I2,证明电解质溶液中含有I-;在阴极上有H2生成;所以上层液体为KI溶液(或NaI溶液),下层液体密度大于水且与水不相溶,能从上层溶液中将I2萃取出来,说明下层液体为CCl4溶液(或CHCl3溶液);再应用金属离子的检验方法——焰色反应,即可给出正确答案.
(1) 2I- — 2 e- = I2
(2) 2 H+ + 2 e - = H2↑
(3) NaI或KI
(4) 四氯化碳
(5) I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中
(6) 焰色反应.若焰色为黄色为NaI,通过蓝色钴玻璃观察,若焰色为紫色为KI.
这个题是全国卷高考化学命题的耻辱.巨大的BUG.
电解后水层是NaOH或KOH,I2怎么可能从碱液中进入CCl4?
144种方法.
 1年前查看全部
1年前查看全部
- 碳素行业里,为什么普通石墨电极用RP标示?高功率用HP标示?超高功率用UHP标示?
碳素行业里,为什么普通石墨电极用RP标示?高功率用HP标示?超高功率用UHP标示?
为什么用RP,HP,UHP来标示呢?是英文的缩写还是其他原因? 1080966751年前1
1080966751年前1 -
 lantongyue 共回答了19个问题
lantongyue 共回答了19个问题 |采纳率78.9%肯定是英文缩写了,
rp就是Regular Power(普通功率的意思),所以普通功率石墨电极在英文里就是Regular Power Graphite Electrodes .
HP就是High Power(高功率的意思),所以高功率石墨电极在英文里就是High Power Graphite Electrodes.
uhp就是 Ultra High Power(超高功率的意思,所以超高功率石墨电极在英文里就是Ultra High Power Graphite Electrodes.
----------------------------------------------------------------
承德隆和碳素厂,石墨电极生产厂家.1年前查看全部
- 请回答下列问题.(1)钢铁的电化学腐蚀原理如图1所示:写出石墨电极的电极反应式______;该腐蚀的总反应的化学方程式_
 请回答下列问题.
请回答下列问题.
(1)钢铁的电化学腐蚀原理如图1所示:
写出石墨电极的电极反应式______;
该腐蚀的总反应的化学方程式______.
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图2所示:
①A电极的电极反应式是______.
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为4.48g,则电镀时电路中通过的电子为______mol.
(3)如图3装置所示,C、D、E、F、G、H、X、Y都是惰性电极,甲、乙、丙中均为500mL 0.2mol/L的溶液(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,H极附近溶液变红.请回答:①A电极为______极(填“正”或“负”)
②若C极产生1.12L气体(标准状况),F极析出金属的质量为______g.
③通电一段时间后,发现Y极附近颜色加深,原因是______. fenfen7131年前1
fenfen7131年前1 -
 coolbilly 共回答了19个问题
coolbilly 共回答了19个问题 |采纳率94.7%解题思路:(1)钢铁发生吸氧腐蚀,石墨为正极,正极氧气得电子被还原生成OH-;负极上Fe失电子生成亚铁离子,总反应为Fe与氧气、水反应生成氢氧化亚铁;
(2)①电镀时镀层金属作阳极,待镀金属作阴极;
②根据金属质量和转移电子之间的关系式计算;
(3)①将直流电源接通后,H极附近呈红色,可知道氢离子在该电极放电,所以H即是阴极,并得到其他各个电极的名称;
②根据电极方程式结合电子守恒计算;
③氢氧化铁胶体粒子吸附正电荷.(1)钢铁发生吸氧腐蚀,石墨为正极,氧气得电子被还原生成OH-,方程式为O2+2H2O+4e-═4OH-,负极上Fe失电子生成亚铁离子,总反应为Fe与氧气、水反应生成氢氧化亚铁,该腐蚀的总反应的化学方程式2Fe+2H2O+O2=2Fe(OH)2;
故答案为:O2+2H2O+4e-═4OH-;2Fe+2H2O+O2=2Fe(OH)2;
(2)①电镀时镀层金属作阳极,待镀金属作阴极,则A极为Cu,其电极反应式为:Cu-2e-=Cu2+;
故答案为:Cu-2e-=Cu2+;
②阳极上铜质量减少,阴极上铜质量增加,二者质量差为4.48g时,阴极上析出铜的质量为2.24g,根据铜和转移电子之间的关系式知,转移电子的物质的量=[2.24g/64g/mol]×2=0.07mol,
故答案为:0.07;
(3)将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;
①由以上分析可知,A电极是电源的正极,
故答案为:正;
②若C极产生1.12L气体(标准状况)即0.05mol,C的电极方程式为:4OH--4e-=O2↑+2H2O,则转移的电子为0.2mol,F极的电极方程式为:Ag++e-=Ag,已知硝酸银溶液为500mL 0.2mol/L,则F极析出金属为0.1mol,所以析出银的质量为10.8g;
故答案为:10.8;
③在甲池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,
故答案为:氢氧化铁胶体粒子带正电荷.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,明确原电池的构成条件是解本题关键,注意把握电子守恒在计算中的应用,题目难度中等.1年前查看全部
- 如图所示,a,b,c,d均为石墨电极,通电进行电解,下列说法正确的是 [
如图所示,a,b,c,d均为石墨电极,通电进行电解,下列说法正确的是 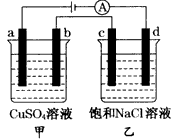
[ ]
A.乙池中d的电极反应为 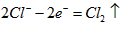
B.a,c两极产生气体的物质的量相等
C.甲、乙两池中溶液pH均保持不变
D.乙池中发生的反应为

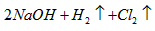
 journiac1年前1
journiac1年前1 -
 四加波 共回答了18个问题
四加波 共回答了18个问题 |采纳率83.3%D1年前查看全部
- 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.烧杯中C极上电极反应式为4H++4e-=2H2↑
D.乙烧杯中滴入酚酞试液,D极附近先变红 桉桉桉1年前1
桉桉桉1年前1 -
 xxwmj 共回答了18个问题
xxwmj 共回答了18个问题 |采纳率66.7%解题思路:电解时,甲烧杯中:A极(阳极)反应式为4OH--4e-=2H2O+O2↑,B极(阴极)反应式为:Cu2++2e-=Cu,乙烧杯中:C极(阳极)反应式为2Cl--2e-=Cl2↑,D极(阴极)反应式为2H++2e-=H2↑,以此解答该题.A.A极(阳极)反应式为4OH--4e-=2H2O+O2↑,生成氧气,不能析出铜,故A错误;
B.甲烧杯中B极上电极反应式为:Cu2++2e-=Cu,故B错误;
C.烧杯中C极上电极反应式为2Cl--2e-=Cl2↑,故C错误;
D.D极(阴极)反应式为2H++2e-=H2↑,由于H+放电,打破了水的电离平衡,导致D极附近溶液呈碱性(有NaOH生成),故D正确.
故选D.点评:
本题考点: 电解原理.
考点点评: 本题综合电解原理知识,侧重于电极方程式的判断和书写,明确电极反应为解答该题的关键,学习中注意把握书写方法,题目难度中等.1年前查看全部
- 图甲中电极均为石墨电极,下列叙述中正确的是 A.电子沿a→d→c→d路径流动 B.b极的电极反应为O 2 +4e - +
图甲中电极均为石墨电极,下列叙述中正确的是
A.电子沿a→d→c→d路径流动 B.b极的电极反应为O 2 +4e - +4H + =2H 2 O C.通电初期乙中的总反应为Cu+H 2 SO 4  CuSO 4 +H 2 ↑
CuSO 4 +H 2 ↑D.反应过程中,甲、乙装置中溶液的pH都逐渐减小  honcen1年前1
honcen1年前1 -
 bxf365 共回答了24个问题
bxf365 共回答了24个问题 |采纳率87.5%C
电子可以沿着导线流动,在电解质溶液中是阴阳离子的移动产生电流,即电子沿a→d、c→b路径流动;电池电解质为NaOH,所以b电极的电极反应为O 2 +4e - +2H 2 O=4OH - ;反应过程中,甲装置中产生水,所以溶液的pH减小,但是乙装置中由于H + 被消耗,所以pH增大。1年前查看全部
- 1LK2SO4、CuSO4的混合溶液中[SO42-]=2mol/L,用石墨电极电解此溶液,通电一段时间后,两极均收集到(
1LK2SO4、CuSO4的混合溶液中[SO42-]=2mol/L,用石墨电极电解此溶液,通电一段时间后,两极均收集到(标况)22.4L气体,则原溶液中[K+]为
(写出过程) 76年那天1年前1
76年那天1年前1 -
 fish90808 共回答了13个问题
fish90808 共回答了13个问题 |采纳率76.9%电解时,铜离子优先于氢离子反应.
两级都收集到22.4L的气体,即氢气和氧气都是一升
2H2O=2H2+O2
由电荷守恒定律可知,一共有2*2=4MOL的电子被转移,其中,氢得到2MOL,那么还有2MOL转移给了铜离子.
方程式不好打我用中文吧
铜离子得到两个电子后变为铜原子,既有2/2=1MOL的铜离子被还原为铜原子.
知道铜原子的物质的量后,可以得出溶液中有CuSO4提供的SO42-的物质的量也为1MOL,即由K2SO4提供的SO42-的物质的量为2-1=1MOL,[K+][SO42-]的比例关系为2:1,既有2MOL的[K+],其物质的量浓度为2/1=2MOL/L1年前查看全部
- 电解稀磷酸会产生什么麻烦高手解答一下用石墨电极电解稀磷酸,正负极分别会产生什么?如果磷酸中混有少量硫酸电解产物会有什么变
电解稀磷酸会产生什么
麻烦高手解答一下用石墨电极电解稀磷酸,正负极分别会产生什么?如果磷酸中混有少量硫酸电解产物会有什么变化? misia10281年前2
misia10281年前2 -
 放不低 共回答了15个问题
放不低 共回答了15个问题 |采纳率80%氢气和氧气.磷酸根离子比较稳定,不容易被电解.整个反应相当于电解水.没有变化1年前查看全部
- 用石墨电极在一定温度下电解K 2 SO 4 饱和溶液m g.当阴极产生a mol气体时,从溶液中析出n g无水晶体.则剩
用石墨电极在一定温度下电解K 2 SO 4 饱和溶液m g.当阴极产生a mol气体时,从溶液中析出n g无水晶体.则剩余溶液的溶质质量分数是( ) A. n 18a+n B. n m-n C. n 9a+n D. n 36a+n  ngy20001年前1
ngy20001年前1 -
 温州男人 共回答了24个问题
温州男人 共回答了24个问题 |采纳率91.7%用石墨电极电解硫酸钠溶液时,阴极上氢离子放电,阳极上氢氧根离子放电,所以实质上是电解水,当阴极产生a mol气体时,电解水的质量=
amol
2 ×2×18g/mol=18ag ,原来是饱和溶液,析出晶体后仍然是饱和溶液,且浓度不变,所以ng硫酸钾溶于电解的水中得到的质量发生就等于原溶液中质量分数,
所以该溶液的质量分数=
n
18a+n ,故选A.1年前查看全部
- (2010•东城区二模)如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色.下列说法正确的是( )
 (2010•东城区二模)如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色.下列说法正确的是( )
(2010•东城区二模)如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色.下列说法正确的是( )
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-=Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4g Cu析出时,b极产生2.24L(标准状况)气体 红_茶1年前1
红_茶1年前1 -
 鹤舞天堂 共回答了15个问题
鹤舞天堂 共回答了15个问题 |采纳率93.3%解题思路:a、b是石墨电极,通电一段时间后,b极附近溶液显红色,依据电解质溶液为氯化钠的酚酞溶液,判断b电极是阴极,Y为电源负极,X为电源正极,Pt为阳极,Cu为阴极;依据电极原理分析选项;
A、分析判断Y为电源负极,X为电源正极;
B、a电极是氯离子失电子发生的氧化反应;
C、电解过程中硫酸铜溶液中氢氧根离子放电生成氧气,溶液的pH减小;
D、Pt电极分析判断为阳极,所以铜离子在Cu电极析出.A、a、b是石墨电极,通电一段时间后,b极附近溶液显红色,依据电解质溶液为氯化钠的酚酞溶液,判断b电极是阴极,Y为电源负极,X为电源正极,故A错误;
B、a电极是氯离子失电子发生的氧化反应,电极反应为2Cl--2e-=Cl2↑,故B正确;
C、电解过程中CuSO4溶液中 的氢氧根离子在阳极Pt电极失电子生成氧气,溶液中铜离子在Cu电极得到电子析出铜,溶液中氢离子浓度增大,溶液的pH逐渐减小,故C错误;
D、电解过程中CuSO4溶液中 的氢氧根离子在阳极Pt电极失电子生成氧气,溶液中铜离子在Cu电极得到电子析出铜,故D错误;
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解池原理的分析判断,注意现象判断电极,阳极电极上的放电顺序书写电极反应,题目难度中等.1年前查看全部
- 右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
 右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
(1)X电极上的电极反应式为______,在X极附近观察到的现象是______.
(2)Y电极上的电极反应式为______,若在X电极处收集到标准状况下的气体224mL,则Y电极处生成物的质量为______ g. mcpbv1年前1
mcpbv1年前1 -
 安徽rr 共回答了19个问题
安徽rr 共回答了19个问题 |采纳率94.7%解题思路:(1)依据装置图可知X为电解池阴极,溶液中氢离子得到电子发生还原反应生成氢气,破坏了水的电离平衡,溶液中氢氧根离子浓度增大;
(2)Y电极和电源正极连接是电解池的阳极,溶液中氯离子失电子发生氧化反应失电子生成氯气;依据X电极生成的氢气物质的量计算Y电极生成的氯气;(1)装置图可知X连接电源负极,为电解池阴极,溶液中氢离子得到电子发生还原反应生成氢气,电极反应为:2H++2e-=H2↑,破坏了水的电离平衡,溶液中氢氧根离子浓度增大,酚酞变红色;
故答案为:2H++2e-=H2↑,生成无色气体,X电极附近溶液变红;
(2)Y电极和电源正极连接是电解池的阳极,溶液中氯离子失电子发生氧化反应失电子生成氯气,Y电极上的电极反应式为2Cl--2e-=Cl2↑,若在X电极处收集到标准状况下的气体224mL是氢气,物质的量为0.01mol,依据电子守恒计算得到氯气为0.01mol,生成氯气质量=0.01mol×71g/mol=0.71g;
故答案为:2Cl--2e-=Cl2↑,0.71g;点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理的应用,主要是电极判断,电极反应应用,题目较简单.1年前查看全部
大家在问
- 1找出下列名词中的可数名词及不可数名词,将其序号写在下面横线上.
- 2(2011•青岛模拟)归纳式探究:
- 3数字小学一年级的四个圆放到数位上,最大的两位数和最小的两位数是什么
- 4哪位天才帮我解答下两道数学题目?谢谢~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
- 5学校合唱队有男队员20人,占合唱队总人数的九分之二.合唱队的人数占全校学生人数的十七分之一,全校共有学生多少人?
- 6My collection 英语作文
- 7相同质量、初温的高温的铜和铁,放入水中..等到与水同温(水的温度会上升).哪个放出的热量多
- 8今天是2014年7月1日,那么今天以后的2014^3天是星期几?
- 9我是一名高一的学生,想在数学方面多做些题目练练手,以中档题为主,并配有解析.请大家帮我推荐几本
- 10hello,hi那个号 英语翻译
- 11(2014•普陀区二模)下列实验操作正确的是( )
- 12《童趣》这篇古文,你认为要怎样才能成为一个富有情趣的人?
- 13midway through 他们两个一起用就是中途的意思是吗?
- 14android 中的ADT是不是模拟器的意思?
- 15(2011•路南区一模)如图所示的四个图象,能正确反映对应变化关系的是( )

