有刺激性气味且对空气构成污染的气体是
 lxp_cadi2022-10-04 11:39:545条回答
lxp_cadi2022-10-04 11:39:545条回答
已提交,审核后显示!提交回复
共5条回复
 六月烟火 共回答了12个问题
六月烟火 共回答了12个问题 |采纳率100%- 二氧化硫,硫化氢,氯气,氮氧化物,氨气
- 1年前
 书店使者 共回答了94个问题
书店使者 共回答了94个问题 |采纳率- N——NO2 NH3
S—— SO2 H2S
Cl——Cl2 HCl - 1年前
 我心相依 共回答了5个问题
我心相依 共回答了5个问题 |采纳率- SO2 还有NO和NO2
- 1年前
 lulu_7blue 共回答了3个问题
lulu_7blue 共回答了3个问题 |采纳率- SO2
- 1年前
 云雀lark 共回答了1661个问题
云雀lark 共回答了1661个问题 |采纳率- SO2 ,NH3,H2S 等等很多
- 1年前
相关推荐
- 油料腐蚀问题油品蒸馏装置在200°c的负压情况下,铁质装置被严重腐蚀,塔顶回流装置中有强烈刺激性气味,塔板腐蚀后有绿色斑
油料腐蚀问题
油品蒸馏装置在200°c的负压情况下,铁质装置被严重腐蚀,塔顶回流装置中有强烈刺激性气味,塔板腐蚀后有绿色斑纹,塔顶油料取出后先为透明黄色,加热到120左右后变成墨绿色也可以说蓝绿色,然后降温加入等体积水搅拌1min后会变成浅棕黄色,萃取出油层再加热到120又会变成墨绿色……可反复.含水油料加热后冷凝在容器顶部的液体为酸性.油料加水搅拌后变成浅棕黄色后加入氢氧化钙搅拌后,再萃取油层加热不会变色,维持浅棕黄色.目前只知道油料中氯含量严重超标,其他指标未测.有谁懂得帮忙分析下吧
油料内有水的时候腐蚀严重 夜雨添蓝1年前1
夜雨添蓝1年前1 -
 夜色阿曼_oo 共回答了18个问题
夜色阿曼_oo 共回答了18个问题 |采纳率72.2%“江苏省太仓市数千辆汽车加油后出现异常,许多车辆出现加油熄火、排气管生锈、流出不明液体等情况.第三方检测机构上海SGS通标国际检测中心报告显示,太仓事故所涉油品中有两项指标明显偏高,其中氯含量高达6400PPM,超过美国标准6000多倍.”也许是氯含量直接影响1年前查看全部
- 气体X是一种无色有刺激性气味的酸性氧化物,X加氧气变为Y,加水变为Z,Z加氧气变为W,Y加水变为W
气体X是一种无色有刺激性气味的酸性氧化物,X加氧气变为Y,加水变为Z,Z加氧气变为W,Y加水变为W
求Y的化学式,Z的化学式,X直接排入空气造成的环境问题 林外 X加氯水变为W 他们中那些是可逆反应,哪些是氧化还原反应写出X与氯水反应的方程式 briviar1年前2
briviar1年前2 -
 仨怪物 共回答了18个问题
仨怪物 共回答了18个问题 |采纳率88.9%X是二氧化硫 Y是三氧化硫 Z是H2SO3 W是H2SO4
SO2+2H2O+Cl2=H2SO4+2HCl
可逆反应:2SO2+O2﹤=催化剂△=﹥2SO3
SO2+H2O﹤=﹥H2SO3
氧化还原反应:2SO2+O2﹤=催化剂△=﹥2SO3
2H2SO3+O2=2H2SO4
SO2+2H2O+Cl2=H2SO4+2HCl1年前查看全部
- 无色液体A在一定的条件下可分解成B、C两种气体,将点燃的硫放入B中,则燃烧更旺,发出明亮的蓝紫色火焰,生成一种有刺激性气
无色液体A在一定的条件下可分解成B、C两种气体,将点燃的硫放入B中,则燃烧更旺,发出明亮的蓝紫色火焰,生成一种有刺激性气味的气体D.将C通过加热的氧化铜,则生成A和E.
(1)由此可推断:
A是:______B是:______ C 是:______ D 是:______E是:______
(2)写出下列化学方程式:
A→B+C______;
C+CuO→A+E______. 马萱1年前4
马萱1年前4 -
 gongliunan 共回答了21个问题
gongliunan 共回答了21个问题 |采纳率85.7%解题思路:A物质在一定条件下分解生成B、C两种气体,而硫能够在B中燃烧可以知道B为氧气,则可知A是水,则C为氢气,生成的气体D为二氧化硫,可以据此答题.A物质在一定条件下分解生成B、C两种气体,而硫能够在B中燃烧可以知道B为氧气,则可知A是水,则C为氢气,生成的气体D为二氧化硫,氢气和氧化铜反应可以生成水和铜;
(1)由分析知A是水,B是氧气,C是氢气,D是二氧化硫,E是铜;
(2)A→B+C是水的电解过程,方程式为:2H2O
通电
.
2H2↑+O2↑;C+CuO→A+E是氢气还原氧化铜的反应,方程式为CuO+H2
△
.
Cu+H2O;
故答案为:(1)水;氧气;氢气;二氧化硫;铜;
(2)2H2O
通电
.
2H2↑+O2↑;CuO+H2
△
.
Cu+H2O;点评:
本题考点: 物质的鉴别、推断.
考点点评: 熟练掌握常见物质的化学性质,能够根据反应的现象来判断发生反应的物质,是解题的关键所在;1年前查看全部
- 在蔗糖晶体中加入少量的水湿润后,再加入热的浓硫酸,蔗糖变黑 并有刺激性气体产生,气体能使品红褪色
在蔗糖晶体中加入少量的水湿润后,再加入热的浓硫酸,蔗糖变黑 并有刺激性气体产生,气体能使品红褪色
写出方程式 fkue52831年前1
fkue52831年前1 -
 逃课的水手 共回答了24个问题
逃课的水手 共回答了24个问题 |采纳率87.5%浓硫酸具有脱水性、吸水性、强氧化性,在蔗糖溶液中蔗倘变黑体现的是脱水性,有刺激性气体产生体现的是强氧化性.化学方程式为2H2SO4(浓) C==加热==CO2(向上箭头) H2O 2SO2(向上剪头)1年前查看全部
- 乙醛与乙酸的气味乙酸和乙醛都是强烈刺激性气味,而乙酸就是醋酸,它和乙醛的味道有相似吗?乙醛的气味是什么样的?
 ooose1101年前2
ooose1101年前2 -
 最爱13的mfx 共回答了14个问题
最爱13的mfx 共回答了14个问题 |采纳率92.9%乙酸有酸味,你应该比较清楚;乙醛有芳香味,带香味的,不酸.1年前查看全部
- 写出符合下列各式的文字表达式 1.加热碳酸氢铵可以产生刺激性氨臭味气体
 lanling79341年前1
lanling79341年前1 -
 ericxuwei 共回答了23个问题
ericxuwei 共回答了23个问题 |采纳率91.3%1.加热碳酸氢铵可以产生刺激性氨臭味气体
碳酸氢铵==加热===氨气+二氧化碳+水1年前查看全部
- 生活中常见的刺激性强、易产气、粗纤维多的食物有哪些?
生活中常见的刺激性强、易产气、粗纤维多的食物有哪些?
呵 但我还是想知道一下 哪些食物具备这些特性 符合以上条件 天天呗美1年前1
天天呗美1年前1 -
 1013耳朵 共回答了9个问题
1013耳朵 共回答了9个问题 |采纳率88.9%你不会再寻找辣椒吧……据我亲身体会,辣椒很符合你要求哦!冷外,燕麦也挺好的!知道的就这么多了,不能提出更多的建议了.其实说真的,我觉得样样食物都吃一点,吃的又健康又快乐的就好,不必要考虑太多什么营养价值,食物功效之类的……人生在世何其短,要好好享受.1年前查看全部
- 什么与NaOH生成有刺激性气味的气体,滴加盐酸有气泡
 sijun77771年前3
sijun77771年前3 -
 我cc妻 共回答了18个问题
我cc妻 共回答了18个问题 |采纳率83.3%常见的:易分解成为难溶气体的弱酸的铵盐符合要求,或者是游离酸是气体并且溶解度小的
比如碳酸、亚硫酸、氢硫酸,他们的铵盐都是.
(NH4)2CO3 NH4HCO3 (NH4)2SO3 NH4HSO3 NH4HS (NH4)2S
另外有一个例子比较特殊,那就是亚硝酸铵,由于亚硝酸不稳定,在酸性条件下分解产生气体,因此也是:
3HNO2 ===2NO↑ + HNO3 +H2O
欢迎追问1年前查看全部
- 无色有刺激性气味的气体,能使紫色石蕊变蓝 是什么?
 zhchdyx1年前4
zhchdyx1年前4 -
 黑色眼睛007 共回答了18个问题
黑色眼睛007 共回答了18个问题 |采纳率88.9%氨气
二氧化硫是酸性气体,变红1年前查看全部
- 描述某些物质的物理性质时常见臭味字眼,刺激性气味在化学上都叫臭味吗?
 大在我1年前3
大在我1年前3 -
 qpalzmgh 共回答了18个问题
qpalzmgh 共回答了18个问题 |采纳率94.4%不是,那只是某些物质特定的气味,刺激性气味是指问到后对鼻粘膜有刺激作用的气味1年前查看全部
- 从分子角度回答下列问题:硫在空气燃烧,能问到刺激性气味的气体
 bgshw_jun1年前1
bgshw_jun1年前1 -
 宝宝兔的宝贝蛋 共回答了18个问题
宝宝兔的宝贝蛋 共回答了18个问题 |采纳率77.8%刺激性气味是SO2的,体现了分子不断运动的性质.
S+O2=SO21年前查看全部
- 硫在氧气中燃烧长生有刺激性气味
 血祭亡灵1年前2
血祭亡灵1年前2 -
 玉女之君 共回答了25个问题
玉女之君 共回答了25个问题 |采纳率100%对 ,因为生成了SO2 ,具有刺激性气味 S +O2==燃烧==SO21年前查看全部
- 氨(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性.实验室里加热氯化铵(NH4Cl)和熟石
氨(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性.实验室里加热氯化铵(NH4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.

(1)用化学方程式表示实验室制取氨气的化学反应原理.
(2)实验室里选择气体发生装置和收集装置应考虑哪些因素?
(3)最好选用下列气体发生装置中的______(填字母)制取氨气. 超级大水杯1年前1
超级大水杯1年前1 -
 yani_sy 共回答了19个问题
yani_sy 共回答了19个问题 |采纳率78.9%解题思路:(1)根据制取氨气的反应,写出反应的化学方程式;
(2)反应物的状态、反应条件、气体的密度、溶解性等是选择的依据;
(3)根据上述因素选择反应装置.(10实验室里加热氯化铵(NH4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.反应的化学方程式是:2NH4Cl+Ca(OH)2
△
.
CaCl2+2NH3↑+2H2O;
(2)实验室制取气体,气体的发生装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.
(3)由上述分析可知,因制取氨气是固固混合,反应条件是加热,为防止生成的水珠倒流炸裂试管,应选用C装置制取氨气.
故答案为:(1)2NH4Cl+Ca(OH)2
△
.
CaCl2+2NH3↑+2H2O;(2)反应物的状态和反应的条件,气体的性质或气体的密度、溶解性等;(3)C.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取气体的思路;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题的难度不大,熟练掌握实验室三大气体的制法是解答本题关健.1年前查看全部
- 请你参与下列探究:【问题情景】在课外活动中,小斌按照课本实验(见图1)探究微粒的性质时,闻到了刺激性的氨味,于是,小斌在
请你参与下列探究:
【问题情景】在课外活动中,小斌按照课本实验(见图1)探究微粒的性质时,闻到了刺激性的氨味,于是,小斌在老师的指导下,设计了如图2的实验装置,进行同样的实验,结果不再有刺激性的氨味,并且快速出现实验现象,得到了和课本实验同样的结论。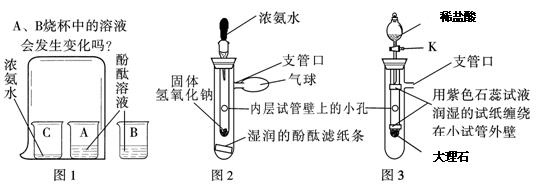
【实验探究与结论】小斌用图2装置进行实验。
(1)滴入少量浓氨水后,湿润的酚酞滤纸条发生的变化是 ;从微观角度分析,此现象可说明的结论是 。
(2)“图2的实验装置,快速出现实验现象”说明固体氢氧化钠遇到浓氨水时可能会
(填“放热”或“吸热”)。
(3)和课本实验比较,小斌改进后的装置的优点是(写出两点)
① ;② 。
【思维拓展】小媚受小斌实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的性质。
(1)打开活塞K滴入稀盐酸后,小试管中发生的反应的文字表达式为 ,发现两条用紫色石蕊试液润湿的试纸都变红,请你分析两条试纸变红的情况是 。
小媚从课本实验中知道,二氧化碳和水本身都不能使石蕊变色,因而她认为以上两个变化可验证的二氧化碳的性质是 、 。A.下面先变红,上面后变红 B.上面和下面一起变红 C.上面先变红,下面后变红 D.以上均有可能
(2)小柔认为小媚的装置还可以验证:①二氧化碳能使澄清石灰水变混浊;②二氧化碳不能燃烧,也不支持燃烧。小柔为完成自己的两个验证实验,对小媚的实验进行的简单改进:验证① 、 验证② 。 aicaifeng1年前1
aicaifeng1年前1 -
 wyshirley 共回答了11个问题
wyshirley 共回答了11个问题 |采纳率81.8%1年前查看全部
- 均由H、O、Na、S组成的两种盐溶液相互混合,生成无色有刺激性气味气体的方程式
 霜手有1年前1
霜手有1年前1 -
 轻WYJ松 共回答了12个问题
轻WYJ松 共回答了12个问题 |采纳率83.3%NaHSO3+NaHSO4===Na2SO4+H2O+SO2气体
SO2是无色有刺激性气味气体1年前查看全部
- 煤炉里的煤燃烧时,闻到刺激性气味的原因
 蓝子风1年前1
蓝子风1年前1 -
 wer1635 共回答了26个问题
wer1635 共回答了26个问题 |采纳率84.6%煤燃烧有二氧化硫,二氧化硫有刺激性气味1年前查看全部
- 下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。 
请回答下列问题
(1)B的电子式为_________________。
(2)J、K是同种金属的氯化物,且K为白色沉淀。写出SO 2 还原J生成K的离子方程式_________________________________。
(3)汽车尾气中常含有D。B在加热和催化剂存在的条件下能消除D的污染。已知:
①4NH 3 (g)+5O 2 (g) 4NO(g)+6H 2 O(g) △H=-905 kJ·mol -1
4NO(g)+6H 2 O(g) △H=-905 kJ·mol -1
②4NH 3 (g)+3O 2 (g) 2N 2 (g)+6H 2 O(g) △H=-1268 kJ·mol -1
2N 2 (g)+6H 2 O(g) △H=-1268 kJ·mol -1
则B与D反应的热化学方程式为________________________。
(4)有人认为:“表面化学”研究成果能使B和D的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高。请你应用化学基本理论对此观点进行评价:___________________________ 来自北方的狐狸1年前1
来自北方的狐狸1年前1 -
 冰舞悠扬 共回答了17个问题
冰舞悠扬 共回答了17个问题 |采纳率88.2%1年前查看全部
- 1.有时打开自来水龙头,会闻到一股刺激性气味,为什么?2.直接用氯气来漂白、杀菌消毒有什么不利因
1.有时打开自来水龙头,会闻到一股刺激性气味,为什么?2.直接用氯气来漂白、杀菌消毒有什么不利因
1.有时打开自来水龙头,会闻到一股刺激性气味,为什么?
2.直接用氯气来漂白、杀菌消毒有什么不利因素?如何改进? limin10111年前1
limin10111年前1 -
 gonewithstone 共回答了20个问题
gonewithstone 共回答了20个问题 |采纳率90%自来水中的刺激性气味是次氯酸的味道,用来给自来水消毒的
这样生产的自来水有比较刺鼻的氯气的气味,并且一部分溶解在水中的氯气会与水发生化学反应,生成少量的次氯酸(起到消毒作用),次氯酸不稳定又分解为盐酸.
改进:曝气(即把空气通入水中,再用阳光晒晒)1年前查看全部
- 氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用加热氯化铵与氢氧化钙固体混合物来
氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用加热氯化铵与氢氧化钙固体混合物来制取氨气.如图甲是实验室常用的制取气体的装置.

(1)请选择实验室制取氨气的发生装置,并写出用此装置制取另一气体的化学方程式.
(2)若在C装置中盛满水,用排水法收集氧气,则气体应该从哪端通入?若用C装置收集氨气,则气体应该从哪端通入?
(3)图乙是利用氨气做的一个趣味实验(夹持设备已略去),烧瓶中装有干燥的氨气,胶头滴管中装有水,先关闭阀门,将胶头滴管中的水挤入烧瓶内,然后打开阀门,请你描述烧瓶中可能出现的现象. loushiming1年前1
loushiming1年前1 -
 三角梅007 共回答了13个问题
三角梅007 共回答了13个问题 |采纳率92.3%解题思路:(1)由题目给出的信息可知:用加热氯化铵与氢氧化钙固体混合物来制取氨气,需要加热,故选发生装置A,还可用加热氯酸钾的方法制取氧气,据此书写方程式;
(2)排水法收集气体,气体要从短导管进,若用C装置收集氨气,因为氨气的密度比空气小,则气体要从e进入集气瓶;
(3)据题目信息:氨气的溶解性,其水溶液显碱性,以及实验设计和压强分析解答;烧瓶中装有干燥的氨气,胶头滴管中装有水,先关闭阀门,将胶头滴管中的水挤入烧瓶内,然后打开阀门,会看到:酚酞溶液进入烧瓶内,形成红色喷泉.(1)用加热氯化铵与氢氧化钙固体混合物来制取氨气,需要加热,故选发生装置A,还可用加热氯酸钾的方法制取氧气,方程式是:2KClO3
MnO2
.
△2KCl+3O2↑,加热高锰酸钾制取氧气试管口要放棉花,所以高锰酸钾制取氧气不能用此装置;
(2)排水法收集气体,气体要从短导管进,将水挤压到集气瓶底部排出;若用C装置收集氨气,因为氨气的密度比空气小,则气体要从e进入集气瓶,将空气挤压到集气瓶底部排出;故答案为:b;
(3)由于氨气极易溶于水,其水溶液显碱性,则关闭阀门,将胶头滴管中的水挤入烧瓶内,氨气会溶解使烧瓶内气压减小,打开阀门,酚酞溶液会被压入烧瓶内,由于其水溶液显碱性,所以会使酚酞试液变红,形成红色喷泉;
故答案为:(1)A;2KClO3
MnO2
.
△2KCl+3O2↑;
(2)e;e;
(3)酚酞溶液进入烧瓶内,形成红色喷泉.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 本考点主要考查气体制取的发生装置、收集装置的选择,气体的溶解性,酸碱指示剂的变色情况,气体的制取装置的选择与反应物的状态和反应的条件有关;并根据烧瓶内外产生压强差,有机的将物理和化学学科相联系,要依据相关知识认真分析解答.1年前查看全部
- 科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现
科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现象引起了同学们的思考.从组成物质的元素角度分析,他们猜测气体可能是SO2、CO、CO2、H2中的一种或几种.为了确定该气体的成分,他们进行了如下探究.
查阅资料:
Ⅰ.SO2、CO2都能与碱溶液反应生成盐和水,CaSO3难溶于水;
Ⅱ.SO2能与酸性高锰酸钾溶液反应并使它褪色,上述其它气体不能.
实验探究:
(1)甲同学为了验证处理废金属材料产生的气体中是否含有CO2,把它直接通入澄清石灰水,并观察实验现象.
乙同学认为甲同学的做法不合理.请用化学方程式表示其原因______.
(2)同学们设计了一套合理的实验装置,如图所示(铁架台已略去).请你从下列试剂中选择所需药品并完成实验(药品可重复选用):澄清石灰水,氢氧化钠溶液,酸性高锰酸钾溶液,浓硫酸,无水硫酸铜,碱石灰 (假设每步反应都是完全的)
①写出E装置中试剂的名称或化学式______.
②若观察到______(填装置序号)中澄清石灰水变浑浊,证明原气体中有CO2;
③若观察到______现象,证明原气体中有H2无CO. klgua1cqc65_e51年前1
klgua1cqc65_e51年前1 -
 wwzy1028 共回答了25个问题
wwzy1028 共回答了25个问题 |采纳率96%解题思路:(1)二氧化硫也能使澄清石灰水变浑浊,根据气体中可能含有二氧化硫分析;
(2)要检验水的存在用无水硫酸铜;检验二氧化碳的存在用澄清石灰水,但要首先除去二氧化硫.(1)二氧化碳可使澄清石灰水变浑浊,但混合气体中可能含有二氧化硫,二氧化硫能与石灰水反应生成亚硫酸钙沉淀,也可以使澄清石灰水变浑浊,化学反应式是:SO2+Ca(OH)2═CaSO3↓+H2O,所以甲同学的做法不合理,
故答案为:SO2+Ca(OH)2═CaSO3↓+H2O;
(2)①E装置中试剂的名称应该是无水硫酸铜,可以检验经过D装置后有无水生成,从而检验氢气的存在;
故答案为:无水硫酸铜;
②要证明原气体中有CO2,首先装置A中的试剂应该是酸性高锰酸钾溶液,除去可能存在的二氧化硫,因为二氧化硫也可以使澄清的石灰水变浑浊;然后在装置B中加入澄清石灰水,澄清石灰水遇二氧化碳变浑浊,检验二氧化碳的存在,所以要观察到B中的澄清石灰水变浑浊,证明原气体中有CO2.
故答案为:B;
③D装置中黑色粉末变成红色,说明有还原气体存在,E中的无水硫酸铜变蓝,说明有水生成,继而说明混合气体中含有氢气;再就是F中的石灰水不变浑浊,说明没有二氧化碳生成,就是说混合气体中没有一氧化碳.就可证明原气体中有H2无CO,
故答案为:D装置中黑色粉末变成红色,E中的无水硫酸铜变蓝,F中的石灰水不变浑浊.点评:
本题考点: 常见气体的检验.
考点点评: 做好本题应该了解二氧化硫、无水硫酸铜可以检验水的存在、澄清石灰水检验二氧化碳的存在、一氧化碳和氢气具有还原性等性质,看似复杂的题目更需要同学们静心思考,方可迎刃而解.1年前查看全部
- 氮肥为什么遇碱有刺激性气味
 vivi07301年前1
vivi07301年前1 -
 zwq_1983 共回答了16个问题
zwq_1983 共回答了16个问题 |采纳率93.8%氮肥里面一般都含有铵根离子 ,(NH4+)+(OH-)=NH3+H2O,遇碱反应会生成氨气1年前查看全部
- (2009•普宁市一模)甲醛(化学式为CH2O)是一种无色、有刺激性气味的气体,易溶于水,有毒.为使服装达到防皱、改善手
(2009•普宁市一模)甲醛(化学式为CH2O)是一种无色、有刺激性气味的气体,易溶于水,有毒.为使服装达到防皱、改善手感等效果,在加工中需添加甲醛.但衣物中残留的甲醛超标会损害人体健康.以下说法或做法中错误的是( )
A.甲醛属于有机物
B.新衣服先用水洗可除去残留的甲醛
C.甲醛属于氧化物
D.新衣服有异味可能是甲醛含量超标 004281年前1
004281年前1 -
 tombbs071 共回答了12个问题
tombbs071 共回答了12个问题 |采纳率100%解题思路:A、根据有机物的定义进行分析,
B、根据甲醛的物理性质进行分析,
C、根据有机物的定义进行分析,
D、根据甲醛的气味进行分析.A、有机物中都含有碳元素,甲醛中有碳元素,所以属于有机物,故A正确,
B、甲醛易溶于水,所以新衣服用水洗,可以将甲醛除去,故B正确,
C、有两种元素组成的化合物中,其中一种是氧元素的叫氧化物,而甲醛中有三种元素,不属于氧化物,故C错误,
D、甲醛是一种无色有刺激性气味的气体,故D错误,
故选C.点评:
本题考点: 亚硝酸钠、甲醛等化学品的性质与人体健康;物质的简单分类.
考点点评: 在解此类题时,首先从题中找出有用的知识,然后根据学过的知识对选项进行判断.在用定义解释时,注意定义的严密性.1年前查看全部
- (1)二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填
(1)二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填“物理”或“化学”).
(2)新闻报道《小雨引“燃”一车电石》很好地说明水可“引火”.该报道称:5月9日傍晚,一辆储运电石的汽车因未做好防水工作,行驶过程中天降小雨,引发车厢着火…已知:电石(CaC 2 )不可燃,与水接触剧烈反应产生乙炔(C 2 H 2 ).
①根据上述信息,请从物质组成和化学性质的角度,说说你对乙炔气体的认识(各一条).
组成:______;化学性质:______.
②根据上述信息,你认为应该如何保存电石?答______. jude7621年前1
jude7621年前1 -
 junjie1103 共回答了15个问题
junjie1103 共回答了15个问题 |采纳率86.7%(1)二氧化氮的颜色、状态、气味等方面的性质不需要通过化学变化表现出来,属于物理性质.故填:物理.
(2)①由乙炔的化学式可知,乙炔是由碳元素和氢元素组成的.故填:乙炔是由碳元素和氢元素组成的.
乙炔能够燃烧需要通过化学变化表现出来,属于化学性质.故填:乙炔可以燃烧.
②乙炔能够和水发生化学反应,所以应该防水、密封保存.故填:防水、密封保存.1年前查看全部
- 矿物能源燃烧时会产生一种刺激性气味的气体,易形成酸雨,因为矿物能源中含有---
矿物能源燃烧时会产生一种刺激性气味的气体,易形成酸雨,因为矿物能源中含有---
工业酒精不能饮用是因为--- qvv771年前1
qvv771年前1 -
 流水铿然 共回答了21个问题
流水铿然 共回答了21个问题 |采纳率95.2%含有硫,工业酒精是甲醇,酒精是乙醇1年前查看全部
- 写出有关内容反应的化学方程式:燃烧含有硫黄的烟花竹爆时,会产生一种刺激性的气味_____________________
写出有关内容反应的化学方程式:燃烧含有硫黄的烟花竹爆时,会产生一种刺激性的气味_________________________.
 lrdelr1年前0
lrdelr1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高锰酸钾与福尔马林反应生成什么,放出具有刺激性的气体又是什么,求反应式
 茜子1年前2
茜子1年前2 -
 韵飞 共回答了16个问题
韵飞 共回答了16个问题 |采纳率87.5%我知道生成的就是甲酸 和 锰酸钾.反应原理就是氧化还原反应.高锰酸钾是强氧化剂 甲醛是还原剂 甲醛氧化成了甲酸 高锰酸钾还原成了锰酸钾1年前查看全部
- (2013•奉贤区二模)1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广谱、高效、无刺激性、
(2013•奉贤区二模)1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广谱、高效、无刺激性、无腐蚀等特点,对禽流感、猪流感等疾病有良好的防治作用.根据上述信息,判断下列说法正确的是( )
A.戊二醛分子式是C5H10O2,符合此分子式的二元醛有4种
B.戊二醛不能在加热条件下和新制的氢氧化铜悬浊液反应
C.戊二醛不能使酸性高锰酸钾溶液褪色
D.2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用 wangtian88481年前1
wangtian88481年前1 -
 zzhh008 共回答了15个问题
zzhh008 共回答了15个问题 |采纳率86.7%解题思路:A、根据结构简式写出其分子式,根据碳链异构确定其含有二元醛的同分异构体个数.
B、一定条件下,醛基和新制氢氧化铜能反应生成砖红色氧化亚铜.
C、醛基能被酸性高锰酸钾溶液氧化.
D、GA溶液有杀菌消毒作用.A、戊二醛分子式为C5H8O2,符合此分子式的二元醛有2种,故A错误.
B、戊二醛含有醛基,所以在加热条件下,戊二醛能和新制氢氧化铜反应生成砖红色沉淀氧化亚铜,故B错误.
C、戊二醛含有醛基,性质较活泼,能被酸性高锰酸钾溶液氧化,所以戊二醛能使酸性高锰酸钾溶液褪色,故C错误.
D、根据题意知,2%的GA溶液具有广谱、高效、无刺激、无腐蚀等特点,对禽流感、口蹄疫、猪瘟等疾病有良好的防治作用,所以2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用,故D正确.
故选D.点评:
本题考点: 醛类简介.
考点点评: 本题以戊二醛为载体考查了醛的性质,难度不大,注意醛能被弱氧化剂银氨溶液氧化,所以更能被强氧化剂酸性高锰酸钾氧化.1年前查看全部
- J均为初中化学中的常见物质,已知A、B的组成元素相同,B是最常用的溶剂;常温下C、E均为无刺激性气味的气体,且C为单质;
J均为初中化学中的常见物质,已知A、B的组成元素相同,B是最常用的溶剂;常温下C、E均为无刺激性气味的气体,且C为单质;A、B、D、E、J均为氧化物,J是常用的干燥剂;F、G是粗严重含有较多的可溶性杂质,它们的阳离子是硬水中含有较多的金属离子;H、I均为白色难溶于水的盐,其中H能溶于酸,而I却不溶于酸.J之间的转化关系如图所示(其中→代表物质之间的转化关系,部分反应物、生成物和反应条件均略去)

 SDA-蓝天1年前1
SDA-蓝天1年前1 -
 myzj45arq651b 共回答了19个问题
myzj45arq651b 共回答了19个问题 |采纳率94.7%BaSO4 CaO
| |
MgSO4---CaCl2---CaCO3
| |
MgO CO2
/
O2
/
H2O2 H2O
解题思路:
1、已知A、B的组成元素相同,B是最常用的溶剂;常温下C、E均为无刺激性气味的气体,且C为单质;A、B、D、E、J均为氧化物,J是常用的干燥剂;
可以知道 J是CaO; A是H2O2;B是H2O;C自然是O2;
2、F、G是粗严重含有较多的可溶性杂质,它们的阳离子是硬水中含有较多的金属离子;可以知道F、G是Ca、 Mg化合物了;
3、再结合H、I均为白色难溶于水的盐,其中H能溶于酸,而I却不溶于酸.
以及J是CaO可以推断 H为CaCO3,而G为CaCl2了
4、结合上面三点应当可以推断 D为MgO ;E为 CO2;F为MgSO4,I自然是BaSO4了1年前查看全部
- 图1表示制作洋葱鳞片叶表皮细胞临时装片的部分步骤,请据图回答: (1)在步骤②的操作过程中,某同学闻到刺激性气味,含有该
图1表示制作洋葱鳞片叶表皮细胞临时装片的部分步骤,请据图回答: 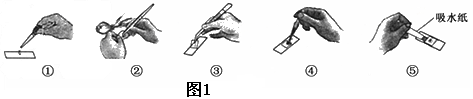
(1)在步骤②的操作过程中,某同学闻到刺激性气味,含有该气味的物质主要来自细胞结构中的 。
(2)步骤④滴的液体是 ___ 。
(3)观察时,若视野中出现较多气泡,是由于图5中所示的步骤 ____ (填序号)操作不当引起的。
(4)图2是显微镜的四个镜头,欲使视野中的细胞数目最多,应选用的镜头组合是 。
 零点八四1年前1
零点八四1年前1 -
 商未雄 共回答了14个问题
商未雄 共回答了14个问题 |采纳率85.7%(1)液泡
(2)稀碘液
(3)③
(4)①④1年前查看全部
- 冰醋酸挥发的气体成分是什么冰醋酸易挥发大家都知道 有刺激性气味产生 但是挥发出的气体成分是什么呢
 娃哈哈qv1821年前1
娃哈哈qv1821年前1 -
 qqbuluo 共回答了25个问题
qqbuluo 共回答了25个问题 |采纳率92%冰醋酸就是纯的乙酸,它挥发有刺激性气味的气体就是气态的乙酸分子.1年前查看全部
- 氯气(Cl2)通常情况下为有刺激性气味的黄绿色的有毒气体,密度比空气大,可跟水反应,反应后溶液呈酸性.实验室通常用浓盐酸
氯气(Cl2)通常情况下为有刺激性气味的黄绿色的有毒气体,密度比空气大,可跟水反应,反应后溶液呈酸性.实验室通常用浓盐酸与二氧化锰共热的方法来制取氯气.实验室制取气体的一套完整装置应包括发生装置、净化装置(包括干燥)、收集装置、尾气处理装置.回答下列问题:
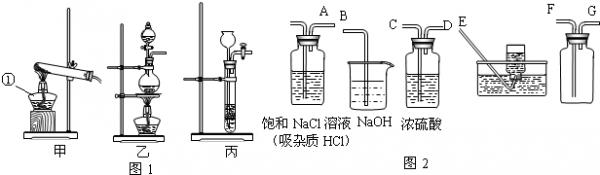

(1)制取氯气的发生装置应选用图1中的______装置;仪器①的名称是______.
(2)在放入药品之前必须检查______.
(3)氯气的化学性质为:______.
(4)用图2中的仪器(不一定全部用到)完成氯气的净化(包括干燥)、收集、尾气处理,其正确的连接方法是:A接______、______接______、______接______. renbude1年前1
renbude1年前1 -
 junbopre 共回答了12个问题
junbopre 共回答了12个问题 |采纳率91.7%解题思路:(1)根据题目所给反应物的状态和发生装置的选择依据即可.
(2)凡是有气体参加或有气体生成的反应装置开始前都要检验气密性,防止泄气.
(3)这个空是要学生通过题目信息搜索答案,注意必须是化学性质.
(4)根据二氧化碳的性质及其反应后的杂质即可做出判断.(1)根据题目信息可知,实验室通常用浓盐酸与二氧化锰共热的方法来制取氯气;二氧化锰是固体,浓盐酸是液体,结合发生装置的选择条件,应该选择乙装置;故答案为:乙;酒精灯.
(2)凡是有气体参加或有气体生成的反应装置开始前都要检验气密性,防止泄气,故答案为:装置气密性
(3)根据题目信息可知,可于水反应,反应后溶液显酸性,酸性物质可以和碱反应生成盐和水;故答案为:可跟水反应,也可与碱溶液反应.
(4)反应后气体有三种:氯气和氯化氢(浓盐酸有挥发性)和水蒸汽,所以应该先除氯化氢,再除水蒸气;在收集装置中,由于氯气密度比空气大,所以气体应该F口进去;氯气有毒性,所以要进行尾气处理,同时氯气可以和碱反应;故答案为:C、DF、GB点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常用仪器的名称和选用;化学性质与物理性质的差别及应用.
考点点评: 这是一个完整的气体制取、净化、收集、尾气处理装置,使学生对气体的生成到收集有了完整的理解.本题需要注意的是净化的先后顺序和收集气体时的进气口选择.1年前查看全部
- 氯化铵与碱混合共热生成一种有刺激性气味的气体,该气体是
 戒掉你的爱1年前1
戒掉你的爱1年前1 -
 晨雾 共回答了14个问题
晨雾 共回答了14个问题 |采纳率78.6%氨气1年前查看全部
- Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的K
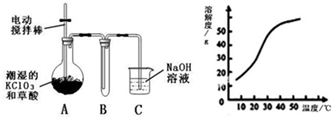 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有______.
(2)反应后在装置C中可得NaClO2溶液.已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2•3H2O,在温度高于38℃时析出晶体是NaClO2.根据图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:①蒸发结晶;②______;③洗涤;④干燥.
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液.为测定所得溶液中ClO2的浓度,进行了下列实验:
①准确量取ClO2溶液V1 mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0.
②加入足量的KI晶体,静置片刻.此时发生反应的离子方程式为:______;
③加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL.则原ClO2溶液的浓度为cV2 5V1 mol/L(用含字母的代数式表示).(已知2Na2S2O3+I2=Na2S4O6+2NaI)cV2 5V1
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入如图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极.
接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如图(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式2CuSO4+2H2O
2Cu+O2↑+2H2SO4通电 .2CuSO4+2H2O;
2Cu+O2↑+2H2SO4通电 .
(2)电极f上发生的电极反应为______;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是______. 礼物漂亮1年前1
礼物漂亮1年前1 -
 三年天下 共回答了19个问题
三年天下 共回答了19个问题 |采纳率89.5%解题思路:(1)根据反应需要的温度介于60~100℃之间的要采用水浴加热;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,根据题意温度高于38℃时析出晶体是NaClO2来确定过滤的温度;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,据此书写方程式;
③根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
Ⅱ、乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,根据电解池的工作原理以及电子守恒来书写电解方程式并进行计算即可.I.(1)KClO3和草酸(H2C2O4)在60℃时的反应来制取目标产物,需要的温度介于60~100℃之间的要采用水浴加热,所以还缺少盛水的装置:烧杯,
故答案为:烧杯;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,并且只有温度高于38℃时析出晶体才是NaClO2,所以要趁热过滤,故答案为:趁热过滤;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,2ClO2+8H++10I-═Cl2+5I2+4H2O,故答案为:2ClO2+8H++10I-═Cl2+5I2+4H2O;
③设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2 10
10-3×xV110-3×cV2
解得x=
cV2
5V1,故答案为:
cV2
5V1;
Ⅱ.乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O
通电
.
2Cu+O2↑+H2SO4,故答案为:2CuSO4+2H2O
通电
.
2Cu+O2↑+H2SO4;
(2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)=[8g/64g/mol]=0.125mol,转移0.25mol电子,丙中发生2H2O
通电
.
O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
故答案为:向丙烧杯中加入2.25g水.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;电解原理.
考点点评: 本题是一道综合知识的考查题,涉及物质的制备实验,电解池的工作原理等方面知识,综合性强,难度大.1年前查看全部
- 初三试验题,关于铁和氧化铁,32.(6分)同学们在用某硫酸溶液处理金属废料(主要是生铁)时,观察到溶液发烫并闻到刺激性气
初三试验题,关于铁和氧化铁,
32.(6分)同学们在用某硫酸溶液处理金属废料(主要是生铁)时,观察到溶液发烫并闻到刺激性气味,这种反常现象引起同学们的思考.从元素组成的角度分析,他们猜测气体可能是SO2、CO、CO2、H2中的一种或几种.
资料:①SO2与澄清石灰水反应生成亚硫酸钙沉淀;②SO2能与酸性高锰酸钾溶液反应,使之褪色,上述其他气体均不能;③氢气具有还原性.
(1)甲同学认为废气中一定有SO2,原因是 .
(2)为了确定该气体的成分,同学们设计了一套合理的实验装置,如下图所示(铁架台已略去).请你从下列试剂中选择药品并结合实验装置完成实验.
药品:澄清石灰水,酸性高锰酸钾溶液,无水硫酸铜(遇水变蓝),碱石灰(吸收水和CO2).【药品可重复选用,每一步均反应充分】
(Ⅲ)D中反应前有样品10g(样品中可能混有铁),完全反应后剩余固体7.6g,则原样品的成分为:.(写出物质及其对应的质量)
除了8g的氧化铁,还有2g的Fe,为什么啊/?


 shlh181年前1
shlh181年前1 -
 luckpotato 共回答了20个问题
luckpotato 共回答了20个问题 |采纳率85%A→KMnO4,B-是石灰水,c是碱石灰,E是CuSO4,F是石灰水.
原理是先检验二氧化硫(高锰酸钾褪色),高锰酸钾氧化性暴强,基本可以把二氧化硫吸光,接下来检验二氧化碳(排除了二氧化硫的干扰),再用碱石灰确保把把酸性氧化物除尽,用co和H2还原氧化铁(还原氧化铜类似),再检验还原反应产物水的存在,最后检验由co生成的CO2.(不能颠倒,否则石灰水带出水)
结论是"某"硫酸是浓硫酸,会氧化生铁中的碳,铁,生成co,co2,硫酸亚铁,硫酸铁,自己生成二氧化硫,知道变为稀硫酸.
计算用差量法,列出方程3co Fe2O3=3CO2 2Fe求出反应生成的铁是5.6克,拿7.6减掉,是原来混的铁(设氧化铁完全反应,否则没法做),刚好是2克1年前查看全部
- (2014?河东区二模)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究
(2014?河东区二模)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究
 (2014?河东区二模)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
(2014?河东区二模)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
(1)装置A中的现象是______.在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是______.
(2)装置C的作用是______.
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有______
A.烧瓶B.酒精灯C.漏斗D.烧杯E.玻璃棒
(4)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去.
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.上述方案不合理的是______,原因是______.
(5)能表明的还原性性弱于SO2的现象是______.
 soking1年前1
soking1年前1 -
 2007西楚霸王 共回答了16个问题
2007西楚霸王 共回答了16个问题 |采纳率81.3%(1)装置A中SO2做还原剂,被氧化为硫酸根离子,Fe3+作氧化剂,被还原为Fe2+,反应离子方程式为:SO2+2Fe3++2H2O═2Fe2++SO42-+4H+,则A中反应的现象为:溶液颜色由黄色逐渐变为浅绿色;
反应中S元素的化合价由+4升高为+6价,Fe元素的化合价由+3价降低为+2,SO2和Fe3+的化合价升降之比为2:1,因此参加反应的物质的量之比为1:2,
故答案为:溶液颜色由黄色逐渐变为浅绿色,1:2;
(2)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染,故答案为:吸收未反应的SO2,防止空气污染;
(3)蒸发用到蒸发皿、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,没有用到烧瓶,所以A错误,故答案为:A;
(4)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,
故答案为:方案①;过量的SO2也能使KMnO4溶液褪色;
(5)I2+SO2+2H2O=2HI+H2SO4二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,故答案为:装置B中溶液蓝色褪去.1年前查看全部
- 光化学烟雾是排入大气的氮氧化合物和碳氢化合物等受太阳紫外线作用产生的一种具有刺激性的浅蓝色的烟雾.你认为美国洛杉矶一年中
光化学烟雾是排入大气的氮氧化合物和碳氢化合物等受太阳紫外线作用产生的一种具有刺激性的浅蓝色的烟雾.你认为美国洛杉矶一年中最易发生光化学污染的月份是
A. 1月
B. 4月
C. 7月
D. 11月
 haikuo5551年前1
haikuo5551年前1 -
 娃哈哈on0 共回答了24个问题
娃哈哈on0 共回答了24个问题 |采纳率83.3%答案C
本题考查大气污染.洛杉矶受地中海气候影响,夏季高温少雨,最容易发生光化学烟雾事件,故选C项.1年前查看全部
- 二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填“物理
二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填“物理”或“化学”).在催化剂作用下,汽车尾气中的一氧化碳(C0)可以和二氧化氮反应生成氮气和二氧化碳,该反应的化学方程式是2NO2+4CO
N2+4CO2催化剂 .2NO2+4CO.
N2+4CO2催化剂 . 灵儿13145201年前1
灵儿13145201年前1 -
 longtao08 共回答了18个问题
longtao08 共回答了18个问题 |采纳率94.4%解题思路:根据物质的颜色、状态、气味、熔点、沸点、硬度、密度等性质,不需要发生化学变化就表现出来,因此,都属于物理性质;根据方程式的书写考虑本题.二氧化氮通常状况下,它是一种有刺激性气味的红棕色气体属于颜色、状态、气味,属于物理性质;反应物是一氧化碳(C0)和二氧化氮写在等号的左边,生成物是氮气和二氧化碳,写在等号的右边,用观察法配平,反应条件是催化剂写在等号的上边,所以方程式是:2NO2+4CO
催化剂
.
N2+4CO2.
故答案为:物理;2NO2+4CO
催化剂
.
N2+4CO2.点评:
本题考点: 化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 物理性质、化学性质是一对与物理变化、化学变化有密切关系的概念,联系物理变化、化学变化来理解物理性质和化学性质,则掌握起来并不困难.熟记方程式的书写注意事项.1年前查看全部
- 已知氨气(NH3)是一种无色、有刺激性气味的气体,在实验室研究课上,小欣同学为了验证氨气(NH3)的某些性质,做了以下实
已知氨气(NH3)是一种无色、有刺激性气味的气体,在实验室研究课上,小欣同学为了验证氨气(NH3)的某些性质,做了以下实验:下图从左向右依次是她做的实验及相应现象.根据小欣的实验操作和现象,请你总结出氨气的两点物理性质和一点化学性质:
(1)物理性质:①______;②______;
(2)化学性质:______.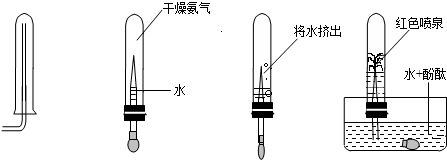
 青芒果22021年前1
青芒果22021年前1 -
 jackycncn 共回答了18个问题
jackycncn 共回答了18个问题 |采纳率88.9%解题思路:根据实验不难得出,用向下排空气法来收集氨气,说明氨气的密度比空气小,而氨气遇到水使试管内压强减小,而且形成的溶液能使酚酞变红,说明氨气易溶于水,形成的溶液呈碱性.物质的性质决定其用途,物质的用途体现其性质,若在使用物质的过程中,物质本身没有变化,则是利用了该物质的物理性质;若在使用过程中,物质本身发生了变化,变成了其他物质,则是利用了该物质的化学性质.
(1)通过观察题中的图示不难推测出物质氨气的物理性质:由于导气管口向下,可知,氨气的密度比空气小;再根据当向试管内挤入水时,水槽的水+酚酞能进入试管,可知氨气极易溶于水;
(2)再根据水+酚酞遇到氨气的水溶液变红色可推知,氨气溶于水形成的溶液呈碱性,发生了化学反应.
故答案为:(1)①氨气密度比空气小;②氨气易溶于水;
(2)氨气溶于水形成的溶液显碱性;点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 在解答此类信息给予题时,必须认真读懂题中所给予的信息,发觉隐含信息,再结合物质的性质特点定能准确做出判断.1年前查看全部
- 蹦极是一种富有刺激性的运动项目,一端系住人的腰部,另一端系于跳台的一跟弹性橡皮绳,当人下落至Q点时,橡皮绳刚好被拉直,那
蹦极是一种富有刺激性的运动项目,一端系住人的腰部,另一端系于跳台的一跟弹性橡皮绳,当人下落至Q点时,橡皮绳刚好被拉直,那么,在人越过Q点继续向下的过程中,人的动能变化情况是怎样的?
 caochunfang1年前1
caochunfang1年前1 -
 njce 共回答了16个问题
njce 共回答了16个问题 |采纳率93.8%当人下落到Q点时,动能是最大的,因为此时速度最大,此时弹簧还没有发生形变,
再往下运动时,动能逐渐减小,转化成弹性势能,速度减小,弹簧的形变增大.
能明白吗?1年前查看全部
- 下列关于化肥的一些说法,正确的是( ) A.氯化钾是一种复合肥料 B.所有氮肥加入熟石灰能闻到刺激性气味 C.硝酸铵的
下列关于化肥的一些说法,正确的是( ) A.氯化钾是一种复合肥料 B.所有氮肥加入熟石灰能闻到刺激性气味 C.硝酸铵的含氮量比尿素[化学是CO(NH 2 ) 2 ]高 D.农家肥与化肥综合使用,有利于保护环境  zy8111081年前1
zy8111081年前1 -
 v688 共回答了21个问题
v688 共回答了21个问题 |采纳率85.7%A、氯化钾中含有钾元素,属于钾肥.故选项说法错误.
B、铵态氮肥与碱性物质混合会产生刺激性气味,尿素不与熟石灰反应,加入熟石灰能不会闻到刺激性气味,故选项说法错误.
C、硝酸铵(NH 4 NO 3 )中氮元素的质量分数是
14×2
80 ×100%=35%,尿素中氮元素的质量分数是
14×2
60 ×100%≈46.7%;故硝酸铵的含氮量比尿素低,故选项说法错误.
D、要合理地使用化肥,将农家肥与化肥综合使用,有利于保护环境,故选项说法正确.
故选D.1年前查看全部
- 在通常情况下,二硫化碳(CS2)是一种无色有刺激性气味的液体.在空气中完全燃烧生成一种大气污染物和一种能产生温室效应的气
在通常情况下,二硫化碳(CS2)是一种无色有刺激性气味的液体.在空气中完全燃烧生成一种大气污染物和一种能产生温室效应的气体.请根据以上信息回答:
(1)二硫化碳的物理性质有______;
(2)发生反应的化学方程式为______,
(3)反应前后硫元素的化合价分别是______(CS2中碳元素的化合价为+4价). 挨淋1年前1
挨淋1年前1 -
 小猪笨笨快快跑啊 共回答了15个问题
小猪笨笨快快跑啊 共回答了15个问题 |采纳率80%解题思路:物质的物理性质主要有:颜色、状态、气味、密度、硬度、熔点、沸点等.根据反应物和生成物可以书写化学方程式.根据化合物中元素的化合价代数和为零的原则可以求元素的化合价.(1)无色、有刺激性气味、液体都是二硫化碳的物理性质.
故填:(通常情况下)无色、刺激性气味、液体.
(2)反应物是二硫化碳和氧气,生成物是二氧化硫和二氧化碳.化学方程式为:CS2+3O2
点燃
.
CO2+2SO2
二硫化碳中硫元素的化合价是-2价,二氧化硫中硫元素的化合价是+4价.故填:-2价和+4价.点评:
本题考点: 化学性质与物理性质的差别及应用;有关元素化合价的计算;化学方程式的概念、读法和含义.
考点点评: 本题主要考查了物质的物理性质、化学方程式、化合价等方面的内容.1年前查看全部
- 下列实验现象描述正确的是( ) A.硫粉在空气中燃烧时,发出蓝紫色火焰,生成具有刺激性气味的气体 B.浓硫酸的试剂瓶口
下列实验现象描述正确的是( ) A.硫粉在空气中燃烧时,发出蓝紫色火焰,生成具有刺激性气味的气体 B.浓硫酸的试剂瓶口能看到大量的白雾 C.木炭在氧气中燃烧,生成黑色固体 D.将CO 2 通入紫色石蕊溶液中,溶液变为红色  sammi2181年前1
sammi2181年前1 -
 peoplehlj 共回答了17个问题
peoplehlj 共回答了17个问题 |采纳率88.2%A、硫磺在空气中燃烧,发出淡蓝色火焰,且有刺激性气味的气体生成,故选项说法错误.
B、浓硫酸具有吸水性,不具有挥发性,因此打开盛浓盐酸的试剂瓶盖,瓶口没有白雾出现,故选项说法错误.
C、木炭在氧气中燃烧的现象是发出白光,不生成黑色固体,故选项说法错误.
D、将CO 2 通入紫色石蕊溶液中,溶液变为红色,故选项说法正确.
故选:D.1年前查看全部
- “非典”肆虐时期,过氧乙酸(C2H4O3)是被人们广泛使用的消毒剂,它无色且有刺激性气味,具有强氧化性,温度稍高即分解放
“非典”肆虐时期,过氧乙酸(C2H4O3)是被人们广泛使用的消毒剂,它无色且有刺激性气味,具有强氧化性,温度稍高即分解放出氧气并生成醋酸(CH3COOH),请写出过氧乙酸分解的化学方程式______.
 hn12801年前4
hn12801年前4 -
 胡宽 共回答了16个问题
胡宽 共回答了16个问题 |采纳率81.3%解题思路:根据题意:过氧乙酸温度稍高即分解放出氧气并生成醋酸(CH3COOH),然后根据方程式的书写步骤“写配注等”进行书写.过氧乙酸温度稍高即分解放出氧气并生成醋酸,方程式是2C2H4O3=2CH3COOH+O2↑;
故答案为:2C2H4O3=2CH3COOH+O2↑.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了学生根据题目信息书写方程式的能力,难度不大.1年前查看全部
- 【材料Ⅰ】实验室常用加热氯化铵固体和氢氧化钙粉末的方法来制取氨气(NH3),它是一种无色,有刺激性气味,极易溶于水,密度
【材料Ⅰ】实验室常用加热氯化铵固体和氢氧化钙粉末的方法来制取氨气(NH3),它是一种无色,有刺激性气味,极易溶于水,密度比空气小的气体.
【材料Ⅱ】实验室常用锌粒和稀硫酸在常温下反应制取氢气(H2),它是一种无色,无味,难溶于水的气体.相同条件下氢气是密度最小的气体.
【问题Ⅰ】:研究实验室制取气体的发生装置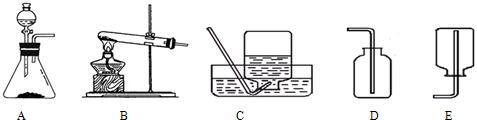
(1)实验室制取NH3的发生装置是______,可以选择与______(KMnO4制取O2,H2O2制取O2,制取CO2)相同的装置,原因是______;
(2)实验室制取H2的发生装置是______,可以选择与______(KMnO4制取O2,H2O2制取O2,制取CO2)相同的装置,原因是______.
(3)总结:实验室制取气体选择发生装置的依据是______.
【问题Ⅱ】:研究实验室制取气体的收集装置
(1)NH3的收集装置是______,原因是______.
(2)H2的收集装置是______,原因是______.
(3)总结:实验室制取气体选择收集装置的依据是______. loveni13141年前1
loveni13141年前1 -
 zhuzhumylove 共回答了19个问题
zhuzhumylove 共回答了19个问题 |采纳率89.5%解题思路:【问题Ⅰ】(1)实验室制取氨气、利用高锰酸钾制取氧气都需要加热,反应物都是固体;(2)实验室制取氢气、制取二氧化碳、利用过氧化氢制取氧气都不需要加热,反应物是固体和液体;(3)实验室制取气体选择发生装置时,要考虑反应物的状态、反应条件;【问题Ⅱ】(1)根据氨气的性质可以选择收集的方法;(2)根据氢气的性质可以选择收集的方法;(3)实验室制取气体选择收集装置时,要考虑气体的水溶性、密度.【问题Ⅰ】
(1)实验室制取氨气需要加热,应该用B装置作为发生装置,可以选择与高锰酸钾制取氧气相同的装置,原因是反应物是固体,需要加热.
故填:B;KMnO4制取O2;反应物是固体,需要加热.
(2)实验室制取氢气不需要加热,应该用A装置作为发生装置,可以选择与过氧化氢制取氧气、制取二氧化碳相同的装置,原因是反应物是液体和固体,不需要加热.
故填:A;H2O2制取O2,制取CO2;反应物是液体和固体,不需要加热.
(3)实验室制取气体选择发生装置的依据是反应物状态和反应条件.
故填:反应物状态和反应条件.
【问题Ⅱ】
(1)氨气极易溶于水,不能用排水法收集,密度比空气小,可以用向下排空气法收集,即用E装置收集.
故填:E;氨气的密度比空气小.
(2)因为氢气不溶于水,可以用排水法收集,即用C装置收集,密度比空气小,可以用向下排空气法收集,即用E装置收集.
故填:C或E;不溶于水或密度比空气小.
(3)实验室制取气体选择收集装置的依据是水溶性和密度.
故填:水溶性和密度.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取气体的思路;实验室制取氧气的反应原理;氢气的制取和检验.
考点点评: 选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、密度、能否和空气中的物质发生化学反应等因素.1年前查看全部
- 燃放烟花爆竹能产生一种具有刺激性气味的气体,会污染空气.该气体由两种元素组成,其质量比为1:1.这种气体是( ) A.
燃放烟花爆竹能产生一种具有刺激性气味的气体,会污染空气.该气体由两种元素组成,其质量比为1:1.这种气体是( )
A.CO B.SO 2 C.H 2 S D.NO 2  非无理取闹1年前1
非无理取闹1年前1 -
 snoobi 共回答了13个问题
snoobi 共回答了13个问题 |采纳率76.9%B
1年前查看全部
- 氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与生石灰反应来制取氨气.
氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与生石灰反应来制取氨气.
(1)请你从图中选择实验室用此方法制取氨气的发生装置.
(2)若用C装置收集氨气,则气体要从 (填“a”或“b”)进入集气瓶.
(3)将石蕊溶液滴加到盛有氨气的集气瓶中,可观察到的现象是什么?
(4)氨气具有强烈刺激性,怎么才能正确闻氨气的气味?
 baci12211年前1
baci12211年前1 -
 蝙蝠狂人 共回答了21个问题
蝙蝠狂人 共回答了21个问题 |采纳率71.4%(1)B;(2)B;(3)石蕊试液变成蓝色;(4)用手在容器口轻轻扇动,让极少量气体飘进鼻孔.
1年前查看全部
- (2012•武汉模拟)二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水,密度比空气大.实验室常用亚硫酸钠(Na2SO
(2012•武汉模拟)二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水,密度比空气大.实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫.现有如下装置:若在实验室中用上述装置制备并收集一瓶二氧化硫气体,且符合“绿色化学”理念,所选装置的连接顺序(按气体从左到右的方向)是( )

A.①接③
B.①接⑥,⑦接⑤
C.②接⑨,⑧接⑥
D.②接④ maria1969091年前1
maria1969091年前1 -
 静思俊 共回答了15个问题
静思俊 共回答了15个问题 |采纳率80%解题思路:制取装置包括加热和不需加热两种,实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫,因此不需要加热;二氧化硫能溶于水,密度比空气的密度大,因此只能用向上排空气法;为了环保,用最后一个装置,二氧化硫的密度比空气的密度大,因此应该从长管进入.二氧化硫污染空气,因此可以用氢氧化钠溶液吸收.A、实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫,因此不需要加热;故选项错误;
B、不需要加热,不能用排水法收集,故选项错误;
C、不需要加热,为了环保,用最后一个装置,二氧化硫的密度比空气的密度大,因此应该从长管进入;二氧化硫污染空气,因此可以用氢氧化钠溶液吸收.故选项正确;
D、如果用向上排空气法收集,容易造成污染,故选项错误;
故选C点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常见气体的检验与除杂方法;绿色化学.
考点点评: 本考点主要考查气体的制取装置和收集装置的选择,同时也考查了气体的收集和吸收.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- 关于鲁米诺的困惑鲁米诺(又称发光氨),它是一种黄色的晶体,一种刺激性的强酸.如果要跟血迹反应,是应该先把它配成溶液试剂吗
关于鲁米诺的困惑
鲁米诺(又称发光氨),它是一种黄色的晶体,一种刺激性的强酸.如果要跟血迹反应,是应该先把它配成溶液试剂吗?如果时晶体状态,可以跟血迹反应吗? 寓羚先尊1年前1
寓羚先尊1年前1 -
 裴不了 共回答了12个问题
裴不了 共回答了12个问题 |采纳率83.3%鲁米诺luminol,又名发光氨.可以鉴别经过擦洗,时间很久以前的血痕.它常温下是一种黄色晶体或者米黄色粉末,是一种比较稳定的化学试剂.它的化学式是C8H7N3O2 结构式在下面的图图里面有.同时,鲁米诺又是一种碱性物质,对眼睛、皮肤、呼吸道有一定刺激作用.在检验血痕时,鲁米诺与血红素(hemoglobin,血红蛋白中负责运输氧的一种蛋白质)发生反应,显出蓝绿色的荧光.鲁米诺的灵敏度可以达到一百万分之一.即1滴血混在 999,999滴水中时也可以被检验出来.不过它与其他具有氧化性的物质也发生反应,但是显示的颜色和显色的时间长短都是不同的.任何东西都不会不留痕迹地消失.这对于暴力犯罪受害者尤为适用.凶手可以处理掉受害者尸体,擦去一滩滩的血,但如果不使用强效清洁剂,仍将会留下一些痕迹.血液中的微小粒子将会附着在现场表面许多年,却无人知晓.
编辑本段基本原理
发光氨的基本原理是:几种化学物质与血液中的含氧蛋白——血红蛋白发生发光化学反应,从而显示血液的痕迹.分子会分裂成原子,原子重新组合成新分子.在这一特定反应中,反应物(原有分子)比生成物(生成分子)能量大.分子以可见光子的形式释放出多余的能量.这一过程通常称为化学发光,与萤火虫和荧光棒发光现象类似.
编辑本段适用范围
.使用发光氨的一个问题是化学反应会破坏犯罪现场的其他证据.基于这一原因,调查人员仅会在尝试其他办法之后,才使用发光氨.发光氨的确是警察的有用工具,但在现实犯罪调查中,并不像有些电视节目上使用得那样普遍.警察不会一走进犯罪现场,便开始向所有物体表面喷射发光氨.
编辑本段缺点
发光氨的缺点:它能照亮如铜和漂白剂等物质而不是血液.一直用发光氨来检测血液,也能摧毁血液证据,虽然研究证明一个能自行生产发育的DNA匹配经常在发光氨血液检测中被发现.最后一点就是,目前还不清楚发光氨是否是一种致癌物质.当CSI用发光氨检测血液时,他们首先将发光氨与过氧化氢混合.发光氨与过氧化氢进行化学反应.发光氨损耗氢和氮生成过氧化物,而过氧化物损耗氧生成发光氨.反应产生3个氨基.当发光氨进行化学反应时,它会损失电子,使之成为一个氧化反应.所以,在这个化学反应过程中,过氧化氢是氧化剂,因为它正在不断减少.反应后,3个氨基中的电子留在较高的能量水平.当电子回落到它们的正常能量水平,能量被释放,而人眼所看到的是一缕浅蓝色的光 虽然,发光氨的用途没有一些化学品的多.但是,在加拿大,在抓捕极端危险的罪犯时,它发挥了非常重要的作用,使其成为一个非常重要的化学品.1年前查看全部
- 化 学 无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气
化 学 无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气
化
学
无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气味气体f,这些字母名称是? rtttuytytytyty1年前2
rtttuytytytyty1年前2 -
 2007yexin 共回答了37个问题
2007yexin 共回答了37个问题 |采纳率91.9%a过氧化氢,b二氧化锰,c氧气,d水,e硫,f二氧化硫1年前查看全部
大家在问
- 1妈妈买三千克苹果,和两千克梨共付款12元,李奶奶买同样价格的三千克苹果和五千克梨,共付款21元
- 2已知a=(2,3,-4),b=(-4,-3,-2),则2a+b=?
- 3高中化学金属颜色帮我检查喜爱有无错误
- 4读经纬网图,回答问题.(1)甲经度为______,纬度为______.丙经度为______,纬度为______.(2)甲
- 5为什么地震级别前有"里氏"二字?
- 6求英语翻译 在线等 这个活动截止时间是2014年3月1日,我希望你可以在此之前写出你的创意方案
- 7小强同学用如图所示的装置,探究“电流通过导体时产生的热量多少与什么因素有关”.图中两个密封的烧瓶内盛满质量和温度都相同的
- 8剑桥雅思6test2 小作文,高手来估分,谢谢
- 9这个平行四边形面积是28平方米,底是7米,这个平行四边形的面积是多少?
- 10控制红绿色盲和控制血友病两对相对性状的基因不遵守基因自由组合 为什么呢?
- 1127800立方厘米=()立方分米()升
- 12杜甫的春夜喜雨一诗中,什么表达了作者对这场及时雨的赞美
- 13怎么定英语报纸呢我马上要去一家外企做前台接待,属于行政方面的工作,我想问问每天读什么英语报纸会比较好呢,怎么订呢?我是凯
- 14Cieverness is more useful than beauty
- 15Well noted and thanks,will let you know if there is doubt(翻译


