以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如下:
 无及天使2022-10-04 11:39:541条回答
无及天使2022-10-04 11:39:541条回答
(1)写出流程图中一种氧化物的名称______.
(2)将黄铁矿粉碎,目的是______.
(3)流程中SO2转化为SO3的化学方程式为
| ||
| △ |
| ||
| △ |

已提交,审核后显示!提交回复
共1条回复
 yayayaya 共回答了16个问题
yayayaya 共回答了16个问题 |采纳率81.3%- 解题思路:(1)根据氧化物是由两种元素组成,一种元素是氧元素的化合物进行分析;
(2)根据黄铁矿粉碎会增大反应物的接触面积加快反应速度进行分析;
(3)根据题中的叙述找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式.(1)通过分析反应流程中的物质可知,二氧化硫或三氧化硫或三氧化二铁都是由两种元素组成,一种元素是氧元素,属于氧化物;
(2)反应物接触面积越大,反应越剧烈,黄铁矿粉碎会增大反应物的接触面积,加快反应速度,所以将黄铁矿粉碎,目的是:增大反应物的接触面积;
(3)二氧化硫和氧气在催化剂的作用下加热生成三氧化硫,化学方程式为:2SO2+O2
催化剂
.
△2SO3.
故答案为:(1)二氧化硫;
(2)增大反应物的接触面积;
(3)2SO2+O2
催化剂
.
△2SO3.点评:
本题考点: 物质的相互转化和制备;从组成上识别氧化物;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答此类题的关键是要知道氧化物的定义,知道反应物接触面积越大,反应越剧烈,了解书写化学方程式的注意事项. - 1年前
相关推荐
- (2010•江苏一模)以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以硫酸渣
(2010•江苏一模)以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以硫酸渣制备铁红(Fe2O3)的过程如下:
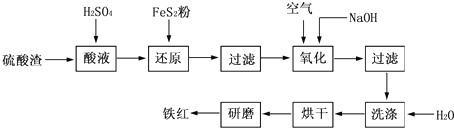
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是______.
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO
,写出有关的离子方程式:______.2−4
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:______.
(4)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH至3~4,其目的是______. 小螃蟹凯1年前1
小螃蟹凯1年前1 -
 freeoral 共回答了17个问题
freeoral 共回答了17个问题 |采纳率76.5%解题思路:(1)氧化铁是碱性氧化物,可以和酸反应生成盐和水;
(2)根据氧化还原反应中的反应物和生成物几何电子守恒来配平化学方程式;
(3)在碱性环境下,亚铁离子可以被氧气氧化为正三价离子;
(4)根据表中离子沉淀所需的pH大小来回答.(1)氧化铁是碱性氧化物,可以和硫酸反应生成硫酸铁和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)-2价的硫离子具有还原性,FeS2可以将溶液中的Fe3+还原为Fe2+,而本身被氧化为硫酸根离子,有关的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3)通入空气、加入NaOH可以将溶液中的铁元素充分转化为氢氧化铁沉淀而析出,即4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓,故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓;
(4)为了确保铁红的质量,氧化过程调节溶液的pH至3~4,其目的是使Fe3+沉淀完全,而其他金属阳离子不生成沉淀,故答案为:使Fe3+沉淀完全,而其他金属阳离子不生成沉淀.点评:
本题考点: 铁的氧化物和氢氧化物;离子方程式的书写;硅和二氧化硅;镁、铝的重要化合物.
考点点评: 本题涉及物质的性质、离子方程式的书写以及元素以及化合物的性质等方面的知识,难度不大.1年前查看全部
- 用黄铁矿制硫酸的流程为什么?
 梁超伟1年前3
梁超伟1年前3 -
 反反46 共回答了14个问题
反反46 共回答了14个问题 |采纳率78.6%黄铁矿化学成分是FeS2.
在空气中煅烧即可得到SO2,SO2在催化剂作用下与氧气反应生成SO3.
SO3继续如水反应就得到硫酸H2SO4.
总的流程图为:
FeS2+O2——SO2+Fe2O3,
SO2+O2——SO3,
SO3+H2O——H2SO4.1年前查看全部
- 下列事实不能用勒夏特列原理解释的是( ) A.往氢硫酸溶液中加入碱,有利于S 2- 增多 B.经粉碎的黄铁矿燃烧得较快
下列事实不能用勒夏特列原理解释的是( ) A.往氢硫酸溶液中加入碱,有利于S 2- 增多 B.经粉碎的黄铁矿燃烧得较快、较完全 C.实验室用排饱和食盐水的方法收集氯气 D.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率  zxhxy1年前0
zxhxy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•北海)煅烧黄铁矿(主要成分是FeS2)的化学方程式是:4FeS2+11O2 高温 .
(2012•北海)煅烧黄铁矿(主要成分是FeS2)的化学方程式是:4FeS2+11O2
2M+8SO2.请判断M的化学式是( )高温 .
A.FeSO4
B.Fe2O3
C.Fe3O4
D.Fe2(SO4)3 luolanzxc1年前1
luolanzxc1年前1 -
 flash543 共回答了18个问题
flash543 共回答了18个问题 |采纳率94.4%解题思路:质量守恒定律定律的微观解释是原子的三不变,即化学反应前后原子的种类不变、原子的数目不变、原子的质量不变,据此分析解答即可.在反应前原子的种类和数目分别为:Fe→4个,O→22个,S→8个,反应后不包括物质M中,原子的种类和数目分别为:S→8个,O→16个,所以根据化学反应前后原子的种类和数目不变可得:2M中含有个4个Fe和6个O,所以M中含有2个Fe和3个O,化学式为Fe203.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 此题考查的是质量守恒定律,根据其微观解释原子的三不变来做题,此题属于比较简单的题,但关键是要数清各原子的个数,另外要注意M前面有计量数2,很多学生往往忽略这一点,导致结果错误.1年前查看全部
- 工业上以黄铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2等对环境有较大影响的有害气体.能用于测定硫酸尾气
工业上以黄铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2等对环境有较大影响的有害气体.能用于测定硫酸尾气中SO2含量的是( )
A.NaOH溶液、酚酞试液
B.石灰水、石蕊试液
C.碘水、淀粉溶液
D.氨水、酚酞试液 chrishan1年前1
chrishan1年前1 -
 草根飘香 共回答了9个问题
草根飘香 共回答了9个问题 |采纳率100%解题思路:测定SO2含量必须要能跟SO2反应,而且可以用颜色变化来准确确定反应终点,A项和D项虽然能反应,但A在完全生成Na2SO3时溶液还是碱性,没变色,而D在SO2还没与氨水完全反应时就开始变色了.B项石灰水中所含溶质较少,且石蕊试液的颜色变化不明显,以此解答.A.在完全生成Na2SO3时溶液还是碱性,没变色,不能用于测定,故A错误;
B.石灰水中所含溶质较少,且石蕊试液的颜色变化不明显,故B错误;
C.碘水和二氧化硫发生氧化还原反应,终点时溶液褪色,可检测,故C正确;
D.氨水碱性较弱,在SO2还没与氨水完全反应时就开始变色了,不能测定,故D错误.
故选C.点评:
本题考点: 探究物质的组成或测量物质的含量;二氧化硫的化学性质.
考点点评: 本题考查物质的含量的测定实验方案的评价,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及溶液酸碱性的判断,难度不大.1年前查看全部
- 已知4FeS2+11O2=2Fe2O3+8SO2,使用1吨含杂质为20%的黄铁矿(FeS2)石,制得98%的浓硫酸约多少
已知4FeS2+11O2=2Fe2O3+8SO2,使用1吨含杂质为20%的黄铁矿(FeS2)石,制得98%的浓硫酸约多少吨?保留一位小
 向往变成神经病1年前1
向往变成神经病1年前1 -
 近几年 共回答了15个问题
近几年 共回答了15个问题 |采纳率86.7%4FeS2+11O2=2Fe2O3+8SO2
2SO2+ O2 ==催化==2SO3
SO3+H2O ==H2SO4
由上反应式得
1FeS2 2SO2 2SO3 2H2SO4
120 196
1*(1-20%) X*98%
X=1.31年前查看全部
- 某种含铁的矿石——黄铁矿种含有FeS2的质量分数为90%,10吨这种黄铁矿种含铁多少吨
 巨大小猫1年前1
巨大小猫1年前1 -
 zlf0056 共回答了18个问题
zlf0056 共回答了18个问题 |采纳率94.4%FeS2的质量:
M(FeS2)=10TX90%=9T
Fe的质量分数是56,S的是32,那么
M(Fe)=【56/(56+32X 2)】X9T=4.2T1年前查看全部
- 将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4,离子方程式怎么写
将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4,离子方程式怎么写
要分两步的 小偷cc1年前2
小偷cc1年前2 -
 懒人伤疤 共回答了22个问题
懒人伤疤 共回答了22个问题 |采纳率81.8%Fe3O4 + 8H+ ==2Fe3+ + Fe2+ +4H2O
2Fe3+ +Fe ==3Fe2+1年前查看全部
- 设某化工厂以黄铁矿(主要成分为Fes2)为原料产生硫酸.空气中的氧气的体积分数0,2,
设某化工厂以黄铁矿(主要成分为Fes2)为原料产生硫酸.空气中的氧气的体积分数0,2,
如果该厂生产98%的 浓硫酸100t.不考虑其他各生产阶段的物料损失.
1.需要含FeS260%的矿石质量为多少t?
2.最少需要消耗空气的体积(标状)为多少m³?
尽快回答, flowers41年前1
flowers41年前1 -
 5227720 共回答了15个问题
5227720 共回答了15个问题 |采纳率93.3%有关化学方程式为:1. 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 2. 8SO2 + 4O2 = 8SO3 3. 8SO3 + 8H2O = 8H2SO4 可以看出,题目中的已知物与待求物的关系为:
4FeS2 ~ 15O2 ~ 8H2SO4
4×120 t 15Mmol 8×98t
60% x y 100×98% t
解之 x= 100t y=1875Kmol
1.需要含FeS260%的矿石质量为100t.
2.最少需要消耗空气的体积(标状)为1875÷0.2×22.4=210000m³1年前查看全部
- 在沸腾炉中煅烧黄铁矿 化学方程式怎么写
 downsman1年前5
downsman1年前5 -
 老葱的星期天 共回答了16个问题
老葱的星期天 共回答了16个问题 |采纳率87.5%4FeS2+11O2==(煅烧)8SO2+2Fe2O31年前查看全部
- 以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如图:
以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如图:

(1)写出流程图中一种氧化物的名称______.
(2)将黄铁矿粉碎,目的是______.
(3)流程中SO2转化为SO3的化学方程式为2SO2+O2
2SO3催化剂 .△ 2SO2+O2.
2SO3催化剂 .△
(4)实验室稀释浓硫酸应注意什么?______.
(5)炉渣(Fe2O3)在工业上可用来______写出工业上以Fe2O3 为原料生产铁的化学方程式3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 . 861016520ppp1年前1
861016520ppp1年前1 -
 庚宝呵呵 共回答了24个问题
庚宝呵呵 共回答了24个问题 |采纳率91.7%解题思路:(1)氧化物是由两种元素组成,一种元素是氧元素的化合物;
(2)黄铁矿粉碎会增大反应物的接触面积加快反应速度;
(3)根据化学方程式的书写考虑;
(4)根据浓硫酸的稀释方法考虑;
(5)根据氧化铁可以用来炼铁考虑.(1)二氧化硫或三氧化硫或三氧化二铁都是由两种元素组成,一种元素是氧元素,属于氧化物;
(2)反应物接触面积越大,反应越剧烈,黄铁矿粉碎会增大反应物的接触面积,加快反应速度;
(3)反应物是二氧化硫和氧气,生成物是三氧化硫,用观察法配平,反应条件是催化剂和加热,所以方程式是:2SO2+O2
催化剂
.
△2SO3;
(4)浓硫酸的稀释方法是:将浓硫酸沿着容器壁慢慢倒入水中,并用玻璃棒不断搅拌;
(5)炉渣(Fe2O3)可以用来炼铁,一氧化碳与氧化铁反应生成铁和二氧化碳,所以可以用做冶铁原料,反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,根据得失氧进行配平,反应条件是高温,所以方程式是:3CO+Fe2O3
高温
.
2Fe+3CO2.
故答案为:(1)二氧化硫(或三氧化硫或三氧化二铁);(2)增大反应物的接触面积;(3)2SO2+O2
催化剂
.
△2SO3;(4)将浓硫酸沿器壁慢慢倒入水中,边倒边搅拌,且不可将水倒入浓硫酸中;(5)炼铁;3CO+Fe2O3
高温
.
2Fe+3CO2.点评:
本题考点: 物质的相互转化和制备;浓硫酸的性质及浓硫酸的稀释;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题的关键是要知道氧化物的特点,知道反应物接触面积越大,反应越剧烈,熟悉方程式的书写注意事项,知道浓硫酸的稀释方法.1年前查看全部
- 将黄铁矿煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.溶解过程中需保持溶液足够酸性,其原因是?
 舞台上的孤独1年前1
舞台上的孤独1年前1 -
 weilan37 共回答了19个问题
weilan37 共回答了19个问题 |采纳率94.7%因为铁离子和亚铁离子
在弱酸性,中性,碱性条件下会水解
使得制取的硫酸亚铁会转化为氢氧化铁
所以保持溶液足够酸性,使得不让铁离子和亚铁离子水解1年前查看全部
- (2011•江山市模拟)以黄铁矿为原料生产硫酸的主要设备是沸腾炉、(炉气精制)、接触室和吸收塔等.
(2011•江山市模拟)以黄铁矿为原料生产硫酸的主要设备是沸腾炉、(炉气精制)、接触室和吸收塔等.
(1)请写出炉气制造即沸腾炉中黄铁矿燃烧的化学方程式4FeS2+11O2
2Fe2O3+4SO2高温 .4FeS2+11O2.
2Fe2O3+4SO2高温 . (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
A、精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图1所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是______、______.
B、接触室中2SO2(g)+O2(g)
2SO3(g),反应过程的能量变化如图2所示.催化剂 .△
已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
①图中C点表示______,E的大小对该反应的反应热______(填“有”或“无”) 影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”或“降低”).
②反应达到平衡时,平衡常数表达式K=c2(SO3) c2(SO2)c(O2) ,升高温度,K值______(填“增大”、“减小”或“不变”);图中△H=______kJ•mol-1.c2(SO3) c2(SO2)c(O2)
(3)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物.取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收.实验数据如下:
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为______.实验次数 铵盐质量(g) 浓硫酸增加的质量(g) 第一次 1.570 0.340 第二次 3.140 0.680 第三次 4.710 0.510 第四次 6.280 0
②x的值为______. XUANXUAN1001年前1
XUANXUAN1001年前1 -
 xingnvhai 共回答了17个问题
xingnvhai 共回答了17个问题 |采纳率88.2%解题思路:(1)结合工业制硫酸的原理书写化学方程式;
(2)A、根据图中所示,结合实际生成和需要,在常压下二氧化硫的转化率已经很高了,再加压需要对设备更新投入,且提高的余地很小,无经济效益;温度过低,反应速率低生产周期长影响生成效益;
B、根据图形分析结合能量高低进行判断,催化剂只改变反应的活化能不改变平衡,反应的焓变只与起始和终了物质的能量有关,与反应过程无关,运用化学平衡的理论,改变条件,依据平衡移动的方向来分析判断,K值只随温度的变化而变化;
(3)本反应历程是:OH-首先是和NH4HSO3中的H+反应,随后有多的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO3的量也增大,放出的氨气的量会为0.浓硫酸增加的质量就是氨气的质量.第一次和第二次放出的氨气的量是一样的,所以说第一次肯定是OH-的量过量.利用第二次的量计算(因为是OH-不足).(1)根据反应原料写出化学方程式4FeS2+11O2
高温
.
2Fe2O3+4SO2,故答案为4FeS2+11O2
高温
.
2Fe2O3+4SO2
(2)①E为活化能,不影响化学反应能量,加入催化剂可改变反应历程并降低活化能.
②K只与温度相关的函数,升高温度,由于本反应为放热反应,平衡向逆移动,故K减小;图中表示的是反应2SO2(g)+O2(g)
催化剂
.
△2SO3(g),表示2mol二氧化硫反应放出的热量,已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1,所以图中的焓变为99kJ•mol-1×2=198KJ•mol-1,
故答案为:①生成物能量,无,降低.②,减小,-198.
(3)本反应历程是:OH-首先是和NH4HSO3中的H+反应,随后有多的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO3的量也增大,放出的氨气的量会为0.浓硫酸增加的质量就是氨气的质量.第一次和第二次放出的氨气的量是一样的,所以说第一次肯定是OH-的量过量.利用第二次的量计算(因为是OH-不足).
设:(NH4)2SO3的物质的量为a,NH4HSO3的物质的量为b
116a+99b=3.140(质量守恒)…①
17(2a+b)=0.680(元素守恒)…②
解得a=0.010mol,b=0.020mol,即(NH4)2SO3和NH4HSO3的物质的量之比为1:2.
再根据(NH4)2SO3~2NaOH,NH4HSO3~NaOH,可算出x=1.2mol/L.
故答案为:①1:2.②1.2.点评:
本题考点: 工业制取硫酸;化学反应中能量转化的原因;化学平衡常数的含义.
考点点评: 本题考查了影响化学平衡的因素,利用平衡进行工业生产的条件选择,反应焓变的计算和影响因素,平衡常数的书写与判断,元素守恒、质量守恒的计算应用等知识.1年前查看全部
- 以黄铁矿(主要成分为二硫化亚铁,FeS2)为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、
以黄铁矿(主要成分为二硫化亚铁,FeS2)为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、
以黄铁矿(主要成分为二硫化亚铁,FeS2)为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3)的过程 红铁的主要成分 lidaoxiang1001年前2
lidaoxiang1001年前2 -
 zdaceng 共回答了15个问题
zdaceng 共回答了15个问题 |采纳率93.3%Fe2O3加硫酸溶解,溶液成黄色
SiO2加氢氧化钠溶解,溶液呈粘稠的液体1年前查看全部
- (2014•闸北区二模)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40
(2014•闸北区二模)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).
下表列出了相关金属离子生成氢氧化物沉淀的pH:
某同学设计了如下方案,分离样品中各种金属元素,请回答下列问题.金属离子 开始沉淀的pH 沉淀完全的pH Fe3+ 2.2 3.2 Al3+ 3.7 4.7 Mg2+ 9.6 11.1 
(1)试剂A的化学式:______;固体C的化学式:______;操作I的名称:______;
(2)请你按上述框图形式进一步完成由“溶液D”到“Al2O3”的流程(注明试剂、条件和操作);为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
(3)若用铁粉还原Fe3+,测得的铁元素的含量______(填“偏大”或“偏小”或“不变”);如何确定Fe3+已全部被还原:______;
(4)判断到达滴定终点的现象是______;
(5)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL,试样溶液,用1.000×10-2mol/L KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则硫酸渣中铁元素的质量分数是______. 海洋小舟1年前1
海洋小舟1年前1 -
 jetrocky 共回答了19个问题
jetrocky 共回答了19个问题 |采纳率94.7%解题思路:流程依据废渣溶于过量盐酸得到溶液B中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;B溶液中加入氢氧化钠溶液,调节溶液PH=3.2后,生成氢氧化铁沉淀;和滤液MgCl2、AlCl3和过量HCl;在加入过量氢氧化钠溶液,过滤得到滤液中为NaCl,NaAlO2;通入二氧化碳气体生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到Al2O3;
(1)根据废渣主要化学成分中SiO2、Fe2O3、Al2O3和MgO的性质判断应加入过量盐酸或稀硫酸,Fe2O3碱性氧化物,Al2O3两性氧化物、MgO碱性氧化物都溶于过量的酸,只有二氧化硅不溶,经过滤后可分离;根据表中数据可知调节溶液PH=3.2后,生成氢氧化铁沉淀;
(2)依据流程图画出;
(3)若用铁粉还原Fe3+,会引入更多的铁元素,使测得的铁元素的含量偏大;可根据Fe3+的性质确定Fe3+是否已全部被还原;
(4)根据KMnO4标准溶液本身就是一种指示剂;
(5)利用关系式法计算和质量分数的概念来分析.依据废渣溶于过量盐酸得到溶液B中含有溶质为:MgCl2、AlCl3、FeCl3和过量HCl;B溶液中加入氢氧化钠溶液,调节溶液PH=3.2后,生成氢氧化铁沉淀;和滤液MgCl2、AlCl3和过量HCl;在加入过量氢氧化钠溶液,过滤得到滤液...
点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了设计流程分离物质,试剂选择和反应现象,反应特征的应用,滴定实验的终点判断,滴定过程的计算应用,题目难度中等.1年前查看全部
- 工业上黄铁矿原料制H2SO4,请回答下列问题:
工业上黄铁矿原料制H2SO4,请回答下列问题:
(1)燃烧黄铁矿是在______(填设备名称)中进行的.
(2)在接触室中生成SO3反应条件的选择,可以完全用勒夏特列原理解释的是(填标号)______.
A.温度为400℃-500℃B.常压C.O2过量D.用V2O5作催化剂
(3)硫酸工业的尾气中,除含有N2、O2外,还含有SO2、微量SO3和酸雾,为保护环境和提高综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品.处理方法可采用过量氨水吸收,主反应的化学方程式为______,同时还能发生多个反应,写出其中可能发生的两个氧化还原反应的反应式(或离子方程式):
______.
(4)SO2尾气可用饱和Na2SO3溶液吸收而得重要化工原料,反应的离子方程式为______.
(5)黄铁矿的煅烧产物Fe2O3(或Fe3O4等)溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其原因是______. 夜月悄悄1年前1
夜月悄悄1年前1 -
 longzhu8888 共回答了15个问题
longzhu8888 共回答了15个问题 |采纳率86.7%解题思路:(1)根据工艺流程分析;
(2)能够使平衡发生移动,则可以用勒夏特列原理解释;
(3)根据溶液中的成分和物质的性质分析;
(4)SO2能与饱和Na2SO3溶液反应;
(5)Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+.(1)燃烧黄铁矿是在沸腾炉中与氧气反应,故答案为:沸腾炉;
(2)能够使平衡向正方向移动的条件,有利于三氧化硫的生成,则可以用勒夏特列原理解释:
A.二氧化硫与氧气反应是放热反应,温度为400℃-500℃,平衡逆移,不利于三氧化硫的生成,故A错误;
B.高温有利于三氧化硫的生成,但是高压对转化率改变不大,而且提高了生产成本,所以采用常压,故B错误;
C.O2过量,能促使平衡正移,提高二氧化硫的转化率,故C正确;
D.用V2O5作催化剂,能加快反应速率,但是平衡不移动,故D错误;
故答案为:C;
(3)氨水中的NH3•H2O能与二氧化硫反应,其反应方程式为:SO2+NH3•H2O=(NH4)2SO3,亚硫酸和亚硫酸根离子中的硫元素易被氧气氧化,其反应方程为2H2SO3+O2=2H2SO4 2SO32-+O2=2SO42-,
故答案为:SO2+NH3•H2O=(NH4)2SO3;2H2SO3+O2=2H2SO4 2SO32-+O2=2SO42-;
(4)SO2能与饱和Na2SO3溶液反应生成NaHSO3,其反应方程式为SO2+H2O+SO32-=2HSO3-,故答案为:SO2+H2O+SO32-=2HSO3-;
(5)Fe2O3(或Fe3O4等)溶于H2SO4后,生成的Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+,所以要加入Fe粉和酸,抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+,
故答案为:抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+.点评:
本题考点: 工业制取硫酸.
考点点评: 本题考查了元素及化合物的性质,涉及平衡的移动,化学方程式和离子方程式的书写等,考查的知识点较多,难度中等.1年前查看全部
- 含FeS2百分之80的黄铁矿在煅烧是有百分之5的硫损失,二氧化硫生成三氧化硫的转化率为百分之80,
含FeS2百分之80的黄铁矿在煅烧是有百分之5的硫损失,二氧化硫生成三氧化硫的转化率为百分之80,
要生产百分之98的硫酸1吨,需要这样的硫铁矿多少吨
希望在2天内回答出来
 粉红心情1年前1
粉红心情1年前1 -
 诗人的眼泪_ss 共回答了14个问题
诗人的眼泪_ss 共回答了14个问题 |采纳率85.7%设硫酸中硫的质量为X千克,需要这样的硫铁矿Y吨
S……H2SO4
32 98
X 1000*98%=980
X/32=980/98
X=320千克
由于二氧化硫生成三氧化硫的转化率为百分之80,因此二氧化硫含硫320/80%=400千克
硫铁矿在煅烧是有百分之5的硫损失,因此硫铁矿中应含硫400/(1-5%)=421.1千克
FeS2…………2S
120 64
Y*80%*1000 421.1
800Y/120=421.1/64
Y=0.987吨1年前查看全部
- 某硫酸厂用750吨黄铁矿(含FeS2 80%)为原料(所含杂质不参加反应),计算能生产98%的浓硫酸多少吨
 0vibg1年前1
0vibg1年前1 -
 muyunshe 共回答了19个问题
muyunshe 共回答了19个问题 |采纳率84.2%750t*80%=600t
FeS2----2S----2H2SO4
120 196
600t x*98%
120/600t=196/(x*98%)
x=1000t1年前查看全部
- 某化工厂生产硫酸,使用一种含有SiO2杂质的黄铁矿样品.
某化工厂生产硫酸,使用一种含有SiO2杂质的黄铁矿样品.
经过测试该矿石,发现1g矿石样品在氧气中充分燃烧,残余固体是0.76g.若取1t该矿石,可值得98%的浓硫酸多少吨 苏格格1年前1
苏格格1年前1 -
 哦哦18 共回答了17个问题
哦哦18 共回答了17个问题 |采纳率94.1%黄铁矿和空气反应的化学方程式:4FeS2+11O2=2Fe2O3+8SO2残余固体是0.76g,残余的就是二氧化硅和杂质还有三氧化二铁,根据差量设FeS2为Mg4FeS2(480)+11O2=2Fe2O3(320)+8SO2(512) △m(160)△m=0.24g 所以列式可...1年前查看全部
- :将0.5080g黄铁矿(FeS2)试样分解后,得1.561gBaSO4.若溶液中的铁沉淀为Fe(OH)3,灼烧可得Fe
:将0.5080g黄铁矿(FeS2)试样分解后,得1.561gBaSO4.若溶液中的铁沉淀为Fe(OH)3,灼烧可得Fe2O3多少克?
 babyqiu20051年前1
babyqiu20051年前1 -
 wabt_002 共回答了19个问题
wabt_002 共回答了19个问题 |采纳率89.5%根据硫元素守恒,可得
FeS2 2 BaSO4
根据铁元素守恒,可得
FeS2 1/2 Fe2O3
所以2 BaSO4 1/2 Fe2O3
· 2*233.37 0.5*159.7
· 1.561 g m
2*233.37/(159.7*0.5) = 1.561 g / m
所以m = 0.267 g
灼烧可得Fe2O3 0.267 g1年前查看全部
- 以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如图:
以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如图:

(1)写出流程图中一种氧化物的名称______.
(2)将黄铁矿粉碎,目的是______.
(3)流程中SO2转化为SO3的化学方程式为2SO2+O2
2SO3催化剂 .△ 2SO2+O2.
2SO3催化剂 .△
(4)实验室稀释浓硫酸应注意什么?______. 江边小筑1年前1
江边小筑1年前1 -
 东侃侃西侃侃 共回答了17个问题
东侃侃西侃侃 共回答了17个问题 |采纳率100%解题思路:(1)氧化物是由两种元素组成,一种元素是氧元素的化合物;(2)黄铁矿粉碎会增大反应物的接触面积加快反应速度;(3)根据化学方程式的书写考虑;(4)根据浓硫酸的稀释方法考虑.(1)二氧化硫、三氧化硫、三氧化二铁都是由两种元素组成,一种元素是氧元素,属于氧化物;
(2)反应物接触面积越大,反应越剧烈,黄铁矿粉碎会增大反应物的接触面积,加快反应速度;
(3)反应物是二氧化硫和氧气,生成物是三氧化硫,用观察法配平,反应条件是催化剂和加热,所以方程式是:2SO2+O2
催化剂
.
△2SO3;
(4)浓硫酸的稀释方法是:将浓硫酸沿着容器壁慢慢倒入水中,并用玻璃棒不断搅拌;
故答案为:(1)二氧化硫(或三氧化硫或三氧化二铁);
(2)增大反应物的接触面积;
(3)2SO2+O2
催化剂
.
△2SO3;
(4)将浓硫酸沿器壁慢慢倒入水中,边倒边搅拌,且不可将水倒入浓硫酸中.点评:
本题考点: 物质的相互转化和制备;浓硫酸的性质及浓硫酸的稀释;从组成上识别氧化物;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题的关键是要知道氧化物的特点,知道反应物接触面积越大,反应越剧烈,熟悉方程式的书写注意事项,知道浓硫酸的稀释方法.1年前查看全部
- (2011•海门市二模)工业制硫酸主要分造气、氧化反应和吸收三个阶段.硫酸的生产流程如下(其中黄铁矿的主要成分为FeS2
(2011•海门市二模)工业制硫酸主要分造气、氧化反应和吸收三个阶段.硫酸的生产流程如下(其中黄铁矿的主要成分为FeS2):

请结合硫酸的生产流程回答:
(1)流程中含Fe2O3炉渣的用途是:______;在反应室中要不断排出热气,才能维持反应室的温度恒定.说明反应室中的化学反应是______(填“放热”或“吸热”)反应.含有SO2的废气造成空气的危害是:______.
(2)实验室通过稀释98%的浓硫酸配制20%稀硫酸98g,则需要加水的质量为______.
(3)用含硫元素32%的黄铁矿在反应流程中有2%的硫受到损失而混入炉渣和废气中(假设在SO2、吸收中没有损失).则这种黄铁矿石10t可以制得98%的硫酸多少t? hhm1111年前1
hhm1111年前1 -
 jefferyhsu 共回答了22个问题
jefferyhsu 共回答了22个问题 |采纳率90.9%解题思路:(1)充分理解节能环保的重要性.煅烧黄铁矿时生成的固体是三氧化二铁,所以炉渣是三氧化二铁,三氧化二铁用来炼铁.二氧化硫能形成亚硫酸,形成酸雨;
(2)根据稀释前后溶质质量不变;
(3)根据反应前后元素质量不变故反应前和反应后硫元素质量相等.(1)炉渣的主要成分是三氧化二铁;二氧化硫易形成酸雨;故答案为:用来炼铁.放热、造成酸雨.
(2)根据稀释前后溶质质量不变设需98%的浓硫酸的质量为x
x×98%═98g×20%
x=20g
需要加水的质量为:98g-20g═78g
答:需要加水的质量为78g
故答案为:78g
(3)根据反应前后元素质量不变故反应前和反应后硫元素质量相等;可列等式.
设98%的硫酸的质量为y
10t×32%×(1-2%)=y×98%×[32/98]
y═9.8t
答:98%的硫酸的质量为9.8t点评:
本题考点: 物质的相互转化和制备;用水稀释改变浓度的方法;酸雨的产生、危害及防治;物质组成的综合计算;物质发生化学变化时的能量变化.
考点点评: 解答本题的关键是要掌握稀释前后溶质质量不变,反应前后元素质量不变的判断方法,只有这样才能对问题做出正确的判断.1年前查看全部
- 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~900℃时,硫铁矿在纯净的氧气中煅烧,可能发生下列反
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~900℃时,硫铁矿在纯净的氧气中煅烧,可能发生下列反应:
① 3FeS2+8O2→Fe3O4+6SO2 ② 4FeS2+11O2→2Fe2O3+8SO2
⑵480 g纯净的FeS2在氧气中完全反应,若所得固体中,Fe和O的物质的量之比
n(Fe)∶n(O)=4∶a,此时消耗氧气b mol.
② b的最小值为_______▲ ____. tt深圳010101年前1
tt深圳010101年前1 -
 平安成都 共回答了12个问题
平安成都 共回答了12个问题 |采纳率100%从题目给出的反应方程式可以看出,FeS2中S元素消耗O2不管按照哪个反应进行都是一样多的(因为都是生成SO2),耗氧量多少关键是看Fe元素最后转化成什么.
如果转化为含O较少的Fe3O4,消耗氧就少;反之转化成含O较多的Fe2O3,则消耗O2就多.
480gFeS2物质的量为480g÷120g/mol=4mol,其中的含8molS原子和4molFe原子,S转化为SO2消耗8molO2,则Fe消耗的O2就是(b-8)mol,根据题意可知n(Fe) : n(O) = 4 : a = 4 : 2(b-8),解得:2b = a+16.
当FeS2全部生成含氧的质量分数较大的Fe2O3时,消耗氧最多,Fe2O3中n(Fe) : n(O) = 4 : a = 2 : 3,也就是a = 6,此时2b = a+16 = 22,b = 11.
当FeS2全部生成含氧的质量分数较小的Fe3O4时,消耗氧最少,Fe2O3中n(Fe) : n(O) = 4 : a = 3 : 4,也就是a = 16/3,此时2b = a+16 = 64/3,b = 32/3.
这是因为要解释a与b的关系才这样算的,如果只是要求出耗氧量的最小值,完全可以根据反应方程式计算得出.
3FeS2+8O2→Fe3O4+6SO2
3 8
4 x
x = 32/3
4FeS2+11O2→2Fe2O3+8SO2
4 11
4 y
y = 111年前查看全部
- 工业上制备100吨98%的浓硫酸 需含80% FeS2的黄铁矿多少吨
 D四代1年前1
D四代1年前1 -
 lyd827 共回答了11个问题
lyd827 共回答了11个问题 |采纳率72.7%FeS2 ~ 2*H2SO4
120 2*98
X*80% 100*98%
按上述方程算得:X=75,即要80%黄铁矿75吨.1年前查看全部
- 赤铁矿石和黄铁矿石哪个更适合炼铁
赤铁矿石和黄铁矿石哪个更适合炼铁
理由是什么 dyw123s1年前3
dyw123s1年前3 -
 suiyi332004 共回答了17个问题
suiyi332004 共回答了17个问题 |采纳率88.2%赤铁矿石适合 因为黄铁矿石中有硫酸根 燃烧后会生成二氧化硫 污染空气1年前查看全部
- 【化学与技术】以黄铁矿为原料(主要成分是FeS 2 )为原料,生产硫酸的简要流程图如下: (1)写出流程图中一种氧化物的
【化学与技术】
以黄铁矿为原料(主要成分是FeS 2 )为原料,生产硫酸的简要流程图如下:
(1)写出流程图中一种氧化物的名称 。
(2)将黄铁矿粉碎,目的是 。
(3)流程中SO 2 转化为SO 3 的化学方程式为 。
(4)炉渣(Fe 2 O 3 )在工业上可用来 。 mickeymim1年前1
mickeymim1年前1 -
 城市猎人BG 共回答了22个问题
城市猎人BG 共回答了22个问题 |采纳率81.8%1年前查看全部
- 黄铁矿主要成分是FeS2,其中硫负价只有-2,那么铁是几价?血求.
 黑色紫色1年前5
黑色紫色1年前5 -
 BBT晓英 共回答了13个问题
BBT晓英 共回答了13个问题 |采纳率84.6%硫的化合价也是可变的,不只是-2价,在黄铁矿中铁是+2价,硫是-1价.1年前查看全部
- 1.某化工厂生产硫酸,使用一种含杂质为25%的黄铁矿样品.已知黄铁矿与与氧气反映的化学方程式为4FeS2+11O2=2F
1.某化工厂生产硫酸,使用一种含杂质为25%的黄铁矿样品.已知黄铁矿与与氧气反映的化学方程式为4FeS2+11O2=2Fe2O3+8SO2若取一吨该矿石,可制的98%的浓硫酸多少吨.
2.若往电炉里加入二氧化硅和适量的混合物通电失他们发生反应如下.SiO2+2C=Si+2CO↑
①求生成物的质量各式多少?生成一氧化碳再标准状况下体积是多少?②写出工业提纯硅的有关反应化学方程式. 天天331281年前1
天天331281年前1 -
 重阳子 共回答了19个问题
重阳子 共回答了19个问题 |采纳率94.7%第一问抓住质量守恒定律.S的总质量不变.第二问什么都没告诉怎么算啊...1年前查看全部
- 黄铁矿和王水反应方程式
 超越第三者1年前1
超越第三者1年前1 -
 bobbie221 共回答了17个问题
bobbie221 共回答了17个问题 |采纳率94.1%FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O1年前查看全部
- 胆矾(CuSO4.5H2O)当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积,反应得到的铁
胆矾(CuSO4.5H2O)当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积,反应得到的铁和硫的混合物进入水溶液,该溶液无臭味,透明不浑浊,绿色,呈强酸性,试用一个方程式来表示.
 yeyi1281年前1
yeyi1281年前1 -
 从青岛到上海 共回答了14个问题
从青岛到上海 共回答了14个问题 |采纳率92.9%反应物有CuSO4、FeS2,生成物中有Cu2S.
溶液显绿色 说明Fe2+存在
溶液无臭味,透明,不浑浊,呈强酸性 ,可能存在(SO4)2-
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO41年前查看全部
- 把一克含SiO2的黄铁矿样品在氧气流中灼烧,反应后完全得到0.88g残渣
把一克含SiO2的黄铁矿样品在氧气流中灼烧,反应后完全得到0.88g残渣
已知SiO2不与氧气反应,则铁矿的纯度A33%B36%C78%D88% 娃哈哈1121年前1
娃哈哈1121年前1 -
 vvwwvv 共回答了18个问题
vvwwvv 共回答了18个问题 |采纳率83.3%用质量差量法计算
设纯度x
4FeS2 + 11O2 =高温= 2Fe2O3 + 8SO2----固体质量减少
4*120----------------2*160--------------------------160
1g*x------------------------------------------------(1-0.88)g
x=36%
即B1年前查看全部
- 把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是 A,33% B,66%
把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是 A,33% B,66% C,78%
把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是
A,33% B,66% C,78% D,88%
为什么此题中生成的是正三价的 铁,而在别的题目中,铁在氧气中生成四氧化三铁,在空气中点燃生成三氧化二铁 qihuoyj1年前3
qihuoyj1年前3 -
 ljzhang 共回答了16个问题
ljzhang 共回答了16个问题 |采纳率81.3%4FeS2+11O2==2Fe2O3+8SO2 质量减小
480 320 160
x 1-0.78
x=0.66
黄铁矿的纯度是0.66/1*100%=66%
是B.
注意:Fe在纯O2中点燃,得到Fe3O4.
铁在空气中不能燃烧,只能加热缓慢氧化,得到铁锈(Fe2O3)
在空气中灼烧含铁物质得到的是Fe2O31年前查看全部
- 当胆矾渗入地下,遇到黄铁矿(FeS2)时可生成辉铜矿(Cu2S),同时还升成FeSO4和H2SO4,反应中Cu离子与Fe
当胆矾渗入地下,遇到黄铁矿(FeS2)时可生成辉铜矿(Cu2S),同时还升成FeSO4和H2SO4,反应中Cu离子与FeS2的物质的量比是?
 hchott1年前2
hchott1年前2 -
 倦倚西风夜已昏 共回答了18个问题
倦倚西风夜已昏 共回答了18个问题 |采纳率94.4%反应中Cu2+与FeS2的物质的量之比是14∶5
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
由题给的信息可知:反应物有CuSO4?5H2O、FeS2、还有可能有H2O.生成物有中Cu2S,硫和铁的价态运用直接法可确定:排除了硫以-2,0,+4等价态进入水溶液的可能,只能以SO42-存在.1年前查看全部
- 把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是
把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是
A,33% B,66% C,78% D,88%
我需要详细的解法 hexinoo1年前1
hexinoo1年前1 -
 pzw4850 共回答了16个问题
pzw4850 共回答了16个问题 |采纳率93.8%4FeS2+11O2==2Fe2O3+8SO2 质量减小
480 320 160
x 1-0.78
x=0.66
黄铁矿的纯度是0.66/1*100%=66%
正确答案是B.1年前查看全部
- 现有磁铁矿 黄铁矿 赤铁矿 .请从多种角度分析三种矿石中哪种不适合同来炼铁---,原因是?
 mixib1年前2
mixib1年前2 -
 lechang531 共回答了25个问题
lechang531 共回答了25个问题 |采纳率92%黄铁矿是铁与硫的化合物,工业上用来制取硫酸,焙烧后的炉渣含有大量的铁,在拿来炼铁,赤铁矿与磁铁矿都是工业上炼铁的主要原料,黄铁矿因为含大量的硫,在焙烧前是绝对不能炼铁的,因为黄铁矿较易燃烧,只有经过焙烧,将其中的硫取代为氧后才能用来炼铁1年前查看全部
- 燃烧含FeS2 80%的黄铁矿制硫酸的利用率为90%,用75吨该黄铁矿制得硫酸铵79.2吨,则用黄铁矿制硫酸铵的损失率是
燃烧含FeS2 80%的黄铁矿制硫酸的利用率为90%,用75吨该黄铁矿制得硫酸铵79.2吨,则用黄铁矿制硫酸铵的损失率是多少,
 tianping_03081年前1
tianping_03081年前1 -
 raupe 共回答了20个问题
raupe 共回答了20个问题 |采纳率85%4FeS2 + 11O2 =△= 2Fe2O3 + 8SO2
m(FeS2)=75000000*0.8=60000000 g
n(FeS2)=60000000/120=500000 mol
n(SO2)=500000*2=1000000 mol
n(SO3理论上)=1000000 mol
n(H2SO4理论上)=1000000 mol
n(硫酸铵理论上)=1000000 mol
m(硫酸铵理论上)=1000000*132/1000000=132 t
损失硫酸铵质量=132-79.2=52.8 t
损失率=52.8/132=40%1年前查看全部
- FeS2是黄铁矿的主要成分,但FeS2中铁元素和硫元素各几价?
 adfsdsfadsfdasfa1年前2
adfsdsfadsfdasfa1年前2 -
 顺谁自然 共回答了16个问题
顺谁自然 共回答了16个问题 |采纳率75%铁是正二价的.
FeS2中硫是-1价1年前查看全部
- 用硫酸钡沉淀法测定黄铁矿中硫酸的含量时,称取试样0.2436g最后得到硫酸钡沉淀0.
用硫酸钡沉淀法测定黄铁矿中硫酸的含量时,称取试样0.2436g最后得到硫酸钡沉淀0.
128g计算试样中硫的质量分数. happyhxf1年前1
happyhxf1年前1 -
 kevinzhangfengls 共回答了20个问题
kevinzhangfengls 共回答了20个问题 |采纳率90%你确定题目没有表达错误?黄铁矿中硫酸的含量?!1年前查看全部
- 为什么黄铁矿在氧气中灼烧生成氧化铁而不是四氧化三铁
 提前还贷1年前1
提前还贷1年前1 -
 l82916 共回答了19个问题
l82916 共回答了19个问题 |采纳率78.9%因为是完全燃烧,将二价铁完全氧化成三价铁了.
而Fe3O4是Fe2O3·FeO.1年前查看全部
- ①盐酸②碳酸钠溶液③水银④黄铁矿⑤硫磺⑥碘酒 如何区分 分类标准;(1) ,共包括三种物质(2)
 踢风浪仔1年前2
踢风浪仔1年前2 -
 wanghuiaijjj 共回答了14个问题
wanghuiaijjj 共回答了14个问题 |采纳率78.6%溶液 ①盐酸②碳酸钠溶液⑥碘酒1年前查看全部
- ①盐酸②碳酸钠溶液③水银④黄铁矿⑤硫磺⑥碘酒 如何区分 分类标准;(1) ,共包括三种物质(2)
 dorissong1131年前3
dorissong1131年前3 -
 magnifico 共回答了15个问题
magnifico 共回答了15个问题 |采纳率86.7%(1)溶液
(2)①盐酸②碳酸钠溶液⑥碘酒1年前查看全部
- 化学中h2o2在黄铁矿的作用
 清风之翼1年前1
清风之翼1年前1 -
 sz12 共回答了15个问题
sz12 共回答了15个问题 |采纳率86.7%黄铁矿中FeS2.双氧水用于氧化硫生成硫的氧化物后溶于酸,有助于黄铁矿的溶解.1年前查看全部
- 某工厂生产硫酸,使用一种含杂质为25%的黄铁矿样品.知黄铁矿与氧气反应的化学方程式为FeS2+11O2=Fe2O3+8S
某工厂生产硫酸,使用一种含杂质为25%的黄铁矿样品.知黄铁矿与氧气反应的化学方程式为FeS2+11O2=Fe2O3+8So2.
若取一吨矿石,可制得98%的浓硫酸多少吨,假如生产过程硫的损失不记,求详解,若假设生产过程中硫损失2%呢?求详解 遗失的青春1年前1
遗失的青春1年前1 -
 朴洙秀 共回答了21个问题
朴洙秀 共回答了21个问题 |采纳率100%1吨该矿石含杂质为25%,则含75%的黄铁矿.1吨中有750kg黄铁矿.
4FeS2+11O22Fe2O3+8SO2
480 512
750kg x
列出式子,算得x=800kg
2SO2+O2+2H2O=2H2SO4
128 196
800 y
算得y=1225kg
1225÷98%=1250kg1年前查看全部
- 黄铁矿制二氧化硫反应是吸热还是放热
 西湖鱼鱼1年前1
西湖鱼鱼1年前1 -
 zy乐在其中 共回答了19个问题
zy乐在其中 共回答了19个问题 |采纳率84.2%可以利用热力学数据计算
4FeS2(s) + 11O2(g) = 2Fe2O3(s) + 8SO2(g)
△fHm,FeS2(g) = -177.9 kJ/mol
△fHm,O2(g) = 0
△fHm,Fe2O3(s) = -822.2 kJ/mol
△fHm,SO2(g) = -296.9 kJ/mol
反应的焓变△rHm = 8△fHm,SO2(g) + 2△fHm,Fe2O3(s) - 11△fHm,O2(g) - 4△fHm,FeS2(g)
= -3308.0 kJ/mol
△rHm < 0,说明反应放热,每摩尔FeS2参加反应时,放出的热量为3308.0/4 = 827.0 kJ.1年前查看全部
- 硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,将上述炉气经
硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,将上述炉气经净化除尘后直接送入接触室,气体体积减少了5%(同温同压下测定),试计算SO2的转化率
 端木秋1年前1
端木秋1年前1 -
 testing33333 共回答了18个问题
testing33333 共回答了18个问题 |采纳率94.4%解析:
相关反应方程式:
4FeS2 + 11O2 ―(高温煅烧)→ 2Fe2O3 + 8SO2
2SO2 + O2 =(400℃~500℃,V2O5)= 2SO3 (=表示可逆符号)
通入过量40%的空气,那么氧气也同样过量40%,
则氧气初始计量 = 11 * 1.4 = 15.4,反应掉11体积的O2,剩余4.4体积O2
反应前空气总量 = 15.4 / 0.2 = 77 体积
第一步反应:消耗11体积O2,生成8体积SO2,反应后气体总量 = 77 - 11 + 8 = 74体积
第二步反应:气体体积减少了5%
设反应掉的SO2 体积 为 x,反应掉的O2 体积 为 y,生成的SO3体积 为 z,则有:
2SO2 + O2 =(400℃~500℃,V2O5)= 2SO3 (=表示可逆符号)………… △V
2 1 2 (2+1-2)
x y z 5%
解得:x = 10%,y = 5%,z = 10%
则SO2转化率 = (74*10%)*100% / 8 = 92.5 %1年前查看全部
- 关于硫酸的制法的一些问题..1黄铁矿焙烧前要粉碎,解释是黄铁矿不能燃烧..为什么错?2沸腾炉出来的炉气必须净化,因为杂质
关于硫酸的制法的一些问题..
1黄铁矿焙烧前要粉碎,解释是黄铁矿不能燃烧..为什么错?
2沸腾炉出来的炉气必须净化,因为杂质会和SO2反应..为什么错?
3SO2氧化成SO3时需要使用催化剂,因为要提高SO2的转化率...为什么错? wwxtu241年前1
wwxtu241年前1 -
 heqing1980 共回答了17个问题
heqing1980 共回答了17个问题 |采纳率70.6%黄铁矿可以燃烧,粉碎是为了彻底完全燃烧;
杂质气体会使催化剂钝化;
催化剂不能提高转化率.1年前查看全部
- (2011•淄博二模)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,
(2011•淄博二模)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为sio2:约45%,fe2o3:约40%,al2o3:约10%,mgo:约5%.目前***已经在技术上取得突破--用硫酸渣炼铁.
i.某学生探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验(已知25℃氢氧化镁ksp=5.6×10-12;氢氧化铁ksp=3.5×10-38;一水合氨电离常数k=1.8×10-5,其饱和溶液中c(oh-)约为1×10-3mol•l-1).
方案一:
请回答:
(1)写出固体e的化学式:______.
(2)试剂①是______
a.氢氧化钠b.氧化铝c.氨水d.水
(3)若要准确测定溶液的ph是否达到3.7,下列物品中可供使用的是______
a.石蕊试液b.广泛ph试纸c.精密ph试纸d.ph计
(4)溶液h中溶质的化学式:______
(5)要将固体c、固体e和固体g都转化为相应的稳定的氧化物,需进行的实验操作为______.
(6)若不考虑溶液体积的变化,请计算溶液h中c(mg2+)=______.
方案二:
请回答:
(7)此方案的主要问题有:______
(8)写出由溶液m→固体乙这个过程中,最主要化学反应的离子方程式:______
ii.为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成fe2+,再用kmno4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5fe2++mno4-+8h+=5fe3++mn2++4h2o.
(1)判断到达滴定终点的现象是______.
(2)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol•l-1kmno4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00ml,则残留物中铁元素的质量分数是______. vscrash1年前1
vscrash1年前1 -
 sntge123 共回答了18个问题
sntge123 共回答了18个问题 |采纳率77.8%解题思路:I.根据硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸(过量);向溶液B中加试剂①并调节溶液的pH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的pH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝,
(1)固体E是氢氧化镁;
(2)试剂①是强碱溶液;
(3)根据pH值精确到小数点后一位;
(4)溶液F的溶质含有偏铝酸钠和氯化钠;
(5)根据难溶性碱加热分解;
(6)根据氢氧化镁Ksp=5.6×10-12来计算;
根据硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量氢氧化钠时,Fe2O3、MgO和氢氧化钠不反应,所以固体甲是Fe2O3、MgO,SiO2、Al2O3和氢氧化钠反应,所以溶液M的溶质是硅酸钠、偏铝酸钠、氢氧化钠(过量);向溶液M中通入过量二氧化碳气体,硅酸钠、偏铝酸钠、氢氧化钠都与二氧化碳反应,所以固体乙是硅酸、氢氧化铝,进行加热得到二氧化硅和氧化铝.
(7)根据产物和消耗的原料来分析;
(8)溶液主要含有硅酸钠;
II.(1)根据KMnO4标准溶液本身就是一种指示剂;
(2)利用关系式法计算和质量百分数的概念来分析.I.根据硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸(过量);向溶液B中加试剂①并调节溶液的pH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的pH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝,
(1)固体E是氢氧化镁,故答案为:Mg(OH)2;
(2)试剂①是强碱溶液,故选:A;
(3)因PH值精确到小数点后一位,而石蕊试液测得的PH值在一个范围内,广泛pH试纸测得的PH值是一个整数,精密pH试纸、pH计均可准确到小数点后一位,故选:CD;
(4)溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,故答案为:NaCl、NaHCO3;
(5)固体C是氢氧化铁,固体E是氢氧化镁,固体G是氢氧化铝,加热均可分解得到对应的氧化物,故答案为:灼烧;
(6)因溶液的PH值为13,C(OH-)=10-1mol•L-1,Ksp=C(Mg2+)×C2(OH-)=C(Mg2+)×10-2=5.6×10-12,所以C(Mg2+)=5.6×10-10 mol•L-1,故答案为:5.6×10-10 mol•L-1;
(7)①产品不纯,最后产物中大多数是二氧化硅;②步骤多试剂消耗题量大,故答案为:①产品不纯,最后产物中大多数是二氧化硅;②步骤多试剂消耗题量大;
(8)溶液主要含有硅酸钠,硅酸钠和二氧化碳反应生成硅酸沉淀和碳酸氢钠,方程式为:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO32-;
II.(1)因KMnO4标准溶液本身就是一种指示剂,故答案为:与滴下最后一滴KMnO4标准溶液时,溶液颜色变为紫红色,且在半分钟内不褪色;
(2)利用关系式法计算:
5Fe2+~MnO4-
2×10-3mol 1.000×10-2mol•L-1×0.01L×4
铁元素的质量为:2×10-3mol×56g/mol=1.12×10-1g,铁元素的质量分数为
1.12×10 −1g
2.000g×100%=5.6%,故答案为:5.6%.点评:
本题考点: 物质的分离、提纯的基本方法选择与应用;难溶电解质的溶解平衡及沉淀转化的本质;铁的氧化物和氢氧化物;中和滴定.
考点点评: 本题考查了物质的分离、提纯的方法选择及应用,实验方案设计和评价,题目难度较大,明确各物质的性质是解本题的关键,本题注意关系式法的利用.1年前查看全部
- 用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄
用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄铁矿可产生98%硫酸多少吨?
 心跳乱了节奏1年前4
心跳乱了节奏1年前4 -
 skchenglong 共回答了20个问题
skchenglong 共回答了20个问题 |采纳率95%就是计算最后进入硫酸的硫的重量,进而换算成硫酸就可以了,因为硫元素是守恒的.
1t FeS2含有FeS2 720kg,FeS2中硫元素的质量分数是64/(64+56)=0.5333,所以S元素的质量就是384kg ,损失1.5%那么还剩下384×0.985=378.24kg,在转换三氧化硫的时候转化率是97%,所以这时候能转化成SO3的S的重量就是378.24×0.97=367kg,好了,现在知道变成硫酸的硫元素的质量,进而计算三氧化硫转化的纯硫酸质量:(367/32)×98=1123kg,因为硫酸是98%,所以再除以0.98,得到硫酸重量是1146.54kg
实际上运用守恒是很简单的,我写得很复杂,因为要介绍思想,如果你很熟悉,可以一步写齐所有算式,这样其中数字运算的约分等等能让计算更加简单,元素守恒、质量守恒、电荷守恒、能量守恒等等的应用有时候会让人视野更加开阔,看问题更宏观全面,简化思考和计算过程,十分有用.无论是做题还是研究,这都是很重要的思想和思考方法.1年前查看全部
大家在问
- 1小数相邻两个单位之间的进率是什么?
- 2根据下图中的仪器和装置回答问题.
- 3“未填单价或总价的细目” 英语怎么翻译
- 4带举字的词语,表示说明,举出的意思
- 5用力踩脚踏板使自行车前进的问题后轮与地面间的摩擦力的方向朝前,是因为它的运动趋势朝后,为什么是朝后,后轮和前轮的运动趋势
- 6half an hour?half an hour、an hour and a half 、 one and a hal
- 7一篇不少于8句的英文自我介绍我现在是一个初一中学生,帮我写一篇,简单的就行,不要看不懂的,尽量快点,谢谢拉
- 8请帮我做下下面的英语题目翻译1.来自中国的问候 2.通过手机聊天 3.在春节前夕 4.对某人说 写出下列单词的相应形式1
- 9l'd like to( )this red dress for a blue one.(change)
- 101.在三角形ABC中,已知a=6,b=10,C=60°,求c 2.角C=90°且tan=三分之一,则cosB的值为
- 11一项工程,单独完成,甲要12天,乙要20天,甲乙工作效率的比是多少?
- 12分数[12/1],[12/2],[12/3],[12/4],…,[12/100]中有______个分数可以化为整数或有限
- 13春酒课后第三题 “独在异乡为异客,每日逢佳节倍思亲.”“露从今夜白,月是故乡明.”这些古诗名 句都表达了游子的思乡之情.
- 14将6.5g KClO3和MnO2的混合物装入大试管中,加热制氧气.待反应完毕后,冷却试管后称量,剩有4.58g
- 15英文翻译,不要网上直接翻译的我们现在不能确定这款产品是否能符合客户要求,我们正在跟我们的供应商确认,会尽快答复。

