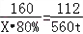赤铁矿的主要成分为Fe2O3 ,现有含80%的赤铁矿5000吨,经高温冶炼
 魔炎的火花2022-10-04 11:39:542条回答
魔炎的火花2022-10-04 11:39:542条回答赤铁矿的主要成分为Fe2O3 ,现有含80%的赤铁矿5000吨,经高温冶炼可炼出含杂质3.5%的生铁多少吨?【杂质不含铁元素】谢谢!

已提交,审核后显示!提交回复
共2条回复
 hmzjy 共回答了13个问题
hmzjy 共回答了13个问题 |采纳率92.3%- FE2O3+ 3CO= 3CO2+ 2FE
160 112
80%*5000T X=2800T
2800T+2800*3.5%T=2898T经高温冶炼可炼出含杂质3.5%的生铁2898吨 - 1年前
 潜水到永远 共回答了2254个问题
潜水到永远 共回答了2254个问题 |采纳率- 3CO+Fe2O3=高温=2Fe+3CO2
160 112
5000t*80% x*(1-3.5%)
160/112=5000t*80%/x*(1-3.5%)
x=2901.55t
所以含80%的赤铁矿5000吨,经高温冶炼可炼出含杂质3.5%的生铁2901.55吨. - 1年前
相关推荐
- 不属于赤铁矿冶铁过程中的主要反应的是 A.C+O 2 ══CO 2 B.CO 2 +C══2CO C.Fe 2 O 3
不属于赤铁矿冶铁过程中的主要反应的是
A.C+O 2 ══CO 2 B.CO 2 +C══2CO C.Fe 2 O 3 +3CO══2Fe + 3CO 2 D.Fe 3 O 4 +4CO══3Fe + 4CO 2  zhank1231年前1
zhank1231年前1 -
 戳卜 共回答了16个问题
戳卜 共回答了16个问题 |采纳率100%D
高炉炼铁的高炉中发生一系列化学变化,首先焦炭与空气中的氧气生成二氧化碳,然后生成的二氧化碳继续与焦炭反应生成气体还原剂一氧化碳,接下来一氧化碳还原氧化铁生成铁和二氧化碳,从而冶炼得到生铁.故选D1年前查看全部
- 赤铁矿(主要成分是Fe2O3)是冶炼生铁的主要原料.若测得某赤铁矿石中铁元素的质量分数为56%.(假设杂质不含铁元素)请
赤铁矿(主要成分是Fe2O3)是冶炼生铁的主要原料.若测得某赤铁矿石中铁元素的质量分数为56%.(假设杂质不含铁元素)请回答下列问题:
(1)氧化铁中铁元素与氧元素的质量比______.
(2)该矿石中氧化铁的质量分数为______.
(3)冶炼生铁的化学方程式为______. 巡逻一队1年前1
巡逻一队1年前1 -
 何休 共回答了19个问题
何休 共回答了19个问题 |采纳率84.2%解题思路:(1)Fe2O3中铁元素与氧元素的质量比为:(铁的相对原子质量×铁原子个数):(氧的相对原子质量×氧原子个数);
(2)该矿石中氧化铁的质量分数为:赤铁矿石中铁元素的质量分数÷氧化铁中铁元素的质量分数;
(3)生铁冶炼采用的是高温固态还原法,即在炉温提高到1150~1300℃的条件下把铁矿石(氧化铁)还原成铁.据此写出化学方程式.(1)氧化铁中铁元素与氧元素的质量比为:(56×2):(16×3)=7:3;
(2)该矿石中氧化铁的质量分数为:56%÷[56×2/160]=80%;
(3)生铁冶炼是把铁矿石(氧化铁)还原成铁,还原剂主要是CO,反应的化学方程式为:Fe2O3+3CO
高温
.
2Fe+3CO2.
故答案为:(1)7:3;(2)80%;(3)Fe2O3+3CO
高温
.
2Fe+3CO2.点评:
本题考点: 元素质量比的计算;一氧化碳还原氧化铁.
考点点评: 本题主要考查学生运用化学式进行计算的能力.同时要知道生铁冶炼采用的是高温固态还原法.1年前查看全部
- 某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96% 的生铁63 t ,假设在炼制过
某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96% 的生铁63 t ,假设在炼制过程中损失10% 铁元素,则理论上需要含杂质20% 的赤铁矿石的质量是 [ ]A. 120 t
B. 108 t
C. 96 t
D. 84 t HJY20021年前1
HJY20021年前1 -
 未激活276 共回答了22个问题
未激活276 共回答了22个问题 |采纳率90.9%A1年前查看全部
- 某炼铁企业以焦炭、赤铁矿等为主要原材料炼铁,反应过程如图:
某炼铁企业以焦炭、赤铁矿等为主要原材料炼铁,反应过程如图:

(1)过程①中发生的反应属于______反应(选填“化合”“分解”“置换”“复分解”之一),过程③是利用了一氧化碳的______(选填“氧化性”“还原性”之一).
(2)列举一例防止钢铁锈蚀的具体措施:______.
(3)试用化学方程式计算:该企业用1000t含氧化铁80%的赤铁矿可炼得金属铁多少吨? 游戏中的王者1年前1
游戏中的王者1年前1 -
 天空深蓝 共回答了15个问题
天空深蓝 共回答了15个问题 |采纳率93.3%解题思路:(1)根据反应物、生成物的数量和种类来分析;根据一氧化碳的性质来分析;
(2)根据钢铁锈蚀的条件来分析;
(3)由赤铁矿石的质量、氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出铁的质量即可.(1)过程①发生的是:焦炭在高温条件下能和氧气反应生成二氧化碳,符合“多变一”的特征,属于化合反应;过程③是:氧化铁在高温条件下能够一氧化碳反应生成铁和二氧化碳,此反应中体现了一氧化碳具有还原性;
(2)铁与氧气和水接触时容易生锈.要防止钢铁生锈,就要把钢铁与空气和水隔绝,如保持钢铁的表面洁净干燥,镀一层金属,涂一层油漆等;
(3)氧化铁的质量为:1000t×80%=800t
设理论上可以炼铁的质量为x.
Fe2O3+3CO
高温
.
2Fe+3CO2
160112
800t x
[160/112=
800t
x]
x=560t
答:可炼得金属铁的质量为560t.
故答案为:(1)化合;还原性;
(2)刷油漆、镀其他金属、表面涂油等合理均可;
(3)560t.点评:
本题考点: 铁的冶炼;含杂质物质的化学反应的有关计算;金属锈蚀的条件及其防护;反应类型的判定.
考点点评: 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.1年前查看全部
- 用化学方程式表示下列原理:(1)用氢氧化钠吸收二氧化硫:______;(2)工业上用赤铁矿(主要成分Fe2O3)来炼铁:
用化学方程式表示下列原理:
(1)用氢氧化钠吸收二氧化硫:______;
(2)工业上用赤铁矿(主要成分Fe2O3)来炼铁:3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3;
2Fe+3CO2高温 .
(3)含有形成化合物种类最多的一种元素组成最简单化合物燃烧的化学方程式:CH4+2O2
2H2O+CO2点燃 .CH4+2O2.
2H2O+CO2点燃 . shizxz1年前1
shizxz1年前1 -
 huidaozhan 共回答了13个问题
huidaozhan 共回答了13个问题 |采纳率76.9%解题思路:书写化学方程式的步骤一般有四步:
1.根据实验事实,在式子的左、右两边分别写出反应物和生成物的化学式,并在式子的左、右两边之间画一条短线;当反应物或生成物有多种时,中间用加号(即“+”)连接起来.
2.配平化学方程式,并检查后,将刚才画的短线改写成等号(表示式子左、右两边每一种元素原子的总数相等).
3.标明化学反应发生的条件(因为化学反应只有在一定的条件下才能发生);如点燃、加热(常用“△”号表示)、催化剂、通电等.并且,一般都写在等号的上面,若有两个条件,等号上面写一个下面写一个,等等.
4.注明生成物中气体或固体的状态符号(即“↑”、“↓”);一般标注在气体或固体生成物的化学式的右边.但是,如果反应物和生成物中都有气体或固体时,其状态符号就不用标注了.(1)二氧化硫可以和氢氧化钠反应生成亚硫酸钠和水,可以据此写出该反应的化学方程式为:SO2+2NaOH═Na2SO3+2H2O;
(2)工业上炼铁用一氧化碳作为还原剂,将铁还原出来,同时生成了二氧化碳,所以用赤铁矿炼铁的反应原理为:3CO+Fe2O3
高温
.
2Fe+3CO2;
(3)形成化合物种类最多的元素为碳元素,其组成的最简单的有机化合物为甲烷,其完全燃烧生成了二氧化碳和水,化学方程式为:CH4+2O2
点燃
.
2H2O+CO2.
故答案为:(1)SO2+2NaOH═Na2SO3+2H2O;
(2)3CO+Fe2O3
高温
.
2Fe+3CO2;
(3)CH4+2O2
点燃
.
2H2O+CO2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 要想解答好这类题目,首先,要理解和熟记书写化学方程式、文字表达式或电离方程式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.1年前查看全部
- 某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方
某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方程式Fe2O3+3CO
2Fe+3CO2)高温 . loki6131年前1
loki6131年前1 -
 46hf 共回答了22个问题
46hf 共回答了22个问题 |采纳率86.4%解题思路:这是一道一题多解的题目,可利用化学式计算也可利用化学方程式计算,但不管是哪种方式计算时先要把不纯的物质转化为纯净物计算,一般是混合物的质量乘以这种物质中纯净物的质量分数即为这种纯净物的质量.设需要含氧化铁80%的赤铁矿的质量为x
3CO+Fe2O3
高温
.
2Fe+3CO2
160112
x•80% 1120t•95%
x=[160•1120t•95%/112•80%]=1900t
答:需要含氧化铁80%的赤铁矿1900吨.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 此题是对含杂质物质的有关计算,问题的关键是首先解决纯净物与混合物的相互转化,利用混合物的质量乘以某种物质的质量分数即为这种纯净物质的质量,并结合化学式或化学方程式是解决这类题目的关键.1年前查看全部
- 请回答下列问题:(1)用CO高温下还原赤铁矿(主要成分为Fe2O3)的化学方程式为Fe2O3+3CO 高温 . 2Fe+
 请回答下列问题:
请回答下列问题:
(1)用CO高温下还原赤铁矿(主要成分为Fe2O3)的化学方程式为Fe2O3+3CO
2Fe+3CO2.Fe2O3+3CO高温 .
2Fe+3CO2.高温 .
(2)金属镁着火不能用CO2灭火,因为镁能在CO2中燃烧生成碳和氧化镁.该反应的化学方程式为2Mg+CO2
C+2MgO2Mg+CO2点燃 .
C+2MgO,反应基本类型是置换反应.置换反应..点燃 .
(3)用“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,则如图所示的化学方程式为2H2O2
”表示氧原子,则如图所示的化学方程式为2H2O2
2H2O+O2↑.2H2O2催化剂 .
2H2O+O2↑..催化剂 .  fjmax1年前1
fjmax1年前1 -
 没有道理了把 共回答了15个问题
没有道理了把 共回答了15个问题 |采纳率100%解题思路:根据反应物、生成物和反应条件及质量守恒定律的两个原则,写出正确的化学方程式.(1)一氧化碳还原氧化铁生成铁和二氧化碳,化学方程式为:Fe2O3+3CO
高温
.
2Fe+3CO2.
(2)镁在CO2中燃烧生成碳和氧化镁,化学方程式为2Mg+CO2
点燃
.
C+2MgO,反应物是单质和化合物,生成物是另一种单质和化合物,属于置换反应.
(3)由微观模型图可看出是双氧水分解生成水和氧气的过程,化学方程式为:2H2O2
催化剂
.
2H2O+O2↑.
故答案为:(1)Fe2O3+3CO
高温
.
2Fe+3CO2.
(2)2Mg+CO2
点燃
.
C+2MgO,置换反应.
(3)2H2O2
催化剂
.
2H2O+O2↑.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;微粒观点及模型图的应用;反应类型的判定.
考点点评: 书写化学方程式要注意根据题目要求,写出符合题目要求的化学方程式.1年前查看全部
- 某钢铁厂检验员为了检测赤铁矿中氧化铁的质量分数,取矿石样品20g,加入稀盐酸,完全反映后,共用去稀盐酸
某钢铁厂检验员为了检测赤铁矿中氧化铁的质量分数,取矿石样品20g,加入稀盐酸,完全反映后,共用去稀盐酸
共用去稀盐酸219g,过滤得到滤渣4g(假设杂质既不溶于水也不与酸发生反应).请你和检验员一起完成下列计算 昙之馨1年前1
昙之馨1年前1 -
 繁花过后 共回答了14个问题
繁花过后 共回答了14个问题 |采纳率92.9%要计算什么,盐酸的浓度?方程式是Fe2O3+6HCl=2FeCl3+H2O实际反映的氧化铁是20-4=16g带入方程式计算就行了1年前查看全部
- 用含Fe2o3 80%的赤铁矿石5000t炼铁,可得到多少t含杂质2%的生铁
用含Fe2o3 80%的赤铁矿石5000t炼铁,可得到多少t含杂质2%的生铁
下午3点半前! man9091年前1
man9091年前1 -
 我爱小想想 共回答了21个问题
我爱小想想 共回答了21个问题 |采纳率85.7%设可得到生铁X吨
Fe2O3+3CO=2Fe+3CO2
160 112
80%*5000 x X=2800t
2800/(1-2%)≈2857.1t
答:可得到含杂质2%的生铁约2857.1吨.1年前查看全部
- 样品中含铁元素56%,求该赤铁矿中Fe2O3的质量分数
样品中含铁元素56%,求该赤铁矿中Fe2O3的质量分数
测得某赤铁矿石(主要成份是Fe2O3)样品中含铁元素56%,求该赤铁矿中Fe2O3的含量.
好象是80%
急` i803871年前1
i803871年前1 -
 太一的梦想 共回答了14个问题
太一的梦想 共回答了14个问题 |采纳率85.7%设含有X%的FE2O3
由FE2O3的化学式可知,FE在一个FE2O3中的质量分数是:
2*56/2*56+3*16=70%
那么就列出方程:
0.7*X%=0.56
解得X=80
故质量分数为80%1年前查看全部
- 以赤铁矿为原料制取一氧化碳的方程式是什么
 xxxx1年前4
xxxx1年前4 -
 小野-开心 共回答了19个问题
小野-开心 共回答了19个问题 |采纳率84.2%3CO+Fe2O3=高温=2Fe+3CO2
不是制取一氧化碳,是和一氧化碳反应.1年前查看全部
- (4道)8小时内1 赤铁矿中铁元素的质量分数为56%,球赤铁矿中三氧化二铁(Fe2O3)的质量分数.2 某硝酸铵(NH4
(4道)8小时内
1 赤铁矿中铁元素的质量分数为56%,球赤铁矿中三氧化二铁(Fe2O3)的质量分数.
2 某硝酸铵(NH4NO3)中样品中含氮元素质量分数为30%,求样品中硝酸铵的质量.
3 硫酸铜溶于水得到硫酸铜溶液,某硫酸铜溶液中Cu%=32%,求CuSO4%,H2O%
4 Fe(OH)2和Fe(OH)3的混合物中,已知O%=a%,求Fe% 天地会陈近南1年前1
天地会陈近南1年前1 -
 asia001 共回答了18个问题
asia001 共回答了18个问题 |采纳率77.8%1、Fe2O3中铁含量是70%,所以赤铁矿中Fe2O3的含量是:56%/70%=80%2、NH4NO3中N的含量是35%,所以……是:30%/35%=85.7%3、CuSO4中含铜量40%,同样求出CuSO4%=80%,所以H2O%=20%4、由于O和H的个数比都是1:1,则质量比就是...1年前查看全部
- 要练出所含杂质的质量分数为2.5%的生铁500t,至少需要多少吨质量分数为80%三氧化二铁的赤铁矿石?
 xiaolali1年前1
xiaolali1年前1 -
 hegui 共回答了22个问题
hegui 共回答了22个问题 |采纳率72.7%所含杂质的质量分数为2.5%的生铁500t中铁的质量=500t * (1-2.5%)=487.5t
三氧化二铁中铁的质量分数=(56*2)/(56*2+16*3) * 100%=70%
设所需要的赤铁矿石的质量为X,则有:
X * 80% * 70%=487.5t
X=870.5t
答:所需要的赤铁矿石的质量为870.5t1年前查看全部
- (2010•徐汇区一模)钢铁是重要的金属材料,在生产、生活中有广泛的用途.炼铁厂常以焦炭、赤铁矿(主要成分是Fe2O3)
(2010•徐汇区一模)钢铁是重要的金属材料,在生产、生活中有广泛的用途.炼铁厂常以焦炭、赤铁矿(主要成分是Fe2O3)、空气等为主要原料炼铁,反应过程如图:

请回答:
(1)赤铁矿主要成分Fe2O3中铁元素的化合价是______
(2)第②步的化学反应基本类型属于______;
(3)第③步反应的化学方程式:3CO+Fe2O3
3CO2+2Fe高温 .3CO+Fe2O3,其中属于还原剂的物质是______.
3CO2+2Fe高温 . cher_aquarius1年前1
cher_aquarius1年前1 -
 sichuanguangqing 共回答了26个问题
sichuanguangqing 共回答了26个问题 |采纳率88.5%解题思路:(1)化合物中各元素的化合价代数和为零,根据这一原则,可由氧化铁中氧元素的化合价计算铁元素的化合价;
(2)化合反应是指两种或两种以上物质反应生成一种物质的化学变化,该变化的特点可总结为“多变一”;
(3)还原剂是指反应中夺取其它物质中的氧元素的物质.(1)设Fe2O3中铁元素的化合价为x,则x×2+(-2)×3=0,解得x=+3
故答案为:+3;
(2)焦炭在高温条件下与二氧化碳反应生成一氧化碳,该反应符合“多变一”的化合反应的特点,该反应属于化合反应;
故答案为:化合反应;
(3)高温条件下,一氧化碳还原氧化铁生成铁和二氧化碳;该反应中一氧化碳夺取氧化铁中的氧,为该反应中的还原剂;
故答案为:3CO+Fe2O3
高温
.
3CO2+2Fe;CO.点评:
本题考点: 铁的冶炼;一氧化碳还原氧化铁;有关元素化合价的计算;反应类型的判定;还原反应;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学变化的基本类型有四种:化合反应,两种或以上物质生成一种物质的反应;分解反应,一种物质生成两种或以上物质的反应;置换反应,单质与化合物生成单质与化合物的反应;复分解反应,两种化合物相互交换成分生成两种新的化合物的反应.1年前查看全部
- 用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
 902aa1年前1
902aa1年前1 -
 真正的神仙 共回答了24个问题
真正的神仙 共回答了24个问题 |采纳率79.2%解题思路:由赤铁矿石的质量、氧化铁的质量分数、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.设理论上可以炼出含铁96%的生铁的质量为x.
Fe2O3+3CO
高温
.
2Fe+3CO2
160112
1000t×80%96%x
[160/112=
1000t×80%
96%x] x=583t
答:理论上可以炼出含铁96%的生铁的质量为583t.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.1年前查看全部
- 2000吨含氧化铁80%的赤铁矿炼得的生铁中含铁多少吨
2000吨含氧化铁80%的赤铁矿炼得的生铁中含铁多少吨
根据化学方程式计算步骤 twtwfnxuwei1年前4
twtwfnxuwei1年前4 -
 小虫冲哦 共回答了24个问题
小虫冲哦 共回答了24个问题 |采纳率79.2%含氧化铁质量为 2000t*80%=1600t设炼得的生铁中含铁的质量为 xFe2O3 + 3CO =高温= 2Fe + 3CO2
160 112
1600t X
160/1600t=112/X
X=1120t
炼得的生铁中含铁1120吨1年前查看全部
- 某铁厂用含氧化铁【FE2O3]80%的是铁矿是炼铁,若要练出120吨的铁,需要该赤铁矿石多少吨?
 bettyzqp1年前1
bettyzqp1年前1 -
 jjlcao 共回答了17个问题
jjlcao 共回答了17个问题 |采纳率94.1%设,需要该赤铁矿石x吨
Fe2O3+3CO ===加热====2Fe+3CO2
160 112
80%x 120T
160/112=80%x/120T
x=214.3T
需要该赤铁矿石214.3吨1年前查看全部
- 现有一批赤铁矿石(主要成分Fe2O3)100t.为测定该矿石中Fe2O3的含量,取样品粉末10g,加入7.3%的稀盐酸(
现有一批赤铁矿石(主要成分Fe2O3)100t.为测定该矿石中Fe2O3的含量,取样品粉末10g,加入7.3%的稀盐酸(矿石中的其它成分不与稀盐酸反应),当当加入150g时恰好完全反映.试计算:(1)10g样品中含多少克Fe2O3?(2)该铁矿石中Fe2O3的质量分数.(3)这样的铁矿石100t可炼出含铁96%的生铁的质量多少
 黑夜里1年前1
黑夜里1年前1 -
 独孤_无情 共回答了18个问题
独孤_无情 共回答了18个问题 |采纳率83.3%Fe2O3+6HCl=2FeCl3+3H2O
160 219
X 150*7.3%
X=8克------(1)
8/10=80%----(2)
100t*80%*70%/96%=58.33t------(3) 注:70%是Fe2O3中铁的质量分数.1年前查看全部
- .某赤铁矿石2000t,可炼出铁1050t,求该赤铁矿石中氧化铁的质量分数.
 jacob_junbo1年前1
jacob_junbo1年前1 -
 我是周穆王 共回答了20个问题
我是周穆王 共回答了20个问题 |采纳率85%氧化铁的分子式为Fe3O2,其中铁的质量分数为112/160=0.7,故1050t赤铁矿石中氧化铁的质量为1050/0.7=1500t,所以氧化铁的质量分数为1500/2000×100%=75%1年前查看全部
- 要炼112t铁,需含氧化铁80%的赤铁矿石多少吨
 臭美丑小鸭1年前2
臭美丑小鸭1年前2 -
 雨天之恋 共回答了21个问题
雨天之恋 共回答了21个问题 |采纳率90.5%设:需要x吨
2Fe~Fe2O3
112 160
112 x×80%
x=200
答:需要200吨赤铁矿
不明白欢迎来求助!
多谢了!1年前查看全部
- 某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液.为防止直接排放造成
某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液.为防止直接排放造成环境污染,对其进行了处理,过滤该残液,取100g 滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得
实验数据如下表:
加入氢氧化钠溶液的总质量/g 20 40 60 80 ...160 180
生成沉淀的质量/g 0 0 0.89 1.78 ...5.35 5.35
1.通过对上述数据的分析,该滤液中含有的溶质是?(写化学式)
2.选择合理的数据,计算100g溶液中溶质的质量(若有多种溶质,任选一种,结果精确到0.01g) 换邮箱啦aq1年前1
换邮箱啦aq1年前1 -
 qiuhe7109 共回答了21个问题
qiuhe7109 共回答了21个问题 |采纳率100%分析:由刚开始加入氢氧化钠溶液没有沉淀,可知残液含有未反应的盐酸.
后有沉淀产生、又结合残液的颜色为黄色,可判断残液含有FeCl3.
1: 该滤液中含有的溶质是:HCl和FeCl3(三氯化铁)两种.
题上已知 用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),
可判断反应生成的沉淀只有一种、即为Fe(OH)3,选择计算它较容易.
Fe(OH)3的物质的量为:5.35g/(56+17*3)g/mol
则由铁守恒可知 FeCl3的物质的量等于 Fe(OH)3的物质的量
FeCl3的质量等于: {5.35g/(56+17*3)g/mol}*(56+35.5*3)g/mol
=8.125g1年前查看全部
- 求质量分数和质量,望伸出园手.海南石碌铁矿探明铁矿石储量3.75亿t,铁矿石矿物主要为赤铁矿(主要成分是Fe2O3),局
求质量分数和质量,望伸出园手.
海南石碌铁矿探明铁矿石储量3.75亿t,铁矿石矿物主要为赤铁矿(主要成分是Fe2O3),局部见菱铁矿、黄铁矿、磁黄铁矿.
工业上用一氧化碳还原赤铁矿的化学方程式3CO+Fe2O3=2Fe+3O2 .
若某实验室用此铁矿石4.00g样品放入玻璃管中,在高温条件下用CO充分还原后冷却,称得残余固体的质量为3.04g 求:
1.生成铁的质量
2.赤铁矿里含有的Fe2O3质量分数
请大家帮个忙 sdytwsw1年前1
sdytwsw1年前1 -
 快要老的老头 共回答了21个问题
快要老的老头 共回答了21个问题 |采纳率90.5%2.24.
用差量法计算,得生成铁2.24
3CO+Fe2O3=2Fe+3CO2 差值
2* 56 16*3
X 4-3.04
解得X=2.24
质量分数为80%1年前查看全部
- 几道化学计算题1.某炼铁厂日产含碳3%的生铁310t,问该厂每天至少需要含氧化铁80%的赤铁矿石多少吨?2.在实验室用一
几道化学计算题
1.某炼铁厂日产含碳3%的生铁310t,问该厂每天至少需要含氧化铁80%的赤铁矿石多少吨?
2.在实验室用一氧化碳还原2.0g赤铁矿样品,反应后生成的二氧化碳跟足量的澄清石灰水反应,生成了3.0g白色沉淀.求赤铁矿样品中Fe2O3的质量分数
3.某铜矿石(主要成分CuFeS2)中含硫元素29.75%.求该矿石中铜元素的质量分数
4.某硝酸铵样品中NH4NO3的纯度为90%,求此样品中氮元素的质量分数 luckyjack61年前1
luckyjack61年前1 -
 282549526 共回答了14个问题
282549526 共回答了14个问题 |采纳率100%【答】:
1).
首先为您提供一组数据:
原子量:C 12 Fe 56 O 16
分子量:氧化铁 160
附加信息:氧化铁即三氧化二铁(Fe2O3)
生铁中含纯铁质量:310t*(1-3%)=300.7t
一个三氧化二铁分子中有两个Fe原子.设氧化铁的质量为Xt,那麽可以得出方程:
2Fe Fe2O3
2*56 160
300.7t X
解得:X=430t
所以赤铁矿的质量为:430t/80% = 【537.5t】
另外,这道题还可利用物质的量的方法计算,也很简单.
2).
设氧化铁质量为X ,CO2质量为y
CO2 + Ca(OH)2 = CaCO3 + H2O
44.100
y.3.0
y = 1.32g
3CO+Fe2O3==(高温)2Fe+3CO2
.160.132
.X.1.32g
X = 1.6g
Fe2O3质量分数=1.6g/2.0g*100% = 【80%】
答:略.
3).
w(S) = 2*32 / (64+56+32*2) = 34.78%
铜矿石的纯度为:29.75/34.78 = 85.54%
w(Cu) = [64 / (64+56+32*2)]*85.54% = 29.85%
注:CuFeS2中Cu的式量为64,2个S的式量也是64.所以【硫和铜元素的质量分数相等.】
4).
设样品中氮元素的质量分数为y
纯硝酸铵中氮元素的质量分数为x
NH4NO3~N*2
80.28
x=28/80*100%=35%
∵样品中硝酸铵的质量分数为90%
∴y = 90%*x = 35%*90% = 【31.5%】
答:样品中氮元素的质量分数为31.5%.1年前查看全部
- 若炼制1000t百分之93.3纯度的铁,至少需要含氧化铁80百分之的赤铁矿多少吨
 一片风景1年前1
一片风景1年前1 -
 森林里的画展 共回答了19个问题
森林里的画展 共回答了19个问题 |采纳率84.2%FE2O3+3co=3co2+ 2fe
160 112
X=1332.85T 1000T*93.3%=933T
1332.85T/80%=1666.1T1年前查看全部
- 实验室里用一氧化碳还原赤铁矿.取样4G将反应后的二氧化碳跟足量的石灰水起反应.生成白色沉淀6G.求该赤铁矿中FE2O3的
实验室里用一氧化碳还原赤铁矿.取样4G将反应后的二氧化碳跟足量的石灰水起反应.生成白色沉淀6G.求该赤铁矿中FE2O3的质量分数
 歌特熊1年前1
歌特熊1年前1 -
 like2002vip 共回答了21个问题
like2002vip 共回答了21个问题 |采纳率95.2%CO2+Ca(OH)2==CaCO3+H2O
44-------------100
x--------------6
x=2.64g
3CO+Fe2O3==2Fe+3CO2
----160---------132
-----y----------2.64
y=3.2
该赤铁矿中FE2O3的质量分数:3.2/4==80%1年前查看全部
- (2014•道外区三模)某炼钢厂日产含杂质4%的生铁700吨,试计算该炼钢厂每天需含氧化铁质量分数为80%的赤铁矿石多少
(2014•道外区三模)某炼钢厂日产含杂质4%的生铁700吨,试计算该炼钢厂每天需含氧化铁质量分数为80%的赤铁矿石多少吨( )
A.1200
B.2400
C.50
D.1160 mild_wind1年前1
mild_wind1年前1 -
 神归尔克 共回答了20个问题
神归尔克 共回答了20个问题 |采纳率90%解题思路:由生铁的质量、杂质的质量分数、赤铁矿石中氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出需含氧化铁质量分数为80%的赤铁矿石的质量.设需含氧化铁质量分数为80%的赤铁矿石的质量为x.
Fe2O3+3CO
高温
.
2Fe+3CO2
160112
80%x 700×(1-4%)
[160/112=
80%x
700×(1−4%) ] x=1200t
故选:A.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.1年前查看全部
- 某赤铁矿样品120克,经测定含铁元素4907克,求该赤铁矿样品中氧化铁(Fe2O3)的质量分数?
某赤铁矿样品120克,经测定含铁元素4907克,求该赤铁矿样品中氧化铁(Fe2O3)的质量分数?
是49.7克 virus0071年前1
virus0071年前1 -
 leleda 共回答了24个问题
leleda 共回答了24个问题 |采纳率91.7%相对原子质量 Fe 56 , O 16 , Fe2O3 160
由题知 Fe2O3的质量=49.7/112*160=71克
则 Fe2O3的质量分数=71/120=59.2%1年前查看全部
- 钢铁工业是国家工业的基础.铁矿石的冶炼是一个复杂的过程,其中赤铁矿冶炼的主要反应原理是:Fe 2 O 3 +3CO 2F
钢铁工业是国家工业的基础.铁矿石的冶炼是一个复杂的过程,其中赤铁矿冶炼的主要反应原理是:Fe 2 O 3 +3CO  2Fe+3CO 2 .某钢铁厂现要冶炼560吨的铁,理论上需要含氧化铁80%的赤铁矿多少吨?
2Fe+3CO 2 .某钢铁厂现要冶炼560吨的铁,理论上需要含氧化铁80%的赤铁矿多少吨? zjessie1年前1
zjessie1年前1 -
 css_205 共回答了28个问题
css_205 共回答了28个问题 |采纳率96.4%1年前查看全部
- 某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理.
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理.
实验时,应先点燃第2个酒精灯. 为什么要先点燃第二个?
 miniliony1年前1
miniliony1年前1 -
 liuqqing 共回答了18个问题
liuqqing 共回答了18个问题 |采纳率94.4%两个酒精灯是不是火力不一样,第二个火力猛点
氧化铁还原顺序:三氧化二铁---四氧化三铁--氧化亚铁---铁;
注意,以570度为分界,小于570度就直接还原到氧化亚铁(实际上是浮氏体)1年前查看全部
- 19G赤铁矿样品经试验测得,其中含有氧化铁9G,则该矿石中铁的质量分数是
 jj36682971年前1
jj36682971年前1 -
 贾伯 共回答了12个问题
贾伯 共回答了12个问题 |采纳率91.7%先求Fe元素的质量 9x 112/160=6.3g
因此矿石中Fe的质量分数为 6.3/19 x100%=33.2%1年前查看全部
- 大哥大,大姐大,请进!求含有Fe3O380%的赤铁矿中铁元素的质量分数.化学式Fe【小写2】O【小写3 】 80% 【谢
大哥大,大姐大,请进!
求含有Fe3O380%的赤铁矿中铁元素的质量分数.
化学式Fe【小写2】O【小写3 】 80% 【谢谢你们,但是我还有1题求助你们,我会加分的】【最后一题】有200千克含Fe3O4 70%的磁铁矿,①纯净的Fe3O4中铁的质量分数为( )②含Fe3O4 70%的磁铁矿石中铁的质量分数为 ( )③200千克含有Fe3O4 70%的磁铁矿石中含铁( )千克. 小老头家的小丫头1年前1
小老头家的小丫头1年前1 -
 大量2008 共回答了23个问题
大量2008 共回答了23个问题 |采纳率65.2%是Fe2O3吧?
Fe2O3中铁的质量分数为70%,赤铁矿中为70%×80%=56%1年前查看全部
- 某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe 2 O 3 )炼铁的主要反应原理.他们设计的实验装置,
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe 2 O 3 )炼铁的主要反应原理.他们设计的实验装置,如图:
回答下列问题:
(1)写出用一氧化碳还原氧化铁的化学方程式______;
(2)实验时,在澄清的石灰水中观察到的现象是______,发生反应的化学方程式为______;
(3)图中,设计第②个酒精灯的目的是______.实验时应先点燃第______个酒精灯.
 qsn5201年前1
qsn5201年前1 -
 小妖的ss 共回答了20个问题
小妖的ss 共回答了20个问题 |采纳率85%(1)一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe 2 O 3
高温
.
2Fe+3CO 2 .
(2)生成的二氧化碳能与澄清石灰水反应生成碳酸钙沉淀和水,故可以观察到澄清石灰水变浑浊,反应的化学方程式为:CO 2 +Ca(OH) 2 ═CaCO 3 ↓+H 2 O.
(3)一氧化碳有毒,排放到空气中会污染空气,一氧化碳与氧气在点燃条件下反应生成二氧化碳,故设计第②个酒精灯可防止未反应的一氧化碳排放到空气中污染空气.
因为要先通一氧化碳排净玻璃管内的空气,而一氧化碳有毒不能排放到空气中去,所以要先点燃第②个酒精灯.
故答案为:(1)3CO+Fe 2 O 3
高温
.
2Fe+3CO 2 ;(2)澄清石灰水变浑浊;CO 2 +Ca(OH) 2 ═CaCO 3 ↓+H 2 O;(3)除去尾气中的CO,防止污染空气;②.1年前查看全部
- 为了计算某赤铁矿中Fe2O3的质量分数,同学取赤铁样品10g,与足量一氧化碳反应,反应后固体的质量为7.6g.
为了计算某赤铁矿中Fe2O3的质量分数,同学取赤铁样品10g,与足量一氧化碳反应,反应后固体的质量为7.6g.
问:1.该赤铁矿中Fe2O3的质量
2.该赤铁矿中Fe2O3的质量分数 要化学方程式 jane11301年前1
jane11301年前1 -
 小妖926 共回答了20个问题
小妖926 共回答了20个问题 |采纳率85%(1)设赤铁矿样品中Fe2O3质量为x克
与足量一氧化碳反应
说明Fe2O3完全反应
根据差量法计算
减少质量为2.4g
Fe2O3+3CO=2Fe+3CO2 减少量
160 48
x 2.4
计算可知
x=8克
该赤铁矿中Fe2O3的质量为8g
(2)该赤铁矿中Fe2O3的质量分数为8/10=80%1年前查看全部
- (2010•玄武区一模)炉甘石、金刚石、赤铁矿是三种矿石,请你依照示例填空.(物质类别填“单质”、“氧化物”、“酸”、“
(2010•玄武区一模)炉甘石、金刚石、赤铁矿是三种矿石,请你依照示例填空.(物质类别填“单质”、“氧化物”、“酸”、“碱”或“盐”)
示例:金刚石主要成分--碳--C--单质
炉甘石主要成分--______--ZnCO3--______
赤铁矿主要成分---氧化铁-______--______ 为欣赏你们而来1年前1
为欣赏你们而来1年前1 -
 sorme 共回答了20个问题
sorme 共回答了20个问题 |采纳率90%解题思路:弄清单质、化合物、酸、碱、盐的概念,即物质的命名.ZnCO3有金属离子和酸根离子构成,因此属于盐类物质,而氧化铁中应是+3价的铁的化合物,为Fe2O3,由铁元素和氧元素两种元素组成,故为氧化物.
故答案为:碳酸锌,盐;Fe2O3,氧化物.点评:
本题考点: 物质的简单分类;常见的氧化物、酸、碱和盐的判别;化学式的书写及意义.
考点点评: 主要考查了纯净物的分类及物质的命名,培养学生应用知识的能力.1年前查看全部
- 铁在生产生活中应用十分广泛.(1)工业上常用赤铁矿(主要成分是Fe 2 O 3 )和一氧化碳在高温下炼铁,其反应的化学方
铁在生产生活中应用十分广泛.
(1)工业上常用赤铁矿(主要成分是Fe 2 O 3 )和一氧化碳在高温下炼铁,其反应的化学方程式为______.
(2)下列铁制品在使用时,主要利用金属具有良好导热性的是______ (填标号).
A.铁锤B.铁丝C.铁锅
(3)如图实验中,洁净无锈的铁钉在______ (填标号)情况下最容易生锈.写出防止铁制品生锈的l条措施:______
(4)某麦片里添加了一种极细的铁粉,食用后在胃酸(含HCl)作用下可被人体吸收.写出铁与胃酸反应的化学方程式:______.
 wyp08051年前1
wyp08051年前1 -
 cc比段nn多 共回答了14个问题
cc比段nn多 共回答了14个问题 |采纳率92.9%解;(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe 2 O 3
高温
.
2Fe+3CO 2 ;
(2)铁锤是利用铁的硬度大的性质;铁丝是利用延展性;铁锅是利用导热性;
(3)为了防止钢铁的锈蚀,人们常采用在其表面刷油漆或镀上其他金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水;
(4))铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl═FeCl 2 +H 2 ↑.
故答案为:(1)3CO+Fe 2 O 3
高温
.
2Fe+3CO 2
(2)C;(3)B涂上一层油漆(其他合理答案);(4)Fe+2HCl═FeCl 2 +H 2 ↑.1年前查看全部
- 某钢铁厂每天需消耗5000t含Fe2O3 76%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁的质量是多少?
 段绪文1年前1
段绪文1年前1 -
 百脉剑侠 共回答了25个问题
百脉剑侠 共回答了25个问题 |采纳率88%2Fe2O3 = 4Fe+ 3O2 5000t矿石中76%的Fe2O3自然就是5000*76%t了.设可制铁x吨.根据守衡规律:分子质量 2*160————4*56 则质量 5000*76%——--x*98% 上述数据关系为2*160*x*98%=5000*76%*4*56( 交叉相乘即相等) 故x=2714.291年前查看全部
- 炼200吨含杂质3%的生铁,需要含85%氧化铁的赤铁矿石多少吨?
 他可他可1年前2
他可他可1年前2 -
 XiaoWawayu 共回答了23个问题
XiaoWawayu 共回答了23个问题 |采纳率91.3%解题思路:由生铁的质量、杂质的质量分数、赤铁矿石中氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出需要赤铁矿石的质量.设需要含85%氧化铁的赤铁矿石的质量为x.
Fe2O3+3CO
高温
.
2Fe+3CO2
160112
85%x 200t×(1-3%)
[160/112=
85%x
200t×(1−3%)] x≈326.1t
答:需要含85%氧化铁的赤铁矿石的质量为326.1t.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.1年前查看全部
- 赤铁矿的主要成分是Fe2O3,通过冶炼可以把其中的铁元素转化为铁单质.
赤铁矿的主要成分是Fe2O3,通过冶炼可以把其中的铁元素转化为铁单质.
(1)炼铁的过程属于-----(填“物理”或“化学”)变化.
(2)某地开采的赤铁矿中氧化铁的质量分数为80%(假设其它成分中不含铁元素)冶炼过程中铁元素的利用率为90%.要生产1000吨铁,需要这种铁矿石多少吨? 中场小贝隆1年前1
中场小贝隆1年前1 -
 LY-cyd 共回答了15个问题
LY-cyd 共回答了15个问题 |采纳率93.3%(1)是化学变化.
(2)需要1984.13吨.设需要x吨.则x*0.8*0.9*(56*2)/(56*2+16*3)=1000,得x=1984.131年前查看全部
- 化学兴趣小组的同学在实验室测定某赤铁矿石中氧化铁的质量分数。取赤铁矿石样品10.0 g,加入稀盐酸109.5 g,恰好完
化学兴趣小组的同学在实验室测定某赤铁矿石中氧化铁的质量分数。取赤铁矿石样品10.0 g,加入稀盐酸109.5 g,恰好完全反应。过滤得到滤渣2.0 g(假设杂质既不溶于水也不与酸发生反应)。请计算:
(1)赤铁矿石中氧化铁的质量分数;
(2)反应后所得溶液中溶质的质量分数。
(计算结果精确到0.1%,写出必要的计算过程。可能用到得相对原子质量:H—1,C—12,O—16,Cl—35.5, Fe—56) Rubyswtgrl1年前1
Rubyswtgrl1年前1 -
 yoyo198210 共回答了24个问题
yoyo198210 共回答了24个问题 |采纳率83.3%(1)赤铁矿石中氧化铁的质量分数 =" (10.0g-2.0g)/10.0g" ×100% = 80.0%(1分)
(2)设反应后溶液中溶质的质量为x。
Fe 2 O 3 + 6HCl ="2" FeCl 3 + 3H 2 O(2分)
160 2×162.5
8.0g x (1分)
160/8.0g=2×162.5/x
x = 16.25 g (1分)
溶液中溶质的质量分数=16.25 g/(109.5 g + 8.0g)×100% =13.8 %(1分)
答略。
(其它合理答案参考给分)
(1)赤铁矿石中氧化铁的质量分数=
10.0g-2.0g
10.0g
×100%=80.0%
(2)设反应后溶液中溶质的质量为x
Fe 2 O 3 +6HCl=2FeCl 3 +3H 2 O
1602×162.5
8.0g x
160
8.0g
=
2×162.5
x
x="16.25" g
(2)反应后所得溶液中溶质的质量分数为:
16.25 g
109.5 g+8.0g
×100%=13.8%
答:(1)赤铁矿石中氧化铁的质量分数为80.0%;
(2)反应后所得溶液中溶质的质量分数为13.8%.1年前查看全部
- 注意:以下都用化学式表示!①:最常见的溶剂②:菱铁矿的主要成分:③:赤铁矿的主要成分:④:磁铁矿的主要成分:⑤:铁锈的主
注意:以下都用化学式表示!
①:最常见的溶剂
②:菱铁矿的主要成分:
③:赤铁矿的主要成分:
④:磁铁矿的主要成分:
⑤:铁锈的主要成分: 泪小叶QMM1年前5
泪小叶QMM1年前5 -
 kasnet 共回答了7个问题
kasnet 共回答了7个问题 |采纳率100%①:最常见的溶剂 H2O
②:菱铁矿的主要成分:FeCO3
③:赤铁矿的主要成分:Fe2O3
④:磁铁矿的主要成分:Fe3O4
⑤:铁锈的主要成分 Fe2O31年前查看全部
- 测定某赤铁矿中氧化铁的质量分数.假设赤铁矿中氧化铁全部还原为铁,杂质不参与反应,现记录如下:(玻璃管质量为65.6克)玻
测定某赤铁矿中氧化铁的质量分数.假设赤铁矿中氧化铁全部还原为铁,杂质不参与反应,现记录如下:(玻璃管质量为65.6克)玻璃管(包括样品)实验前85.6克 试验后80.8克,洗气管(包括药品)实验前156.8克,试验后170.0克
问:(1)赤铁矿中氧化铁质量分数
(2)实验结束后,玻璃管中剩余粉末里铁的质量分数(杂质中不含其它可被还原的氧化物) fm123boy1年前1
fm123boy1年前1 -
 风一样走过 共回答了16个问题
风一样走过 共回答了16个问题 |采纳率87.5%玻璃管总质量,反应前85.6-反应后80.8=4.8克
这减少的4.8克为Fe2O3中氧元素的质量.
Fe2O3 3O
160 48
4.8
所以反应前混合物中,含有Fe2O3 16克
而反应前混合物的总质量=85.6-65.6=20克
(1)所以赤铁矿中Fe2O3的质量分数为16÷20×100%=80%
(2)反应后,玻璃管中剩余的物质总质量为80.8-65.6=15.2克
反应后,Fe的质量=112÷160×16克=11.2克
所以反应后玻璃管中剩余铁粉的质量分数=11.2克÷15.2克×100%≈73.68%1年前查看全部
- 现有200t含氧化铁80%的赤铁矿,则用这批原料进行炼铁,可以练出纯度为97%的生铁多少
 y2kksam1年前1
y2kksam1年前1 -
 aileen_cn2004 共回答了14个问题
aileen_cn2004 共回答了14个问题 |采纳率92.9%3CO+ Fe2O3 =高温= 2Fe + 3CO2
160 112
200*80% 97%x
160:112=200*80%:97%x
10:7=160:97%x
97%x=112
x=115.51年前查看全部
- 赤铁矿为原料练铁的化学反应原理(用化学方程式表示)
 syg7894561年前1
syg7894561年前1 -
 yehaomei 共回答了14个问题
yehaomei 共回答了14个问题 |采纳率100%Fe2O3+3CO=2Fe+3CO21年前查看全部
- 下列有关金属和金属材料的认识中,不正确的是( ) A.生铁和钢的性能相同 B.赤铁矿的主要成分是氧化铁 C.回收废旧金
下列有关金属和金属材料的认识中,不正确的是( ) A.生铁和钢的性能相同 B.赤铁矿的主要成分是氧化铁 C.回收废旧金属有利于节约资源 D.铁粉做“双吸剂”和铁生锈原理相同  未激活6261年前1
未激活6261年前1 -
 流光璀璨 共回答了15个问题
流光璀璨 共回答了15个问题 |采纳率93.3%A、生铁硬而脆易断,钢较硬有良好的延性、展性和弹性.故选项错误;
B、赤铁矿的主要成分是氧化铁;故选项正确;
C、废旧金属的回收有利于节约资源;故选项正确;
D、铁生锈的原理,是在氧气和水的共同作用下发生的;“双吸剂”就是吸收氧气和水;故选项正确;
故选A.1年前查看全部
- 人类的生活生产离不开金属.(1)写出在高炉中用赤铁矿炼铁的化学反应方程式3CO+Fe2O3 高温 . 3CO2+2Fe3
 人类的生活生产离不开金属.
人类的生活生产离不开金属.
(1)写出在高炉中用赤铁矿炼铁的化学反应方程式3CO+Fe2O3
3CO2+2Fe高温 .3CO+Fe2O3.
3CO2+2Fe高温 .
(2)如图所示的是某“暧宝宝”外包装的图片.该“暧宝宝”中发热剂主要成分有铁粉、活性炭、氯化钠、水等.使用时,先要撕去“暧宝宝”的保护膜,其目的是______,推测发热剂成分中氯化钠的作用是______.
(3)现有一种金属R(可能是银、镁、铁中的一种).欲确定R,请你一起完成:
①请将银、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置
②取少量的金属R的粉末于试管中,逐滴加入稀硫酸,有气泡产生,则R不可能是______.
③待不再产生气泡时,再往溶液中加入洁净的锌片,锌片表面有金属析出,则R是______.写出锌片表面析出金属R的化学反应方程式______.该反应的基本类型属于______(选填“化合”、“分解”、“置换”)反应. 罗鑫1年前1
罗鑫1年前1 -
 zh1987511 共回答了20个问题
zh1987511 共回答了20个问题 |采纳率90%解题思路:(1)赤铁矿的主要成分Fe2O3;高炉炼铁的原理是用还原剂将铁从它的氧化物中还原出来;
(2)根据铁粉生锈的条件需要水和氧气分析;氯化钠可以加快铁的锈蚀;
(3)①根据金属活动性顺序:镁>铁>H>银;
②只有排在氢前面的金属才能置换出酸中的氢,产生气泡;
③只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;单质和化合物反应生成新单质和新化合物的反应是置换反应.(1)高炉中用一氧化碳还原赤铁矿炼铁的化学反应方程式:3CO+Fe2O3
高温
.
3CO2+2Fe;
(2)“暧宝宝”中发热剂主要成分有铁粉,其原理就是利用铁粉生锈放出热量,而铁粉生锈的条件是在氧气和水并存时发生的缓慢氧化;所以使用时,先要撕去“暧宝宝”的保护膜的目的就是铁粉与空气接触,促使铁粉生锈,其中的氯化钠可以加快铁的生锈;故答案为:与空气接触,促使铁粉生锈 加速铁粉生锈,更快地放出热量;
(3)①在金属活动性顺序中,镁>铁>H>银;
②镁和铁的活动性位于氢的前面,能够与酸反应产生气泡,而银排在氢的后面不能与酸发生置换反应,故R不可能为银;
③镁与稀硫酸反应生成硫酸镁和氢气,铁和稀硫酸反应生成硫酸亚铁和氢气,所以溶液中的溶质有硫酸镁和硫酸亚铁,向其中加入锌:因为镁>锌>铁,排在前面的金属能把排在后面的金属从其盐溶液中置换出来,因此锌表面析出的金属是铁,故R金属是铁;锌和铁反应的方程式为:Zn+FeSO4═ZnSO4+Fe;该反应符合:单质+化合物→单质+化合物,故属于置换反应.
故答案为:①镁>铁>H>银;②银; ③铁 Zn+FeSO4═ZnSO4+Fe 置换点评:
本题考点: 铁的冶炼;金属活动性顺序及其应用;金属锈蚀的条件及其防护;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了铁的生锈条件、炼铁的原理以及铁发生的置换反应,是中考考查的重点之一,要注意顺序化学方程式时铁元素的化合价.1年前查看全部
- 1.用还原赤铁矿可得到一种具有银白色金属光泽的单质A,A在纯氧中燃烧得到一种黑色固体B,将B投入到稀硫酸中,可得到溶质为
1.用还原赤铁矿可得到一种具有银白色金属光泽的单质A,A在纯氧中燃烧得到一种黑色固体B,将B投入到稀硫酸中,可得到溶质为C和D的混合溶液,则A、B、C、D的化学式分别是:
2. 将一定质量的镁铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaoH溶液的体
积关系如图:
求A点为多少?具体的方程式和式子)

图上有个地方错了。A点的地方,沉淀是19.4... 5513600011年前1
5513600011年前1 -
 alexissui 共回答了19个问题
alexissui 共回答了19个问题 |采纳率94.7%赤铁矿被还原生成铁单质,A是Fe.Fe在纯氧中燃烧生成四氧化三铁B为Fe3O4.Fe3O4可视为FeO·Fe2O3所以C和D分别为FeSO4和Fe2(SO4)3.就是这个分析,真的没有计算方法.
2.当加入体积为20ml的时候把盐酸完全的中和了,在A点的时候生成Mg(OH)2和Al(OH)3,在180的时候Al(OH)3反应生成AlO2^-
Al(OH)3 + OH- = AlO2^- + 2H2O.得到Al(OH)3的质量为15.5 - 11.6 = 3.9g 氢氧化铝的物质的量为3.9/78 = 0.05mol,消耗氢氧根为0.05mol
11.6为氢氧化镁的质量Mg(OH)2,物质的量为11.6/58 = 0.2mol,则消耗氢氧根的量为0.4mol
共消耗氢氧化钠0.45mol.体积为0.45/5 x 1000 = 90ml
加上一开始中和盐酸的20ml,则在A点的体积为90+20 = 110ml
不够详细,很多都是文字,请见谅.
有问题欢迎追问.
希望我的回答能够对你有所帮助1年前查看全部
- 赤铁矿中含三氧化二铁的质量分数为80%,求铁矿石中含铁元素的质量分数(铁矿石中所含杂质不含铁元素)
 噗噗可1年前1
噗噗可1年前1 -
 带暗兮后群惊 共回答了14个问题
带暗兮后群惊 共回答了14个问题 |采纳率85.7%铁元素=56×2÷(56×2+16×3)×80%=56%1年前查看全部
- 亲们~走过路过 来瞧瞧~有400t含Fe2O3 80%的赤铁矿石,最多可炼成纯度97%的生铁多少吨?
 小白紫狼1年前3
小白紫狼1年前3 -
 cocogxj 共回答了23个问题
cocogxj 共回答了23个问题 |采纳率95.7%400t*80%=320t
3CO+ Fe2O3 =高温= 2Fe + 3CO2
160 112
320t x*97%
160/320t=112/(x*97%)
x=230.9t
可以炼得纯度97%的生铁230.9吨1年前查看全部
- 有12g赤铁矿的样品经分析化验检测地其中汗三氧化二铁,质量为9.6g,求赤铁矿中铁元素的质量分数.其中含三氧化二铁(Fe
有12g赤铁矿的样品
经分析化验检测地其中汗三氧化二铁,质量为9.6g,求赤铁矿中铁元素的质量分数.
其中含三氧化二铁(Fe₂O₃) 幽冥妖蝶1年前1
幽冥妖蝶1年前1 -
 水果木斯里 共回答了25个问题
水果木斯里 共回答了25个问题 |采纳率84%先求铁元素质量 已知Fe2O3有9.6g 那么含铁为
9.6x 112/160=6.72g 也就是赤铁矿12g中含6.72g铁元素 所以质量分数为6.72/12=56%1年前查看全部
大家在问
- 1甲醇燃料电池可把电能转化为化学能?
- 2用一个锤子将钉子钉进墙中,作钉子受到锤子压力的示意图时,作用点是在锤子与钉子的接触点上,还是钉子与墙的接触点上?为什么、
- 3(2011•南通)为了测定潜水艇的下潜深度,科技人员设计了深度测定仪,测定仪的原理图如图所示,R0为定值电阻,F是传感器
- 4李大伯的菜地共有有400m² (1)每种蔬菜的种植面积是多少;
- 5氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示 (1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式
- 6All words in English have a hierarchical struture.请问 这句话对吗
- 7用绝字组意思是独一无二的词
- 8这首词表达了作者怎样的思想感情如梦令 李清照 昨夜雨疏风骤,浓睡不消残酒. 试问卷帘人,却道“海棠依旧”. “知否?知否
- 9《对不起!我会记得你的好一辈子》英文翻译怎么写
- 10our maths teacher is tall改为一般疑问句
- 11已知函数F(x)=-2/3ax^3+ax^2-2x 在[-3,-2]上为增函数 求a的取值范围
- 12英语翻译He was not ready to believe something just because Arist
- 13补写下列名句名篇中的空缺部分。(8分)
- 14已知△ABC的△BDE都是等边三角形,试说明AE=CD
- 1598%的硫酸与水等体积的水混合后,溶液的质量分水比49%大还是小还是等于?