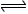FeSO4所含阳离子的符号为?
 铃铛m2022-10-04 11:39:541条回答
铃铛m2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 济南没有下雨 共回答了16个问题
济南没有下雨 共回答了16个问题 |采纳率81.3%- 亚铁离子Fe+2
- 1年前
相关推荐
- 阴离子和负电子 阳离子和正电荷 有什么区别
阴离子和负电子 阳离子和正电荷 有什么区别
如题 zbsd788111年前4
zbsd788111年前4 -
 又是个大东东 共回答了22个问题
又是个大东东 共回答了22个问题 |采纳率90.9%阴离子是单个原子或几个原子结合在一起,又从外界得到了电子,所以带有负电荷
至于负电子,在中学阶段所说的电子都是带负电的,就是在原子核外不停运动的粒子
阳离子和阴离子是一个道理,单个原子或者几个原子结合在一起,失去了电子,所以带正电
原子或原子团失去了电子,带有的就是正电荷1年前查看全部
- OH-和Na+ k+ 会共存吗OH-不是和大量金属阳离子都不共存吗?
 lxh16581年前1
lxh16581年前1 -
 perfumeandmakeup 共回答了16个问题
perfumeandmakeup 共回答了16个问题 |采纳率87.5%能共存
OH- 和 Mg2+ ,Fe2+,Fe3+,Cu2+等和它形成沉淀的才是不能共存的
K+和Na+ 不和OH-形成沉淀是能够共存的
比如 NaOH和KOH溶液中就有大量的Na+和OH-,K+共存1年前查看全部
- 什么是弱碱阳离子、弱酸、弱酸酸式酸根?最好能举几个例子
 桐木人士1年前4
桐木人士1年前4 -
 laoshiyi23 共回答了22个问题
laoshiyi23 共回答了22个问题 |采纳率90.9%常见的强碱有NaOH.KOH.Ca(OH)2.Ba(OH)2等.所以钠.钾.钙.钡离子属于强碱阳离子.一水合氨和难溶的碱都属于弱碱.所以NH4+.Cu2+等离子均为弱碱阳离子.1年前查看全部
- 用化学用语按下列要求填空:(1)碳酸钠中的阴离子______;氯化亚铁中的阳离子______;最轻的氧化物______;
用化学用语按下列要求填空:
(1)碳酸钠中的阴离子______;
氯化亚铁中的阳离子______;
最轻的氧化物______;
溶于水后显碱性的气体______.
(2)实验室用稀硫酸与锌粒反应制取氢气:______.
(3)长期存放石灰水的甁壁上会出现一层白膜,其形成的原因是______;该白膜可用稀盐酸除去,其原理是______. iseem1年前1
iseem1年前1 -
 uestcfrank 共回答了20个问题
uestcfrank 共回答了20个问题 |采纳率85%解题思路:(1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.相对分子质量最小的氧化物是水;溶于水后显碱性的气体有氨气.
(2)根据反应物和生成物及质量守恒定律进行分析解答.
(3)根据氢氧化钙和二氧化碳的反应及碳酸钙与盐酸的反应进行分析.(1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.碳酸钠中的阴离子是碳酸根离子,可表示为:CO32-;氯化亚铁中的阳离子的亚铁离子,可表示为:Fe2+;最轻(相对分子质量最小)的氧化物是水,其化学式为:H2O.氨气溶于水后显碱性,化学式为:NH3;
(2)稀硫酸与锌粒生成硫酸锌和氢气,反应方程式为:Zn+H2SO4=ZnSO4+H2↑;
(3)长期存放石灰水的甁壁上会出现一层白膜,其形成的原因氢氧化钙与二氧化碳反应生成了碳酸钙沉淀,反应方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;该白膜可用稀盐酸除去,其原理是碳酸钙能与盐酸发生反应生成可溶性的氯化钙及水、二氧化碳,反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:(1)CO32-Fe2+H2ONH3(2)Zn+H2SO4=ZnSO4+H2↑
(3)CO2+Ca(OH)2═CaCO3↓+H2OCaCO3+2HCl═CaCl2+H2O+CO2↑点评:
本题考点: 化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,主要考查同学们对常见化学用语(分子符号、化学式、离子符号、化学方程式等)的书写和理解能力.1年前查看全部
- (8分)现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构
(8分)现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构与Ne原子相同,2gB的氧化物与100ml 0.5mol/L的
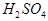 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物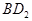 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)五种元素的名称是B________;D ;E________.
(2) 形成化合物 的化学键类型是: .
的化学键类型是: .
(3)用电子式表示化合物BD 2 的形成过程。 .
(4) A的氢氧化物的水溶液和C单质发生反应的离子方程式: . snsn261年前1
snsn261年前1 -
 害虫头头 共回答了17个问题
害虫头头 共回答了17个问题 |采纳率88.2%(1) B_镁;D氯;E 氧。 (每空1分)
(2)离子键、(极性)共价键。(1分,只填一种键不给分)
(3)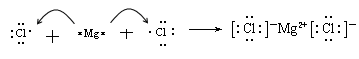 (2分)
(2分)
(4)2OH - +2Al +2H 2 O=2AlO 2 - +3 H 2 ↑。(2分)
根据B单质与D单质反应后可形成离子化合物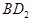 ,说明B是第ⅡA,D是第 Ⅶ A 。2gB的氧化物与100ml 0.5mol/L的
,说明B是第ⅡA,D是第 Ⅶ A 。2gB的氧化物与100ml 0.5mol/L的 恰好完全反应,所以B的氧化物的相对分子质量是40,因此B是镁,则A是Na,C是Al,D是Cl,E是O。
恰好完全反应,所以B的氧化物的相对分子质量是40,因此B是镁,则A是Na,C是Al,D是Cl,E是O。
(2)过氧化钠中含有离子键和非极性键。
(3)氯化镁是离子化合物,其形成过程为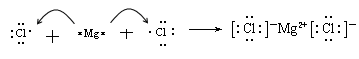 。
。
(4)铝和氢氧化钠反应的方程式为2OH - +2Al +2H 2 O=2AlO 2 - +3 H 2 ↑。1年前查看全部
- 在原电池中,阳离子放电顺序中的H+,是指酸中H+,还是水中H+?
在原电池中,阳离子放电顺序中的H+,是指酸中H+,还是水中H+?
即在原电池的正极被还原的离子是否仍是以Ag+>Hg2+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+的顺序放电. 528m1年前1
528m1年前1 -
 StephenLau 共回答了11个问题
StephenLau 共回答了11个问题 |采纳率90.9%你说的放电顺序是电解池的,不是原电池的,电解池中,铜离子后面的氢离子是酸中氢离子,锌离子后面还有一个氢离子,是指水中氢离子1年前查看全部
- 下列叙述中,正确的是( )A. 含金属元素的离子不一定都是阳离子B. 在氧化还原反应中,非金属单质一定是氧化剂C. 化
下列叙述中,正确的是( )
A. 含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 化合物变为单质时,化合价变化的元素一定被还原
D. 金属离子被还原一定得到金属单质 tiramisu11241年前5
tiramisu11241年前5 -
 supersever 共回答了24个问题
supersever 共回答了24个问题 |采纳率79.2%解题思路:A.含金属元素的离子也可能为阴离子,如AlO2-等;
B.非金属性单质可作还原剂,如C、H2等;
C.化合物变为单质时,化合价变化的元素可被氧化,也可被还原;
D.金属离子被还原不一定得到单质.A.含金属元素的离子可为简单阳离子或酸根离子,如为酸根离子,则为阴离子,如AlO2-等,故A正确;
B.当非金属单质的元素的化合价为最低价态时,可为还原剂,故B错误;
C.化合物变为单质时,化合价变化的元素可被氧化,也可被还原,如Cu2+→Cu,S2-→S,故C错误;
D.金属离子被还原不一定得到单质,如Fe3+→Fe2+,故D错误.
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,侧重于常见物质的性质的考查,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 纯净水为什么不能导电电解质是溶于水溶液中或在熔融状态下就能够导电(电解离成阳离子与阴离子)并产生化学变化的化合物.水是电
纯净水为什么不能导电
电解质是溶于水溶液中或在熔融状态下就能够导电(电解离成阳离子与阴离子)并产生化学变化的化合物.水是电解质为什么不能导电 离离原上火1年前1
离离原上火1年前1 -
 大床头柜 共回答了18个问题
大床头柜 共回答了18个问题 |采纳率88.9%水是弱电解质,只能电离出极少的氢离子和氢氧根离子,所以导电性很弱,但它是可以导电的,只不过用我们实验的导电装置测不到(灯泡不亮),用灵敏电流计可以测到电流.1年前查看全部
- CaH2晶体中的阳离子与阴离子的个数比
 1234098001年前1
1234098001年前1 -
 mugege 共回答了17个问题
mugege 共回答了17个问题 |采纳率88.2%1:2
Ca为正二价,H为负一价1年前查看全部
- 与氖原子核外电子排布相同的一组阳离子是
与氖原子核外电子排布相同的一组阳离子是
A、Li+ Be2+ B、K+ Ca2+ C、Mg2+ Al3+ D、Na+ K+ tianhai3161年前1
tianhai3161年前1 -
 ieqb6l 共回答了17个问题
ieqb6l 共回答了17个问题 |采纳率100%C
都是2 8结构1年前查看全部
- 水是不是氧化物,什么是阴离子,什么是阳离子
 向前快跑1年前1
向前快跑1年前1 -
 xxxx3214 共回答了22个问题
xxxx3214 共回答了22个问题 |采纳率95.5%水 是氧化物 阴离子是指原子由于外界作用得到一个或几个电子,使其最外层电子数达到稳定结构 阳离子是指原子由于外界作用失去一个或几个电子,使其最外层电子数达到8个或2个电子的稳定结构.1年前查看全部
- (18分)根据下图回答问题:(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离子位于8个
(18分)根据下图回答问题:
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离
子位于8个顶点,该化合物中阳、阴离子的个数比是_______________。
(2)B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na +
和Cl - 的个数分别为_______________、_______________。
(3)C图是金刚石的晶体结构,C 60 、金刚石和石墨三者的关系是_______________。
硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是_______________N A 个。二氧化硅的结构相当于在硅晶体结构中每个硅—硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上原子数目是_______________。A.同分异构体 B.同素异形体 C.同系物 D.同位素
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为_______________,“C—C”键数为_______________。
(5)足球烯C 60 结构形如足球,如E图,则C 60 中有_______________个六边形,_______________个五边形。固态时,C 60 属于_______________ (填“离子”、“原子”或“分子”)晶体,C 60 分子中含有双键的数目是_______________。
(6)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如F图。其中含有
20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察F图,推断这个基本结构单元所含硼原子个数、键角、“B—B”键的个数依次为______________、_______________、_______________。 xuzhiwei1991111年前1
xuzhiwei1991111年前1 -
 lsy2003 共回答了20个问题
lsy2003 共回答了20个问题 |采纳率100%(1)1∶1 (2)4 4 (3)B 2 12 (3)2 3
(5)20 12 分子 30 (6)12 60° 30
(1)阳离子数=1,阴离子数=8× =1,即个数比为
=1,即个数比为 。
。
(2)Na + 个数=8× +6×
+6× =4,Cl - 个数=12×
=4,Cl - 个数=12×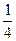 +1=4。
+1=4。
(3)由同一种元素形成的不同单质互称为同素异形体。如红磷、白磷;O 2 、O 3 等。1 mol Si原子形成4 mol Si—Si键,而1 mol Si—Si键为2 mol Si原子共用,所以1 mol Si原子实际“占有”Si—Si键为4 mol× ="2" mol,即为2N a 个。硅晶体最小环上有6个硅原子,每2个硅原子之间插入1个O原子,则共插入6个O原子,所以形成的最小环为12元环。
="2" mol,即为2N a 个。硅晶体最小环上有6个硅原子,每2个硅原子之间插入1个O原子,则共插入6个O原子,所以形成的最小环为12元环。
(4)一个正六边形中C原子数=6× =2,C—C键数=6×
=2,C—C键数=6× =3。
=3。
(5)B原子数=20×3× =12。等边三角形,键角为60°。B—B键数=20×3×
=12。等边三角形,键角为60°。B—B键数=20×3× =30。
1年前查看全部
=30。
1年前查看全部
- 电解质溶液中,阴离子阳离子均以水合离子形式存在,如H离子结合H2O形成H3O-,下面书写错误的是
电解质溶液中,阴离子阳离子均以水合离子形式存在,如H离子结合H2O形成H3O-,下面书写错误的是
A.CuSO4=Cu﹙2+﹚+SO4﹙2-﹚ B.Hcl+H2o=H3O﹙+﹚+Cl﹙-﹚ C.NaHSO4=Na﹙+﹚+HSO4﹙-﹚ D· NaHCO3=Na﹙+﹚+HCO3﹙-﹚ dengaspl1年前1
dengaspl1年前1 -
 eastlifer 共回答了28个问题
eastlifer 共回答了28个问题 |采纳率92.9%C项错误,高中阶段认为硫酸氢根离子在水中完全电离,所以应拆开
NaHSO4+H2O==Na(+)+H3O(+)+SO4(-)1年前查看全部
- 阳离子染色需要加什么助剂,各为多少?
 sky7471年前1
sky7471年前1 -
 swy1105 共回答了18个问题
swy1105 共回答了18个问题 |采纳率88.9%总体一般用到3种助剂:元明粉,醋酸,醋酸钠.染色需在酸性条件下进行,故要用到醋酸,但PH值也不能过低一般控制在3.5所以要要加醋酸钠,还要用到元明粉.1年前查看全部
- 下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的
下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的化肥。B、D常温常压下是气体。请回答下列问题 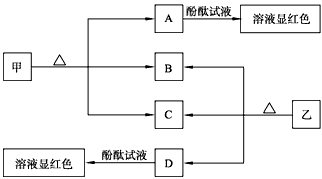
(1)甲的俗名是____________________________。
(2)A、D物质的水溶液分别滴入酚酞试液后,溶液均显红色,说明溶液均显_______性,其原理是否相同?请用必要的文字加以解释并写出离子方程式:_____________________________________。
(3)向饱和氯化钠溶液中通入气体D至饱和后,再通入足量的气体B可制得物质甲,写出该反应的化学方程式:_________________________________ qyf27771年前1
qyf27771年前1 -
 yy娜娜 共回答了20个问题
yy娜娜 共回答了20个问题 |采纳率85%1年前查看全部
- 化学中阴离子只有氧化性,阳离子只有还原性吗?
化学中阴离子只有氧化性,阳离子只有还原性吗?
如题`` 就要生了1年前11
就要生了1年前11 -
 老天打笨小孩 共回答了23个问题
老天打笨小孩 共回答了23个问题 |采纳率91.3%当然不是的啦,因为有的元素有多个化合价的,处于中间价态的离子就有两性了1年前查看全部
- 一个阳离子 一个阴离子 他们的电子数和质子数都相等.可能吗.举例说明、
 green6543211年前4
green6543211年前4 -
 刚想换手机 共回答了21个问题
刚想换手机 共回答了21个问题 |采纳率85.7%不可能
如果电子数相等,那么阳离子的质子数必定多
我先回答的~1年前查看全部
- 与氖原子核外电子排布相同的阳离子,跟与氩原子核外电子排布相同的阴离子所形成的化合物化学式是
与氖原子核外电子排布相同的阳离子,跟与氩原子核外电子排布相同的阴离子所形成的化合物化学式是
1.CCl4 2.Na2S 3.KCl 4.KF
为什么?
在多电子原子中,能量最高的电子是
A.离原子核最近的电子
B.一定是第1电子层的电子
C.在化学反应中最易失去的电子
D.在化学反应中最难失去的电子
第1题选择题我更改清楚点
A.CCl4
B.Na2S
C.KCl
D .KF 陈加强1年前3
陈加强1年前3 -
 moses_han 共回答了17个问题
moses_han 共回答了17个问题 |采纳率76.5%与氖原子核外电子排布相同的阳离子
意思就是失去电子后的离子和氖相同,所以必定是下一个周期的金属元素.
Na Mg Al
与氩原子核外电子排布相同的阴离子
意思就是得到电子后离子的电子排部与氩相同,所以必定是本周期的非金属元素.
P S Cl
所以选Na2S
第二题选C
能量高表示不稳定,容易失去
电子层数越高能量越高
A B都是能量最低的
D难失去也表示能量低1年前查看全部
- 1.含有阳离子的晶体一定是离子晶体,
1.含有阳离子的晶体一定是离子晶体,
2.分子晶体中一定有共价键,
为什么不对?
双原子分子一定是极性分子,为什么不对?
CO 四月踏歌1年前2
四月踏歌1年前2 -
 汉水墨人 共回答了25个问题
汉水墨人 共回答了25个问题 |采纳率80%1.因为金属晶体是阳离子和电子构成的,不是离子晶体,所以错
2.固态的稀有气体是单原子分子晶体,全靠分子间力,没有化学键,所以也错
H2这些东西不都是双原子啊,是非极性.
正确的说法应该是 由不同元素的原子构成的双原子分子是极性分子1年前查看全部
- 试分析离子晶体中,阴离子扩散系数一般都小于阳离子扩散系数的原因.
 家乡的早餐1年前1
家乡的早餐1年前1 -
 ShowSolo 共回答了18个问题
ShowSolo 共回答了18个问题 |采纳率94.4%阳离子的扩散系数通常比阴离子大.因为阳离子失去了它们的价电子,它们的离子半径比阴离子小,因而更易扩散.例如,在NaCl中,氯离子的扩散激活能约是钠离子的2倍. 看看这个,http://wlxt.xhu.edu.cn/UploadFiles/course/clkxjc2005/WebCourse/chapter4/c4-s8.asp.htm1年前查看全部
- 影响盐类水解主要因素 外加酸碱比方说水解成酸性的盐溶液,加碱会促进盐的水解.但如果加强碱,弱碱阳离子直接与氢氧根反应,抑
影响盐类水解主要因素 外加酸碱
比方说水解成酸性的盐溶液,加碱会促进盐的水解.
但如果加强碱,弱碱阳离子直接与氢氧根反应,抑制盐的水解.
难道是加弱碱促进,强碱抑制吗?
请具体说清楚各种情况. 诺诺N721年前1
诺诺N721年前1 -
 zijian5721 共回答了25个问题
zijian5721 共回答了25个问题 |采纳率100%楼主在某处弄糊涂了~
你说得都对.水解成酸性的盐,其水解反应式生成物包括氢离子,此时加入碱性物质可以中和(部分)氢离子,降低生成物浓度,促进平衡右移,从而促进水解.
“如果加强碱,弱碱阳离子直接与氢氧根反应”实际上这个过程实质跟水解没什么差别,都是金属阳离子与溶液中的氢氧根离子结合生成难电离的粒子,只不过加入强碱后氢氧根离子由强碱电离提供而不是水.事实上有些地方也把后面这个过程成为水解.
// 楼主还有不明白的可以跟进1年前查看全部
- 二氧化碳溶于水产生碳酸,溶液中存在的阳离子是什么
 cxuhua1年前4
cxuhua1年前4 -
 水她她 共回答了21个问题
水她她 共回答了21个问题 |采纳率100%二氧化碳溶于水产生碳酸,碳酸是弱酸,会电离出部分氢离子(即溶液中存在的阳离子)1年前查看全部
- 证明金属阳离子具有氧化性例如Ag+它已经达到稳定结构,为什么还有得电子的性质啊
 mathilda_ma1年前1
mathilda_ma1年前1 -
 kk洗发水 共回答了14个问题
kk洗发水 共回答了14个问题 |采纳率100%各电子层最多容纳的电子数为2n2个(即K层2,L层8,M层18,N层32) 最外层电子数≤8(K层为2个),次外层电子数≤18,倒数第三层电子数≤32
在已知的金属元素中没有一种是达到饱和状态的
得失电子是相对而言的Ag+ 是2,8,18,18,1排列 极容易失去最外层电子
但和一些比较稳定的元素想比还是会得到电子形成共用电子团 显现微弱的氧化性1年前查看全部
- 某微粒的结构示意图为: 下列有关该离子的说法,其中错误的是( ) A.该粒子为阳离子 B.该粒子的原子核内有16个
某微粒的结构示意图为: 
下列有关该离子的说法,其中错误的是( )A.该粒子为阳离子 B.该粒子的原子核内有16个质子 C.该粒子已经达到相对稳定结构 D.该粒子核外有三个电子层  lkllm1年前1
lkllm1年前1 -
 鱼儿不相信眼泪 共回答了24个问题
鱼儿不相信眼泪 共回答了24个问题 |采纳率87.5%A、该核内质子数为16,核外电子数为18,即:质子数<核外电子数,所以该粒子为阴离子,故B说法错误;B、根据原子结构示意图可以知道,该原子的核内为16个质子,故B说法正确;C、最外层电子数为8(只有一个电子层...1年前查看全部
- 有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-
有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)现将溶液两两混合,记录现象如下:A+B→白色沉淀;2B+D→白色沉淀;C+D→蓝色沉淀则A、B、C、D的化学式分别是______、______、______、______.
 qq1096072111年前2
qq1096072111年前2 -
 jonem 共回答了23个问题
jonem 共回答了23个问题 |采纳率87%解题思路:题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
故答案为:AgNO3;MgCl2;CuSO4;NaOH.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质的检验和鉴别,为高频考点,把握发生的反应及习题中的信息为解答的关键,侧重分析、推断能力的考查,注意白色沉淀、蓝色沉淀为推断的突破口,题目难度不大.1年前查看全部
- 求“高分子化学论述题”答案?1. 从活性中心状态、活性、反应特点等方面简述自由基聚合和阳离子聚合实现可控聚合的难度及解决
求“高分子化学论述题”答案?
1. 从活性中心状态、活性、反应特点等方面简述自由基聚合和阳离子聚合实现可控聚合的难度及解决问题的主要思路和方法. 2. 从大分子设计合成的角度,比较连锁聚合和逐步聚合的特点与不足.
 AdUN491年前1
AdUN491年前1 -
 ntbluesky 共回答了19个问题
ntbluesky 共回答了19个问题 |采纳率94.7%2、逐步聚合 多数缩聚和聚加成反应都属于逐步聚合,其特征是低分子转变成高分子在缓慢逐步进行,每步反应的速率和活化能大致相同.两单体分子反映,形成二聚体;二聚体与单体反应,形成三聚体;二聚体互相反应,则成四聚体.反应早期,单体很快聚合成二、三、四聚体等,这些低聚物常称为齐聚物.短期内单体转化率就很高,反应集团的转化率却很低.所后,低聚物间互相缩聚,分子量缓慢增加,直至基团转化率很高(大于98%)时,分子量才达到较高的数值.体系由单体和分子量递增的系列中间产物组成.1年前查看全部
- 下列离子化合物中阴,阳离子间距最大的是:
下列离子化合物中阴,阳离子间距最大的是:
A.LiCL
B.NaCL.
C.KCL
D.KBr lilei01年前1
lilei01年前1 -
 拔弩 共回答了23个问题
拔弩 共回答了23个问题 |采纳率87%阳离子中钾离子的半径最大,阴离子中溴离子的半径最大,所以溴化钾中阴,阳离子间距最大
选D1年前查看全部
- X、Y、Z、W四种短周期元素,若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子氧化性强于等电荷的X阳离子的氧化性
X、Y、Z、W四种短周期元素,若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子氧化性强于等电荷的X阳离子的氧化性,Z的阴离子半径大于等电荷的Y的阴离子半径,且Z离子所带电荷数的绝对值是W离子的两倍,W离子与Z离子的电子层相差两层.试推断这四种元素X_______,Y_________,Z_________,W_______.
 dy6141年前4
dy6141年前4 -
 dol3k 共回答了22个问题
dol3k 共回答了22个问题 |采纳率86.4%X、Y、Z、W四种短周期元素,Z离子所带电荷数的绝对值是W离子的两倍,一般可得z离子和y离子带两个单位的负电荷,又因为Z的阴离子半径大于等电荷的Y的阴离子半径,所以z为硫元素、y为氧元素.同时说明w离子带一个单位的正电...1年前查看全部
- 电解池的阳离子得电子能力其中Al3+<H+(水中)<Zn2+<.<H+(酸性)<.如果是硫酸溶液 那么H+先于Zn2+得
电解池的阳离子得电子能力
其中Al3+<H+(水中)<Zn2+<.<H+(酸性)<.
如果是硫酸溶液 那么H+先于Zn2+得电子 如果是水溶液 Zn2+先于H+得电子
那如果是ZnSO4这样的盐溶液呢? yxcmcu1年前3
yxcmcu1年前3 -
 虎纠仁 共回答了25个问题
虎纠仁 共回答了25个问题 |采纳率88%ZnSO4这样的盐溶液就是水溶液了,所以Zn2+先于H+得电子1年前查看全部
- 推断题 有点难度哦 别瞎说!现有A.B.C.D.E 五种强电解质,他们在水中可电离产生下列离子(各种离子不重复)阳离子:
推断题 有点难度哦 别瞎说!
现有A.B.C.D.E 五种强电解质,他们在水中可电离产生下列离子(各种离子不重复)
阳离子:氢离子 钠离子 铝离子 银离子 钡离子
阴离子:氢氧根离子 氯离子 碳酸跟离子 硝酸根离子 硫酸根离子
已知:①A.B两溶液呈碱性;C.D.E溶液呈酸性
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反映止呕气体产生(沉淀包括微溶物,下同)
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D 反应产生沉淀.
试回答下列问题:
⑴A.B均显碱性请分别用方程式解释原因--------------------.----------------------、
⑵写出E溶液与少量的B溶液反应的离子方程式---------------------------------
⑶在100ml0.1mol/L E溶液中,逐滴假如35ml2mol/L NaOH 溶液,最终得到沉淀无知的量为-----------------. lvweijin1年前2
lvweijin1年前2 -
 lyzz100 共回答了19个问题
lyzz100 共回答了19个问题 |采纳率84.2%A.Na2CO3
B.Ba(OH)2
C HCl
D AgNO3
E Al2(SO4)3
1 A的原因是 碳酸根的水解产生了OH-
B的原因是因为有OH-
2小问 3Ba2+ + 6OH- + 2Al3+ +3SO42- = 3BaSO4 (沉淀) +2Al(OH)3(沉淀) 原因是 氢氧化钡少 以他为标准配平
3 0.01mol
PS 有疑问可以Hi我 我给你解释一下~1年前查看全部
- 电解质溶液中,阴离子和阳离子均以水合离子形式存在,如H+可以结合一个水分子形成H3O+.下列物质的电离方程式错误的是(
电解质溶液中,阴离子和阳离子均以水合离子形式存在,如H+可以结合一个水分子形成H3O+.下列物质的电离方程式错误的是( )
A.CuSO4═Cu2++SO42−
B.HCl+H2O═H3O++Cl-
C.NaHCO3═Na++HCO3−
D.NaHSO4═Na++HSO+SO4− 科小月1年前1
科小月1年前1 -
 萨娜优啦 共回答了20个问题
萨娜优啦 共回答了20个问题 |采纳率95%解题思路:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式;可根据质量守恒定律及电荷守恒来检查电离方程式书写的正误.A、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
B、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
C、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
D、硫酸氢钠的电离方程式应为:NaHSO4═Na++HSO4-.
故选D.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查电离方程式的书写,掌握电离方程式的书写方法是正确解答本题的关键.1年前查看全部
- (2013•苏州一模)下列结构示意图中,能表示出带2个单位正电荷的阳离子是( )
(2013•苏州一模)下列结构示意图中,能表示出带2个单位正电荷的阳离子是( )
A.
B.
C.
D.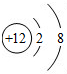
 神勇小白菜1年前1
神勇小白菜1年前1 -
 来给13铺路 共回答了16个问题
来给13铺路 共回答了16个问题 |采纳率87.5%解题思路:根据阳离子是失去电子带正电荷的微粒,看圆圈内数字与核外电子数的关系,只有失去2个电子就能表示出带2个单位正电荷的阳离子进行解答.A、核内质子数小于核外电子数,原子得到1个电子,带1个单位负电荷,属于阴离子;
B、核内质子数等于核外电子数,属于原子;
C、核内质子数大于核外电子数,属于阳离子,原子失去1个电子,带1个单位的正电荷,;
D、核内质子数大于核外电子数,原子失去2个电子,带2个单位的正电荷,属于阳离子.
故选D.点评:
本题考点: 原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.
考点点评: 核内质子数等于核外电子数属于原子,核内质子数大于核外电子数为阳离子,核内质子数小于核外电子数为阴离子.1年前查看全部
- 为什么使用DNA聚合酶要游离的二价阳离子
 玲珑杏子1年前1
玲珑杏子1年前1 -
 wangmh5555 共回答了25个问题
wangmh5555 共回答了25个问题 |采纳率92%热稳定性的DNA聚合酶需要二价阳离子的激活,并且二价阳离子可以稳定DNA聚合酶.1年前查看全部
- 欲配制下列四种含大量阴、阳离子的溶液,其中配不成的是( )
欲配制下列四种含大量阴、阳离子的溶液,其中配不成的是( )
A.Ca2+、K+、Cl-、CO32-
B.K+、Na+、OH-、NO3-
C.Mg2+、Ca2+、Cl-、NO3-
D.K+、Al3+、SO42-、NO3- 肥vvv21年前1
肥vvv21年前1 -
 lle1985 共回答了24个问题
lle1985 共回答了24个问题 |采纳率95.8%解题思路:A.钙离子与碳酸根离子反应生成难溶物碳酸钙;
B.K+、Na+、OH-、NO3-之间不发生反应;
C.Mg2+、Ca2+、Cl-、NO3-之间在溶液中能够大量共存;
D.K+、Al3+、SO42-、NO3-之间不发生反应,可以配成溶液.A.Ca2+、CO32-之间能够反应生成碳酸钙,在溶液中不能共存,无法配成溶液,故A正确;
B.K+、Na+、OH-、NO3-之间不发生反应,在溶液中能够大量共存,可以配成溶液,故B错误;
C.Mg2+、Ca2+、Cl-、NO3-之间不满足离子反应发生条件,可以配制溶液,故C错误;
D.K+、Al3+、SO42-、NO3-之间不反应,在溶液中能够大量共存,可以配成溶液,故D错误;
故选A.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.1年前查看全部
- 简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性?
简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性?
什么是简单非金属阴离子?S2-是吗那他不既有还原型又有氧化性吗但答案这个选项又是对的 hazaline1年前2
hazaline1年前2 -
 男炎之隐 共回答了23个问题
男炎之隐 共回答了23个问题 |采纳率91.3%S2-化合价为-2已经最低了,所以没有氧化性,只有还原性1年前查看全部
- 氢氧化钙溶液中阳离子符号最好把溶液中金属元素化合价也写上
 中原一客1年前2
中原一客1年前2 -
 叶儿叶儿飞 共回答了19个问题
叶儿叶儿飞 共回答了19个问题 |采纳率89.5%Ca2+ 正2价1年前查看全部
- 两小题混盐一般由一种阳离子与两种酸根离子组成的盐,如Ca(NO30)Cl.漂白粉中有一种混盐CaOCl2.请将该混盐改为
两小题
混盐一般由一种阳离子与两种酸根离子组成的盐,如Ca(NO30)Cl.漂白粉中有一种混盐CaOCl2.
请将该混盐改为如Ca(NO30)Cl的形式,
该混盐中氯元素的化合价为 iv121年前1
iv121年前1 -
 陈行之 共回答了20个问题
陈行之 共回答了20个问题 |采纳率90%Ca(ClO)Cl,其中两个氯元素的化合价分别为:第一个+1,第二个-11年前查看全部
- (2005•宣武区二模)下列粒子示意图中,表示+3价阳离子的是( )
(2005•宣武区二模)下列粒子示意图中,表示+3价阳离子的是( )
A.
B.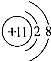
C.
D.
 世事难两全1年前1
世事难两全1年前1 -
 琉璃佛 共回答了24个问题
琉璃佛 共回答了24个问题 |采纳率95.8%解题思路:根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;+3价阳离子带有3的单位的正电荷;据此进行分析解答.+3价阳离子带有3的单位的正电荷.
A、质子数=核外电子数=10,为原子,故选项错误.
B、质子数=11,核外电子数=10,质子数>核外电子数,为阳离子;但该离子带有1个单位的正电荷,故选项错误.
C、质子数=12,核外电子数=10,质子数>核外电子数,为阳离子;但该离子带有2个单位的正电荷,故选项错误.
D、质子数=13,核外电子数=10,质子数>核外电子数,为阳离子;且该离子带有3个单位的正电荷,故选项正确.
故选D.点评:
本题考点: 原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.1年前查看全部
- 化学电极反应中得注意负极生成的阳离子能否和电解质中的阴离子共存,不能共存则写入反应式中,为什么呢
化学电极反应中得注意负极生成的阳离子能否和电解质中的阴离子共存,不能共存则写入反应式中,为什么呢
Zn Cu Hcl原电池中Zn离子不能和Cl离子共存,可以生成Zncl,Cl离子怎么不写到电极反应式中呢? 窗子的aa1年前1
窗子的aa1年前1 -
 niunai80_hh 共回答了15个问题
niunai80_hh 共回答了15个问题 |采纳率100%Zn离子和Cl离子可以共存啊,ZnCl2在溶液中是以离子存在的 ,ZnCl2在熔融态也是有着很好的导电性能,虽然Zn和Al一样都是两性金属,但是氯化铝是共价化合物,熔融态不导电,但是氯化锌是可以的,这一点你可以搜百科:http://baike.baidu.com/view/525735.htm1年前查看全部
- 在有盐桥的铜锌原电池中,电解质溶液的选择为什么要与电极材料的阳离子相同?
在有盐桥的铜锌原电池中,电解质溶液的选择为什么要与电极材料的阳离子相同?
如果两个溶液都选硫酸铜,是不是在锌上析出铜,那还是叫原电池吗?请分析下原理
 jason21ce1年前1
jason21ce1年前1 -
 Prince_handsome 共回答了9个问题
Prince_handsome 共回答了9个问题 |采纳率77.8%不是,还是在铜棒上析出铜。锌棒上锌失的电子通过导线转移到铜棒上,溶液中的铜离子在铜棒上得电子,被还原。1年前查看全部
- 某元素a的粒子,原子质量为x,第一层电子数为2,第二层电子数为y.若a为阳离子时,x与y的关系,y等于多少
某元素a的粒子,原子质量为x,第一层电子数为2,第二层电子数为y.若a为阳离子时,x与y的关系,y等于多少
当a为中性原子时,x等于10+y. 法律要执行1年前3
法律要执行1年前3 -
 dreamfang 共回答了18个问题
dreamfang 共回答了18个问题 |采纳率88.9%x>10+y,具体数值有多种,不过我还是认为中性时y=6.1年前查看全部
- 较不活泼的金属单质不能还原较活泼的金属阳离子,为什么不对阿?
 maxiaohai1年前1
maxiaohai1年前1 -
 山上的猪 共回答了17个问题
山上的猪 共回答了17个问题 |采纳率94.1%Cu+2Fe3+=Cu2+ +2Fe2+1年前查看全部
- A,B,I都是XY2型化合物,且阳离子相同
A,B,I都是XY2型化合物,且阳离子相同
A,B阴阳离子之比为1比1,I阴阳离子之比为2比1,且I为干燥剂
试求各字母所代表化合物的化学式?
A是CaC2 B是CaO2 I是CaCl2
这个我就看不懂类A,B阴阳离子之比为1比1,I阴阳离子之比为2比1
I的阴离子是Cl-和Ca2+阴阳离子之比为2比1是对的
可是根据题设A,B阴阳离子之比为1比1 但是这里A是CaC2 B是CaO2 碳离子比上Ca2+不是2:1么 还有这里的CaO2阴离子是氧离子有两个比上一个钙离子不也是2:1么?哪来的1:1丫? xiaozhao1年前1
xiaozhao1年前1 -
 敲锣打鼓迎接你 共回答了19个问题
敲锣打鼓迎接你 共回答了19个问题 |采纳率94.7%这个一楼其实已经说的很清楚了
我就列举一下比较特殊的吧
b比如Na2O2 H2O2这些 事实上你还是主要看化合价
有一些特别的你记住就好了
过氧键中有的氧没有与中心原子成键(与氧成键),这就使得这个基团中拥有超过氧与中心原子成键且只与中心原子成键时的数目,从而做出选择1年前查看全部
- 1、容器中装着含有大量阴、阳离子的溶液,当溶液中插入连有电源的电极时,大量离子定向移动形成电流.测得在5S内共有6C正电
1、容器中装着含有大量阴、阳离子的溶液,当溶液中插入连有电源的电极时,大量离子定向移动形成电流.测得在5S内共有6C正电荷和6C的负电荷通过容器的竖直截面OO’,则(串联)电路中电流表的读数应为( )A
2、每种金属导体中单位体积内的自由电子数有确定的值.若两段长度之比为2:1 ,横截面积之比为1:3的镍铬合金丝并联在某电路中使用时,则这两根电阻丝内电子定向移动的平均速度之比为()
A.3:1 B.1:2 C.2:1 D.1:1 jingyihu1年前1
jingyihu1年前1 -
 活力瓶13 共回答了13个问题
活力瓶13 共回答了13个问题 |采纳率92.3%第一题应该是(6+6)/5=2.5A
第二题:同种材料同种电压条件下电子定向移动的平均速度应该相等,答案是D1年前查看全部
- 关于酸碱盐的溶解性表关于NO3的老师叫我们只要背K,Na,NH4,与NO3能溶于水,其它的都要,但溶解表上所有阳离子和N
关于酸碱盐的溶解性表
关于NO3的老师叫我们只要背K,Na,NH4,与NO3能溶于水,其它的都要,但溶解表上所有阳离子和NO3结合都易溶,不知道是不是因为初中生只要记NO3这些,还是因为NO3有什么性质? dfhsir1年前1
dfhsir1年前1 -
 游戏人间的猪 共回答了14个问题
游戏人间的猪 共回答了14个问题 |采纳率92.9%溶解性表只需要背不溶于水的物质即可.你们老师说的只记那些是因为你们学的硝酸盐很少,只有列出的那些而已.关于硝酸根的性质,你将在高一第一学期的时候学到.祝你中考顺利!1年前查看全部
- 化学判断题错的话错在哪(1)cuso4.5h2o是混合物(2)含有金属元素的离子不一定是阳离子
化学判断题错的话错在哪(1)cuso4.5h2o是混合物(2)含有金属元素的离子不一定是阳离子
(3)金属氧化物一定是碱性氧化物(4)酸分子中含有几个氢原子就是几元酸(5)酸性氧化物一定是非金属氧化物(6)酸性氧化物都能与水反应生成对应的酸(7)碳酸钠属于钠盐碳酸盐正盐(8)渗析实验可以证明胶体粒子比溶液中粒子直径大(9)摩尔既是物质质量单位又是物质数量单位(10)1摩尔小麦约含6.02*10^23个麦粒(11)0.012g12c所含碳原子数即为阿佛加德罗常数 zufangmao1年前1
zufangmao1年前1 -
 xxtc2008 共回答了12个问题
xxtc2008 共回答了12个问题 |采纳率91.7%1错,是纯净物,进一步,他是化合物,5水是分子本身结合的,不属于其他物质
2对,比如铝酸根,AlO2-
3错,铝的氧化物是酸性
4错,碳酸氢根,亚硫酸氢根都只是二元酸,却有3哥氢原子
5错,铝酸
6错,三氧化二铝(刚玉)不与水反应
7错,属于碱式盐不是正盐
8错,这句话全错,比溶液中溶质粒子大
9错,摩尔只是物质的量的单位
10错,我怎么给你解释啊,看看概念吧,摩尔只是微观
11错,不是即,只是等于关系1年前查看全部
- 离子正电荷数和电子最多相差多大比如 一个离子 正电荷数为X 两个电子层 内层2个电子 最外层8个电子 当为阳离子时 X=
离子正电荷数和电子最多相差多大
比如 一个离子 正电荷数为X 两个电子层 内层2个电子 最外层8个电子 当为阳离子时 X=() 当为阴离子时 X=() 括号中的数字不止一个 oO小猪Oo乖乖1年前1
oO小猪Oo乖乖1年前1 -
 小乱来 共回答了26个问题
小乱来 共回答了26个问题 |采纳率88.5%一个离子 正电荷数为X 两个电子层 内层2个电子 最外层8个电子 当为阳离子时 X=(11,12,13) 当为阴离子时 X=(7,8,9)
最多相差31年前查看全部
- Y电解池中阳离子为什么向阴极移动
 Lallie1年前3
Lallie1年前3 -
 limeflowers 共回答了20个问题
limeflowers 共回答了20个问题 |采纳率90%电解池中电流由正极流向负极,电子是由负极流向正极.
阴极发生还原反应,物质化合价降低,所以阴极与负极相连,阴极得到电子,而电解池中阳离子会被还原,所以向阴极移动,阳离子得电子一般生成单质.1年前查看全部
- 离子键是阳阳离子间的静电吸引作用是错的 为什么有斥力啊
 ofcofc1年前1
ofcofc1年前1 -
 绯忖剑心 共回答了17个问题
绯忖剑心 共回答了17个问题 |采纳率94.1%离子是由原子得到电子(形成阴离子)或失去电子(形成阳离子)而形成的.原子核质子带正电荷,电子带负电荷,每个原子都是质子数=电子数,那么阴离子质子数电子数,所以阴离子带负电荷,阳离子带正电荷,两者可相互吸引.
阳离子的原子核对阴离子的电子有吸引,阴离子的原子核对阳离子的电子也有吸引,这种引力叫静电引力.但是阴阳离子的两原子核不能无限制的接近,两个带正电荷的原子核当接近时会产生斥力,这种斥力叫做静电斥力.当两原子核到达一定距离(这个距离就是离子键键长)使静电引力=静电斥力时,就形成了离子键.
所以离子键是阴阳离子间的静电引力与静电斥力1年前查看全部
大家在问
- 1买本数学课本6.15元购买数学课本的数量和总价成什么比例?
- 2英语翻译
- 3(q889•湘潭三模)“北斗二号”地球卫星导航系统由少轨道、高轨道和同步卫星等组成,已知三种卫星少,少轨道卫星离地最近,
- 4sin(-兀/3)+2sin4兀/3+3sin2兀/3=?
- 5Cargo City
- 6全班有46人去划船,共乘12条船,其中大船坐5人,小船坐3人,每条船都刚好坐满,那么大 小船应是多少条全班有46人去划船
- 7烤鸡是fired chicken,为什么不是fire chicken呢
- 8电影从下午1:10开始放映,90分钟后结束,结束时是2:40.______.(判断对错)
- 9反比例函数y=一9k²/x(k为常数,k≠0)的图像位于
- 10理想运算放大器线性应用的条件是什么
- 11Generally speaking,twins have a great deal in___.(A all B pu
- 12一道高中英语试题What the old man ( )have a great effect on him.A doe
- 13He ahs won the first prize in the school painting competitio
- 14文言文翻译《欧阳修》就两句 “汝父为吏,常夜烛治官书,屡废而叹”“求其生而不得,则死者与我皆无敌”
- 15从1、3、5、7、9中任取3个数字,从2、4、6、8、0中任取2个数字,一共可以组成多少个没有重复的五位数