fe3o4中铁的氧化数是多少?氧化数
 sy28882022-10-04 11:39:544条回答
sy28882022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 梦醒5分 共回答了21个问题
梦醒5分 共回答了21个问题 |采纳率85.7%- fe3o4=FeO.Fe2O3即三分之一为+2,三分之二为+3
- 1年前
 fkueymsn 共回答了630个问题
fkueymsn 共回答了630个问题 |采纳率- 两个铁原子3价,一个铁原子2价。
- 1年前
 猪猪与我 共回答了38个问题
猪猪与我 共回答了38个问题 |采纳率- 铁的氧化数?????????????????????????????????
- 1年前
 风箫箫西 共回答了48个问题
风箫箫西 共回答了48个问题 |采纳率- Fe3O4=Fe2O3+FeO
四氧化三铁是三氧化二铁和氧化亚铁的混合物
下面的知道了吧 - 1年前
相关推荐
- 以重铬酸钾发测定铁矿石中铁含量,用0.02mol/L重铬酸钾滴定,设试样含铁以Fe2O3计,约为50%,
以重铬酸钾发测定铁矿石中铁含量,用0.02mol/L重铬酸钾滴定,设试样含铁以Fe2O3计,约为50%,
则试样称取量为多少克 一土静子1年前2
一土静子1年前2 -
 zhcqn 共回答了18个问题
zhcqn 共回答了18个问题 |采纳率88.9%滴定体积一般要求在20—40毫升范围内
K2Cr2O7——6Fe——3Fe2O3
1 3
0.02*20/1000 m*50%/159.69
m=(3*0.02*20/1000)/(1*50%/159.69)=3.83g
同样当V=40ml时,m=7.66g1年前查看全部
- 将铁、铝合金5.5g和足量盐酸反应,产生4.48L氢气(S.T.P)求:(1)合金中铁、铝的质量百分含量各是多少?(2)
将铁、铝合金5.5g和足量盐酸反应,产生4.48L氢气(S.T.P)求:(1)合金中铁、铝的质量百分含量各是多少?(2)反应后的溶液中需要加入多少升4mol/L的氢氧化钠溶液,才能使生成的沉淀全部是氢氧化亚铁?
 般若波1年前1
般若波1年前1 -
 1135 共回答了14个问题
1135 共回答了14个问题 |采纳率85.7%(1)设铁:xmol,铝:ymol
x+1.5y=4.48/22.4
56x+27y=5.5
解之得:
x=
y=1年前查看全部
- 将一含有杂质的铁粉10g 投入足量100g稀盐酸中(杂质不与盐酸反应)反应后过滤得滤液质量为105.4g,求铁粉中铁的质
将一含有杂质的铁粉10g 投入足量100g稀盐酸中(杂质不与盐酸反应)反应后过滤得滤液质量为105.4g,求铁粉中铁的质量分数.
 powerliujian1年前1
powerliujian1年前1 -
 风凌雪儿 共回答了11个问题
风凌雪儿 共回答了11个问题 |采纳率90.9%解题思路:发生反应:Fe+2HCl=FeCl2+H2↑,计算溶液质量增重,再根据方程式计算Fe的质量,进而计算Fe的质量分数.设铁粉中Fe的质量为m,则:
Fe+2HCl=FeCl2+H2↑ 溶液质量增重
56 54
m105.4g-100g=5.4g
故m=[56×5.4g/54]=5.6g
故铁粉中Fe的质量分数为[5.6g/10g]×100%=56%,
答:铁粉中铁的质量分数为56%.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的有关计算,利用差量法计算避免常规方法的繁琐,难度不大.1年前查看全部
- 某含铬Cr2O72- 废水用硫亚铁铵[FeSO4•(NH4)2 SO4•6H2O]处理,反应中铁元素
某含铬Cr2O72- 废水用硫亚铁铵[FeSO4•(NH4)2 SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到n molFeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质量为n(3x+1)mol
B.处理废水中Cr2O72- 的物质量为[nx/2]mol
C.反应中发生转移的电子数为1.5nx mol
D.在FeO•FeyCrxO3中3x=y niers1年前1
niers1年前1 -
 多多华 共回答了18个问题
多多华 共回答了18个问题 |采纳率88.9%解题思路:A.由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算;
B.反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
C.Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
D.根据失电子守恒计算.A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO•FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A正...
点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考高频考点,题目难度中等,注意原子守恒、电子守恒在计算中的应用,使计算简单化.1年前查看全部
- 铁矿石中铁含量的测定中甲基橙起什么作用?
 海角1191年前2
海角1191年前2 -
 adba3448 共回答了19个问题
adba3448 共回答了19个问题 |采纳率89.5%甲基橙是指示剂 它是检测溶液中的三价铁是否都转变成了二价铁 还原剂优先还原三价铁 如三价铁都被还原 就会还原指示剂 溶液就有红色变为无色 还原剂的选择有很多 氯化亚锡比较常用1年前查看全部
- 在40克密度为dg/cm^3的硫酸铁溶液中,含有1.4g铁离子,则此溶液中铁离子的物质的量浓度为
 shiwei123151年前2
shiwei123151年前2 -
 jldfxy01 共回答了25个问题
jldfxy01 共回答了25个问题 |采纳率84%40克密度为dg/cm^3的硫酸铁溶液,体积为40/1000*d升,1.4g铁离子=0.025摩尔,此溶液中铁离子的物质的量浓度=0.025*1000*d/40=0.625 (摩尔/升)1年前查看全部
- 奥氏体化过程中残留碳化物问题书上说珠光体中铁素体数量大大超过渗碳体数量,所以珠光体中铁素体向奥氏体转变刚完成时,平均碳浓
奥氏体化过程中残留碳化物问题
书上说珠光体中铁素体数量大大超过渗碳体数量,所以珠光体中铁素体向奥氏体转变刚完成时,平均碳浓度低于共析成分,所以,共析钢奥氏体刚形成时必有部分碳化物残留下来 这里不太懂啊 有点语焉不详 为什么铁素体转变完了就一定剩下碳化物了? 花骨朵儿20061年前1
花骨朵儿20061年前1 -
 ztailiu 共回答了26个问题
ztailiu 共回答了26个问题 |采纳率80.8%首先,奥氏体是由铁素体转变而来的,第二,奥氏体的溶解碳能力大大高于铁素体,第三,奥氏体中的碳是由碳化物溶解而来的,第四,只有当碳化物完全溶解后共析钢奥氏体中的平均碳浓度才是共析成分,第五,碳化物溶解是一个过程,需要时间,第六,铁素体转变成奥氏体是瞬间转变的同素异构体转变.当钢加热到奥氏体化温度后,铁素体瞬间转变成奥氏体,而渗碳体的完全溶解还需要一定的时间,所以共析钢奥氏体刚形成时必有部分碳化物残留.1年前查看全部
- 双相不锈钢是什么?双相不锈钢是在固溶体中铁素体相和奥氏体相各约占一半,一般较少相的含量至少也需要达到30%的不锈钢.与奥
双相不锈钢是什么?
双相不锈钢是在固溶体中铁素体相和奥氏体相各约占一半,一般较少相的含量至少也需要达到30%的不锈钢.与奥氏体不锈钢相比,双相不锈钢具有强度高,对晶间腐蚀不敏感和较好的耐点腐蚀和耐缝隙腐蚀的能力,其中优良的耐应力腐蚀是开发这种钢的主要目的.
因焊接冷却过程造成不平衡的相变,室温所得到的γ相数量在近缝区常具有低值.母材成分或Creq、Nieq对HAZ能否形成“健全”的δ-γ两相组织有重要影响.所谓“健全”组织是指不存在γ-γ或δ-δ相界.可用当量指数B来衡量.
与纯奥氏体不锈钢相比,双相不锈钢焊后具有较低的热裂倾向;与纯铁素体不锈钢相比,焊后具有较低的脆化倾向,且焊接热影响区粗化程度也较低,因而具有良好的焊接性.但双相不锈钢中因有较大比例铁素体存在,而铁素体钢所固有的脆化倾向,如475℃脆性,σ相析出脆化和晶粒粗化依然存在,
双相不锈钢选用合适的焊接材料不会发生焊接热裂纹和冷裂纹;双相不锈钢具有良好的耐应力腐蚀性能、耐点腐蚀性能、耐缝隙腐蚀性能及耐晶间腐蚀性能. gbmsky211年前1
gbmsky211年前1 -
 mao雨mao雪 共回答了14个问题
mao雨mao雪 共回答了14个问题 |采纳率85.7%相当不错的知识介绍~1年前查看全部
- (2008•揭阳二模)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行
(2008•揭阳二模)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和______(填字母).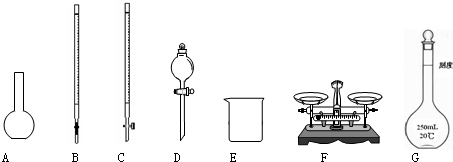
(2)写出步骤③中发生反应的离子方程式______.
(3)洗涤是洗去附着在沉淀上的______(写离子符号),洗涤沉淀的操作是______.
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g;再次加热并冷却室温称量其质量为m2g,且m1-m2=0.3,接下来的操作应当是______.
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为
×100%(W2−W1)g×
×112 160 250 25 a g .(列出算式,不需化简)
×100%(W2−W1)g×
×112 160 250 25 a g
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的.你认为甲学生的观点是否正确?______(填正确或错误);请说明理由:______. 语衡1年前1
语衡1年前1 -
 qzgyh99 共回答了16个问题
qzgyh99 共回答了16个问题 |采纳率87.5%解题思路:(1)根据称量、溶解、配制一定物质的量浓度的溶液、准确量取溶液等操作确定所需仪器;
(2)根据氯水能将FeCl2氧化生成FeCl3;
(3)根据溶液中含有氨水、氯化铵来确定离子;根据洗涤沉淀的方法;
(4)根据最后两次称得的质量差不超0.1g确定反应完全进行;
(5)氢氧化铁加热灼烧后生成氧化铁,坩埚质量是W1,坩埚与加热后固体总质量是W2,则氧化铁的质量为(W2-W1)g.氧化铁中铁元素的质量等于样品中铁元素的质量,进而计算铁元素的质量分数;
(6)根据FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3;(1)称量时需要天平、钥匙;
溶解时需要烧杯、玻璃棒;
配制一定物质的量浓度的溶液时需要量筒、烧杯、玻璃棒、胶头滴管、一定规格的容量瓶;
准确量取溶液需要酸式滴定管、洗耳球,
故答案为:C F G;
(2)氯水能将FeCl2氧化生成FeCl3,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)溶液中含有氨水、氯化铵,所以离子有:NH4+、Cl-、OH-;洗涤沉淀的方法是向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次,
故答案为:NH4+、Cl-、OH-;向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次;
(4)最后两次称得的质量差不超0.1g确定反应完全进行,
故答案为:继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超0.1g.
(5)铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×[112/160],样品中铁元素的质量(W2-W1)g×[112/160]×[250/25],样品中铁元素的质量分数
(W2−W1)g×
112
160×
250
25
a g×100%,
故答案为:
(W2−W1)g×
112
160×
250
25
a g×100%.
(6)因FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,仍可达到实验目的,
故答案为:正确;FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,对实验结果无影响.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题主要考查学生溶液的配制、对实验原理理解、对实验操作的评价、物质含量的测定、化学计算等,难度中等,需要学生具备扎实的基础知识与分析问题、解决问题能力.1年前查看全部
- Fe3O4中铁的化合价是几?
 爱走马路沿1年前7
爱走马路沿1年前7 -
 牵手为猪猪 共回答了19个问题
牵手为猪猪 共回答了19个问题 |采纳率78.9%Fe3O4可以写为FeO.Fe2O3
2个+3价1个+2价1年前查看全部
- 在Fe2(SO4)3和FeSO4组成的混合物中,经测定硫元素的质量分数为23%,则该混合物中铁元素的质量分数为_____
在Fe2(SO4)3和FeSO4组成的混合物中,经测定硫元素的质量分数为23%,则该混合物中铁元素的质量分数为______.
 小小老师1年前1
小小老师1年前1 -
 翻身的日子 共回答了17个问题
翻身的日子 共回答了17个问题 |采纳率100%解题思路:根据FeSO4和Fe2(SO4)3两物质的组成特点,可知混合物中硫元素与氧元素的质量比为1:2,混合物中硫元素的质量分数为23%,可计算出混合物中氧元素质量分数,进而可计算出该混合物中铁元素的质量分数.在FeSO4和Fe2(SO4)3组成的混合物中,硫元素与氧元素的质量比=32:(16×4)=1:2,由于混合物中硫元素的质量分数为23%,则混合物中氧元素的质量分数=23%×2=46%,该混合物中铁元素的质量分数为1-23%-46%=31%.
故答案为:31%.点评:
本题考点: 元素的质量分数计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 请你用相应的化学符号填空.(1)地壳中含量最多的元素______;(2)两个硫酸根离子______;(3)氯化亚铁中铁显
请你用相应的化学符号填空.
(1)地壳中含量最多的元素______;
(2)两个硫酸根离子______;
(3)氯化亚铁中铁显+2价
Cl2+2 Fe ;
Cl2+2 Fe
(4)3个甲烷分子______;
(5)保持氮气化学性质的最小粒子______. 大西洋深1年前1
大西洋深1年前1 -
 我曾经单翼 共回答了19个问题
我曾经单翼 共回答了19个问题 |采纳率100%解题思路:书写元素符号时,第一个字母要大写,第二个字母要小写;化学符号周围的数字表示不同的意义:符号前面的数字,表示原子、分子或离子个数;右上角的数字表示一个离子所带的电荷数;右下角的数字表示几个原子构成一个分子;元素正上方的数字表示元素的化合价.地壳中含量最多的元素是氧元素,一个硫酸根离子带两个单位的负电荷;氯化亚铁中铁显+2价表示
Cl2;一个甲烷分子是由一个碳原子和四个氢原子构成的;保持氮气化学性质的最小粒子是氮气分子,一个氮分子是由两个氮原子构成的.+2 Fe (1)地壳中含量最多的元素是氧元素,故答案为:O;
(2)符号前面的数字,表示离子个数,一个硫酸根离子带两个单位的负电荷,故答案为:2SO42-;
(3)元素正上方的数字表示元素的化合价,氯化亚铁中铁显+2价表示
+2
FeCl2,故答案为:
+2
FeCl2;
(4)符号前面的数字,表示分子个数,一个甲烷分子是由一个碳原子和四个氢原子构成的,故答案为:3CH4
(5)保持氮气化学性质的最小粒子是氮气分子,一个氮分子是由两个氮原子构成的,故答案为:N2点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本考点考查了化学式和离子符号的书写,元素符号、化学式、化学方程式等化学用语的书写是中考的重要考点之一,要加强练习,理解应用.本考点主要出现在选择题和填空题中.1年前查看全部
- 在PH>5的溶液中铁离子全部转化为氢氧化铁沉淀,为什么呢?
在PH>5的溶液中铁离子全部转化为氢氧化铁沉淀,为什么呢?
 塞外小猪被谋杀1年前3
塞外小猪被谋杀1年前3 -
 柠檬BAR 共回答了19个问题
柠檬BAR 共回答了19个问题 |采纳率89.5%学吧~不用管了~记住就行了~我给你简单说一说~
氢氧化铁沉淀以及氧化铁~它们与Fe3 结合的是OH-和O2-,而Fe3 溶液中的其实是与水结合的~也就是说他们络合的对象不同,自然颜色也不一样~以后你学到和硫氰根(SCN-)络合,显血红色,具体原因则要用晶体场理论来解释了~你应该还不需要吧?
简言之,就是和它络合的东西不一样~导致显示出来的整体颜色不一样~(你所认为的Fe3 其实是与水结合的哦)现在嘛~记住就行!固体红褐色~到溶液里了~就是黄色(如固体FeCl3是红褐色的,溶于水就是黄的了~而氢氧化铁不溶所以就仍然是红褐色咯~)
很无语~刚才网页错误~白打了这么多字!欢迎继续探讨~1年前查看全部
- 一种钢样品中铁的含量为98%,有同学提出:高温可以是钢中的炭变为co2,挥发掉,高温后钢样品的质量会减轻.可是他们将一定
一种钢样品中铁的含量为98%,有同学提出:高温可以是钢中的炭变为co2,挥发掉,高温后钢样品的质量会减轻.可是他们将一定量的钢样品高温后,发现质量反而增加了很多原因是什么?
 tqq65211年前3
tqq65211年前3 -
 gmhs007 共回答了15个问题
gmhs007 共回答了15个问题 |采纳率86.7%FE+O2生成FE3O4 需要一定想象力 至于二氧化碳是挥发掉但 生成的FE3O4比比CO2的质量大所以说刚的质量增加了 有时你不知能看一个条件化学需要想象力1年前查看全部
- (4道)8小时内1 赤铁矿中铁元素的质量分数为56%,球赤铁矿中三氧化二铁(Fe2O3)的质量分数.2 某硝酸铵(NH4
(4道)8小时内
1 赤铁矿中铁元素的质量分数为56%,球赤铁矿中三氧化二铁(Fe2O3)的质量分数.
2 某硝酸铵(NH4NO3)中样品中含氮元素质量分数为30%,求样品中硝酸铵的质量.
3 硫酸铜溶于水得到硫酸铜溶液,某硫酸铜溶液中Cu%=32%,求CuSO4%,H2O%
4 Fe(OH)2和Fe(OH)3的混合物中,已知O%=a%,求Fe% 天地会陈近南1年前1
天地会陈近南1年前1 -
 asia001 共回答了18个问题
asia001 共回答了18个问题 |采纳率77.8%1、Fe2O3中铁含量是70%,所以赤铁矿中Fe2O3的含量是:56%/70%=80%2、NH4NO3中N的含量是35%,所以……是:30%/35%=85.7%3、CuSO4中含铜量40%,同样求出CuSO4%=80%,所以H2O%=20%4、由于O和H的个数比都是1:1,则质量比就是...1年前查看全部
- 化学中铁元素什么时候用+3价什么时候用+2价 学得脑子好乱啊
化学中铁元素什么时候用+3价什么时候用+2价 学得脑子好乱啊
答案的内容要在初三范围内 不要太深奥哦 要不鄙人不懂嘀~— —|| f1harry1年前8
f1harry1年前8 -
 浮尘孤影 共回答了26个问题
浮尘孤影 共回答了26个问题 |采纳率96.2%首先+2价的叫亚铁,+3价的叫铁(也就是说它说的是XX化亚铁就是用+2价,说是XX化铁就用+3价);另外需要注意的是在置换反应中生成物只能是亚铁(具体为什么我也不知道,老师说的)(比如:Fe+CuSO4=FeSO4+Cu);最后要注意铁在氧气中燃烧生成的是Fe3O4,而不是氧化铁(可以看做是氧化铁与氧化亚铁的合成版.当然,只能是可以看做,但并不等于)
我今年也在读初三,不久就要中考了,一起加油吧!1年前查看全部
- 四氧化三铁中铁的化合价是多少?为什么?
 kiki09041年前1
kiki09041年前1 -
 jk281031311 共回答了18个问题
jk281031311 共回答了18个问题 |采纳率88.9%四氧化三铁是一种铁酸盐,即Fe2+Fe+3[Fe3+O4].在Fe3O4里,铁显两种价态,一个铁原子显+2价,两个铁原显+3价,所以说四氧化三铁可看成是由FeO与Fe2O3组成的化合物,可表示为FeO·Fe2O3,而不能说是FeO与Fe2O3组成的混合物.1年前查看全部
- 亚铁盐中铁的测定中重骆酸钾的消耗量
 唱歌4901年前1
唱歌4901年前1 -
 joy316 共回答了20个问题
joy316 共回答了20个问题 |采纳率95%重铬酸钾吧.
6Fe(NH4)2(SO4)2+K2Cr2O7+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+6(NH4)2SO4+7H2O1年前查看全部
- 1L 1摩尔/升的氯化铁溶液中铁离子数目为NA个 为什么是错的?
 呵呵氧气1年前1
呵呵氧气1年前1 -
 hxt331 共回答了14个问题
hxt331 共回答了14个问题 |采纳率92.9%在该溶液中Fe3+存在水解,水解成氢氧化铁,导致铁离子浓度降低,不足1mol/L1年前查看全部
- 如何确定化学式中铁元素的化合价
 kouneng1年前5
kouneng1年前5 -
 泡97 共回答了19个问题
泡97 共回答了19个问题 |采纳率94.7%比如Fe2O3
三氧化二铁
氧是-2
-2x3+2x铁的化合价=0
这样就能算出铁的化合价
但是特殊的背下来就好了
学习还是靠循序渐进的1年前查看全部
- 按要求计算下列各题(1)计算三氧化二铁中铁元素的质量分数.
按要求计算下列各题(1)计算三氧化二铁中铁元素的质量分数.
(2) 现在80g三氧化二铁,计算其中铁元素的质量.
(3)多少克三氧化二铁中含有40g铁元素?(精确到0.1)
(4)多少克氧化亚铁与80g三氧化二铁中含铁元素的质量相等?
 zhongming9471年前0
zhongming9471年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- Fe3O4中铁和氧的化合价为多少?为什么?
 lzl5261年前8
lzl5261年前8 -
 翠竹听涛 共回答了12个问题
翠竹听涛 共回答了12个问题 |采纳率83.3%把它换个表达方式你可能比较容易理解,Fe3O4可以表示为FeO·Fe2O3,在Fe3O4里,铁显两种价态,一个铁原子显+2价,两个铁原子显+3价,Fe3O4可看成是由FeO与Fe2O3组成的化合物,但并不是FeO与Fe2O3组成的混合物,它属于纯净物,这个千万不能混淆!1年前查看全部
- 有关化学中铁钉锈蚀条件探究的问题
有关化学中铁钉锈蚀条件探究的问题
铁钉锈蚀条件的探究中用到经煮沸迅速冷却的蒸馏水,为什么要迅速冷却? wcz671年前2
wcz671年前2 -
 bitbuguai 共回答了20个问题
bitbuguai 共回答了20个问题 |采纳率85%没有看原题,不清楚具体的意图,估计是减少冷却时间,从而减少氧气的溶解!1年前查看全部
- 氯化铁溶液中铁离子水解成氢氧化铁为什么不出沉淀?
 lgf1251年前2
lgf1251年前2 -
 w0lutengfei 共回答了19个问题
w0lutengfei 共回答了19个问题 |采纳率94.7%在氯化铁溶液中,铁离子水解成氢氧化铁时还会产生氢离子,于是氢离子、铁离子、氢氧化铁直接产生了一个微妙的平衡.
在这种水解平衡的条件下,氢氧化铁在产生的同时也在被氢离子溶解,所以不会观察到沉淀现象的.
但是,如果加入试剂打破这种平衡状态,比如少量氢氧化钠加入后会消耗氢离子,于是多余的氢氧化铁不会被溶解,那么就可以见到了沉淀.
而氯化铁溶液实际上是化学 水解平衡 的通例,向更远处关联,它跟各种平衡都有所关系,需要学习者自己体会把握了.1年前查看全部
- 高铁酸钠(Na2FeO4)是一种绿色环保高效的饮水消毒剂.高铁酸钠中铁元素的化合价为
 scyber1年前1
scyber1年前1 -
 rainxing 共回答了18个问题
rainxing 共回答了18个问题 |采纳率88.9%+61年前查看全部
- 测得某硫酸铁溶液中水分子中铁离子的个数比为100比1,则该溶液中溶质的质量分数?
测得某硫酸铁溶液中水分子中铁离子的个数比为100比1,则该溶液中溶质的质量分数?
要完整的分析过程 ami721年前1
ami721年前1 -
 直觉的三次方 共回答了15个问题
直觉的三次方 共回答了15个问题 |采纳率86.7%1L的同学,努力是必须的,不过要仔细审题这个是硫酸铁,不是硫酸亚铁.Fe2(SO4)3在水中电离,溶液中以Fe3+ 、SO42-存在这个其实可以看为100个H2O分子中有1个Fe3+200个H2O分子中有2个Fe3+,即200个H2O可以溶解1个Fe2(SO4)3...1年前查看全部
- 将11.7克某生铁放入足量的硫酸铜溶液中,完全反应后,共得到13.3克不溶物,求此生铁中铁的质量分数是多少
 xiaofang_loveyou1年前1
xiaofang_loveyou1年前1 -
 看尽繁华 共回答了18个问题
看尽繁华 共回答了18个问题 |采纳率88.9%设铁的质量为x
Fe+CuSO4===FeSO4+Cu~M代表质量差
解得x=11.2g
那么铁的质量分数=11.2/11.7*100%=95.73%1年前查看全部
- 为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO 4 •7H 2 O)]中铁元素的含量,某化学兴趣小组设计了两套实验
为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO 4 •7H 2 O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO 4 溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式______.
(2)下列滴定方式中,最合理的是______(夹持部分略去)(填字母序号).
(3)实验前,首先要准确配制一定物质的量浓度的KMnO 4 溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______(填仪器名称).
(4)某同学设计以原电池的形式实现Fe 2+ 至Fe 3+ 的转化,电解质溶液为稀硫酸,请写出负极的电极反应式______
方案二 将FeSO 4 转化为Fe 2 O 3 ,测定质量变化操作流程如下:
(3)步骤②中除用H 2 O 2 外还可以使用的物质是______.
(5)步骤②是否可以省略______,理由是______.
(6)步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示). 丢rr码的俗人1年前1
丢rr码的俗人1年前1 -
 83ny 共回答了13个问题
83ny 共回答了13个问题 |采纳率84.6%方案一:(1)酸性高锰酸钾具有强氧化性,将Fe 2+ 氧化为Fe 3+ ,被还原为Mn 2+ ,同时生成水,反应离子方程式为5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O;
故答案为:5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O;
(2)酸性高锰酸钾具有强氧化性,可以发生橡皮管,应盛放在酸式滴定管内,硫酸亚铁溶液呈酸性,应盛放在酸式滴定管内,故B最合适;
故答案为:B;
(3)精确配制一定物质的量浓度的KMnO 4 溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(4)原电池负极反应氧化反应,Fe 2+ 在负极放电生成Fe 3+ ,负极电极反应式为Fe 2+ -e - ═Fe 3+ ;
故答案为:Fe 2+ -e - ═Fe 3+ ;
方案二:
(3)步骤②加入有强氧化性试剂,能将Fe 2+ 全部氧化为Fe 3+ ,除用H 2 O 2 外还可以使用氯水等;
故答案为:氯水;
(5)Fe 2+ 与碱反应后不能保证Fe 2+ 全部转化为Fe 3+ ,加热不能得到纯净的Fe 2 O 3 ,故无法准确计算Fe的含量,故步骤②不能省略;
故答案为:不能,Fe 2+ 与碱反应后不能保证Fe 2+ 全部转化为Fe 3+ ,加热不能得到纯净的Fe 2 O 3 ,故无法准确计算Fe的含量;
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
故答案为:灼烧;
(7)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
ag×
112
160
10 =0.07ag;
故答案为:0.07a.1年前查看全部
- 用重铬酸钾法测定褐铁矿中铁含量,整个反应过程如何?定出测定过程中各反应的反应式
 等你忘了我是谁1年前1
等你忘了我是谁1年前1 -
 颓废的种子 共回答了22个问题
颓废的种子 共回答了22个问题 |采纳率81.8%(1)加入盐酸 氧化铁和盐酸的反应
(2)过量SnCl2 还原三价铁 Sn2++Fe3+---Fe2++Sn3+(没配平)
(3)多出来的SnCl2用Hgcl2氧化 这是个两部反应先是 HgCl2+SnCl2----Hg2Cl2(白色)+SnCl4 然后Hg2Cl2(白色)+SnCl2----Hg(黑色)+SnCl4 即出现黑色停止滴定
(4)指示剂:二苯磺酸钠和硫酸磷酸配在一起 然后就是重铬酸钾滴定二价铁的反应了.
差不多就这些了吧.呼呼.1年前查看全部
- 19G赤铁矿样品经试验测得,其中含有氧化铁9G,则该矿石中铁的质量分数是
 jj36682971年前1
jj36682971年前1 -
 贾伯 共回答了12个问题
贾伯 共回答了12个问题 |采纳率91.7%先求Fe元素的质量 9x 112/160=6.3g
因此矿石中Fe的质量分数为 6.3/19 x100%=33.2%1年前查看全部
- 某铁的氧化物的混合物中铁氧的质量比为21:8 求该混合物的可能组成
 aghast1年前1
aghast1年前1 -
 charlsezhang 共回答了16个问题
charlsezhang 共回答了16个问题 |采纳率75%FeO中m(Fe):m(O)=7:2=21:6
Fe2O3中m(Fe):m(O)=7:3=21:9
Fe3O4中m(Fe):m(O)=21:8
因为混合物中要含有含铁较多的氧化物和含铁较少的氧化物,或刚好为21:8的氧化物,所以有三种可能
1.FeO,Fe2O3 2.Fe3O4 3.FeO,Fe2O3 Fe3O41年前查看全部
- 大哥大,大姐大,请进!求含有Fe3O380%的赤铁矿中铁元素的质量分数.化学式Fe【小写2】O【小写3 】 80% 【谢
大哥大,大姐大,请进!
求含有Fe3O380%的赤铁矿中铁元素的质量分数.
化学式Fe【小写2】O【小写3 】 80% 【谢谢你们,但是我还有1题求助你们,我会加分的】【最后一题】有200千克含Fe3O4 70%的磁铁矿,①纯净的Fe3O4中铁的质量分数为( )②含Fe3O4 70%的磁铁矿石中铁的质量分数为 ( )③200千克含有Fe3O4 70%的磁铁矿石中含铁( )千克. 小老头家的小丫头1年前1
小老头家的小丫头1年前1 -
 大量2008 共回答了23个问题
大量2008 共回答了23个问题 |采纳率65.2%是Fe2O3吧?
Fe2O3中铁的质量分数为70%,赤铁矿中为70%×80%=56%1年前查看全部
- FeS2中铁元素和硫元素各几价?
 董星辰1年前1
董星辰1年前1 -
 Tiu_LAND 共回答了25个问题
Tiu_LAND 共回答了25个问题 |采纳率88%Fe+2价 S-1价1年前查看全部
- 24.4g锌和铁的混合物与足量稀硫酸反应,在标准状况下产生8.96LH2,求混合气体中铁的百分含量
 hhypd1年前1
hhypd1年前1 -
 xiaoqi19458 共回答了14个问题
xiaoqi19458 共回答了14个问题 |采纳率71.4%设Fe的物质的量为x Zn的物质的量为Y
Fe+H2SO4=FeSO4+H2
1 1
x x
Zn+H2SO4=ZnSO4+H2
1 1
y y
则
56x+65y=24.4
x+y=8.96/22.41年前查看全部
- 有一标准Fe2+溶液,浓度为6μg.cm-3,有一Fe2+的待测液体试样,在同一条件下测得吸光度为0.510,求试样中铁
有一标准Fe2+溶液,浓度为6μg.cm-3,有一Fe2+的待测液体试样,在同一条件下测得吸光度为0.510,求试样中铁的含量.
 kwan1631年前1
kwan1631年前1 -
 伤说不出 共回答了20个问题
伤说不出 共回答了20个问题 |采纳率100%缺少条件,没有给出标准溶液的吸光度值,给出以后,本题非常简单,根据朗伯比耳定律(吸光度与浓度成正比)计算即可.1年前查看全部
- 金属铁中铁元素化合价
 碎昔人生1年前1
碎昔人生1年前1 -
 千里带刀 共回答了18个问题
千里带刀 共回答了18个问题 |采纳率94.4%铁:正三价 亚铁:正二价1年前查看全部
- 化学题(铁镁合金中铁含量的测定)
化学题(铁镁合金中铁含量的测定)
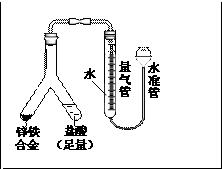
若称得铁镁合金的质量为0.080g,量气管中初读数为1.00ml,末读数为45.80ml(已折算为标准状况),则合金中铁的百分含量为_____(精确到0.01%)
70.00%
 喝醉的耳朵1年前1
喝醉的耳朵1年前1 -
 5121082 共回答了19个问题
5121082 共回答了19个问题 |采纳率89.5%V(H2)=45.80ml-1.00mL=44.8mL
n(H2)=44.8mL/22.4L/mol=0.002mol
Mg +2HCl =MgCl2 +H2
1 1
X X
Fe +2HCl =FeCl2 +H2
1 1
Y Y
24X+56Y=0.080g
X+Y=0.002mol
解得X= 0.001mol Y=0.001mol
铁的百分含量=56Y/0.080=56*0.001/0.080=70%1年前查看全部
- 在化学式中铁离子 铁原子 亚铁离子怎样区分
 FancyOne1年前1
FancyOne1年前1 -
 jingzhouxue 共回答了20个问题
jingzhouxue 共回答了20个问题 |采纳率80%铁离子 铁原子 亚铁离子的区别:主要是化合价不一样
1、铁离子,Fe3+,是三价的,就是说外层电子缺了三个
2、铁原子,Fe,是0价的,单质铁中含有的都是铁原子
3、亚铁离子,Fe2+,是二价的
不知你问的是不是这个意思?!1年前查看全部
- 四氧化三铁中铁元素的化合价该如何计算?
 半勺汤1年前2
半勺汤1年前2 -
 wanglt1026 共回答了15个问题
wanglt1026 共回答了15个问题 |采纳率100%Fe4O3是由Fe2O3和FeO组成的,是二价铁和三价铁的平均化合价8/31年前查看全部
- 铁在自然界中发布较广,在地壳里所含的元素中铁的含量占第 位,在地壳所含的金属元素中铁的含量仅次于 .
 13808865651hao1年前1
13808865651hao1年前1 -
 neucqy 共回答了22个问题
neucqy 共回答了22个问题 |采纳率90.9%4
铝1年前查看全部
- 用化学式填空:最轻的气体:______;地壳中含量最高的金属元素:______;氧化亚铁中铁元素显正二价:+2FeO+2
用化学式填空:最轻的气体:______;地壳中含量最高的金属元素:______;氧化亚铁中铁元素显正二价:
O+2 Fe ;2个钠离子:______;保持水的化学性质的最小粒子______.
O+2 Fe  没想到我如此冷静1年前1
没想到我如此冷静1年前1 -
 hanyajuande 共回答了13个问题
hanyajuande 共回答了13个问题 |采纳率84.6%解题思路:本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.最轻的气体是氢气,氢气是由氢分子构成的,每个氢分子是由2个氢原子构成的,故氢分子表示为:H2.
地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素,其元素符号为:Al.
由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化亚铁中铁元素显正二价可表示为:
+2
FeO.
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故2个钠离子可表示为:2Na+.
水是由水分子构成的,水分子是保持水的化学性质的最小粒子,水分子表示为:H2O;
故答案为:H2;Al;
+2
FeO;2Na+;H2O;点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.1年前查看全部
- (2014•抚州二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元
 (2014•抚州二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(2014•抚州二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(1)从化学元素与人体健康的角度考虑,我们应选用铁锅还是铝锅?______,为什么?______.
(2)废铁锅片中铁单质的质量分数为______.(结果保留到0.1%)
(3)所得溶液中所含溶质的化学式为______.
(4)计算溶液中硫酸铁的质量.(要求写出计算过程) shirly40801年前1
shirly40801年前1 -
 乃几嘎 共回答了22个问题
乃几嘎 共回答了22个问题 |采纳率95.5%解题思路:铁元素是人体必需的营养元素之一,使用铁锅可以为人体提供铁元素,从而促进人体健康;
氧化铁和稀硫酸反应生成硫酸铁和水,铁和稀硫酸反应生成硫酸亚铁和氢气;
根据稀硫酸的质量、生成氢气的质量可以计算铁、硫酸铁的质量,进一步可以计算废铁锅片中铁单质的质量分数和溶液中硫酸铁的质量.(1)从化学元素与人体健康的角度考虑,我们应选用铁锅,这是因为使用铁锅能够为人体提供铁元素,从而促进人体健康.
故填:铁锅;能够为人体补充铁元素.
(2)设铁的质量为x,
由图中可知,生成氢气的质量是1.0g,
Fe+H2SO4═FeSO4+H2↑,
56 2
x 1.0g
[56/x]=[2/1.0g],
x=28g,
废铁锅片中铁单质的质量分数为:[28g/33g]×100%=84.8%,
答:废铁锅片中铁单质的质量分数为84.8%.
(3)所得溶液中所含溶质是硫酸亚铁和硫酸铁,化学式分别是FeSO4、Fe2(SO4)3.
故填:FeSO4、Fe2(SO4)3.
(4)设溶液中硫酸铁的质量为y,
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,
294 400
18.75g×39.2% y
[294/18.75g×39.2%]=[400/y],
y=10g,
答:溶液中硫酸铁的质量为10g.点评:
本题考点: 根据化学反应方程式的计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- 用化学用语填空(1)2个铵根离子______;(2)硫酸分子______;(3)写出氯化铁的化学式并标出该化合物中铁元素
用化学用语填空
(1)2个铵根离子______;(2)硫酸分子______;(3)写出氯化铁的化学式并标出该化合物中铁元素的化合价
Cl3+3 Fe (4)地壳中含量最多的元素______;(5)两个氢氧根离子______;(6)氧化铜的化学式______;(7)氨气分子______;(8)保持氮气化学性质的最小粒子______.(9)氯化亚铁______;(10)氧化铁______;(11)氢氧化钙______;(12)硫酸铜______;(13)碳酸钾______.
Cl3+3 Fe  yidianjiemo1年前1
yidianjiemo1年前1 -
 qaz1314123 共回答了14个问题
qaz1314123 共回答了14个问题 |采纳率100%解题思路:本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.(1)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故2个铵根离子可表示为:2NH4+.
(2)由分子的表示方法:正确书写物质的化学式,由分子构成的物质,其化学式能表示一个分子,硫酸分子可表示为:H2SO4.
(3)元素的化合价的正确标法是在元素符号或原子团符号的正上方标明化合价的种类和价目,氯化铁中铁元素的化合价为+3价,符号为
+3
FeCl3
(4)地壳中含量最多的元素是氧元素,其元素符号为:O.
(5)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.但氢氧根离子是由多个原子组成的离子,整体带1个单元位的负电荷,表示为OH-,若表示多个该离子,就在其元素符号前加上相应的数字,所以2个氢氧根离子答案为2OH-;
(6)铜的化合价为+2;氧的化合价为-2,故氧化铜的化学式为:CuO;
(7)根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,因此氨气分子表示为:NH3;
(8)氮气是由氮分子构成的,保持氮气化学性质的最小粒子是氮分子,其分子符号为:N2.
(9)在氯化亚铁中,铁元素显+2价,氯元素显-1价,故氯化亚铁的化学式为:FeCl2;
(10)氧化铁是由显+3价的铁元素和显-2价的氧元素组成的,根据化合价的原则,其化学式可表示为:Fe2O3;
(11)钙元素的化合价为+2,氢氧根的化合价为-1,氢氧化钙的化学式为:Ca(OH)2;
(12)硫酸铜中铜元素显+2价,硫酸根显-2价,其化学式为:CuSO4.
(13)碳酸钾是由显+1价的钾元素和显-2价的碳酸根组成的,根据化合价原则,其化学式可表示为:K2CO3;
故答案为:(1)2NH4+;(2)H2SO4;(3)
+3
FeCl3;(4)O;(5)2OH-;(6)CuO;(7)NH3;(8)N2;(9)FeCl2;(10)Fe2O3;(11)Ca(OH)2;(12)CuSO4;(13)K2CO3点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.1年前查看全部
- 某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀
某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到nmol FeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B.处理废水中Cr2O72-的物质的量为[nx/2]mo1
C.反应中发生转移的电子的物质的量为6nx mol
D.在FeO•FeyCrxO3中3x=y 丝巾1年前1
丝巾1年前1 -
 sll6886 共回答了17个问题
sll6886 共回答了17个问题 |采纳率82.4%解题思路:A.由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算;
B.反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
C.Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
D.根据失电子守恒计算.A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO•FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A正确;
B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为[nx/2]mol,故B正确;
C.得到nmolFeO•FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,故C错误;
D、FeO•FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,故D正确.
故选C.点评:
本题考点: 氧化还原反应的计算;氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,注意原子守恒、电子守恒在计算中的应用,使计算简单化.1年前查看全部
- 用适当溶液吧3.31g某铁矿石溶解,加入过量碱溶液,烧灼生成的沉淀,的2.4gFe2O3,已知铁矿石中铁的氧化物
用适当溶液吧3.31g某铁矿石溶解,加入过量碱溶液,烧灼生成的沉淀,的2.4gFe2O3,已知铁矿石中铁的氧化物
质量分数位70%.计算(1)铁矿石中铁的质量分数(2)铁矿石中铁的氧化物的化学式 henryjx1年前1
henryjx1年前1 -
 篮球杰 共回答了27个问题
篮球杰 共回答了27个问题 |采纳率96.3%(1)Fe2O3有2.4克,铁元素有1.68g,所以其质量分数为1.68/3.31=50.8%
(2)铁氧化物有3.31*70%=2.317g,而铁有1.68g,所以铁约占72.5%,故应是Fe3O41年前查看全部
- 用化学用语填空:(1)空气中含量最多的气体______;(2)2个亚铁离子______(3)氧化铁中铁元素的化合价+3F
用化学用语填空:
(1)空气中含量最多的气体______;
(2)2个亚铁离子______
(3)氧化铁中铁元素的化合价
2O3+3 Fe .
2O3+3 Fe
(4)写出符号“4NO2”中数字表示的含义:
①“4”表示______;
②“2”表示______. XMX77585211年前1
XMX77585211年前1 -
 ww专用ee沙发 共回答了23个问题
ww专用ee沙发 共回答了23个问题 |采纳率95.7%解题思路:(1)空气中含量最多的气体是氮气.
(2)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字.
(3)化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后.
(4)①标在分子符号前面的数字表示分子的个数.
②标在化学式中元素右下角的数字表示一个分子中所含原子的数目.(1)空气中含量最多的气体是氮气,氮气属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为:N2.
(2)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故2个亚铁离子可表示为:2Fe2+.
(3)氧化铁中氧元素显-2价,铁元素显+3价;由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化铁中铁元素的化合价为+3价可表示为:
+3
Fe2O3.
(4)①标在分子符号前面的数字表示分子的个数,“4NO2”中“4”表示二氧化氮分子的个数为4.
②标在化学式中元素右下角的数字表示一个分子中所含原子的数目,4NO2中的“2”表示1个二氧化氮分子中含有2个氧原子.
故答案为:(1)N2;(2)2Fe2+;(3)
+3
Fe2O3;(4)①二氧化氮分子的个数为4;②1个二氧化氮分子中含有2个氧原子.点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题难度不大,主要考查同学们对常见化学用语(分子符号、化学式、化合价、离子符号等)的书写和理解能力.1年前查看全部
- Fe的价态问题我想知道,铁在不同的常见化合物中各显几价,怎么制得的..(比如硫酸铁,等等)FeCl2 和FeCl3 中铁
Fe的价态问题
我想知道,铁在不同的常见化合物中各显几价,怎么制得的..(比如硫酸铁,等等)
FeCl2 和FeCl3 中铁各是2价和3价,这是怎么制得的呢? 卧室君囧1年前1
卧室君囧1年前1 -
 nkfw2698 共回答了20个问题
nkfw2698 共回答了20个问题 |采纳率95%铁单质0价,化合物中有+2,+3,+3价更稳定,而Fe3O4实际上是Fe(FeO2)2,其中Fe的价态可以看做是+2,+3,
FeCl2可由铁和盐酸反应制得,FeCl3可由铁与氯气反应得到,或是由FeCl2与cl2反应得到1年前查看全部
- 四氧化三铁中铁的化合价为三分之八?不是只有+2和+3吗
 生命的砝码1年前3
生命的砝码1年前3 -
 zcm968 共回答了17个问题
zcm968 共回答了17个问题 |采纳率94.1%铁的化合价没有三分之八的说法,四氧化三铁中铁的化合价只有+2价,+3价.1年前查看全部
- 有12g赤铁矿的样品经分析化验检测地其中汗三氧化二铁,质量为9.6g,求赤铁矿中铁元素的质量分数.其中含三氧化二铁(Fe
有12g赤铁矿的样品
经分析化验检测地其中汗三氧化二铁,质量为9.6g,求赤铁矿中铁元素的质量分数.
其中含三氧化二铁(Fe₂O₃) 幽冥妖蝶1年前1
幽冥妖蝶1年前1 -
 水果木斯里 共回答了25个问题
水果木斯里 共回答了25个问题 |采纳率84%先求铁元素质量 已知Fe2O3有9.6g 那么含铁为
9.6x 112/160=6.72g 也就是赤铁矿12g中含6.72g铁元素 所以质量分数为6.72/12=56%1年前查看全部
大家在问
- 1小林和他爸爸周日去钓鱼,他在亲近大自然的同时还观察到爸爸在钓鱼前要“试漂”来确定铅坠(铅坠由合金
- 2一列客车长100米,一列货车长310米,两列车在平行的轨道上同向行驶,客车与货车的速度之比是4比3,如果客车...
- 3The weather in South China __ are hot and rainy at this time
- 4一个数改写成用亿作单位并保留两位小数约是2.85亿,改写成用万作单位的数约是28462万。这个数最大是多少?
- 5英语翻译keep one's balanceat the back of
- 656分之1+72分之1+90分之1+110分之1+132分之1+156分之1+182分之1=
- 7函数y=2sinx+1的值域是
- 8请用语言乏味造句
- 9若定义运算a⊗b=b,a≥ba,a<b,则函数f(x)=x⊗(2-x)的值域是______.
- 10他放学在四点的英文His school end at 4 o'clock .我那样写可以么?
- 11this afternoon前用什么介词
- 12迈克尔逊干涉试验中如何用干涉条纹测出单色光的波长?
- 13如何使植物细胞的细胞膜涨破
- 14我是专程来看你的 I came here _____ ____ _____ you
- 15现有以下实验仪器,请按要求填空: (1)仪器⑤的名称是 _________ ;配制一定质量分数的氯化钠溶液,以上仪器需用
