气体对液体沸点的影响气压增大,沸点( ),气压减小,沸点( )那么:1、在高山上,用普通的锅难以将饭烧熟,原因 :A.海
 恋上西洞庭2022-10-04 11:39:541条回答
恋上西洞庭2022-10-04 11:39:541条回答气压增大,沸点( ),气压减小,沸点( )
那么:1、在高山上,用普通的锅难以将饭烧熟,原因 :
A.海拔高、气压低,液体沸点低
.B.海拔高、气压低,液体沸点高

已提交,审核后显示!提交回复
共1条回复
 樟树下 共回答了22个问题
樟树下 共回答了22个问题 |采纳率90.9%- 气压增大,沸点(升高),气压减小,沸点(降低)
在高山上,用普通的锅难以将饭烧熟,原因 :
A.海拔高、气压低,液体沸点低 - 1年前
相关推荐
- 在压强为1.01*105pa,温度为300度时,有1mol某气体A发生如下反应:2A(g)=xB(g)+C(g),当反应
在压强为1.01*105pa,温度为300度时,有1mol某气体A发生如下反应:2A(g)=xB(g)+C(g),当反应达到平衡时,平衡混合气体中含A体积分数为60%,混合气体的总质量为46g,体积为64L.求;
1)平衡后混合气体的平均相对分子质量
2)平衡后已转化的A的物质的量
3)求x的值 Lonely-Dancer1年前1
Lonely-Dancer1年前1 -
 57201747 共回答了15个问题
57201747 共回答了15个问题 |采纳率86.7%1)根据题意,非标准状况下混合气体的温度T非=573 K,体积V非=64 L,转化为标准状况下的体积V标,由PV=nRT得:V标=(T标/T非)×V非=(273/573)×64 L = 30.5 L.则混合气体的物质的量n=(30.5/22.4)mol=1.36 mol,
设平衡时,已转化的A的物质的量为a mol,依题意:
2A(g)= xB(g)+ C(g)
起始/mol 1 0 0
变化/mol a xa/2 a/2
平衡/mol 1-a xa/2 a/2
[(1-a)/1.36]×100%=60%
a=0.184
即平衡后已转化的A的物质的量为0.184 mol.
(2)由(1-a)+xa/2+a/2=1.36,a=0.184,可计算得x=5.1年前查看全部
- doc某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几种.将X通过适量的氯水时,
 serenehe1年前3
serenehe1年前3 -
 qq1019 共回答了21个问题
qq1019 共回答了21个问题 |采纳率90.5%CO2没反应
SO2使氯水褪色
HCL没反应
HBR使氯水变色,产生HCL和BR2,使溶液呈橙色1年前查看全部
- 要除去密闭容器里空气中的氧气 ,得要较为 纯净的氮气.而不混入其他气体,可以选用的课燃物最好是?
要除去密闭容器里空气中的氧气 ,得要较为 纯净的氮气.而不混入其他气体,可以选用的课燃物最好是?
A硫 B铁丝 C红磷 D木炭 ruby281年前1
ruby281年前1 -
 redstone2001 共回答了15个问题
redstone2001 共回答了15个问题 |采纳率93.3%C 红磷1年前查看全部
- 定压的绝热压缩使气体温度升高是否存在焓变,
 11235831年前2
11235831年前2 -
 欧阳逍遥 共回答了18个问题
欧阳逍遥 共回答了18个问题 |采纳率94.4%在工程热力学理论中,定压过程与绝热过程是不同的两种过程,不是一回事,不能混为一谈.绝热压缩或膨胀过程熵不变,即等熵过程,但工质内的焓有变化.定压过程(等压过程)容积随温度变化,有焓变.1年前查看全部
- 增大压强,平衡向气体体积减少的方向移动
增大压强,平衡向气体体积减少的方向移动
减小体积,平衡想体积增大的方向移动,矛盾, lulauugic1年前4
lulauugic1年前4 -
 伺服马达 共回答了19个问题
伺服马达 共回答了19个问题 |采纳率84.2%当压强增大时,为了使反应平衡,就拿2摩尔二氧化硫与1摩尔氧气生成2摩尔三氧化硫的反应做例子,当你增大压强时,为了使反应平衡,那么就必须使反应向生成三氧化硫的方向进行(也就是向气体体积减小的方向进行),以减小总体积使与外界压强一样,达到平衡,因为如果再向气体体积增大的方向移动就永远不可能平衡了;反之,减小体积时……(自己推吧,我相信你)
注:仅供参考,有可能不对,因为这句话在一开始我也不大明白,现在还行;你结合资料看看.1年前查看全部
- 气体除杂的问题可能含有CO,O2,CO2的混合气体,想要验证混合气体里是否一定含有CO,实验过程如下:先后通入澄清石灰水
气体除杂的问题
可能含有CO,O2,CO2的混合气体,想要验证混合气体里是否一定含有CO,实验过程如下:
先后通入澄清石灰水,氢氧化钠溶液,浓硫酸,加热的铜,加热的氧化铜,澄清石灰水.
请为什么要按照这样的顺序?分别怎么除去其他气体的干扰? 痴迷于风1年前2
痴迷于风1年前2 -
 陈霜晓 共回答了17个问题
陈霜晓 共回答了17个问题 |采纳率76.5%通入澄清石灰水:证明是否含有CO2,也除去部分的CO2
氢氧化钠溶液:完全除去CO2
浓硫酸:把前面步骤产生的水蒸气除掉
加热的铜:除去O2 2Cu+O2=2CuO
加热的氧化铜:检验是否有CO CuO+CO=Cu+CO2
澄清石灰水:如变浑浊,则说明有CO,若无明显现象,则说明无CO1年前查看全部
- 气体除杂的问题(需要详尽解释)既可除去CO2中所含的杂质气体HCl和水蒸气,又可除去H2中所含的杂质气体HCl和水蒸气,
气体除杂的问题(需要详尽解释)
既可除去CO2中所含的杂质气体HCl和水蒸气,又可除去H2中所含的杂质气体HCl和水蒸气,则可选用最合适的试剂组是………………………………………………………………………………( )
(A)碳酸钠溶液和浓硫酸 (B)碳酸钠溶液和氢氧化钠溶液
(C)饱和碳酸氢钠溶液和浓硫酸 (D)饱和碳酸氢钠溶液和氢氧化钠溶液
饱和碳酸氢钠溶液好像不能出去H2中的HCl吧
饱和碳酸氢钠溶液好像不能除去H2中的HCl吧
碳酸钠溶液能不能洗气呢?! 永远的阿曼尼1年前3
永远的阿曼尼1年前3 -
 竹子林下的泉水 共回答了17个问题
竹子林下的泉水 共回答了17个问题 |采纳率100%就是呀!
HCL极易溶于水!用饱和碳酸氢钠可以初去HCL但会生成CO2!所以第一个混合气体能用C,第二组就不能了
可能题有问题!1年前查看全部
- :NO2和NO混合气体体积为22.4L(标准气压),两种气体体积分别为多少?
 luckios1年前4
luckios1年前4 -
 桑梓云海 共回答了17个问题
桑梓云海 共回答了17个问题 |采纳率88.2%……
题目不完整,没法算,任意比例都可以的1年前查看全部
- NAOH不能干燥HCL 不是不能干燥气体么
NAOH不能干燥HCL 不是不能干燥气体么
可它不是气体啊 不懂饿..... 芯伶hana1年前6
芯伶hana1年前6 -
 rongrongzhu 共回答了20个问题
rongrongzhu 共回答了20个问题 |采纳率95%NAOH不能干燥HCL
发生酸碱中和反应
HCL标准状态下是气态
我们说的盐酸是HCL的水溶液1年前查看全部
- 一个隔热容器中间一个隔热隔板,左右两边气体一样隔板可以无摩擦滑动
一个隔热容器中间一个隔热隔板,左右两边气体一样隔板可以无摩擦滑动
右边气体有一电热丝通电一小会电气体膨胀了,隔板左移,右边气压强大了小了 rnss1年前1
rnss1年前1 -
 一直记得绝对不忘 共回答了10个问题
一直记得绝对不忘 共回答了10个问题 |采纳率100%隔板无摩擦滑动,当隔板不动时,左右两边压力相等.左边属于绝热系统,外界对气体所做的功等于气体内能增加,温度升高,PV=nRT,体积减小,温度增加,其他参数不变,则左边压力增大,右边压力增大.1年前查看全部
- 在标准状况下,1120mL某气体的质量为1.60g,则该气体的相对分子质量为多少?
 路行者1年前1
路行者1年前1 -
 凌蓁儿 共回答了27个问题
凌蓁儿 共回答了27个问题 |采纳率92.6%标准状况下,Vm=22.4mol/l,由题可知
n=v/Vm
=1120ml/(22.4mol/l)
=0.05mol
相对分子质量M=m/n
=1.6g/0.05mol
=8g/mol1年前查看全部
- 用排水法测量气体体积时是否要算入玻璃管中的液体 为什么
 幸福的勺子1年前1
幸福的勺子1年前1 -
 有只猫 共回答了14个问题
有只猫 共回答了14个问题 |采纳率100%解题中都不算的,一个是因为难算,一个是因为误差比较小(玻璃管内径要小).但我觉得有误差,会使测得体积偏小,应该等冷却后拿掉玻璃管并让其中水流入量筒再读数.1年前查看全部
- 将一定质量的铜溶于80ml 13.5mol/l 的浓HNO3中,待完全溶解后收集到气体6.72L(标准状况),并得到溶液
将一定质量的铜溶于80ml 13.5mol/l 的浓HNO3中,待完全溶解后收集到气体6.72L(标准状况),并得到溶液中c(H+)=1mol/L,假设反应后溶液的体积仍为80ml,试计算:
a 被还原的硝酸的物质的量
b 铜的质量最多是多少 一万个理由我爱你1年前1
一万个理由我爱你1年前1 -
 hbhzzh 共回答了18个问题
hbhzzh 共回答了18个问题 |采纳率88.9%a.气体(NO,NO2)的物质的量为0.3mol,利用氮守恒可知被还原的硝酸的物质 的量为0.3mol
当然,如果你不喜欢这么做你也可以选择列方程
消耗了1mol的H+,产生0.3mol气体 根据离子方程式(设与浓硝酸反应的Cu为x,与稀硝酸反应的Cu为y)
Cu+4H(+)+2NO3(-)=Cu(2+)+2NO2↑+ 2H2O
3Cu + 8H+ + 2NO3- ====3Cu2+ + 2NO↑+ 4H2O
列出4x+8/3y=1,2x+2/3y=0.31年前查看全部
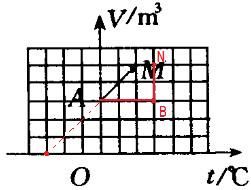
- 图11给出了一定质量的理想气体的V-t图,由状态M到状态A,气体的压强保持不变;从状态A开始保持体积不变,
图11给出了一定质量的理想气体的V-t图,由状态M到状态A,气体的压强保持不变;从状态A开始保持体积不变,
如图给出了一定质量的理想气体的V-t图,由状态M到状态A,气体的压强保持不变;从状态A开始保持体积不变,而使压强增加到原来的2倍,然后保持气体的温度不变;到达状态N,状态N与M体积相同,在图中画出上述状态变化过程及N点的位置,并计算M态与N态的压强之比pM:pN=

 舞儿飞雪1年前1
舞儿飞雪1年前1 -
 wangtongdro 共回答了20个问题
wangtongdro 共回答了20个问题 |采纳率90%1年前查看全部
- 白送分咯在80gCO?和O?的混合气体中,经分析含碳元素的质量分数为25%,则混合物中氧气所占质量分数是________
白送分咯
在80gCO?和O?的混合气体中,经分析含碳元素的质量分数为25%,则混合物中氧气所占质量分数是__________
在80gCO2和O2的混合气体中,经分析含碳元素的质量分数为?是 15%,则混合物中氧气所占质量分数是__________ 云婆婆1年前1
云婆婆1年前1 -
 suhao000 共回答了18个问题
suhao000 共回答了18个问题 |采纳率94.4%C在CO2中的质量分数是12/44=3/11
因为在很和气体中C占了25%
所以CO2占了25/(3/11)%=91.67%
即O2占了100%-91.67%=8.33%
你打错了的话,C占了15%
那么设CO2占了x
即x*(3/11)=15%
即x=55%
所以氧气占了(100-55)%=45%1年前查看全部
- 在标准状况下1mol的气体有多少个分子?
 云来云起1年前1
云来云起1年前1 -
 liwei0710 共回答了18个问题
liwei0710 共回答了18个问题 |采纳率94.4%任何情况下1mol气体都有NA即阿佛加德罗常数个分子,6.02*10^23是个约数.1年前查看全部
- 向200ml18mol/L浓硫酸中加入3.84克的铜,生成的气体在标准状况下的体积为多少毫升
 swangen1年前3
swangen1年前3 -
 tigerwoods16 共回答了15个问题
tigerwoods16 共回答了15个问题 |采纳率93.3%Cu + 2 H2SO4 == CuSO4 + SO2 + 2H2O
1 2 1 2
0.06 mol 3.6 mol 0.06 mol
所以硫酸过量,假设铜是完全反应,消耗0.12 mol硫酸后,
硫酸浓度大约还有17 mol/L,所以还是浓硫酸,故可以认为铜是完全反应
(如果浓硫酸变为稀硫酸,就不能再溶解Cu了,所以这一步是必须的)
所以生成SO2是 0.06 mol ,体积1.344 L1年前查看全部
- 标准状况下,A,B两种气态烷烃的混合气体的质量为9.8g,体积为7.84L,相对分子质量A
 fairy_韩雪1年前1
fairy_韩雪1年前1 -
 feelingzdj 共回答了17个问题
feelingzdj 共回答了17个问题 |采纳率94.1%混合气体的物质的量n=V/Vm=7.84L/22.4L/mol=0.35mol
混合气体的平均摩尔质量=m/n=9.8g/0.35mol=28g/mol
则混合气体中一种烷烃的相对分子质量小于28、一种相对分子质量大于28,相对分子质量A1年前查看全部
- 同温同压下,含相同原子数的下列气体,密度最大的是( )
同温同压下,含相同原子数的下列气体,密度最大的是( )
A. SO2
B. CO2
C. HCl
D. CH4 jade土拨鼠1年前1
jade土拨鼠1年前1 -
 沃野榆梅 共回答了15个问题
沃野榆梅 共回答了15个问题 |采纳率86.7%解题思路:同温同压下,气体摩尔体积相等,根据ρ=
知,气体的摩尔质量越大,其密度越大,据此分析解答.M Vm 二氧化硫的摩尔质量是64g/mol、二氧化碳的摩尔质量是44g/mol、氯化氢的摩尔质量是36.5g/mol、甲烷的摩尔质量是16g/mol,同温同压下,气体摩尔体积相等,根据ρ=
M
Vm知,气体的摩尔质量越大,其密度越大,与气体的分子数无关,摩尔质量最大的是二氧化硫,则其密度最大的是二氧化硫,
故选A.点评:
本题考点: 阿伏加德罗定律及推论.
考点点评: 本题考查了阿伏伽德罗定律及其推论,明确密度与摩尔质量的关系是解本题关键,相同条件下,气体密度只与摩尔质量有关,与其质量、分子数、体积都无关,题目难度不大.1年前查看全部
- 气体固体液体三者的溶点沸点分别是指什么?
气体固体液体三者的溶点沸点分别是指什么?
甲烷的沸点为-10.熔点为-180.是指什么? 晶莹的心1年前5
晶莹的心1年前5 -
 lt1979 共回答了24个问题
lt1979 共回答了24个问题 |采纳率87.5%首先,气体固体液体的状态不一样,气体的温度是在它的沸点之上的,液体的温度是在它的熔点之上沸点之下的,固体的温度是在它的熔点之下的,所以当一个物体的温度在不同的范围内是有不同的状态的,而熔点沸点只不过是这个范围的界限罢了.(非晶体不存在溶点沸点)1年前查看全部
- 在标准状况下,2.24L的某气态烷烃和具有一个双键的烯烃的混合气体完全燃烧后,将高温下产生的气体缓慢通过浓硫酸,浓硫酸增
在标准状况下,2.24L的某气态烷烃和具有一个双键的烯烃的混合气体完全燃烧后,将高温下产生的气体缓慢通过浓硫酸,浓硫酸增重4.05g,剩余气体通过碱石灰,碱石灰增重6.60g.另再取2.24L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05g.
问:(1)混合气体由哪两种烃组成,写出它们的结构简式.
(2)混合气体中两种烃的体积分数各为多少? 82895721年前0
82895721年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 标准状况下,2.24LH2和C2H2的混合气体所含分子数是多少
 寒冰磐岩1年前1
寒冰磐岩1年前1 -
 sisyx 共回答了17个问题
sisyx 共回答了17个问题 |采纳率76.5%2.24LH2和C2H2的混合气体为0.1mol
0.1mol*6.02*10^23=6.02*10^22
所含分子数是6.02*10^221年前查看全部
- 取含有80g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况
取含有80g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况下CO2的密度为1.977g/L)
 吧啦咕噜嗒1年前2
吧啦咕噜嗒1年前2 -
 吮指鸡块 共回答了19个问题
吮指鸡块 共回答了19个问题 |采纳率73.7%解题思路:碳酸钙与盐酸反应,生成氯化钙、水和二氧化碳,由于200g碳酸钙完全反应,可利用碳酸钙的质量根据反应的化学方程式,计算生成气体二氧化碳的质量;
利用V=[m/ρ],根据二氧化碳质量计算出标准状况下气体的体积.设生成二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
80g x
[100/80g=
44
x]
x=35.2g
标准状况下CO2的体积V=[35.2g/1.977g/L]=17.8L
答:可生成二氧化碳气体35.2g;在标准状况下体积为17.8L.
故答案为:35.2g;17.8L.点评:
本题考点: ["根据化学反应方程式的计算"]
考点点评: 本题是根据反应的化学方程式进行的基础计算,需要注意正确的书写格式及完整的步骤,特别是还需要使用质量与体积的关系式计算出气体的体积.1年前查看全部
- 关于勒沙特列的计算题673K 1.01*10^5 Pa下,1mol气体A发生如下反应:2A(g)==(可逆符号)XB(g
关于勒沙特列的计算题
673K 1.01*10^5 Pa下,1mol气体A发生如下反应:2A(g)==(可逆符号)XB(g)+C(g),在一定条件下达到平衡,平衡混合气中A的体积分数58.84% ,混合气的总质量为46g,密度为0.72g/L 求:
1.达到平衡后混合气的平均相对分子质量
2.X的值
3.A的转化率
并说明 我一点都没看懂呢 alexalex141年前1
alexalex141年前1 -
 rickinrio 共回答了25个问题
rickinrio 共回答了25个问题 |采纳率88%只要是和平衡有关的计算,都要学会用三段法格式计算.
设A的转化率为y
2A(g) xB(g) + C(g)
n(始)1mol---------0--------0
变---y------------xy/2-------y/2
平---(1-y)----------xy/2-------y/2
A的体积分数,58.84%=(1-y)/(1-y+xy/2+y/2)
混合气的总质量为46g,密度为0.72g/L,673K,1.01*10^5 Pa ,据气体方程,pV=nRT
1.01*10^5*(46/0.72)*10^-3=n*8.314*673
混合气体的总物质的量,n=1.15=1-y+xy/2+y/2
解上面两个方程,x=2,y=32.14%
达到平衡后混合气的平均相对分子质量=总质量/总物质的量=46/1.15=401年前查看全部
- 1.硝酸钾和氢氧化钠在水溶液中混合 离子方程式 2.向澄清石灰水中通入co2气体 离子方程式
1.硝酸钾和氢氧化钠在水溶液中混合 离子方程式 2.向澄清石灰水中通入co2气体 离子方程式
3.硝酸银溶液和氯化钡溶液 离子方程式
4.稀醋酸和石灰石 离子方程式
5.用铁粉和稀硫酸反应制取氢气 离子方程式 9di61年前4
9di61年前4 -
 潜水高手927 共回答了17个问题
潜水高手927 共回答了17个问题 |采纳率100%1.不反应
2.(1)Ca2+ + 2OH- + CO2 = CaCO3↓+ H2O,
如果二氧化碳过量就会发生
(2)CaCO3+ H2O+CO2==Ca2+ + 2HCO3-
总反应:OH- + CO2==HCO3 -
3.Ag+ + Cl- = AgCl↓
4.2CH3COOH + CaCO3 = Ca2+ + H2O +2CH3COO- +CO2↑
5.Fe + 2H+ = Fe2+ + H2↑1年前查看全部
- 一定质量的理想气体由状态A沿着图 6-27所示的过程 变化到B,下列分析正确的是()
一定质量的理想气体由状态A沿着图 6-27所示的过程 变化到B,下列分析正确的是()
A气体的温度保持不变 B气体的温度先升高,后降低
C气体的内能保持不变 D气体的内能先增大,后减小

 happytangysh1年前2
happytangysh1年前2 -
 海中的泡漠 共回答了21个问题
海中的泡漠 共回答了21个问题 |采纳率90.5%PV=NRt
NR都是常数所以AB两点温度一样(因为PV乘积一样)
如果温度t不变,那么PV曲线应该是反比例函数(自己在图上画一下,等温曲线),目测应该比现在的曲线向原点凹一点(这个全靠你对反比例函数的熟悉了,本题PV=2,所以等温曲线要过(根号2,根号2),这个点也就是角AOB的平分线和半径为2,圆点在圆心的圆的焦点.总之 我是目测),也就是等温的PV曲线在AB弧线的左下方.
现在来分析AB弧线的温度以及内能变化.
A温度不变肯定错的,因为不符合反比例曲线
B正确,比较一下反比例曲线,AB弧线上的近A点,因为图中曲线的点都在反比例曲线右上方,也就是P和V总是比反比例曲线大,所以温度更高
C错,同上,变了
D对,同B,相对于等温曲线,可以理解为其他在等温曲线上被压缩吸热,内能增加1年前查看全部
- 一种固态物体和一种气体发生置换反应方程式
 adonman1年前3
adonman1年前3 -
 jjkezl 共回答了21个问题
jjkezl 共回答了21个问题 |采纳率81%铁和高温水蒸气反应,3Fe+4H2O(g)=Fe3O4+4H2,高温反应,氢气不加箭头.
水煤气反应C+H2O(g)=CO+H2,高温反应,氢气不加箭头
氢气还原金属氧化物H2+XO=X+H21年前查看全部
- 容器中,A+3B=C+D,(全部为气体),反应焓变
 雨中散步19721年前1
雨中散步19721年前1 -
 seaboy91 共回答了16个问题
seaboy91 共回答了16个问题 |采纳率81.3%不对;此题很简单,由点类似数学题的做法,取D的物质的量的最大值与最小值,当D的物质的量取最小值d/3时,反应重新达到平衡消耗D的物质的量为d-d/3=2d/3,因为D消耗(生成)的量=A生成(消耗)的量,所以A有最大值a+2d/3~.而当D的物质的量取最大值3d时,D生成的量为3d-d=2d,所以A有最小值a-2d,所以A取值范围为a-2d1年前查看全部
- 为什么打火机里的气体遇水会吸热?
 宝宝86551年前1
宝宝86551年前1 -
 海棠花飘香 共回答了20个问题
海棠花飘香 共回答了20个问题 |采纳率85%液化丁烷气是打火机气体遇水汽化发生吸热1年前查看全部
- 有50升的CO和CO2的混合气体,其气体密度是相同条件下H2密度的19倍.则(1)混合气体中CO和CO2的体积比是多少?
有50升的CO和CO2的混合气体,其气体密度是相同条件下H2密度的19倍.则(1)混合气体中CO和CO2的体积比是多少?(2)混合气体中CO和CO2的质量比是多少?(3)CO和CO2各占的体积为多少升?
我自己做出来的数据感觉不太对头, 噜咪啦1年前3
噜咪啦1年前3 -
 metallication 共回答了14个问题
metallication 共回答了14个问题 |采纳率78.6%可以用阿伏伽德罗定律进行考虑.
设混合气体的相对质量为M1,氢气的相对质量为M2
混合气体的密度为ρ1,氢气的密度为ρ2
则M1/M2=ρ1/ρ2,其中M2=2
所以M1=38
而M(混合气体)=m总/n总
设CO的体积为x,则CO2的体积为(50-x)
假设此时是标况下
m总=(x/22.4*28)+((50-x)/22.4*44)=(2200-16x)/22.4
CO的质量 CO2的质量
n总=(x/22.4)+((50-x)/22.4)=50/22.4
CO的物质的量 CO2的物质的量
M1=((2200-16x)/22.4)/(50/22.4)=38
x=18.75
CO的体积为18.75L,CO2的体积为31.25L
Vco:Vco2=18.75/31.25=3:5
nCO:nCO2=3:5
mCO:mCO2=(nCO*28)/(nCO2*44)=21:551年前查看全部
- 我知道-纯液体或固体物质量改变却不会影响化学反应速率,但纯气体为什么会受影响?跟纯液体不一样是常数吗
 锦山人1年前2
锦山人1年前2 -
 sadoi789 共回答了11个问题
sadoi789 共回答了11个问题 |采纳率100%气体化学反应速率的计算,受状态影响,质量减少而体积不变,压力就要随之减少;液体基本不受这个影响.固体反应速率其实受颗粒状态影响的,固体与液体反应时,颗粒小,表面积大,反应速率也就大.1年前查看全部
- 一定温度下,在密闭容器中,发生反应:2NO2⇌2NO+O2,经过一段时间后,测得混合气体中NO2浓度为0.06mol/L
一定温度下,在密闭容器中,发生反应:2NO2⇌2NO+O2,经过一段时间后,测得混合气体中NO2浓度为0.06mol/L,O2的浓度为0.12mol/L,且各物质的浓度不再发生变化,求:
(1)NO2的起始浓度?
(2)此时NO2的分解率? zd1001年前1
zd1001年前1 -
 398088586 共回答了17个问题
398088586 共回答了17个问题 |采纳率100%解题思路:一定温度下,在密闭容器中,发生反应:2NO2⇌2NO+O2,经2min时间后,测得混合气中NO2浓度为0.06mol•L-1,O2的浓度为0.12mol•L-1,且各物质的浓度不再发生变化,说明反应达到平衡状态,依据化学平衡三段式列式计算.
(1)浓度c=[n/V]计算得到;
(2)二氧化氮转化率=[消耗量/起始量]×100%.一定温度下,在密闭容器中,发生反应:2NO2⇌2NO+O2,经2min时间后,测得混合气中NO2浓度为0.06mol•L-1,O2的浓度为0.12mol•L-1,且各物质的浓度不再发生变化,说明反应达到平衡状态,依据化学平衡三段式列式计算,设二氧化氮起始量为x;
2NO2⇌2NO+O2
起始量(mol/L) x 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L)x-0.24 0.24 0.12
x-0.24=0.06,解得:x=0.30mol/L
(1)NO2的起始浓度=0.3 mol/L;
答:NO2的起始浓度0.3 mol/L;
(2)二氧化氮转化率=[消耗量/起始量]×100%=[0.24mol/L/0.3mol/L]×100%=80%;
答:此时NO2的转化率80%.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了和平衡的计算应用,主要是转化率、反应速率概念的计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 如果有毒气体报警仪是测氯化氢的,我用氯气做为标准气体去检测,可以吗.
 kk亡族1年前2
kk亡族1年前2 -
 foxken 共回答了17个问题
foxken 共回答了17个问题 |采纳率88.2%测什么气体的就要用什么气体去检测 如果标定的话 要注意量 标气是个问题 不能气体含量太大 容易损坏传感器1年前查看全部
- 气体无孔不入,说明气体分子间存在分子力这句话错在哪里?
 纵横时代1年前3
纵横时代1年前3 -
 liu0816 共回答了20个问题
liu0816 共回答了20个问题 |采纳率85%气体无孔不入,说明气体分子很小且间隙很大.
气体被压缩到极限后就不能再压缩了,说明分子间存在分子力.1年前查看全部
- 在压缩体积使气体液化时,怎样进行才快些和好些.比如控制温度等?
 亡子1年前2
亡子1年前2 -
 白绫无忧 共回答了20个问题
白绫无忧 共回答了20个问题 |采纳率95%一般都是低温液化的.因为很多气体单纯加压不能液化的,需要温度下降到临界温度以下.空气的主要成分氮气,临界温度是-147℃.加压的同时,使温度降到临界温度以下才能液化.1年前查看全部
- 三个容器中装有同种分子数密度相同的理想气体,其分子的平均平动能比为1:2:4,求其压强比()
 o乜乜o1年前1
o乜乜o1年前1 -
 snoopy0823 共回答了10个问题
snoopy0823 共回答了10个问题 |采纳率90%p=2/3n*ε
其中ε是分子平均平动动能,n是分子数密度
所以压强比为1:2:41年前查看全部
- 手机一瓶一氧化氮气体,可采用什么方法?
 cys02271年前1
cys02271年前1 -
 留个人给我 共回答了21个问题
留个人给我 共回答了21个问题 |采纳率95.2%应该是“收集一瓶一氧化氮气体,可采用什么方法”
排水法 因为NO难溶于水.1年前查看全部
- 用仪器A.B和胶管组成装置收集NO气体(1.仪器A已经气密性检查;2.除水外不能选用其 他试剂
 nihaott12251年前3
nihaott12251年前3 -
 因你我在 共回答了18个问题
因你我在 共回答了18个问题 |采纳率94.4%在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a口通入 NO气体,水通过b和c排入B中1年前查看全部
- 在密闭容器中,碳与氧气按质量比1:2完全反应,生成的气体可能是什么
 老侯1年前3
老侯1年前3 -
 神风浪剑 共回答了14个问题
神风浪剑 共回答了14个问题 |采纳率85.7%因为是完全反应,有只生成CO可能,也有只生成CO2可能,还有生成两者的混合物的可能.
C、O质量比是1:2,由于在CO中,C、O质量比为 12 / 16 > 1:2,在CO2中C、O质量比是 12 / 16*2 < 1:2,所以不可能生成一种物质,只能是CO、CO2共存.1年前查看全部
- 1.06克某有机化合物A完全燃烧后,得到1.79LCO2气体(标况)和0.90克H2O,该有机物对空气相对密度是3.66
1.06克某有机化合物A完全燃烧后,得到1.79LCO2气体(标况)和0.90克H2O,该有机物对空气相对密度是3.66
求分子式 正米小雪1年前2
正米小雪1年前2 -
 mmenghuang2000 共回答了16个问题
mmenghuang2000 共回答了16个问题 |采纳率93.8%分子式是C8H10.
CO2的物质的量是n=V/Vm=1.79/22.4=0.08mol
H2O的物质的量是n=m/M=0.9/18=0.05mol
1个CO2含有1个C原子,所以C原子的物质的量是0.08mol,质量是0.08*12=0.96g
1个H2O含有2个H原子,所以H原子的物质的量是0.1mol,质量是0.1*1=0.1g
C和H元素的质量和是0.96+0.1=1.06g,所以该物质只含有C、H元素,没有O元素,最简式是C8H10.
相对密度比等于相对分子质量之比,空气的平均相对分子质量为29,有机物的相对分子质量为3.66*29=106,(8*12+10)x=106,x=1,所以化学式是C8H10.1年前查看全部
- 盐酸+过氧化氢+铁粉=神马气体
 思余121年前5
思余121年前5 -
 yah5808 共回答了11个问题
yah5808 共回答了11个问题 |采纳率100%Fe+2HCl=FeCl2+H2
过氧化氢氧化FeCl2
化学方程式:H2O2+2FeCl2+2HCl=2FeCl3+2H2O
FeCl3催化分解H2O2
2H2O2=FeCl3催化=2H2O+O2
气体为H2、O21年前查看全部
- 反应物均为气体,保持容积不变,通入b mol氖气,反应速率怎么变化,为什么会这样变呢?求大师
 xiujing_pp1年前6
xiujing_pp1年前6 -
 我是那么那么的想 共回答了11个问题
我是那么那么的想 共回答了11个问题 |采纳率90.9%反应速率不变.
因为氖气是稀有气体,不参加反应,通入后,由于保持容积不变,所以反应物浓度不变,化学反应速率不变.1年前查看全部
- 为什么电解水的两只试管中的气体是不同的(回答采纳加10分)
为什么电解水的两只试管中的气体是不同的(回答采纳加10分)
为什么接正极的就一定是氧气,接负极的一定是氢气 yky_jimmy_yang1年前2
yky_jimmy_yang1年前2 -
 杨紫陌1981 共回答了29个问题
杨紫陌1981 共回答了29个问题 |采纳率93.1%电解时,氢h带正电去负极,氧o带负电去正极,所以分开了.1年前查看全部
- .标准状况下,33.6L CH4气体中原子的数目是多少?
 LINYAJING9007131年前1
LINYAJING9007131年前1 -
 大象撼蚂蚁 共回答了22个问题
大象撼蚂蚁 共回答了22个问题 |采纳率90.9%标准状况下,气体的摩尔体积为22.4L,所以33.6L甲烷气体为33.6/22.4=1.5mol,共含有的分子数目是1.5*6.02*10^23个,每个分子中含有4个原子,所以原子个数为:4*1.5*6.02*10^23=3.612*10^24个1年前查看全部
- 用活塞式抽气机,在温度不变的情况下,从容积为4L的玻璃瓶中抽气,每抽一次,瓶内气体的压强减小到原来的5/6,那么这台抽气
用活塞式抽气机,在温度不变的情况下,从容积为4L的玻璃瓶中抽气,每抽一次,瓶内气体的压强减小到原来的5/6,那么这台抽气机的气室容积为多少升?
 落雨划痕1年前1
落雨划痕1年前1 -
 amyloveamyhoho 共回答了17个问题
amyloveamyhoho 共回答了17个问题 |采纳率94.1%(4-v)/4=6/5
因为温度不变的情况下PV为一定值1年前查看全部
- 气体进出肺泡的动力是什么
 lxinlai1年前3
lxinlai1年前3 -
 nymx 共回答了18个问题
nymx 共回答了18个问题 |采纳率88.9%随着膈肌和肋间外肌的收缩和舒张,肺内体积不断改变,导致肺内气压不断改变.当肺内气压小于外界大气压时,空气由外界流入肺,完成吸气运动;当肺内气压大于外界大气压时,空气由肺流到外界,完成呼气运动;1年前查看全部
- 在标况下,2.8L某气体的质量是3.5g,已知该气体是由碳和氢两种元素组成的化合物,且化合物中碳元素的质量分数为85.7
在标况下,2.8L某气体的质量是3.5g,已知该气体是由碳和氢两种元素组成的化合物,且化合物中碳元素的质量分数为85.7%,氢元素的质量分数为14.3%,求该气体的分子式?
 sneozt1年前1
sneozt1年前1 -
 出神入化者 共回答了13个问题
出神入化者 共回答了13个问题 |采纳率100%该气体物质的量为0.125mol,所以其分子量应该为28,只含有碳氢元素.所以为气态烃,碳元素的质量分数:氢元素的质量分数=85.7%:14.3%=6:1,即C:H=6:1,设有x个C,y个H则有
6:1=12x:y,且有12x+y=28解得 x=2 y=4
所以为C2H4.1年前查看全部
- 填空!气体进出肺泡的过程叫做____?能不能叫肺的通气啊?
 徐家蕙蕙1年前7
徐家蕙蕙1年前7 -
 尹书 共回答了22个问题
尹书 共回答了22个问题 |采纳率90.9%就填肺通气,不是气体交换
气体交换太笼统,呼吸过程有以下环节:
1,肺通气:外界空气与肺之间的气体交换过程
2,肺换气:肺泡与肺毛细血管之间的气体交换过程
3,气体在血液中的运输;
4,组织换气:血液与组织、细胞之间的气体交换过程
以上四个环节,有三个存在气体交换,而你说的应该是第一个.1年前查看全部
- 人体气体进出肺泡的动力是什么?
 older_boy1年前1
older_boy1年前1 -
 泪冬眠了 共回答了24个问题
泪冬眠了 共回答了24个问题 |采纳率95.8%是肺下的腹隔肌的舒张与收缩产生的压力使气体进出肺泡的!1年前查看全部
大家在问
- 1经过调查发现,某种新产品在投放市场的100天中,前40天,其价格直线上升,(价格是一次函数),而后60天,其价格则呈直线
- 2D0 y0U的意思
- 3photo front so open 单词辨音 o的读音哪个不同
- 4what kind of snack do youl
- 5一道能量传递题下图表示一个简单的食物网,如果要使B尽量多地从A获得能量则A→C和A→B之间的能量传递效率分别是 和 .
- 6一个数的最大因数是16这个数是()一个最大的因数与最小的因数和是16 这个数是()一个数和最大因数与最小因数的差是16这
- 7集合B={X | |X| 小于等于2} 集合C={X | 2X - a 大于0} 若B与C的并集等于C ,那么求a的取值
- 8气体固体液体三者的溶点沸点分别是指什么?
- 9不好看的说.这句话是神马意思啊?
- 10这两个句子是神马意思?3 years from now ,you'd not be long gone .someone
- 11已知sina乘以cosa=八分之一,且a为第四象限,则cosa减sina等于好多?
- 12两根同样长的绳子第一根剪去全长的八分之一,第二根剪去全长的八分之七.哪一根绳子剪去的长?哪一根绳子剩下的长?
- 13两根1米长的绳子,第一根剪去八分之五,第二根剪去八分之五米,剩下的比较( ).A.第一根长B.第二根长C.一样长
- 14化合物按结构如何分类?按有无碳如何分类?
- 15生态因子的作用不分阶段?