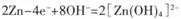银锌碱性电池的电解质溶液为KOH溶液,电池放电时发生的总反应为Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)
 中学rr2022-10-04 11:39:541条回答
中学rr2022-10-04 11:39:541条回答A. 放电时OH-向正极移动
B. Ag2O2在反应中既是氧化剂又是还原剂
C. 每生成1mol Ag外电路转移1 mol电子
D. 负极反应为Zn+4OH--2e-═Zn
| (OH) | 2− 4 |

已提交,审核后显示!提交回复
共1条回复
 吼吼上山打老虎 共回答了23个问题
吼吼上山打老虎 共回答了23个问题 |采纳率95.7%- 解题思路:根据Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag可知,Ag2O2在反应中Ag和O元素的化合价降低,被还原,应为原电池正极,电极反应式为Ag2O2+2H2O+4e-=2Ag+4OH-,Zn元素化合价升高,被氧化,应为原电池负极,电极反应式为Zn+4OH--2e-═Zn(OH)42-,以此解答该题.
A.放电时阴离子向原电池正极移动,阳离子向原电池正极移动,故A错误;
B.Ag2O2在反应中Ag和O元素的化合价降低,被还原,Ag2O2在反应中为氧化剂,故B错误;
C.负极反应式为Ag2O2+2H2O+4e-=2Ag+4OH-,每生成1molAg外电路转移2mol电子,故C错误;
D.Zn元素化合价升高,被氧化,应为原电池负极,电极反应式为Zn+4OH--2e-═Zn(OH)42-,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度中等,注意电极反应式的书写,为解答该题的关键,易错点为Ag2O2在反应中Ag和O元素的化合价的变化. - 1年前
相关推荐
- AAA碱性电池是几号电池?
 猪猪猪小妹1年前1
猪猪猪小妹1年前1 -
 哈擦哈擦 共回答了22个问题
哈擦哈擦 共回答了22个问题 |采纳率90.9%71年前查看全部
- 碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌--锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn(s)
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌--锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn(s)+2MnO 2 (s)+H 2 O(l)=Zn(OH) 2 (s)+Mn 2 O 3 (s)下列说法错误的是 [ ]A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO 2 (s)+H 2 O(l)+2e - = Mn 2 O 3 (s)+2OH - (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g 标发近1年前1
标发近1年前1 -
 风舞木 共回答了19个问题
风舞木 共回答了19个问题 |采纳率73.7%C1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2 (s)+H 2 O(l)=Zn(OH) 2 (s)+Mn 2 O 3 (s)下列说法错误的是 [ ]A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO 2 (s)+H 2 O(1)+2e - =Mn 2 O 3 (s)+2OH - (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g 我爱张姝1年前1
我爱张姝1年前1 -
 小熊9号 共回答了18个问题
小熊9号 共回答了18个问题 |采纳率72.2%C1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2 (s)+H 2 O(l)==Zn(OH) 2 (s)+Mn 2 O 3 (s) 下列说法错误的是 [ ]A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO 2 (s)+H 2 O(l)+2e - =Mn 2 O 3 (s)+2OH - (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g 起个破名想七天1年前1
起个破名想七天1年前1 -
 印家老大 共回答了18个问题
印家老大 共回答了18个问题 |采纳率88.9%C1年前查看全部
- 是银锌碱性电池的正极活性物质,可通过下列方法制备:在 加入适量 溶液,生成 沉淀,保持反应温度为80,边搅拌
 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在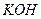 加入适量
加入适量 溶液,生成
溶液,生成 沉淀,保持反应温度为80,边搅拌边将一定量
沉淀,保持反应温度为80,边搅拌边将一定量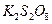 溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是 .
(2)银锌碱性电池的电解质溶液为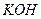 溶液,电池放电时正极的
溶液,电池放电时正极的 转化为
转化为 ,负极的
,负极的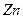 转化为
转化为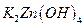 ,写出该电池反应方程式: .
,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设 仅含和
仅含和 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为 和
和 ,得到224.0mL
,得到224.0mL (标准状况下)。计算样品中
(标准状况下)。计算样品中 的质量分数(计算结果精确到小数点后两位)。
的质量分数(计算结果精确到小数点后两位)。 snow东方1年前1
snow东方1年前1 -
 宝贝鱼1206 共回答了17个问题
宝贝鱼1206 共回答了17个问题 |采纳率88.2% 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在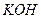 加入适量
加入适量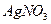 溶液,生成
溶液,生成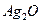 沉淀,保持反应温度为80,边搅拌边将一定量
沉淀,保持反应温度为80,边搅拌边将一定量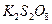 溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是 .
(2)银锌碱性电池的电解质溶液为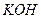 溶液,电池放电时正极的
溶液,电池放电时正极的 转化为
转化为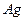 ,负极的
,负极的 转化为
转化为 ,写出该电池反应方程式: .
,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设 仅含和
仅含和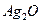 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为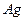 和
和 ,得到224.0mL
,得到224.0mL (标准状况下)。计算样品中
(标准状况下)。计算样品中 的质量分数(计算结果精确到小数点后两位)。
的质量分数(计算结果精确到小数点后两位)。
(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO )
)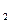 溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)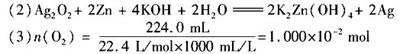
设样品中Ag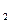 O
O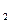 的物质的量为x,Ag
的物质的量为x,Ag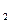 O 的物质的量量为y
O 的物质的量量为y
略1年前查看全部
- (1)(2011•江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶
 (1)(2011•江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:______.
(1)(2011•江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:______.
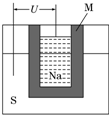
(2)(2011•山东高考,节选)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,正极的电极反应式为______.M(由Na2O和Al2O3制得)的两个作用是______.与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的______倍.
(3)(2011•新课标高考,节选)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为______,正极的反应式为[3/2]O2+6H++6e-═3H2O[3/2]O2+6H++6e-═3H2O.理想状态下,该燃料电池消耗1mol 甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为______(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为△H=-726.5kJ/mol). angry451年前1
angry451年前1 -
 XIAODUDU1979 共回答了17个问题
XIAODUDU1979 共回答了17个问题 |采纳率94.1%解题思路:(1)根据电池正、负极反应的物质和电解质溶液分析反应物和生成物,根据电子守恒进行配平;
(2)正极上得电子发生还原反应;熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应;根据转移电子和负极质量的关系分析;
(3)甲醇酸性燃料电池中,负极上燃料失电子发生氧化反应,正极上氧气得电子发生还原反应,其产生的电能与燃烧放出的燃料的比即为燃料电池的理论效率.(1)根据题意知,碱性条件下,负极上锌失电子发生氧化反应,正极上Ag2O2得电子发生还原反应,
所以电池反应式为Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag,
故答案为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag;
(2)正极上硫得电子发生还原反应,所以正极电极反应式为:xS+2e-═Sx2-,熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应,所以它起到隔离作用,
钠高能电池中负极为钠,有23g钠消耗释放1mol e-,则207g钠消耗时转移207/23mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,铅蓄电池中铅是负极,207g铅消耗时转移 2mol e-,故钠硫电池的理论放电量是铅蓄电池的:207÷23÷2=4.5 倍,
故答案为:xS+2e-═Sx2-;导电和隔离钠与硫;4.5;
(3)甲醇燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH+H2O-6e-═CO2+6H+
,正极上氧气得电子发生还原反应,电极反应式为[3/2]O2+6H++6e-═3H2O,
该燃料电池的理论效率=702.1kJ÷726.5kJ×100%=96.6%.
答案:CH3OH+H2O-6e-═CO2+6H+;[3/2]O2+6H++6e-═3H2O;96.6%.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理,明确正负极上得失电子及反应类型是解本题关键,难点是电极反应式的书写,注意结合电解质溶液的酸碱性书写,易错题是(2),根据M晶体的类型确定M的导电作用,难度很大.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因此得到广泛应用.锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO
碱性电池具有容量大、放电电流大的特点,因此得到广泛应用.锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO2+2H2O=2MnOOH+Zn(OH)2下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池负极反应为Zn+2OH--2e-=Zn(OH)2
C.电池工作时,电流由负极通过外电路流向正极
D.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g miao02151年前1
miao02151年前1 -
 我是一棵小葱 共回答了15个问题
我是一棵小葱 共回答了15个问题 |采纳率93.3%解题思路:A、根据原电池中失电子的一极为负极判断;
B、根据负极上的反应类型书写电极反应式;
C、根据原电池工作原理中电子的流向来回答;
D、根据锌与转移电子的关系计算.A、原电池中失电子的一极为负极,Zn转化为Zn(OH)2,化合价升高失电子,做负极,故A正确;B、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故B正确;C、电池工作时,电子由负极流向...
点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查原电池,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.1年前查看全部
- 银锌碱性电池的电解质溶液为KOH溶液,电池放电时的正极的Ag2O2转化为Ag
银锌碱性电池的电解质溶液为KOH溶液,电池放电时的正极的Ag2O2转化为Ag
银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:.
要写出这个方程式的过程 也就是为什么写出的这个化学方程式 思路是什么
二楼以后的网友能评价一下
Ag2o2+2H20=2Ag+4OH-
Zn+2KOH+2H2O=K2Zn(OH)4+2H+ 逍遥族1年前3
逍遥族1年前3 -
 jingjinghejun 共回答了18个问题
jingjinghejun 共回答了18个问题 |采纳率88.9%电池反应方程式应该有电子的得到和失去,上面的式子应该加上4e-,因为Ag从+4价降到0价了,下面的应该减去2e-,Zn从0价到了+2价,失去两个电子,最后还要有总的反应方程式,把电子去掉1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn(s)
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn(s) + 2MnO 2 (s) + H 2 O(l)=Zn(OH) 2 (s) + Mn 2 O 3 (s)。下列说法正确的是 [ ]A.该电池的正极为锌
B.电池正极的反应式为: 2MnO 2 (s) + H 2 O(l) + 2e - = Mn 2 O 3 (s) + 2OH - (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.该电池反应中二氧化锰起催化作用 yjsygg1年前1
yjsygg1年前1 -
 高老虫子 共回答了16个问题
高老虫子 共回答了16个问题 |采纳率87.5%B1年前查看全部
- 22(老师说此题很严谨),碱性电池具有容量大,供电时间长的特点得到广泛应用.
22(老师说此题很严谨),碱性电池具有容量大,供电时间长的特点得到广泛应用.
锌-锰碱性电池以KOH溶液为电解液,电池总反应为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法中错误的是( )
A 负极的电极反应式为:Zn-2e-=Zn2+
B 正极的电极反应为:2MnO2(S)+H2O(I)+2e-=Mn2O3(S)+2OH-(aq)
C 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D 电池工作时电解质溶液浓度基本不变,电子由负极通过外电路流向正极
老师说此题很严谨,浓度应增大,怎么回事呢? 皑皑蔼蔼1年前1
皑皑蔼蔼1年前1 -
 dyjcxfh 共回答了12个问题
dyjcxfh 共回答了12个问题 |采纳率66.7%锌-锰碱性电池以KOH溶液为电解液, 电池总反应为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法中错误的是( A )A 负极的电极反应式为:Zn-2e-=Zn2+ 因为A中没有考虑Zn2+与KOH...1年前查看全部
- 酸性碱性电池问题当用电池供电的时候,酸性电池和碱性电池有什么不同,为什么有的时候一定要用酸性电池而不能用碱性电池呢我指的
酸性碱性电池问题
当用电池供电的时候,酸性电池和碱性电池有什么不同,为什么有的时候一定要用酸性电池而不能用碱性电池呢
我指的是电池供电,并不是原电池反应的原理 秋无远近门外寒山1年前2
秋无远近门外寒山1年前2 -
 关刀山 共回答了12个问题
关刀山 共回答了12个问题 |采纳率91.7%碱性电池在寿命上,保养上都比酸电池优越很多,一般碱性蓄电池机房几乎不需要有人值守,如果换铅酸电池机房就必须派人值守,还要准备维护电池的器具.最直接的,铅酸电池充电时会产生酸雾,什么都腐蚀,碱性电池就不会;铅酸...1年前查看全部
- 目前市面上干电池有哪几种.就是常用的5号和7号电池有哪些种类.我知道镍氢 镍锌 磷酸铁锂 碱性电池 碳性电池还有其他的吗
目前市面上干电池有哪几种.
就是常用的5号和7号电池有哪些种类.我知道镍氢 镍锌 磷酸铁锂 碱性电池 碳性电池还有其他的吗.还有市面上大多数充电电池是哪一种.是不是镍氢电池怎么鉴定. ytnobye1年前1
ytnobye1年前1 -
 执子之手_ 共回答了19个问题
执子之手_ 共回答了19个问题 |采纳率89.5%第一类:按电解液种类划分:碱性电池电解质主要以氢氧化钾水溶液为主的电池;酸性电池;中性电池;有机电解液电池,第二类:按工作性质和贮存方式划分包括:一次电池,;二次电池----------望采纳,谢谢1年前查看全部
- 普通干电池的电量是多少?(希望能包括炭性电池、碱性电池、汞性电池等,总之越详细越好)
普通干电池的电量是多少?(希望能包括炭性电池、碱性电池、汞性电池等,总之越详细越好)
另外,同品牌同型号的1号、5号、7号干电池的电量是相同的吗?如果不同,相差多少? vivian的天使1年前1
vivian的天使1年前1 -
 大风无痕 共回答了16个问题
大风无痕 共回答了16个问题 |采纳率81.3%你说的干电池的电量准确地说是它的容量,也就是常说的mAh 数.随着干电池的放电,它的内阻增加,端电压下降,待端电压下降到一定程度,放电电流就趋于零.但搁上一段时间,它的端电压又可恢复一些.所以真正什么时候放完电,是不完全确定的.因此没有一个干电池厂家在产品上给出它的容量.在实际使用中,你还是可以比较出不同电池的容量,比如你说的几种电池中,最耐用的是碱性电池.同品牌、同种类的电池其容量肯定1号大于5号,7号最小.1年前查看全部
- 牡丹牌5号碱性电池被水泡了3小时水有毒吗?误喝了2杯水.
牡丹牌5号碱性电池被水泡了3小时水有毒吗?误喝了2杯水.
求解专业人士,无汞的那种电池. 小狐理1年前1
小狐理1年前1 -
 yekong3699 共回答了21个问题
yekong3699 共回答了21个问题 |采纳率95.2%无毒!电池外皮材料是铁皮、塑料,均为无毒材料且不溶于水,仅泡3小时不会造成电池破损,即使误喝了2杯水绝对不会对健康有任何影响.1年前查看全部
- 银锌碱性电池是一种可充电电池,总反应式2Ag+Zn(OH) 2 Zn+Ag 2 O+H 2 O
银锌碱性电池是一种可充电电池,总反应式2Ag+Zn(OH) 2
 Zn+Ag 2 O+H 2 O
Zn+Ag 2 O+H 2 O
下列关于该电池的说法正确的是 ( )A.充电时,Ag极接电源的负极 B.充电时,溶液中阴离子向阴极移动 C.放电时,负极反应为Zn+ 2OH ― -2e - 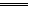 Zn(OH) 2
Zn(OH) 2 D.放电时,当电路上有0.02 mol电子通过时,消耗负极材料2.32 g  879500601年前1
879500601年前1 -
 才阿卡 共回答了19个问题
才阿卡 共回答了19个问题 |采纳率94.7%1年前查看全部
- 燃料电池电池效率碱性电池为什么比酸性高
 fxtianfang1年前1
fxtianfang1年前1 -
 一柄断剑 共回答了22个问题
一柄断剑 共回答了22个问题 |采纳率90.9%燃料电池的燃料一般是有机物,譬如:甲烷、甲醇、乙醇、丙烷等等,而这些物质在做原电池时候,都有二氧化碳气体产生,假如是酸性介质,则气体必须逸出,影响反应进程!而假如是碱性介质,则得到的就不的气体,而是碳酸盐!
从化学平衡的角度上看,也有利于平衡往右移动!因为生成物及时被转化了!1年前查看全部
- (2004年江苏高考化学题)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液
(2004年江苏高考化学题)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2 (s)+H 2 O(l)═Zn(OH) 2 (s)+Mn 2 O 3 (s),下列说法错误的是( ) A.电池工作时,锌失去电子 B.电池正极的电极反应式为:2MnO 2 (s)+H 2 O(l)+2e - ═Mn 2 O 3 (s)+2OH - (aq) C.电池工作时,电子由正极通过外电路流向负极 D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g  华强北四姐妹1年前1
华强北四姐妹1年前1 -
 娃哈哈o527 共回答了21个问题
娃哈哈o527 共回答了21个问题 |采纳率100%A、根据总反应可知Zn被氧化,为原电池的负极,故A正确;
B、根据电池总反应式为:Zn(s)+2MnO 2 (s)+H 2 O(l)═Zn(OH) 2 (s)+Mn 2 O 3 (s),可知反应中Zn被氧化,
为原电池的负极,负极反应为Zn-2e - +2OH - ═Zn(OH) 2 ,MnO 2 为原电池的正极,发生还原反应,正极反应为
2MnO 2 (s)+H 2 O(1)+2e - ═Mn 2 O 3 (s)+2OH - (aq),故B正确;
C、原电池中,电子由负极经外电路流向正极,故C错误;
D、负极反应为Zn-2e - +2OH - ═Zn(OH) 2 ,外电路中每通过O.2mol电子,消耗的Zn的物质的量为0.1mol,质量
为0.1mol×65g/mol=6.5g,故D正确.
故选C.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO2+H2O═Zn(OH)2+Mn2O3,下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极反应式为:2MnO2+H2O+2e-═Mn2O3+2OH-
C.电池工作时,负极附近pH降低
D.正极是水电离出的H+得到电子 真烦1年前1
真烦1年前1 -
 coolbeebee 共回答了20个问题
coolbeebee 共回答了20个问题 |采纳率100%解题思路:根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),以此解答该题.解;A.该电解质溶液呈碱性,放电时,负极上锌失电子发生氧化反应,电极反应式为Zn(s)+2OH-(aq)-2e-=Zn(OH)2(s),故A正确;
B.正极上二氧化锰得电子发生还原反应,电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH-,故B正确;
C.放电时,负极上氢氧根离子参加反应导致负极附近氢氧根离子浓度减小,则pH降低,故C正确;
D.正极发生2MnO2+H2O+2e-═Mn2O3+2OH-,故D错误.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了化学电源新型电池,明确原电池原理是解本题关键,难点的电极反应式的书写,要结合电解质溶液的酸碱性书写,难度中等.1年前查看全部
- 高铁酸钾和锌制成的高铁碱性电池,负极的电极反应是
 xzygood1年前2
xzygood1年前2 -
 coral鱼 共回答了17个问题
coral鱼 共回答了17个问题 |采纳率94.1%根据总反应的化学方程式可知:
反应前锌是3mol,反应后生成1molZnO和2molK2ZnO2,反应前锌的化合价为0,反应后ZnO和K2ZnO2中锌的化合价都为+2价.每摩尔锌原子变为+2价失去2摩尔电子,所以一共失去6摩尔电子,因此不可能是最下面的反应.
根据反应后生成2molZnO2^2-,说明反应后带4mol单位的负电荷,而反应前失去6mol电子应带6mol单位的正电荷,为使反应前后所带电荷相等,所以需要10mol的氢氧根离子,
3Zn-6e^-+10OH^-一ZnO+2ZnO2^2-+H2O
最后根原子守恒即可配平.
3Zn-6e^-+10OH^-=ZnO+2ZnO2^2-+5H2O1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因此得到广泛应用.锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO
碱性电池具有容量大、放电电流大的特点,因此得到广泛应用.锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO2+2H2O=2MnOOH+Zn(OH)2下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池负极反应为Zn+2OH--2e-=Zn(OH)2
C. 电池工作时,电流由负极通过外电路流向正极
D. 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g ghostfox231年前1
ghostfox231年前1 -
 billy157421 共回答了9个问题
billy157421 共回答了9个问题 |采纳率88.9%解题思路:A、根据原电池中失电子的一极为负极判断;
B、根据负极上的反应类型书写电极反应式;
C、根据原电池工作原理中电子的流向来回答;
D、根据锌与转移电子的关系计算.A、原电池中失电子的一极为负极,Zn转化为Zn(OH)2,化合价升高失电子,做负极,故A正确;
B、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故B正确;
C、电池工作时,电子由负极流向正极,电流由正极通过外电路流向负极,故C错误;
D、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故D正确.
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查原电池,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO
碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO 2 +2H 2 O=2MnOOH+Zn(OH) 2 下列说法错误的是 [ ]A. 电池工作时,锌失去电子
B. 电池负极反应为Zn+2OH - -2e - =Zn(OH) 2
C. 电池工作时,电流由负极通过外电路流向正极
D. 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g 吴小屋1年前1
吴小屋1年前1 -
 xiao0719 共回答了23个问题
xiao0719 共回答了23个问题 |采纳率95.7%C1年前查看全部
- 2011江苏高考化学问题Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH中加入适量AgNO3溶液,生
2011江苏高考化学问题
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH中加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80℃边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品,反应方程式为2AgNO3+4KOH+K2S2O8=Ag2O2+2KNO3+K2SO4+2H2O,
(1)上述制备过程中,检验洗涤是否完全的方法是?
这一题解答是:滴入Ba(NO3)2溶液,若不出现白色浑浊,或滴入酚酞溶液,若溶液不显红色.
为什么答案是这个,检验洗涤完全加入 Ba(NO3)2 或 酚酞 是检验什么;为什么要这样检验;检验的物质如果没反应,还和别的物质有关系么
就当作老师回答问题一样,要讲清楚
就这个问题了,紧急! 老式电风扇1年前1
老式电风扇1年前1 -
 6102939 共回答了20个问题
6102939 共回答了20个问题 |采纳率95%因为我们要得到Ag2O2固体,如果没洗涤干净会含有氢氧根,硫酸根等杂质离子,加入酚酞或Ba(NO3)2不就是为了检查氢氧根和硫酸根吗,为什么不用氯化钡检验硫酸根呢,因为氯是新杂质 .如果有杂质这些杂质是同时存在的,所以只要检出其中一种就能知道有没有洗干净1年前查看全部
- 银锌碱性电池发生的反应为什么不是ag2o2+zn+2koh=2ag+k2zn(oh)4
银锌碱性电池发生的反应为什么不是ag2o2+zn+2koh=2ag+k2zn(oh)4
为什么是2h2o+ag2o2+2zn+4koh=2ag+2k2zn(oh)4 雁舞ee1年前1
雁舞ee1年前1 -
 A20011029 共回答了22个问题
A20011029 共回答了22个问题 |采纳率72.7%Ag2O2在反应中Ag和O元素的化合价降低,被还原,应为原电池正极,电极反应式为Ag2O2+2H2O+4e-=2Ag+4OH-,
Zn元素化合价升高,被氧化,应为原电池负极,电极反应式为Zn+4OH--2e-═Zn(OH)42-,
由两个半反应式得出总反应式:Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag1年前查看全部
- (2011•云浮模拟)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以KOH溶液为电解液,电池总
(2011•云浮模拟)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s).下列说法正确的是( )
A.该电池的正极为锌
B.电池正极的反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.该电池反应中二氧化锰起催化作用 小佛爷67511年前1
小佛爷67511年前1 -
 包大人吃花卷 共回答了13个问题
包大人吃花卷 共回答了13个问题 |采纳率76.9%解题思路:根据电极反应式Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),可知电池工作时,负极材料是Zn,发生氧化反应生成Zn(OH)2,电极反应式为Zn-2e-+2OH-=Zn(OH)2,正极材料为MnO2,发生还原反应,电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-,电子从负极沿导线流向正极.A.根据电池反应式知,锌失电子发生氧化反应,则锌作负极,故A错误;
B.二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq),故B正确;
C.放电时,电子从负极锌沿外电路流向正极二氧化锰,故C错误;
D.该反应中,锰元素得电子作氧化剂,故D错误;
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池的组成和工作原理,题目难度不大,本题注意电极的组成和电极反应式以及总反应式的书写.1年前查看全部
- 肼-空气燃料电池是一种碱性电池,该电池放电时,负极的反应为(求快速回)
 liuyuan831年前2
liuyuan831年前2 -
 戴川子 共回答了15个问题
戴川子 共回答了15个问题 |采纳率93.3%负极是肼,发生氧化反应
N2H4 - 4e + 4OH- ——> N2 + H2O
满意请点好评o(∩_∩)o1年前查看全部
- 碱性电池和干电池干电池是什么电池 碱性电池是干电池吗?
 fukcghkhg761年前2
fukcghkhg761年前2 -
 揭盘手18 共回答了25个问题
揭盘手18 共回答了25个问题 |采纳率92%干电池
一种伏打电池,利用某种吸收剂(如木屑或明胶)使内含物成为不会外溢的糊状.常用作手电筒照明、收音机等的电源
干电池属于化学电源中的原电池,是一种一次性电池.因为这种化学电源装置其电解质是一种不能流动的糊状物,所以叫做干电池,这是相对于具有可流动电解质的电池说的.干电池不仅适用于手电筒、半导体收音机、收录机、照相机、电子钟、玩具等,而且也适用于国防、科研、电信、航海、航空、医学等国民经济中的各个领域.
碱性电池
亦称为碱性干电池、碱性锌锰电池、碱锰电池,是锌锰电池系列中性能最优的品种.适用于需放电量大及长时间使用.电池内阻较低,因此产生之电流较一般锰电池为大,而环保型含汞量只有0.025%,无须回收.
碱性电池是最成功的高容量干电池,也是目前最具性能价格比的电池之一.
碱性电池是以二氧化锰为正极,锌为负极,氢氧化钾为电解液.其特性上较碳锌电池来的优异,电容量大.
碱性电池在结构上采用于普通电池相反的电极结构,增大了正负极间的相对面积,而且用高导电性的氢氧化钾溶液替代了氯化铵、氯化锌溶液,负极锌也由片状改变成粒状,增大了负极的反应面积,加之采用了高性能的电解锰粉,所以电性能得以很大提高,一般的,同等型号的碱性电池是普通电池的容量和放电时间的3-7倍,低温性能两者差距更大,碱性电池更适用于大电流连续放电和要求高的工作电压的用电场合,特别适用于照相机、闪光灯、剃须刀、电动玩具、CD机、大功率遥控器等.
所以,碱性电池就是干电池1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2 (s)+H 2 O(l)==Zn(OH) 2 (s)+Mn 2 O 3 (s)下列说法中错误的是 [ ]A.电池工作时,锌失去电子,锌是负极
B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
C.电池正极的电极反应式为:2MnO 2 +H 2 O+2e - == Mn 2 O 3 +2OH -
D.电池工作时,溶液中OH - 向正极移动,K + 、H + 向负极移动 soso07271年前1
soso07271年前1 -
 linda_weta 共回答了17个问题
linda_weta 共回答了17个问题 |采纳率94.1%D1年前查看全部
- 碱性电池中的氢氧化钾能否用氢氧化钠代替?
 hyheo10301年前1
hyheo10301年前1 -
 yuyu326 共回答了25个问题
yuyu326 共回答了25个问题 |采纳率92%氢氧化钠的钠离子在元素活性周期里排在钾之后,也就是说钾是最活泼的.同样,用钾做碱性电池是比较稳定,不易被置换.1年前查看全部
- 钟可以用碱性电池吗?
 呆呆傻傻笨笨1年前1
呆呆傻傻笨笨1年前1 -
 zhoubin0574 共回答了15个问题
zhoubin0574 共回答了15个问题 |采纳率100%当然可以的,
碱性电池的电压和普通碳性的一样,标称电压都是1.5V
但它的容量是普通碳性电池的好几倍,约5~7倍,使用时间大大延长了
就是价格贵了些,普通5号约0.5元左右,碱性5号约2元左右.算性价比的话,碱性电池是划算的1年前查看全部
- 银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:
银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:
Ag 2 O 2 +2Zn+4KOH+2H 2 O=2K 2 Zn( OH ) 4 +2Ag下列有关该电池的说法不正确的是A.电池放电时,正极附近溶液的碱性增强 B.电池放电时,负极反应为 
C.电池充电时,阳极反应为 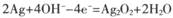
D.充电时锌极与外电源正极相连  灵儿姑娘1年前1
灵儿姑娘1年前1 -
 迷徒的羊 共回答了20个问题
迷徒的羊 共回答了20个问题 |采纳率85%1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2 (s)+H 2 O(l)==Zn(OH) 2 (s)+Mn 2 O 3 (s) 下列说法错误的是 [ ]A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO 2 (s)+H 2 O(l)+2e - =Mn 2 O 3 (s)+2OH - (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g 初吻给你的奶嘴1年前1
初吻给你的奶嘴1年前1 -
 东北 共回答了17个问题
东北 共回答了17个问题 |采纳率94.1%C1年前查看全部
- 5号碱性电池容量是否随电池节数的增加而容量增加?
 sw2k01901年前1
sw2k01901年前1 -
 jebrain 共回答了15个问题
jebrain 共回答了15个问题 |采纳率93.3%电池容量是一定的
无论你采用并联或者串联
不同只是电压1年前查看全部
- 锌和高铁酸钾组成的碱性电池,正负极方程式咋写?正负极的生成物咋判断是什么?、
 二十而狂1年前2
二十而狂1年前2 -
 归零57 共回答了25个问题
归零57 共回答了25个问题 |采纳率88%楼上很完美,只有一个地方错误,就是高铁酸钾一定存在於强碱溶液中,因此氢氧化锌一定会溶解.
负极:Zn-2e-+4OH-=ZnO22-+2H2O
正极:FeO42-+3e-+4H2O=Fe(OH)3+5OH-
总:3Zn+2K2FeO4+2KOH+2H2O=3K2ZnO2+2Fe(OH)31年前查看全部
- Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH中加入适量AgNO3溶液,生成Ag2O沉淀,保...
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH中加入适量AgNO3溶液,生成Ag2O沉淀,保...
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH中加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80℃边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品,反应方程式为2AgNO3加4KOH加K2S2O8=Ag2O2加2KNO3加K2SO4加2H2O,(1)上述制备过程中,检验洗涤是否完全的方法是?(2)称取上述制备的样品(设Ag2O2仅含Ag2O)2.588g,在一定的条件下完全分解为Ag和O2,得到224molO2(标准状况下)计算样品中Ag2O2的质量分数为? shhch19841年前1
shhch19841年前1 -
 行君_qq 共回答了19个问题
行君_qq 共回答了19个问题 |采纳率100%1滴入Ba(NO3)2溶液,若不出现白色浑浊,或滴入酚酞溶液,若溶液不显红色.
2 n(O2)=0.01mol 设Ag2O2 x Ag2O y
248g•mol-1 × x + 232 g•mol-1 × y =2.588 g
x+1/2 y =0.01 mol
w(Ag2O2)=0.91.1年前查看全部
- 南孚电池上标有碱性电池字样,里面含有哪种碱?
 中原老九1年前1
中原老九1年前1 -
 南山秋色 共回答了17个问题
南山秋色 共回答了17个问题 |采纳率100%KOH1年前查看全部
- 5号碱性电池
 爱莉爱蓝1年前4
爱莉爱蓝1年前4 -
 zhuenzhu昆明 共回答了17个问题
zhuenzhu昆明 共回答了17个问题 |采纳率88.2%正极材料:石墨
负极材料:Zn
总的电池反应为:
Zn+MnO2+2H2O+4OH-=Mn(OH)2-+Zn(OH)2- 正负极的反应,你自己根据总反应就能写出来.1年前查看全部
- AAA碱性电池电放电电流的计算没有正确回答一组串联两个AAA碱性电池1.5v 1200mA每小时,放电电流是1mA回答要
AAA碱性电池电放电电流的计算
没有正确回答一组串联两个AAA碱性电池1.5v 1200mA每小时,放电电流是1mA
回答要多长时间才能降下2v bingjuwu1年前1
bingjuwu1年前1 -
 jijing_19821107 共回答了22个问题
jijing_19821107 共回答了22个问题 |采纳率81.8%无法准确回答,需要知道电池的放电曲线.
从经验来讲,按照标准的容量放电,则最后的电压约等于1V.但是题中的放电电流极小,差不多就是电池的自然放电的水平了.可能使用的时间就是电池的储存时间了,至少一年吧.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2 (s)+H 2 O(l) ==Zn(OH) 2 (s)+Mn 2 O 3 (s),下列说法错误的是 [ ]A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO 2 (s)+H 2 O(1)+2e - ==Mn 2 O 3 (s)+2OH - (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g pontwokz1年前1
pontwokz1年前1 -
 xulovezhen 共回答了8个问题
xulovezhen 共回答了8个问题 |采纳率75%C1年前查看全部
- 求助高中化学问题Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O
求助高中化学问题
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80℃,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为:
2AgNO3+4KOH+K2S2O8===Ag2O2↓+2KNO3+K2SO4+2H2O
上述制备过程中,检验洗剂是否完全的方法是______.
所给答案为:检验是否洗涤完全,可取最后一次滤液,检验溶液中是否含有SO42-或OH-,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
请问为什么只要检验SO42-或OH-,溶液中不是还可能含有K+和NO3-吗,谢谢
 水蓝茉莉-1年前1
水蓝茉莉-1年前1 -
 xiaotongsun 共回答了27个问题
xiaotongsun 共回答了27个问题 |采纳率88.9%在检验残留离子的时候,一般选用有明显现象或者明显特征的离子来检验.要检验K+的话,可以用焰色反应证明有,但是不能说明钾离子是来自于硝酸钾还是过硫酸钾,还是氢氧化钾;而硝酸根离子不同,在初高中甚至大学里所有的硝酸盐就是可溶的,硝酸根也没有特殊的检验方法(有也会破坏你的产物,过氧化银).
综上所述,只选择检验硫酸根和氢氧根离子1年前查看全部
- (10分)Ag 2 O 2 是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO 3 溶液,生成A
(10分)Ag 2 O 2 是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO 3 溶液,生成Ag 2 O沉淀,保持反应温度为80,边搅拌边将一定量K 2 S 2 O 8 溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO 3 +4KOH+K 2 S 2 O 8
 Ag 2 O 2 ↓+2KNO 3 +K 2 SO 4 +2H 2 O
Ag 2 O 2 ↓+2KNO 3 +K 2 SO 4 +2H 2 O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是
。
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag 2 O 2 转化为Ag,负极的Zn转化为K 2 Zn(OH) 4 ,写出该电池反应方程式:
。
(3)准确称取上述制备的样品(设Ag 2 O 2 仅含Ag 2 O)2.558g,在一定的条件下完全分解为Ag 和O 2 ,得到224.0mLO 2 (标准状况下)。计算样品中Ag 2 O 2 的质量分数(计算结果精确到小数点后两位)。 轩轩Sally1年前1
轩轩Sally1年前1 -
 美丽心情2001 共回答了7个问题
美丽心情2001 共回答了7个问题 |采纳率100%(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO 3 ) 2 溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
(2)Ag 2 O 2 +2Zn+4KOH+2H 2 O=2K 2 Zn(OH) 4 +2Ag
(3)0.91
1年前查看全部
- 哪些地方应该使用碳性电池?是不是有些地方使用碳性电池比碱性电池更合适?
 叫我如何不想你1年前1
叫我如何不想你1年前1 -
 心的离开 共回答了18个问题
心的离开 共回答了18个问题 |采纳率83.3%碳性电池属于化学电源中的原电池,是一种一次性电池.因为这种化学电源装置其电解质是一种不能流动的糊状物,所以也叫做干电池,这是相对于具有可流动电解质的电池说的.
碳性电池不仅适用于手电筒、半导体收音机、收录机、照相机、电子钟、玩具等,而且也适用于国防、科研、电信、航海、航空、医学等国民经济中的各个领域.碳性电池主要用于低耗电电器,如钟表,无线鼠标等大耗电电器应该用碱性电池,如相机,某些相机碱性也撑不住,那就需要用镍氢.1年前查看全部
- Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3 溶液,生成Ag2O沉淀,保持反应
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3 溶液,生成Ag2O沉淀,保持反应温度为80℃,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为2AgNO3+4KOH+K2S2O8 = Ag2O2↓+2KNO3+K2SO4+2H2O
(1)上述制备过程中,检验洗涤是否完全的方法是
答案中是取最后一次洗涤液加入Ba(NO3)2,为什么不是加入Cl-?不应该检验Ag+吗? hupeng1231年前1
hupeng1231年前1 -
 jdliqing6205 共回答了21个问题
jdliqing6205 共回答了21个问题 |采纳率90.5%反应中氧化剂K2S2O8必须是稍过量的,这样才能保证将Ag2O氧化成Ag2O2.反应完成后基本上就没有Ag(I)了,不需要检验.
洗涤液用Ba(NO3)2检验,是为了确保沉淀中已经没有硫酸根了,这样才说明洗涤彻底.1年前查看全部
- 镍镉碱性电池与铅蓄电池,使用一段时间后前者内阻基本不变,后者内阻明显增大的主要原...
镍镉碱性电池与铅蓄电池,使用一段时间后前者内阻基本不变,后者内阻明显增大的主要原...
镍镉碱性电池与铅蓄电池,使用一段时间后前者内阻基本不变,后者内阻明显增大的主要原因是? freya198210161年前1
freya198210161年前1 -
 我巍子 共回答了9个问题
我巍子 共回答了9个问题 |采纳率88.9%铅蓄电池极板电阻随极板上有效物质即参与化学反应的活性物质的变化而变化,充电时电阻变小,放电时电阻变大,特别是放电之后生成硫酸铅沉淀,使电阻大大增加1年前查看全部
- 南孚电池是碱性电池吗?无线鼠标使用南孚有影响吗
 haoyuexin1年前1
haoyuexin1年前1 -
 微笑的原创文字 共回答了13个问题
微笑的原创文字 共回答了13个问题 |采纳率92.3%有碱性电池,也有镍氢充电电池
没影响
最好镍氢电池1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn(s)+
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn(s)+2MnO 2 (s)+H 2 O(l)═Zn(OH) 2 (s)+Mn 2 O 3 (s),下列说法错误的是( ) A.电池工作时,锌失去电子 B.电池工作时,电子由负极通过外电路流向正极 C.电池正极的电极反应式为:2MnO 2 (s)+H 2 O(l)+2e - ═Mn 2 O 3 (s)+2OH - (aq) D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g  风吹草滴1年前1
风吹草滴1年前1 -
 eggborn 共回答了23个问题
eggborn 共回答了23个问题 |采纳率95.7%A、原电池工作原理是:负极失电子,发生氧化反应,根据总反应可知失电子的是金属锌,故A正确;
B、电池工作时,电子由负极流向正极,故B正确;
C、正极得电子,发生还原反应,所以正极的电极反应式为:2MnO 2 (s)+H 2 O(l)+2e-﹦Mn 2 O 3 (s)+2OH - (aq),故C正确;
D、根据电池反应Zn(s)+2MnO 2 (s)+H 2 O(l)﹦Zn(OH) 2 (s)+Mn 2 O 3 (s),消耗1mol的金属锌,转移电子是2mol,所以当外电路中每通过0.1mol电子,消耗金属锌0.05mol,锌的质量理论上减小0.05mol×65g/mol=3.25g,故D错误.
故选D.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO 2 (s)+H 2 O(l)═Zn(OH) 2 (s)+Mn 2 O 3 (s),下列说法中错误的是( ) A.电池工作时,锌失去电子,锌是负极 B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g C.电池负极的电极反应式为:Zn-2e-+2OH - =Zn(OH) 2 D.电池工作时,电子由负极流向正极,溶液中OH - 向正极移动,K + 、H + 向负极移动  永远的小懒猪1年前1
永远的小懒猪1年前1 -
 失去声音的鸟 共回答了13个问题
失去声音的鸟 共回答了13个问题 |采纳率100%A、原电池工作原理是,负极失电子,发生氧化反应,故A正确;
B、由Zn(s)+2MnO 2 (s)+H 2 O(l)═Zn(OH) 2 (s)+Mn 2 O 3 (s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故B正确;
C、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn-2e-+2OH - =Zn(OH) 2 ,故C正确;
D、电池工作时,电子由负极流向正极,根据异性电荷相吸,溶液中K + 、H + 向正极移动,OH - 向负极移动,故D错误;
故选D.1年前查看全部
- 碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO2+H2O═Zn(OH)2+Mn2O3,下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极反应式为:2MnO2+H2O+2e-═Mn2O3+2OH-
C. 电池工作时,负极附近pH降低
D. 正极是水电离出的H+得到电子 猪头0081年前1
猪头0081年前1 -
 樱桃纸鸢 共回答了26个问题
樱桃纸鸢 共回答了26个问题 |采纳率84.6%解题思路:根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),以此解答该题.解;A.该电解质溶液呈碱性,放电时,负极上锌失电子发生氧化反应,电极反应式为Zn(s)+2OH-(aq)-2e-=Zn(OH)2(s),故A正确;
B.正极上二氧化锰得电子发生还原反应,电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH-,故B正确;
C.放电时,负极上氢氧根离子参加反应导致负极附近氢氧根离子浓度减小,则pH降低,故C正确;
D.正极发生2MnO2+H2O+2e-═Mn2O3+2OH-,故D错误.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了化学电源新型电池,明确原电池原理是解本题关键,难点的电极反应式的书写,要结合电解质溶液的酸碱性书写,难度中等.1年前查看全部
- 高二化学碱性电池正极:2MnO2+2H2O+2e═2MnO(OH)+2OH-负极:Zn+2OH--2e═Zn(OH)2总
高二化学碱性电池
正极:2MnO2+2H2O+2e═2MnO(OH)+2OH-
负极:Zn+2OH--2e═Zn(OH)2
总反应式:2MnO2+Zn+2H2O═2MnO(OH)+Zn(OH)2
在这个里面、Zn是跟电解质KOH的OH-反应还是跟正极得的OH-反应啊?能算电解质参加反应吗?感觉OH-并没有少 jacxk2ie1年前2
jacxk2ie1年前2 -
 yzfwj 共回答了20个问题
yzfwj 共回答了20个问题 |采纳率90%Zn与负极的OH-发生反应,因为Zn作为负极电极,失去电子之后由固体表面向溶液中扩散,肯定立即遇到负极区附近的OH-,生成沉淀.
OH-没有减少,但是OH-作为介质参加了反应,这是没有问题的1年前查看全部
- (2012•石家庄二模)银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:Ag2O2+2Zn+4KOH+2H2O
(2012•石家庄二模)银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag下列有关该电池的说法不正确的是( )
A.电池放电时,正极附近溶液的碱性增强
B.电池放电时,负极反应为2Zn-4e-+8OH-═2[Zn(OH)4]2-
C.电池充电时,阳极反应为2Ag+4OH--4e-═Ag2O2+2H2O
D.充电时锌极与外电源正极相连 木各桑1年前1
木各桑1年前1 -
 2d1g 共回答了16个问题
2d1g 共回答了16个问题 |采纳率100%解题思路:根据Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag可知,Ag2O2在反应中Ag和O元素的化合价降低,被还原,应为原电池正极,电极反应式为Ag2O2+2H2O+4e-═2Ag+4OH-,Zn元素化合价升高,被氧化,应为原电池负极,电极反应式为Zn+4OH--2e-═Zn(OH)42-,以此解答该题.A、电池放电时,正极发生的电极反应为:Ag2O2+2H2O+4e-═2Ag+4OH-,所以该电极附近溶液的碱性增强,故A正确;
B、电池放电时,Zn元素化合价升高,被氧化,应为原电池负极,负极反应为2Zn-4e-+8OH-═2[Zn(OH)4]2-,故B正确;
C、电池充电时,阳极上发生失电子的氧化反应,该反应是放电时正极反应的逆反应,即反应为2Ag+4OH--4e-═Ag2O2+2H2O,故C正确;
D、充电时,锌极与外电源负极相连,故D错误.
故选:D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度中等,注意电极反应式的书写,为解答该题的关键,易错点为Ag2O2在反应中Ag和O元素的化合价的变化.1年前查看全部
大家在问
- 1(2009•通州区一模)如图所示,体重为510N的人,用滑轮组拉重500N的物体A沿水平方向以0.02m/s的速度匀速运
- 2科学家的师生情谊这篇课文中的过渡段是哪一段?
- 3有一个梯形,下底是上底的3倍,高是10cm,如果上底加6cm,下底减4cm,则变成长方形.求梯形面积.
- 4直接写得数 3.2×0.2=1.4×0.4=3.3÷3=1.2÷0.3=2.5×0.4=1.5×2=0.7×7=7.3+
- 5什么叫主谓宾表语,什么叫宾语从句、表语从句?
- 6把一个棱长6分米的正方形木块加工成一个最大的圆柱.木料的实际利用率是百分之几?
- 71又4分之1,1又4分之7,1又3分之2.,12分之11,选3个数,记A、B、C,3个数使A*{B-C}尽量大.
- 8六个人的帽子打乱了顺序,随即各取一个帽子,求都不是自己的帽子的概率?n个呢.
- 9一台计算机字长为8位,下列说法正确的是A.它最多有256种指令 B.数据总线=8位 C.最大数是256 D.字长=字节
- 101、lt's four o' clock. 2、lt's half past twelve
- 11小明和同学们在动物园游玩时看到好多可爱的动物,小丽指着一头大象对同学们说:“给你一个量程为10N的弹簧测力计,再利分身边
- 12将一百只杯子分别装入若干个盒子中,每盒装的个数互不相同,并且都不是空的,最多装入多少个盒子?
- 13①( )÷16=3/8=15:( )=( ):24=( )【用小数表示】
- 14七年级上册英语第83–84课课练答案配译林版权
- 15The t___ is about football.