氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成的氢气供燃料之需,该反应同时还生成氢氧化钙.现有87.
 colleen62022-10-04 11:39:542条回答
colleen62022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 307660389 共回答了24个问题
307660389 共回答了24个问题 |采纳率91.7%- 设产生H2的质量是x
CaH2 + 2 H2O = Ca(OH)2 + 2 H2
42 4
87.5 g x
所以42 / 4 = 87.5 g / x
x = 8.33 g
体积 = 8.33 / 0.0893 = 93.3 L
即可生成氢气 8.33 g,体积为 93.3 L - 1年前
 shujianzhen 共回答了14319个问题
shujianzhen 共回答了14319个问题 |采纳率- CAH2+2H2O=CA(OH)2+2H2
42 4
87.5 X=87.5*4/42=8.33g 体积8.33、2=4.17摩尔 4.17*22.4=93.33升
生成氢气8.33克、体积是93.33升 - 1年前
相关推荐
- 氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它与水反应生成氢氧化钙〔Ca(OH)2〕和氢气,氢气供燃烧之需,现有
氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它与水反应生成氢氧化钙〔Ca(OH)2〕和氢气,氢气供燃烧之需,现有84g氢化钙与足量水反应,可生成多少克H2?
 yuhui_83011年前1
yuhui_83011年前1 -
 天蝎我的名 共回答了17个问题
天蝎我的名 共回答了17个问题 |采纳率94.1%解题思路:根据氢化钙与水反应生成氢氧化钙和氢气的反应化学方程式可表示反应中各物质的质量关系,可利用参加反应的氢化钙的质量计算出生成的氢气的质量.设84g氢化钙与足量水反应生成氢气的质量为x
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
84g x
[42/84=
4
x]
x=8g
答:84g氢化钙与足量水反应可生成氢气8g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 反应的化学方程式能表示出反应中各物质的质量比,根据物质的质量比,可由反应中任一物质的质量计算出反应中其它物质的质量.1年前查看全部
- 氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂.已知:
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂.已知:
①氢化钙通常用氢气与钙加热制得.
②氢化钙要密封保存,遇水反应生成氢氧化钙和氢气.
下列判断中正确的是( )
A.氢化钙的化学性质稳定
B.①中发生化合反应,②中发生复分解反应
C.氢化钙作为能源提供剂是因为与水反应能生成氢气
D.氢化钙可用于干燥潮湿的二氧化碳、氯化氢等气体 Google测试员57861年前1
Google测试员57861年前1 -
 happydancing831 共回答了20个问题
happydancing831 共回答了20个问题 |采纳率95%解题思路:A、根据题中信息“氢化钙要密封保存,遇水反应生成氢氧化钙和氢气”分析;
B、根据化合反应和复分解反应的概念进行分析;
C、根据题中信息进行分析;
D、根据氢化钙可以和水反应进行分析.A、根据题中信息“氢化钙要密封保存,遇水反应生成氢氧化钙和氢气”可知,氢化钙的化学性质不稳定,故错误;
B、氢气与钙加热制得氢化钙,属于化合反应;氢化钙和水反应生成氢氧化钙和氢气,生成物中氢气属于单质,因此该反应不属于复分解反应,故错误;
C、氢化钙作为能源提供剂是因为与水反应能生成氢气,故正确;
D、氢化钙可以和水反应生成氢气,因此不能用氢化钙干燥潮湿的二氧化碳、氯化氢等气体,故错误.
故选:C.点评:
本题考点: 化学性质与物理性质的差别及应用;反应类型的判定.
考点点评: 此题难度不大,根据所学化学知识结合题中信息进行分析是解题的关键所在.1年前查看全部
- 氢化钙可作为生氢剂,(氢化钙中氢的化合价为-1),反映的化学方程式在下面下列说法***错误***的是:
氢化钙可作为生氢剂,(氢化钙中氢的化合价为-1),反映的化学方程式在下面下列说法***错误***的是:
cah2+2h2o==ca(oh)2+2h2↑
a.氢化钙既是氧化剂,又是还原剂
b.氢气既是氧化产物,又是还原产物
c.氢化钙是还原剂,水是氧化剂
d.氧化产物于还原产物质量比为1:1
尤其反应物或生成物有两个同元素,价态还不一样。怎么说呢,就是一个式子有4个化合物,每个化合物都有同一个元素,这时候电子的具体移法是什么,怎么看?耐心的***如果明白我以上含糊其辞的概括,请详细的教教我,如果还遇到移电子这类问题该怎么去做? 清水火焰01年前2
清水火焰01年前2 -
 一个茸茸 共回答了19个问题
一个茸茸 共回答了19个问题 |采纳率94.7%错误的答案是A.这个化学反应过程,用文字来描述的就是,就是CaH2的-1价的氢将水的H2O中的+1价的H还原成不带电的原子,然后两个H原子结合成氢分子,即是H2.电子由CaH2中的-1价的H转移给水中的+1价的H,CaH2中-1价的H失去了...1年前查看全部
- 为什么登山制取氢气用氢化钙而不电解水?
为什么登山制取氢气用氢化钙而不电解水?
制取同等质量的氢气需要的水的质量要比氢化钙要少,负担更少,而且电解水还能产生氧气,为社么登山制取氢气用氧化钙而不电解水? 晟筠1年前1
晟筠1年前1 -
 cfyq123 共回答了17个问题
cfyq123 共回答了17个问题 |采纳率94.1%电解水耗电量大,成本太高,并且目前最经济的电源还是蓄电池,但蓄电池能量密度太低,比较笨重,相比之下,氢化钙制取氢气就简便的多,带几包氢化钙,在山上只要有液态水就可以很方便的制取大量的氢气.1年前查看全部
- 现有875g氢化钙固体(含CaH2 96%),与足量水反应可生成多少克氢气
现有875g氢化钙固体(含CaH2 96%),与足量水反应可生成多少克氢气
已知氢氧钙固体与水反应生成氢氧化钙的氢气///CaH2+2H2O=Ca(OH)2+2H2↑ guhong66661年前2
guhong66661年前2 -
 guoxin0338 共回答了18个问题
guoxin0338 共回答了18个问题 |采纳率83.3%纯氢化钙875*0.96/42=20mol
所以可以生成40mol的氢气
则氢气质量为:40mol*2g/mol=80g1年前查看全部
- 氢化钙(CaH 2 )固体是一种储氢材料,是登山运动员常用的能源提供剂。
氢化钙(CaH 2 )固体是一种储氢材料,是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物;
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气;
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得。某化学兴趣小组设计的制取装置如图1所示(固定装置省略)。
回答下列问题:
(1)装置A中制取氢气的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中制取氢化钙的化学方程式为 。
(4)若不改变温度,整套装置气密性的检查方法是 。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按图2(固定装置省略)所示连接仪器;
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0mL;
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合;
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0mL。
回答下列问题:
(5)如何判断样品与水完全反应: 。
(6)反应生成氢气的体积为 mL。
(7)已知该实验条件下,氢气的密度为0.09mg/mL,样品中氢化钙的纯度为 (结果精确到0.1%)。 beautifulgirl1年前1
beautifulgirl1年前1 -
 jiazhengjing 共回答了16个问题
jiazhengjing 共回答了16个问题 |采纳率87.5%1年前查看全部
- 氢化钙(CaH 2 中H为-1价)可作为生氢剂,反应的化学方程式为CaH 2 +2H 2 O=Ca(OH) 2 +2H
氢化钙(CaH 2 中H为-1价)可作为生氢剂,反应的化学方程式为CaH 2 +2H 2 O=Ca(OH) 2 +2H 2 ↑,下列说法错误的是( ) A.CaH 2 既是氧化剂,又是还原剂 B.H 2 既是氧化产物,又是还原产物 C.CaH 2 是还原剂,H 2 O是氧化剂 D.氧化产物与还原产物的质量比为1:1  wsanle1年前1
wsanle1年前1 -
 我要嫩白 共回答了16个问题
我要嫩白 共回答了16个问题 |采纳率93.8%A.CaH 2 中H元素为-1价,在反应中升高为0,则为还原剂,而H 2 O中H元素为+1价,在反应中降低为0,则为氧化剂,故A错误;
B.由反应可知,氧化产物与还原反应均为氢气,故B正确;
C.CaH 2 中H元素为-1价,在反应中升高为0,则为还原剂,而H 2 O中H元素为+1价,在反应中降低为0,则为氧化剂,故C正确;
D.氧化产物与还原反应均为氢气,其物质的量相同,则氧化产物与还原产物的质量比为1:1,故D正确;
故选A.1年前查看全部
- 氢化钙与水反应CaH2+2H2O=Ca(OH)2+2H2 下列说法不正确的是
氢化钙与水反应CaH2+2H2O=Ca(OH)2+2H2 下列说法不正确的是
A CaH2既是氧化剂又是还原剂 B H2既是氧化产物,又是还原产物
C CaH2是还原剂,H2O是氧化剂 D 氧化产物与还原产物质量比是1:1 浪子心生1年前1
浪子心生1年前1 -
 julyryt 共回答了13个问题
julyryt 共回答了13个问题 |采纳率100%氢化钙里氢是负一价的,作还原剂.水中的氢有两方面用途:一方面负责氢氧化钙的全部氢原子,另一方面负责氢气里的氢.也即是说,水是氧化剂,氢化钙是还原剂,氢气既是氧化产物又是还原产物,产量,2:2=1:1.因此a错1年前查看全部
- 氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成的氢气供燃烧之需,化学方程式为:CaH2+2H2O=C
氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成的氢气供燃烧之需,化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,现有84g氢化钙与足量水反应,可生成多少克氢气?
 南十字军军士1年前1
南十字军军士1年前1 -
 flykone 共回答了21个问题
flykone 共回答了21个问题 |采纳率90.5%解题思路:根据氢化钙与水反应生成氢氧化钙和氢气的反应化学方程式可表示反应中各物质的质量关系,可利用参加反应的氢化钙的质量计算出生成的氢气的质量.设84g氢化钙与足量水反应生成氢气的质量为x
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
84g x
[42/84g=
4
x] x=8g
答:84g氢化钙与足量水反应可生成氢气8g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 反应的化学方程式能表示出反应中各物质的质量比,根据物质的质量比,可由反应中任一物质的质量计算出反应中其它物质的质量.1年前查看全部
- 氢化钙(CaH2)固体可用于登山队员的能源提供剂,它和水反应生成氢氧化钙和氢气:CaH2+2H2O═Ca(OH)2+2H
氢化钙(CaH2)固体可用于登山队员的能源提供剂,它和水反应生成氢氧化钙和氢气:CaH2+2H2O═Ca(OH)2+2H2↑,氢气供燃烧之需.现有84g氢化钙与足量水反应,可生成多少克氢气?
 sdzl1231年前1
sdzl1231年前1 -
 hudeji1214 共回答了17个问题
hudeji1214 共回答了17个问题 |采纳率88.2%解题思路:根据氢化钙与水反应生成氢氧化钙和氢气的反应化学方程式可表示反应中各物质的质量关系,可利用参加反应的氢化钙的质量计算出生成的氢气的质量.设84g氢化钙与足量水反应生成氢气的质量为x
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
84g x
[42/84g=
4
x] x=8g
答:84g氢化钙与足量水反应可生成氢气8g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 反应的化学方程式能表示出反应中各物质的质量比,根据物质的质量比,可由反应中任一物质的质量计算出反应中其它物质的质量.1年前查看全部
- (2012•呼和浩特)氢化钙(CaH2)固体可用于登山队员的能源提供剂,与氢气做能源相比它的优点是______;它和水反
(2012•呼和浩特)氢化钙(CaH2)固体可用于登山队员的能源提供剂,与氢气做能源相比它的优点是______;它和水反应生成氢氧化钙和氢气,则该反应的化学方程式为______.
 你看你看1年前1
你看你看1年前1 -
 lgnmg 共回答了19个问题
lgnmg 共回答了19个问题 |采纳率89.5%解题思路:欲正确解答本题,需从氢化钙是固体,比气体便于携带方面考虑;
找出反应物,生成物,根据化学方程式的书写规则正确书写化学方程式.氢化钙是固体,携带方便,与水作用,能很快产生氢气,氢气燃烧,放出的热量很多且产物为水对空气不造成污染.故与氢气做能源相比它的优点是携带方便;
反应物为氢化钙和水,生成物是氢氧化钙和氢气,反应的化学方程式为:CaH2+2H2O═Ca(OH)2+2H2↑;
故答案为:携带方便;CaH2+2H2O═Ca(OH)2+2H2↑.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了化学方程式的书写,只要找出反应物和生成物,配平即可.1年前查看全部
- 两道化学题 、求真相帝 、1、保存氢化钙时应注意什么 ?2、现将A,B两种物质各10g加热 、A完全反应,生成8gC和4
两道化学题 、求真相帝 、
1、保存氢化钙时应注意什么 ?
2、现将A,B两种物质各10g加热 、A完全反应,生成8gC和4gD ,则参加反应的A和B的质量比是?
要过程 loveinhere_20061年前5
loveinhere_20061年前5 -
 hlto 共回答了19个问题
hlto 共回答了19个问题 |采纳率89.5%1、在干燥密封的条件下保存,否则会变质
2、
A + B = C + D
10g 10g 8g 4g
根据质量守恒定律,反应物总质量等于生成物总质量,所以:
A + B = C + D
10g + ?= 12g
可得出 B 参加反应的质量为2g
A :B = 10g:2g = 5:11年前查看全部
- 氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂. 【阅读资料】 ①碱石灰是氧化钙和
 xgirl_18801年前1
xgirl_18801年前1 -
 A皓天A 共回答了17个问题
A皓天A 共回答了17个问题 |采纳率94.1%方程式吗? CaH2+H2O==Ca(OH)2+H21年前查看全部
- 氢化钙(CaH2)固体是登山运动员常用的能源剂,用它和水反应生成氢氧化钙和氢气( CaH2+2H2O=Ca(O
氢化钙(CaH2)固体是登山运动员常用的能源剂,用它和水反应生成氢氧化钙和氢气( CaH2+2H2O=Ca(OH)2+2H2↑ ),氢气供燃烧之需.现要得到8g氢气,需要多少克氢化钙与足量水反应?(精确到0.1%)
 娃哈哈f401年前1
娃哈哈f401年前1 -
 xiaoxuedaxue 共回答了23个问题
xiaoxuedaxue 共回答了23个问题 |采纳率95.7%解题思路:由反应的化学方程式可以确定反应中氢气与氢化钙的质量比,利用此质量比,由氢气质量计算氢化钙质量.设需要氢化钙的质量为x
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
x8g
[42/4=
x
8g]
x=84g
答:需要氢化钙的质量为84g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题为根据化学方程计算的基础题型,符合要求的书写格式及计算结果的准确性是影响本题的因素.1年前查看全部
- 氢化钙固体登山运动员常用的能源提供剂
氢化钙固体登山运动员常用的能源提供剂
氢化钙固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙.
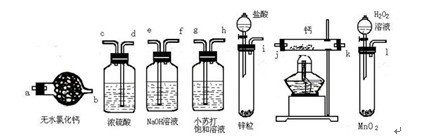
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为 ▲ (填仪器接口的字母编号);
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞; ▲ (请按正确的顺序填入下列步骤的标号);
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.
① 写出CaH2与水反应的化学方程式 ▲ ;②该同学的判断不正确,原因是 ▲ ;
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象
不说别的我就想知道无水氯化钙放在最末尾是做什么的,前面的小苏打氢氧化钠和浓硫酸都是吸收什么? 北风萧瑟1年前1
北风萧瑟1年前1 -
 weiwodaofen 共回答了24个问题
weiwodaofen 共回答了24个问题 |采纳率79.2%一般来说无水氯化钙是除检验水的,小苏打氢氧化钠是除 co2的,浓硫酸吸水1年前查看全部
- 氢化钙(CaH 2 )固体是登山队员常用的能源提供剂,用它与水反应生成氢氧化钙和氢气:CaH 2 + 2H 2 O==
氢化钙(CaH 2 )固体是登山队员常用的能源提供剂,用它与水反应生成氢氧化钙和氢气:CaH 2 + 2H 2 O==
Ca(OH) 2 +2H 2 ↑,氢气供燃烧之需,现有84g氢化钙与足量水反应,可生成多少克H 2 ? 哮喘晚期1年前0
哮喘晚期1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 登山运动员常利用氢化钙固体作为能源提供剂,在需要时与水反应生成其他物质和氢气,提供燃料。某兴趣小组用纯净干燥的氢气和金属
登山运动员常利用氢化钙固体作为能源提供剂,在需要时与水反应生成其他物质和氢气,提供燃料。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图如下:

A B C D E
查阅资料:(1)钙易与水反应生成碱和气体。
(2)无水氯化钙能作干燥剂。
(1)请写出E图中仪器①的名称 。
(2) 请按气流方向连接顺序i接(),()接(),()接(),k接 a
(填仪器接口的字母编号)。写出C中可能发生的化学方程式 。
(3)实验结束后,某同学取少量生成物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验的确有CaH 2 生成。另一位同学认为该同学的判断不准确,原因是 。
(4)氢化钙作为能源提供剂,与直接用氢气相比,其优点是 考试癖1年前1
考试癖1年前1 -
 独游 共回答了21个问题
独游 共回答了21个问题 |采纳率85.7%(1)铁架台;
(2)e,f接d,c接j;AgNO 3 + HCl= AgCl↓+HNO 3
(3)钙与水反应也能生成碱,同时也有气泡冒出;
(4)便于携带;安全;通过反应,能将水中的氢元素部分转化为氢气
1年前查看全部
- 氢化钙CaH2与冰反应放出氢气,生成对应的碱.(要化学方程式)(生成的碱沉淀吗?)
 wuvs0071年前1
wuvs0071年前1 -
 小米傻瓜 共回答了16个问题
小米傻瓜 共回答了16个问题 |采纳率81.3%CaH2 +2H2O ==Ca(OH)2 +2H2
不沉淀,这不是溶液中的反应,反应物都是固体.1年前查看全部
- (2013•昆明一模)氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生反应的化学方程式为CaH2+2H2O=Ca(O
(2013•昆明一模)氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.若制取10g氢气,需要消耗多少氢化钙?
 娃娃的眼睛1年前1
娃娃的眼睛1年前1 -
 我爱小瑜521 共回答了18个问题
我爱小瑜521 共回答了18个问题 |采纳率83.3%设消耗氢化钙的质量为x.
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
x 10g
[42/x=
4
10g]
解之得:x=105g
答:需要消耗105克氢化钙.1年前查看全部
- 氢化钠固体(NaH)和氢化钙固体(CaH 2 )都可与水反应生成氢气和相应的碱.
氢化钠固体(NaH)和氢化钙固体(CaH 2 )都可与水反应生成氢气和相应的碱.
(1)有关反应的化学方程式为______、______.
(2)若用等质量的NaH和CaH 2 分别与水反应,生成氢气较多的是______. zzzz01011年前1
zzzz01011年前1 -
 孤殉雪 共回答了19个问题
孤殉雪 共回答了19个问题 |采纳率89.5%(1)根据题意可以知道氢化钠和水反应生成了氢氧化钠和氢气,而氢化钙和水反应生成了氢氧化钙和氢气,故可以写出它们反应的化学方程式;
(2)在这里我们可以设氢化钠和氢化钙的质量为1g,然后根据化学方程式进行计算并比较后得出结论;
设1g氢化钠和水反应生成氢气的质量为x
NaH+H 2 O═NaOH+H 2 ↑
242
1g x
24
2 =
1g
x
解得 x=0.08g
设1g氢化钙和水反应生成氢气的质量为y
CaH 2 +2H 2 O═Ca(OH) 2 +2H 2 ↑
42 4
1gy
42
4 =
1g
y
解得 y=0.095g
通过比较可以得出等质量的NaH和CaH 2 分别与水反应,生成氢气较多的是氢化钙.
故答案为:(1)NaH+H 2 O═NaOH+H 2 ↑;CaH 2 +2H 2 O=═Ca(OH) 2 +2H 2 ↑;
(2)CaH 2 .1年前查看全部
- 已知:CaH2+2H2O=Ca(OH)2+2H2↑,请设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的
已知:CaH2+2H2O=Ca(OH)2+2H2↑,请设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象_______
 flyingdust11141年前1
flyingdust11141年前1 -
 了残烟 共回答了15个问题
了残烟 共回答了15个问题 |采纳率93.3%取少量固体在干燥条件下与氧气反应,将生成的产物通入无水硫酸铜干燥管,观察硫酸铜颜色变化,硫酸铜变蓝说明固体是氢化钙,无明显现象是钙单质.
如果你认可我的回答,请及时点击采纳为【满意回答】按钮
手机提问者在客户端右上角评价点“满意”即可.
你的采纳是我前进的动力! 如还有新的问题,请另外向我求助,答题不易,谢谢支持…1年前查看全部
- CaH2+2H2O==Ca(OH)2+2H2↑现有875g氢化钙固体(含CaH2 96%)与足量水反应可生成多少克氢气?
 突然短路1年前1
突然短路1年前1 -
 taotao12 共回答了20个问题
taotao12 共回答了20个问题 |采纳率85%有氢化钙840g=20mol 由方程可得,氢化钙和氢气是1:2,所以产生氢气40mol=80g1年前查看全部
- (2010•龙岩)金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
(2010•龙岩)金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
CaH2+2H2O=Ca(OH)2+2H2↑NaH+H2O=NaOH+H2↑
(1)若某化学反应需要消耗10g氢气,需要消耗多少克NaH?
(2)登山运动员登山时也需通过金属氢化物与水反应获得氢气以提供必须的能量.小红认为,若用CaH2替代NaH,有利于登山运动员减轻包袱负担.为什么? 阿珍20081年前1
阿珍20081年前1 -
 1207226 共回答了17个问题
1207226 共回答了17个问题 |采纳率94.1%解题思路:(1)10g氢气来自于氢化钠与水的反应,因此根据氢化钠与水反应的化学方程式可计算生成10g氢气需要消耗氢化钠的质量;
(2)比较生成相同质量的氢气消耗氢化钠与氢化钙的质量大小,就能得到减轻包袱负担的原因.(1)设制10g氢气需消耗氢化钠的质量为x
NaH+H2O=NaOH+H2↑
24 2
x 10g
24:2=x:10g
解之得 x=120g
答:制10g氢气需消耗氢化钠的质量为120g;
(2)设生成10g氢气需消耗氢化钙的质量为y
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
y 10g
42:4=y:10g
解之得 y=105g
∵生成10g氢气需氢化钙105g,而需氢化钠却要120g
∴得到同样质量的氢气消耗氢化钙的质量小于氢化钠质量,因此,可以减轻包袱负担.点评:
本题考点: 根据化学反应方程式的计算;化学方程式的概念、读法和含义.
考点点评: 根据反应的化学方程式可知:消耗24份质量的氢化钠可得到2份质量的氢气,消耗42份质量的氢化钙就可得到4份质量的氢气,显然得到相同质量的氢气,消耗氢化钠的质量大于氢化钙的质量.1年前查看全部
- 氢化钙固体是登山队员常用的能源提供剂,用它和水反应生成轻言滑盖和氢气:CaH2+2H2O=Ca(OH)2+2H2↑.氢气
氢化钙固体是登山队员常用的能源提供剂,用它和水反应生成轻言滑盖和氢气:CaH2+2H2O=Ca(OH)2+2H2↑.氢气供燃烧之需.现有84g氢化钙与足量水反应,可生成多少克氢气?
 dd高手1年前1
dd高手1年前1 -
 louisu 共回答了19个问题
louisu 共回答了19个问题 |采纳率94.7%设可生成x克氢气.
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
84 x
42/84=4/x
x=8
答:可生成8克氢气.1年前查看全部
- 氢化钙与水反应,水是做什么剂如题.氢氧化钙,和氢气中的氢元素.到底哪个是来自水的?并请说明理由,我要的并不只是一个答案而
氢化钙与水反应,水是做什么剂
如题.
氢氧化钙,和氢气中的氢元素.到底哪个是来自水的?
并请说明理由,我要的并不只是一个答案而已.
两位答得都很好,不知道选谁的…… 沉e浮1年前2
沉e浮1年前2 -
 少年洪七 共回答了13个问题
少年洪七 共回答了13个问题 |采纳率100%氢化钙与水反应,水是做氧化剂
CaH2+2H2O=Ca(OH)2+2H2
其中氢气中的氢元素是-1价氢升价,+1价氢降价得到的,所以氢气中的氢来自CaH2和H2O,而Ca(OH)2中的氢元素是+1价,没有发生变价,所以Ca(OH)2中的氢元素来自水1年前查看全部
- 3个化学方程式的双线桥表示方法1.氯气和氢氧化钾反应2.氢化钙和水3.氧化亚铁和稀硝酸反应用双线桥的表示方法还有要标出氧
3个化学方程式的双线桥表示方法
1.氯气和氢氧化钾反应2.氢化钙和水3.氧化亚铁和稀硝酸反应用双线桥的表示方法还有要标出氧化剂和还原剂谢谢 shengglay1年前1
shengglay1年前1 -
 爱吾师更爱真理 共回答了18个问题
爱吾师更爱真理 共回答了18个问题 |采纳率88.9%Cl2+2KOH=KClO+KCl+H2O氯气得一摩尔电子到氯化钾,氯气失一摩尔电子到次氯酸钾;CaH2+2H2O=Ca(OH)2+2H2,氢负离子失两摩尔电子到氢气,水中氢离子得两摩尔电子到氢气;3FeO+10HNO3=3Fe(NO3)3+5H2O+NO二价铁失一乘三摩尔电子到三价铁,五价氮得三摩尔电子到二价氮…1年前查看全部
- 氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢气供燃烧之需,反应的化学方程式为:
氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢气供燃烧之需,反应的化学方程式为:
(1)氢化钙中钙、氢元素的原子个数为——,氢元素的质量分数为(精确到0.1%) lesgo19761年前1
lesgo19761年前1 -
 波波的MM 共回答了18个问题
波波的MM 共回答了18个问题 |采纳率88.9%(1)氢化钙:CaH2,所以钙氢原子个数比是:1:2
(2)氢元素的质量分数:w(H) = 2 / 42 * 100% = 4.8%
(3)化学方程式:CaH2 + 2H2O = Ca(OH)2 + 2H2↑1年前查看全部
- 氢化钙固体是登山运动员常用的能源提供剂
氢化钙固体是登山运动员常用的能源提供剂
同学利用图2装置测定上述实验中得到的氢化钙的纯度.他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处.(上述气体体积均在标准状况下测定)
盛有水和氢化钙的两支试管用两只橡胶管连接的原因是,
使两支试管中的物质发生反应的操作方法是 .
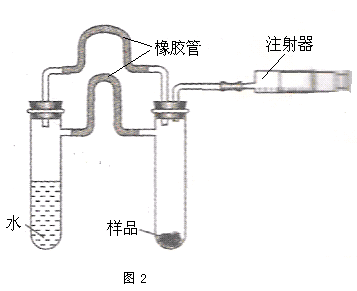
 无间道的善良人1年前1
无间道的善良人1年前1 -
 gflqs 共回答了14个问题
gflqs 共回答了14个问题 |采纳率100%(1)便于移动两支试管,使水进入样品中,同时由于有两个橡皮管起到平衡压强的作用,防止水进入样品中造成注射器活塞后移
(2)把装水的试管太高,水从下端的橡胶管中流入样品中,即可1年前查看全部
- 关于CaH2(氢化钙)登山队员常用的能源是氢化钙(CaH2)固体.用它和水反应生成氢气供燃烧之需,反应方程式:CaH2
关于CaH2(氢化钙)
登山队员常用的能源是氢化钙(CaH2)固体.用它和水反应生成氢气供燃烧之需,反应方程式:CaH2 + 2H2O == Ca(OH)2 + 2H2↑.则
1、现在有840克氢化钙固体能源,与足量水反应.可以生成氢气_____克.
2、这些氢气完全燃烧时放出的热量为______焦.(氢的热值为1.4×10^8焦/千克 ) 我长的不高也不矮1年前1
我长的不高也不矮1年前1 -
 逆天笑 共回答了16个问题
逆天笑 共回答了16个问题 |采纳率93.8%可生成80g H2; 产生的热量为1.12*10'7焦耳.1年前查看全部
- (2012•石景山区一模)氢化钙(CaH2)是一种重要的制氢剂,与水接触时,发生反应生成氢氧化钙和氢气.
(2012•石景山区一模)氢化钙(CaH2)是一种重要的制氢剂,与水接触时,发生反应生成氢氧化钙和氢气.
(1)写出该反应的化学方程式.
(2)若需要40g氢气,计算至少需要消耗氢化钙的质量. 娃哈哈fe5601年前1
娃哈哈fe5601年前1 -
 猛龙战机 共回答了27个问题
猛龙战机 共回答了27个问题 |采纳率85.2%解题思路:(1)根据反应物、生成物与反应条件书写化学方程式;
(2)可根据化学方程式进行计算,写出配平的化学方程式,找出氢气和氢化钙的质量比,列出比例式求解.【解】(1)反应物氢化钙和水生成物为氢氧化钙和氢气;反应条件为常温,
故化学方程式为:CaH2+2H2O═Ca(OH)2+2H2↑故答案为:CaH2+2H2O═Ca(OH)2+2H2↑
(2)设至少需要消耗氢化钙的质量为x.
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
x 40g
[42/x=
4
40g]
x=420 g
答:需要消耗氢化钙的质量为420g点评:
本题考点: 根据化学反应方程式的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生利用化学方程式进行简单计算的能力.试题比较简单,关键是要步骤规范,才能保证不失分.1年前查看全部
- 15.0mL的水和100mg的氢化钙(含杂质)完全反应,生成氢氧化钙和氢气.氢气的体积为100mL,密度是0.09mg/
15.0mL的水和100mg的氢化钙(含杂质)完全反应,生成氢氧化钙和氢气.氢气的体积为100mL,密度是0.09mg/mL.
求样品中的氢化钙纯度?(杂质是钙、钙遇水发生剧烈反应生成氢氧化钙和氢气) liws1081年前1
liws1081年前1 -
 丫丫在mm 共回答了12个问题
丫丫在mm 共回答了12个问题 |采纳率91.7%氢气的质量为100mL*0.09mg/mL=9mg
设样品中氢化钙的质量为X,反应生成氢气的质量为Y
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
X Y
Ca+2H2O=Ca(OH)2+H2↑
40 2
100-X 9-Y
42:4=X:Y
40:2=(100-X):(9-Y)
解得X=88.42mg
样品中的氢化钙纯度为88.42mg/100mg*100%=88.42%
答:样品中的氢化钙纯度为88.42%1年前查看全部
- 氢化钙(CaH2)固体可用于登山队员的能源提供剂,它和水反应生成氢氧化钙和氢气:CaH2+2H2O═Ca(OH)2+2H
氢化钙(CaH2)固体可用于登山队员的能源提供剂,它和水反应生成氢氧化钙和氢气:CaH2+2H2O═Ca(OH)2+2H2↑,氢气供燃烧之需.现有84g氢化钙与足量水反应,可生成多少克氢气?
 意源101年前1
意源101年前1 -
 一杯盐水 共回答了13个问题
一杯盐水 共回答了13个问题 |采纳率92.3%解题思路:根据氢化钙与水反应生成氢氧化钙和氢气的反应化学方程式可表示反应中各物质的质量关系,可利用参加反应的氢化钙的质量计算出生成的氢气的质量.设84g氢化钙与足量水反应生成氢气的质量为x
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
84g x
[42/84g=
4
x] x=8g
答:84g氢化钙与足量水反应可生成氢气8g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 反应的化学方程式能表示出反应中各物质的质量比,根据物质的质量比,可由反应中任一物质的质量计算出反应中其它物质的质量.1年前查看全部
- 氢化钠固体(NaH)和氢化钙固体(CaH2)都可与水反应生成氢气和相应的碱.
氢化钠固体(NaH)和氢化钙固体(CaH2)都可与水反应生成氢气和相应的碱.
(1)有关反应的化学方程式为______、______.
(2)若用等质量的NaH和CaH2分别与水反应,生成氢气较多的是______. 排排站吃果果1年前1
排排站吃果果1年前1 -
 lihui2008123456 共回答了22个问题
lihui2008123456 共回答了22个问题 |采纳率90.9%解题思路:(1)根据题给的信息可以完成对这两个化学方程式的书写;
(2)根据化学方程式可以计算出生成氢气的质量,进行比较后可以得出答案.(1)根据题意可以知道氢化钠和水反应生成了氢氧化钠和氢气,而氢化钙和水反应生成了氢氧化钙和氢气,故可以写出它们反应的化学方程式;
(2)在这里我们可以设氢化钠和氢化钙的质量为1g,然后根据化学方程式进行计算并比较后得出结论;
设1g氢化钠和水反应生成氢气的质量为x
NaH+H2O═NaOH+H2↑
242
1g x
[24/2=
1g
x]
解得 x=0.08g
设1g氢化钙和水反应生成氢气的质量为y
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
1gy
[42/4 =
1g
y]
解得 y=0.095g
通过比较可以得出等质量的NaH和CaH2分别与水反应,生成氢气较多的是氢化钙.
故答案为:(1)NaH+H2O═NaOH+H2↑;CaH2+2H2O=═Ca(OH)2+2H2↑;
(2)CaH2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 在书写化学方程式时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件;在书写化学方程式时要注意条件,物质的状态符号和配平.1年前查看全部
- (2010•晋江市质检)氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢气供燃烧之需,反应的化学方程
(2010•晋江市质检)氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢气供燃烧之需,反应的化学方程式为:CaH2+2H2O═Ca(OH)2+2H2↑.现有126g氢化钙与足量水反应,可生成氢气的质量多少?
 blue_0071年前1
blue_0071年前1 -
 dabin330 共回答了20个问题
dabin330 共回答了20个问题 |采纳率90%解题思路:根据反应的化学方程式,由反应物氢化钙的质量计算反应生成物氢气的质量.设可生成氢气的质量为x
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
126g x
42:4=126g:x
解之得 x=12g
答:现有126g氢化钙与足量水反应,可生成氢气的质量为12g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 化学方程式计算类的基本计算题型,作答时注意解题过程的完整和解题格式的完善.1年前查看全部
- 氢化钙可作为生氢剂,化学方程式是CaH2+2H2O═Ca(OH)2+2H2↑,下列有关叙述正确的是( )
氢化钙可作为生氢剂,化学方程式是CaH2+2H2O═Ca(OH)2+2H2↑,下列有关叙述正确的是( )
A. 氢化钙被还原
B. 水既是氧化剂,又是还原剂
C. H2既是氧化产物,也是还原产物
D. H2O发生氧化反应 sentlin13981年前4
sentlin13981年前4 -
 田是这样的吗 共回答了9个问题
田是这样的吗 共回答了9个问题 |采纳率100%解题思路:CaH2中H为-1价,具有还原性,可被氧化,H2O中H为+1价,具有氧化性,可被还原,则在该反应中,CaH2是还原剂,H2O是氧化剂,H2既是氧化产物又是还原产物,以此解答该题.A.反应中CaH2为还原剂,H为-1价,具有还原性,可被氧化,故A错误;
B.H2O中H为+1价,生成氢气,H2O是氧化剂,故B错误;
C.反应中只有H元素化合价发生变化,H2既是氧化产物又是还原产物,故C正确;
D.H2O是氧化剂,发生还原反应,故D错误.
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中还原剂、氧化剂判断的考查,题目难度不大.1年前查看全部
- 氢化钙固体登山运动员常用的能源提供剂.某兴趣小组长拟选用如下装置制备氢化钙.
氢化钙固体登山运动员常用的能源提供剂.某兴趣小组长拟选用如下装置制备氢化钙.
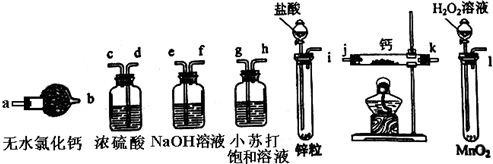
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为______(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞______(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间B.收集气体并检验其纯度
C.关闭分液漏斗活塞D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成.
①写出CaH2与水反应的化学方程式______;
②该同学的判断不正确,原因是______.
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象______(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是______. lonely_lu1年前1
lonely_lu1年前1 -
 kjwfjwh 共回答了17个问题
kjwfjwh 共回答了17个问题 |采纳率88.2%解题思路:(1)一般制备纯净干燥的气体的实验装置的顺序为:制备装置→除杂装置→干燥装置等;
(2)实验过程中要保证整个装置内已充满氢气,实验的操作程序是:检查装置的气密性→产生氢气→收集氢气并进行验纯→加热反应→停止加热→继续通氢气至冷却→停止通入氢气;
(3)CaH2中H元素的化合价为-1价,CaH2具有还原性,与水发生氧化还原反应生成Ca(OH)2和H2;Ca与水反应也能产生Ca(OH)2和H2;
(4)区分钙和氢化钙时可利用其组成、性质的差异来判断;
(5)作为能源,氢化钙是固体,比氢气更易携带,使用也较方便.(1)氢化钙和金属钙都是极强的还原剂,遇水、遇空气都能发生剧烈反应,因此在制取氢化钙时,必须要除去空气、水等其他杂质;在题给的实验装置中,不难判断出氢气的发生装置,氢气的净化装置和氢化钙的生成装置等,其连接顺序为i→e→f→d→c→j→k(或k→j)→a;故答案为:i→e,f→d,c→j,k(或k,j)→a;
(2)为保证整个装置内已充满氢气,因此实验的操作程序是:检查装置的气密性→产生氢气→收集氢气并进行验纯→加热反应→停止加热→继续通氢气至冷却→停止通入氢气,故答案为:BADC;
(3)CaH2和Ca与水反应都能产生Ca(OH)2和H2,反应方程式分别为:CaH2+2H2O=Ca(OH)2+2H2↑和Ca+2H2O=Ca(OH)2+H2↑,因此不能根据反应后溶液呈碱性判断是否含有CaH2,故答案为:CaH2+2H2O=Ca(OH)2+2H2↑;金属钙与水反应也有类似现象;
(4)CaH2可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色,故答案为:取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色;
(5)作为能源,氢化钙明显比氢气更易携带,使用也较方便,故答案为:氢化钙是固体,携带方便.点评:
本题考点: 制备实验方案的设计;连接仪器装置;气体的净化和干燥.
考点点评: 本题考查元素化合物知识,涉及到物质的性质和制备实验,注意实验的一般方法.1年前查看全部
- 氢化钙中氢的化学价与钙的化学价?
氢化钙中氢的化学价与钙的化学价?
氢的化学价不是正1价么? ryujhjfgh1年前4
ryujhjfgh1年前4 -
 hym1 共回答了20个问题
hym1 共回答了20个问题 |采纳率95%从名字上就可以看出来“氢化钙”,“氢化”就说明
氢得了电子嘛!如果氢是+1价,则叫做“钙化氢”了.
还可以从书写方式看出:一般情况下,得电子的元素写在右边,比如CO2,CO,SO2,SO3……
有一个金属活动性表:
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
(从左到右,失电子能力减小)
可以看出,钙比氢的失电子能力要强,也就是氢比钙的得电子能力要强,所以氢会抢钙的电子,得到-1价的H
所以,在氢化钙中,氢是的电子的,是-1价的.
钙是像往常一样,+2价.1年前查看全部
- 氢化钾 氢化钠 氢化钙都是强碱吗?那为啥氢氧化钙就不是强碱呢?氢氧化钾V.S.氢氧化钠谁更强呢?
 applefxzfxz0351年前6
applefxzfxz0351年前6 -
 adwer 共回答了17个问题
adwer 共回答了17个问题 |采纳率82.4%1.氢化钾、氢化钠、氢化钙从化学定义上不是碱,分类都为氢化物.由于和水一起反应,生成NaOH、KOH等强碱,所以呈强碱性,但不是碱.
2.单从电离度而碱度来看,氢氧化钙是强碱,但由于其水溶性较差,所以溶解在水里部分有限,使得水中氢氧根浓度较小,故只是中强碱.
3.根据元素周期律来说,氢氧化钾碱性应该强于氢氧化钠1年前查看全部
- 氢化钙可以和氢氧化钠反应生成氢气吗?
 松鼠88601年前1
松鼠88601年前1 -
 猪肉难吃猪好养 共回答了22个问题
猪肉难吃猪好养 共回答了22个问题 |采纳率90.9%和水反应,不适合氢氧化钠反应.
本人来自知名团队,答题认真,准确率极高.欢迎继续提问.1年前查看全部
- 金属氢化物是如何制备的?如氢化钠,氢化钙
 无名06081年前2
无名06081年前2 -
 第五骑兵kk 共回答了15个问题
第五骑兵kk 共回答了15个问题 |采纳率80%制备条件比较苛刻:
300度以上,细的金属粉末在高压氢气流中加热10多个小时才能得到产品
实验室制备几乎不可能1年前查看全部
- 氢化钙投入水中产生的气体会燃烧吗?
 blxfkm1年前1
blxfkm1年前1 -
 哈利油条 共回答了24个问题
哈利油条 共回答了24个问题 |采纳率87.5%会,产生的是氢气.
CaH2+2H2O====Ca(OH)2+2H2↑
反应原理:氢化钙是离子化合物,其中的氢负离子与水电离出的氢正离子氧化还原生成氢原子,后结合生成氢分子.从而水溶液中氢离子浓度降低,促进了水的电离,反应持续进行.
顺便说一句,氢化钙是常用的野外生氢剂.1年前查看全部
- 请设计一个实验,用化学方法区分钙和氢化钙
 轨丑zz1年前1
轨丑zz1年前1 -
 xiesuan 共回答了29个问题
xiesuan 共回答了29个问题 |采纳率82.8%用碳酸钠溶液检验:若有白色沉淀生成者,则为氯化钙,不反应者为钙1年前查看全部
- 如何判断氢化钙与钙,(最好用简单的化学方法)
 风扇1年前1
风扇1年前1 -
 天地远 共回答了19个问题
天地远 共回答了19个问题 |采纳率78.9%用无水乙醇,钙能与它反应,氢化钙不能1年前查看全部
- (2012•丹阳市二模)氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.氢化钙一旦接触到水就发生
(2012•丹阳市二模)氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.氢化钙一旦接触到水就发生反应生成氢气.实验小组的同学对氢化钙作了以下探究:
[探究一]氢化钙与水反应生成氢气的同时生成的另一种产物是什么?
甲同学认为是氧化钙,而乙同学认为是氢氧化钙.小组其他同学讨论后一致确认乙同学的猜想是正确的,你认为他们的理由是______.
[探究二]实验室模拟制取氢化钙
[查阅资料]Ⅰ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅱ.活动性很强的金属遇水即剧烈反应生成相应的碱和氢气.
[实验装置]同学们设计了以下实验装置:
请回答:
(1)图1装置A 的作用是制H2,请写出实验室制H2的化学方程式______;
(2)图1装置B 中装有无水氯化钙,其作用是干燥H2.有同学建议:为确保H2已彻底干燥,应在B、C之间连接图2中的______(填①或②)装置.
(3)图1D装置中浓硫酸的作用是______.D装置中F导管的作用是______.
[实验步骤]利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品,______(请按正确的顺序填入下列步骤的序号).
①加热反应一段时间②打开分液漏斗活塞 ③关闭分液漏斗活塞④停止加热,充分冷却
有同学建议:为了安全,应在步骤①前增加______
(填实验操作)再进行后续实验.
[实验拓展]制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.请你判断他的结论是否正确并说明理由______. luoxuejun1年前1
luoxuejun1年前1 -
 鼠恋米 共回答了18个问题
鼠恋米 共回答了18个问题 |采纳率83.3%解题思路:【探究一】根据氧化钙能与水反应生成氢氧化钙进行解答;
【实验装置】:(1)根据实验室用稀硫酸和锌粒反应制取氢气进行解答;
(2)根据气体要经过B、C,所以应该连接U形管进行解答;
(3)根据浓硫酸具有吸水性以及E导管中液面升降情况来控制通氢气的速度进行解答;
[实验步骤]:根据实验步骤以及注意事项以及氢气实验前应该先验纯进行解答;
[实验拓展]:根据钙与水反应也生成氢氧化钙和氢气,以及氢氧化钙溶液显碱性进行解答.【探究一】氧化钙能与水反应生成氢氧化钙,所以乙同学的猜想是正确的;
【实验装置】:(1)实验室用稀硫酸和锌粒反应制取氢气,化学方程式Zn+H2SO4=ZnSO4+H2↑;
(2)气体要经过B、C,所以应该连接U形管,应在B、C之间连接图2中的②装置;
(3)浓硫酸具有吸水性,图1D装置中浓硫酸的作用是:防止空气中的水进入C中;D装置中F导管的作用是:根据E导管中液面升降情况来控制通氢气的速度;
[实验步骤]:实验步骤如下:检查装置气密性后装入药品,②打开分液漏斗活塞,①加热反应一段时间,④停止加热,充分冷却,③关闭分液漏斗活塞;氢气实验前应该先验纯,所以为了安全,应在步骤①前增加在F导管口收集氢气进行验纯;
[实验拓展]:钙与水反应也生成氢氧化钙和氢气,氢氧化钙溶液显碱性也能使滴入酚酞后显红色,故他的结论不正确.
故答案为:【探究一】氧化钙能与水反应生成氢氧化钙;
【探究二】实验室模拟制取氢化钙
【实验装置】
(1)Zn+H2SO4=ZnSO4+H2↑; (2)②(3)防止空气中的水进入C中; 根据E导管中液面升降情况来控制通氢气的速度;
【实验步骤】②①④③;在F导管口收集氢气进行验纯;
【实验拓展】不正确,因为钙与水反应也生成氢氧化钙和氢气.点评:
本题考点: 实验探究物质的性质或变化规律;气体的干燥(除水);氢气的制取和检验;书写化学方程式、文字表达式、电离方程式;氢气、一氧化碳、甲烷等可燃气体的验纯.
考点点评: 解答时注意分析题目所给信息并结合所学知识,对信息加以整合,依据题意分析问题、解决问题.1年前查看全部
- 氢化钙 是怎么回事 氢元素和钙元素的化合价分别是多少
 chenlei21nt1年前4
chenlei21nt1年前4 -
 林林彼岸 共回答了26个问题
林林彼岸 共回答了26个问题 |采纳率96.2%活泼金属可以和H形成金属氢化物,
比如 NaH,KH,BaH2 等等
里面的H 都是 -1价的 ,金属是正价的 ,比如CaH2 中Ca +2 价,H -1价
形成原因是 Ca,Na等元素太容易失去电子了.1年前查看全部
- 硫化钙为什么在水中不存在?为什么会生成硫氢化钙?
 m4694925651年前1
m4694925651年前1 -
 了即 共回答了16个问题
了即 共回答了16个问题 |采纳率81.3%因为生成的硫化锌溶于酸若反应则是:Zn2 H2S== ZnS 2H 这个反应是逆向进行的.而硫化钙是也是出于同样的道理硫化钙固体遇水就水解了,在水中不存在1年前查看全部
- 氢化钙可以作为生氢气体中水的作用是
 lvxiaomin1年前1
lvxiaomin1年前1 -
 别逼我做kk 共回答了18个问题
别逼我做kk 共回答了18个问题 |采纳率94.4%氧化剂1年前查看全部
- 金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
CaH2+2H2O=Ca(OH)2+2H2↑NaH+H2O=NaOH+H2↑
(1)若某化学反应需要消耗10g氢气,需要消耗多少克NaH?
(2)登山运动员登山时也需通过金属氢化物与水反应获得氢气以提供必须的能量.小红认为,若用CaH2替代NaH,有利于登山运动员减轻包袱负担.为什么? 西塞山前桃花流水1年前3
西塞山前桃花流水1年前3 -
 如雪如梅18 共回答了22个问题
如雪如梅18 共回答了22个问题 |采纳率95.5%解题思路:(1)10g氢气来自于氢化钠与水的反应,因此根据氢化钠与水反应的化学方程式可计算生成10g氢气需要消耗氢化钠的质量;
(2)比较生成相同质量的氢气消耗氢化钠与氢化钙的质量大小,就能得到减轻包袱负担的原因.(1)设制10g氢气需消耗氢化钠的质量为x
NaH+H2O=NaOH+H2↑
24 2
x 10g
24:2=x:10g
解之得 x=120g
答:制10g氢气需消耗氢化钠的质量为120g;
(2)设生成10g氢气需消耗氢化钙的质量为y
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
y 10g
42:4=y:10g
解之得 y=105g
∵生成10g氢气需氢化钙105g,而需氢化钠却要120g
∴得到同样质量的氢气消耗氢化钙的质量小于氢化钠质量,因此,可以减轻包袱负担.点评:
本题考点: 根据化学反应方程式的计算;化学方程式的概念、读法和含义.
考点点评: 根据反应的化学方程式可知:消耗24份质量的氢化钠可得到2份质量的氢气,消耗42份质量的氢化钙就可得到4份质量的氢气,显然得到相同质量的氢气,消耗氢化钠的质量大于氢化钙的质量.1年前查看全部
- 2005年,中国登山测量队成功登上珠峰峰顶,圆满完成珠峰高度最新测量工作.登山队员常用的能源是氢化钙(CaH2)固体,它
2005年,中国登山测量队成功登上珠峰峰顶,圆满完成珠峰高度最新测量工作.登山队员常用的能源是氢化钙(CaH2)固体,它和水反应生成的氢气供燃烧之需[CaH2+2H2O==Ca(OH)2+2H2]
现有875g氢化钙固体能源(含CaH2 96%,杂质不参加反应),与水反应可生成多少克氢气? quzhenhua1年前2
quzhenhua1年前2 -
 zhhzzh 共回答了28个问题
zhhzzh 共回答了28个问题 |采纳率92.9%第一步:假设未知数
设反应可生成X的氢气
第二步:写出方程式:
CaH2+2H2O==Ca(OH)2+2H2
42 4
875g*96% X
42/875g*96%==4/X
X=?
自已算了.
计算题不会难的,你只要慢慢的找出已知条件来,就能算出来.1年前查看全部
大家在问
- 1星特朗60az能不能看暗的的星系或者星云,星团
- 2用五点法作出 y=2sin(3x+π/5)-1的函数图像
- 3(英文)至少用五句话,描写一下日常生活。
- 4,角ABC〈90度,AD为BC边上的高,延长AB到点E,使BE=BD .过点E,D引直线交AC于点F.求证:AF=CF=
- 5英语翻译例句it is good to look for opportunities and to try new wa
- 6It is absolutely essential that all the applicants one by on
- 7tan75°等于?是2+根号3吗?
- 8要参加一个作文比赛,给外星人写一封信 结构大约怎样编排才会写得更好?
- 9你们的语文和英语作文题目都是什么呀?
- 10学校要举行乒乓球比赛,每两个班比赛一场,六年级有5个班,一共要比赛多少场?
- 11麻烦写一篇450字左右的日记,题目自命
- 12已知方程a(x^2+3x+2)+b(x^2+5x+6)+c(x^2+4x+3)=0有根x=0和x=1且abc都不是0,求
- 13下列说法正确的是( )A.需要加热才能发生的反应一定是吸热反应B.任何放热反应在常温条件下一定能发生反应C.反应物和生
- 14为迎接2011年高中招生考试,某中学对全校九年级学生进行了一次数学摸底考试,随机抽取了部分学生的测试成绩作为样本进行分析
- 15用小麦种子做发芽实验,有480粒种子发芽,20粒没发芽,求发芽率?

