有一碳膜电阻阻值100,功率0.25w,问接在10v的电源上行不行
 uban2022-10-04 11:39:541条回答
uban2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 meng28 共回答了33个问题
meng28 共回答了33个问题 |采纳率81.8%- 理论上,额度功率P=0.25W,电阻R=100Ω,用P=U^2/R计算,额定电压U=5V,10V超出很多.建议串联其他电阻器,或者选用阻值高一些的碳膜电阻.不能并联.这个仅供参考,具体是否能行通还有根据实际情况来看!希望能帮到你
- 1年前
相关推荐
- 生物化学氨基酸合成一碳单位相关问题,不是很难,
 谭涵1年前2
谭涵1年前2 -
 achae8te 共回答了15个问题
achae8te 共回答了15个问题 |采纳率100%1年前查看全部
- 一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料合成一系列化工原料和燃料的化学.如图为一碳化学的一种
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料合成一系列化工原料和燃料的化学.如图为一碳化学的一种简易流程,回答下列问题:
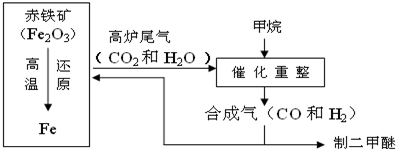 (1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为______.
(1)利用高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为______.
(2)课外小组的同学从上述流程中收集到一瓶“合成气”,用下图所示装置进行研究(已知高温条件下,甲烷和氧化铁反应生成CO2和H2O,3H2+Fe2O3
3H2O+2Fe),以确定“合成气”的成分.高温 .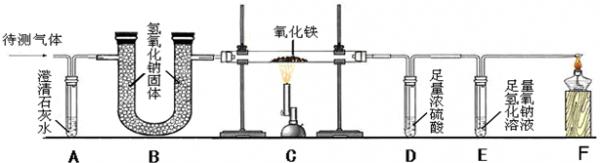
①A中澄清石灰水变浑浊,反应的化学方程式为______.
②C中一氧化碳与氧化铁反应的化学方程式为______.
③B装置中盛有足量的氢氧化钠颗粒,其作用是______.
④实验测量D和E的质量反应后分别增加9.0g和8.8g,推测原混合气体的组成为(假设混合气在C装置中反应完全)______(填字母).
A.CO、H2、CO2; B.CO、H2、CH4; C.CO、H2、CH4、CO2; D.CO2、H2、CH4. zhanglincs1年前4
zhanglincs1年前4 -
 我在等你回来 共回答了23个问题
我在等你回来 共回答了23个问题 |采纳率95.7%解题思路:(1)根据反应物生成物及化学方程式的书写原则正确写出化学方程式.
(2)根据题意,浓硫酸吸收燃烧生成的水而碱石灰用于吸收燃烧生成的二氧化碳,浓硫酸质量与碱石灰质量都增加,说明燃烧既生成了水又生成了二氧化碳,结合可燃物完全燃烧的规律,可判断混合气体中含C、H元素;而利用水、二氧化碳的质量进一步确定混合气体中C、H元素的质量比,对于判断混合气体的组成有决定性作用.(1)高炉尾气中的水蒸气与甲烷催化重整得到合成气,化学方程式为 CH4+H2O
催化剂
.
CO+3H2.
(2)①A中澄清石灰水变浑浊是因为二氧化碳与氢氧化钙反应生成不溶于水的碳酸钙,化学方程式为 CO2+Ca(OH)2═CaCO3↓+H2O.
②一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为 3CO+Fe2O3
高温
.
3CO2+2Fe.
③氢氧化钠颗粒具有吸水性,能吸水潮解,且能吸收二氧化碳,因此其作用是 吸收水分,除去二氧化碳.
④A中石灰水变浑浊,说明原气体中有二氧化碳,D装置增加的质量是生成的水的质量,原气体中含有氢元素,且氢元素质量=9g×[2/18]×100%=1g;E装置增加的质量是反应生成的二氧化碳的质量,故原气体中含有碳元素.且碳元素质量=8.8g×[12/44]×100%=2.4g;甲烷气体中C、H元素质量比=12:(1×4)=3:1,则混合气体中C、H元素质量比=2.4g:1g=15:4,因此可判断混合气体中若含有甲烷则一定同时含有CO气体;故选C.
故答案为:
(1)CH4+H2O
催化剂
.
CO+3H2;
(2)①CO2+Ca(OH)2═CaCO3↓+H2O;
②3CO+Fe2O3
高温
.
3CO2+2Fe;
③吸收水分,除去二氧化碳;
④C.点评:
本题考点: 物质的相互转化和制备;实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;气体的净化(除杂);一氧化碳还原氧化铁;书写化学方程式、文字表达式、电离方程式.
考点点评: 可燃物完全燃烧时,可燃物中的碳元素全部生成二氧化碳,可燃物中的氢元素全部生成水;可燃物完全燃烧生成二氧化碳和水,可判断可燃物中一定含C、H元素.1年前查看全部
- 生物体内转运一碳单位的载体?SAM是不是一碳载体啊?
 Cindy_X1年前4
Cindy_X1年前4 -
 laxia770 共回答了23个问题
laxia770 共回答了23个问题 |采纳率82.6%一碳单位能独立存在,必须以四氢叶酸为载体,从一碳单位的供体转移给一碳单位的受体,使后者增加一个碳原子1年前查看全部
- (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制
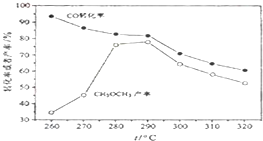 (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(1)CO转化率随温度升高而降低的原因是______.
(2)在一定温度,容积不变的容器中进行该反应,则以下为达到平衡状态的标志是______(填编号)
a.V(CO)正:V(H2)逆=2:1
b.CO的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度
e.每断裂4molH-H键的同时形成2molH-O键
(3)二甲醚燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃烧利用的能量密度(5.93kW•h•kg-1),若燃料电池电解质为酸性,二甲醚燃料电池的负极反应为______. 一个二甲醚分子经过电化学氧化,可以转移______个电子;该电池理论输出电压1.20V,能量密度E=
=8.39KW•h•kg-11.2V×
×12×96500C/mol1000g 46g/mol 1Kg 3.6×106J•kw−1•h−1 (要列式计算,能量密度=电池输出电能/燃料质量,已知:1kW•h=3.6×105J;每mol电子所带的电量为96500C).
=8.39KW•h•kg-11.2V×
×12×96500C/mol1000g 46g/mol 1Kg 3.6×106J•kw−1•h−1  davidyan71年前1
davidyan71年前1 -
 Kiddy猪猪 共回答了21个问题
Kiddy猪猪 共回答了21个问题 |采纳率95.2%解题思路:(1)依据化学平衡移动原理分析;
(2)反应到达平衡状态时正逆反应速率相等,各物质的浓度保持不变,以及由此衍生的一些量保持不变,据此分析;
(3)燃料电池中燃料在负极上失电子发生氧化反应,书写电极反应,计算电子转移;依据能量密度=电池输出电能/燃料质量列式计算.(1)CO转化率随温度升高而降低,是因为反应是放热反应,升温平衡逆向进行,故答案为:反应放热,温度升高,平衡逆向移动;
(2)a.V(CO)正:V(H2)逆=2:1,之比不等于计量数之比,故不选;
b.CO的转化率不再增大,说明正逆反应速率相等,故选;
c.混合气体的平均相对分子质量不再改变,说明正逆反应速率相等,故选;
d.混合气体的密度,从反应开始一直不变,故不选;
e.每断裂4molH-H键的同时形成2molH-O键,从反应开始一直不变,故不选;
故选bc;
(3)若电解质为酸性,二甲醚直接燃料电池的负极反应为二甲醚失电子生成二氧化碳,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+3H2O-12e-=2CO2+12H+;
一个二甲醚分子经过电化学氧化失去12个电子,能量密度=电池输出电能/燃料质量,该电池的理论输出电压为1.20V,能量密度E=
1.2V×
1000g
46g/mol×12×96500C/mol
1Kg
3.6×106J•kw−1•h−1=8.39KW•h•kg-1,
故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+;12;
1.2V×
1000g
46g/mol×12×96500C/mol
1Kg
3.6×106J•kw−1•h−1=8.39KW•h•kg-1.点评:
本题考点: 化学平衡状态的判断;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查了化学平衡状态的判断,化学平衡移动原理的分析判断,原电池原理分析和电极书写,题目难度中等.1年前查看全部
- 下列说法正确的是( )A.一碳化学常指以合成气(CO+H2)等为原料的化工合成.当前的一种有效应用是以合成气生产甲醇,
下列说法正确的是( )
A.一碳化学常指以合成气(CO+H2)等为原料的化工合成.当前的一种有效应用是以合成气生产甲醇,再由甲醇生产汽油,这种技术可以用于煤的液化
B. 碳纳米管是由碳原子构成的一种新材料,如图所示,由此可知,碳纳米管与石墨互为同位素
碳纳米管是由碳原子构成的一种新材料,如图所示,由此可知,碳纳米管与石墨互为同位素
C.海水是卤族元素氯、溴、碘等的主要来源,也是金属元素钠、镁、铝的主要来源
D.合成氨工厂用水将1molCH4转化为4molH2,符合节约资源和保护环境的循环经济和绿色化学原理,但违反了质量守恒定律 Benzino1年前1
Benzino1年前1 -
 微笑青瞳 共回答了25个问题
微笑青瞳 共回答了25个问题 |采纳率88%解题思路:A.一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料合成一系列化工原料和燃料的化学,根据这一原理可制取甲醇;
B.同位素是指同种元素的不同原子;
C.海水是一种化学成分复杂的混合物,包括水、溶解于水中的多种化学元素,含量较高的元素除组成水的氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴、碳、锶、硼、氟等;
D.合成氨工厂用水将1molCH4转化为4molH2,符合节约资源和保护环境的循环经济和绿色化学原理,任何化学反应,都遵循质量守恒定律.A.煤的液化,先用一碳化学的原理制取气体,C+H2O
高温
.
CO+H2,CO+H2O
高温
.
CO2+H2,C+CO2
高温
.
2CO,后以合成气生产甲醇:CO+2H2
一定条件
.
CH3OH,故A正确;
B.碳纳米管是由碳原子构成的一种新材料,是单质,石墨也是单质,它们都是碳元素组成的单质,属于同素异形体,故B错误;
C.海水含有氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴、碳、锶、碘、硼、氟等,是卤族元素氯、溴、碘等的主要来源,但铝海水中含量不多,且冶炼金属铝通常从铝土矿中冶炼,故C错误;
D.合成氨工厂用水将1molCH4转化为4molH2,氢气是生产氨气的原料,用甲烷生成和水生产氢气,符合节约资源,但任何化学反应均遵循质量守恒定律,故D错误;
故选A.点评:
本题考点: 煤的干馏和综合利用;同位素及其应用;质量守恒定律;海水资源及其综合利用.
考点点评: 该题考查了元素化合物的知识,解答须熟悉同素异形体的概念、一些金属的冶炼方法等相关知识,平时应多注意积累.1年前查看全部
- (09南京)28.(13分)一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化
 yanyurusi1年前1
yanyurusi1年前1 -
 nice19811109 共回答了17个问题
nice19811109 共回答了17个问题 |采纳率82.4%上述反应属于化合反应的是①(填序号),属于氧化反应的是①②③(填序号).
①二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制的.用合成气制二甲醚时,还产生了一种可参与大气循环的、常温为液态的氧化物,写出该反应的化学方程式:(2CO+4H2═CH3OCH3+H2O)
②合成气在冶炼铁的生产过程中所起的作用是(做还原剂)
①实验中持续通入干燥的氮气.加热前缓缓通入一段时间,其作用是(排净装置内的空气)
②停止加热前是否需要先断开a和b的连接处以防止倒吸?为什么?(不需要因为实验中要持续通入氮气)
③如果氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用氢氧化钠溶液的质最变化测定出氧化铁的质量分数将(偏小)(选填“偏大”、“偏小”或“准确”),原因是(一氧化碳的生成和气体带走水蒸气)1年前查看全部
- (2014•上海模拟)将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广
 (2014•上海模拟)将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
(2014•上海模拟)将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)
CO(g)+H2(g),此反应是吸热反应.高温
①此反应的化学平衡常数表达式为c(CH3OH) c(CO)×c(H2) ;c(CH3OH) c(CO)×c(H2)
②下列能增大碳的转化率的措施是______;
A.加入C(s)B.加入H2O(g)C.升高温度D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4(g)+[3/2]O2(g)⇌CO(g)+2H2O(g)△H=-519KJ/mol.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是______(填“X”或“Y”或“Z”),选择的理由是______;
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:
2H2(g)+CO(g)⇌CH3OH(g);△H=-90.8kJ•mol-1,T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正______v逆 (填“>”、“<”或“=”).物质 H2 CO CH3OH 浓度/(mol•L-1) 0.2 0.1 0.4
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=______mol-1•(L•min)-1.
(4)生产过程中,合成气要进行循环,其目的是______. 1215930541年前1
1215930541年前1 -
 在迈阿 共回答了19个问题
在迈阿 共回答了19个问题 |采纳率94.7%解题思路:(1)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
②增大碳的转化率,应采取措施使平衡向正反应移动,结合外界条件对平衡移动影响分析;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低;
(3)①计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
②依据图表数据计算起始量,结合三段式列式计算,根据甲氢气的浓度变化计算甲醇的浓度变化量,再根据v=[△c/△t]计算v(CH3OH);
(4)合成气进行循环,可以提高原料利用率.(1)①C(s)+H2O(g)
高温
.
CO(g)+H2(g)的平衡常数K=
c(CH3OH)
c(CO)×c(H2),故答案为:
c(CH3OH)
c(CO)×c(H2);
②A.加入固体C(s),不影响平衡移动,故A错误;
B.加入H2O(g),水蒸气的浓度增大,平衡向正反应方向移动,碳的转化率增大,故B正确;
C.正反应是吸热反应,升高温度平衡向正反应方向移动,碳的转化率增大,故C正确;
D.增大压强,平衡向逆反应方向移动,碳的转化率降低,故D错误;
故答案为:BC;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低;
(3)①由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=[0.4
0.22×0.1=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,故答案为:>;
②依据图表计算起始量;
2H2(g)+CO(g)⇌CH3OH(g)
起始量(mol/L) 1 0.5 0
变化量(mol/L) 0.80.4 0.4
T4时(mol/L) 0.2 0.1 0.4
若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol•L-1,由表中数据可知,l0min内氢气的浓度变化量为0.6mol/L,故甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=
0.3mol/L/10min]=0.03mol/(L•min),
故答案为:0.03;
(4)生产过程中,合成气要进行循环,这样可以提高原料利用率,故答案为:提高原料利用率(或提高产量、产率亦可).点评:
本题考点: 化学平衡常数的含义;化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查化学平衡常数、化学平衡影响因素、反应速率计算、反应中能量变化等,难度中等,注意理解掌握平衡常数的用途.1年前查看全部
- 金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中
金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
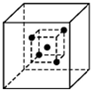 A. 12,大立方体的12条棱的中点
A. 12,大立方体的12条棱的中点
B. 8,大立方体的8个顶角
C. 6,大立方体的6个面的中心
D. 14,大立方体的8个顶角和6个面的中心 jgl249601年前1
jgl249601年前1 -
 纵横驰骋2008 共回答了19个问题
纵横驰骋2008 共回答了19个问题 |采纳率89.5%解题思路:根据金刚石晶胞的结构可知,每个碳周围连有4个碳,在如图所示结构中,体心上的碳与小立方体上的四个碳相连,而小立方体上的互不相邻的四个碳周围也连有四个碳,除了体上的碳之外还有三个碳,所以与小立方体顶角的四个碳原子直接相邻的碳原子数为12,它们分别位于12条棱的中点上,据此答题.根据金刚石晶胞的结构可知,每个碳周围连有4个碳,在如图所示结构中,体心上的碳与小立方体上的四个碳相连,而小立方体上的互不相邻的四个碳周围也连有四个碳,除了体上的碳之外还有三个碳,所以与小立方体顶角的四个碳原子直接相邻的碳原子数为12,它们分别位于12条棱的中点上,
故选A.点评:
本题考点: 晶胞的计算.
考点点评: 本题主要考查了金刚石晶胞的结构,对学生空间想象力有较高的要求,中等难度,解题时要熟悉金刚石晶胞的结构.1年前查看全部
- 氨基酸代谢的一碳单位主要由_供给,核苷酸生物合成中的一碳单位主要由 供给.
氨基酸代谢的一碳单位主要由_供给,核苷酸生物合成中的一碳单位主要由 供给.
氨基酸代谢的一碳单位主要由——供给,核苷酸生物合成中的一碳单位主要由——供给.
填空题。 yanswo1年前1
yanswo1年前1 -
 xzbdgt 共回答了18个问题
xzbdgt 共回答了18个问题 |采纳率88.9%核苷酸生物合成中的一碳单位主要由THF供给.
AA的应该是甘氨酸主要的吧,苏氨酸、丝氨酸和组氨酸也能供给.
另外,胆碱、肌酸、肾上腺素什么的是S-腺苷甲硫氨酸提供的.
我觉得是这样.1年前查看全部
- (2010•南京)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.
(2010•南京)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.
(1)工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2,该反应的化学方程式为CH4+H2O
CO+3H2高温 .CH4+H2O,得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属.
CO+3H2高温 .
(2)某他学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性.
I.用甲烷和水蒸气在高温条件下反应得到合成气.根据(1)中所写的化学方程式.合成气中CO和H2的质量比为______.
Ⅱ.用合成气还原足量氧化铜.实验装置如图所示: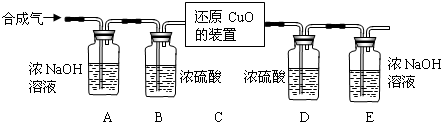
【设计买验步骤】
①连接好装置并检查气密性.
②装入药品,通人一段时间合成气.
③分别称量装置D、E的质量.
④缓缓通入合成气,加热装置C,使其充分反应.
⑤停止加热,继续通入合成气至恢复到室温.
⑥再次分别称量装置D、E的质量.
【完善实验设计】经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤______(填实验步骤的序号)中点燃(点燃前应对气体验纯).
】进行实验】该小组的同学按上述步骤进行实验,并记录了实验现象和数据:
①装置C中出现______色物质.
②称量数据如表所示.
【现象分析和数据处理】装置D的质量 装置E的质量 反应前 292.4g 198.2g 反应后 296.0g 201.5g
①甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO.
②乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中可能还有未反应的CH4,且CH4也还原了CuO.试通过计算说明他的推测依据.
③丙同学提出,实验步骤⑤中通入的气体会带走装置E中的部分水蒸气,使实验产生误差.你认为该误差对乙同学的推测结果是否有影响?______(选填“是”或“否”,并说明理由).
【拓展探究】该小组同学对于CH4是否真的能够还原氧化铜提出了质疑并进行探究.
查阅资料:甲烷具有还原性,可以还原氧化铜,生成CO2和H2O;白色的无水硫酸铜遇水会变成蓝色.
实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验.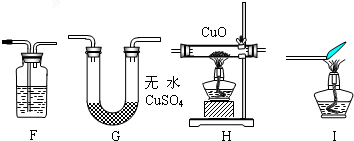
①如图装置F中盛放的试剂名称是______.
②如图装置的正确连接顺序是______(填字母,且每套装置限用一次).
【实验反思】除了可能是CH4也还原了CuO外,出现上表数据关系还可能是因为______(写出一个原因,并说明理由). ahchoow1年前1
ahchoow1年前1 -
 飞龙转世1 共回答了21个问题
飞龙转世1 共回答了21个问题 |采纳率85.7%解题思路:(1)根据题中信息结合方程式书写要点书写.
(2)I.根据化学方程式的意义来分析求解.
Ⅱ.[完善实验设计]可分析各装置中发生反应的条件即可.
[进行实验]①可根据反应中各物质的物性来分析.
[现象分析和数据处理]
②分析表中数据可知生成物中CO2、H2O的质量,采用极端分析法讨论若全部是CO和H2参与反应得到的CO2、H2O的质量比与全部是甲烷参与反应得到的二者相比较来分析.
③若带着E装置中的部分水蒸气,对实验数据来说就是测得的H2O的质量将减小.即CO2和H2O的质量比增大,可以和实际试验数据相比较进行分析.
[拓展探究]
①要证明CH4参与反应,就是要证明反应后生成了CO2和H2O.
②根据反应过程来确定顺序,一般验证气体先验证水蒸气,因为中间反应可能带入水汽.
[实验反思因为合成气中有CH4、CO、H2O,是混合气参与的反应,参加反应的物质质量比并不是定值.(1)根据题意,生成物是CO和H2,条件是高温,根据方程式书写要求可以写出.CH4+H2O
高温
.
CO+3H2
(2)I.根据化学方程式知CO和H2的质量比=28:(2×3)=14:3
Ⅱ.[完善实验设计]分析所用各装置中的反应条件可知,装置C中氢气和氧化铜反应需要加热,对应实验步骤为②.
[进行实验]
①反应后装置C中黑色的氧化铜逐渐变为红色的铜,所以装置C中的固体是铜,为红色.
[现象分析和数据处理]
②如果只有CO和H2,还原足量CuO,合成气中CO与H2的分子个数比为1:3.生成物中碳元素与氢元素的质量比为2:1;如果只有CH4还原足量CuO,生成物中碳元素与氢元索的质量比为3:1.现测得CO2的质量:201.5g-198.2g=3.3g,H20的质量:296.0g一292.4g=3.6g
生成物中碳元素与氢元素的质量比:(3•3g×[12/44]):(3.6g×[2/18])=9:4,9;4介于2:1和3:1之间,由此可推测出,除了CO和H2以外,制得的合成气中可能还有来反应的CH4,且CH4也还原了CuO
③否.因为带走水蒸气会使测得的CO2质量偏低,而实际测得的生成物中碳、氢元素的质量比已经大于2:1,所以对推测结果无影响.
[拓展探究]要证明甲烷还原氧化铜,只要证明生成物中有CO2和H2O生成即可,所以F装置应是检验CO2生成的,用澄清石灰水.装置H是还原CuO,G是用来证明水的生成,F是证明二氧化碳生成,I是处理尾气,所以顺序为HGFI.
[实验反思]因为本题是定量性实验,反应物是混合物,在以上的讨论中对反应物参加的可能性进行了分析证明,影响生成物的质量变化的还有参加反应的物质质量大小以及反应过程中是否全部参与反应.所以可以从这两方面进行分析证明.
故答案为:
(1)CH4+H2O
高温
.
CO+3H2
(2)I.14:3
Ⅱ.[完善实验设计]②
[进行实验]红
[现象分析和数据处理]
②如果只有CO和H.还原足量CuO,合成气中CO与H2的分子个数比为1:3.生成物中碳元素与氢元素的质量比为2;1
如果只有CH4还原足量CuO,生成物中碳元素与氢元索的质量比为3:1
现测得CO2的质量:201.5g-198.2g=3.3g H20的质量:296.0g一292.4g=3.6g
生成物中碳元索与氢元索的质量比:(3•3g×[12/44]):(3.6g×[2/36])=9:4
9;4介于2:1和3:1之间
由此可推测出,除了CO和H2以外,制得的合成气中可能还有来反应的CH4,且CH4也还原了CuO.
③否.因为带走水蒸气,将会导致E装置的质量增加减小,从而会使测得的CO2质量偏低,(二氧化碳的质量就是两次称量E装置的质量差),而实际测得的生成物中碳、氢元素的质量比已经大于2:1,所以对推测结果无影响.
[拓展探究]澄清石灰水 H G F I
[实验反思]因为根据测得数据计算,生成物中碳、氧元素的质量比值2:1,所以可能是合成气中参与反应的CO与H2
分子个数比大于1:3(或H2未完全参加反应、生成的水未被完全吸收等).点评:
本题考点: 碳、一氧化碳、氢气还原氧化铜实验;仪器的装配或连接;常见气体的检验与除杂方法;质量守恒定律及其应用;常见化学反应中的质量关系;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道综合性实验探究题,对培养学生分析问题解决问题的能力有一定的提高.1年前查看全部
大家在问
- 1一个等腰三角形一个腰的高与另一个腰的夹角是35°,这个等腰三角形的顶角是多少?
- 2亮亮 星星 明明三人去书店买书,他们共有54元.亮亮用了自己钱数的五分之三,星星用了自己钱数的百分之七十五,明明用了自己
- 3求解一到关于开方的数学题我们刚学开方~~求式子两个正方体:一个棱长【2.15】一个棱长【3.24】,将他们融化为一个大正
- 4(关于平方根)已知y=(平方根符号)(x+2)+(平方根符号)(2-x)-3,求y的x方的值.各位大哥大姐大叔大婶大爷大
- 5某班将买一些乒乓球和乒乓球拍,现了解情况如下:甲、乙两家商店出售两种同 样品牌的乒乓球和乒乓球拍.
- 6一道数学智力题!急!5个5~~~+-*/必须全部都用上!要怎么样排列才能得到24?
- 7人物描写一组的问题小嘎子是个富有心计的男孩子,从( )可以看出来,同时,从他时时想把对手打败,可以看出他( ).
- 8不等式kx<5x+2得x>2/k-5 试简化10—2k的绝对值—k-5的绝对值
- 9一棵树的广义表表示为a(b,c(e,f(g)),d),当用左子女-右兄弟链表表示时,右指针域非空的结点个数为( ).
- 10advice的用法与哪个词相同?
- 11一张长方形纸片的周长是72厘米,3张这样的长方形纸片恰好可以拼成一个正方形.拼成的正方形纸片的面积是多
- 12一个长方形纸片的周长是72厘米,3张这样的纸片恰好可以拼成一张正方形纸片,拼成的正方形纸片的面积是多少平方厘米?
- 13一棵树高h(m)与年数n(年)之间的关系如下表:n(年) 2 4 6 h(m) 2.6 3.2 3.8 写出用n表示h的
- 14判断.当X=1时,X÷0.8=0.8
- 15某一海域被重金属污染,下列生物体中含有毒物质最多的可能是?A藻类 B虾 C小鱼 D大鱼