1molO2的质量是一个O2分子质量的_______倍,1molO2的质量与O2的化学式量在______上
 gugu_lu2022-10-04 11:39:542条回答
gugu_lu2022-10-04 11:39:542条回答1molO2的质量是一个O2分子质量的__NA_____倍,1molO2的质量与O2的化学式量在__数值____上相同,但前者以________为单位,后者以____________为标准.
1molO2的质量是一个O2分子质量的__NA_____倍,1molO2的质量与O2的化学式量在__数值____上相同,但前者以___g_____为单位,后者是一个____________。一个O2分子质量为____________克。

已提交,审核后显示!提交回复
共2条回复
 brazil15 共回答了16个问题
brazil15 共回答了16个问题 |采纳率93.8%- 1molO2的质量是一个O2分子质量的__NA_____倍,1molO2的质量与O2的化学式量在__数值____上相同,但前者以___g_____为单位,后者是一个(比值).一个O2分子质量为(32/NA)克.
- 1年前
 小呆小呆 共回答了38个问题
小呆小呆 共回答了38个问题 |采纳率- 后者以___一个碳-12分子的质量的1/12的倍数____为标准。
后者是一个___比值___。 一个O2分子质量为__32/NA______克。 - 1年前
相关推荐
- 说法正确的是( )A.1mol气体的体积约为22.4LB.标准状况下,1molO2和N2混合气体的体积约为22.4LC
说法正确的是( )
A.1mol气体的体积约为22.4L
B.标准状况下,1molO2和N2混合气体的体积约为22.4L
C.任何条件下,气体的摩尔体积都约为22.4L/mol
D.标准状况下,气体的摩尔体积为22.4L hr54j54qian1年前1
hr54j54qian1年前1 -
 若兮75 共回答了21个问题
若兮75 共回答了21个问题 |采纳率90.5%解题思路:A、依据气体摩尔体积的条件分析判断;B、气体摩尔体积适用于单一气体和混合气体;C、标准状况下气体摩尔体积约为22.4L/mol;D、标准状况下,气体的摩尔体积为22.4L/L.A、依据气体摩尔体积的条件分析判断,标准状况下,1mol气体的体积约为22.4L,故A错误;
B、气体摩尔体积适用于单一气体和混合气体,标准状况下,1molO2和N2混合气体的体积约为22.4L,故B正确;
C、标准状况下气体摩尔体积约为22.4L/mol,不同温度不同压强下气体摩尔体积不同,故C错误;
D、标准状况下,1mol气体的摩尔体积约为22.4L,故D错误;
故选B.点评:
本题考点: 气体摩尔体积;物质的量的相关计算.
考点点评: 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的概念,应用条件和正误判断,题目较简单.1年前查看全部
- 1molO2的质量是一个氧分子质量的几倍?
 center_shen1年前3
center_shen1年前3 -
 paladinsa 共回答了24个问题
paladinsa 共回答了24个问题 |采纳率95.8%6.02*10的负23次方倍1年前查看全部
- 分别在恒温恒压,恒温恒容条件下,投入2molso2和1molo2,2so2(g)+o2(g)=2so3(g)达到平衡,哪
分别在恒温恒压,恒温恒容条件下,投入2molso2和1molo2,2so2(g)+o2(g)=2so3(g)达到平衡,哪一个so2转化率
开始时两容器压强相等 绝美1年前1
绝美1年前1 -
 懒鱼儿 共回答了20个问题
懒鱼儿 共回答了20个问题 |采纳率80%恒温恒压时 转化率高
因为该反应在两条件下进行,正向时,气体分子的总数目会减少,当恒容时,压强会降低,根据勒夏特列原理,平衡会向着减小这种变化的方向移动,即逆向移动,此时二氧化硫转化的少了,
当恒压时就不存在这个情况.1年前查看全部
- 一定温度下,向一带活塞体积为2L的容器中充2molSO2和1molO2,达到平衡后体积变为1.6L则SO2转化率是?
一定温度下,向一带活塞体积为2L的容器中充2molSO2和1molO2,达到平衡后体积变为1.6L则SO2转化率是?
答案=60%,求详解过称 ju7y1年前2
ju7y1年前2 -
 止若冰 共回答了20个问题
止若冰 共回答了20个问题 |采纳率95%解设平衡时混合气体的总物质的量为X,设反应的SO2的物质的量为Y
根据体积比等于物质的量之比得2L:1L=(2mol+1mol):X
解得X=2.4mol
反应减少的物质的量为3mol+1mol-2.4mol=0.6mol
2SO2+O2=(可逆)2SO3 减少的物质的量
2 1 2 1
Y 0.6mol
2:1=Y:0.6mol
解得Y=1.2mol
SO2转化率是1.2mol/2mol*100%=60%
答SO2转化率是60%1年前查看全部
- 将a mol H2S和1molO2 置于一个容积可变的容器内进行反应,维持容器内气体压强不变,在120C测得反应前后容器
将a mol H2S和1molO2 置于一个容积可变的容器内进行反应,维持容器内气体压强不变,在120C测得反应前后容器内气体的密度分别为d1,d2,
若a取值不同,则H2S的氧化物有三种可能
1,全部为SO2,a取值0 qw8g1年前1
qw8g1年前1 -
 yifeier720 共回答了22个问题
yifeier720 共回答了22个问题 |采纳率86.4%因为“部分为二氧化硫部分为硫”时,硫化氢和氧气都没有剩余,所以:
a H2S + O2 = x SO2 + y S + a H2O 配平可得 x=1-a/2 y=3a/2-1
所以:nSO2=x=1-a/2 mol ,反应后n总(气)= x+a=1-a/2+a=1+a2 mol.1年前查看全部
- 一道化学电子守恒题在2Na2O2+2H2O==4NaOH+O2中,生成1molO2转移的电子数为什麽是2mol?在H2O
一道化学电子守恒题
在2Na2O2+2H2O==4NaOH+O2中,生成1molO2转移的电子数为什麽是2mol?在H2O中-2价的氧不可以直接被氧化到O2里零价的氧吗?
 踩着猫的脚印走1年前1
踩着猫的脚印走1年前1 -
 梅影横窗瘦 共回答了15个问题
梅影横窗瘦 共回答了15个问题 |采纳率100%反应过程:Na2O2+H2O=Na2O+H2O2
Na2O+H2O=2NaOH并放热
2H2O2=2H2O+O2(H2O2受热分解)
总反应:2Na2O2+2H2O==4NaOH+O2
由以上可看出:只有2H2O2=2H2O+O2是氧化还原反应,因此易得生成1molO2转移的电子数是2mol,而且O2里零价的氧是从H2O2来的.1年前查看全部
- 2KClO3==2kCl+3O2,每生成1molO2,转移几mol电子
2KClO3==2kCl+3O2,每生成1molO2,转移几mol电子
我知道转移了4mol,可是为什么呀!请仔细讲讲.最好能说说像转移电子这类题的做法 jackalQ1年前3
jackalQ1年前3 -
 王门弟子 共回答了22个问题
王门弟子 共回答了22个问题 |采纳率90.9%这个是KClO3的自身氧化还原反应,氯化合价降低,氧的升高,每生成3mol氧气,转移12mol 电子,生产1mol氧气 就是4mol了 其实,很简单,生产1mol氧气,必须转移4mol电子,因为一个氧由二价变为0价转移2mol电子,那么一分子氧就是4mol1年前查看全部
- 将2molSO2和1molO2放入一个密闭容器中,在一定的条件下反应到达"平衡状态"
将2molSO2和1molO2放入一个密闭容器中,在一定的条件下反应到达"平衡状态"
(双选题)将2mol SO2和1mol O2放入一个密闭容器中,在一定的条件下反应到达"平衡状态",此时,下列所示容器内存在各物质的物质的量中,一定不可能的是( )
A.0mol SO2
B.1mol SO2
C.2mol SO3
D.0.3mol O2 leilei_xuan21年前2
leilei_xuan21年前2 -
 souhumao3000 共回答了21个问题
souhumao3000 共回答了21个问题 |采纳率81%既然是可逆反应,就不可能完全转化
所以SO2一定不可以没有,A错误
SO3也达不到2mol,C错误1年前查看全部
- 研究表明,在一定温度和压强条件下,2molH2(g)和1molO2(g)完全化合生成2molH2O(g)所放出的热量:
研究表明,在一定温度和压强条件下,2molH2(g)和1molO2(g)完全化合生成2molH2O(g)所放出的热量:
1.在与相同条件下2molH2O(g)完全分解为2molH2(g)和1molO2(g)所吸收的热量在数值上相等;2.是相同条件下1molH2(g)和0.5molO2(g)完全化合生成1molH2O(g)所放出热量的2倍;3.比在相同条件下2molH2(g)和1molO2(g)完全化合生成2molH2O(l)所放出的热量少.由此,你可得出那些结论? facai20051年前2
facai20051年前2 -
 滴血十字_dxsz 共回答了25个问题
滴血十字_dxsz 共回答了25个问题 |采纳率92%①一个化学反应其正、逆反应的能量变化,在数值上相等,吸收与放出相反;
②一个化学反应的能量变化量与其反应物的物质的量有关(成正比例)
③一个化学反应的能量变化量与其反应物、生成物的状态(固、液、气)有关.1年前查看全部
- 由1molO2(氧气)和1molN2(氮气)构成的混合气体,在标准状况下对H2(氢气)的相对密度是什么?
由1molO2(氧气)和1molN2(氮气)构成的混合气体,在标准状况下对H2(氢气)的相对密度是什么?
如题.
N的相对原子质量为14 劝你走1年前3
劝你走1年前3 -
 zjbtod 共回答了23个问题
zjbtod 共回答了23个问题 |采纳率91.3%1molO2(氧气)质量为32克,1molN2(氮气)质量为28克,所以混合气体的平均摩尔质量为:
(32+28)/2=30,所以混合气体对H2(氢气)的相对密度为:30/2=15.1年前查看全部
- 一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g)
一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A. 保持温度和容器体积不变,充入1mol SO2(g)
B. 保持温度和容器内压强不变,充入1mol SO3(g)
C. 保持温度和容器内压强不变,充入1mol O2(g)
D. 保持温度和容器内压强不变,充入1mol Ar(g) 大头1231年前3
大头1231年前3 -
 实话一定实说 共回答了11个问题
实话一定实说 共回答了11个问题 |采纳率100%解题思路:达到平衡后,改变条件,SO3的平衡浓度不改变的,说明为等效平衡,恒温恒容按化学计量数转化到左边满足2molSO2,1molO2或恒温恒压按化学计量数转化到左边满足n(SO2):n(O2)=2:1,再结合平衡移动分析.A、温度和容器的体积不变,充入1mol SO2(g),增大反应物的浓度平衡正移,SO3气体平衡浓度增大,故A错误;
B、温度和容器的压强不变,充入1mol SO3(g),按化学计量数转化到左边,得到n(SO2)=1mol,n(O2)=0.5mol,满足n(SO2):n(O2)=2:1,与原来的平衡是等效平衡,所以SO3气体平衡浓度不改变,故B正确;
C、保持温度和容器的压强不变,充入1mol O2(g),增大反应物的浓度平衡正移,平衡向正反应移动,SO3的平衡浓度增大,故C错误;
D、保持温度和容器的压强不变,充入1mol Ar,体积增大,反应混合物产生的压强减小,平衡向逆反应移动,移动的结果是减小SO3的浓度,所以SO3的平衡浓度减小,故D错误;
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查平衡移动、等效平衡等,难度中等,注意掌握等效平衡规律.1年前查看全部
- 已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放
 已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量.根据以上所给的数据计算反应:
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量.根据以上所给的数据计算反应:
2H2(g)+O2(g)=2H2O(g);△H=______.
(2)如图所示,可形成氢氧燃料电池.通常氢氧燃料电池有酸式(当电解质溶液为H2SO4溶液时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种.试回答下列问题:
1式电池的电极反应:负极______,正极______;电池总反应:______;电解质溶液pH的变化______(填“变大”、“变小”或“不变”).
②碱式电池的电极反应:负极______,正极______;电池总反应:______;电解质溶液pH的变化______(填“变大”、“变小”或“不变”). tgh_dd1年前1
tgh_dd1年前1 -
 MJF1028 共回答了20个问题
MJF1028 共回答了20个问题 |采纳率85%解题思路:(1)由信息可知,H-H键能为436kJ/mol,O=O键能为496kJ/mol,H-O键能为436kJ/mol,2H2(g)+O2(g)=2H2O(l)中,△H=反应物中键能和-生成物中键能和,以此来解答;
(2)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,溶液的酸碱性不同,电极反应式不同,酸性溶液中负极反应为:2H2-4e-=4H+,正极反应为:O2+4e-+4H+=2H2O;碱性溶液中负极反应为2H2-4e-+4OH-=2H2O,正极反应为O2+4e-+2H2O=4OH-,电池总反应都为2H2+O2=2H2O,可根据溶液氢离子或氢氧根离子浓度的变化判断溶液的pH.(1)常温下拆开1mol H2中的化学键要吸收436kJ的能量,拆开1mol O2中的化学键要吸收496kJ的能量,形成水分子中的1mol H-O键要放出463kJ的能量,则H-H键能为436kJ/mol,O=O键能为496kJ/mol,H-O键能为436kJ/mol,由2H2(g)+O2(g)=2H2O(l)中,△H=反应物中键能和-生成物中键能和=2×436kJ/mol+496kJ/mol-4×463kJ/mol=-484kJ/mol,故答案为:-484kJ/mol;
(2)①氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,酸性溶液中负极反应为:2H2-4e-=4H+,通入氧气的一极为原电池的正极,发生还原反应,酸性溶液中正极反应为:O2+4e-+4H+=2H2O,电池总反应为2H2+O2=2H2O,反应生成水,溶液氢离子浓度降低,pH增大,
故答案为:2H2-4e-=4H+;O2+4e-+4H+=2H2O;2H2+O2=2H2O;变大;
②氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,碱性溶液中负极反应为2H2-4e-+4OH-=2H2O,通入氧气的一极为原电池的正极,发生还原反应,碱性溶液中正极反应为O2+4e-+2H2O=4OH-,电池总反应为2H2+O2=2H2O,反应生成水,溶液氢氧根离子离子浓度降低,pH减小,
故答案为:2H2-4e-+4OH-=2H2O;O2+4e-+2H2O=4OH-;2H2+O2=2H2O;变小.点评:
本题考点: 化学电源新型电池;热化学方程式.
考点点评: 本题考查反应热的计算,为高频考点,把握键能与反应热的关系、焓变正负的意义为解答的关键,侧重分析能力与计算能力的考查,题目难度不大.1年前查看全部
- 1molH2与1molO2混合的体积
1molH2与1molO2混合的体积
是否为22.4L? shaohuachen1年前2
shaohuachen1年前2 -
 fanxinvv7285 共回答了19个问题
fanxinvv7285 共回答了19个问题 |采纳率89.5%2mol的啊!这有不会反应,你又没有点燃···1年前查看全部
- 钠在氧气中燃烧 1molO2作氧化剂时得到的电子数为
钠在氧气中燃烧 1molO2作氧化剂时得到的电子数为
钠在氧气中燃烧 1molO2作氧化剂时得到的电子数 4NA 为什么不对呢 feng123feng1年前1
feng123feng1年前1 -
 咯咯悟01 共回答了21个问题
咯咯悟01 共回答了21个问题 |采纳率76.2%恩,是不正确的.
因为Na在氧气中燃烧,大多数生成Na2O2、但仍有小部分生成Na2O
所以,1molO2得到的电子数就不是4mol了.
因为生成了两种产物:Na2O2、Na2O.1年前查看全部
- 在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,下列反应:
在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,下列反应:
2SO2(g)+O2(g)=2so3(g)
达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A保持温度和容器体积不变,充入1molSO2(g)
B保持温度和容器内压强不变,充入1molSO3(g)
C保持温度和容器内压强不变,充入1molO2(g)
D保持温度和容器内压强不变,充入1molAr(g) 游蜂儿1年前3
游蜂儿1年前3 -
 ll和qq 共回答了19个问题
ll和qq 共回答了19个问题 |采纳率89.5%等效平衡问题,选择B
恒温恒容时,平衡等效要求投料相等,A错误
恒温恒压时,平衡等效要求投料比相当,B正确,C错误
充入惰性气体时,恒压相当于减压,平衡会向做移动,浓度不等,D错误1年前查看全部
- 2so2+o2=2so3 带活塞的密闭容器中,加入2molso2,1molo2,达到平衡后,改变条件,平衡浓度不变的是A
2so2+o2=2so3
带活塞的密闭容器中,加入2molso2,1molo2,达到平衡后,改变条件,平衡浓度不变的是
A温度体积不变,加入1mol so3
B温度压强不变 加入1mol so3
c温度压强不变 加入1mol o2
D温度压强不变 加入1mol ar(g)
但我不明白A怎么判断,体积不变,加入生成物,生成物浓度变大,向逆向移动,但体积不变,压强变大了,向正向体积减小的方向移动,那怎么判断向哪个方向移动呢?
so3平衡浓度不变 心佛和陶妖1年前1
心佛和陶妖1年前1 -
 nelson1000 共回答了13个问题
nelson1000 共回答了13个问题 |采纳率92.3%因为加入1mol so3引起的生成物浓度变化而导致化学平衡方程式的移动远小于由压强变化导致的化学方程式的移动变化~所以A判断为向正向体积减小的方向移动~1年前查看全部
- 高中化学等效平衡问题在一定温度下,容积相同的两个密闭容器中,一个充入2molSO2,1molO2,另一个充入2molSO
高中化学等效平衡问题
在一定温度下,容积相同的两个密闭容器中,一个充入2molSO2,1molO2,另一个充入2molSO3,发生反应2SO3+O2=2SO3;△H=-196.6KJ/mol时,下列六种说法正确的有
①二氧化硫的转化率与三氧化硫的分解率之和为1
②达到平衡所需的时间相等
③密度相等
④压强相等
⑤放出与吸收的热量相等
⑥二氧化硫的浓度相等
答案是①②④⑥求解释,④和⑥没懂啊
不是说什么反应进行的程度不确定吗?那两种情况下二氧化硫的浓度怎么会相等呢? ylin1181年前3
ylin1181年前3 -
 luxiaolei123 共回答了15个问题
luxiaolei123 共回答了15个问题 |采纳率93.3%单看反应 2SO3 + O2 = 2SO3
第一种投料 2mol 1mol 0mol
第二种 0mol 0mol 2mol
可知这两种为等效平衡.(这个应该知道吧?)
所以这两种投料达到的平衡的结果是一样的,看起来相同.
即这两种容器内各物质的百分含量相同.所以不管是SO2、O2还是SO3它们的物质的量均相同.所以总压强相同 so2浓度也一定想通了.
是反应进行的程度不确定.但是这两个投料最后达到的是同一种平衡(始态终态法.考虑最后就可以了)1年前查看全部
- 1molO2分子的质量是多少?要格式!
 jcsq1年前2
jcsq1年前2 -
 DIEGOONE 共回答了17个问题
DIEGOONE 共回答了17个问题 |采纳率70.6%32g 1mol乘以32g/mol m=n乘以M1年前查看全部
- 已知反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2,则有1molO2生成时反应所转移的电子
已知反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2,则有1molO2生成时反应所转移的电子总数为( )
A.4mol
B.9mol
C.10mol
D.5mol 爱n1231年前1
爱n1231年前1 -
 zjwu5 共回答了19个问题
zjwu5 共回答了19个问题 |采纳率89.5%解题思路:反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2中,Cl元素的化合价既升高又降低,O元素的化合价升高,以此来解答.反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2中,
有1molO2生成时,5molCl2参加反应,
但9molCl作氧化剂,转移的电子为9mol×(1-0)=9mol,
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确元素的化合价变化是解答的关键,注意Cl的得电子数等于转移的电子总数,题目难度中等.1年前查看全部
- 将1molH2S和1molO2混合后点燃,生成SO2的物质的量为_____mol? 请帮我解答氧守恒的方程
 pinksummer1年前3
pinksummer1年前3 -
 张英 共回答了19个问题
张英 共回答了19个问题 |采纳率94.7%H2S燃烧时:2H2S+O2=2S+2H2O S+O2=SO2
可以算出SO2的物质的量为0.5mol1年前查看全部
- 用铂电极电解硫酸铜浓液,当阴极产生6.4g铜时,阳极放出多少升的氧气 为何1molO2需失4mol电子
 寒沙带1年前2
寒沙带1年前2 -
 小巫女碎碎 共回答了19个问题
小巫女碎碎 共回答了19个问题 |采纳率100%2CuSO4+2H2O=2Cu+O2+2H2SO4
128 22.4
6.4 X
X=1.12L
阳极放出1.12升的氧气 .
为何1molO2需失4mol电子
H2O中的O是-2价,变为0价需要失去两个电子,两个O原子形成一个O2,需要失去4个电子.所以1molO2需失4mol电子.1年前查看全部
- 保持温度不变,向2L容积固定的密闭容器中充入2molSO2和1molO2.已知2SO2+O2==2SO3,放热akj/m
保持温度不变,向2L容积固定的密闭容器中充入2molSO2和1molO2.已知2SO2+O2==2SO3,放热akj/mol(a>0)
经2min达到平衡状态,反应放热0.25akj.下列判断正确的是( )
B.2min内,v(SO2)=0.25mol/(L.min)
C.若再充入2molSO3,达平衡时SO3的体积分数减小
D.反应条件相同,若起始时向上述反应容器中充入2molSO3,平衡时反应吸热0.25akj
答案上说B项中v(SO2)=0.125mol/(L.min),还有D中应该吸热0.75akj.不懂这些数是如何算出的.
回答呢?怎么没看到. 030332631年前1
030332631年前1 -
 lvufaraway 共回答了21个问题
lvufaraway 共回答了21个问题 |采纳率90.5%有反应式可知 当消耗2mol二氧化硫时放热akj 而现在放出0.25kj热 则消耗二氧化硫0.5mol 浓度变化为0.25mol/l 因此速率为0.25/2=0.25mol/(l.min).D项中,这是一个完全等效平衡,从两个方向进行放热(或吸热)之和为焓变的绝对值,因此吸热为(a-0.25a)kj 即0.75akj,这是一个定理经常用要记住的.1年前查看全部
- 1、向一个容积为1L的密闭容器中放入2moLSO2和1moLO2,在一定条件下反应,2S末,测得容器内有0.8moLSO
1、向一个容积为1L的密闭容器中放入2moLSO2和1moLO2,在一定条件下反应,2S末,测得容器内有0.8moLSO2,求2
 liu911年前2
liu911年前2 -
 超人归来95 共回答了14个问题
超人归来95 共回答了14个问题 |采纳率100%你想求什么啊?
2SO2+O2=2SO3
2mol 1mol 0mol
2x x 2x
0.8 0.4 1.21年前查看全部
- SO2+O2=SO3 反应平衡后加入1molO2 SO3 体积分数为什么会减小
 大褐熊1年前1
大褐熊1年前1 -
 笨蛋晓强 共回答了20个问题
笨蛋晓强 共回答了20个问题 |采纳率100%加入反应物氧气,会使平衡正向移动SO3浓度会有少量增加,但增加的量很小,远远小1mol,整个平衡还是氧气体积分数增大,所以其它都减少了1年前查看全部
- (2009•广州二模)在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)
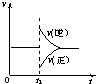 (2009•广州二模)在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图.下列对t1时刻改变条件的推断中正确的是( )
(2009•广州二模)在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图.下列对t1时刻改变条件的推断中正确的是( )
A.保持压强不变,升高反应温度
B.保持温度不变,增大容器体积
C.保持温度和容器体积不变,充入1molSO3(g)
D.保持温度和压强不变,充入1molSO3(g) 纵横天下NO11年前1
纵横天下NO11年前1 -
 老李广 共回答了16个问题
老李广 共回答了16个问题 |采纳率100%解题思路:A、升高温度,正逆反应速率都增大,化学平衡向吸热反应方向移动.
B、减小压强,正逆反应速率都减小,化学平衡向气体体积增大的方向移动.
C、保持温度和容器体积不变,充入1molSO3(g)的瞬间,生成物的浓度增大,反应物的浓度不变,根据浓度对化学反应速率的影响分析.
D、保持温度和压强不变,充入1molSO3(g)的瞬间,容器的体积增大,导致生成物的浓度增大,反应物的浓度减小,根据浓度对反应速率的影响分析.A、该反应是放热反应,升高温度,正逆反应速率都增大,正逆反应速率曲线都在原直线上方,逆反应速率增大倍数大于正反应速率增大的倍数,导致平衡向逆反应方向移动,故A错误.
B、保持温度不变,增大容器体积,导致容器内减小压强,正逆反应速率都减小,即正逆反应速率曲线都在原直线的下方,正反应速率减小的倍数大于逆反应速率减小的倍数,导致平衡向逆反应方向移动,故B错误.
C、保持温度和容器体积不变,充入1molSO3(g)的瞬间,三氧化硫的浓度增大,二氧化硫和氧气的浓度不变,所以逆反应速率大于正反应速率,所以正反应速率与原速率有接触点,故C错误.
D、保持温度和压强不变,充入1molSO3(g)的瞬间,容器的体积增大,导致生成物的浓度增大,反应物的浓度减小,逆反应速率大于正反应速率,平衡向逆反应方向移动,故D正确.
故选D.点评:
本题考点: 化学反应速率与化学平衡图象的综合应用.
考点点评: 本题考查了外界条件对化学反应速率和平衡的影响,难度较大,明确浓度变化引起化学反应速率变化是解本题的关键.1年前查看全部
- 怎样通过电解水实验,得出结论:在相同温度和压强下,1molO2和H2的体积相同?
怎样通过电解水实验,得出结论:在相同温度和压强下,1molO2和H2的体积相同?
书上的探究实验让算出了电解水实验中H2和O2的质量,又算出物质的量,让再比较.但这怎么证明和推论:在相同温度和压强下,1molO2和H2的体积相同呢?. 梅朵儿wm1年前4
梅朵儿wm1年前4 -
 Jessiehe32 共回答了25个问题
Jessiehe32 共回答了25个问题 |采纳率88%因为根据水、氢气、氧气的组成可知,反应方程式为:2H2O=2H2+O2
即得到两种气体的物质的量比为H2:O2=2:1,又因为实验现象表明生成气体体积比为H2:O2=2:1,
所以在相同温度和压强下,1molO2和H2的体积相同.1年前查看全部
- 关于化学键能量变化为什么2molH2(g)跟1molO2(g)反应生成2molH2O(g)释放能量490KJ怎么算的?
 barkeler1年前1
barkeler1年前1 -
 pz_xiaofeng 共回答了22个问题
pz_xiaofeng 共回答了22个问题 |采纳率95.5%查工具书上的H-H、O=O和H-O键的键能,设分别为a,b cKj/mol,拆开共价键要吸收能量,形成共价键要放出能量.
放出的能量=4c-(2a+b),单位是Kj/mol
a=436,b=498,c=464 .代入上式计算得到的数字是486.约为490.1年前查看全部
- 设Na为阿伏伽德罗常数,则1molO2的质量是一个O2分子质量的( ) 倍
 gongxxx1年前1
gongxxx1年前1 -
 我爱hicham 共回答了10个问题
我爱hicham 共回答了10个问题 |采纳率90%Na倍1年前查看全部
- 1:在相同的A、B密闭容器中分别充入2mol的SO2和1molO2,使它们在一定温度下反应,并达新平衡:2SO2+O2
1:在相同的A、B密闭容器中分别充入2mol的SO2和1molO2,使它们在一定温度下反应,并达新平衡:2SO2+O2 ===== 2SO3(g).(该反应为可逆反应)若A容器保持体积不变,B容器保持压强不变.当A中SO2的转化率为25%时,B中SO2的转化率为:A、25% B、大于25% C、小于25% D、无法判断
 明珠玮宝1年前1
明珠玮宝1年前1 -
 ff在线114 共回答了17个问题
ff在线114 共回答了17个问题 |采纳率82.4%B 因为正反应方向是体积减小的方向,B容器可以看成这样过程,首先保持体积不变达到平衡,这是转化率为25%,然后减小体积,使压强与初始时相同,这是平衡继续向正方向移动,SO2的转化率大于25%1年前查看全部
- 关于气体平均相对分子质量 在通常条件下,下列气体混合后,气体的平均相对分子质量最大的是A.2molNO和1molO2 B
关于气体平均相对分子质量
在通常条件下,下列气体混合后,气体的平均相对分子质量最大的是
A.2molNO和1molO2 B.2molH2S和1molSO2
C.2molHBr和1molCL2 D.2molCO和1molO2
这一题答案是A
需要考虑气体之间的反应吗?比如A中生成NO2 B中生成S D中生成CO2 liu_ke1年前3
liu_ke1年前3 -
 macaiyuan 共回答了16个问题
macaiyuan 共回答了16个问题 |采纳率93.8%2molNO和1molO2 恰好完全反应生成2mol NO2,所以反应后气体相对分子质量 = NO2相对分子质量 = 46
B.2molH2S和1molSO2 恰好完全反应生成生成3mol S单质和2mol H2O,无气体剩余
C.2molHBr和1molCl2恰好完全反应生成2mol HCl和1mol Br2,Br2是液态,所以反应后气体相对分子质量 = HCl相对分子质量 = 36.5 < 46
D.2molCO和1molO2常温下不反应,所以平均相对分子质量 = (2*28+1*32)/(2+1) = 29.3 < 46
所以选 A1年前查看全部
- 在容积相同的甲(体积不变),乙(压强不变)两个密闭容器中,分别充入2molSO2和1molO2,平衡所用时哪个长
在容积相同的甲(体积不变),乙(压强不变)两个密闭容器中,分别充入2molSO2和1molO2,平衡所用时哪个长
为什么?
温度相同的。 kkhh551年前2
kkhh551年前2 -
 ypyuyu 共回答了17个问题
ypyuyu 共回答了17个问题 |采纳率76.5%甲温度升高,平衡所用时短;乙体积增加,平衡用时长.
虽然初始温度相同,但是充入气体之后就不同了.甲体积不变,充入气体后必然压力增加温度上升.乙压强不变,充入气体之后必然体积膨胀.1年前查看全部
- 在容积相同的甲乙两容器中分别充入2molSO2和1molO2
在容积相同的甲乙两容器中分别充入2molSO2和1molO2
发生可逆反应,甲容器体积不变,乙容器压强不变
【压强不变和体积不变在化学可逆反应的平衡中分别意味着什么?】 淡水轩1年前1
淡水轩1年前1 -
 88768275 共回答了18个问题
88768275 共回答了18个问题 |采纳率100%压强不变就是体积可变
体积不变就是压强可变1年前查看全部
- 将2molSO2和1molO2混合置于容积为2L的密闭容器中,在800K时,发生如下反应:2SO2(g)+O2(g)⇌2
将2molSO2和1molO2混合置于容积为2L的密闭容器中,在800K时,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)当反应从开始进行到5min时,反应达到平衡状态,测得混合气体总物质的量为2.1mol.请回答下列问题:
(1)800K时,写出该反应的平衡常数表达式并计算K=
=1620c2(SO3) c2(SO 2)•c(O2) ,在0~5min时间间隔内SO2的反应速率为______.
=1620c2(SO3) c2(SO 2)•c(O2)
(2).若在5min时降低温度,在某一时刻重新达到平衡状态,则新平衡混合物中气体的总物质的量______2.1mol(填“>”、“<”或“=”)
(3).相同条件下,若在上述容器中,再充入0.2mol SO2、0.4mol O2和4.0molSO3三种气体,下列对该反应状态的描述中,正确的是______(填字母序号).
A.处于平衡状态
B.不是平衡状态,反应正向进行
C.不是平衡状态,反应逆向进行. 1a2rma1年前1
1a2rma1年前1 -
 alansgg 共回答了21个问题
alansgg 共回答了21个问题 |采纳率85.7%解题思路:(1)根据三段式表示出平衡时各组分的浓度,再利用平衡后气体的总物质的量计算c值,代入平衡常数表达式k=
计算,再根据v=[△c/△t]计算v(SO2);c2(SO3) c2(SO2)•c(O2)
(2)正反应是一个气体总物质的量减小的反应,且是放热反应,当降低温度时,平衡向正反应方向移动;
(3)计算此时的浓度商Qc,与平衡常数比较,若Qc>k,反应向逆反应进行,若Qc=k,反应处于平衡状态,若Qc<k,反应向正反应进行.(1)令平衡时SO2的浓度变化量为cmol/L,则: 2SO2(g)+O2(g)⇌2SO3(g)开始(mol/L):1 0.5&...
点评:
本题考点: 反应速率的定量表示方法;化学平衡常数的含义;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查化学反应速率、影响化学平衡因素、平衡常数的有关计算等问题,难度中等,平衡常数的计算与应用,成为高考的热点,注意平衡常数的用途.1年前查看全部
- 在一固定容积的密闭容器中充入2molSO2和1molO2,在t°C时发生反应:2SO2(g)+O2(g)==2SO3(g
在一固定容积的密闭容器中充入2molSO2和1molO2,在t°C时发生反应:2SO2(g)+O2(g)==2SO3(g)
2min后反应达到平衡状态,此时O2转化率为90%,则反应前后的压强之比为 zuoyunyima1年前2
zuoyunyima1年前2 -
 sethchow 共回答了16个问题
sethchow 共回答了16个问题 |采纳率87.5%10:7
压强之比等于物质的量之比.
O2反应掉的物质的量是1*90%=0.9mol
2SO2(g)+O2(g)2SO3(g)
化学计量数 2 1 2
起始 2 1 0
变化 1.8 0.9 1.8
平衡 0.2 0.1 1.8
反应前的物质的量的和是2+1=3mol
反应后的物质的量的和是0.2+0.1+1.8=2.1mol
压强之比等于物质的量之比,是3:2.1=10:7.1年前查看全部
- 在一定温度下的2L密闭容器中充入0.4molSO2和0.2molO2发生反应若温度不变,在容器中再加1molO2.重新达
在一定温度下的2L密闭容器中充入0.4molSO2和0.2molO2发生反应若温度不变,在容器中再加1molO2.重新达到平衡,则氧气的转化率为什么降低,SO3的体积分数如何证明减小(不通过计算)
 zhould1年前1
zhould1年前1 -
 huanlingxl 共回答了23个问题
huanlingxl 共回答了23个问题 |采纳率87%其实,有个公认的定理,叫做:在一个可逆反应中,添加某一种反应物的量,其他所有反应物的转化率的升高,被添加的转化率就降低,记住这个定理解题可以快很多.
现在来解释一下:温度不变的情况下,添加O2,反应向右进行,但是SO2的量已经不多,所以能反应的O2也少了.先举一例帮助理解.
例(数字的单位都是mol) :
10 SO2和 10 O2 反应后剩下 5 SO2 和 4 O2 .
添加10 O2 ,可以将反应 分成两份 分别都是5 SO2 和 10O2
反应后剩下的O2肯定大于4(因为SO2量减少),而SO2经过两次反应当然剩下少于5.
所以O2的转化率就减小了,SO2的转化率就增大了.
SO3的体积分数减小是因为,增加的氧气中,反应的比消耗的多,也就是说剩余的O2多余新生成的SO3,而容器体积不变,所以SO3的体积分数减小.1年前查看全部
- 1molO2约有( )个O2,(1)1molO2约有( )个O2 ( )molO( )个O(2)3molH2SO4中约含
1molO2约有( )个O2,
(1)1molO2约有( )个O2 ( )molO( )个O
(2)3molH2SO4中约含有( )个H2SO4,可电离出( )molH+,约为( )个H+
(3)2molNH4+中含有( )molH,约含有( )个N
(4)2molH2O含有( )H,含有( )个O 省优部优zz优煤球1年前2
省优部优zz优煤球1年前2 -
 xhm11 共回答了19个问题
xhm11 共回答了19个问题 |采纳率94.7%6.02*10^23
6.02*10^23
1.806*10^24
6
3.612*10^24
8
1.204*10^24
4mol
1.204*10^241年前查看全部
- 1molO2和1molN2所占有的体积都约为22.
 wert21年前1
wert21年前1 -
 yy807012 共回答了11个问题
yy807012 共回答了11个问题 |采纳率72.7%差了个条件“标准状况”
如果有这个状况的话,都是约为22.4L1年前查看全部
- 求详解在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2=2SO3,
求详解
在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2=2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态.现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2、SO3的物质的量.如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同.请填写下列空白:
(1)若a=0,b=0,则c=----.(2)若a=0.5,则b=----和c=----.(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a 和c,另一个只含b和c):---------------------.
第三问 不懂 a+c=2 或者 b+c/2=1 求 .. 心如大醉吴淞月1年前1
心如大醉吴淞月1年前1 -
 mini659 共回答了13个问题
mini659 共回答了13个问题 |采纳率84.6%2SO2+O2=2SO3
2molSO2和1molO2通入一个一定容积的密闭容器里,平衡了
现通入amolSO2和bmolO2和cmolSO3
我可以假设SO3是平衡移动到某个阶段生成的
那么我通(a+c)molSO2和(b+0.5c)molO2,平衡也不改变
即a+c=2,b+0.5c=11年前查看全部
- ..对你们来说很简单某状态下将1molO2、2molSO2和1molSO3的混合气体压入装有V2O5的密闭容器中平衡时测
..对你们来说很简单
某状态下将1molO2、2molSO2和1molSO3的混合气体压入装有V2O5的密闭容器中平衡时测得混合气体对H2的相对密度为28.5求:①反应前混合气体的平均分子量②平衡混合气体的平均分子量③根据上述计算结果,写出原混合气发生反应的化学方程式④求反应的转化率.
.. 维城1年前1
维城1年前1 -
 薇风倩影 共回答了24个问题
薇风倩影 共回答了24个问题 |采纳率91.7%①反应前混合气体的平均分子量
32*1/4+64*2/4+80*1/4=60
②平衡混合气体的平均分子量
混合气体的相对分子质量=28.5*2=57
③根据上述计算结果,写出原混合气发生反应的化学方程式
2SO3?2SO2+O2
④求反应的转化率
----2SO3?2SO2+O2
起始1------2-----1
转化X------X----x/2
平衡1-X----2+X---1+X/2
总物质的量=1-X+2+X+1+X/2=4+X/2
则有:
80*(1-X)/(4+X/2)+64*(2+X)/(4+X/2)+32*(1+X/2)/(4+X/2)=57
X=0.42mol
反应的转化率=0.42/1=42%1年前查看全部
- 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(
一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g),达到平衡后改变下述条件,SO3(g)平衡浓度不变的是( )
A. 保持温度和容器体积不变,再充入1molSO3(g)
B. 保持温度和容器内压强不变,再充入1molSO3(g)
C. 保持温度和容器体积不变,再充入2molSO2(g) 和1molO2(g)
D. 保持温度和容器内压强不变,再充入1molAr(g) 无心luck1年前1
无心luck1年前1 -
 12249098 共回答了16个问题
12249098 共回答了16个问题 |采纳率93.8%解题思路:达到平衡后,改变条件,SO3的平衡浓度不改变的,说明为等效平衡,恒温恒容按化学计量数转化到左边满足2molSO2,1molO2或恒温恒压按化学计量数转化到左边满足n(SO2):n(O2)=2:1,再结合平衡移动分析.A、温度和容器的体积不变,充入1mol SO3(g),按化学计量数转化到左边,得到n(SO2)=1mol,n(O2)=0.5mol,不满足2molSO2,1molO2,与原来的平衡不是等效平衡,所以SO3气体平衡浓度改变,故A不符合;B、温度和容...
点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查平衡移动、等效平衡等,难度中等,注意掌握等效平衡规律.1年前查看全部
- 对于反应C+O2=CO2,1molO2与1molC反应转移几mol电子?
对于反应C+O2=CO2,1molO2与1molC反应转移几mol电子?
不会的别乱来,整错了很麻烦的… 外围1年前1
外围1年前1 -
 无泪的生物 共回答了17个问题
无泪的生物 共回答了17个问题 |采纳率100%4 mol1年前查看全部
- 1、相同情况下1molH2与1molO2的任意比例 混合体积不变?
1、相同情况下1molH2与1molO2的任意比例 混合体积不变?
1、相同情况下1molH2与1molO2的任意比例 混合体积不变?
2、标准情况下1molH2与1molO2的任意比例 混合体积不变
谢绝 jrj120501 再次回答!因为我根本不懂 yzjjbhl1年前1
yzjjbhl1年前1 -
 风貌 共回答了21个问题
风貌 共回答了21个问题 |采纳率100%标准情况下1mol氢气体积是22.4L 氧气也是22.4L(一定要是标况)所以任意比例混合体积不变,即等于原来氢气体积加氧气体积.
相同情况下1molH2与1molO2体积不能确定,但是任意比例混合与原来氢气和氧气总体积不变.1年前查看全部
- 在一定温度下,把2molSO2和1molO2通入一个密闭容器中发生反应;
在一定温度下,把2molSO2和1molO2通入一个密闭容器中发生反应;
在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如反应:2SO2+O2 ==2SO3(g),当此反应进行到一定程度时,反应混合物处于化学平衡状态.维持该容器中温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol).如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时完全相同,请填写下列空白:
①若a=0,b=0,则c= .
②若a=0.5,则b= 和c= .
③a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)
我完全不懂这跟守恒有什么关系啊,比方说第二问吧,a=0.5,为什么不填b=0.25,c=0.5不就直接平衡了么, oo奥特曼1年前1
oo奥特曼1年前1 -
 偶是新粽 共回答了18个问题
偶是新粽 共回答了18个问题 |采纳率100%请看清楚题目要求“三种气体体积分数要仍跟上述平衡完全相同”.还有,这个容器是定容的,反应物气体的计量数之和大于生成物的计量数之和,所以要完全等效,也就是说把加入的物质完全转化为反应物时,SO2和O2的物质的量一定要分别是2mol和1mol.
重点解释③吧!
①c=2
②b=0.25 ; c=1.5
③根据上面的解释,a+c=2 ; b+c/2=1,即2b+c=2,
所以,
abc满足的关系是a+c=2和2b+c=2.1年前查看全部
- 已知断裂1molO2中的化学键需要吸收496kj的能量,H―O键的键能为463kj/mol,则H2中H―H键的键能为?
 zuomeng0081年前1
zuomeng0081年前1 -
 英伦上空的鹰 共回答了2个问题
英伦上空的鹰 共回答了2个问题 |采纳率50%系统消息: 您问的问题有些难,您可以及时的点击右上角的采纳,然后输入#召唤学霸#即可将您的问题反馈给管理员,然后把你的问题推送给学霸解答(3分钟内回复有效)1年前查看全部
- 在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,达到平衡后改变下列条件,SO2、O2、SO3气体平
在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,达到平衡后改变下列条件,SO2、O2、SO3气体平
在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,
达到平衡后改变下列条件,SO2、O2、SO3气体平衡浓度都比原来增大的是ACF(为什么?还有E
的选项原因?)平衡浓度的影响因素是什么
A 保持温度和容积不变,充入2molSO3
B 保持温度和容积不变,充入2molN2
C 保持温度和容积不变,充入0.5molSO2和0.25molO2
D 保持温度和压强不变,充入1molSO3
E 升高温度
F 移动活塞压缩气体问题补充:
额外问下 G 保持温度和压强不变,充入0.5molSO2和0.25molO2
和B的作用区别 linw041年前1
linw041年前1 -
 liuhew 共回答了21个问题
liuhew 共回答了21个问题 |采纳率95.2%ACF都是相当于增大了反应物的浓度
B.压强大了,但各反应物的分压是不变的.浓度没有变化
G与ACF相同1年前查看全部
- 一定温度下,将2molSO2和1molO2加入甲容器,将4molSO3加入乙容器中,隔板不动,将甲乙两容器分成1:2
一定温度下,将2molSO2和1molO2加入甲容器,将4molSO3加入乙容器中,隔板不动,将甲乙两容器分成1:2
(1)现使两容器体积相等,达到新平衡时,S03的体积分数为什么是甲小于乙?
(2)若保持乙中压强不变,向甲乙容器中通入等质量的氦气,达到新平衡时,甲和乙中S03的体积分数比较大小?
条件说隔板不动 xxyy1年前1
xxyy1年前1 -
 Wuqilong 共回答了17个问题
Wuqilong 共回答了17个问题 |采纳率100%(1)原题为一个容器,只是中间用隔板隔开,分为甲,乙两个容器.一开始,甲,乙的体积比为1:2.
而现在使两容器体积相等,即甲,乙的容器体积为1:1.
所以只减小了甲容器的压强,乙容器的压强不变.
2SO2+O2==(可逆)2SO3.减小甲容器的压强,根据勒夏特列原理,反应向逆反应方向进行,所以SO3减少.而乙的不变.后面的就不用我废话了.
(2)因为要保持乙中压强不变,向其中通入气体,其体积也要变大,即乙容器体积增大,而甲容器的体积不变.所以甲容器的压强增大,根据勒夏特列原理,反应向正反应方向进行,所以SO3增多.而乙容器虽然体积变大了,但压强不变,所以甲>乙.
(还有不懂的可以问,.)
(改好了.)1年前查看全部
- 1mol的O2的质量是一个氧分子质量的__________倍,1molO2的质量和氧气的式量在_______上相同,但前
1mol的O2的质量是一个氧分子质量的__________倍,1molO2的质量和氧气的式量在_______上相同,但前者是用________作单位,后者是_______单位
 zxcvlk2jlkjflksd1年前1
zxcvlk2jlkjflksd1年前1 -
 撑起孩子的天空 共回答了22个问题
撑起孩子的天空 共回答了22个问题 |采纳率72.7%2倍
数值
g
g/mol1年前查看全部
- ?高一化学容器中,在一定条件下反应将1molSO2和1molO2通入密闭达到平衡,平衡体系中有SO30.3mol,此时若
?高一化学
容器中,在一定条件下反应将1molSO2和1molO2通入密闭达到平衡,平衡体系中有SO30.3mol,此时若移走0.5molO2和0.5molSO2,则反应达到新平衡时SO3的物质的量为
A0.3mol B 0.15mol C 小于0.15mol D 大于0.15mol,小于0.3mol 为什么是C 怎么算的. vgbvgb1年前3
vgbvgb1年前3 -
 漫夜飞 共回答了19个问题
漫夜飞 共回答了19个问题 |采纳率78.9%不用算.
假如不考虑化学平衡,应该有SO3 0.15mol .现在考虑化学平衡,移走0.5molO2和0.5molSO2,气压减小,平衡向逆反应方向移动,不利于SO3的生成,所以SO3小于0.15mol1年前查看全部
- (1)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子
(1)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1mol H-O键要放出463kJ的能量,则1g氢气燃烧生成气态水时放出的热量为______.
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池的负极反应式为:2H2+4OH--4e-=4H2O,则正极反应式为______. iksusan1年前1
iksusan1年前1 -
 月下人2代 共回答了17个问题
月下人2代 共回答了17个问题 |采纳率88.2%解题思路:(1)由信息可知,H-H键能为436kJ/mol,O=O键能为496kJ/mol,H-O键能为436kJ/mol,2H2(g)+O2(g)=2H2O(g)中,△H=反应物中键能和-生成物中键能和,以此来计算.
(2)根据燃料电池的工作原理:负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子的还原反应来回答.常温下拆开1mol H2中的化学键要吸收436kJ的能量,拆开1mol O2中的化学键要吸收496kJ的能量,形成水分子中的1mol H-O键要放出463kJ的能量,则H-H键能为436kJ/mol,O=O键能为496kJ/mol,H-O键能为436kJ/mol,由2H2(g)+O2(g)=2H2O(l)中,△H=反应物中键能和-生成物中键能和=2×436kJ/mol+496kJ/mol-4×463kJ/mol=-484kJ/mol,即2mol氢气燃烧放出484kJ的能量,1g氢气的物质的量n=[m/M]=[1g/2g/mol]=0.5mol,燃烧放出的热量为121KJ,故答案为:121KJ;
(2)由于是碱性氢氧燃料电池,正极上是氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-.
故答案为:O2+2H2O+4e-=4OH-.点评:
本题考点: 有关反应热的计算;化学电源新型电池.
考点点评: 本题考查血学生有关电化学和热化学的综合知识,注意知识的迁移和应用是解题的关键,难度不大.1年前查看全部
大家在问
- 1从26个子母中任意选一个发挥想象,仿写句子
- 2他点亮了霓虹灯阅读答案1.你用一句话概括文章的主要内容2.在第一段中的“司空见惯”和“天方夜谭”各表明什么?3.在第4段
- 3圆在生活中有哪些应用?为什么草原上的蒙古包是圆形的?为什么绝大多数植物的根和茎的横截面是圆形的?
- 4十九分之十六乘十七分之五减十九分之十二乘十七分之十六加三除以十九用简便计
- 5线索细胞阴性,什么是文章的线索,举个例子,新闻线索是什么
- 6Hainan lsiand is in the south of shanghai (保持句意不变)把他变脸
- 72010年世博会在上海举办,它是世界博览会历史上最伟大的一届。1851年在英国伦敦举行了第一届世界博览会,它以工业革命成
- 8一张纸条给了我一生的尊严父母似乎并没有发现我拿钱的事.似乎能去掉吗?为什么?
- 9英语翻译纳税证明兹有XXX,女,1962年8月28日出生,于1992年9月进入我单位工作至今,现担任会计员.XXX自20
- 10对这种动物外部形态起决定作用的因素为[ ],它是影响生物生活的[ ] .
- 11以下说法中正确的是( )A.某种昆虫靠翅的振动发声.这种昆虫的翅在2 s内做了700 次振动,则频率是350 Hz,人
- 12花药是不是可能是单倍体也可能是多倍体,为什么?
- 13根据收到的 email,我如何 BANK TRANSFER
- 14判断: 盘形凸轮机构从动件的运动规律与基圆半径大小无关.
- 15(1)25℃时,硫氢化钾的稀溶液里存在着下列平衡:(a) HS-+H2O⇌OH-+H2S
