硫酸铵,碳酸氢铵,醋酸铵和氯化铵的PH大小
 圣斗士-一辉2022-10-04 11:39:544条回答
圣斗士-一辉2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 lyhabcde 共回答了15个问题
lyhabcde 共回答了15个问题 |采纳率100%- 碳酸氢铵>醋酸铵>氯化铵>硫酸铵
- 1年前
 林中雪狼 共回答了66个问题
林中雪狼 共回答了66个问题 |采纳率- 硫酸铵>氯化铵>醋酸铵>碳酸氢铵
- 1年前
 水cc 共回答了74个问题
水cc 共回答了74个问题 |采纳率- 首先,题目有误,要说明【等浓度的上述四种溶液】才能比较
【根据越弱越水解,谁强显谁性。】
这四种物质都是铵盐,那么只需要判断阴离子的水解能力即可。
阴离子水解要消耗溶液中的H+ ,使溶液的PH增大。
所以,阴离子对应的酸的酸性越弱,则阴离子的水解能力越大,溶液的PH就越大。
(NH4)SO4 ,NH4HCO3 , CH3COONH4 ,NH4Cl
S... - 1年前
 asiali 共回答了2个问题
asiali 共回答了2个问题 |采纳率- 这个首先要注意严谨。必须标明相同的物质的量浓度,否则比较是没有什么意义的。
相同浓度下,硫酸铵和氯化铵铵根离子水解呈酸性。但硫酸铵铵根多,水解多,酸性最强,其次是氯化铵。
然后醋酸铵醋酸根离子和铵根发生双水解,一碱性一酸性,基本相当,基本呈中性。
然后碳酸氢铵水解呈碱性
故碳酸氢铵>醋酸铵>氯化铵>硫酸铵
回答完毕,请采纳。
本人黄冈的,希望交个朋友... - 1年前
相关推荐
- 加入蒸馏水的鸡蛋清中在加入饱和硫酸铵溶液,会有什么现象?
 viva_long1年前2
viva_long1年前2 -
 cherjenny 共回答了25个问题
cherjenny 共回答了25个问题 |采纳率96%加入蒸馏水的鸡蛋清就是蛋白质胶体溶液(溶胶),往其中加入饱和硫酸铵溶液会产生白色絮状沉淀,即蛋白质从溶液中析出,这种现象叫盐析,盐析是物理变化,是可逆的,当把沉淀过滤取出后再加入蒸馏水中,又会重新溶解成无色透明溶液的.也就是说饱和硫酸铵溶液大大降低了蛋白质在水中的溶解度,而且以沉淀的形式析出.本质上,主要的原因是由于硫酸铵中和了蛋白质的电性,从而降低了蛋白质在水中的溶解能力.
这跟蛋白质溶液中加入重金属盐而发生变性凝聚是完全不一样的.
望采纳!谢谢!1年前查看全部
- 农村常用的有硫酸铵、硝酸铵和尿素等,属于______肥.磷盐酸属于______肥.硫酸钾、氯化钾等属于______肥.
农村常用的有硫酸铵、硝酸铵和尿素等,属于______肥.磷盐酸属于______肥.硫酸钾、氯化钾等属于______肥.
快 蓝茜茜1年前1
蓝茜茜1年前1 -
 雨桑 共回答了14个问题
雨桑 共回答了14个问题 |采纳率92.9%农村常用的有硫酸铵、硝酸铵和尿素等,属于___氮___肥.磷盐酸属于___磷___肥.硫酸钾、氯化钾等属于__钾____肥.1年前查看全部
- 能把 硫酸钠 硝酸铵 氯化钾 硫酸铵 四瓶物色溶液区分开的试剂(可加热)
能把 硫酸钠 硝酸铵 氯化钾 硫酸铵 四瓶物色溶液区分开的试剂(可加热)
A 氯化钡 B 氢氧化钠 C 氢氧化钡 D 硝酸银 happyqf1年前4
happyqf1年前4 -
 CJLIN 共回答了17个问题
CJLIN 共回答了17个问题 |采纳率94.1%A C
A 硝酸铵 硫酸铵 加热发出氨气.2者分别加入氯化钡 有白色沉淀者为硫酸铵. 另一为 硝酸铵
剩余2种中加入氯化钡 无沉淀者为氯化钾 剩余为硫酸钠
C 硝酸铵 硫酸铵 加热发出氨气.2者分别加入氢氧化钡 有白色沉淀者为硫酸铵. 另一为 硝酸铵
剩余2种中加入氢氧化钡 无沉淀者为氯化钾 剩余为硫酸钠1年前查看全部
- 取一定量的硝酸铵和硫酸铵固体混合物,分成质量相等的两份.第一份加水配成50ml的溶液,与足量的氢氧化钠浓溶液共热,在标况
取一定量的硝酸铵和硫酸铵固体混合物,分成质量相等的两份.第一份加水配成50ml的溶液,与足量的氢氧化钠浓溶液共热,在标况下收集到6.72L的氨气;第二份加水完全溶解后,加入过量的氯化钡溶液得到11.65克白色沉淀.试计算:
(1)原固体中硫酸铵的质量
(2)第一份溶液中铵根的物质的量的浓度
(3)原固体中氮元素的质量分数 中泽庆子1年前1
中泽庆子1年前1 -
 fayezeng 共回答了20个问题
fayezeng 共回答了20个问题 |采纳率100%设两份固体中NH4NO3为x mol、(NH4)2SO4为y mol
足量NaOH,即放出所有NH3
x+2y=6.72/22.4=0.3
过量BaCl2,即完全沉淀BaSO4
y=11.65/233=0.05 mol
x=0.2 mol
即(NH4)2SO4质量=6.6g*2=13.2g
NH4^+浓度=(x+2y)/0.05=6 mol/L
N元素质量分数=(2x+2y)*14/(80x+132y)=30.97%
尤其注意,NH4NO3中有2个N1年前查看全部
- 加热硫酸铵的化学反应式
 hsastity1年前2
hsastity1年前2 -
 程维平 共回答了18个问题
程维平 共回答了18个问题 |采纳率77.8%(NH4)2SO4 = NH4HSO4 + NH3↑
谢.1年前查看全部
- 称取含少量杂质(杂质不与酸碱反应)的硫酸铵肥料1.49g,加入足量的碱溶液,加热放出的
称取含少量杂质(杂质不与酸碱反应)的硫酸铵肥料1.49g,加入足量的碱溶液,加热放出的
氨气用25ml0.5mol/L硫酸吸收,剩余的硫酸需用15ml0.2mol/LNaOH溶液中和,求该硫酸铵的纯度 hj1191年前1
hj1191年前1 -
 空谷幽兰鸟 共回答了16个问题
空谷幽兰鸟 共回答了16个问题 |采纳率87.5%氢氧化钠=0.2*0.015=0.003摩尔,能中和硫酸0.003/2=0.0015摩尔;硫酸总量=0.5*0.025=0.0125摩尔,吸收氨气用硫酸0.0125-0.0015=0.011摩尔,生成硫酸铵0.011摩尔,质量=0.011*124=1.364克,硫酸铵的纯度=1.364/1.49=91.5%1年前查看全部
- 将尿素从氯化铵、硫酸铵、硝酸铵、尿素中鉴别出来的物质是…
将尿素从氯化铵、硫酸铵、硝酸铵、尿素中鉴别出来的物质是…
氢氧化钙、稀盐酸、氯化钠、水…中选择 lingbuddy1年前4
lingbuddy1年前4 -
 none7546 共回答了14个问题
none7546 共回答了14个问题 |采纳率100%Ca(OH)21年前查看全部
- 高一化学 下列各组分别是硫酸的性质和用途,其中不能建立对应关系的是 A,酸性-制硫酸铵 B,高沸点
高一化学 下列各组分别是硫酸的性质和用途,其中不能建立对应关系的是 A,酸性-制硫酸铵 B,高沸点
-制氯化氢
C,强氧化性-钝化某些金属 D,脱水性-做干燥剂
 tmmake1年前1
tmmake1年前1 -
 正康 共回答了22个问题
正康 共回答了22个问题 |采纳率90.9%B1年前查看全部
- 尿素CO(NH2)2,硝酸铵NH4NO3,硫酸铵(NH4)2SO4都含有什么元素?[数字都是小写的]
尿素CO(NH2)2,硝酸铵NH4NO3,硫酸铵(NH4)2SO4都含有什么元素?[数字都是小写的]
为什么?
是!一定!含有什么元素?
为什么? 天行一健1年前1
天行一健1年前1 -
 pp127 共回答了12个问题
pp127 共回答了12个问题 |采纳率91.7%其实你列举的这些都是化肥的主要成分.
NH3+是氨基,在水中这些东西会以离子的形态在水中存在,作为小分子物质容易被植物吸收.
N是元素氮,是植物生长的必要元素.
所以作为化肥,他们要选择易溶于水的盐类来做为主要成分.
又因为这3种物质的含氮量不同,而分植物或分时间对植物使用.
含氮量根据分子量计算得出的.
计算公式为:含氮量(100%)=(氮原子量X氮原子个数)/分子量1年前查看全部
- 某硫酸铵化肥混有另一种氮肥,测得该硫酸铵化肥中氮元素的质量分数为35%,则其中混有的另一种氮肥可能是
某硫酸铵化肥混有另一种氮肥,测得该硫酸铵化肥中氮元素的质量分数为35%,则其中混有的另一种氮肥可能是
A.碳酸氢铵B.硝酸铵C.氯化铵D.尿素 lujiang123101年前1
lujiang123101年前1 -
 zhuanmenmaren 共回答了14个问题
zhuanmenmaren 共回答了14个问题 |采纳率100%用极限法做.
一种是硫酸铵含量为100%得氮质量分数
然后将ABCD四个答案按照含量100%得氮质量分数
若35%介于硫酸铵中氮质量分数和答案中氮质量分数
则该答案正确1年前查看全部
- 硫酸钠硫酸镁硫酸铵 加一种试剂鉴别 加什么
 fifi19991年前1
fifi19991年前1 -
 nicehello 共回答了25个问题
nicehello 共回答了25个问题 |采纳率84%氢氧化钠
(NH4)2SO4+2NaOH====2NH3 + 2H2O+Na2SO4有刺激性气味的气体氨气产生
硫酸钠与氢氧化钠不反应
溶液中出现白色沉淀
MgCl2+2NaOH=2NaCl+Mg(OH)2↓1年前查看全部
- 用一种试剂就能鉴别硫酸铵,硫酸钠和氢氧化钠四瓶无色溶液,该试剂是
用一种试剂就能鉴别硫酸铵,硫酸钠和氢氧化钠四瓶无色溶液,该试剂是
A.氢氧化钠溶液 B.氢氧化钡溶液
C.硝酸银溶液 D.硝酸钡溶液 long8412231年前6
long8412231年前6 -
 东哥811 共回答了13个问题
东哥811 共回答了13个问题 |采纳率84.6%氢氧化钡 跟第一个生成白色沉淀和刺激性气体 第二个白色沉淀 第三个无明显现象1年前查看全部
- 稀氢氧化钠水溶液与硫酸铵固体一起加热 1.会观察到什么变化 2.生成物的名称 3.4.离子反应式
 吃过亏1年前3
吃过亏1年前3 -
 xuqyun 共回答了21个问题
xuqyun 共回答了21个问题 |采纳率85.7%1.会有氨气生成
2.生成物质名称:硫酸钠,氨气及水
3. (NH4)2SO4 + 2NaOH ===Na2SO4 + 2NH3 + 2H2O
4. NH4+ + OH- == NH3 + H2O1年前查看全部
- 写出下面的化学式:碳酸钠 碳酸钙 碳酸钡 碳酸钾 磷酸钠 磷酸钙 氯化铵 硫酸铵 硝酸铵 氨气 高锰酸钾 锰酸钾 氯酸钾
 vv_COM1年前1
vv_COM1年前1 -
 dlgcgs 共回答了20个问题
dlgcgs 共回答了20个问题 |采纳率90%碳酸钠 Na2CO3
碳酸钙 CaCO3
碳酸钡 BaCO3
碳酸钾 K2CO3
磷酸钠 Na3PO4
磷酸钙 Ca3(PO4)2
氯化铵 NH4Cl
硫酸铵 (NH4)2SO4
硝酸铵 NH4NO3
氨气 NH3
高锰酸钾 KMnO4
锰酸钾 K2MnO4
氯酸钾 KClO31年前查看全部
- 硫酸铵(NH4)2SO4 碳酸氢铵 (NH4HCO3) 氯化铵 (NH4CL) 硝酸铵(NH4NO3) 中氮元素的含量怎
硫酸铵(NH4)2SO4 碳酸氢铵 (NH4HCO3) 氯化铵 (NH4CL) 硝酸铵(NH4NO3) 中氮元素的含量怎么求 ?
这是谢谢你们了啊...
我我 辛苦死我了.. 幸好还有一口气 .. 蓝天下飞翔1年前1
蓝天下飞翔1年前1 -
 孤堡飘雪 共回答了14个问题
孤堡飘雪 共回答了14个问题 |采纳率85.7%很简单,各氮元素原子量除以本化学式的化学式量,既氮元素的百分含量,如各物质的实际质量知道,和氮元素的百分含量一乘即是.1年前查看全部
- 鉴别氯化铵 硫酸铵 硝酸铵,取样后,先分别滴加:溶液.反应为:.再在没现象的两溶液中滴加:.反应为:.
 66226411年前2
66226411年前2 -
 blue21666 共回答了25个问题
blue21666 共回答了25个问题 |采纳率88%BaCl2
BaCl2+(NH4)2SO4=BASO4+2NH4Cl2
AgNO3
AgNO3+NH4Cl=AgCl(沉淀)+NH4NO31年前查看全部
- 可以在指定溶液中大量共存的是A 稀盐酸 Ba CO3 ZnB 氯化钠 K Ca NO3C 硫酸铵 Na Cu OH
 bodybag-mina1年前1
bodybag-mina1年前1 -
 天魔噬魂 共回答了23个问题
天魔噬魂 共回答了23个问题 |采纳率91.3%B
A 稀盐酸 与Ba CO3 Zn都能反映
C 硫酸铵 Na Cu OH Na与溶液中水反应1年前查看全部
- 硫酸铵、硝酸铵中氮元素质量分数分别为21.2%、35%.硫酸铵与硝酸铵组成的混合物中氮元素的质量分数为
硫酸铵、硝酸铵中氮元素质量分数分别为21.2%、35%.硫酸铵与硝酸铵组成的混合物中氮元素的质量分数为
A 大于35% B 小于21.2%
C 21.2%-35% D以上均有可能 唯生素1年前1
唯生素1年前1 -
 南使用权 共回答了16个问题
南使用权 共回答了16个问题 |采纳率93.8%C.
你两个都大于等于21.2%不可能配出来比它小
同样的·也不能比35%大.1年前查看全部
- 1.66G(nh4)2SO4中含氮多少G?2.多少克硫酸铵中含氮54克?3.10克硫酸铵与足量稀盐酸反应CO2多少?
 tly88881年前1
tly88881年前1 -
 小宝宝027 共回答了10个问题
小宝宝027 共回答了10个问题 |采纳率80%(NH4)2SO4 2N
132 28
66g X
Y 54g
132/66g=28/X
X= 14g
132/Y=28/54g
Y=254.6g
66G(nh4)2SO4中含氮14G
254.6克硫酸铵中含氮54克
硫酸铵与稀盐酸不反应1年前查看全部
- (1)多少克硫酸铵中的氮元素与100g硝酸铵中氮元素的治疗量相等 (2)100g硝酸铵中含氧元素的质量相等
 鹤妹妹1年前2
鹤妹妹1年前2 -
 Applys 共回答了23个问题
Applys 共回答了23个问题 |采纳率95.7%(24/80)X100=(24/132)X xg
第二题方法一样1年前查看全部
- 硫酸铵氢氧化钠碳酸钠能不能共存最后的溶液有没有颜色
 l8505011年前1
l8505011年前1 -
 江雪寒轩 共回答了18个问题
江雪寒轩 共回答了18个问题 |采纳率100%如果是三种溶液的话,不能共存的,整个溶液是强碱性,会有氨气生成,
最后的溶液是无色的.
有Na+,碳酸根,硫酸根,都是无色的 .可能有少量的NH4+.
***硫酸铵和氢氧化钠溶液剧烈反应.***1年前查看全部
- 硝酸 硫酸钡 硫酸镁 硫酸铜 硫酸亚铁 硫酸铁 硫酸铵
硝酸 硫酸钡 硫酸镁 硫酸铜 硫酸亚铁 硫酸铁 硫酸铵
还有碳酸钠 碳酸钾 碳酸钡 碳酸钙 碳酸铵 氢氧化钠 氢氧化钙 氢氧化铁 氢氧化铜 氢氧化铝 氢氧化铵 硝酸钾 硝酸钠 硝酸银 硝酸铜 硝酸铵
有点多啊,我给多点分啊 tgren1年前5
tgren1年前5 -
 小雪是星星 共回答了19个问题
小雪是星星 共回答了19个问题 |采纳率94.7%硝酸 HNO3
硫酸钡 BaSO4
硫酸镁 MgSO4
硫酸铜 CuSO4
硫酸亚铁 FeSO4
硫酸铁 Fe2(SO4)3
硫酸铵 (NH4)2SO4
碳酸钠 Na2CO3
碳酸钾 K2CO3
碳酸钡 BaCO3
碳酸钙 CaCO3
碳酸铵 (NH4)2CO3
氢氧化钠 NaOH
氢氧化钙 Ca(OH)2
氢氧化铁 Fe(OH)3
氢氧化铜 CU(OH)2
氢氧化铝 Al(OH)3
氢氧化铵 NH3.H2O
硝酸钾 KNO3
硝酸钠 NaNO3
硝酸银 AgNO3
硝酸铜 Cu(NO3)2
硝酸铵NH4NO31年前查看全部
- 有一包硫酸铵肥料,一直它含另一种氮肥.测得其含N为20%,则另一种氮肥可能是
 Finiter1年前1
Finiter1年前1 -
 风雨春 共回答了31个问题
风雨春 共回答了31个问题 |采纳率93.5%1、氨态氮肥:液氨含氮82.3%,氨水,碳酸氢铵含氮17.7%,硫酸铵含氮21.2%,氯化铵含氮26.1%
2、硝态氮肥:硝酸铵含氮35%,硝酸钠和硝酸钙含氮15%左右
3、尿素含氮46%1年前查看全部
- 鉴定硫酸铵鉴定一种化肥可能是硫酸铵的方案现象,结论知道并回答的人,感激不尽
 黄山蓝沁1年前2
黄山蓝沁1年前2 -
 海de蓝 共回答了15个问题
海de蓝 共回答了15个问题 |采纳率93.3%取点该物质,加氢氧化钠溶液,稍加热后有难闻的氨气味道应该有氨根离子.加氯化钡溶液,有沉淀,加盐酸溶液沉淀不溶解应该是硫酸根.判断硫酸根就不是那么绝对啊!1年前查看全部
- 将绿矾(FeSO 4 ·7H 2 O)、硫酸铵[(NH 4 ) 2 SO 4 ]以相等物质的量混合可制得摩尔盐[FeSO
将绿矾(FeSO 4 ·7H 2 O)、硫酸铵[(NH 4 ) 2 SO 4 ]以相等物质的量混合可制得摩尔盐[FeSO 4 ·(NH 4 ) 2 SO 4 ·6H 2 O]晶体。 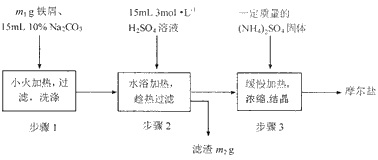
I.根据上图回答:
(1)步骤1的主要作用是__________________________。
(2)步骤3在溶液浓缩时不能蒸发至干,为什么?_______________________________。
(3)制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,理由是___________________________。
Ⅱ.制摩尔盐的原料之一是硫酸铵,评价硫酸铵化肥的主要指标如下:
某研究性学习小组对某硫酸铵化肥样品进行了如下实验探究:
[观察外观] 该硫酸铵化肥无可见机械杂质。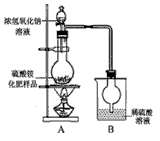
[实验探究] 按图示装置进行实验。
[交流讨论]
(1)甲同学:根据此实验测得的数据,计算的硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:____________________________。
(2)乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是________________________________。
[探究结论] 称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g。由此可判断该化肥的品质为______________________。(选填“优等品”、“一等品”、“合格品”) 叼蛮小丫1年前1
叼蛮小丫1年前1 -
 目送归鸿 共回答了14个问题
目送归鸿 共回答了14个问题 |采纳率78.6%I.(1)除去铁屑表面的油污
(2)①蒸干时溶液中的杂质离子会被带入晶体中②蒸干时晶体会受热分解或被氧化③得不到含有结晶水的晶体
(3) ①减少晶体在洗涤时的溶解②减少蒸馏水中溶解氧对晶体的氧化
Ⅱ.(1)A、B装置间缺一个干燥装置
(2)使硫酸铵充分反应完全转化为NH 3 ;合格品1年前查看全部
- 为什么硫酸铵分解不生成氨气和硫酸(NH4)2SO4--加热--2NH3+H2SO4 重点在为什么
 zlbping1年前2
zlbping1年前2 -
 潇洒云儿 共回答了22个问题
潇洒云儿 共回答了22个问题 |采纳率90.9%氨气是碱性气体,酸碱相遇会发生中和如果按你说的生成氨气和硫酸,两者又会马上反应,所以同时生成氨气和硫酸是不可能的.1年前查看全部
- 取下万化肥各少量,分别加入少量熟石灰粉末,混合、研磨,能否嗅到气味?硫酸铵、氯化铵、硫酸钾、氯化钾
 radgzu1年前2
radgzu1年前2 -
 poui 共回答了18个问题
poui 共回答了18个问题 |采纳率88.9%氯化铵可以!硫酸铵应该也可以.能嗅到有刺激性臭味道气体,是氨气.1年前查看全部
- 1.物质的量浓度相同的下列五种溶液:1.氨水 2.氯化铵 3.碳酸氢铵 4.硫酸氢铵 5.硫酸铵
1.物质的量浓度相同的下列五种溶液:1.氨水 2.氯化铵 3.碳酸氢铵 4.硫酸氢铵 5.硫酸铵
按根离子的浓度由大到小的顺序?
为什么?
2.醋酸钠中加入醋酸,各离子浓度大小比较? 龙红太1年前2
龙红太1年前2 -
 wangshicheng113 共回答了19个问题
wangshicheng113 共回答了19个问题 |采纳率89.5%1、醋酸与醋酸钠等体积等浓度混合呈酸性!醋酸的电离程度大于醋酸根离子的水解!这个可以用醋酸的电离常数和水的离子积常数来计算得出!2、注意:并不是弱酸和相应的弱酸盐混合,就是呈酸性的!假如是很弱的酸和相应的弱...1年前查看全部
- 硫酸钠和硫酸铵的混合溶液,其中硫酸钠饱和而硫酸铵不饱和,此时硫酸钠结晶后其结晶水中是否含有硫酸铵
 赵壮壮1年前3
赵壮壮1年前3 -
 anlanse123 共回答了16个问题
anlanse123 共回答了16个问题 |采纳率93.8%硫酸钠与结晶水之间是化学结合,结合的是水分子不是液态水,不可能有硫酸铵,而且结合的水分子数目是一定的.1年前查看全部
- 现有氯化铵.硫酸铵两种固体混合物,试说明检验其中的硫酸根的实验步骤,实验现象和实验结论?
现有氯化铵.硫酸铵两种固体混合物,试说明检验其中的硫酸根的实验步骤,实验现象和实验结论?
详细点 谢啦 lucky小狐狸1年前2
lucky小狐狸1年前2 -
 天使之珠 共回答了8个问题
天使之珠 共回答了8个问题 |采纳率62.5%溶解_加氯化钡溶液_若出现白色沉淀,则可说明硫酸根离子的存在!
本题是在已知物质的情况下的检验,否则则需要在未知溶液中先加盐酸以排除其他离子的干扰,譬如:碳酸根离子磷酸根离子,银离子硅酸根等离子的干扰!
注意:以上回答适用高中化学教学!1年前查看全部
- 在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体为什么不是氧化还原反应?
 we18921年前1
we18921年前1 -
 shu5012 共回答了13个问题
shu5012 共回答了13个问题 |采纳率92.3%不是,这个属于胶体的盐析现象,是物理反应1年前查看全部
- 硫酸铵晶体存在哪些化学键?
 云霓裳1年前1
云霓裳1年前1 -
 wonzcom 共回答了20个问题
wonzcom 共回答了20个问题 |采纳率95%共价键和离子键1年前查看全部
- 一些化学物质对人类有很大的贡献,但也给人类带来了很多污染等方面的问题,请举一例(塑料 硫酸铵化肥除外)并说说解决问题的办
一些化学物质对人类有很大的贡献,但也给人类带来了很多污染等方面的问题,请举一例(塑料 硫酸铵化肥除外)并说说解决问题的办法.
 吖win1年前2
吖win1年前2 -
 璐猪 共回答了20个问题
璐猪 共回答了20个问题 |采纳率90%福尔马林
有毒,却能防腐1年前查看全部
- 向0.1mol每升的氨水中加入少量硫酸铵固体,则溶液中氢氧根离子的浓度比氨水的浓度 为什么减小呢?
向0.1mol每升的氨水中加入少量硫酸铵固体,则溶液中氢氧根离子的浓度比氨水的浓度 为什么减小呢?
硫酸铵完全电离 ,生成的铵根离子会一直一水合氨的电离 ,可是铵根离子水解也会促进一水合氨的电离啊? 小凸子1年前3
小凸子1年前3 -
 淦越 共回答了20个问题
淦越 共回答了20个问题 |采纳率95%氨水水解生成铵离子和氢氧根离子,题中提到了少量这个词,以高中的做题思维,即不考虑水解了,但是你要纠结这点,这么说氨水是弱碱,它的的电离度强于铵根离子的水解1年前查看全部
- 氯化铵和硫酸铵的水解平衡常数一样吗
氯化铵和硫酸铵的水解平衡常数一样吗
计算方法一样吗orz?
还是说因为c(NH4+)不同有K1^2=K2的关系orz
 alpinehill1年前1
alpinehill1年前1 -
 嘴唇有点厚 共回答了16个问题
嘴唇有点厚 共回答了16个问题 |采纳率81.3%二者水解常数不一样1年前查看全部
- 硫酸铵溶于水为什么呈酸性
 andylcb1年前3
andylcb1年前3 -
 justinbest 共回答了19个问题
justinbest 共回答了19个问题 |采纳率89.5%硫酸铵是强酸弱碱盐水溶液呈酸性
(NH4)2SO4+H2O=2NH3气体+2H2O+H2SO41年前查看全部
- 有一包化学肥料,可能是硫酸铵、过磷酸钙、氯化钾中的一种.取少量样品,观察到其外观为白色晶体,加入水后能全部溶解;另取少量
有一包化学肥料,可能是硫酸铵、过磷酸钙、氯化钾中的一种.取少量样品,观察到其外观为白色晶体,加入水后能全部溶解;另取少量样品与熟石灰混合、研磨,没有刺激性气味气体放出,这种化肥是______.  waterinsky11291年前1
waterinsky11291年前1 -
 詹大师 共回答了19个问题
詹大师 共回答了19个问题 |采纳率89.5%过磷酸钙不是白色晶体;硫酸铵是一种白色晶体,易溶于水,和熟石灰混合、研磨,能生成有刺激性气味的气体氨气;只有氯化钾符合上述情况.
故答案为:氯化钾(或KCl)1年前查看全部
- 硫酸铵与氯化钾溶液需在浓氨水中进行反应浓氨水的作用是
 乡下新白领1年前1
乡下新白领1年前1 -
 sihuaiyong 共回答了13个问题
sihuaiyong 共回答了13个问题 |采纳率84.6%用作溶剂.
水溶液中,(NH4)2SO4与KCl是不能反应的,因为交换成分得到NH4Cl、K2SO4,
他们都易溶于水,没有气体、沉淀、水.所以不满足复分解反应的条件.不反应.
此处,水是溶剂.
但在浓氨水中,交换成分得到NH4Cl、K2SO4.
K2SO4会在浓氨水中析出,所以满足复分解反应的条件.
此处,浓氨水类似于水,是溶剂.1年前查看全部
- 硫酸铵与氢氧化铜反应的化学方程式
 qwert_0070080091年前4
qwert_0070080091年前4 -
 jkfgkjgg 共回答了19个问题
jkfgkjgg 共回答了19个问题 |采纳率84.2%LS误导,氢氧化铜不溶于水,肯定不会与硫酸铵发生复分解反应;
而且如果生成“亚硫酸铜加氨气加水”,那么S元素化合价降低,却没有元素化合价升高,肯定是不可能的.
不过有一种络合物叫做“硫酸铜氨”(硫酸四氨合铜(Ⅱ)),可以通过向硫酸铜溶液中滴加过量氨水制得,也许这与你的问题有关吧.
至于化学方程式,我也不太清楚……不过有一个相关的
CuSO4+4NH3+H2O=([Cu(NH3)4]SO4)·H2O1年前查看全部
- 为了防止有人利用劣质化肥坑害农民,可采用铵盐和氢氧化钠的反应来检验某些氮肥的质量.某同学称取8.25g硫酸铵(杂质不含氮
为了防止有人利用劣质化肥坑害农民,可采用铵盐和氢氧化钠的反应来检验某些氮肥的质量.某同学称取8.25g硫酸铵(杂质不含氮元素)与足量的氢氧化钠混合后,放入试管中加热发生如下反应:(NH4)2SO4+2NaOH
Na2SO4+2NH3↑+2H2O△ .
充分反应后共收集到1.7g氨气,试求这种化肥中硫酸铵的质量分数是多少?氮元素的质量分数是多少? dddzzz5551年前1
dddzzz5551年前1 -
 真搞不明白了 共回答了17个问题
真搞不明白了 共回答了17个问题 |采纳率100%解题思路:根据题目所给的硫酸铵与氢氧化钠反应的化学方程式,由产生氨气的质量计算样品中硫酸铵的质量,并计算出样品中硫酸铵的质量分数和氮元素的质量分数.设样品中硫酸铵的质量为x
(NH4)2SO4+2NaOH
△
.
Na2SO4+2NH3↑+2H2O
132 34
x 1.7g
[132/x]=[34/1.7g]
x=6.6g
样品中硫酸铵的质量分数=[6.6g/8.25g]×100%=80%
6.6g(NH4)2SO4中氮元素的质量为:6.6g×[28/132×100%=1.4g
所以该化肥含氮元素的质量分数是
1.4g
8.25g]×100%=17%
答:这种化肥中硫酸铵的质量分数是80%,氮元素的质量分数是17%.点评:
本题考点: 根据化学反应方程式的计算;元素的质量分数计算.
考点点评: 本题所涉及的反应的化学方程式较为复杂,但题目已经给出,降低了题目难度,依据已知量进行细心计算即可.1年前查看全部
- 用硫酸铵,氯化铵和氯化钾怎么制出硫酸钾
 心态平常1年前3
心态平常1年前3 -
 zxcvoas0df9809as 共回答了9个问题
zxcvoas0df9809as 共回答了9个问题 |采纳率100%根据这三种盐的性质,硫酸铵是强酸弱碱盐,水解加热后,NH4(+)会以NH3形式挥发出去;
氯化铵是强酸弱碱盐,但水解加热后,NH4(+)会以NH3形式挥发出去,Cl(-)也会以HCl形式挥发出去;
氯化钾是强酸强碱盐,它不水解,只电离,电离出K(+),Cl(-)
选择硫酸铵和氯化钾,溶解于水中加热搅拌,便于NH4(+)和Cl(-)挥发出去,就能制得硫酸钾了1年前查看全部
- 化学题(选择正确的答案)A.熟石灰可以改良酸性土壤,但不可以与硫酸铵混合使用.B.塑料都能反复使用,使用塑料无污染.C.
化学题(选择正确的答案)
A.熟石灰可以改良酸性土壤,但不可以与硫酸铵混合使用.
B.塑料都能反复使用,使用塑料无污染.
C.维生素在人体内需要量极少,无需从外界摄取.
D.喝纯净水(蒸馏水)比矿泉水更好. dqyl77181年前4
dqyl77181年前4 -
 小李光花熔 共回答了20个问题
小李光花熔 共回答了20个问题 |采纳率80%A(正确)
B(使用塑料有污染)
C(要从外界摄取)
D(矿泉水中含有许多微量元素,对人体有益,而蒸馏水中什么都没有)1年前查看全部
- 题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
最终分别要得到氯化铵和硫酸铵,提示是用溶解性,我不知道具体的, haifeng5321年前2
haifeng5321年前2 -
 yang_cheng7261 共回答了22个问题
yang_cheng7261 共回答了22个问题 |采纳率81.8%查找一下在不同温度下两种物质的溶解度,找一个合适的温度可以分离出两种物质的晶体!1年前查看全部
- 6瓶白色固体试剂,分别是氯化钡,氢氧化钠,硫酸钠,硫酸铵,无水硫酸铜,碳酸钠,现只提供蒸馏水.
6瓶白色固体试剂,分别是氯化钡,氢氧化钠,硫酸钠,硫酸铵,无水硫酸铜,碳酸钠,现只提供蒸馏水.
1.各取适量固体试剂分别加入六只试管中,加入适当蒸馏水,震荡试管,观察到的现象是______________________
2分别取出未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是__________________________________________-
3鉴别余下未检出的物质的方法和观察到的现象是__________________________________
其中的第一问,“分别取样于试管,加入蒸馏水”.其中,有一试管中出现蓝色溶液,这是硫酸铜.但是通过观察,应该会有氢氧化钠溶于水放热.我看过了之前的提问及答案,认为这道题出得并不算严密.我想知道:为什么答案并没有提到有关氢氧化钠的问题?(还有,我知道这是2005年的全国卷的题,但我们要有实事求是的精神.) 木下恭辅1年前1
木下恭辅1年前1 -
 jian255 共回答了19个问题
jian255 共回答了19个问题 |采纳率89.5%1溶液变蓝的为硫酸铜(氢氧化钠溶于水放热,但现象没有硫酸铜明显;适量固体的热效应不大)1年前查看全部
- 硫酸铵与草木灰可以混合使用吗?为什么?
 永远的小秃1年前1
永远的小秃1年前1 -
 喜碧 共回答了16个问题
喜碧 共回答了16个问题 |采纳率81.3%草木灰是经常使用的肥料.它是由植物秸杆,柴草,枯枝落叶等经过燃烧后的残留物,以含钾为主.
草木灰为灰黑色或黑色,不含氮素及有机物,仅有灰分及其他大量微量元素,其中最多的是钾和钙.由于草木灰中钾的形态主要为碳酸钾,其是硫酸,少量的氯化钾,90%以上可以溶于水,有效性高.
草木灰是一种碱性肥料,它不能与硫酸铵,硝酸铵等铵态氮肥混存和使用,同时也不能与人粪尿,家畜粪混存,否则会引起氮素的迅速挥发而失效.
草木灰适用于除盐碱土以外的各种土壤,尤其适用于酸性土壤.它可作基肥和追肥,一般用量每亩约50-100公斤,并在施用前和湿土拌和,但不要水分太多,否则会使养分流失.
草木灰在盆栽花卉中可以和培养土配成一比例混合使用.不但增加了钾肥,而且能使盆土疏松,排水良好,利于发根.无论扦插用土,播种小苗,一般盆栽花卉都能用上草木灰.1年前查看全部
- 硫酸铵加热分解时一般在多少摄氏度时只释放NH3?
硫酸铵加热分解时一般在多少摄氏度时只释放NH3?
如题,在硫酸钠硫酸铵混合的情况下,只想去除一部分NH3,其他成分想尽量保留,那么试验温度控制在多少比较好? 在黑与白之间1年前2
在黑与白之间1年前2 -
 持久战里有冲刺 共回答了16个问题
持久战里有冲刺 共回答了16个问题 |采纳率93.8%280℃左右
硫酸铵在280℃就开始分解,分解产物放出氨气而生成硫酸氢铵(酸式硫酸铵);
513℃时则硫酸铵完全分解,分解放出氨气、氮气、二氧化硫及水.1年前查看全部
- 某硫酸铵样品中混有一种其他氮肥 经分析样品中含有百分之20.5的氮 则该样品中可能混有的氮肥是
某硫酸铵样品中混有一种其他氮肥 经分析样品中含有百分之20.5的氮 则该样品中可能混有的氮肥是
A尿素B硝酸铵C碳酸氢铵D氯化铵 飘摇jane1年前1
飘摇jane1年前1 -
 清新绿茶827 共回答了16个问题
清新绿茶827 共回答了16个问题 |采纳率93.8%(NH4)2SO4中N的质量分数为:21.2% 〉20.5% 所以混入的化肥中N的质量分数要小于20.5% 只能选C1年前查看全部
- 下列与20ml0.1mol/L硫酸铵中的NH4+浓度相同的溶液是
下列与20ml0.1mol/L硫酸铵中的NH4+浓度相同的溶液是
A.0.2mol/L氨水10ml
B.0.1mol/L氯化铵溶液 40ml
C.0.1mol/L磷酸铵溶液20ml
D.0.2mol/L硝酸铵溶液10ml palewind1年前3
palewind1年前3 -
 wwbbooyy 共回答了14个问题
wwbbooyy 共回答了14个问题 |采纳率100%20ml0.1mol/L硫酸铵中的NH4+浓度:(NH4)2SO4,每mol含2molNH4+,所以浓度为
0.1mol/L*2=0.2mol/L
A.0.2mol/L氨水10ml :氨水溶质看作NH3.H2O,电离成OH-+NH4+,浓度为:0.2mol/L*1=0.2mol/L
B.0.1mol/L氯化铵溶液 40ml :NH4HCL,1mol中含1molNH4+
浓度:0.1mol/L*1=0.1mol/L
C.0.1mol/L磷酸铵溶液20ml :(NH4)3PO4,1mol(NH4)3PO4
含3molNH4+,浓度为:0.1mol/L*3=0.3mol/L
D.0.2mol/L硝酸铵溶液10ml:NH4NO3,1mol含1molNH4+
浓度:0.2*1=0.2mol/L
即A、D.主要注意不要被溶液的体积所迷惑,它问的是浓度而不是物质的量.1年前查看全部
- 把aL含硫酸铵、硝酸铵的混合溶液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份用氯化钡溶液完全反应,消耗c
把aL含硫酸铵、硝酸铵的混合溶液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份用氯化钡溶液完全反应,消耗c mol BlCl2,则原溶液中c(NO3-)为( )
A.b-2c/a mol/L
B.2b-4c/a mol/L
C.2b-c/a mol/L
D.2c-4b/a mol/L
c(NO3-)到底是如何算的, xiejinghe1年前3
xiejinghe1年前3 -
 wldshen 共回答了16个问题
wldshen 共回答了16个问题 |采纳率93.8%由“另一份用氯化钡溶液完全反应,消耗c mol BlCl2”知每一份中含有c mol硫酸铵,所以第一份与烧碱反应的
硫酸铵也为c mol ,第一份c mol 硫酸铵消耗的烧碱为2c mol,故与烧碱反应的硝酸铵为(b-2c) mol,即第一份c(NO3-)=(b-2c)/(a/2)=(2b-4c)/a mol/L ,将溶液等分并不改变其浓度,原溶液中c(NO3-)也为(2b-4c)/a mol/L .1年前查看全部
大家在问
- 1我要比谁都幸福的英文
- 2四大名著中其中一本的读后感?600字就可以了
- 3为什么不管串并联,一个电阻变大,总电阻变大
- 4英语翻译一切,从实际出发!神州行,我看行!
- 5求过点(2,-3),且与圆x2+y2=13相切的直线方程
- 6养鸡场有2200只鸡,公鸡只数是母鸡只数的十分之一,养鸡场有多少只公鸡?
- 7气候具有相似性的地区为什么是刚果盆地和亚马孙平原马上就要考试了急!
- 8如果规定:“*”为一种运算符号,且a*b-ab-a的b次方,计算(-2)*3*4的值
- 9(2)在1,1/2,1/3,1/4,…,1/98,1/99,1/100中选出若干个数,使他们的和大于3,至少要选多少个数
- 10紧急求救!数学的解决问题!王宁去买圆珠笔,家摊位5元可买8支,乙摊位买5支要3元,丙摊位7元买8支送2支,算一算:买哪个
- 11请用3,-5,7,-13进行加减乘除四则运算,使其结果等于24 (每个数只能用一次)
- 12FDOGKADUCKSPCATRLPIGMNPANDA从中找出五个单词,急,
- 13一种奶茶是由奶和茶按5:1配制而成的,现有奶48千克,茶8千克,最多可配制这种奶茶()千克.
- 14+2与-2是一对相反数,请赋予它实际的意义:______.
- 15The numbers of the following traffic signs,which are axially
