燃料电池的负极通常是燃料,它失电子,之后成为什么?一定被氧化成二氧化碳和水吗?什么情况例外
 hhl8192022-10-04 11:39:542条回答
hhl8192022-10-04 11:39:542条回答1楼你说得对,但是为什么呢?
比如说是甲烷,被氧化后先生成什么又和OH-生成碳酸盐?

已提交,审核后显示!提交回复
共2条回复
 远航木 共回答了13个问题
远航木 共回答了13个问题 |采纳率100%- 燃料 自然是被氧化了 产物一般是这样的 但是比如碱性氛围 就会生成碳酸盐
- 1年前
 剑南存 共回答了4个问题
剑南存 共回答了4个问题 |采纳率- 氧气不充分时是一氧化碳和水
- 1年前
相关推荐
- 燃料电池燃料为什么放负极?不是阳极发生氧化反应么?
 tfltg1年前1
tfltg1年前1 -
 liunina 共回答了24个问题
liunina 共回答了24个问题 |采纳率87.5%这个问题不矛盾.
阳极是anode,阴极是cathode.
从电化学角度来说,燃料在阳极发生反应,被氧化,燃料失去电子.
所以从电路中电流方向来说来说,电子从阳极流入电路.所以阳极是燃料电池的负极.
阴极、阳极是根据氧化还原来命名,正极、负极是根据电流方向命名的.在研究电池材料方面的文献中一般用阴极和阳极表示,在电路方面一般使用正极和负极.
所以,对于燃料电池来说,阳极就是负极,这个问题不矛盾.1年前查看全部
- 科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为甲烷,然后将甲烷通入以KOH为电解质的燃料电池发电.电池负
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为甲烷,然后将甲烷通入以KOH为电解质的燃料电池发电.电池负极反应为( ) A.CH 4 +10OH - -8e - = C O 3 2- +7H 2 O B.O 2 +4H + +4e - =2H 2 O C.CH 4 -8e - +8OH - =CO 2 +6H 2 O D.O 2 +2H 2 O+4e - =4OH -  孙多平23381年前1
孙多平23381年前1 -
 zhanguilin 共回答了16个问题
zhanguilin 共回答了16个问题 |采纳率93.8%甲烷中C元素的化合价为-4价,具有还原性,则碱性甲烷燃料电池工作时,通入甲烷的一极为原电池的负极,发生氧化反应,电极反应式为CH 4 +10OH - -8e - =CO 3 2- +7H 2 O,通入氧气的一极为电池的正极,发生还原反应,电极方程式为O 2 +2H 2 O+4e - =4OH - ,
故选A.1年前查看全部
- 以CO为燃料制作燃料电池,电池正极通氧气和二氧化碳,负极通CO,电解质是熔融碳酸
以CO为燃料制作燃料电池,电池正极通氧气和二氧化碳,负极通CO,电解质是熔融碳酸
负极反应为什么生成CO2,反应物为什么有碳酸钠. hsxw1年前1
hsxw1年前1 -
 poolwar 共回答了21个问题
poolwar 共回答了21个问题 |采纳率100%因为燃料电池就好比一个小型的发电场CO+O2=CO2
像火力发电一般但不是真的火力发电、所以一般需要某种金属来参与反应这个反应就应该是Na与碳酸反应了1年前查看全部
- 一种新型的“绿色电池-燃料电池”是把H2、CO、CH4等燃料和空气不断输入,直接氧化,使化学能转化为电能,被称为“21世
一种新型的“绿色电池-燃料电池”是把H2、CO、CH4等燃料和空气不断输入,直接氧化,使化学能转化为电能,被称为“21世纪的绿色发电站”.这三种气体可以作为燃料的原因是( )
A. 都是无毒无害的气体
B. 都可燃烧,放出大量的热
C. 燃烧产物均为二氧化碳和水
D. 均在自然界中大量存在 世紀酷哥1年前1
世紀酷哥1年前1 -
 蝎子BABY 共回答了28个问题
蝎子BABY 共回答了28个问题 |采纳率89.3%解题思路:氢气、一氧化碳、甲烷等物质都具有可燃性,燃烧是能够放出大量的热,常常用作燃料;根据氢气、一氧化碳、甲烷三种气体的特殊之处分析.A、无毒无害气体不一定能够用作燃料,例如氮气无毒无害,不能用作燃料.故选项错误;
B、都可以燃烧并放出大量的热,可以用作燃料.故选项正确;
C、氢气燃烧不能生成二氧化碳,一氧化碳燃烧不能生成水.故选项错误.
D、在自然界大量存在的物质不一定能够用作燃料,例如水在自然界大量存在,不能用作燃料.故选项错误;
故选:B.点评:
本题考点: 常用燃料的使用与其对环境的影响.
考点点评: 解答本题要掌握各种物质的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 关于燃料电池反应原理的问题我想知道,电解质是什么,在反应中的作用,还有高一的课本中氢氧燃料电池的构造图中,通入氢气,氧气
关于燃料电池反应原理的问题
我想知道,电解质是什么,在反应中的作用,还有高一的课本中氢氧燃料电池的构造图中,通入氢气,氧气,但没有说怎么燃烧,我想知道比较具体的原理
最后一个问题,是不是电解质不一定参加电极反应,那它的作用是? 幸福就在身旁1年前3
幸福就在身旁1年前3 -
 wuhanming123456 共回答了22个问题
wuhanming123456 共回答了22个问题 |采纳率100%1、电解质是在水溶液中能够解离成自由移动的离子可以导电的化合物.
2、电解质参加电极反应.
3、电解质在燃料电池中的作用:
氢氧燃料电池工作时,向氢电极供应氢气,同时向氧电极供应氧气.氢、氧气在电极上的催化剂作用下,通过电解质生成水.这时在氢电极上有多余的电子而带负电,在氧电极上由于缺少电子而带正电.接通电路后,这一类似于燃烧的反应过程就能连续进行.
具体地说,燃料电池是利用水的电解的逆反应的"发电机".它由正极、负极和夹在正负极中间的电解质板所组成.最初,电解质板是利用电解质渗入多孔的板而形成,现在正发展为直接使用固体的电解质.工作时向负极供给燃料(氢),向正极供给氧化剂(空气,起作用的成分为氧气).氢在负极分解成正离子H+和电子e-.氢离子进入电解液中,而电子则沿外部电路移向正极.用电的负载就接在外部电路中.在正极上,空气中的氧同电解液中的氢离子吸收抵达正极上的电子形成水.这正是水的电解反应的逆过程.
在酸溶液中负极:2H2-4e-==4H+ 正极:O2 + 4H+ +4eˉ== 2H2O;
碱溶液中负极:2H2 + 4OHˉ-4eˉ== 4H20 正极:O2 + 2H2O + 4eˉ== 4OHˉ
盐溶液中负极:2H2-4eˉ=4H+(阳离子),正极:O2+4eˉ+2H2O=4OHˉ1年前查看全部
- (2012•开封二模)一种新型燃料电池,是用两根金属钼做电极插入KOH溶液中,然后向两极上分别通入H2和O2.下列说法不
(2012•开封二模)一种新型燃料电池,是用两根金属钼做电极插入KOH溶液中,然后向两极上分别通入H2和O2.下列说法不正确的是( )
A.通人H2的电极为负极
B.随着放电的进行,负极附近pH上升
C.通入O2的一极电极反应为2H2O+O2+4e-=4OH-
D.标准状况下通人5.6 L O2完全反应后有1 mol电子转移 池鱼儿1年前1
池鱼儿1年前1 -
 史前巨大食腐兽 共回答了16个问题
史前巨大食腐兽 共回答了16个问题 |采纳率100%解题思路:氢氧燃料碱性电池中通入氢气的一极为原电池的负极,发生氧化反应,电极反应式为H2+2OH--2e-=2H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,据此分析解答.A.该燃料电池中,氢气失电子发生氧化反应,所以通入氢气的电极是负极,故A正确;
B.放电时,负极上电极反应式为H2+2OH--2e-=2H2O,所以负极附近氢氧根离子浓度降低,则pH减小,故B错误;
C.氧气得电子和水反应生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,所以通入氧气的电极是正极,故C正确;
D.氧气的物质的量=
5.6L
22.4L/mol=0.25mol,当消耗0.25mol氧气时转移电子的物质的量=0.25mol×2×[0-(-2)]=1mol,故D正确;
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查氢氧燃料电池的工作原理及电极反应式的书写,题目难度不大,注意电极反应式的书写与电解质溶液酸碱性有关,为易错点.1年前查看全部
- (2014?浙江模拟)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧
(2014?浙江模拟)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧
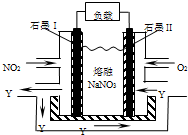 (2014?浙江模拟)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )
(2014?浙江模拟)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )
A.石墨I附近发生的反应为NO2+NO3--e-═N2O5
B.石墨Ⅱ附近反生的反应为O2-4e-═2O2-
C.该电池放电时NO3-从右侧向左侧迁移
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4:1
 水色冰月1年前1
水色冰月1年前1 -
 esucceed 共回答了14个问题
esucceed 共回答了14个问题 |采纳率85.7%A.石墨I为原电池的负极,发生氧化反应,电极方程式为NO2+NO3--e-═N2O5,故A正确;B.石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,故B错误;C.原电池工作时,阴离子向负极移...1年前查看全部
- 有人将铂丝插入H2SO4溶液中做电极,并在两极片分别通入H2和氧气,形成一种燃料电池,在该电池反应中,H2
 野人芭芭1年前1
野人芭芭1年前1 -
 bgunl 共回答了16个问题
bgunl 共回答了16个问题 |采纳率87.5%负极 2H2—4e—=4H+ 正极O2+4H++4e—=2H2O1年前查看全部
- 某燃料电池所用燃料为H2和空气,电解质为熔融的K2CO3.该电池的总反应为2H2+02=2H2O,则该电池正极反应试是什
某燃料电池所用燃料为H2和空气
,电解质为熔融的K2CO3.该电池的总反应为2H2+02=2H2O,则该电池正极反应试是什么样的? sizzler991年前1
sizzler991年前1 -
 长白凤鸢 共回答了23个问题
长白凤鸢 共回答了23个问题 |采纳率91.3%负极:H2 + CO3 2- - 2e = H2O + CO2
正极:O2 + 2CO2 +4e = 2CO3 2-1年前查看全部
- 求6000字论文,题目三选一;1.高温高压技术合成材料的发展概况 2、燃料电池的研究现状 3太阳能电池的研究现
求6000字论文,题目三选一;1.高温高压技术合成材料的发展概况 2、燃料电池的研究现状 3太阳能电池的研究现
内容;1目前有哪些成分体系,并按体系分别介绍
2工作原理、功能、作用
3各体系分别用什么制备工艺制造
4该成分或工艺存在什么问题,如何解决
5未来的发展趋势
5月5日之前,过了就关闭了
可粘贴复制,内容越多越好
资料也可以 我可以自己整理 danxibao611年前1
danxibao611年前1 -
 kayo540 共回答了20个问题
kayo540 共回答了20个问题 |采纳率100%高转换效率太阳能电池仿真设计
【摘要】:随着各国对环境保护的力度加大,再生清洁能源的市场需求巨大,发展太阳能利用技术前景广阔.太阳能利用领域众多,目前主要通过太阳能电池片把太阳能转换为电能加以利用.太阳能电池是利用太阳辐射能切实可行的方法之一,目前能够获得较高的光电转换效率,成本也得到了一定程度的降低,由最初仅应用在航天科技等军工领域扩展到民用方面,以满足日常应用需求.但也应该看到,由于太阳能利用技术目前还不是十分的完善,太阳能的转换利用效率相对常规能源较低,因此,有效提高作为太阳能利用载体的太阳能电池的光电转换效率成为了一个日益迫切的问题.本文对太阳能电池的开发与利用进行了简要的阐述,分析了太阳能电池发电的优点和前景,就提高太阳能电池转换效率的方法进行了探讨,提出了论文的研究目标,分析了其实现方法.对寄生电阻、扩散长度和表面复合速率等影响太阳能电池转换效率的主要因素进行了深入分析.介绍了太阳能电池仿真软件AMPS和PC-ID,选取PC-ID软件并对其特性和参数设置做了简要介绍,分析了利用该软件进行太阳能电池效率分析的具体方法.针对各因素对太阳能电池转换效率的影响,在掌握PC-ID使用方法的基础上,就太阳能电池转换效率的影响因素进行了具体的仿真分析,验证了各因素对太阳能电池转换效率的影响规律.通过仿真优化设计,得出了较高转换效率的多晶硅薄膜太阳能电池仿真参数,该方案实现了0.7818填充因子、15.82%光电转换效率的太阳能电池仿真设计,完成了0.75填充因子、15%光电转换效率的预期目标.根据仿真所得电池参数,设计了一款SSP衬底多晶硅薄膜太阳能电池,探讨了工艺过程和条件.该电池工艺首先使用区熔再结晶的方法制备较好结晶质量和表面平整度的SSP衬底,然后通过光刻穿透衬底表面SiO2层(磷扩散层)后使用PECVD工艺烧结铝浆穿透该层,形成背电场,再使用快速热化学气相沉积工艺进行多晶硅薄膜的沉积,采用低成本的酸腐蚀法工艺进行电池表面制绒处理并采用等离子气相沉积法制备SiNx材质减反膜.最后分层蒸镀、烧结制备电极,去边处理后完成电池片的制备.通过工艺条件的控制得到与设计结构相符的电池片.
【关键词】:多晶硅太阳能电池 PC-1D 转换效率 影响因素 仿真
摘要
目录
第1章 绪论
1.1 太阳能概述
1.2 太阳能电池的优点
1.3 太阳能电池应用前景
1.4 太阳能电池材料
1.5 太阳能电池研究现状及其效率的提高
1.6 太阳能电池电学模型
1.6.1 太阳能电池工作原理
1.6.2 太阳能电池主要技术参数
1.6.3 光照下太阳能电池等效电路
1.7 研究目标
1.8 本文结构和特点
第2章 多晶硅太阳能电池效率影响因素
2.1 寄生电阻
2.2 扩散长度
2.3 表面复合速率
2.3.1 表面复合成因
2.3.2 表面复合的影响
2.4 本章小结
第3章 太阳能电池仿真分析方法
3.1 太阳能电池仿真软件简介
3.1.1 AMPS-1D
3.1.2 PC-1D
3.2 仿真软件的选取
3.3 太阳能电池的PC-1D参数界面
3.4 使用PC-1D优化太阳能电池设计
3.4.1 器件参数设置思路
3.4.2 输入激励设置
3.5 仿真数据处理过程
本章小结
第4章 PC-1D仿真分析
4.1 影响因素的仿真分析
4.1.1 寄生电阻的影响
4.1.2 扩散长度的影响
4.1.3 复合速率的影响
4.2 仿真结论
4.3 本章小结
第5章 多晶硅薄膜电池设计
5.1 薄膜电池参数
5.2 多晶硅薄膜电池制备
5.2.1 SSP衬底的制备
5.2.2 PN结的制备及制绒减反处理
5.2.3 背电极的蒸镀和烧结
5.2.4 正电极蒸镀及Forming Gas烧结
5.3 本章小结48-49
第6章 全文总结
6.1 本文主要工作
6.2 结论及展望
致谢
参考文献
自己扩展……1年前查看全部
- CH4的燃料电池 NaCO3溶液电解液 正负极 方程式
CH4的燃料电池 NaCO3溶液电解液 正负极 方程式
要准确啊 ..........Na2CO3(打错了) psomer1年前2
psomer1年前2 -
 yooyuan87 共回答了19个问题
yooyuan87 共回答了19个问题 |采纳率89.5%负极:CH4 -8e + 9OH(-) = HCO3(-) + 6H2O
正极:O2 + 4e + 2H2O = 4OH(-)
总反应:CH4 + 2O2 + OH(-) = HCO3(-) + 2H2O1年前查看全部
- 燃料电池酸性条件下电极方程式为什么写二氧化碳?他不和水反应生成碳酸吗?
 猿人qq1年前1
猿人qq1年前1 -
 阿仁_陈永仁 共回答了12个问题
阿仁_陈永仁 共回答了12个问题 |采纳率83.3%我举个例子,例如甲烷燃料电池(酸性条件):
正极:O2 + 4H+ + 4e- = 2H2O
负极:CH4 + 2H2O - 8e- = CO2 + 8H+
总反应:CH4 + 2O2 = CO2 + 2H2O
一般酸性和中性条件下我们认为CO2不会和H2O反应,因为程度比较小
而碱性环境发生这个反应:CO2 + 2OH- = CO32- + H2O
所以碱性条件负极将得到CO32-而不是CO2了
亲!1年前查看全部
- 甲醇制燃料电池的那一问..
甲醇制燃料电池的那一问..

 zhouzhenjun1年前1
zhouzhenjun1年前1 -
 wjuny163 共回答了17个问题
wjuny163 共回答了17个问题 |采纳率88.2%CH3OH-6e+6OH=CO2+5H2O1年前查看全部
- 求教燃料电池的反应原理一般电池的反应都是自发的氧化还原,可是燃料电池跟这个没什么关系啊,我不明白燃料电池的反应机理,哪位
求教燃料电池的反应原理
一般电池的反应都是自发的氧化还原,可是燃料电池跟这个没什么关系啊,我不明白燃料电池的反应机理,哪位高手可以给我讲一下:
酸性时为什么失电子还要加个水上去?
 kk男孩991年前1
kk男孩991年前1 -
 kimi661O 共回答了21个问题
kimi661O 共回答了21个问题 |采纳率100%燃料电池电极判断很简单1、通入燃料的作负极,助燃剂是正极2、总反应方程式与燃料的燃烧反应类似(不需要点燃)写电极方程式时要考虑产物与电解质是否反应,这个题目的负极写法比较复杂,告诉你一个技巧先写总反应方程...1年前查看全部
- C3H8/O2(KOH)燃料电池,电极反应及总反应
 rr旋风1年前2
rr旋风1年前2 -
 crispymushroom 共回答了26个问题
crispymushroom 共回答了26个问题 |采纳率88.5%负极:C3H8 - 20 e- + 26OH- = 3CO32- + 17H2O
正极:5O2 + 20 e- + 10H2O = 20OH-
总反应:C3H8 + 5O2 + 6KOH = 3K2CO3 + 7H2O1年前查看全部
- 燃料电池的题以甲醇为燃料的燃料电池求正负极的反应式
 logz1年前1
logz1年前1 -
 cs2004zx 共回答了20个问题
cs2004zx 共回答了20个问题 |采纳率95%甲醇燃料电池(碱性)
负极:2CH3OH + 4H2O+ 16OH- ==12H2O+ 12e- +2CO3 2-
正极:3O2 + 12H2O +12e- ==12OH-
(酸性)
负极:CH3OH+H2O-6e-=CO2+6H+
正极:O2+4H++4e-=2H2O1年前查看全部
- 科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电.电池负极反应为
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电.电池负极反应为( )
A. H2+2OH-=2H2O+2e-
B. O2+4H++4e-=2H2O
C. H2=2H++2e-
D. O2+2H2O+4e-=4OH- smilecjz1年前1
smilecjz1年前1 -
 yfh1967 共回答了14个问题
yfh1967 共回答了14个问题 |采纳率85.7%解题思路:氢气具有还原性,在负极上发生氧化反应,由于电解质溶液呈酸性,则负极上氢气失电子生成氢离子,负极反应为
H2=2H++2e-,正极反应O2+4H++4e-=2H2O.A、电解质溶液呈酸性,负极上无OH-离子参与反应,故A错误;
B、负极发生氧化反应,氢气失去电子,该反应为正极反应,故B错误;
C、电解质溶液呈酸性,则负极上氢气失电子生成氢离子,电极反应为H2=2H++2e-,故C正确;
D、负极发生氧化反应,氢气失去电子,该反应为碱性溶液中正极反应,故D错误.
故选C.点评:
本题考点: 电极反应和电池反应方程式.
考点点评: 本题考查电极反应,题目难度不大,本题中注意两极上的变化和电解质溶液对电极反应的影响.1年前查看全部
- 高一 化学 原电池燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,宇宙飞船上的氢氧燃料电池,其电极反应为
高一 化学 原电池
燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,宇宙飞船上的氢氧燃料电池,其电极反应为2H2-4e-+4OH-4H2O,O2+2H2O+4e-4OH-
燃料电池在发电的同时还合成了水,这正好解决了宇航员在太空中饮水的问题.若电池输出的电流强度为533 A,则每小时能合成多少克水?
求过程
问题补充: 每个电子所带的电量为1.6x10的负19次方。Q=It t37bl1年前1
t37bl1年前1 -
 过来过来 共回答了18个问题
过来过来 共回答了18个问题 |采纳率83.3%电流强度 I=533A
根据I=Q/t
Q=It=533x3600=1.92x10^6 C
转移电子的物质的量n=Q/F=1.92x10^6/96500mol=19.9mol
由于每生成1mol水需要2mol电子,则生成水9.95mol
则生成水180g1年前查看全部
- 1.燃料电池,若电极为氢气和氧气.KOH是电解质溶液.正极反应为什么是O2+2H2O+4e-=4OH-,这个H2O是怎么
1.燃料电池,若电极为氢气和氧气.KOH是电解质溶液.正极反应为什么是O2+2H2O+4e-=4OH-,这个H2O是怎么回事?
2.把KOH换成硫酸,负极反应为什么是2H2-4e-=4H+,为什么没有阴离子移向负极呢?
对于这个问题,我还想知道为什么有的方程式里面只是得失电子,有的还要结合阴阳离子?
3.以Fe和Cu为电极,Cucl2作电解质,总反应和电极反应分别是什么?
4.以锌,铜为电极,CuSO4为电解质,总反应和电极反应分别是什么?
5.为什么构成原电池加快反应速率? ct3211年前3
ct3211年前3 -
 kgbzyw 共回答了16个问题
kgbzyw 共回答了16个问题 |采纳率100%1,负极生成水,正极就要消耗水.主要是氧负离子不能在水中稳定存在,会与水反应生成氢氧跟,或与氢离子反应生成水.2,此时是硫酸做电解质溶液,溶液显酸性,正极产生的氧负离子与氢离子结合生成水.故溶液中只有硫酸跟向负极移动.负极生成的氢离子因此能稳定存在.方程式写法与电解质溶液有关,主要看参与电极反应的物质的产物与电解质反应不.如氧失去电子得氧负离子碱性环境与水反应生成氢氧跟,酸性环境与氢离子反应生成水.4,总反应就是铁置换铜,负极为铁失去电子成二价,正极是铜得电子成单质.5,原电池电路加快了电子移动速度,增大了电子释放面积.1年前查看全部
- 试就一种燃料电池体系(如质子交换膜燃料电池,固体氧化物燃料电池)说明燃料电池的特点、优势及目前存在
 wer36691年前2
wer36691年前2 -
 依破天 共回答了24个问题
依破天 共回答了24个问题 |采纳率87.5%……你是要交论文么?随便找篇综述翻译一下就好了,比如固体氧化物燃料电池(sofc),找篇阳极支撑型的review,翻译前半段就好了.像sofc的特点就是生产以及使用过程当中无毒无污染,发电效率高,可以实现热电联供.1年前查看全部
- 为什么说氨气燃料电池要是碱性的?不要复制粘贴,
 8777091年前4
8777091年前4 -
 yyidd 共回答了25个问题
yyidd 共回答了25个问题 |采纳率92%氨气燃料电池是负极氨气,正极是空气或氧气或者其他强氧化性物质,用惰性电极等组成.电解质呈碱性,主要是氨气极易溶于水,生成的氨水呈碱性,而且反应可逆,溶液里若有大量OH-的话就一定程度上减小氨气的溶解度,使氨气的氧化更容易些1年前查看全部
- 某种燃料电池是以甲烷(CH4)和空气为原料,以KOH为电解质溶液构成的原电池.电池的总反应类似甲烷在氧气中的燃烧.下列说
某种燃料电池是以甲烷(CH4)和空气为原料,以KOH为电解质溶液构成的原电池.电池的总反应类似甲烷在氧气中的燃烧.下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②CH4在负极发生氧化反应,电极反应式是:CH4+10OH--8e-=CO32-+7H2O
③燃料电池把化学能直接转化为电能,而不经过热能这一种中间形式,所以它的能量转化效率高,并且减少了对环境的污染
④这种燃料电池要定期更换电解质溶液.
A.①②
B.①②③④
C.①③④
D.②④ 壮志向日葵1年前1
壮志向日葵1年前1 -
 nottingroro 共回答了12个问题
nottingroro 共回答了12个问题 |采纳率91.7%解题思路:①根据电极反应来确定转移电子情况;
②根据负极上发生反应的反应类型确定反应的物质及电极反应式;
③根据能量转化判断;
④根据电池反应前后电解质的变化来判断.①根据电极反应式:CH4+10OH--8e-=CO32-+7H2O,则每消耗1molCH4可以向外电路提供8mole-,故①正确;
②燃料在负极上失电子发生氧化反应,甲烷燃烧能生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾,所以电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故②正确;
③燃料电池把化学能直接转化为电能,而不经过热能这一种中间形式,所以它的能量转化效率高,反应的产物是碳酸钾和水,可以减少对环境的污染,故③正确;
④该电池的电池反应式为:CH4+2O2+2KOH=K2CO3+3H2O,溶液由碱溶液变成盐溶液,要定期更换电解质溶液,故④正确.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了燃料电池,电极反应式的书写要注意结合电解质溶液判断电极上的生成物,原料相同,电解质溶液不同,电极反应式就不同.1年前查看全部
- 电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O═Cl-+Mg(
电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图②是含Cr2O72-工业废水的电化学处理示意图.下列说法正确的是( )
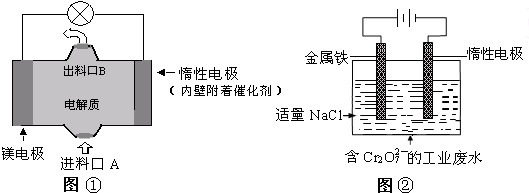
A.图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②中阳极上的电极反应式为:Fe-3e-═Fe3+
C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-═Cl-+Mg (OH)2↓
D.若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀 江城子II1年前1
江城子II1年前1 -
 wuxiaozizi 共回答了19个问题
wuxiaozizi 共回答了19个问题 |采纳率94.7%解题思路:A.图②中惰性电极为阴极;
B.阳极铁被氧化生成Fe2+;
C.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,以此计算.A.图②中惰性电极为阴极,Fe电极为阳极,则Cr2O2-7离子向金属铁电极移动,与亚铁离子发生氧化还原反应生成的金属阳离子与惰性电极附近的OH-结合转化成Cr(OH)3除去,故A错误;
B.图②中阳极上的电极反应式为:Fe-2e-═Fe2+,故B错误;
C.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应,则总反应减去负极反应可得正极还原反应为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,故C正确;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,则n(Mg)=[3.6g/24g/mol]=0.15mol,理论可产生氢氧化铁沉淀的质量为0.15mol×107g/mol=16.05g,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查电解原理,涉及电解、氧化还原反应、电子守恒的计算等问题,为高频考点,要求具有较好的分析和解决问题的能力,题目难度中等.1年前查看全部
- 燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉
 燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉花的碳棒为电极,电解质溶液用0.5mol•L-1Na2SO4溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA.
燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉花的碳棒为电极,电解质溶液用0.5mol•L-1Na2SO4溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA.
(1)在碳棒电极外面缠绕棉花的作用是______
(2)按下开关S1,半分钟后两碳棒上产生明显的气泡,此时碳棒C1为______极,装置中发生的总反应的化学方程式为2H2O
O2↑+2H2↑通电 .2H2O;
O2↑+2H2↑通电 .
(3)断开开关S1,按下开关S2,可观察到的明显现象为______;碳棒C2为______极,其电极反应式为______.
(4)该小组把0.55mol.L-1Na2SO4溶液换成0.55mol.L-1NaCl溶液;当断开开关S2,按下开关S1,则检验C1极产生气体的实验方法:______;一段时间后,当断开开关S1,按下开关S2时,电极C1反应式为______. apple261年前1
apple261年前1 -
 崔允 共回答了14个问题
崔允 共回答了14个问题 |采纳率85.7%解题思路:(1)吸附气体体积与电极表面积成正比,吸附气体越多越有利于形成燃料电池;
(2)按下开关S1,该装置是电解池,碳棒C1为作阳极,碳棒C2为阴极,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,实质上是电解水;
(3)断开开关S1,按下开关S2,该装置构成燃料电池,氢气所在电极为负极,氧气所在电极为阳极,负极上氢气失电子发生氧化反应;
(4)以氯化钠溶液为电解质溶液时,当断开开关S2,按下开关S1,C1极氯离子放电生成氯气,氯气能置换出碘单质,碘遇湿润的淀粉碘化钾试纸变蓝色;
一段时间后,当断开开关S1,按下开关S2时,该装置构成原电池,电极C1上氯气得电子发生还原反应.(1)在碳棒电极外面缠绕棉花,增大表面积而使碳棒吸附较多的气体,有利于形成燃料电池,
故答案为:使碳棒吸附较多的气体,有利于形成燃料电池;
(2)按下开关S1,该装置是电解池,碳棒C1为作阳极,碳棒C2为阴极,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,实质上是电解水,电池反应式为2H2O
通电
.
O2↑+2H2↑,
故答案为:阳极;2H2O
通电
.
O2↑+2H2↑;
(3)断开开关S1,按下开关S2,该装置构成燃料电池,有电流产生,则二极管发光;氢气易失电子发生氧化反应,则氢气所在电极为负极,氧气所在电极为阳极,负极上氢气失电子发生氧化反应,
电极反应式为H2-2e-=2H+(写H2+OH--2e-=H2O也对),
故答案为:二极管发光;负极;H2-2e-=2H+(写H2+OH--2e-=H2O也对);
(4)以氯化钠溶液为电解质溶液时,当断开开关S2,按下开关S1,C1极氯离子放电生成氯气,氯气能置换出碘单质,碘遇湿润的淀粉碘化钾试纸变蓝色,其检验方法为:将湿润的淀粉碘化钾试纸置于C1极附近,若试纸变蓝,则说明C1极产生Cl2;
一段时间后,当断开开关S1,按下开关S2时,该装置构成原电池,电极C1上氯气得电子发生还原反应,
电极反应式为Cl2+2e-=2Cl-,
故答案为:将湿润的淀粉碘化钾试纸置于C1极附近,若试纸变蓝,则说明C1极产生Cl2;Cl2+2e-=2Cl-.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,知道氯气的检验方法,电解硫酸钠溶液时,阴极上氢离子放电,电解亚硫酸钠时,阴极上亚硫酸根离子放电,二者不同.1年前查看全部
- 下列热化学方程式或离子方程式中,正确的是( ) A.在CH4、02和KOH溶液组成的燃料电池中,负极反应式为:CH 4
下列热化学方程式或离子方程式中,正确的是( ) A.在CH4、02和KOH溶液组成的燃料电池中,负极反应式为:CH 4 -8e - +10OH - =CO 3 2- +7H 2 O B.在5000C、30Mpa条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH 3 (g),放热19.3kJ,其热化学方程式为:
N 2 (g)+3H 2 (g)
2NH 3 (g);△H=-38.6kJ/molC.乙烯的燃烧热为akJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C 2 H 4 (g)+3O 2 (g)=2CO 2 (g)+2H 2 O(g););△H=-akJ/mol D.向苯酚钠(C6H5ONa)溶液中通入少量二氧化碳:C 6 H 5 O - +CO 2 +H 2 O→2C 6 H 5 OH+CO 3 2-  风影30001年前1
风影30001年前1 -
 印江新寨 共回答了22个问题
印江新寨 共回答了22个问题 |采纳率90.9%A、原电池负极发生氧化反应,甲烷在负极放电,在碱性条件下生成碳酸根离子与水,电极反应式为CH 4 -8e - +10OH - =CO 3 2- +7H 2 O,故A正确;B、0.5molN 2 和1.5molH 2 置于密闭容器中充分反应生成NH 3 (g)...1年前查看全部
- 在燃料电池中,固体电解质作介质与普通的酸碱溶液作介质写电极反应式时有何不同?需要考虑哪些问题?希望举例加以说明.我诚心坐
在燃料电池中,固体电解质作介质与普通的酸碱溶液作介质写电极反应式时有何不同?需要考虑哪些问题?希望举例加以说明.我诚心坐等解答.先致感激.
 画神仙1年前1
画神仙1年前1 -
 istandup 共回答了29个问题
istandup 共回答了29个问题 |采纳率75.9%高中的时候,只需要掌握固体电解质(氧化钇,氧化锆等)可以传导O2-就可以了.在写电极反应式的时候,正极区氧气得电子可直接得到氧离子(O2-).
而电解质溶液则需要根据溶液的酸碱性来考虑氧气得电子的产物,酸性时产物为H2O,中性或碱性时产物为OH-.氧离子不能在水中存在.
给你举个例子吧:同样是甲烷 — 氧气 燃料电池,
如果是固体电解质,那么正极的反应式:O2 - 4e- = 2O2-
如果电解质溶液是碱性溶液,那么正极反应式就是:O2 - 4e- + 2H2O = 4OH-
如有疑惑,欢迎追问1年前查看全部
- 求甲醇氧气燃料电池的总反应方程,正负极.
 airplay19831年前0
airplay19831年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 书写电极反应以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.正负极的电极反应 分别怎么写呢
 kbwuying1年前2
kbwuying1年前2 -
 ax8k 共回答了13个问题
ax8k 共回答了13个问题 |采纳率84.6%只要知道原电池正极是阴极就行了.(负极当然就是阳极了)
H2被氧化,氧化反应发生在阴极上.
H2 + 2Cl- ---> 2HCl + 2e
N2被还原,还原反应发生在阳极.
N2 + 6H+ + 6e ---> 2NH31年前查看全部
- 氢气,一氧化碳,甲烷,作为燃料电池所需燃料理由
氢气,一氧化碳,甲烷,作为燃料电池所需燃料理由
答案是都可燃烧放出大量热,是因为他们化学能很多吗?
化学能转化为内能,大量热说明内能多, Fei-r1年前4
Fei-r1年前4 -
 不想说 共回答了13个问题
不想说 共回答了13个问题 |采纳率69.2%因为他们与氧气反应,是放热反应
没这个说法!1年前查看全部
- 燃料电池的电解质溶液是什么?酸性环境和碱性环境的区别在哪里?为什么碱性的优于酸性的?如何判断出的“在碱性条件下氢气、氢氧
燃料电池的电解质溶液是什么?
酸性环境和碱性环境的区别在哪里?为什么碱性的优于酸性的?
如何判断出的“在碱性条件下氢气、氢氧根反应再失电子产物就是水”? weixinglaker1年前3
weixinglaker1年前3 -
 笑笑日光倾城 共回答了12个问题
笑笑日光倾城 共回答了12个问题 |采纳率91.7%1.燃料电池的电极本身不包含活性物质,它只是一个催化原件.
2.酸性的可以提供氢离子,氢离子参与反应.碱性的当然就是氢氧根参与反应,或者水参与反应,氢氧根浓度不变.
碱性的更环保,耐用.酸性的容易生成氢气,使用时间长了就失效了.
而碱性的就不会出现这种问题.
3.氢气中的氢是0价,失去电子后+1价,容易和碱性条件下的OH-反应生成水.1年前查看全部
- 一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能
一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料说法正确的是( )
A. 在熔融电解质中,O2-由负极移向正极
B. 电池的总反应是:2C4H10+13O2═8CO2+10H2O
C. 通入空气的一极是负极,电极反应为:O2+4e-=2O2-
D. 通入丁烷的一极是负极,电极反应为:C4H10-26e-+13O2-=4CO2+5H2O 2005jie111年前3
2005jie111年前3 -
 保持专注 共回答了20个问题
保持专注 共回答了20个问题 |采纳率85%解题思路:在丁烷燃料电池中,负极发生氧化反应,电极反应式为C4H10-26e-+13O2-=4CO2+5H2O,正极发生还原反应,电极反应式为O2+4e-=2O2-,总反应式为2C4H10+13O2═8CO2+10H2O,在原电池中,阴离子向负极移动,阳离子向正极移动.A、在原电池中,阴离子向负极移动,阳离子向正极移动,故A错误;
B、燃料电池的总反应与燃料燃烧的化学方程式相同,为2C4H10+13O2═8CO2+10H2O,故B正确;
C、通入空气的一极是正极,发生还原反应,电极反应为:O2+4e-=2O2-,故C错误;
D、丁烷具有还原性,在丁烷燃料电池中,负极发生氧化反应,电极反应式为C4H10-26e-+13O2-=4CO2+5H2O,故D正确.
故选BD.点评:
本题考点: 化学电源新型电池;电极反应和电池反应方程式.
考点点评: 本题考查化学电源新型电池,侧重于电极反应方程式的考查,题目难度中等,注意从正负极发生的变化结合电解质的特点书写电极反应式.1年前查看全部
- 如图为Mg-NaClO燃料电池结构示意图.下列说法正确的是( )
如图为Mg-NaClO燃料电池结构示意图.下列说法正确的是( )
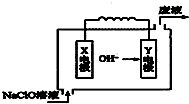
A. 镁作Y电极
B. 电池工作时Na+向负极移动
C. 废液的pH大于NaClO溶液的pH
D. X电极上发生的反应为:ClO-+2H2O-4e-=ClO3-+4H+ 604360431年前1
604360431年前1 -
 涛007 共回答了10个问题
涛007 共回答了10个问题 |采纳率90%解题思路:原电池工作时,阴离子向负极移动,阳离子向正极移动,由阴离子移动方向可知Y为负极,X为正极,负极发生氧化反应,正极发生还原反应,以此解答该题.A.Mg容易失去电子,OH-在燃料电池中移向流出电子的负极,故Mg作Y电极,故A正确;
B.Na+移向流入电子的正极或X电极,故B错误;
C.镁失去2个电子变为镁离子,镁离子与氢氧根离子结合为氢氧化镁沉淀,OH-被消耗,反应后废液的主要成分为氯化钠,故废液的pH小于 NaClO溶液的pH,故C错误;
D.H+与OH-不能大量共存,则正极反应式为ClO-+2e-+H2O=Cl-+2OH-,故D错误.
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查电解池和原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,难度中等.1年前查看全部
- 乙炔燃料电池正负极反应方程式(酸,碱性)
 遗失美好keey1年前1
遗失美好keey1年前1 -
 479981 共回答了20个问题
479981 共回答了20个问题 |采纳率95%正极:O2 + 4e + 4H+ ----> 2H2O
负极:C2H2 - 10e + 4H2O ----> 2CO2 + 10H+
正极:O2 + 4e + 2H2O ----> 4OH-
负极:C2H2 - 10e + 14OH- ----> 2CO32- + 8H2O1年前查看全部
- 燃料电池的 碱性反应不明白为什么用naOH 在两两个金属能组成原电池 为什么用Nacl溶液做电解液也能组成电池 我们原电
燃料电池的 碱性反应不明白为什么用naOH 在两两个金属能组成原电池 为什么用Nacl溶液做电解液也能组成电池 我们原电池都学完了就这点不明白 哪个朋友要是明白
 三百六十五天1年前4
三百六十五天1年前4 -
 猩猩点灯 共回答了19个问题
猩猩点灯 共回答了19个问题 |采纳率100%燃料电池碱作电解质正极氧气得电子生成氢氧根离子,负极燃料:H2失电子后结合氢氧根生成水.如果是甲烷或甲醇有CO2生成应该继续与OH-反应生成CO32-和水.
用naOH 在两两个金属能组成原电池,一定是因为某一种金属是铝能和碱反应.
用Nacl溶液做电解液也能组成电池 ,应该用金属的电化学腐蚀来解释,你们可能还没学到,把教材往后看几节就会了.学习是有阶段性的,有时学到后边,前面的知识会突然明白,1年前查看全部
- 甲醇是一种优质燃料,可制作燃料电池.
 甲醇是一种优质燃料,可制作燃料电池.
甲醇是一种优质燃料,可制作燃料电池.
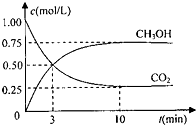
(1)为探究用 CO2 来生产燃料甲醇的反应原理,现进行如下实验:在体积为 1L 的密 闭容器中,充入 1molCO2 和 3molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O (g)△H=-49.0kJ/mol
测得 CO2 和 CH3OH(g)的浓度随时间变化如图.请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)=______
②下列措中能使平衡混合物中 n(CH3OH)/n(CO2) 增大的是
A.加入催化剂 B.充入 He(g),使体系压强增大
C.将 H2O(g)从体系中分离D.降低温度
(2)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为______极,正极反应的电极反应式为______
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H 1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则 1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=
+2△H3△H1−△H2 2 (用含△H 1、△H2、△H3 的式子表示)
+2△H3△H1−△H2 2  安静jj1年前1
安静jj1年前1 -
 ddxin 共回答了16个问题
ddxin 共回答了16个问题 |采纳率93.8%解题思路:(1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=[△c/△t]计算v(H2);
②使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(3)根据盖斯定律进行计算.(1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)⇌CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=[2.25mol/L/10min]=0.225mol/(L•mon),
故答案为:0.225mol/(L min);
②A.加入催化剂只改变化学反应速率不改变平衡移动,故A错误;
B.充入 He(g),使体系压强增大,反应物和生成物浓度不变,所以平衡不移动,故B错误;
C.将 H2O(g)从体系中分离,平衡向正反应分析移动,则n(CH3OH)/n(CO2)增大,故C正确;
D.D.降低温度向正反应分析移动,则n(CH3OH)/n(CO2)增大,故D正确;
故选C D;
(2)甲醇燃料电池中,燃料失电子发生氧化反应,所以通入甲醇的电极是负极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;
故答案为:负;O2+2H2O+4e-=4OH-;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H 1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H 3
由盖斯定律[①−②/2+2③得CH3OH(l)+O2(g)=CO(g)+2H2O(l),故△H=
△H1−△H2
2]+2△H3,
故答案为:
△H1−△H2
2+2△H3.点评:
本题考点: 化学电源新型电池;用盖斯定律进行有关反应热的计算;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查了化学平衡的计算、平衡移动方向的判断、盖斯定律、原电池原理等知识点,这些都是学习重点,难点是化学平衡移动方向的判断,易错选项是(1)②B,改变体系压强不一定使平衡移动,只有改变压强能使反应物或生成物浓度的,平衡才移动,为易错点.1年前查看全部
- 甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池。工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下。
甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池。工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下。
反应Ⅰ:CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g) △H1
CO(g)+3H 2 (g) △H1
反应Ⅱ:CO(g)+2H 2 (g) CH 3 OH(g) △H2
CH 3 OH(g) △H2
(1)如图是反应1进行过程中的能量变化示意图。根据图象判断,升高温度,反应I的平衡常数将____________ (填“增大”、“减小”或“不变”)。反应I的逆反应的活化能为___________(用含E1、E2的表达式表示)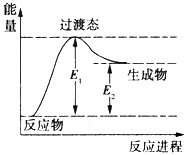
(2)已知在催化剂和一定压强下,反应?能自发进行。若保持容器容积不变,下列措施可增加该反应中CO转化率的是___________(填字母)。
A.适当降低温度
B.将甲醇从反应体系中分离出来
C.充入He,使体系总压强增大
D.按原比例再充入CO和H 2
(3)一种甲醇燃料电池以多孔石墨为电极,一极通入甲醇蒸气,另一极通入氧气,电解质溶液为4L 1 moI/L的KOH溶液。当有3 mol甲醇放电时,电解质溶液中各种离子的浓度由大到小的顺序为_________________
(4)下图甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路到达另一极与氧气反应,电池总反应为2CH 3 OH+3O 2 2CO 2 +4H 2 O。
2CO 2 +4H 2 O。
①M电极的电极反应式为______________________________。
②以上述电池做电源,用乙图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示):______________。Al电极应接燃料电池的___________(填“M”或“N”)极。 llc4444441年前1
llc4444441年前1 -
 1000712 共回答了29个问题
1000712 共回答了29个问题 |采纳率86.2%1年前查看全部
- 开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
 开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.2kJ•mol-1
CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)△H=+165.0kJ•mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是______.
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0
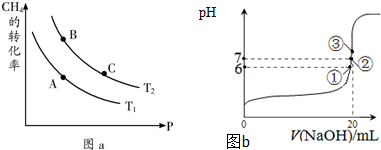
①一定条件下CH4的平衡转化率与温度、压强的关系如图a.则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为______.(填“<”、“>”、“=”);
②100℃时,将1mol CH4和2mol H2O通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是______.
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4同时生成0.3molH2
c.容器的压强恒定
d.3v正(CH4)=v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图b所示,下列说法正确的是______.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,该反应的化学方程式为______. eiowenig1年前1
eiowenig1年前1 -
 美yy大uu卡特 共回答了23个问题
美yy大uu卡特 共回答了23个问题 |采纳率91.3%解题思路:(1)根据盖斯定律书写目标热化学方程式;
(2)①平衡常数只受温度影响,处于等温线上各点平衡常数相等,由图可知,压强一定时,温度T2条件下,甲烷的转化率更大,则反应进行的程度更大;
②达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生其它一些物理量不变,据此结合选项判断;
(3)A.酸或碱抑制水电离,含有弱根离子的盐促进水电离;
B.根据电荷守恒计算;
C.根据电荷守恒计算;
D.等物质的量的氢氟酸和氢氧化钠恰好反应生成氟化钠,溶液呈碱性,根据电荷守恒判断,注意等体积混合时,不水解离子浓度变为原来的一半;
(4)电负性F>O,故H-O-F中F元素表现-1价,与水反应生成HF,发生水解反应,可推知A为H-O-O-H.(1)已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)△H=+165.0kJ•mol-1
根据盖斯定律,②-①得:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2 kJ•mol-1,
故答案为:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2 kJ•mol-1;
(2)①平衡常数只受温度影响,B、C处于等温线上,平衡常数相等,由图可知,压强一定时,温度T2条件下,甲烷的转化率更大,则反应进行的程度更大,比温度T1时的平衡常数大,故平衡常数KC=KB>KA,
故答案为:KC=KB>KA;
②a.100℃时,反应混合物都是气体,混合气体总质量不变,容器的容积不变,容器内气体密度始终不变,不能说明得到平衡,故a错误;
b.单位时间内消耗0.1mol CH4同时生成0.3molH2,反应始终按此比例进行,不能说明到达平衡,故b错误;
c.随反应进行混合气体总物质的量增大,容器容积不变,压强增大,当容器的压强恒定时,说明到达平衡,故c正确;
d.3v正(CH4)=v逆(H2),不能物质的正逆速率之比等于化学计量数之比,反应到达平衡,故d正确,
故答案为:cd;
(3)A.氢氟酸抑制水电离,氟化钠促进水电离,所以pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的不相等,故错误;
B.①点时pH=6,溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,故正确;
C.②点时,溶液呈中性,c(OH-)=c(H+),溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)=c(Na+),故正确;
D.③点时V=20mL,此时溶液中溶质在氟化钠,溶液呈碱性,根据电荷守恒知c(F-)<c(Na+),但等体积混合时不水解的离子浓度变为原来的一半,所以c(F-)<c(Na+)=0.05mol/L,故错误;
故选BC;
(4)电负性F>O,故H-O-F中F元素表现-1价,与水反应生成HF,发生水解反应,可推知A为H-O-O-H,该反应的化学方程式为:H2O+HFO=HF+H2O2,
故答案为:H2O+HFO=HF+H2O2.点评:
本题考点: 转化率随温度、压强的变化曲线;热化学方程式;化学平衡状态的判断.
考点点评: 本题比较综合,涉及热化学方程式、化学平衡图象及影响因素、平衡常数、平衡状态判断、弱电解质的电离、离子浓度比较等,(3)中注意溶液中离子浓度等量关系,经常考虑电荷守恒、物料守恒、质子恒等式等.1年前查看全部
- 二甲醚是一种绿色、可再生的新能源。如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,
二甲醚是一种绿色、可再生的新能源。如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法不正确的是

A.a电极为该电池负极 B.O 2 在b电极上得电子,被氧化 C.电池工作时,a电极反应式:
CH 3 OCH 3 —12e - +3H 2 O→2CO 2 ↑+12H +D.电池工作时,燃料电池内部H + 从a电极移向b电极  西域刀客0小宝1年前1
西域刀客0小宝1年前1 -
 zxd_psj 共回答了24个问题
zxd_psj 共回答了24个问题 |采纳率83.3%B
1年前查看全部
- (2013•南开区一模)查处酒后驾驶采用的“便携式乙醇检测仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧
(2013•南开区一模)查处酒后驾驶采用的“便携式乙醇检测仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X.其中一个电极上的反应为:CH3CH2OH-4e-+H2O═X+4H+.下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.另一电极上发生的反应为:O2+4e-+2H2O═4OH-
C.乙醇在正极发生反应,电子通过外电路流向负极
D.电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O 朋友之家1年前1
朋友之家1年前1 -
 雨夜无语 共回答了23个问题
雨夜无语 共回答了23个问题 |采纳率95.7%解题思路:乙醇酸性燃料电池中,乙醇被氧化,应为电池负极,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O,电池总反应应为2CH3CH2OH+O2→2CH3CHO+2H2O,原电池工作时,电子由负极经外电路流向正极.A.原电池工作时,阳离子向正极移动,故A错误;
B.电解质溶液呈酸性,正极反应式为O2+4e-+4H+=2H2O,故B错误;
C.原电池工作时,电子由负极经外电路流向正极,故C错误;
D.电池总反应为2CH3CH2OH+O2→2CH3CHO+2H2O,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题以化学电源新型电池为载体考查了原电池原理,难度不大,易错选项是B,写电极反应式时要注意结合溶液的酸碱性;在酸性溶液,生成物中不能有氢氧根离子生成;在碱性溶液中,生成物中不能有氢离子生成.1年前查看全部
- 目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金
 目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金属陶瓷”,作为负极.在750℃实验温度下,空气中的氧分子吸附于黑色正极,氧原子会分别从涂层中“抢走”2个电子,变成氧离子,随后氧离子穿过陶瓷膜,与负极那一边的燃气反应,并释放出能量,氧不断“劫持”电子穿越薄膜,正负两极间便形成电压,产生电流.
目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金属陶瓷”,作为负极.在750℃实验温度下,空气中的氧分子吸附于黑色正极,氧原子会分别从涂层中“抢走”2个电子,变成氧离子,随后氧离子穿过陶瓷膜,与负极那一边的燃气反应,并释放出能量,氧不断“劫持”电子穿越薄膜,正负两极间便形成电压,产生电流.
(1)水煤气成分是______.水煤气又称为合成气,在一定条件下可以合成二甲醚时,还产生一种可以参与大气循环的无机化合物,写出该化学方程式可能是2CO+4H2
CH3OCH3+H2O一定条件 .2CO+4H2.
CH3OCH3+H2O一定条件 .
(2)若以水煤气为上述陶瓷电池的燃料气,则电池的负极反应方程式为______.(写出一个即可)
(3)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.
根据该图写出二甲醚燃烧的热化学方程式:______. summerice8301年前1
summerice8301年前1 -
 inzaghi9 共回答了20个问题
inzaghi9 共回答了20个问题 |采纳率95%解题思路:(1)C与水蒸气在高温条件下生成水煤气;根据反应物和生成物写方程式;
(2)CO和H2都具有还原性,为燃料电池的负极,被氧化失去电子生成CO2和H2O,结合电解质书写电极反应式;
(3)根据生成1mol水放出的热量计算反应热.(1)C与水蒸气在高温条件下生成水煤气,水煤气的成分为CO、H2;CO和H2在一定的条件下生成二甲醚和水,化学方程式是2CO+4H2
一定条件
.
CH3OCH3+H2O;
故答案为:CO、H2;2CO+4H2
一定条件
.
CH3OCH3+H2O;
(2)CO和H2都具有还原性,为燃料电池的负极,被氧化失去电子生成CO2和H2O,电极反应为CO+O2--2e-=CO2,或H2+O2--2e-=2H2O,
故答案为:CO+O2--2e-=CO2或H2+O2--2e-=2H2O;
(3)由图象可知生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,
所以热化学方程式为CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455kJ•mol-1,
故答案为:CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455kJ•mol-1.点评:
本题考点: 反应热和焓变;化学电源新型电池.
考点点评: 本题考查了方程式的书写、电极方程式的书写、反应热的计算及热化学方程式的书写,题目难度中等,注意把握燃料电池中电极方程式的书写方法.1年前查看全部
- 燃料电池是一种将化学反应产生的能量直接转换成电能的装置.下列燃料电池最适合在宇宙飞船上使用的是( )
燃料电池是一种将化学反应产生的能量直接转换成电能的装置.下列燃料电池最适合在宇宙飞船上使用的是( )
A. CH4-O2,燃料电池
B. C2H5OH-O2燃料电池
C. H2-O2燃料电池
D. CO-O2燃料电池 huxiao82811年前1
huxiao82811年前1 -
 十四是十四 共回答了19个问题
十四是十四 共回答了19个问题 |采纳率89.5%解题思路:此题涉及了不同物质燃烧产生的效果不同的一道比较题型,从环保、安全等角度进行考虑,解答时可以常用逐一比较排除的方法进行筛选即可.选项ABD尽管燃烧的产物有二氧化碳或者水,但是它们均有不足之处,即燃烧产物二氧化碳会加重环境中的二氧化碳的含量,加重温室效应.其次,燃烧放出的能量不同.而选项C,H2-O2燃料不仅产物是水,无污染.而且氢气的燃烧会放出大量的热,产生巨大的能量.
故选C点评:
本题考点: 资源综合利用和新能源开发.
考点点评: 解答此题时,应注意比较方法的利用,常用排除法进行筛选即可得出答案.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)写出CO燃烧的热化学方程式______;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
①温度升高该反应的平衡常数______(增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是3nB 2tB mol•L-1•min-13nB 2tB
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,负极的反应式为______. mwemei1年前1
mwemei1年前1 -
 津女 共回答了16个问题
津女 共回答了16个问题 |采纳率100%解题思路:(1)依据热化学方程式书写方法和注意问题标注物质聚集状态和对应焓变;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)①依据先拐先平的判断方法可知T1<T2,温度变化判断平衡移动的分析分析平衡常数变化;
②依据图象分析甲醇的平衡物质的量和时间,结合化学方程式计算消耗氢气的物质的量,结合反应速率概念计算得到;
(4)甲醇燃料电池,燃料在负极失电子发生氧化反应.(1)由CO(g)的燃烧热△H分别为-283.0kJ•mol-1,则一氧化碳燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)①图象分析先拐先平,温度高,T1<T2,温度越高甲醇物质的量越小,说明平衡逆向进行,平衡常数减小,故答案为:减小;
②B过程依据图象分析,在tB达到平衡时生成甲醇nBmol,依据化学方程式CO2+3H2=CH3OH+H2O,消耗氢气物质的量为3nBmol,用H2表示该反应的化学反应速率=
3nBmol
2L
tBmin=
3nB
2tBmol/L•min,故答案为:
3nB
2tB;
(4)直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,甲醇燃料电池,燃料在负极失电子发生氧化反应,负极的反应式为:
CH3OH-6e-+8OH-═CO32-+6H2O,故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式的书写和盖斯定律的应用,化学平衡的影响因素分析判断,图象分析应用能力,原电池电极反应书写方法,题目难度中等.1年前查看全部
- 燃料电池是怎样反应起来的我学过燃料电池的反应原理,我想问的是它是怎么反应起来的?说是氢气在负极失电子氧气在正极得电子的,
燃料电池是怎样反应起来的
我学过燃料电池的反应原理,我想问的是它是怎么反应起来的?说是氢气在负极失电子氧气在正极得电子的,它怎会失电子又怎么会得电子?一般情况下把氢气跟氧气通入碱液也没见它们能反应啊… 南京1912酒吧1年前2
南京1912酒吧1年前2 -
 zjgzzh 共回答了26个问题
zjgzzh 共回答了26个问题 |采纳率84.6%经由催化剂的作用,使得阳极的氢原子分解成两个氢质子(proton)与两个电子(electron),其中质子被氧『吸引』到薄膜的另一边,电子则经由外电路形成电流后,到达阴极.在阴极催化剂之作用下,氢质子、氧及电子,发生反应形成水分子1年前查看全部
- 如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH) 2 的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH) 2 ,使用硫酸钠做电解质溶液,阳极选用 作电极。
 过眼vs云烟1年前1
过眼vs云烟1年前1 -
 ttqqTT 共回答了16个问题
ttqqTT 共回答了16个问题 |采纳率93.8%(1)CH 4 -8e - +10OH - =CO 3 2 - +7H 2 O
(2)2Cl - -2e - =Cl 2 ↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
1年前查看全部
- (2014•番禺区一模)查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧
(2014•番禺区一模)查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+.下列说法中正确的是( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2+4e-+2H2O=4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O 哀思你1年前1
哀思你1年前1 -
 就要来了 共回答了10个问题
就要来了 共回答了10个问题 |采纳率90%解题思路:乙醇酸性燃料电池中,乙醇被氧化,应为电池负极,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O,由CH3CH2OH-2e-→X+2H+可知,X应为CH3CHO,应为2CH3CH2OH+O2→2CH3CHO+2H2O,原电池工作时,电子由负极经外电路流向正极.A.原电池工作时,阳离子向正极移动,故A错误;
B.电解质溶液呈酸性,正极反应式为O2+4e-+4H+=2H2O,故B错误;
C.原电池工作时,电子由负极经外电路流向正极,故C错误;
D.由CH3CH2OH-2e-→X+2H+可知,X应为CH3CHO,则电池总反应为2CH3CH2OH+O2→2CH3CHO+2H2O,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题以化学电源新型电池为载体考查了原电池原理,难度不大,易错选项是B,写电极反应式时要注意结合溶液的酸碱性;在酸性溶液,生成物中不能有氢氧根离子生成;在碱性溶液中,生成物中不能有氢离子生成.1年前查看全部
- 燃料电池上,若用C2H4来做燃料,负极反应式是什么
燃料电池上,若用C2H4来做燃料,负极反应式是什么
能知道正极反应式吗 庄梦鱼1年前4
庄梦鱼1年前4 -
 秋意已浓YOYO 共回答了20个问题
秋意已浓YOYO 共回答了20个问题 |采纳率100%打错了 O2+2H2O+4e- =4OH- 是正极的反应 负极的是C2H4+3O2-4e-=2CO2+2H2O1年前查看全部
- 弱问一道关于燃料电池的问题这种有机物燃料的原电池反应要怎么写……
弱问一道关于燃料电池的问题

这种有机物燃料的原电池反应要怎么写…… 眼睛里的湖1年前2
眼睛里的湖1年前2 -
 lihengshan 共回答了15个问题
lihengshan 共回答了15个问题 |采纳率93.3%CH3OH~CO2,反应物少O酸性条件下加水,配平电荷得到CH3OH+H2O-6e-=CO2+6H+,另一边就简单了1年前查看全部
- 2H2+O2==2H2O这个燃料电池俗名是不是阿波罗电池.如果不是那么是什么?
 xx521_nn1年前1
xx521_nn1年前1 -
 漂亮又可爱 共回答了14个问题
漂亮又可爱 共回答了14个问题 |采纳率78.6%氢氧燃料电池1年前查看全部
- 氢气和氧气在催化剂作用下反应做燃料电池的化学方程式?
 云舞飞扬11年前2
云舞飞扬11年前2 -
 chouch 共回答了19个问题
chouch 共回答了19个问题 |采纳率89.5%负极:2H2-4e-=4H+
正极:O2+2H2O+4e-=4OH-
总反应:2H2+O2=2H2O1年前查看全部
大家在问
- 1因式分解ax^2+2ax+a 已知m-n=2,m+n=5,求m^2-n^2的值
- 2甲烷燃料电池碱性有产物二氧化碳么
- 3氢氧燃料电池酸性条件下负极为什么生成co2,而不是碳酸氢根?不是有有大量的氢离子吗?
- 4冲装灭火器英语怎么说
- 5取一副三角板,怎么拼出75度的角
- 6SiO2和盐酸反应方程式那么sio2会跟水反应吗》那么sio2会跟水反应吗》那么sio2会跟水反应吗》那么sio2会跟水
- 7SiO2能与盐酸反应吗?为什么SiO2能与HF反应?
- 8从5个互不相等的自然数中任意取2个、3个、4个分别相加,所得的和都成为部分和.为方便起见,将这5个自然数本身也成为部分好
- 9计算2的2006次方的简便方法
- 10(-1/4)的2006次方*4的2006次方,用简便方法计算
- 11川与它加偏旁组词有那些?多点!
- 12大林寺桃花的特点这首诗有什么特点,反映出了什么
- 13给川加一个偏旁并组词!快 急
- 14圆的周长和直径成比例吗?
- 15英语三级作文格式书信等

