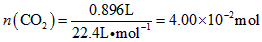碱式碳酸镁300度即分解为3种无毒的氧化物,该反应的化学方程式为?
 金小卜2022-10-04 11:39:542条回答
金小卜2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 zsjlwl 共回答了10个问题
zsjlwl 共回答了10个问题 |采纳率100%- 碱式碳酸镁(Mg2(OH)2CO3)加热完全分解后的产物有:氧化镁,二氧化碳和水.
碱式碳酸镁分解方程式:Mg2(OH)2CO3 ==△== 2MgO + CO2↑ + H2O
和碱式碳酸铜相似.碱式碳酸盐分解都生成金属氧化物、二氧化碳和水. - 1年前
 conniennix 共回答了31个问题
conniennix 共回答了31个问题 |采纳率- 4MgCO3·Mg(OH)2·5H2O->5MgO+4CO2+6H2O
- 1年前
相关推荐
- 将一长期露置于空气中部分被氧化成Mg2(OH)2CO3 (碱式碳酸镁)的镁带磨成粉末后,在空气中充分灼烧.测得灼烧前后粉
将一长期露置于空气中部分被氧化成Mg2(OH)2CO3 (碱式碳酸镁)的镁带磨成粉末后,在空气中充分灼烧.测得灼烧前后粉末质量不变,则灼烧前粉末中镁的质量分数为多少?
 带我回家01281年前1
带我回家01281年前1 -
 liu**wfcl 共回答了26个问题
liu**wfcl 共回答了26个问题 |采纳率88.5%2Mg + O2 ==== 2MgO
Mg2(OH)2CO3 ==== 2MgO + H2O + CO2
设Mg的物质的量为x,Mg2(OH)2CO3的物质的量为y
24x+142y=40x+80y
x/y=31/8
即Mg和Mg2(OH)2CO3物质的量之比为31/8,
则镁的质量分数=31*24/(31*24+8*142)=39.57%1年前查看全部
- 为了探究碱式碳酸镁[mMgCO 3 ·nMg(OH) 2 ·xH 2 O]的组成,某化学小组仅利用下列仪器组装一套完整装
为了探究碱式碳酸镁[mMgCO 3 ·nMg(OH) 2 ·xH 2 O]的组成,某化学小组仅利用下列仪器组装一套完整装置进行实验(夹持仪器省略)。 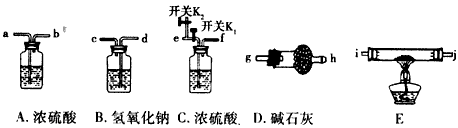
回答下列问题:
(1)实验时应向装置中通入空气,若空气流从左向右,装置连接顺序为(装置不重复使用,填入仪器接口字母编号):空气→( )( )→( )( )→( )( )→( )( )→(g)。
(2)连接好装置,检查装置气密性,装好药品后,加热前应进行的操作是________________。
(3)仪器B的作用是_________________,仪器A的作用是_________________。
(4)有同学认为(1)中的整套实验装置有缺陷,其不妥之处为___________;改进方案是___________。
(5)将装置改进后进行实验,称取一定量的碱式碳酸镁样品,充分反应后得到1.6g残留物,生成1.32g二氧化碳和0. 72 g水。则此碱式碳酸镁的化学式为___________。 言若风1年前1
言若风1年前1 -
 xxbtx1437 共回答了21个问题
xxbtx1437 共回答了21个问题 |采纳率95.2%(1)d、c、a、b、i、j(或j、i)、e、f
(2)关闭K1,打开K2,通入足量空气后,再打开K1关闭K2
(3)吸收空气中的二氧化碳;除去空气中的水蒸气
(4)D吸收空气中的水蒸气与二氧化碳气体;D后再接一个装有碱石灰的干燥管
(5)3MgCO 3 ·Mg(OH) 2 ·3H 2 O1年前查看全部
- 某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mg x
某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mg x (OH) y (CO 3 ) z (x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳] 
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是_____________;A处干燥管盛放的药品是_____________,其作用是____________________________。
(2)指导老师在审阅设计方案后指出需要在E处进行改进,请你帮助该小组设计出改进方案:____________________________________。
(3)加热前需要进行的必要操作是__________________________________,其目的是____________________________________;对活塞的操作方法是:关闭活塞_________________,打开活塞_______________________。
(4)通过什么现象能够说明碱式碳酸镁分解完全____________________________。
(5)待B装置中的反应完全后,打开K 1 ,再缓缓鼓入空气数分钟,其目的是________________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式___________________________,该碱式碳酸镁受热分解的化学方程式为______________________________。 wfq3201年前1
wfq3201年前1 -
 halleyhuo 共回答了19个问题
halleyhuo 共回答了19个问题 |采纳率89.5%1年前查看全部
- 碱式碳酸镁化学式是什么
 沙漠砾石1年前3
沙漠砾石1年前3 -
 yingtaoxiaowanzi 共回答了22个问题
yingtaoxiaowanzi 共回答了22个问题 |采纳率77.3%碱式碳酸镁的组成一般以xMgCO3·yMg(OH)2·zH2O表示.其中x、y、z的比例有几种,可以为4∶1∶4,4∶1∶5,4∶1∶6,4∶1∶7,3∶1∶3,3∶1∶4.碱式碳酸镁遇稀酸即分解放出二氧化碳.加热至300℃以上分解.1年前查看全部
- 碱式碳酸镁的化学式是?是 Mg2(OH)2CO3 还是 Mg(OH)2·MgCO3 还是 Mg5(OH)2(CO3)4?
碱式碳酸镁的化学式是?
是 Mg2(OH)2CO3 还是 Mg(OH)2·MgCO3 还是 Mg5(OH)2(CO3)4?
这几种写法有什么区别呢? 枫林伴晚1年前6
枫林伴晚1年前6 -
 jftwff 共回答了16个问题
jftwff 共回答了16个问题 |采纳率100%其实都是可以的.
区别如下:
Mg2(OH)2CO3是以复盐形式表示的,是以离子水平表示的化学组成
Mg(OH)2·MgCO3是将其拆分为一种碱和一种盐的化合物,主要用于表示其分子水平的化学组成
Mg5(OH)2(CO3)4也是复盐形式表示,但其组成和上述两种碱式碳酸镁不同,分子中碳酸根的含量更高.
一般情况下Mg2(OH)2CO3和Mg(OH)2·MgCO3用的最多,在题目中也更常见.这两者是同一种物质的不同表示方法.1年前查看全部
- 谁会这道题:为了探究碱式碳酸镁[m
谁会这道题:为了探究碱式碳酸镁[m
为了探究碱式碳酸镁[mMgCO 3 ·nMg(OH) 2 ·xH 2 O]的组成,某化学小组仅利用下列仪器组装一套完整装置进行实验(夹持仪器省略). 
回答下列问题:
(1)实验时应向装置中通入空气,若空气流从左向右,装置连接顺序为(装置不重复使用,填入仪器接口字母编号):空气→( )( )→( )( )→( )( )→( )( )→(g).
(2)连接好装置,检查装置气密性,装好药品后,加热前应进行的操作是________________.
(3)仪器B的作用是_________________,仪器A的作用是_________________.
(4)有同学认为(1)中的整套实验装置有缺陷,其不妥之处为___________;改进方案是___________.
(5)将装置改进后进行实验,称取一定量的碱式碳酸镁样品,充分反应后得到1.6g残留物,生成1.32g二氧化碳和0.72 g水.则此碱式碳酸镁的化学式为___________. 彼岸的春天1年前1
彼岸的春天1年前1 -
 花样朵朵 共回答了28个问题
花样朵朵 共回答了28个问题 |采纳率96.4%(1)d、c、a、b、i、j(或j、i)、e、f
(2)关闭K1,打开K2,通入足量空气后,再打开K1关闭K2
(3)吸收空气中的二氧化碳;除去空气中的水蒸气
(4)D吸收空气中的水蒸气与二氧化碳气体;D后再接一个装有碱石灰的干燥管
(5)3MgCO 3 ·Mg(OH) 2 ·3H 2 O1年前查看全部
- 碱式碳酸镁是纯净物吗?或是氢氧化镁与碳酸镁的混合物?
 欣赏巴乔1年前4
欣赏巴乔1年前4 -
 crasyboy 共回答了22个问题
crasyboy 共回答了22个问题 |采纳率90.9%是纯净物
比如:Fe3O4=Fe2O3 FeO,都是一样的道理
因为他们有固定的组成了
两种物质组合一种新物质,判断是否是纯净物的标准:这两种物质的组成比例是否固定1年前查看全部
- (2011•晋中三模)某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已
(2011•晋中三模)某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]

(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是______;A处干燥管盛放的药品是______,其作用是______.
(2)指导老师在审阅设计方案后指出需要在E处进行改进,请你帮助该小组设计出改进方案:______.
(3)加热前需要进行的必要操作是______,其目的是______;对活塞的操作方法是:打开活塞______,关闭活塞______.
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于______.
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是______.
(6)实验测得数据如下:碱式碳酸镁样品22.6g;反应前C装置的质量为87.6g,反应后质量为89.4g;反应前D装置的质量为74.7g,反应后质量为83.5g.请计算推导该碱式碳酸镁的化学式______,该碱式碳酸镁受热分解的化学方程式为Mg3(OH)2(CO3)2
3MgO+2CO2↑+H2O△ .Mg3(OH)2(CO3)2.
3MgO+2CO2↑+H2O△ . hn7vv4241年前1
hn7vv4241年前1 -
 154088773 共回答了16个问题
154088773 共回答了16个问题 |采纳率93.8%解题思路:(1)由实验原理可知,实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,故应首先检验装置的气密性.
装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差,故A装置应吸收空气中的水蒸气和二氧化碳.
(2)D装置中盛放的碱石灰容易吸收空气中的水蒸气和二氧化碳,应在D装置之后添加一个盛有碱石灰(或氧化钙)的干燥管,防止空气中的水蒸气和二氧化碳进入D装置中,影响测量结果.
(3)装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,故实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差.活塞的操作方法是:打开活塞K1、K2,关闭活塞K3.
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,说明碱式碳酸镁分解完全,B装置内反应结束.
(5)B装置中的反应完全后,装置中的残留少量水蒸气和二氧化碳,为减少误差,应全部赶到装置C和D中.
(6)碱式碳酸镁样品22.6g,反应前C装置的质量为87.6g,反应后质量为89.4g,故生成水的质量为89.4g-87.6g=1.8g;反应前D装置的质量为74.7g,反应后质量为83.5g,生成二氧化碳的质量为83.5g-74.7g=8.8g,故氧化镁的质量为22.6g-1.8g-8.8g=12g,计算各物质的物质的量,利用元素守恒计算碱式碳酸镁中x、y、z,据此书写碱式碳酸镁化学式.
该碱式碳酸镁加热能分解生成氧化镁、水和二氧化碳的物质的量之比为3:1:2.(1)由实验原理可知,实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,故应首先检验装置的气密性.
装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差,故A装置应吸收空气中的水蒸气和二氧化碳,A装置内可以选用碱石灰(或氧化钙).
故答案为:检验装置的气密性;碱石灰(或氧化钙).
(2)D装置中盛放的碱石灰容易吸收空气中的水蒸气和二氧化碳,应在D装置之后添加一个盛有碱石灰(或氧化钙)的干燥管,防止空气中的水蒸气和二氧化碳进入D装置中,影响测量结果.
故答案为:添加一个盛有碱石灰(或氧化钙)的干燥管.
(3)装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,故实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差.
活塞的操作方法是:打开活塞K1、K2,关闭活塞K3.
故答案为:鼓入空气;赶走装置中含有水蒸气和二氧化碳;K1、K2,K3.
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,说明碱式碳酸镁分解完全,B装置内反应结束.
故答案为:B装置中的反应已完全.
(5)B装置中的反应完全后,装置中的残留少量水蒸气和二氧化碳,为减少误差,应全部赶到装置C和D中.
故答案为:将反应生成的残留在装置中的水蒸气和二氧化碳全部赶到装置C和D中.
(6)碱式碳酸镁样品22.6g,反应前C装置的质量为87.6g,反应后质量为89.4g,故生成水的质量为89.4g-87.6g=1.8g,物质的量为[1.8g/18g/mol]=0.1mol;反应前D装置的质量为74.7g,反应后质量为83.5g,生成二氧化碳的质量为83.5g-74.7g=8.8g,物质的量为[8.8g/44g/mol]=0.2mol,故氧化镁的质量为22.6g-1.8g-8.8g=12g,物质的量为[12g/40g/mol]=0.3mol,根据Mg、H、C元素守恒可知,x:y:z=0.3mol:0.1mol×2:0.2mol=3:2:2,故碱式碳酸镁的化学式为Mg3(OH)2(CO3)2;该碱式碳酸镁受热分解的化学方程式为Mg3(OH)2(CO3)2
△
.
3MgO+2CO2↑+H2O.
故答案为:Mg3(OH)2(CO3)2;Mg3(OH)2(CO3)2
△
.
3MgO+2CO2↑+H2O.点评:
本题考点: 探究物质的组成或测量物质的含量;镁、铝的重要化合物.
考点点评: 考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.1年前查看全部
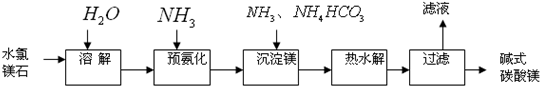
- 镁及其化合物在生产生活中有重要的作用.以水氯镁石(主要成分为MgCl 2 •6H 2 O)为原料生产碱式碳酸镁的主要流程
镁及其化合物在生产生活中有重要的作用.以水氯镁石(主要成分为MgCl 2 •6H 2 O)为原料生产碱式碳酸镁的主要流程如下: 
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为______.指出该物质在工农业生产中的一种用途:______.
(2)写出预氨化时发生的主要反应的离子方程式:______.
(3)沉淀镁时反应的温度不宜过高,原因是______.
(4)设计一个实验,确定产品碱式碳酸镁aMgCO 3 •bMg(OH) 2 •cH 2 O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③______;④______;⑤称量MgO.18.2g产品完全分解后,产生6.6g CO 2 和8.0g MgO,由此可知,产品的化学式中:a=______;b=______;c=______.
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁.有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则.你同意该同学的想法吗?为什么?你的观点是______.理由是______. 11tea0011年前1
11tea0011年前1 -
 50836763 共回答了16个问题
50836763 共回答了16个问题 |采纳率75%(1)在氯化镁中加入氨水和碳酸氢铵后,生成碱式碳酸镁,根据质量守恒可知溶液中存在氯化铵,可用于氮肥,
故答案为:NH 4 Cl;做氮肥(或其他合理答案);
(2)氨水呈碱性,氯化镁溶液中加入氨水生成氢氧化镁沉淀,反应的离子的方程式为Mg 2+ +2NH 3 •H 2 O=Mg(OH) 2 ↓+2NH 4 + ,
故答案为:Mg 2+ +2NH 3 •H 2 O=Mg(OH) 2 ↓+2NH 4 + ;
(3)碳酸氢铵不稳定,加热易分解,所以沉淀镁时反应的温度不宜过高,故答案为:防止碳酸氢铵分解;
(4)测定一定质量碱式碳酸镁分解生成生成的CO 2 、水蒸气和MgO的质量,求出物质的量之比即可确定其化学式.
18.2g碱式碳酸镁分解的产物中,n(MgO)=
8.0g
40g/mol =0.2mol,n(CO 2 )=
6.6g
44g/mol =0.15mol,
n(H 2 O)=
18.2g-8.0g-6.6g
18g/mol =0.2mol.所以,n(MgO):n(CO 2 ):n(H 2 O)=0.2:0.15:0.2=4:3:4,碱式碳酸镁用氧化物表示的化学式为4MgO•3CO 2 •4H 2 O,
即3MgCO 3 •Mg(OH) 2 •3H 2 O,
故答案为:测出CO 2 的质量;④测出水蒸气的质量;3;1;3;
(5)MgO熔点很高,难以溶化,熔融时耗费大量的能量而增加生产成本,工业常用电解熔融的氯化镁的方法冶炼镁,
故答案为:不同意,因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本.1年前查看全部
- 碱式碳酸镁是什么颜色的?都有那几种颜色
 lovejy3181年前2
lovejy3181年前2 -
 guanbingjun 共回答了20个问题
guanbingjun 共回答了20个问题 |采纳率85%碱式碳酸镁
[性 能]:轻质碳酸为白色易碎块状或松散白色粉末.无臭,相对密度2.2.熔点350℃.在空气中稳定,加热至700℃发生二氧化碳.几乎不溶于水,但在水中引起轻微的碱性反应,不溶于乙醇,可被稀酸溶解并发泡
[分子式]:Mg2(OH)2CO3,Mg4(OH)2(CO3)3等形式
[分子量]:365.311年前查看全部
- 问一道化学题!有疑惑高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
问一道化学题!有疑惑
高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO 2 0.896L,通过计算确定碱式碳酸镁的化学式.
解答过程如图:

图中的计算对吗?氢氧根的物质的量为什么是0.01mol?不要乘以氢氧根的下标2么?
 天书奇梦1年前3
天书奇梦1年前3 -
 雪霁寒霄 共回答了15个问题
雪霁寒霄 共回答了15个问题 |采纳率66.7%解答中的0.01mol氢氧根指的是提供生成产物水的氢氧根,你应该发现题目里所有的数字都是成比例的,CO3提供0.04mol O给Mg生成MgO,还有1mol O来自(OH),因此加起来生成0.05mol MgO,所以提供生成产物水的(OH)就剩下0.01mol,加上0.04mol结晶水就总共生成0.05mol水.
其实如果你能明白为什么会有第三行就应该能明白第六行吧.1年前查看全部
- (2010•江苏)以水氯镁石(主要成分为MgCl2•6H2O)为原料生产碱式碳酸镁的主要流程如下:
(2010•江苏)以水氯镁石(主要成分为MgCl2•6H2O)为原料生产碱式碳酸镁的主要流程如下:
(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6mol•L-1,则溶液中c(Mg2+)=______.
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为______.
(3)高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式.
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数______(填“升高”、“降低”或“不变”). 上帝无言1年前1
上帝无言1年前1 -
 我没有错 共回答了15个问题
我没有错 共回答了15个问题 |采纳率86.7%解题思路:(1)根据溶度积表达式Ksp=[Mg2+][OH-]2进行计算;
(2)根据流程判断所得滤液的成分中含有的离子,确定滤液中的物质来回答;
(3)根据碳酸镁的分子式,可以写成氧化物的表示形式,即2MgO•H2O•CO2,然后根据题意确定各个氧化物的量,进而确定分子式.
(4)根据同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大来回答.(1)根据溶度积表达式Ksp=[Mg2+][OH-]2得[Mg2+]=
1.8×10−11
9.0×10−12=2.0 mol•L-1,故答案为:2.0 mol•L-1
(2)根据流程判断所得滤液的成分中含有的离子有氯离子和铵根离子,故所得的滤液中含NH4Cl,故答案为:NH4Cl;
(3)碳酸镁的分子式,可以写成氧化物的表示形式,即2MgO•H2O•CO2;各个氧化物的量分别为:n(CO2)=
0.896L
22.4L•mol−1=4.00×10−2moln(MgO)=
2.00g
40g•mol−1=5.00×10−2moln(H2O)=
4.66g−4.00×10−2mol×44g•mol−1−2.00g
18g•mol−1=5.00×10−2mol
故:n(MgO):n(CO2):n(H2O)=5.00×10-2:4.00×10-2:5.00×10-2=5:4:5,故碱式碳酸镁的化学式为:Mg(OH)2•4MgCO3•4H2O;
(4)同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大,即产品中镁的质量就大,故答案为:升高.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;难溶电解质的溶解平衡及沉淀转化的本质;复杂化学式的确定;物质的分离、提纯和除杂.
考点点评: 本题是一道工业生产题,考查了沉淀溶解平衡的知识以及元素守恒思想的应用,是一道综合型题目.1年前查看全部
- 碱式碳酸镁的化学式为a Mg(OH)2•b MgCO3•c H2O.取4.66g碱式碳酸镁
碱式碳酸镁的化学式为a Mg(OH)2•b MgCO3•c H2O.取4.66g碱式碳酸镁,高温煅烧至恒重,得到固体2.00g和标准状况下0.896L CO2.该碱式碳酸镁b:c的值为( )
A.1:1
B.5:4
C.4:5
D.1:4 蒿子1年前1
蒿子1年前1 -
 云上飞客 共回答了15个问题
云上飞客 共回答了15个问题 |采纳率86.7%解题思路:碱式碳酸镁的化学式为a Mg(OH)2•b MgCO3•c H2O,高温煅烧得到氧化镁、二氧化碳和水,根据题中数据计算出氧化镁、二氧化碳的物质的量,然后根据碳原子守恒计算出碳酸镁的物质的量、质量,再根据镁原子守恒计算出氢氧化镁的物质的量,最后根据质量守恒计算出样品中含有水的物质的量及b:c的值.碱式碳酸镁高温煅烧得到物质为MgO、水和二氧化碳,所以2.00g为氧化镁的质量,n(MgO)=[2.00g/40g/mol]=0.05mol,
生成的二氧化碳的物质的量为:n(CO2)=[0.896mol/L/22.4L/mol]=0.04mol,
根据碳原子守恒可知,4.66g碱式碳酸镁中含有碳酸镁的物质的量为:n(MgCO3)=0.04mol,碳酸镁的质量为:84g/mol×0.04mol=3.36g;
0.04mol碳酸镁中含有0.04mol镁离子,再根据镁离子守恒可知,氢氧化镁中镁离子的物质的量为:0.05mol-0.04mol=0.01mol,
氢氧化镁的质量为:58g/mol×0.01mol=0.58g,
4.66g碱式碳酸镁中含有水的物质的量为:n(H2O)=0.04mol,
所以该碱式碳酸镁b:c=n(MgCO3):n(H2O)=0.04mol:0.04mol=1:1,
故选A.点评:
本题考点: 复杂化学式的确定.
考点点评: 本题考查了复杂化学式的计算,题目难度中等,注意掌握根据质量守恒确定复杂化学式的方法,根据题干信息正确分析碱式碳酸镁的分解产物为解答本题的关键.1年前查看全部
- 用下列装置测定碱式碳酸镁的化学组成,计算xMgCO3•yMg(OH)2•zH2O中x:y:z的最简比.(假设每步反应、吸
用下列装置测定碱式碳酸镁的化学组成,计算xMgCO3•yMg(OH)2•zH2O中x:y:z的最简比.(假设每步反应、吸收均完全)

[实验步骤]
①连接好装置,______;
②在热分解装置中装入23.3g样品,通人空气一段时间;
③分别称量装置C、D的质量;
④______,启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温;
⑥再次分别称量装置C、D的质量.
[进行实验]该小组同学按上述实验步骤进行实验,并记录了如下数据:
[实验分析及数据处理]:装置C的质量(/g) 装置D的质量(/g) 实验前 232.4 208.2 实验后 236.9 217.0
(1)A装置的作用是______;E装置的作用是______;
(2)实验步骤⑤继续通空气至装置冷却到室温是为了______.
(3)根据上述数据,计算xMgCO3•yMg(OH)2•zH2O中x:y:z的最简比;(提示:MgCO3═MgO+CO2↑、Mg(OH)2═MgO+H2O)
(4)根据上述实验结论,结合“固体质量-温度关系图”,回答下列问题:
①当温度达360℃时,固体质量减少了______g,此质量是生成的______的质量;
②反应完全进行时,温度最低为______℃,此时热分解装置中的剩余固体物质为______. 流浪的心漂泊的人1年前1
流浪的心漂泊的人1年前1 -
 wuyanse 共回答了15个问题
wuyanse 共回答了15个问题 |采纳率80%解题思路:[实验步骤]①根据首先要检验装置的气密性进行解答;
④根据实验步骤以及注意事项进行解答;
[实验分析及数据处理]:(1)根据A装置的作用和E装置的作用是防止空气中的二氧化碳和水影响实验结果进行解答;
(2)根据实验步骤⑤继续通空气至装置冷却到室温是为了防止热的生成物与空气中的物质反应进行解答;
(3)根据装置C增加的质量为水的质量,装置D增加的质量为二氧化碳的质量进行解答;
(4)结合“固体质量-温度关系图”进行解答.[实验步骤]①首先要检验装置的气密性,所以连接好装置,检查装置的气密性;
④实验步骤可知,打开弹簧夹,启动热分解装置,使样品充分热解;
[实验分析及数据处理]:(1)A装置的作用是吸收空气中的二氧化碳和水;E装置的作用是防止空气中的二氧化碳和水进入影响实验结果;
(2)实验步骤⑤继续通空气至装置冷却到室温是为了防止热的生成物与空气中的物质反应;
(3)装置C增加的质量为生成水的质量,装置D增加的质量为生成二氧化碳的质量.
生成水的质量=236.9g-232.4g=4.5g,生成二氧化碳的质量=217.0g-208.2g=8.8g,
设碳酸镁的质量为x.
MgCO3═MgO+CO2↑
84 44
x 8.8g
[84/x=
44
8.8g]
x=16.8g
则氧化镁的质量=23.3g-16.8g-4.5g=2.0g
设氢氧化镁的质量为y
Mg(OH)2═MgO+H2O
58 40
y 2.0g
[58/y=
40
2.0g]
y=2.9g
所以xMgCO3•yMg(OH)2•zH2O中水的质量为=23.3g-16.8g-2.9g=3.6g
所以碳酸镁、氢氧化镁和水的质量比为:84x:58y:18z=16.8g:2.9g:3.6g 解得x:y:z=4:1:4.
(4)①由固体质量-温度关系图可知,当温度达360℃时,固体质量减少=23.3g-19.7g=3.6g.此质量是生成的水的质量;
②反应完全进行时,温度最低为360℃,此时热分解装置中的剩余固体物质为碳酸镁和氢氧化镁.
故答案为::[实验步骤]①检查装置的气密性;
④打开弹簧夹;
[实验分析及数据处理]:(1)吸收空气中的二氧化碳和水;防止空气中的二氧化碳和水进入影响实验结果;
(2)防止热的生成物与空气中的物质反应;
(3)4:1:4;
(4)①3.6;水;②360;碳酸镁和氢氧化镁.点评:
本题考点: 实验探究物质的组成成分以及含量;气体的净化(除杂).
考点点评: 本考点属于盐的性质中实验方法和过程的探究,根据物质的化学性质,要认真分析,不仅要把握实验设计的每一个步骤中的实验目的,还要加强记忆除去常用离子的方法,从而突破难点.有关的计算要准确,本考点经常出现在实验题中.1年前查看全部
- 碱式碳酸镁能不能做灭火器
 wangyanbit1年前1
wangyanbit1年前1 -
 碧雨萍 共回答了21个问题
碧雨萍 共回答了21个问题 |采纳率90.5%碱式碳酸镁不能做灭火器,原因是等量的碱式碳酸镁和碳酸氢钠相比较,碱式碳酸镁所产生的二氧化碳比碳酸氢钠少得多.1年前查看全部
- 蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下:
蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下:

室温下,相关金属氢氧化物沉淀的KSP见下表1
注:①lg2=0.3,②溶液中某离子的浓度小于1.0×10-5 mol•L-1,可认为该离子沉淀完全.下列说法不正确的是( )氢氧化物 Fe(OH)3 Al(OH)3 Mg(OH)2 (溶度积)KSP 4.0×10-38 1.25×10-33 1.8×10-11
A. 在滤液I中,不能加过量的Ca(OH)2是为了防止Al(OH)3溶解和Mg2+沉淀
B. 滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C. 室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D. 称18.2g碱式碳酸镁【aMgCO3•b Mg(OH)2•cH2O】高温加热分解得到6.6g CO2和8.0g MgO,由此可知a=3、b=1、c=3 fl86231年前1
fl86231年前1 -
 我是左岸 共回答了17个问题
我是左岸 共回答了17个问题 |采纳率94.1%解题思路:A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀;
C、根据氢氧化铝的Ksp可以求出Al3+刚好沉淀完全时的PH;
D、确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量;A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀,所以不能加过量的Ca(OH)2;故A正确;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀,已知Fe(OH)3的Ksp小,所以Fe(OH)3先形成沉淀,故B错误;
C、Al3+刚好沉淀完全时c(Al3+)=1.0×10-5 mol•L-1,则c(OH-)=
3
Ksp
c(Al3+)
=
3
1.25×10-33
1.0×10-5
=5×10-10mol•L-1,所以c(H+)=2×10-5mol•L-1
,所以PH=4.7,即pH调节到4.7时,Al3+刚好沉淀完全,故C正确;
D、m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分 aMgCO3・bMg(OH)2・cH2
高温
.
O (a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则n(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3,所以a=3、b=1、c=3,故D正确;
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了沉淀溶解平衡原理,Ksp的有关计算,元素化合物中金属铝、铁的性质,解题时需熟知物质间的反应原理.1年前查看全部
- 某碱式碳酸镁〔Mg(OH)2·xMgCO3〕固体31g恰好与100ml8mol·L-1的HCl反应生成MgCl2溶液,则
某碱式碳酸镁〔Mg(OH)2·xMgCO3〕固体31g恰好与100ml8mol·L-1的HCl反应生成MgCl2溶液,则x为?我知道x=3,但是为什么等于3?
 mofeng_19821年前1
mofeng_19821年前1 -
 boy101 共回答了23个问题
boy101 共回答了23个问题 |采纳率87%100ml8mol·L-1的HCl中HCl为0.8 mol,生成MgCl2溶液,由镁守恒,可得镁为0.4mol.则31/(58+84x) ×(1+x)=0.4,解得x=3.1年前查看全部
- 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成的.由蛇纹石制取碱式碳酸镁的实验步骤如下
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成的.由蛇纹石制取碱式碳酸镁的实验步骤如下

(4)可循环的物质是_______
答案为什么是Ca(OH)2、CO2 樱花飘浪1年前1
樱花飘浪1年前1 -
 六脉 共回答了16个问题
六脉 共回答了16个问题 |采纳率93.8%第二次加入Ca(OH)2时通入CO2产生的沉淀物B为Al2O3、CaCO3.CaCO3可以回收产生CO2和Ca(OH)2.Mg(HCO3)2热解也会产生CO2.
方程式我没写出,沉淀物A为Fe(OH)3.
希望这回答你能满意.1年前查看全部
- 有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质。
有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质。
为探究X的成分,设计方案并进行了如下实验:
Ⅰ.将X粉末充分加热,有气体产生。
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液。
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰;透过蓝色钴玻璃观察,无紫色火焰。
Ⅳ.取Ⅱ中无色溶液,滴入KMnO 4 酸性溶液,紫红色不褪去。
Ⅴ.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色。电解过程中测得溶液pH变化如图所示。
(1)根据实验Ⅳ可判断,一定不存在的物质是_______________。
(2)X的成分是____________(填化学式)。
(3)实验V中,0→t1时间内,两个电极上的电极反应式为:阳极______________;阴极_____________。
(4)0→t1时间内,溶液pH升高比较缓慢的原因是_______________(用离子方程式表示)。 kirb1年前1
kirb1年前1 -
 守望瓜田 共回答了18个问题
守望瓜田 共回答了18个问题 |采纳率94.4%(1)NaNO 2
(2)NaCl与NaHCO 3
(3)2Cl - -2e - =Cl 2 ↑;2H + +2e - =H 2 ↑或2H 2 O+ 2e - =H 2 ↑+2OH -
(4)HCO 3 - +OH - =CO 3 2- +H 2 O1年前查看全部
- (2012•丰泽区质检)碱式碳酸镁在300℃分解的化学方程式是:Mg2(OH)2CO3
(2012•丰泽区质检)碱式碳酸镁在300℃分解的化学方程式是:Mg2(OH)2CO3
2MgO+X+CO2↑,生成物X的化学式是( )△ .
A.H2O
B.O2
C.H2
D.CH4 混世霸主1年前1
混世霸主1年前1 -
 qqbbb 共回答了24个问题
qqbbb 共回答了24个问题 |采纳率91.7%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.根据反应的化学方程式,反应物中镁、氧、氢、碳原子个数分别为2、5、2、1,反应后的生成物中镁、氧、氢、碳原子个数分别为2、4、0、1,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O.
故选:A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 请问加热情况下,碱式碳酸镁和/氧化镁/氢氧化镁,都可以和50%硫酸铝溶液反应吗?原理是什么.
请问加热情况下,碱式碳酸镁和/氧化镁/氢氧化镁,都可以和50%硫酸铝溶液反应吗?原理是什么.
最后产物澄清透明吗 ,50%浓度硫酸铝溶液pH在3左右. yc_1191年前3
yc_1191年前3 -
 chantui 共回答了10个问题
chantui 共回答了10个问题 |采纳率90%在Al2(SO4)溶液中存在平衡Al3+ + 3H2OAl(OH)3 + 3H+正向移动,因此同时还会生成Al(OH)3 沉淀,
(2)再增加Mg2(OH)2CO3的量,H+量不足以把CO32+变为H2CO3而分解,生成HCO3-,此时不产生CO2,也生成Al(OH)3 沉淀,
(3)若Mg2(OH)2CO3大量,则会有大量的OH-于H+结合,此时CO32-不与H+结合,CO32-与Mg2+结合成MgCO3,不生成Al2(CO3)3,Al2(CO3)3不能在溶液中不能存在.同理也会生成Al(OH)3 沉淀,
2.MgO和Mg(OH)2与Al2(SO4)溶液反应原理和一上反应一样,都是由于Al3+水解溶液呈酸性,MgO和Mg(OH)2消耗H+使水解正向进行,只是MgO和Mg(OH)2与Al2(SO4)溶液反应不因为反应物量的不同而发生不同的反应.
由于本人水平有限,若有错误及不当之处还敬请您谅解,提出,订正,在此我先向您表示衷心的感谢!祝您新年愉快,1年前查看全部
- 如何制取碱式碳酸镁?MgO+H2O+CO2==Mg2(OH)2CO3 有没有什么条件?或者是其他的制取方法?
如何制取碱式碳酸镁?MgO+H2O+CO2==Mg2(OH)2CO3 有没有什么条件?或者是其他的制取方法?
我是在江苏2010年高考的一道化学题的时候不会的一个问题,它通过MgCl2的预氨化,得到镁沉淀,然后再在溶液中通入氨气和碳酸氢铵.然后热水解,再过滤.我其实是想问从预氨化之后通入氨气和碳酸氢铵,还有热水解的作用.如果可以,把具体流程写出来,有必要还可以把方程式写出来. 远方的zz1年前1
远方的zz1年前1 -
 may80522 共回答了26个问题
may80522 共回答了26个问题 |采纳率96.2%氢氧化镁悬浊液碱性较强(pH约为10.5),氨化后加入碳酸氢铵,目的是引入CO32-并控制碱性.
热水解的目的,我认为是使少量的MgCO3转化为碱式碳酸镁.因为碱式碳酸镁的Ksp小于MgCO3,但水解不能过度,否则得到氢氧化镁.(所以要加入碳酸氢铵)
江苏的化学题太难,有些问题并不需要把流程中各部分的原理都弄清楚,有些即使不清楚,也不妨碍做题.
以上本人拙见,仅供参考,错了不管1年前查看全部
- 求碱式碳酸镁分别与稀盐酸和氧气的化学反应方程式!
 heaven1119271年前2
heaven1119271年前2 -
 wwjia 共回答了13个问题
wwjia 共回答了13个问题 |采纳率100%碱式碳酸镁膜不稳定 Mg2(OH)2CO3加热会分解
所以反应有2 Mg + O2 =点燃= 2 MgO
Mg2(OH)2CO3=加热=2MgO+CO2↑+H2O
还有一个不要漏了2Mg+co2=点燃=2Mg0+C
黑色物质就是碳1年前查看全部
- 蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下:
蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下:

室温下,相关金属氢氧化物沉淀的KSP见下表1
注:①lg2=0.3,②溶液中某离子的浓度小于1.0×10-5 mol•L-1,可认为该离子沉淀完全.下列说法不正确的是( )氢氧化物 Fe(OH)3 Al(OH)3 Mg(OH)2 (溶度积)KSP 4.0×10-38 1.25×10-33 1.8×10-11
A.在滤液I中,不能加过量的Ca(OH)2是为了防止Al(OH)3溶解和Mg2+沉淀
B.滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C.室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D.称18.2g碱式碳酸镁【aMgCO3•b Mg(OH)2•cH2O】高温加热分解得到6.6g CO2和8.0g MgO,由此可知a=3、b=1、c=3 ljq838181年前1
ljq838181年前1 -
 找点儿乐子 共回答了14个问题
找点儿乐子 共回答了14个问题 |采纳率92.9%解题思路:A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀;
C、根据氢氧化铝的Ksp可以求出Al3+刚好沉淀完全时的PH;
D、确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量;A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀,所以不能加过量的Ca(OH)2;故A正确;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀,已知Fe(OH)3的Ksp小,所以Fe(OH)3先形成沉淀,故B错误;
C、Al3+刚好沉淀完全时c(Al3+)=1.0×10-5 mol•L-1,则c(OH-)=
3
Ksp
c(Al3+)
=
3
1.25×10−33
1.0×10−5
=5×10-10mol•L-1,所以c(H+)=2×10-5mol•L-1
,所以PH=4.7,即pH调节到4.7时,Al3+刚好沉淀完全,故C正确;
D、m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分aMgCO3・bMg(OH)2・cH2
高温
.
O (a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3,所以a=3、b=1、c=3,故D正确;
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了沉淀溶解平衡原理,Ksp的有关计算,元素化合物中金属铝、铁的性质,解题时需熟知物质间的反应原理.1年前查看全部
- 以水氯镁石(主要成分为 )为原料生产碱式碳酸镁的主要流程如下 (1)预氨化过程中有Mg(OH) 2 沉淀生成,已知常温下
以水氯镁石(主要成分为 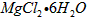 )为原料生产碱式碳酸镁的主要流程如下
)为原料生产碱式碳酸镁的主要流程如下
(1)预氨化过程中有Mg(OH) 2 沉淀生成,已知常温下Mg(OH) 2 的 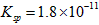 ,若溶液中
,若溶液中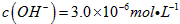 ,则溶液中
,则溶液中 =_______________。
=_______________。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为__________________。
(3)高温煅烧碱式碳酸镁得到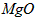 。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下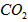 0.896L,通过计算确定碱式碳酸镁的化学式。__________________________
0.896L,通过计算确定碱式碳酸镁的化学式。__________________________
(4)若热水解不完全,所得碱式碳酸镁中将混有 ,则产品中镁的质量分数_____________(填 “升高”、“降低”或“不变”)。
,则产品中镁的质量分数_____________(填 “升高”、“降低”或“不变”)。  jiwaiprofessor1年前1
jiwaiprofessor1年前1 -
 sofangbin 共回答了13个问题
sofangbin 共回答了13个问题 |采纳率92.3%1年前查看全部
- 碱式碳酸镁受热分解的化学反应方程式是什么?
 岚玫1年前3
岚玫1年前3 -
 zhangjian197 共回答了16个问题
zhangjian197 共回答了16个问题 |采纳率93.8%Mg2(OH)2CO3==加热==2MgO+H2O+CO2气体符号1年前查看全部
- 碱式碳酸镁加热完全分解后的产物有什么东西?
 donglianguo1年前4
donglianguo1年前4 -
 龙行在下 共回答了16个问题
龙行在下 共回答了16个问题 |采纳率87.5%碱式碳酸镁(Mg2(OH)2CO3)加热完全分解后的产物有:氧化镁,二氧化碳和水.
碱式碳酸镁分解方程式:Mg2(OH)2CO3 ==△== 2MgO + CO2↑ + H2O
和碱式碳酸铜相似.碱式碳酸盐分解都生成金属氧化物、二氧化碳和水.1年前查看全部
- 某碱式碳酸镁[Mg(OH)2·xMgCO3]固体31g恰好与100ml8mol/L的盐酸反应生成MgCl2溶液,则x的值
某碱式碳酸镁[Mg(OH)2·xMgCO3]固体31g恰好与100ml8mol/L的盐酸反应生成MgCl2溶液,则x的值为多少?
 丢三落四的兔子1年前3
丢三落四的兔子1年前3 -
 ie2019 共回答了19个问题
ie2019 共回答了19个问题 |采纳率84.2%设Mg(OH)2·xMgCO3 a mol ,HCl物质的量=8mol/L·0.1L=0.8mol ,根据氯元素守恒,MgCl2物质的量=0.4mol ,根据镁元素守恒,(1+x)·a = 0.4 ;
根据质量守恒,(58+84x)·a = 31;
两式相比得消去a:(58+84x) / (1+x) = 77.5
解得:x = 31年前查看全部
- 碱式碳酸镁与盐酸反应的化学方程式是什么?
 yuyudeka1年前1
yuyudeka1年前1 -
 不章不段 共回答了17个问题
不章不段 共回答了17个问题 |采纳率88.2%碱式碳酸镁有Mg2(OH)2CO3,Mg4(OH)2(CO3)3等形式
要生成CO2的物质的量与消耗盐酸之比为3:8
那么碱式碳酸镁应是Mg4(OH)2(CO3)3Mg4(OH)2(CO3)3+8HCl==4MgCl2+5H2O+3CO2↑1年前查看全部
- 碱式碳酸镁在300℃分解的化学方程式是:Mg 2 (OH) 2 CO 3 △ 2MgO + X + CO 2 ↑,生成物
碱式碳酸镁在300℃分解的化学方程式是:Mg 2 (OH) 2 CO 3 △ 2MgO + X + CO 2 ↑,生成物X的化学式是
A.H 2 O B.O 2 C.H 2 D.CH 4  wfh54874461年前1
wfh54874461年前1 -
 霏霏碧尔 共回答了21个问题
霏霏碧尔 共回答了21个问题 |采纳率95.2%A
根据:Mg 2 (OH) 2 CO 3 △ 2MgO + X + CO 2 ↑,可知,每个X中含有2个氢原子和1个氧原子,是水故选A1年前查看全部
- 工业上用苦卤为原料制碱式碳酸镁,可表示为aMgCO3·Mg(OH)2·bH2O.取4.84克碱式碳酸镁在坩埚中充分加热,
工业上用苦卤为原料制碱式碳酸镁,可表示为aMgCO3·Mg(OH)2·bH2O.取4.84克碱式碳酸镁在坩埚中充分加热,得到2.00克固体;另取4.84克碱式碳酸镁加入足量盐酸,可产生896 mL的气体(标况下).
(1)求a,b的值
 街头舞王1年前1
街头舞王1年前1 -
 yellowan 共回答了20个问题
yellowan 共回答了20个问题 |采纳率80%工业上用苦卤为原料制碱式碳酸镁,可表示为aMgCO3·Mg(OH)2·bH2O.取4.84克碱式碳酸镁在坩埚中充分加热,得到2.00克固体;另取4.84克碱式碳酸镁加入足量盐酸,可产生896 mL的气体(标况下).
(1)求a,b的值
MgCO3→CO2
1 : 1
x 0.896/22.4
x=0.04mol,3.36克
剩下的为1.48克Mg(OH)2·bH2O
aMgCO3·Mg(OH)2·bH2O →MgO
M 40
4.48 2.0
即4.48 克含镁元素0.05mol
即Mg(OH)2 0.05-0.04=0.01mol,0.58克
剩下水0.54克,0.03mol
即分子式4MgCO3·Mg(OH)2·3H2O
a=4,b=3 .1年前查看全部
- 有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质.为探究X的成分,设计方案并进行了
有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质.为探究X的成分,设计方案并进行了如下实验:
I.将X粉末充分加热,有气体产生.
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液.
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰;透过蓝色钴玻璃观察,无紫色火焰.
Ⅳ,取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去.
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色.电解过程中测得溶液pH变化如
图所示.

(1)根据实验Ⅳ可判断,一定不存在的物质是______.
(2)X的成分是______(填化学式).
(3)实验V中,0~t时间内,两个电极上的电极反应式为:阳极______;阴极______.
(4)0→t1时间内,溶液pH升高比较缓慢的原因是:______(用离子方程式表示). 眉目间惨淡1年前1
眉目间惨淡1年前1 -
 elisas 共回答了20个问题
elisas 共回答了20个问题 |采纳率85%解题思路:I.将X粉末充分加热,有气体产生,可能含有碱式碳酸镁、碳酸氢钠;
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液,则一定不含有碱式碳酸镁;
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰,应含有钠盐;透过蓝色钴玻璃观察,无紫色火焰,说明不含有碳酸钾;
Ⅳ.取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去,说明不含有亚硝酸钠;
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色,应生成氯气,说明含有氯化钠,电解过程后溶液pH不断增大,说明溶液碱性不断增强,以此解答该题.I.将X粉末充分加热,有气体产生,可能含有碱式碳酸镁、碳酸氢钠;
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液,则一定不含有碱式碳酸镁;
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰,应含有钠盐;透过蓝色钴玻璃观察,无紫色火焰,说明不含有碳酸钾;
Ⅳ.取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去,说明不含有亚硝酸钠;
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色,应生成氯气,说明含有氯化钠,电解过程后溶液pH不断增大,说明溶液碱性不断增强,
(1)根据实验Ⅳ可判断,一定不存在的物质是NaNO2,因NaNO2具有还原性,可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,故答案为:NaNO2;
(2)由以上分析可知含有NaCl与NaHCO3,一定不含有碱式碳酸镁、碳酸钾、亚硝酸钠,因碳酸氢铵与硫酸铝发生互促水解而不能共存,则不含有硫酸铝,故答案为:NaCl与NaHCO3;
(3)溶液为氯化钠和碳酸氢钠混合溶液,电解时阳极发生2Cl--2e-=Cl2↑,阴极发生2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,
故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
(4)电解时阴极生成氢氧根离子,溶液中存在碳酸氢钠,则发生:HCO3-+OH-=CO32-+H2O,导致0→t1时间内,溶液pH升高比较缓慢,
故答案为:HCO3-+OH-=CO32-+H2O.点评:
本题考点: 物质的检验和鉴别的实验方案设计;电解原理.
考点点评: 本题考查较为综合,以未知物的检验为载体综合考查学生分析问题能力和知识的综合运用能力,题目侧重于物质的性质的考查,注意把握电解原理和盐类水解的规律,题目难度中等.1年前查看全部
- 为什么碳酸氢钠可以叫酸式碳酸钠,而碱式碳酸镁不叫碳酸氢氧镁?
 刘雯婷1年前1
刘雯婷1年前1 -
 如花如花 共回答了23个问题
如花如花 共回答了23个问题 |采纳率91.3%碳酸氢钠是酸式盐.
碱式碳酸镁是碱式盐.1年前查看全部
- 碱式碳酸镁的化学式怎么写?
 loloeveryday1年前1
loloeveryday1年前1 -
 66655 共回答了27个问题
66655 共回答了27个问题 |采纳率77.8%碱式碳酸镁的组成一般以xMgCO3·yMg(OH)2·zH2O表示.其中x、y、z的比例有几种,可以为4∶1∶4,4∶1∶5,4∶1∶6,4∶1∶7,3∶1∶3,3∶1∶4.碱式碳酸镁遇稀酸即分解放出二氧化碳.加热至300℃以上分解.1年前查看全部
- 碱式碳酸镁的镁的化合价
 与钱无关与乐有染1年前1
与钱无关与乐有染1年前1 -
 爱我吗爱我吗 共回答了19个问题
爱我吗爱我吗 共回答了19个问题 |采纳率94.7%镁永远是二价
xMgCO3·yMg(OH)2·zH2O1年前查看全部
- 将灰黑色的镁条(表面有一层碱式碳酸镁膜)于纯氧中点燃,有黑色物质生成,求反应的化学方程式!
 jeliger1年前3
jeliger1年前3 -
 DAVIDLLL 共回答了19个问题
DAVIDLLL 共回答了19个问题 |采纳率84.2%碱式碳酸镁膜不稳定 Mg2(OH)2CO3加热会分解
所以反应有2 Mg + O2 =点燃= 2 MgO
Mg2(OH)2CO3=加热=2MgO+CO2↑+H2O
还有一个不要漏了2Mg+co2=点燃=2Mg0+C
黑色物质就是碳1年前查看全部
- 碱式碳酸镁的化学式,
 bonartco1年前1
bonartco1年前1 -
 湘龙腾四海 共回答了12个问题
湘龙腾四海 共回答了12个问题 |采纳率83.3%Mg(OH)2CO31年前查看全部
- 碱式碳酸镁的分解化学式同上
 第3ss1年前1
第3ss1年前1 -
 tmld_026 共回答了25个问题
tmld_026 共回答了25个问题 |采纳率92%Mg2(OH)2CO3=2MgO+CO2+H2O1年前查看全部
大家在问
- 1如图所示是碳的原子结构示意图,则碳原子核核外有_____个电子;碳原子核带的电荷量等于___个元电荷,即___
- 2非电解质能导电吗?
- 3电解质在什么情况下导电什么电解质在熔融状态下能导电?什么电解质在溶液中能导电?
- 4生僻字怎么读辟+鸟,是个什么字.一个单人旁+虎+鸟,是个什么字.请大家认识的拼出来.谢谢
- 5这些繁体字怎么读啊?子(鼠)丑(牛)寅(虎)卯(兔)辰(龙)巳(蛇)午(马)未(羊)申(猴)酉(鸡)戌(狗)亥(猪) 这
- 6大气中含有什么物质大气中都含有什么东西?还有,我们呼吸时吸进的气体都包括什么,尽量说全,别出现“其他”之类的词.
- 7做铁丝在氧气中燃烧实验时,为何瓶底要加水
- 8一个超好玩的数学智力题!有个叫尼古丁的烟鬼,他生活特别落魄,甚至连买一盒烟的钱都没有,只好用以前攒下来的抽过的烟头在卷烟
- 9爷爷奶奶的英文怎么写
- 10奶奶的英文怎么写
- 11奶奶的英语单词怎么写
- 12《海底两万里》读后感要求500字左右
- 13海底两万里第一章的读后感
- 14亚硫酸氢铵先酸性还是碱性,怎么看的
- 15对人体生长发育有积极意义的睡眠阶段是