氢氧化物转化金属氧化物氢氧化物怎样转化为金属氧化物 ,例如氢氧化钙怎么转化为氧化钙
 雪狼湖的狼2022-10-04 11:39:544条回答
雪狼湖的狼2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 天地狼 共回答了13个问题
天地狼 共回答了13个问题 |采纳率92.3%- 通二氧化碳,生成碳酸钙,过滤,再煅烧,搞定.
- 1年前
 S308 共回答了5个问题
S308 共回答了5个问题 |采纳率- Ca(OH)2 + CO2=CaCO3+H2O
CaCO3(高温)=Ca(OH)2+CO2 - 1年前
 midget 共回答了1个问题
midget 共回答了1个问题 |采纳率- 在一般情况下,氢氧化物怎样转化为金属氧化物需要煅烧,但部分强碱(比如氢氧化钠)不能煅烧为金属氧化物。至于氢氧化钙,氢氧化镁这样稍弱的碱是可以煅烧转化为金属氧化物
- 1年前
 _cfg_q251fc2cad 共回答了2个问题
_cfg_q251fc2cad 共回答了2个问题 |采纳率- 加酸
- 1年前
相关推荐
- 查阅资料得知Fe 3+ 、Mg 2+ 、Al 3+ 在浓度均为0.1mol•L -1 时,氢氧化物沉淀的pH如下表:
查阅资料得知Fe 3+ 、Mg 2+ 、Al 3+ 在浓度均为0.1mol•L -1 时,氢氧化物沉淀的pH如下表:
若要从含Fe 3+ 、Mg 2+ 、Al 3+ 的混合溶液中,只得到Fe(OH) 3 沉淀,则应调节溶液的pH( )氢氧化物 Fe(OH) 3 Mg(OH) 2 Al(OH) 3 开始沉淀的pH 2.3 10.8 3.7 开始溶解的pH:7.8 完全沉淀的pH 4.3 12.4 5.2 完全溶解的pH:10.0 A.12.4~14 B.7.8~10.0 C.10.0~10.8 D.3.7~5.2  cyychk1年前1
cyychk1年前1 -
 qinqindiudiu 共回答了19个问题
qinqindiudiu 共回答了19个问题 |采纳率78.9%若要从含Fe 3+ 、Mg 2+ 、Al 3+ 的混合溶液中,只得到Fe(OH) 3 沉淀,应防止生成Mg(OH) 2 和Al(OH) 3 沉淀,可调节pH2.3~3.7,此时只生成Fe(OH) 3 沉淀,
或调节pH10.0~10.8使Fe 3+ 转化为Fe(OH) 3 ,而Al 3+ 转化为AlO 2 - ,
此时溶液中Mg 2+ 没有转化生成Mg(OH) 2 沉淀,
故选C.1年前查看全部
- 碱性介于KOH 和Mg(OH )之间的氢氧化物是不是一定是两性化合物?怎样判断?
 琼OA1年前4
琼OA1年前4 -
 靓丽私家庄园 共回答了20个问题
靓丽私家庄园 共回答了20个问题 |采纳率90%KOH是强碱,Mg(OH)2是中强碱.
碱性介于KOH 和Mg(OH)2之间的氢氧化物不一定是两性氧化物.
例如NaOH碱性介于KOH 和Mg(OH)2之间,但NaOH是强碱.
所以这句话是错的.1年前查看全部
- 若25度时碱土金属氢氧化物M(OH)2的溶度积为K,在纯水中溶解度为S mol/L,求该饱和溶液中[H+]
若25度时碱土金属氢氧化物M(OH)2的溶度积为K,在纯水中溶解度为S mol/L,求该饱和溶液中[H+]
您可在这里继续补充问题细节 青菜豆包77771年前1
青菜豆包77771年前1 -
 _420 共回答了14个问题
_420 共回答了14个问题 |采纳率100%溶解度为S mol/L,溶液中的OH-浓度为2S mol/L,H+浓度就是10^-14/(2S) mol/L
这里的S也可用K代换,因为K=S*(2S)^2=4S^3,S=三次根号下(K/4)1年前查看全部
- 谁能帮我列举一下关于Al及其氧化物,氢氧化物的常考的化学方程式及离子方程式,最好是照片,重谢
 partos1年前0
partos1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- Si(OH)2氢氧化硅是碱性氢氧化物,酸性氢氧化物还是两性氢氧化物?
 kgdtk1年前1
kgdtk1年前1 -
 竹酒话梅 共回答了20个问题
竹酒话梅 共回答了20个问题 |采纳率95%氢氧化硅:Si(OH)4,也可以写作H4SiO4 ,叫做正硅酸,是各种硅酸的原酸,弱酸性.1年前查看全部
- 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成 。回答下列
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成  。回答下列问题:
。回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式 _____________________。
(2)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(3)写出可溶性铝盐与氨水反应的离子方程式__________________________。
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因______________________。 蜜蜂小新1年前1
蜜蜂小新1年前1 -
 曾经沧海为悔水 共回答了18个问题
曾经沧海为悔水 共回答了18个问题 |采纳率88.9%(1)Zn+2NaOH===Na 2 ZnO 2 +H 2 ↑
(2)①③④
(3)Al 3+ +3NH 3 ·H 2 O=== Al(OH) 3 ↓ +3NH 4 +
(4)可溶性锌盐与氨水反应产生的Zn(OH) 2 可溶于过量氨水中,生成,氨水的用量不易控制。1年前查看全部
- 某金属元素R的碳酸盐化学式为R2(CO3)3,则R元素的化合价为____价,R元素的氢氧化物的化学式为_________
某金属元素R的碳酸盐化学式为R2(CO3)3,则R元素的化合价为____价,R元素的氢氧化物的化学式为___________.氯化物的化学式为_________.它的硫酸盐化学式是_________
 jamilia1年前2
jamilia1年前2 -
 蓝夜灵 共回答了20个问题
蓝夜灵 共回答了20个问题 |采纳率95%+3价
R(OH)3
RCL3
R2(SO4)31年前查看全部
- 在用作洗涤用品的肥皂制备过程中,用碱土金属氢氧化物代替碱金属氢氧化物,可否?为什么?
 月光字幕组1年前1
月光字幕组1年前1 -
 enfn 共回答了29个问题
enfn 共回答了29个问题 |采纳率89.7%碱性太弱,皂化值低1年前查看全部
- 高铁酸钾与水反应生成的一种红褐色的氢氧化物是什么
 田下有力1年前3
田下有力1年前3 -
 琴伊 共回答了17个问题
琴伊 共回答了17个问题 |采纳率76.5%高铁酸盐钾是六价铁盐,具有很强的氧化性
高铁酸钾极易溶于水,形成类似于高锰酸钾溶液紫红色的溶液.此溶液极不稳定,数分钟后明显分解:
4Fe04 2- + 10H2O = 4Fe(OH)3(沉淀)+ 8OH- + 3O2(气体)
红褐色氢氧化物是氢氧化铁1年前查看全部
- 我们称Li,Na,K,Rb,Cs,Fr为碱金属是因为他们的氢氧化物都是( )碱?
我们称Li,Na,K,Rb,Cs,Fr为碱金属是因为他们的氢氧化物都是( )碱?
同题(填空题)! ligayiqiqi1年前1
ligayiqiqi1年前1 -
 xiaoyu6696 共回答了11个问题
xiaoyu6696 共回答了11个问题 |采纳率90.9%强碱?1年前查看全部
- 第六主族元素的气态氢化物化学元素周期表第六主族元素O S Se Te Po的气态氢氧化物的稳定性比较
 annicou1年前0
annicou1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 是否一切金属的氢氧化物都与酸反应.哪些只和强酸反应.又有什么特例是和强酸弱酸反应产物不同的
 hgz13141年前1
hgz13141年前1 -
 赶紧把房子卖掉 共回答了17个问题
赶紧把房子卖掉 共回答了17个问题 |采纳率94.1%都是中和反应呀
特例:
3Fe(OH)2+10HNO3=3Fe(NO3)3+NO+8H2O1年前查看全部
- 写出Mg最高氢氧化物对应水化物跟Cl的氢化物水溶解反应的离子方程式
 htlyy1年前1
htlyy1年前1 -
 旭日JJLI 共回答了20个问题
旭日JJLI 共回答了20个问题 |采纳率100%Mg最高价氧化物的水化物是Mg(OH)2
Mg(OH)2+2H+(这个+是上标)=2H2O+Mg2+1年前查看全部
- 什么叫“氢氧化物开始沉淀时的pH” Fe3+开始沉淀的pH是1.9 在酸性环境下Fe(OH)3是会分解的呀.
 ahljb20081年前5
ahljb20081年前5 -
 li2005911 共回答了16个问题
li2005911 共回答了16个问题 |采纳率75%有些金属在一定pH以上就会形成氢氧化物沉淀.对于三价铁来说,这个pH就是1.9.
在高中阶段,你就不应该只是局限于初中的简单概念了.以为为氢氧化铁能和酸反应溶解,就草率的认为只要是酸性就一定能反映.酸性还要有个强弱呢,pH大于7是你所认为的碱性,但此时溶液中依然有氢离子,只是浓度很低罢了..你上高二以后要好好学习化学反应原理!1年前查看全部
- 难容碳酸盐或氢氧化物用什么溶解
 www4635958381年前1
www4635958381年前1 -
 浪使者12345 共回答了23个问题
浪使者12345 共回答了23个问题 |采纳率100%用强酸(盐酸,硫酸,硝酸等)溶解.
如:
H2SO4 + Mg(OH)2 == MgSO4 + 2H2O
2HCl + CaCO3 == CaCl2 + H2O + CO2(气体)1年前查看全部
- 某金属M对应的氯化物、氢氧化物的相对分子质量分别为a和b,则M的化合价的数值表达式是( )
某金属M对应的氯化物、氢氧化物的相对分子质量分别为a和b,则M的化合价的数值表达式是( )
A. (a-b)/19.5
B. (b-a)/18.5
C. (a-b+16)/34.5
D. (a-b)/18.5 serina_fei1年前1
serina_fei1年前1 -
 后悔的小傻猪 共回答了20个问题
后悔的小傻猪 共回答了20个问题 |采纳率85%解题思路:先设出金属M的化合价,则可写出对应的氯化物、氢氧化物的化学式,然后利用它们的相对分子质量来列式可得到求M的化合价的数值表达式.设金属M的化合价为x,金属M的相对原子质量为y,
则氯化物的化学式为MClx,
由其相对分子质量为a,则可得到y+35.5x═a;
氢氧化物的化学式为M(OH)x,
由其相对分子质量为b,则可得到y+17x═b;
联立解以上两式,可解得x═
(a−b)
18.5
故选D.点评:
本题考点: 有关化学式的计算和推断;常见元素与常见原子团的化合价.
考点点评: 本题考查利用化合价确定化学式,并利用化学式进行相对分子质量的简单计算,学生应学会大胆设出未知的量通过列式解答来确定答案.1年前查看全部
- 某金属R的相对原子质量为a,它的氢氧化物的相对分子质量为b,则R的化合价的数值表达式是______(用含a、b的式子表示
某金属R的相对原子质量为a,它的氢氧化物的相对分子质量为b,则R的化合价的数值表达式是______(用含a、b的式子表示).
 lovejohnnydepp1年前1
lovejohnnydepp1年前1 -
 huizi 共回答了22个问题
huizi 共回答了22个问题 |采纳率90.9%解题思路:首先设金属元素的化合价为x,再根据R得化合价可以写出R氢氧化物的化学式;最后根据相对分子质量列方程求解即可.设金属元素R的化合价为x
R氢氧化物的化学式为:R(OH)x ,可得
b=a+(16+1)×x,
解得:x=+[b−a/17].
故答案为:+[b−a/17].点评:
本题考点: 相对分子质量的概念及其计算;有关元素化合价的计算.
考点点评: 本题考查学生根据元素的相对原子质量与化合价之间的关系进行分析解题的能力.1年前查看全部
- 反应物中有氢氧化物 生成物中有金属氧化物的化学方程式
 雪儿雪儿要快乐1年前5
雪儿雪儿要快乐1年前5 -
 泗北 共回答了16个问题
泗北 共回答了16个问题 |采纳率87.5%难溶性碱加热后会生成金属氧化物和水.
比如:Cu(OH)2==△==CuO+H2O
2Fe(OH)3==△==2Fe2O3+3H2O1年前查看全部
- 某金属元素M对应的氯化物和氢氧化物的相对分子质量分别为a和b,则M元素的化合价的数字表达式为()过程
 飞翔的心境1年前2
飞翔的心境1年前2 -
 鱼鱼是我 共回答了14个问题
鱼鱼是我 共回答了14个问题 |采纳率92.9%设M化合价为X,则有氯化物为MClx,氢氧化物为M(OH)x,则a=M+35.5X,b=M+17X,X=(a-b)/18.5=2(a-b)/371年前查看全部
- 镭的氢氧化物的酸碱性是什么?镭的碳酸盐的溶解度怎么样?
 zou101年前1
zou101年前1 -
 怎么一刀 共回答了26个问题
怎么一刀 共回答了26个问题 |采纳率88.5%氢氧化镭呈碱性,而且碱性特别强,于强碱的总排名的第三位
碳酸镭难溶于水.1年前查看全部
- 氢氧化铅怎么会是弱碱?同族的金属{主族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越强
氢氧化铅怎么会是弱碱?同族的金属{主族}元素随着原子序数的递增,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越强吗
 尉迟豆1年前3
尉迟豆1年前3 -
 春残 共回答了18个问题
春残 共回答了18个问题 |采纳率88.9%你这个规律只适用于碱金属元素
因为氢氧化铅在水中不完全电离1年前查看全部
- 原子半径在同周期主族元素中最大,但氢氧化物的碱性在同族中最弱的元素
 南宫冰1年前1
南宫冰1年前1 -
 玻璃樽的神话 共回答了22个问题
玻璃樽的神话 共回答了22个问题 |采纳率100%同周期随原子序数增大,半径越小:
同主族由上到下还原性依次增强,氢氧化物碱性依次增强:
所以为锂1年前查看全部
- 元素周期表第一组族碱金属从上至下的氢氧化物的碱性是增强还是减弱
 桃夭_991年前4
桃夭_991年前4 -
 烟花三月下丽江 共回答了17个问题
烟花三月下丽江 共回答了17个问题 |采纳率94.1%增强
以为从上往下原子半径原来越大 也就是说原来越容易失电子 失电子能力强金属性也就强1年前查看全部
- 是不是氢化物中非氢元素金属性强酸性就越强,氢氧化物中金属元素金属性越强碱性就越强
 wo990531年前1
wo990531年前1 -
 讽刺的交集 共回答了17个问题
讽刺的交集 共回答了17个问题 |采纳率88.2%氢化物中非氢元素非金属性越强酸性就越强,氢氧化物中金属元素金属性越强碱性就越强
例如 :酸性 硫化氢 小于氯化氢 碱性 氢氧化钠 大于氢氧化镁1年前查看全部
- ABCD四种元素都是短周期元素,A元素的离子有黄色的火焰.B元素的离子结构与NE具有相同的电子层排布.5.8B的氢氧化物
ABCD四种元素都是短周期元素,A元素的离子有黄色的火焰.B元素的离子结构与NE具有相同的电子层排布.5.8B的氢氧化物恰好能与100ML 2 MOLL 盐酸完全反应,B原子核中质子数与中子数相等,H2在C的单质中燃烧产生苍白色的火焰.D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍.ABCD分别是?C在第几周期第几族?它的最高价氧化物的化学式是?AD在燃烧条件下生成化合物是?其中阴离子和阳离子个数比为?在C单质的实验室制法中发生反应的离子方程式?
 twffcu21年前1
twffcu21年前1 -
 小蜜蜂的lovestor 共回答了18个问题
小蜜蜂的lovestor 共回答了18个问题 |采纳率94.4%A :Na B:Mg C:Cl D:O C在第三周期,ⅦA族元素 ;HClO4;Na2O2;1:2;2 MnO4- + 16 H+ + 10 Cl- ==2 Mn2+ + 5 Cl2 ↑+ 8H2O1年前查看全部
- 除铁外,哪种金属的氢氧化物和碳酸盐是接近棕红色的,氯化物溶液黄颜色,金属本身不与盐酸反应?
除铁外,哪种金属的氢氧化物和碳酸盐是接近棕红色的,氯化物溶液黄颜色,金属本身不与盐酸反应?
这块金属是从煤层中出来的. 水力学院1年前1
水力学院1年前1 -
 夏威夷可纳 共回答了18个问题
夏威夷可纳 共回答了18个问题 |采纳率83.3%应该是铅1年前查看全部
- 金属的氢氧化物是怎样制的的
 loveradio19821年前3
loveradio19821年前3 -
 梨画 共回答了19个问题
梨画 共回答了19个问题 |采纳率100%哪种金属?常见金属(Fe、Cu、Mg、Al、Zn等)的氢氧化物就是用该金属离子的溶液和足量碱反应(一般就是和NaOH反应,Al和Zn是要和适量NaOH反应,碱过量反而会溶解沉淀).生成沉淀后过滤即可.1年前查看全部
- 为什么第二主族的第二周期和第三周期元素的氢氧化物的碱性,是后者碱性强?
 小红KKK1年前1
小红KKK1年前1 -
 cqxcy 共回答了25个问题
cqxcy 共回答了25个问题 |采纳率92%同一主族,从上往下,元素的金属性逐渐增强,对应的最高价氧化物水化物(即氢氧化物)的碱性逐渐增强.1年前查看全部
- 为什么元素的金属性越强它的最高件氢氧化物的碱性越强?
 3958504651年前1
3958504651年前1 -
 ighv 共回答了10个问题
ighv 共回答了10个问题 |采纳率90%金属性越强说明其对最外层电子的束缚最弱 它的碱在水里时时就越容易使氢氧根发生电离1年前查看全部
- K CA ZN BR 哪一种元素的氢氧化物的碱性最强 为什么
 yanhui91年前1
yanhui91年前1 -
 萧罗 共回答了16个问题
萧罗 共回答了16个问题 |采纳率93.8%K 元素的氢氧化物的碱性最强,wieKOH
因为在四种元素中K的金属性最强,金属性越强,对应的碱的碱性越强.1年前查看全部
- 如果将物质按单质、氢氧化物、酸、碱、盐、有机物分类,图中甲、乙、丙是三种不同类别的物质,且相连物质之间均能发生化学反应,
如果将物质按单质、氢氧化物、酸、碱、盐、有机物分类,图中甲、乙、丙是三种不同类别的物质,且相连物质之间均能发生化学反应,下列说法不符合图示要求的是( )
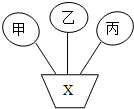 A. 当甲为硝酸铵时,X可以为氢氧化钙
A. 当甲为硝酸铵时,X可以为氢氧化钙
B. 当甲、乙、丙分别为酸、碱、盐时,X可能为碳酸钠
C. 当X为氧气时,甲、乙、丙可以为氢气、红磷、葡萄糖
D. 当X为稀盐酸时,甲、乙、丙可以为氧化铜、氢氧化铜、硝酸银 soaringealge1年前2
soaringealge1年前2 -
 mvudw0 共回答了20个问题
mvudw0 共回答了20个问题 |采纳率95%解题思路:A、根据铵态氮肥和碱反应会生成有刺激性气味的氨气进行分析;
B、根据可溶性碳酸盐会与酸、碱、盐反应进行分析;
C、根据氢气和红磷都是单质进行分析;
D、根据酸会与金属氧化物、碱、硝酸银反应进行分析.A、甲为硝酸铵时,X可以为氢氧化钙,硝酸铵和氢氧化钙会发生反应,满足题中的要求,故A正确;
B、甲、乙、丙分别为酸、碱、盐时,X可能为碳酸钠,碳酸钠会与酸、碱、盐发生反应,满足题中的要求,故B正确;
C、X为氧气时,甲、乙、丙可以为氢气、红磷、葡萄糖,氢气、红磷、葡萄糖都会与氧气反应,但是氢气和红磷都是单质,不满足题中的要求,故C错误;
D、X为稀盐酸时,甲、乙、丙可以为氧化铜、氢氧化铜、硝酸银,盐酸会与氧化铜、氢氧化铜、硝酸银反应,满足题中的要求,故D正确.
故选:C.点评:
本题考点: 物质的相互转化和制备;碱的化学性质;盐的化学性质.
考点点评: 在解此类题时,首先分析题中所给物质的化学性质,然后将选项中所给物质代入转化图中验证它们的可行性.1年前查看全部
- 有某碱金属的单质和其氧化物的混合物1.98g,加入适量的水使成为氢氧化物后得到氢氧化物为2.76g.求原来的碱金属元素使
有某碱金属的单质和其氧化物的混合物1.98g,加入适量的水使成为氢氧化物后得到氢氧化物为2.76g.求原来的碱金属元素使何种元素,其单质、氧化物的质量各为多少?
 梦日月1年前1
梦日月1年前1 -
 uu下的鱼313 共回答了22个问题
uu下的鱼313 共回答了22个问题 |采纳率90.9%原来的碱金属元素是Na,其单质是Na,质量是0.457125g,氧化物是Na2O,其质量是1.522875g.1年前查看全部
- 铬酸与过氧化氢反应为什么会产生铬的三价氢氧化物?
铬酸与过氧化氢反应为什么会产生铬的三价氢氧化物?
反应式:H2CrO4+H2O2--Cr(OH)3+H2O+.(记不起来了)
酸和碱不是不能共存吗?
如果铬酸过量...........
也有这效果吗?(Cr(OH)3依然存在,而不是被铬酸溶解) 纯芝麻证书1年前2
纯芝麻证书1年前2 -
 从失望到失望 共回答了18个问题
从失望到失望 共回答了18个问题 |采纳率88.9%a a a,过氧化氢是强氧化剂.,过氧化氢是有弱酸性的.!铬酸是难溶性酸.怎么可能与氢氧化铬反应.1年前查看全部
- 常见的几种金属单质的氧化物、氢氧化物的制取方法
常见的几种金属单质的氧化物、氢氧化物的制取方法
金属单质
Na
Fe
Al
Mg
(可能还有的,麻烦大师们补充一下下) guanggzh581年前1
guanggzh581年前1 -
 秋妍落雪 共回答了17个问题
秋妍落雪 共回答了17个问题 |采纳率88.2%氧化物都点燃就可以了!
氢氧化物,氧化钠加水,氯化铁加氢氧化钠,氯化铝加氨水,镁也是氯化镁加氢氧化钠1年前查看全部
- 氢氧化与什么物质一起会变质氢氧化钾、氢氧化钙、氢氧化钠、氢氧化钡是否都与二氧化碳反应?还有其他氢氧化物是否也一样?还是与
氢氧化与什么物质一起会变质
氢氧化钾、氢氧化钙、氢氧化钠、氢氧化钡是否都与二氧化碳反应?还有其他氢氧化物是否也一样?还是与其他物质反应? yu5033071171年前3
yu5033071171年前3 -
 lemonjm 共回答了13个问题
lemonjm 共回答了13个问题 |采纳率84.6%碱与非金属氧化物
酸反应1年前查看全部
- 什么活泼金属不能从水中置换出氢气,或者说只有什么金属能在一定条件下直接置换出氢气并生成相应的氢氧化物
 等待奇迹重生1年前1
等待奇迹重生1年前1 -
 努力去爱 共回答了27个问题
努力去爱 共回答了27个问题 |采纳率100%按照金属活动性顺序表,钾、钙、钠均可常温下与水反应置换出氢气,并生成碱;镁可与沸水反应得到氢气和氢氧化镁,铁可以与水蒸气反应得到氢气和四氧化三铁1年前查看全部
- cl的最高价氧化物是什么?cl的氢氧化物是什么?最高价氧化物的水化物是不是就是氢氧化物?
 高傲的孤独1年前3
高傲的孤独1年前3 -
 tyzjr2 共回答了21个问题
tyzjr2 共回答了21个问题 |采纳率90.5%Cl 的最高价氧化物 Cl2O7,Cl没有氢氧化物.
最高价氧化物对应的水化物,分两种情况
非金属元素,就是最高价含氧酸,比如Cl 最高价氧化物对应的水化物是高氯酸HClO4
金属元素,就是最高价氢氧化物,比如 Na 最高价氧化物对应的水化物是氢氧化钠 NaOH1年前查看全部
- 下列说法正确的是 ①多数金属氧化物、氢氧化物不溶于水②多数不溶于水的金属氧化物可与酸反应,生成盐和水氧化铝是一种两性氧化
下列说法正确的是 ①多数金属氧化物、氢氧化物不溶于水②多数不溶于水的金属氧化物可与酸反应,生成盐和水氧化铝是一种两性氧化物④氢氧化亚铁为灰绿色⑤铜绿的主要成分是Cu2(OH)2CO3
A.①②③⑤
B.③④⑤
C.①②④⑤
D.②③④⑤ 砸人ss1年前2
砸人ss1年前2 -
 licwang 共回答了19个问题
licwang 共回答了19个问题 |采纳率89.5%选A.
4错的原因是氢氧化亚铁为白色沉淀.1年前查看全部
- 铝离子以氢氧化物沉淀的pH3.2,是不是使溶液pH大于3.2就可以沉淀
 dongqing51561年前1
dongqing51561年前1 -
 leonesc 共回答了19个问题
leonesc 共回答了19个问题 |采纳率89.5%这样说不准确.
铝离子的浓度是多少时,以氢氧化物沉淀的pH3.2,如果铝离子的浓度比这个浓度低了,就是溶液pH大于3.2也不一定沉淀的.理解请及时采纳!1年前查看全部
- 什么物质加入NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色.最后变成红褐色的氢氧化物?
 清风鸣月1年前1
清风鸣月1年前1 -
 洋葱头宝宝 共回答了11个问题
洋葱头宝宝 共回答了11个问题 |采纳率81.8%含有Fe2+ 亚铁离子的可溶性盐,比如FeC2,Fe(NO3)2等等
方程如下:以FeCL2为例
FeCl2+2NaOH=Fe(OH)2白色沉淀+2NaCL
4Fe(OH)2+O2+2H2O=4Fe(OH)3 红褐色
Fe(OH)2很容易被空气中O2氧化成Fe(OH)3,随着被氧化生成的Fe(OH)3量越来越多,颜色就越来深,最后就变成红褐色了.1年前查看全部
- 氯化镁,氯化钙,的水溶液酸碱性?金属阳离子的氢氧化物不是都强碱吗?怎么还有酸碱性?如何判断水溶液的酸碱性?
 wx811395181年前1
wx811395181年前1 -
 mg109 共回答了15个问题
mg109 共回答了15个问题 |采纳率93.3%氯化镁强酸弱碱盐所以显碱性,氯化钙是强酸强碱盐所以显中性;只有K Ca Na Ba四种强碱其他都是弱碱
从ph判断 常温下 ph<7酸性.PH=7中性.pH>7碱性从浓度判断 氢离子浓度大于氢氧根浓度.酸性氢离子等于氢氧根.中性氢离子小于氢氧根 碱性1年前查看全部
- 化合物M是铁元素的+6价含氧酸钾盐,常用作净水剂与消毒剂.由铁元素的稳定氢氧化物与次氯酸钾、
化合物M是铁元素的+6价含氧酸钾盐,常用作净水剂与消毒剂.由铁元素的稳定氢氧化物与次氯酸钾、
氢氧化钾溶液反应制取化合物M,则制备M的离子方程式怎么写啊 ylcey1年前1
ylcey1年前1 -
 我的dd在杭州 共回答了21个问题
我的dd在杭州 共回答了21个问题 |采纳率95.2%离子方程式 2 Fe(OH)3 + 3 ClO- + 4 OH- = 2 FeO42- + 3 CI- + 5 H2O
化学方程式 2 Fe(OH)3 + 3 KClO + 4 KOH = 2 K2FeO4 + 3 KCI + 5 H2O
铁元素的稳定氢氧化物是Fe(OH)3,根据·化合价可知M是K2FeO4
剩下的就是配平了1年前查看全部
- 将金属C置于金属A的盐溶液中 放出无色气体并生成A的氢氧化物 请问这怎么比较C和A的金属活泼性
将金属C置于金属A的盐溶液中 放出无色气体并生成A的氢氧化物 请问这怎么比较C和A的金属活泼性
请说明理由 方毛丫头1年前2
方毛丫头1年前2 -
 早oo早好 共回答了17个问题
早oo早好 共回答了17个问题 |采纳率94.1%将金属C置于金属A的盐溶液中 放出无色气体并生成A的氢氧化物,说明C的金属活泼性大于A.
例如:C是钠,A是铜.
把钠放进硫酸铜的溶液中,钠先与溶液中的水反应,生成氢氧化钠和氢气.氢氧化钠再和硫酸铜反应生成蓝色氢氧化铜沉淀.
2Na+2H2O====2NaOH+H2↑
2NaOH+CuSO4====Na2SO4+Cu(OH)2↓
总反应为:
2Na+2H2O+CuSO4====Na2SO4+H2↑+Cu(OH)2↓1年前查看全部
- 某金属元素只有一种化合价,已知它的化合物的相对分子质量为M,它的氢氧化物的相对分子质量为N ,则该金属的化合价为 (
 天堂岛岛主1年前3
天堂岛岛主1年前3 -
 野渡泊舟 共回答了17个问题
野渡泊舟 共回答了17个问题 |采纳率76.5%发全,快1年前查看全部
- 如果元素的单质与水(或酸)反应置换出氢容易,而且它的氢氧化物碱性强,这种元素金属性就强,反之则弱.为什么要要加上个“而且
如果元素的单质与水(或酸)反应置换出氢容易,而且它的氢氧化物碱性强,这种元素金属性就强,反之则弱.为什么要要加上个“而且”呢?
 温柔的心房1年前2
温柔的心房1年前2 -
 天成nn 共回答了19个问题
天成nn 共回答了19个问题 |采纳率89.5%因为有些金属也能与酸反应置换出氢气,比如mg,zn,但他们对应的碱是沉淀,碱性很弱1年前查看全部
- 帮忙总结铬,锰,铁,钴,镍的氢氧化物的酸碱性和氧化还原性
帮忙总结铬,锰,铁,钴,镍的氢氧化物的酸碱性和氧化还原性
请另外对它们的氧化还原能力大小作比较 hhnb20081年前2
hhnb20081年前2 -
 writeone 共回答了13个问题
writeone 共回答了13个问题 |采纳率92.3%氢氧化铬 两性
氢氧化锰 碱性
氢氧化铁具有两性,但其碱性强于酸性
氢氧化钴 碱性
氢氧化镍 碱性
全部都是既有氧化性有有还原性.1年前查看全部
- 铬锰铁钴镍的氢氧化物的酸碱性和氧化还原性是怎样
 Gingko_Z1年前1
Gingko_Z1年前1 -
 qianliyan 共回答了19个问题
qianliyan 共回答了19个问题 |采纳率84.2%三价钴镍的氢氧化物有较强氧化性,用盐酸溶有氯气产生,二价锰的氢氧化物还原性强,易被氧化为三价,三价铬的氢氧化物较稳定.铬锰的氢氧化物为两性,铁钴镍的氢氧化物两性偏碱1年前查看全部
- 磷的最高价氧化物对应得到的水化物与钠的氢氧化物可生成多少种盐?
 清風竹影1年前1
清風竹影1年前1 -
 yoursabrina 共回答了17个问题
yoursabrina 共回答了17个问题 |采纳率82.4%磷的最高价为+5价,故有2种酸,H3PO4和HPO3(磷酸失去一个水分子成为偏磷酸)而磷酸和偏磷酸为弱酸,会水解,所以和NaOH形成Na3PO4,NaH2PO4(磷酸2氢钠),Na2HPO4,NaPO3共4种盐1年前查看全部
- 卤素氢氧化物中,稳定性最弱的是什么?
卤素氢氧化物中,稳定性最弱的是什么?
HCL HF HBr HI 安歌_12081年前1
安歌_12081年前1 -
 阿修罗-靖 共回答了22个问题
阿修罗-靖 共回答了22个问题 |采纳率77.3%HI……详情参见元素周期律1年前查看全部
大家在问
- 1阅读下面文言文,完成下面问题。 六月,壬申,师 ① 至于靡笄之下。齐侯使请战,曰:“子以君师辱于敝邑,不腆敝赋 ② ,
- 2某水库大坝横断面是梯形ABCD,坝顶宽CD=3米,斜坡AD=16米,坝高8米,斜坡BC的坡度i=1:3,求斜坡AD的坡角
- 3Hello...I come from Birmingham.My family wanted me to find a
- 4求一篇英语介绍2pm的短文,100字左右
- 5求一阶偏导数.函数右左边是u,左边等于右边,右边是e的t的平方次方(e^t^2)在t上的积分,上限为yz,下限为xz.
- 6点C在⊙O上,将圆心角∠AOB绕点O按逆时针方向旋转到∠A'OB',旋转角为α(0°
- 7你怎么理解教书育人,为人师表
- 8中华民族是礼仪之邦,自古强调“习礼仪”。这说明 ( ) A.礼貌和礼仪对人的成功没有
- 9急 谁知道快回答 急死了 再不回答死人啦!
- 10(2013•长沙模拟)A(红花)和对a(白花)为完全显性,由核基因控制;R(茸毛叶)对r(光滑叶)为完全显性,由质基因控
- 11数序规律强人高高手进!帮我看看这组数字的规律thankyou!
- 12已知数列an为等比数列,a1+a2+a3+a4=1,a5+a6+a7+a8=2,则a17+a18+19+a20=
- 13英语翻译为什么有些动物处于危险之中 为什么保护动物很重要?我们应该怎样保护动物用英语翻译下
- 14已知抛物线y=a(x-h)²的对称轴为直线x=-2,与y轴交于点(0,2)(1)求a和h的值(2)
- 15(2012•惠城区模拟)正十边形的每个内角为( )
