密闭容器中混合气体的压强常温时,下列各组气体在同一密闭容器中等物质的量混合后压强最小的是A.H2S和SO2 B.H2和O
 真我风采_ss2022-10-04 11:39:544条回答
真我风采_ss2022-10-04 11:39:544条回答常温时,下列各组气体在同一密闭容器中等物质的量混合后压强最小的是
A.H2S和SO2 B.H2和O2 C.H2S和O2 D.H2和CI2
原因是什么,像这种判断压强的题要怎么做

已提交,审核后显示!提交回复
共4条回复
 yang向东 共回答了17个问题
yang向东 共回答了17个问题 |采纳率76.5%- 这种题看气体与气体之间是否反应.反应后体积是否变化!变化,哪个变得更小.
A中H2S与SO2反应生成很水和S固体.所以体积减少了. - 1年前
 vita06 共回答了6个问题
vita06 共回答了6个问题 |采纳率- 根据气体的压强最大,然后是液体,最后固体,当气体反应生成液体压强变小,所以是D
- 1年前
 香烟弥漫 共回答了27个问题
香烟弥漫 共回答了27个问题 |采纳率- 分别去看能不能发生反应,发生什么样的反应。
A中,两种气体发生氧化还原反应,生成硫单质和水。生成物中没有一种气体,即使不是恰好完全反应,压强也当然最小。
其它几个在常温下在密闭容器中没有特殊条件的话,都不容易迅速发生反应。
因此选择A选项。... - 1年前
 那就戒了吧 共回答了29个问题
那就戒了吧 共回答了29个问题 |采纳率- 首先等物质的量的气体在常温下体积想等,在密闭容器中压强相等,那么接下来要看反应了,看反应生成物中气体的量,注意还有可逆反应。本题你还是自己试着照我的思路做做。
- 1年前
相关推荐
- 密闭容器中气体反应达平衡后向容器中加入反应物,逆反应速率增加还是减少?
 wsnmgry1年前1
wsnmgry1年前1 -
 天女天女 共回答了14个问题
天女天女 共回答了14个问题 |采纳率85.7%影响反应速率的其实是浓度,密闭容器中气体反应达平衡后向容器中加入反应物,会使反应物的浓度增大,因此正反应速率是加快的,就这一瞬间来说,生成物的浓度还没有改变,因此逆反应这一瞬速率不变,尤其是画图这一点很重要,但由于反应物消耗,就会有生成物产生,这时,生成物浓度变大,自然反应速率也加快了.
综合来说,增大反应物浓度,会使正反应速率加快,也会使逆反应速率加快.1年前查看全部
- 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.v正(X)=v逆(Z)
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1molX同时生成0.2molZ Oo淼焱oO1年前1
Oo淼焱oO1年前1 -
 bl100870 共回答了18个问题
bl100870 共回答了18个问题 |采纳率94.4%解题思路:由X(g)+2Y(g)⇌2Z(g)可知,该反应前后的化学计量数之和不等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变来解答.A、反应达平衡时,各物质的浓度不再随时间改变,所以压强不再变化,故A正确;
B、正逆反应速率相等指同一种物质的正逆反应速率相等,故B错误.
C、反应达到平衡时的浓度与反应的初始物质的量以及反应的转化程度有关,所以不能确定是否达到平衡,故C错误;
D、无论反应是否达到化学平衡,消耗的反应物的物质的量之比等于计量数之比,所以不能用来作为判断是否达到平衡状态的依据,故D错误;
故选A.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,平衡状态的本质是正逆反应速率相等,化学平衡状态的判断常以选择题方式考查.1年前查看全部
- 在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO(2写在右下角
在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO(2写在右下角)气体,如果只考虑发生下列可逆反应:2NO(2写在右下角)【可逆符号】N(2写右下角)O(4写右下角),分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是(CD )
A 平均反应速率A>B
B 平衡时NO(2写右下角)的物质的量B>A
C平衡时NO(2写右下角)的转化率B>A
D平衡时N(2写右下角)O(4写右下角)的物质的量B>A
【注:已经知道答案选CD,我要问的是有关这道题的一个解题知识点:(我们班老师总结的):同一反应在不同的容器中,恒温恒压相当于在恒温恒容的基础上增大压强.这个规律是在任何情况下都成立吗?即如果正反应是体积增大的反应的时候还是成立的吗?这块小生不大明白, 情报局1年前1
情报局1年前1 -
 2005jie11 共回答了15个问题
2005jie11 共回答了15个问题 |采纳率86.7%你可以这样考虑:
此反应:2NO2 → N2 +2O2 由2体积的NO2 生成1体积氮气和2体积氧气,由2体积气体一共生成3体积气体,是气体体积增加的反应;记住压强增加,可逆反应的平衡向气体体积减小的方向移动.
A: 恒容就是体积不变,但是压强会变.B: 恒压就是压强不变.
而此反应是气体体积增加的反应,也就是反应进行中若容器容积不变则压强会变大.所以,A恒容增压,反应向逆反应方向移动,生成的氮气和氧气的体积比B小,反应速率也小.
但是,同一反应在不同的容器中,恒温恒压相当于在恒温恒容的基础上增大压强.这不对吧.应该是同一体积增大的反应在不同的容器中,恒容相当于在恒压的基础上增大压强.而体积增大的反应,恒容相当于在恒压的基础上增大压强.1年前查看全部
- (1995•广州)把某化合物在密闭容器里加热完全分解,可得NO2、H2O、CO2三种物质,则这化合物是由______元素
(1995•广州)把某化合物在密闭容器里加热完全分解,可得NO2、H2O、CO2三种物质,则这化合物是由______元素组成的.
 yur1231年前1
yur1231年前1 -
 694538c0530726dc 共回答了13个问题
694538c0530726dc 共回答了13个问题 |采纳率76.9%解题思路:化学反应前后,元素的种类不变,原子的种类、总个数不变.反应前后元素种类不变,生成物中的元素有氮元素、氢元素、氧元素和碳元素,因此该化合物中也是含有氮元素、氢元素、氧元素和碳元素等4种元素.
故填:氮元素、氢元素、氧元素和碳点评:
本题考点: 质量守恒定律及其应用.
考点点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.1年前查看全部
- 在容积为3L的密闭容器内进行如下反应:4A(g)+5B(g)= 2C(g),开始时A为8 mol,B为12mol,2S后
在容积为3L的密闭容器内进行如下反应:4A(g)+5B(g)= 2C(g),开始时A为8 mol,B为12mol,2S后A为2mol,计算该反应的化学反应速率.
 muduxx1年前1
muduxx1年前1 -
 爱在ee-丹 共回答了21个问题
爱在ee-丹 共回答了21个问题 |采纳率95.2%以A 表示反应速率为 3mol/s B就3.751年前查看全部
- 将8mol氢气和2mol氮气充入2升密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6
将8mol氢气和2mol氮气充入2升密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6mol氢气,求NH3的体积分数
 了拂尘1年前1
了拂尘1年前1 -
 fengxueyi 共回答了25个问题
fengxueyi 共回答了25个问题 |采纳率92%3H2 + N2=====2NH3
起:8 2 0
变:2.4 0.8 1.6
平:5.6 1.2 1.6
1.6/(5.6+1.2+1.6)=19%1年前查看全部
- 取标准状况下2.24L某气态烃置于密闭容器中,再通入足量O2,用电火花点燃,燃烧产物的定量测定实验数据如下
取标准状况下2.24L某气态烃置于密闭容器中,再通入足量O2,用电火花点燃,燃烧产物的定量测定实验数据如下
烃→(燃烧)燃烧产物→(浓H2SO4)增重9g→(碱石灰)增重17.6g
请回答下列问题
(1)该烃的分子式为_______
(2)写出该烃的所有同分异构体的结构简式_____________________________ 不上望京楼1年前3
不上望京楼1年前3 -
 冷傲天骄 共回答了26个问题
冷傲天骄 共回答了26个问题 |采纳率96.2%解析:
(1)烃的燃烧方程式:
CxHy + (x+y/4)O2 ―(点燃)→ xCO2 + (y/2)H2O
浓H2SO4为干燥剂,增重9g为水的质量,
从而得到水的物质的量 = 9g / 18g/mol = 0.5mol
水中的H元素与水物质的量比 = 2:1,所以H元素物质的量 = 0.5mol*2 = 1mol
氢元素全部来源于烃.
碱石灰增重17.6g为CO2质量,
从而得到CO2的物质的量 = 17.6g / 44g/mol = 0.4mol
CO2中的C元素与CO2物质的量比 = 1:1,所以C元素物质的量 = 0.4mol*1 = 0.4mol
碳元素全部来源于烃,
所以C:H物质的量比 = 0.4mol:1mol = 4:10
所以该烃为C4H10
(2)可能的结构简式:
正丁烷:CH3-CH2-CH2-CH3
异丁烷(2-甲基丙烷):CH3-CH-CH3
|
CH31年前查看全部
- 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容器的密闭容器中,发生如下反应:N2+3H2=2NH3
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容器的密闭容器中,发生如下反应:N2+3H2=2NH3
1 若反应进行到某时刻t时,n1(N2)=13mol,n2(NH3)=6mol,计算a=_______.
2 反应达到平衡时,混合气体共32mol,其中NH3占25%,则原混合气体中,a:b=______.
3 达到平衡时,N2和H2的转化率之比,a(NH3):a(H2)=_______. chris_991年前1
chris_991年前1 -
 attianya 共回答了14个问题
attianya 共回答了14个问题 |采纳率85.7%1.a=16mol
2.a:b=2:3
3.a(N2):a(H2)=1:21年前查看全部
- 第一道:X ,Y,Z为三种气体,把a mol的X和b mol的Y充入一密闭容器中发生反应X+2Y=2Z,达到平衡时,若它
第一道:X ,Y,Z为三种气体,把a mol的X和b mol的Y充入一密闭容器中发生反应X+2Y=2Z,达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为多少?第二题:在一定条件下可发生反应:2SO2+O2=2SO3现取3LSO2和6LO2混合,当反应达到平衡后,测得混合气体的体积减小10%,求SO2的转化率.
问下,转化率2A/b然后怎么得到下步的? dydjoy12341年前3
dydjoy12341年前3 -
 默默无闻的家伙 共回答了15个问题
默默无闻的家伙 共回答了15个问题 |采纳率93.3%反应后:设生成 Z c mol 则X剩 a-c/2 Y剩b-c 由题知 (a-c/2)+(b-c)=c 可得:c=2/5(a+b)
Y的转化率:c/b=2(a+b)/5b
2题:转化率60% 设 平衡时有SO3 a mol 所以[(3-a)+(6-a/2)+a]/9=1-10% 得a=1.81年前查看全部
- 在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表: 物质 X Y Z Q 反应前质量/g
在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
下列说法正确的是( )物质 X Y Z Q 反应前质量/g 8 2 40 5 反应后质量/g 待测 24 8 23
A. 该反应一定是置换反应
B. Y、Q的相对分子质量比一定为11:9
C. 参加反应的X、Z的质量比为1:4
D. 反应后X的质量为0 chuiliu1年前1
chuiliu1年前1 -
 视央视意甲垃圾 共回答了13个问题
视央视意甲垃圾 共回答了13个问题 |采纳率84.6%解题思路:该题为一道图表和数据相结合的试题,首先根据质量守恒定律求出反应后X的质量(即待测处的数值)然后根据X、Y、Z、Q反应前后的质量变化确定出反应物和生成物,进而可判断该反应的类型,再根据X、Y、Z、Q反应前后质量的变化可求出X、Z的质量比,Y、Q的质量比.A、根据各物质反应前后质量的变化可知:Y、Q为生成物,X、Z为反应物.故反应为;X+Z→Y+Q 该反应不一定为置换反应,也可能是复分解反应.故A不正确.
B、生成的Y、Q的质量分别为:24-2=22克和23-5=18克故其质量比为22:18=11:9,Y、Q的质量比为11:9,它们的相对分子质量比不一定为11:9.故B不正确.
C、参加反应的X的质量为;8-0=8克 Z的质量为:40-8=32克 故参加反应的X、Z的质量比为1:4,故C正确
D、根据质量守恒定律:反应前物质的总质量8+2+40+5=55,和反应后物质的总质量24+8+23+待测 相等可求出,待测=55-(24+8+23)=0 故D正确.
故选C、D.点评:
本题考点: 质量守恒定律及其应用;置换反应及其应用;常见化学反应中的质量关系.
考点点评: 该题要求学生能从图表中找出有效的数据进行处理解答,考查了学生的观察和分析能力.1年前查看全部
- (2000•烟台)将一只电铃放在密闭的玻璃罩内,用抽气机抽尽玻璃罩内的空气(如图所示),只看见铃锤不断地敲打电铃,却听不
 (2000•烟台)将一只电铃放在密闭的玻璃罩内,用抽气机抽尽玻璃罩内的空气(如图所示),只看见铃锤不断地敲打电铃,却听不到铃声,这说明光的传播与声音的传播______(填“相同”或“不相同”),光可以在______传播,声音不能在______传播.
(2000•烟台)将一只电铃放在密闭的玻璃罩内,用抽气机抽尽玻璃罩内的空气(如图所示),只看见铃锤不断地敲打电铃,却听不到铃声,这说明光的传播与声音的传播______(填“相同”或“不相同”),光可以在______传播,声音不能在______传播.  wyf_suse1年前1
wyf_suse1年前1 -
 落难在这里 共回答了21个问题
落难在这里 共回答了21个问题 |采纳率100%解题思路:(1)声音是由物体的振动产生的,声音能够在固体、液体、气体中传播,不能在真空中传播;
(2)光的传播不需要介质,光可以在真空中传播.将一只电铃放在密闭的玻璃罩内,用抽气机抽尽玻璃罩内的空气,只看见铃锤不断地敲打电铃,却听不到铃声,这说明光的传播与声音的传播不相同,光可以在真空中传播,声音不能在真空中传播.
故答案为:不相同;真空中;真空中.点评:
本题考点: 声音的传播条件.
考点点评: 本题考查了声音的传播条件,属于基础知识的考查,相对比较简单.1年前查看全部
- 在1L密闭容器中,把1mol A和1mol B混合发生如下反应:3A(g)+B(g)⇌xC(g)+2
在1L密闭容器中,把1mol A和1mol B混合发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),当反应达到平衡时,生成0.4mol D,并测得C的平衡浓度为0.4mol•L-1,下列叙述中不正确的是( )
A. x的值为2
B. A的转化率为40%
C. B的平衡浓度为0.8 mol•L-1
D. D的体积分数为20% dbxc1年前1
dbxc1年前1 -
 gzzyydx 共回答了16个问题
gzzyydx 共回答了16个问题 |采纳率87.5%解题思路:C的平衡浓度为0.4mol/L,则平衡时生成C的物质的量为1L×0.4mol/L=0.4mol,
3A(气)+B(气)⇌xC(气)+2D(气)
起始:1mol 1mol 0 0
转化:0.6mol 0.2mol 0.2xmol 0.4mol
平衡:0.4mol 0.8mol0.4mol 0.4mol
则x=2,
以此解答该题.C的平衡浓度为0.4mol/L,则平衡时生成C的物质的量为1L×0.4mol/L=0.4mol,
3A(气)+B(气)⇌xC(气)+2D(气)
起始:1mol 1mol 0 0
转化:0.6mol 0.2mol 0.2xmol 0.4mol
平衡:0.4mol 0.8mol0.4mol 0.4mol
A.0.2xmol=0.4mol,x=2,故A正确;
B.A的转化率为[0.6/1]×100%=60%,故B错误;
C.B的平衡浓度为[0.8mol/1L]=0.8mol/L,故C正确;
D.D的体积分数为[0.4/0.4+0.8+0.4+0.4]×100%=20%,故D正确.
故选:B.点评:
本题考点: 化学平衡建立的过程;化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度不大,解答本题时注意根据生成物的浓度或物质的量利用三段式法计算可轻松解答该题.1年前查看全部
- 恒压下,在一个可变容积的密闭容器中发生如下反应:2NH3(g)+CO2(g)
 scbilly1年前1
scbilly1年前1 -
 抹布者 共回答了22个问题
抹布者 共回答了22个问题 |采纳率86.4%恒压下,在-个可变容积的密闭容器中发生如下反应:2NH3(g)+CO2(g是有点问题,对头,应该加1MOL尿素 题目没说就不用考虑 加也是加2mol1年前查看全部
- (9分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别
(9分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、 B的体积相同.已知:2NO2(g)N2O4(g) △H<0.
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A)___V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将_____(填“变大”、“变小”或“不变”,下同).
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将____;若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_______,B中NO2的转化率将_______.
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_______中的颜色较深.
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为________.

 sylas1年前3
sylas1年前3 -
 ab0932 共回答了32个问题
ab0932 共回答了32个问题 |采纳率87.5%(1)第二个小空、由于存在可逆反应2NO2(g)==N2O4(g),随反应进行B气体减少,体积减小,A气体减少,但体积不变,则A中压强1年前查看全部
- 粗细均匀的U形玻璃管内装有水银,开口向上竖直放置,现有质量和厚度均不计且密闭性能良好的橡皮活塞置于A管中C处,此时B管水
粗细均匀的U形玻璃管内装有水银,开口向上竖直放置,现有质量和厚度均不计且密闭性能良好的橡皮活塞置于A管中C处,此时B管水银面比A管水银面高出h,B管水银面离管口距离为h,A管中活塞下方空气柱长h/2,大气压强p0,把B管口封住,再将活塞缓慢往上提拉,直到A,B两管水银面相平为止,求活塞在A管内上移的位移
(A就是U管的左边,b就是U管的右边,木塞有绳子拉着) 江南雨巷1年前4
江南雨巷1年前4 -
 xiyuyoufeng 共回答了20个问题
xiyuyoufeng 共回答了20个问题 |采纳率90%根据PV=nRT得两边空气柱压强始终相等,体积比为1:2
最终要使左端上声h/2,右端下降h/2,右端空气柱长度变为3h/2,所以左端空气柱长度变为3h/4,所以木塞上升了3h/41年前查看全部
- 在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),
在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol•L-1.求B的反应转化率.
 黄金火柴头1年前1
黄金火柴头1年前1 -
 mw3547 共回答了19个问题
mw3547 共回答了19个问题 |采纳率94.7%生成2molC 则有2/2*1=1molB参与反应
原来有5molB 所以B的转化率为1/5*100%=20%1年前查看全部
- 一道初2上学期的物理题如图所示,密闭容器内有适量的水,如果容器倒过来放置,则水对容器底的压力、压强A.压强变小,压力变大
一道初2上学期的物理题
如图所示,密闭容器内有适量的水,如果容器倒过来放置,则水对容器底的压力、压强
A.压强变小,压力变大
B.压强变大,压力变小
C.压力、压强都不变
D.压力、压强都变大
———
/
/ ∷∷水
/∷ 水 ∷∷
———————
说明理由啊
图片弄不好,是一个梯形容器,里面有大概一半水,上小下大. liuzimin1年前1
liuzimin1年前1 -
 刚才刚才 共回答了22个问题
刚才刚才 共回答了22个问题 |采纳率81.8%选B
因为容器倒过来水高度上升,根据P=ρgh,ρ、g不变,h增大,所以压强P变大.
又因为容器底受到的压力等于容器底上方水的重力,容器倒过来后上大下小,水的一部分重力被容器壁分摊,所以底部受到压力小于实际水的重力,与倒过来前恰恰相反,所以低部受到压力变小.所以选B1年前查看全部
- 一定温度时,向密闭容器里的食盐饱和溶液中加入5G食盐晶体,经过一段时间后( )
一定温度时,向密闭容器里的食盐饱和溶液中加入5G食盐晶体,经过一段时间后( )
A.饱和溶液质量增大
B.晶体的质量不变
很奇怪,为什么给出答案是A?
加入5克食盐晶体, 愤然居士1年前1
愤然居士1年前1 -
 yyhuohu75430 共回答了20个问题
yyhuohu75430 共回答了20个问题 |采纳率100%B.
首先是在一定温度下,密闭容器里水分不会蒸发. 而且它原本就是食盐饱和溶液,溶质质量为100%.当它加入5克食盐晶体,它不会再继续溶解. 不排除很多习题集难免会有答案印刷错误的情况.1年前查看全部
- 密闭容器里的氩气,要抽成多少帕,等加热到550度时压强会为一个标准大气压?
 zi2grz1年前1
zi2grz1年前1 -
 广州户外 共回答了18个问题
广州户外 共回答了18个问题 |采纳率94.4%还需要知道初始温度,不妨假设为293K(20摄氏度).
把氩气近似为理想气体,则有:
P1*V1/t1=P2*V2/t2
因为体积不变,上式简化成:
P1/t1=P2/t2
P1=P2*t1/t2
其中,t1=293K,t2=550+273=823K,P2=101000帕
P1=101000*293/823=35957帕(约为0.356个大气压)
20度时抽成35957帕(0.356个大气压),550度时压强会约为一个标准大气压.1年前查看全部
- 1 .在一个密闭的钢筒内有A,B,C,D四种物质,通过电火花引燃后,充分发生反应.经测定,钢筒内反应前后个物质的质量如下
1 .在一个密闭的钢筒内有A,B,C,D四种物质,通过电火花引燃后,充分发生反应.经测定,钢筒内反应前后个物质的质量如下:
物质 A B C D
反应前质量(g) 4 10 1 25
反应后质量(g)(未测) 21 10 9
若A的分子量为n,D的分子量为2n,则该反应中A与D的化学计量数之比为______.
2.现取2.3g有机物在足量的氧气中充分燃烧,生成4.4gCO2和2.7gH2O,判断正误.
A.分子中C.H的原子个数比为2:5
B.分子中C.H.O的元素质量比为12:3:8.
3.将铁粉加入含有铜离子和银离子的溶液中,充分反应后加入盐酸,发现无气泡产生,但却有白色沉淀产生,则加入盐酸前的物质中含有____.
A.铜离子、银离子、铁离子、银单质 B.铁离子、银离子、铜离子、铜单质
C.铜单质、银单质、银离子、铁离子 D.铜离子、银离子、铁单质、铁离子
4.某样品含有氢氧化钾、碳酸钾和水三种物质.室温下,向该样品中加入浓度为14.6%的稀盐酸100g,恰好完全反应得到中性溶液,蒸干该溶液得到的固体质量为_____.
A.74.5g B.29.8g C.10g D.7.45g
5.下图是某元素的原子结构示意图,下列对该元素的认识正确的是_____.
A.该元素属于金属元素
B.该元素的原子在化学反应中容易失电子
C.该元素的原子核外电子总数为18
D.该元素位于元素周期表的第四周期第VIA族
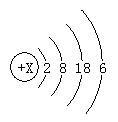
 xudiok1122111年前3
xudiok1122111年前3 -
 家居猫 共回答了22个问题
家居猫 共回答了22个问题 |采纳率86.4%1:2
错 对
A
B
D1年前查看全部
- 如图为竖直放置的上细下粗的密闭细管,水银柱将气体分隔成A、B两部分...
如图为竖直放置的上细下粗的密闭细管,水银柱将气体分隔成A、B两部分...
我先问的是,既然两次都平衡,那么不应该是两次平衡后AB对液柱作用力F之差都是液柱重力G么?那么不应该是AB F的变化量相同么?
从这个角度推的话应该选ABD嘛
请讲的详细一点, 剑月1年前0
剑月1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在一容积、温度不变的密闭容器中,发生可逆反应3A(g)==2C(g),先加入amolA,待反应平衡时A的转化率为X,
在一容积、温度不变的密闭容器中,发生可逆反应3A(g)==2C(g),先加入amolA,待反应平衡时A的转化率为X,
再加入bmolC,问反应再度平衡时,A的转化率大于还是小于X 归心依净1年前1
归心依净1年前1 -
 hawkwisher 共回答了29个问题
hawkwisher 共回答了29个问题 |采纳率82.8%大于X
可以这样考虑,相当于两个容器,一个放amolA,一个放bmolA,容器体积比利与ab比例一致,这样来那个容器压力相等,此时分别达平衡,转化率为X.然后将第二个容器中的气体压入第一个容器,保持体积不变,此时压力升高,平衡向生成C的方向移动,所以转化率将大于X1年前查看全部
- 在一密闭的2l的容器里充入8moSO2和4molO2,在一定条件下开始反应:2SO2(g)+O2(g)==2SO3(g)
在一密闭的2l的容器里充入8moSO2和4molO2,在一定条件下开始反应:2SO2(g)+O2(g)==2SO3(g),2min末测得容器中有7.2molSO2.
求.2min末SO3的浓度.
2SO2(g)+O2(g)==2SO3 (g)
始:8 mol 4mol 0
转:7.2 mol 3.6mol 7.2mol
2min时:0.8mol 0.4mol 7.2mol
可得:2min时SO3的浓度=7.2mol÷2l=3.6mol/l
这个答案怎么去理解啊,还有转化时SO3的物质的量为什么是7.2mol? feiyullh1年前3
feiyullh1年前3 -
 三七二一CC 共回答了25个问题
三七二一CC 共回答了25个问题 |采纳率92%计算2min时SO3的浓度,是那步“转”的SO3的物质的量去除以体积,不是反应平衡时的浓度.
转化时SO3 的物质的量,根据方程式的系数比可知,SO3的物质的量应该等于SO2物质的量.因此是7.2mol.
这样回答理解了吗?1年前查看全部
- 酵母菌在有氧时进行有氧呼吸,无氧时进行无氧呼吸.将酵母菌放在含有培养液的密闭锥形瓶中,测得CO2的释放量比O2的吸收量大
酵母菌在有氧时进行有氧呼吸,无氧时进行无氧呼吸.将酵母菌放在含有培养液的密闭锥形瓶中,测得CO2的释放量比O2的吸收量大1倍,则有氧呼吸与无氧呼吸消耗葡萄糖的比是( )
A. 1:6
B. 1:3
C. 1:2
D. 1:1 vajs0e1年前0
vajs0e1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 今有氢气和氧气的混合气体100克,密闭点燃反应完全后恢复到原来温度,水呈液态,气体剩10克.如果氧气过量,则原气体混合物
今有氢气和氧气的混合气体100克,密闭点燃反应完全后恢复到原来温度,水呈液态,气体剩10克.如果氧气过量,则原气体混合物中,氢气是 克;如果氢气过量,则原混合物中,氧气是 克
用化学方程式回答或解释下列问题:
⑴将表面生锈的铁钉放入稀硫酸中,先看到铁锈溶解,后产生气泡.
① ;② ;
⑵向石蕊试液中通入CO2气体,试液变红色,加热试液又恢复紫色.
① ;② ; 下雨带伞1年前5
下雨带伞1年前5 -
 testufo 共回答了19个问题
testufo 共回答了19个问题 |采纳率94.7%1楼的要看清楚题目了噢,是用化学方程式,不是文字解释.
今有氢气和氧气的混合气体100克,密闭点燃反应完全后恢复到原来温度,水呈液态,气体剩10克.如果氧气过量,则原气体混合物中,氢气是(60)克;如果氢气过量,则原混合物中,氧气是(30)克
用化学方程式回答或解释下列问题:
⑴将表面生锈的铁钉放入稀硫酸中,先看到铁锈溶解,后产生气泡.
锈铁外层主要是三氧化二铁,里面是铁.
① Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ;② Fe+H2SO4=FeSO4+H2↑ ;
⑵向石蕊试液中通入CO2气体,试液变红色,加热试液又恢复紫色.
① CO2+H2O=H2CO3 ;② H2CO3=加热=H2O+CO2 ↑ ;1年前查看全部
- 26.(1)变质的鸡蛋会产生一种有臭味的气体.为了探究该气体的化学式,某同学收集了1升该气体于密闭容器中.点火后,容器壁
26.(1)变质的鸡蛋会产生一种有臭味的气体.为了探究该气体的化学式,某同学收集了1升该气体于密闭容器中.点火后,容器壁上析出固体硫.待反应进行充分后,剩下来的气体是纯净的氢气.分析上述试验结果,可得出的初步结论是:——
(2)将2升该气体与1升氧气同置于密闭的容器中.当电火花通过时,混合物***生成水,同时析出固体硫,而气体不见了.收集生成的水和固体硫,经称量的水和固体硫的质量比为9:16.分析上述实验结果,可得出该气体的化学式:——
氢[h] +1价 相对质量:1
氧[o] -2价 相对质量:16
硫[s] -2、+4、+6价 相对质量:32
能不能写出过程? 621218351年前1
621218351年前1 -
 343693655 共回答了22个问题
343693655 共回答了22个问题 |采纳率77.3%该气体由S和H组成
H2S1年前查看全部
- 在一个密闭容器中有甲乙丙丁四种物质在一定条件下反应一段时间测得反应前后各物质质量如下表
在一个密闭容器中有甲乙丙丁四种物质在一定条件下反应一段时间测得反应前后各物质质量如下表
物质 甲 乙 丙 丁
反应前 23 27 0 19
反应后 x 2 58 5
问:①这一反应类型是( ) x=( )g
②写出一例属于此反应类型的化学方程式 蓝黑黎明1年前1
蓝黑黎明1年前1 -
 mansonfan 共回答了27个问题
mansonfan 共回答了27个问题 |采纳率96.3%分解反应 x=4
甲+已+丁=丙1年前查看全部
- 密闭的容器有部分水,在气压升高时,液面是升高还是降低?
 csdn31411年前4
csdn31411年前4 -
 home119 共回答了25个问题
home119 共回答了25个问题 |采纳率92%降低,同样质量下,水蒸气体积远大于水.密闭容器压强升高说明有部分水转化为水蒸汽,所以液面下降1年前查看全部
- 密闭容器中,甲乙丙丁在一定条件下反应,测得反应前后各物质的质量如下表
 爱你没错de1年前1
爱你没错de1年前1 -
 yjydd 共回答了18个问题
yjydd 共回答了18个问题 |采纳率88.9%2)参加反应的是甲、乙、丁.
比例为(23-4):(27-2):(19-5)=19:25:14
3)CaCO3 + H2O + CO2 === Ca(HCO3)2
后面的看不清题啊1年前查看全部
- 向2L密闭容器中加入2molN2、10molH2,发生反应,2min后N2剩1mol,求生成物和反应物的反应速率.
 dawei3291年前1
dawei3291年前1 -
 aomama 共回答了18个问题
aomama 共回答了18个问题 |采纳率83.3%v(N2)=0.25mol/L·min
v(H2)=0.75mol/L·min
v(NH3)=0.5mol/L
N2反应掉的物质的量是2-1=1mol
变化浓度是1/2=0.5mol
反应速率v=△c/t=0.5/2=0.25mol/L·min
反应速率之比等于化学计量数之比.
v(N2)/1=v(H2)/3=v(NH3)/2
v(H2)=0.75mol/L·min
v(NH3)=0.5mol/L1年前查看全部
- 能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :①容器内N2、H2、NH3三者共存
能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :①容器内N2、H2、NH3三者共存
能够说明N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是
①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度比恰为1:3:2
④t min内生成1molNH3同时消耗0.5molN2
⑤t min内,生成1molN2同时消耗3mol H2
⑥ 某时间内断裂3molH-H键的同时,断裂6molN-H键
⑦容器内质量不随时间的变化而变化
⑧容器内压强不随时间的变化而变化
⑨容器内密度不再发生变化
⑩容器内的平均摩尔质量不再发生变 旋转悠游1年前1
旋转悠游1年前1 -
 btgsd 共回答了25个问题
btgsd 共回答了25个问题 |采纳率92%这个题条件不全啊,是恒压还是恒容不一定.那么8、9、10就没法判断了.一定对的是5、61年前查看全部
- 在密闭、隔热的条件下,向装有水的保温瓶胆中加入某种物质,溶液温度下降,这种物质可能是( )
在密闭、隔热的条件下,向装有水的保温瓶胆中加入某种物质,溶液温度下降,这种物质可能是( )
A. 硝酸铵
B. 生石灰
C. 浓硫酸
D. 氢氧化钠固体 飞天han1年前1
飞天han1年前1 -
 hyx214 共回答了14个问题
hyx214 共回答了14个问题 |采纳率92.9%解题思路:根据物质溶于水后的放热与吸热现象来考虑,要由物质溶于水的整个过程来分析.物质溶于水分为两个过程,向水中扩散的过程吸收热量,与水分子结合形成水合分子的过程放出热量,如果吸收热量大于放出热量,就表现为吸热,如果吸收热量小于放出热量,就表现为放热,如果相等就表现为既不放热,也不吸热.生石灰、氢氧化钠、浓硫酸溶于水都放出热量,硝酸铵溶于水吸收热量,所以溶液温度降低.
故选:A.点评:
本题考点: 溶解时的吸热或放热现象;生石灰的性质与用途.
考点点评: 熟记以下物质:溶于水放热的物质有:浓硫酸、生石灰、氢氧化钠固体;溶于水吸热的有硝酸铵.1年前查看全部
- 静电平衡的场强问题密闭金属壳里放正电荷 外面产生电场 金属壳内部场强为零 接地之后金属 外壳就没有电荷(老师是说大地中和
静电平衡的场强问题
密闭金属壳里放正电荷 外面产生电场 金属壳内部场强为零 接地之后金属 外壳就没有电荷(老师是说大地中和了)就 ***了内电场
既然外表没电荷 金属壳内部(金属壳的部分)为什么场强还为零
是只需壳内表的带的电荷就可以产生场强 还是其他啥?
对外电场***也是
接地后里面场强还是不变 不是一边都没电荷了吗?
你这解释不清楚啊
完全没说到我的疑问上 江天承1年前1
江天承1年前1 -
 我本生事 共回答了11个问题
我本生事 共回答了11个问题 |采纳率90.9%金属壳内放一个正电荷,电荷分布如下:
1.若金属壳不接地:此时由于静电感应导致,金属壳内表面带上负电荷,金属壳外表面带上正电荷.金属壳外表面的正电荷与金属壳内表面的负电荷产生的电场与,金属壳内部的正电荷产生的电场叠加,结果在金属内部合场强为零.
2.若将金属外表面接地,这时候金属与地球作为一个整体了,由于金属上电荷较少,分到地球和金属的整体上就没多少了,导致外表面电荷近似为零.所以金属外表面近似没有电荷.其次,由于将金属和地球看做一个整体或看做一个更大的金属导体,这时候外界电场作用到这个大金属上,导致大金属导体静电感应.达到平衡后,这个大金属导体为等势体.所以内部场强为零.1年前查看全部
- 某温度下,向一密闭的体积可变的容器中加入+答案
某温度下,向一密闭的体积可变的容器中加入+答案
练习:某温度下,向一密闭的体积可变的容器中加入1molN2和3molH2,使之在一定条件下合成NH3.反应达到平衡后,测的平衡混合气体中氨气的浓度为m mol/L.若温度不变,只改变起始加入量,使之反应重新达到平衡,此时平衡气体中氨气的浓度仍为m mol/L,若加入N2、H2、NH3的物质的量分别用X、Y、Z表示,应满足:
⑴体积恒定时:若X = 0,Y = 0,则Z = mol
压强恒定时:若X = 0,Y = 0,则Z =
⑵体积恒定时:若X = 0.65 mol,Y = mol,Z = mol压强恒定时:若X = 0.65 mol,Y = mol,则Z =
⑶压强恒定时,X、Y、Z应满足的关系可用一个等式和一个不等式表示,则等式为 不等式为 dsh19731年前1
dsh19731年前1 -
 celery_lin 共回答了11个问题
celery_lin 共回答了11个问题 |采纳率100%Z=2mol
Z>0
Y=1.95mol;Z=0.7mol
Y=1.95mol;Z>0
X:Y=1:3,Z>01年前查看全部
- 反应:3Fe+4H2O=Fe3O4+4H2在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是.A增加
反应:3Fe+4H2O=Fe3O4+4H2在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是.A增加Fe的量.B将容器体积缩小一半.C保持体积不变,冲入N2使体系压强增大.D保持压强不变,充入N2使容器体积增大.
 xiaopiao_cool1年前1
xiaopiao_cool1年前1 -
 雨隆 共回答了17个问题
雨隆 共回答了17个问题 |采纳率94.1%A的话,固体一般不考虑其作为反应物时对反应速率的影响;C的话,影响H2的反应时H2的分压,和N2没有关系1年前查看全部
- 在一密闭的2L容器中装有4mol二氧化硫,和2mol氧气,在一定条件下开始反应,2min末测得容器中有3.6mol二氧化
在一密闭的2L容器中装有4mol二氧化硫,和2mol氧气,在一定条件下开始反应,2min末测得容器中有3.6mol二氧化硫
请计算
1) min末三氧化硫的浓度.
2)2min内二氧化硫的平均反应速率.
3)氧气的转化率. v15sc1年前3
v15sc1年前3 -
 草衣青牛 共回答了19个问题
草衣青牛 共回答了19个问题 |采纳率89.5%2SO2 + O2 =(可逆)= 2SO3
始 4mol 2mol 0mol
平 3.6mol 1.8mol 0.4mol
转 0.4mol 0.2mol 0.4mol
c(SO3)=n(SO3)/V=0.4/2 mol/L = 0.2mol/L
v(SO2)=(0.4/2)/2 mol/(L*min)=0.1mol/(L*min)
a(O2)%=0.2/2 *100%=10%1年前查看全部
- 一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g),若反应开始时充入2mol A和2m
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 2.5mol C
B. 2 mol A、1 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C
D. 2 mol A、3 mol B和3 mol C 痛并快乐着051年前1
痛并快乐着051年前1 -
 boymind 共回答了16个问题
boymind 共回答了16个问题 |采纳率100%解题思路:反应2A(g)+B(g)⇌3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,即可得到相同平衡状态,结合浓度对平衡移动的影响,只要加入的物质的量:n(A):n(B)>1:1,平衡后A的体积分数大于a%.反应2A(g)+B(g)⇌3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,就是等效平衡,结合浓度对平衡移动的影响,只要加入的物质的量:n(A):n(B)>1:1,平衡后A的体积分数大于a%,
A.2.5molC相当于[5/3]molA和[5/6]molB,二者的比值为2:1,大于1:1,则平衡后A的体积分数大于a%,故A正确;
B.当 2molA、1molB和10molHe(不参加反应)时,n(A):n(B)=2:1,大于1:1,但由于有10molHe的存在,则平衡后A的体积分数不一定大于a%,故B错误;
C.1.5molB和1.5molC,相当于1molA和2molB,n(A):n(B)=1:2,小于1:1,则平衡后A的体积分数小于a%,故C错误;
D.2molA、3molB和3molC,相当于4molA和4molB,二者的比值为4:4,等于1:1,则平衡后A的体积分数等于a%,故D错误,
故选A.点评:
本题考点: 等效平衡.
考点点评: 本题考查等效平衡问题,题目难度中等,本题注意与原配比数相比较,结合浓度对平衡移动的影响可进行判断.1年前查看全部
- A+B=3c(可逆 ABC都是气体).今有甲乙两密闭容器.
A+B=3c(可逆 ABC都是气体).今有甲乙两密闭容器.
今有甲乙两密闭容器,甲容积不可变,乙容积可变.在甲乙两容器中均分别放入1molA 1molB 两容器开始时体积相等.
1.开始时 v正和v逆的关系.
2.达平衡所需时间 甲乙谁长谁短.
3.达平衡后 反应物转化率大小 甲乙谁大谁小 ;甲和乙中C的体积分数谁大谁小. qz38990131年前1
qz38990131年前1 -
 江月无尘 共回答了16个问题
江月无尘 共回答了16个问题 |采纳率81.3%1;v正=v逆
2;甲短乙长
3;转化率甲小乙大;体积分数乙大甲小1年前查看全部
- 在一定温度下,反应1/2H2+1/2X2=HX的平衡常数为10,若将1MOL的HX通入体积为1L的密闭容器中,在该温度时
在一定温度下,反应1/2H2+1/2X2=HX的平衡常数为10,若将1MOL的HX通入体积为1L的密闭容器中,在该温度时HX的最大分解率接近于
5% 17% 25% 33%
步骤要完整否则看不懂 水薇1年前1
水薇1年前1 -
 huayetang 共回答了17个问题
huayetang 共回答了17个问题 |采纳率94.1%HX=1/2H2+1/2X2
设达到平衡时H2的量为a
则X2的量也为a
HX的量为1-2a
(1-2a)/a=10
a=1/12
两分子HX分解为1分子H2
分解率为2a=16.7%1年前查看全部
- 某温度下,反应C+H2O=CO+H2 在密闭容器中 下列选项正确的是
某温度下,反应C+H2O=CO+H2 在密闭容器中 下列选项正确的是
A 在其他条件不变的情况下 加入碳粉 混合气体的密度增大
B 在恒温恒压 充入水蒸气 混合气体中H2的体积分数增大
C 在恒温恒压 充入氖气 平衡向逆反应移动
D 在恒温恒压 充入氖气 水蒸气的转化率增大 我是暖暖小朋友1年前1
我是暖暖小朋友1年前1 -
 大灰狼1331 共回答了19个问题
大灰狼1331 共回答了19个问题 |采纳率89.5%我觉着应该选B
A选项 加入碳粉 ,碳粉是固体的不影响气体的密度也不影响反应速率 固体和纯液体都不影响 C选项加入氖气以为是恒压的 而且 反映前后的化学计量数相等 所以平衡不移动只是容器体积发生一点变化 D选项的解释同C的 做这样类型的题记住几个要点 就是等容 等压 还有气体的化学计量数比较 再就是加入惰性气体 的条件是什么 课本上有 练习册上也有 自己好好看看 再有问题 找我吧1年前查看全部
- COD密闭催化消解法中,消解液中的硫酸铝钾和钼酸铵起什么作用,其原理是?
 夜舞de精灵1年前1
夜舞de精灵1年前1 -
 doutht 共回答了24个问题
doutht 共回答了24个问题 |采纳率91.7%催化作用
为使有机物充分氧化,样品消解时需加人催化剂.标准法中使用的硫酸铝钾和钼酸铵是最
常用的一种催化剂,在它的催化下,对有机物的氧化
率能达90,1年前查看全部
- 要除去密闭容器里空气中的氧气 ,得要较为 纯净的氮气.而不混入其他气体,可以选用的课燃物最好是?
要除去密闭容器里空气中的氧气 ,得要较为 纯净的氮气.而不混入其他气体,可以选用的课燃物最好是?
A硫 B铁丝 C红磷 D木炭 ruby281年前1
ruby281年前1 -
 redstone2001 共回答了15个问题
redstone2001 共回答了15个问题 |采纳率93.3%C 红磷1年前查看全部
- 对于密闭容器中进行的反应:N2+O2=2NO,下列条件中哪些能加快反应速率(假定改变下列条件时温度不变)
对于密闭容器中进行的反应:N2+O2=2NO,下列条件中哪些能加快反应速率(假定改变下列条件时温度不变)
A缩小容器体积使压强增大
B压强不变,充入N2使容器体积增大
C容器体积不变充入氦气使压强增大
D增大容器的体积 feng833525551年前2
feng833525551年前2 -
 clivia0429 共回答了14个问题
clivia0429 共回答了14个问题 |采纳率92.9%A1年前查看全部
- 1.在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增强了75%,则此反应
1.在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增强了75%,则此反应的化学方程式是----------
2.将氢气,氧气,氮气分别放入不同容器中,当温度和密度完全相同时,三种气体压强(p)的大小关系是----------
3.实验测得一氧化碳和氧气混合气体的密度是氢气的14.5倍,可知其中一氧化碳的体积分数为-------------------
4.在20℃时,一钢性容器内部有一个不漏气且可滑动的活塞将容器分割成左右两室,左室冲入氮气,右室冲入氢气和氧气,活塞正好停留在离左端的1/4处,然后点燃氢气和氧气,反应完毕后恢复到原来温度,活塞恰好停在中间,水蒸气的体积可忽略,则反应前后氢气和氧气的体积比可能为------------- sarah_chan1年前1
sarah_chan1年前1 -
 旅游指南 共回答了18个问题
旅游指南 共回答了18个问题 |采纳率94.4%1、设A单质为Ax,则方程式为:2xAH3=2Ax + 3xH2,压强增强了75%即(3x+2)/2x=1.75,解得x=4,即此反应的化学方程式:4AH3=A4 + 6H2
2、温度和密度完全相同时,单位体积内气体质量相同,假设为1的话,氢气,氧气,氮气的物质的量分别为:1/2、1/32、1/28,所以三种气体压强(p)的大小关系为:p(H2)>p(N2)>p(O2).
3、密度是氢气的14.5倍即相对分子质量是2*14.5=29,设一氧化碳的体积分数为x,则:
28x+32(1-x)=29,解得x=75%
4、原来活塞正好停留在离左端的1/4处,说明原来H2、O2总体积是N2的三倍,设氮气为1,则H2、O2总体积是3,反应后活塞恰好停在中间,说明反应后剩余气体体积为1(和氮气一样),所以体积减少2,根据方程式2H2+O2=2H2O可得参加反应氢气体积为2*2/3、氧气体积为2*1/3
当剩余1体积是H2时,反应前氢气和氧气的体积比=7:2;当剩余1体积是O2时,反应前氢气和氧气的体积比=4:51年前查看全部
- 化学等效平衡的判断恒压下,在-个可变容积的密闭容器中发生如下反应:D2NH3(g)+CO2(g) CO(NH2)2(g)
化学等效平衡的判断
恒压下,在-个可变容积的密闭容器中发生如下反应:D
2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)
若开始时放入2mol NH3和1mol CO2,达平衡后,生成amol H2 O;若开始时放入xmol NH3、2mol CO2和1mol H2O(g),达平衡后,H2O的物质的量是3a mol
我想知道怎样确定第二个反应与第一个反应是等效的 reina_sun1年前3
reina_sun1年前3 -
 曼妙午茶 共回答了15个问题
曼妙午茶 共回答了15个问题 |采纳率93.3%如果是恒温恒压 那么只要前后加入的物质换算到一边 比如都换算到生成物 如果前后浓度都是成比例的 那么就是等效平衡
如果是恒温恒容 就要分情况了 如果反应满足mA+nB=pC+qD 且m+n=p+q那么只要前面一个反应和后面一个反应 由不同的起始状态换算到一边 反应物浓度对应成比例的话 就是等效平衡
如果是m+n≠p+q 则前一个和后一个换算到一边只有反应物浓度全部一样才行 这时的等效平衡就是全同平衡1年前查看全部
- 氮气和氢气以1:1的物质量混合后等分成2份分别冲入装有催化剂的真空密闭容器中在保持温度的条件下,反应相继达到平衡,A容器
氮气和氢气以1:1的物质量混合后等分成2份分别冲入装有催化剂的真空密闭容器中在保持温度的条件下,反应相继达到平衡,A容器中氢气的转化率是60%.B容器中氮气的转化率是10%.问A容器和B容器哪个体积大?
 yangsong121年前2
yangsong121年前2 -
 深色领带 共回答了17个问题
深色领带 共回答了17个问题 |采纳率94.1%A容器中氢气的转化率是60%,氮气的转化率就是20%,比B容器中氮气的转化率大,氮气和氢气的反应是一个体积减小的,则B容器体积大.1年前查看全部
- 一定温度下,在密闭容器中,发生反应:2NO2⇌2NO+O2,经过一段时间后,测得混合气体中NO2浓度为0.06mol/L
一定温度下,在密闭容器中,发生反应:2NO2⇌2NO+O2,经过一段时间后,测得混合气体中NO2浓度为0.06mol/L,O2的浓度为0.12mol/L,且各物质的浓度不再发生变化,求:
(1)NO2的起始浓度?
(2)此时NO2的分解率? zd1001年前1
zd1001年前1 -
 398088586 共回答了17个问题
398088586 共回答了17个问题 |采纳率100%解题思路:一定温度下,在密闭容器中,发生反应:2NO2⇌2NO+O2,经2min时间后,测得混合气中NO2浓度为0.06mol•L-1,O2的浓度为0.12mol•L-1,且各物质的浓度不再发生变化,说明反应达到平衡状态,依据化学平衡三段式列式计算.
(1)浓度c=[n/V]计算得到;
(2)二氧化氮转化率=[消耗量/起始量]×100%.一定温度下,在密闭容器中,发生反应:2NO2⇌2NO+O2,经2min时间后,测得混合气中NO2浓度为0.06mol•L-1,O2的浓度为0.12mol•L-1,且各物质的浓度不再发生变化,说明反应达到平衡状态,依据化学平衡三段式列式计算,设二氧化氮起始量为x;
2NO2⇌2NO+O2
起始量(mol/L) x 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L)x-0.24 0.24 0.12
x-0.24=0.06,解得:x=0.30mol/L
(1)NO2的起始浓度=0.3 mol/L;
答:NO2的起始浓度0.3 mol/L;
(2)二氧化氮转化率=[消耗量/起始量]×100%=[0.24mol/L/0.3mol/L]×100%=80%;
答:此时NO2的转化率80%.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了和平衡的计算应用,主要是转化率、反应速率概念的计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 在一个固定容积的密闭容器中.在一个固定容积的密闭容器中,放入3molX(g)和2molY(g),在一定条件下发生反应,4
在一个固定容积的密闭容器中.
在一个固定容积的密闭容器中,放入3molX(g)和2molY(g),在一定条件下发生反应,4X(g)+3Y(g)==2Q(g)+nR(g)“==”是可逆符号.达平衡后,容器内温度不变,混合气体的压强比原来增加0.05,X的浓度减小1/3,则该反应方程式中的n值是( )
A3 B4 C5 D6
选什么?为什么?
为什么浓度减少了1/3,物质的量也减少了1/3,?压强变了,即体积变了,物质的量不应变化1/3呀? san2900331年前1
san2900331年前1 -
 小可夜话 共回答了19个问题
小可夜话 共回答了19个问题 |采纳率89.5%4X(g)+3Y(g)==2Q(g)+nR(g)
3 2
1 0.75 0.5 n/2
2 1.25 0.5 n/2
2+1.25+0.5+n/2=5*1.05
n=3
选A
“在一个固定容积的密闭容器中”
即体积不变1年前查看全部
- 在密闭容器中,碳与氧气按质量比1:2完全反应,生成的气体可能是什么
 老侯1年前3
老侯1年前3 -
 神风浪剑 共回答了14个问题
神风浪剑 共回答了14个问题 |采纳率85.7%因为是完全反应,有只生成CO可能,也有只生成CO2可能,还有生成两者的混合物的可能.
C、O质量比是1:2,由于在CO中,C、O质量比为 12 / 16 > 1:2,在CO2中C、O质量比是 12 / 16*2 < 1:2,所以不可能生成一种物质,只能是CO、CO2共存.1年前查看全部
大家在问
- 1哪些盐溶液显酸性?哪些显碱性?
- 2高中数学,这道题是不是有问题啊,怎么算到是-4000
- 3波涛诡谲的意思是什么
- 4初二英语/;1.You can take the place of her(改为同义句)You can___ ___ _
- 5看图写句子,并给图排序..1.在下午7:15洗碗.2.在早上6:00吃饭.3 在早上10:00去动物园.4.在晚上8:0
- 6小学四年级上学期语文20课《诚实和信任》诚实主要指什么,信任指什么?
- 7辗转相除法为什么能求出最大公因式?
- 8Mr Smith spent $200 on newspapers each year. 选出与句子意思相近的句子
- 9小明要读一本故事书,如果每天看12页,在预计天数内还剩下40页没看,如果每天看 16页,可比计划天数提前3天看完,这本书
- 101、“者”和“所”的语法功能有何区别,它们的功能被近代汉语中的哪个词取代了 2、简要回答第三人称代词“
- 11规定a△b=2a+4b,计算5△3△1
- 12一个60瓦功率的落地扇一个钟耗但多少电啊?
- 13实验中策动力的频率为200Hz,音叉臂的震动频率?
- 14二 阅读下面有关"忧患"的两个文段
- 15哺乳动物是高等生物,地球上大约有4000多种,除极个别的种类外,都具有体表被毛、______、______等特征.
