电解质溶液实验;原电池原理实验求试验目的,步骤.谢谢了
 ancestor202022-10-04 11:39:541条回答
ancestor202022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 abcttf 共回答了19个问题
abcttf 共回答了19个问题 |采纳率89.5%- 原电池原理实验
原电池是化学能转化成电能的装置.两块相连的活动性不同的金属与电解质溶液可组成原电池,如铁、铜与稀硫酸就可形成原电池.
实验目的
理解原电池原理.
实验用品
试管、烧杯、滴管、镊子、药匙、导线(带夹子)、灵敏电流计.
实验步骤
1.用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接.将锌片与铜片接触,观察锌片与铜片接触时是否有电流通过?为什么?
2.把一块纯净的锌片插入盛有稀硫酸的烧杯里,观察现象.再平行地插入一块铜片,观察铜片上有没有气泡产生?用导线把锌片和铜片连接起来,观察铜片上有没有气泡产生?
3.用导线连接灵敏电流计的两端后,再与溶液中的锌片和铜片相连接,观察电流计的指针是否偏转,导线中有无电流通过?
问题和讨论
根据实验结果,说明应怎样装配原电池.如果用铁片代替锌片做原电池原理的实验,会有什么现象发生?如果用导线与一个电流计连接,又会有什么现象发生? - 1年前
相关推荐
- 电解质溶液导电与金属导电的区别是什么?
电解质溶液导电与金属导电的区别是什么?
如题 shendu19791年前4
shendu19791年前4 -
 jsnjld 共回答了18个问题
jsnjld 共回答了18个问题 |采纳率94.4%电解质是靠溶液里的阴阳离子导电,金属是靠自由电子导电.1年前查看全部
- 物质的量浓度均为1 mol / L的下列电解质溶液,各取10 mL混合后,pH值小于7的是 ( )
物质的量浓度均为1 mol / L的下列电解质溶液,各取10 mL混合后,pH值小于7的是 ( )
A.Na2S,NaCl,HCl
B.Na2CO3,HCl,HNO3
C.CaCl2,NaCl,NH4Cl
D.Na2CO3,HCl,CH3COOH
,所以在下有疑问,盐类水解程度不是很小吗,A中NaCl是中性,HCl是强酸,Na2S水解出一点点OH-,那么A为什么错了啊? 像风没理由1年前4
像风没理由1年前4 -
 wangsifeng467 共回答了27个问题
wangsifeng467 共回答了27个问题 |采纳率92.6%A 因为 S2- + H+====HS- 所以混合物是 NaCl 和NaHS的混合物 NaHS水解呈碱性 因此pH大于71年前查看全部
- 电极反应方程式 Mg,Al电极 NaOH电解质溶液 生成四羟基合铝酸钠的方程式
 芳妒群1年前1
芳妒群1年前1 -
 這一季 共回答了23个问题
這一季 共回答了23个问题 |采纳率87%负极:2 Al + 8 OH- =2 (Al(OH)4)- + 6 e-
正极:6 H2O + 6 e- = 3 H2 +6 OH-1年前查看全部
- 关于电解质溶液的选择题一道现有x mol/L的NaA溶液和 y mol/L的NaB溶液,下列说法不正确的是( )A、若x
关于电解质溶液的选择题一道
现有x mol/L的NaA溶液和 y mol/L的NaB溶液,下列说法不正确的是( )
A、若x=y,pH(NaA)>ph(NaB),则体积相等的两溶液中离子总数:N(NaA)K(HB) apo1236661年前2
apo1236661年前2 -
 yingwangni 共回答了15个问题
yingwangni 共回答了15个问题 |采纳率93.3%我们通过答案可知这两个应该是钠的弱酸盐,A是对的,NaA的PH大的话,水的电离程度大,OH-电离的就多,说明HA生成的多了,所以NaA离子数变少.B则是错的,NaA中水电离程度大,则是A-与水中的H+结合的多,说明HA在水中不易电离.那么电离常数应该是K(HA)1年前查看全部
- 1.燃料电池,若电极为氢气和氧气.KOH是电解质溶液.正极反应为什么是O2+2H2O+4e-=4OH-,这个H2O是怎么
1.燃料电池,若电极为氢气和氧气.KOH是电解质溶液.正极反应为什么是O2+2H2O+4e-=4OH-,这个H2O是怎么回事?
2.把KOH换成硫酸,负极反应为什么是2H2-4e-=4H+,为什么没有阴离子移向负极呢?
对于这个问题,我还想知道为什么有的方程式里面只是得失电子,有的还要结合阴阳离子?
3.以Fe和Cu为电极,Cucl2作电解质,总反应和电极反应分别是什么?
4.以锌,铜为电极,CuSO4为电解质,总反应和电极反应分别是什么?
5.为什么构成原电池加快反应速率? ct3211年前3
ct3211年前3 -
 kgbzyw 共回答了16个问题
kgbzyw 共回答了16个问题 |采纳率100%1,负极生成水,正极就要消耗水.主要是氧负离子不能在水中稳定存在,会与水反应生成氢氧跟,或与氢离子反应生成水.2,此时是硫酸做电解质溶液,溶液显酸性,正极产生的氧负离子与氢离子结合生成水.故溶液中只有硫酸跟向负极移动.负极生成的氢离子因此能稳定存在.方程式写法与电解质溶液有关,主要看参与电极反应的物质的产物与电解质反应不.如氧失去电子得氧负离子碱性环境与水反应生成氢氧跟,酸性环境与氢离子反应生成水.4,总反应就是铁置换铜,负极为铁失去电子成二价,正极是铜得电子成单质.5,原电池电路加快了电子移动速度,增大了电子释放面积.1年前查看全部
- 铂做电极,以氢氧化钾溶液做电解质溶液的肼——空气燃料电池的负极反应方程式
 爱深处不经意1年前1
爱深处不经意1年前1 -
 skybear69 共回答了26个问题
skybear69 共回答了26个问题 |采纳率84.6%解析:
负极:N2H4 - 4e- + 4OH-= N2 + 4H2O1年前查看全部
- 某种燃料电池是以甲烷(CH4)和空气为原料,以KOH为电解质溶液构成的原电池.电池的总反应类似甲烷在氧气中的燃烧.下列说
某种燃料电池是以甲烷(CH4)和空气为原料,以KOH为电解质溶液构成的原电池.电池的总反应类似甲烷在氧气中的燃烧.下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②CH4在负极发生氧化反应,电极反应式是:CH4+10OH--8e-=CO32-+7H2O
③燃料电池把化学能直接转化为电能,而不经过热能这一种中间形式,所以它的能量转化效率高,并且减少了对环境的污染
④这种燃料电池要定期更换电解质溶液.
A.①②
B.①②③④
C.①③④
D.②④ 壮志向日葵1年前1
壮志向日葵1年前1 -
 nottingroro 共回答了12个问题
nottingroro 共回答了12个问题 |采纳率91.7%解题思路:①根据电极反应来确定转移电子情况;
②根据负极上发生反应的反应类型确定反应的物质及电极反应式;
③根据能量转化判断;
④根据电池反应前后电解质的变化来判断.①根据电极反应式:CH4+10OH--8e-=CO32-+7H2O,则每消耗1molCH4可以向外电路提供8mole-,故①正确;
②燃料在负极上失电子发生氧化反应,甲烷燃烧能生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾,所以电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故②正确;
③燃料电池把化学能直接转化为电能,而不经过热能这一种中间形式,所以它的能量转化效率高,反应的产物是碳酸钾和水,可以减少对环境的污染,故③正确;
④该电池的电池反应式为:CH4+2O2+2KOH=K2CO3+3H2O,溶液由碱溶液变成盐溶液,要定期更换电解质溶液,故④正确.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了燃料电池,电极反应式的书写要注意结合电解质溶液判断电极上的生成物,原料相同,电解质溶液不同,电极反应式就不同.1年前查看全部
- 原电池中电解质溶液的阴阳离子运动速率是否与内电路中电子速率相同
 成成来了1年前1
成成来了1年前1 -
 lulu8800 共回答了18个问题
lulu8800 共回答了18个问题 |采纳率88.9%相同.
内电池,实质上就是电解质溶液.其内部电流的移动,靠的是阴阳离子的定向运动实现的,并不是电子的移动.所以可以认为是相同的1年前查看全部
- 以铜为负极,银为正极,ZnCl2为电解质溶液的原电池能否发生
以铜为负极,银为正极,ZnCl2为电解质溶液的原电池能否发生
若能,电极反应分别是什么
能写一下电极反应吗 qyj100011年前1
qyj100011年前1 -
 jqrynegje 共回答了17个问题
jqrynegje 共回答了17个问题 |采纳率88.2%以铜、银为正负电极,以ZnCl2为电解质溶液的原电池能发生,但是一旦发生,原电池的正极则为铜,负极则为银,原电池的负极是较活泼金属,正极为不活泼金属.1年前查看全部
- 高一化学关于铜锌原电池铜锌原电池,如果电解质溶液为CuSO4的话那在正极会有什么现象?是Cu片又被镀上一层铜吗?那和电镀
高一化学关于铜锌原电池
铜锌原电池,如果电解质溶液为CuSO4的话那在正极会有什么现象?是Cu片又被镀上一层铜吗?那和电镀铜有什么区别吗?
如果此时把装置上方的电流表改为某一用电器是否用电器可以运作啦? 樱桃小樱1年前1
樱桃小樱1年前1 -
 性格开朗喜欢上网 共回答了11个问题
性格开朗喜欢上网 共回答了11个问题 |采纳率81.8%锌棒是负极,铜棒是正极.将正极与负极用导线连接后,电池开始 工作(电子从锌棒经过导线流向铜棒).现象是:负极:锌棒渐渐溶解(锌棒上的锌失去电子,变成锌离子进入溶液) Zn = Zn2+ + 2e- 正极:铜棒质量增加,表面析...1年前查看全部
- 水溶液中的离子平衡在一定温度下,向不同电解质溶液中加入新物质时的溶液的导电性发生变化其中这个反映NH4Cl+NaOH=N
水溶液中的离子平衡
在一定温度下,向不同电解质溶液中加入新物质时的溶液的导电性发生变化
其中这个反映NH4Cl+NaOH=NaCl+NH3·H2O
反应前NH4Cl和NaOH都是强电解质反应后的NH3·H2O是弱电解质
那导电性不应该是下降了吗?怎么是不变?
还有解释说的“铵离子代替了氢离子,电荷浓度不变”是什么意思
麻烦4、5、6给我解释一下 grex_tr1年前2
grex_tr1年前2 -
 温泉penpen 共回答了24个问题
温泉penpen 共回答了24个问题 |采纳率83.3%4.反应:NH4Cl+NaOH=NaCl+NH3·H2O 是说,在原溶液NH4Cl中逐渐加入NaOH,反应生成NaCl+NH3·H2O,原溶液中NH4+离子导电,反应后的溶液Na+离子导电,两者的量是一样,所以导电性一致
5、6的原理和4一致,故而不一一缀述.1年前查看全部
- 下列关于电解质溶液的叙述中正确的是( ) A.溶质的物质的量浓度相同的NH 4 Cl和NH 4 HSO 4 两种溶液中
下列关于电解质溶液的叙述中正确的是( ) A.溶质的物质的量浓度相同的NH 4 Cl和NH 4 HSO 4 两种溶液中,c(NH 4 + )前者大于后者 B.在CH 3 COONa溶液中c(CH 3 COO - )>c(Na + )>c(OH - )>c(H + ) C.Na 2 CO 3 、NaHCO 3 两种盐的溶液中,离子种类相同 D.常温下,某溶液中由水电离出的c(H + )为10 -5 mol/L,则此溶液可能是盐酸  淑女不是我1年前1
淑女不是我1年前1 -
 xygao 共回答了17个问题
xygao 共回答了17个问题 |采纳率82.4%A.硫酸氢铵在水溶液里电离出氢离子,铵根离子水解而使其溶液呈酸性,则氢离子抑制铵根离子水解,所以物质的量浓度相等的氯化铵和硫酸氢铵溶液中,铵根离子浓度硫酸氢铵大于氯化铵,故A错误;
B.醋酸钠是强碱弱酸盐,醋酸根离子水解而使其溶液呈碱性,则c(OH - )>c(H + ),溶液中存在电荷守恒,根据电荷守恒得c(Na + )+c(H + )=c(CH 3 COO - )+c(OH - ),所以c(Na + )>c(CH 3 COO - ),故B错误;
C.碳酸根离子在水溶液里有两步水解,第一步水解生成碳酸氢根离子,第二步水解生成碳酸,碳酸氢根离子在水溶液里既能电离又能水解,碳酸氢根离子电离生成碳酸根离子,水解生成碳酸,所以两种溶液中离子种类相同,故C正确;
D.酸或碱抑制水电离,含有弱根离子的盐促进水电离,常温下,某溶液中由水电离出的c(H + )为10 -5 mol/L>10 -7 mol/L,所以该溶液中的溶质不可能是氯化氢,故D错误;
故选C.1年前查看全部
- 关于原电池的问题比如说 锌铜原电池,电解质溶液是硫酸,锌失去的电子为什么不直接给溶液中的氢离子,而要通过外电路到铜的那里
关于原电池的问题
比如说 锌铜原电池,电解质溶液是硫酸,锌失去的电子为什么不直接给溶液中的氢离子,而要通过外电路到铜的那里,在和氢离子结合生成氢气呢? 爱情小气包1年前2
爱情小气包1年前2 -
 秋月照茅亭 共回答了19个问题
秋月照茅亭 共回答了19个问题 |采纳率94.7%因为导线的电阻小于硫酸溶液的电阻,因此电子和硫酸溶液短路,电子就通过导线到达铜上,溶液中的H+在铜上得到电子,形成氢气.1年前查看全部
- 铜的电解精炼 电解质溶液为什么通常用酸化的硫酸铜溶液
 蛊惑人生1年前1
蛊惑人生1年前1 -
 天真丫头 共回答了20个问题
天真丫头 共回答了20个问题 |采纳率90%铜的电解精炼 电解质溶液通常用硫酸酸化的硫酸铜溶液
两方面的原因:
硫酸一方面是由于电解过程中铜阳极板的溶解要消耗硫酸形成硫酸铜,硫酸可作为pH缓冲剂,防止阳极附近铜离子水解沉淀;另外一方面由于硫酸在水溶液中的电离,可以增强电解液的导电性.1年前查看全部
- 如果想要在铁上镀铜,用铜做阳极、铁做阴极,电解质溶液用氯化钠为什么不行?铜离子不是比钠离子先放电的吗?
 无理争三分1年前4
无理争三分1年前4 -
 8565865 共回答了22个问题
8565865 共回答了22个问题 |采纳率86.4%电镀的话,电解质溶液要有铜离子,你的理解存在问题,把概念再看看,电镀不是点解.1年前查看全部
- 原电池中 电解质溶液一定会与负极发生自发的氧化还原反应吗
原电池中 电解质溶液一定会与负极发生自发的氧化还原反应吗
如果是的话 那么钢铁在发生的吸氧腐蚀 为什么要有氯化钠做电解质呢 那位仁兄帮帮忙 curarpiki1年前1
curarpiki1年前1 -
 新60 共回答了21个问题
新60 共回答了21个问题 |采纳率100%那个氯化钠可以无视.只是为了了增加溶液导电性而已~
实际反应的还是氧气1年前查看全部
- 在铜锌电解池中,(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
在铜锌电解池中,(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
在铜锌电解池中(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
1.为什么锌片会自己自动失去电子,然后锌原子变成锌离子?硫酸铜溶液为什么不和锌片直接发生氧化还原反应,即锌原子直接把电子转移给铜离子?
2.锌离子出来后为什么不会趋向阴极(铜片),然后又得到电子变成锌原子,形成单质锌?
打错了 是原电池 不是电解池 青帮小老大1年前3
青帮小老大1年前3 -
 凤翅镏金 共回答了12个问题
凤翅镏金 共回答了12个问题 |采纳率100%电解池问题 (请耐心看完)
1电解池由阴极 阳极 电解液体构成 已经形成了闭合的回路 所以回有电子的流动 通常是活泼的金属失电子
因为锌是做负极 负极失电子 阳极得电子(怎样判断阴阳级?通常 相对活泼的金属是做阴极的 锌比铜活泼所以 锌是负)
硫酸铜可以和锌片反应的 因为锌比铜活泼 可以置换铜 不知道你为什么说不能反应
2 这就要看溶液里有什么离子了上述溶液里正离子有氢离子与锌离子 这也涉及了离子的放电顺序 氢离子 》锌离子
也就是说 氢离子的氧化性强于锌离子 氢离子比锌离子先得到电子 所以不会析出单质锌 只会析出氢气
够详细了吧1年前查看全部
- (2012•石家庄二模)银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:Ag2O2+2Zn+4KOH+2H2O
(2012•石家庄二模)银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag下列有关该电池的说法不正确的是( )
A.电池放电时,正极附近溶液的碱性增强
B.电池放电时,负极反应为2Zn-4e-+8OH-═2[Zn(OH)4]2-
C.电池充电时,阳极反应为2Ag+4OH--4e-═Ag2O2+2H2O
D.充电时锌极与外电源正极相连 木各桑1年前1
木各桑1年前1 -
 2d1g 共回答了16个问题
2d1g 共回答了16个问题 |采纳率100%解题思路:根据Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag可知,Ag2O2在反应中Ag和O元素的化合价降低,被还原,应为原电池正极,电极反应式为Ag2O2+2H2O+4e-═2Ag+4OH-,Zn元素化合价升高,被氧化,应为原电池负极,电极反应式为Zn+4OH--2e-═Zn(OH)42-,以此解答该题.A、电池放电时,正极发生的电极反应为:Ag2O2+2H2O+4e-═2Ag+4OH-,所以该电极附近溶液的碱性增强,故A正确;
B、电池放电时,Zn元素化合价升高,被氧化,应为原电池负极,负极反应为2Zn-4e-+8OH-═2[Zn(OH)4]2-,故B正确;
C、电池充电时,阳极上发生失电子的氧化反应,该反应是放电时正极反应的逆反应,即反应为2Ag+4OH--4e-═Ag2O2+2H2O,故C正确;
D、充电时,锌极与外电源负极相连,故D错误.
故选:D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度中等,注意电极反应式的书写,为解答该题的关键,易错点为Ag2O2在反应中Ag和O元素的化合价的变化.1年前查看全部
- 以硫酸为电解质溶液,Zn为阴极,Fe为阳极的点解方程怎么写
 乌雪纷飞1年前4
乌雪纷飞1年前4 -
 ww6369 共回答了15个问题
ww6369 共回答了15个问题 |采纳率73.3%阳极:Fe-2e=Fe2+
阴极:2H+ +2e=H2
总反应Fe+ 2H+ =H2 +Fe2+1年前查看全部
- 如图所示装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中
如图所示装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中
A是Zn、B是Cu、C为稀H2SO4
B.A是Cu、B是Zn、C为稀H2SO4
C.A是Fe、B是Ag、C为AgNO3溶液
D.A是Ag、B是Fe、C为AgNO3溶液 夜火1年前2
夜火1年前2 -
 xman513 共回答了18个问题
xman513 共回答了18个问题 |采纳率94.4%选D
b极失电子 a极得电子
a极活泼型1年前查看全部
- 关于电解质溶液离子浓度比较问题某温度下,等体积、等物质的量浓度的两份NaCl NaAC,问这两种溶液中阴离子总数相比,(
关于电解质溶液离子浓度比较问题
某温度下,等体积、等物质的量浓度的两份nacl naac,问这两种溶液中阴离子总数相比,( ) a 前者大 b 后者大 c 一样大 d 不去确定
请仔细分析一下 不81年前1
不81年前1 -
 dadi98 共回答了19个问题
dadi98 共回答了19个问题 |采纳率94.7%假设2者都是1mol/L,体积为1L
我们从反面来思考这个问题,考虑阳离子,因为2者是一样的数量.
现在NaCl中的是Na+和水在该温度下的自解出的H+
NaAC是弱电解质,会结合掉一些水电解出的那部分H+,所以前者阳离子大于后者,也就是说阴离子也一样
故答案选A1年前查看全部
- 书写电极反应以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.正负极的电极反应 分别怎么写呢
 kbwuying1年前2
kbwuying1年前2 -
 ax8k 共回答了13个问题
ax8k 共回答了13个问题 |采纳率84.6%只要知道原电池正极是阴极就行了.(负极当然就是阳极了)
H2被氧化,氧化反应发生在阴极上.
H2 + 2Cl- ---> 2HCl + 2e
N2被还原,还原反应发生在阳极.
N2 + 6H+ + 6e ---> 2NH31年前查看全部
- 铁和石墨棒做电极,电解质溶液是氯化钠所构成的原电池,电极反应式怎么写?
 lzchengneng1年前2
lzchengneng1年前2 -
 广东青少 共回答了15个问题
广东青少 共回答了15个问题 |采纳率100%这个不一定,请你告诉我铁是阳极还是阴极 .在线等你1年前查看全部
- 燃料电池的电解质溶液是什么?酸性环境和碱性环境的区别在哪里?为什么碱性的优于酸性的?如何判断出的“在碱性条件下氢气、氢氧
燃料电池的电解质溶液是什么?
酸性环境和碱性环境的区别在哪里?为什么碱性的优于酸性的?
如何判断出的“在碱性条件下氢气、氢氧根反应再失电子产物就是水”? weixinglaker1年前3
weixinglaker1年前3 -
 笑笑日光倾城 共回答了12个问题
笑笑日光倾城 共回答了12个问题 |采纳率91.7%1.燃料电池的电极本身不包含活性物质,它只是一个催化原件.
2.酸性的可以提供氢离子,氢离子参与反应.碱性的当然就是氢氧根参与反应,或者水参与反应,氢氧根浓度不变.
碱性的更环保,耐用.酸性的容易生成氢气,使用时间长了就失效了.
而碱性的就不会出现这种问题.
3.氢气中的氢是0价,失去电子后+1价,容易和碱性条件下的OH-反应生成水.1年前查看全部
- 原电池电解质溶液中阴阳离子怎么移动?与电解池中一样吗?
 laovers1年前1
laovers1年前1 -
 tomcat999 共回答了15个问题
tomcat999 共回答了15个问题 |采纳率100%有 都是阳离子向电子堆积的地方搞点电子回来,我称她“放电”
在原电池里面,电子堆积在正极,所以阳离子跑到正极去
在电解槽中,电子在阴极,所以阳离子跑到阴极去
这样说应该还是清楚吧.1年前查看全部
- 铝为负级,铂网做正级,空气做氧化剂,海水做电解质溶液,正极反应式:总反应式:
 qiumao1年前1
qiumao1年前1 -
 alvinailey 共回答了22个问题
alvinailey 共回答了22个问题 |采纳率90.9%正极反应式:O2+2H2O+4e-=4OH-
负极反应式:Al-3e- +3OH-=Al(OH)3↓
总反应式:4Al+3O2+6H2O=4Al(OH)31年前查看全部
- 若用CH4和O2作燃料,氢氧化钾溶液作电解质溶液,问:
若用CH4和O2作燃料,氢氧化钾溶液作电解质溶液,问:
问:①电池工作时,负极附近溶液的pH如何变化?(升高/不变/降低)
②溶液中KOH的物质的量浓度如何变?(升高/不变/降低) langzi811年前3
langzi811年前3 -
 诸股利兜 共回答了18个问题
诸股利兜 共回答了18个问题 |采纳率83.3%负极处反应生成CO2再和氢氧根反应生成碳酸根,所以pH降低.
溶液中的OH-和生成的CO2反应,并且反应生成水,所以浓度降低.1年前查看全部
- 有A、B、C、D四块金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A和D分别投入等浓度盐酸中,D比A反应
有A、B、C、D四块金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A和D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是()
A.D >C >A >BB. D >A >B >C
C.D >B >A >CD.B >A >D >C tcpip70101年前1
tcpip70101年前1 -
 geeg 共回答了11个问题
geeg 共回答了11个问题 |采纳率81.8%B
1年前查看全部
- 高中电化学(关于盐桥原电池)我们在化学必修2中学原电池时,是两个电极同时插入一个电解质溶液中(使得活泼的金属与电解质溶液
高中电化学(关于盐桥原电池)
我们在化学必修2中学原电池时,是两个电极同时插入一个电解质溶液中(使得活泼的金属与电解质溶液接触从而发生氧化反应).但是在含有盐桥原电池中活泼电极与电解质溶液隔开,那么为什么还能产生电流呢.
可能是我忘了相关知识.也请大家回答时将一些基本原理也回答上.
有盐桥原电池中活泼电极与“可反应”电解质溶液隔开。加点字 伊-娃1年前2
伊-娃1年前2 -
 黄同乐hh 共回答了13个问题
黄同乐hh 共回答了13个问题 |采纳率92.3%这将会涉及到电势差的问题,在铜锌原电池中,利用盐桥时,分别形成外电路和内电路,这样就形成了一个闭合电路,虽然活泼金属与可反应溶液分开,在现有知识下开来时不反应的,但是在金属和溶液的接触面存在着电势差,在这种差值下,电子就有了流动的趋势,那么在闭合回路中就有了电子的运动,形成了电流,也就是构成了原电池.1年前查看全部
- 什么叫凝固点?凝固点降低公式在什么条件下才适用?它能否用于电解质溶液?
 ii好望角1年前1
ii好望角1年前1 -
 SchatzVonJia 共回答了25个问题
SchatzVonJia 共回答了25个问题 |采纳率96%凝固点就是大气压下固液两态平衡共存的温度
凝固点降低公式适用于难挥发非电解质稀溶液,由于电解质溶液中阴阳离子之间的复杂的作用力,所以该公式不适用于电解质溶液1年前查看全部
- 如何判断电解质有没参与反应有一道题是甲烷燃料电池的,电解质溶液是NaOH 我当时想总反应式是CH4+2O2=CO2+2H
如何判断电解质有没参与反应
有一道题是甲烷燃料电池的,电解质溶液是NaOH 我当时想总反应式是CH4+2O2=CO2+2H2O 但是答案是CH4+2O2+2NaOH=Na2CO3+3H2O 我不懂为什么电解质参与了反应.
上网问了下怎么判断电解质何时参与反应.但网友们说看总方程式.问题是多数情况下总方程式我都要自己凑自己想.结果就错了.
我想请各位先帮我分析一下上面这道题.再结合我的情况教下我怎么判断? 我首席牛人被封了1年前3
我首席牛人被封了1年前3 -
 luhuiluhui 共回答了17个问题
luhuiluhui 共回答了17个问题 |采纳率100%最主要的方法就是看反应产物能不能和电解质反应,比如本题中显然CO2是溶解于碱的
欢迎追问1年前查看全部
- 铁和铜形成的原电池,电解质溶液是稀硫酸,电极反应式
铁和铜形成的原电池,电解质溶液是稀硫酸,电极反应式
如果电解质是浓硝酸呐? gloria03781年前1
gloria03781年前1 -
 romanfr 共回答了16个问题
romanfr 共回答了16个问题 |采纳率100%根据金属的活动性,可知,在铁铜稀硫酸形成的原电池中,铁为负极,铜为正极.所以电极反应式,铁极为:Fe-2e- = Fe2+,铜极:H+ -2e- = H2
如果变为浓硝酸,因为铁发生钝化,所以负极为铜,正极为铁极.电极反应式为
铁极:2NO3- +4H+ + 2e- = 2NO2 + 2H2O 铜极:Cu - 2e- = Cu2+1年前查看全部
- 电解池中,电子是由负极经外电路流向正极,还是有电解质溶液流向负极?电流是由经过外电路还是电解质溶液
 天职也1年前1
天职也1年前1 -
 qepwq133 共回答了22个问题
qepwq133 共回答了22个问题 |采纳率86.4%一个电路中,导电的质子,带正电荷的就跟电流方向相同,带负电的就跟电流方向相反,这个是由电流的定义决定的.
所以电路回路中,有电子参与导电的部分,电子流动方向是跟电流相反的.
整个回路都有电流,包括外电路跟电解质溶液.外电路中,电子从电源负极流出,到达电解质溶液,由电解质溶液的导电离子参与导电(正离子与电流方向相同,流向负极;负离子与电流方向相反,流向正极),最后从导电溶液出来的电子流向电源正极.1年前查看全部
- 1.什么叫在其他条件不变的情况下,反应物中活化分子的百分比不变?不能理解2.为什么水的离子积只适用于稀的电解质溶液3.关
1.什么叫在其他条件不变的情况下,反应物中活化分子的百分比不变?不能理解2.为什么水的离子积只适用于稀的电解质溶液3.关于盐的电离与水解这节,为啥盐电离出来的离子和水中的离子结合,然后把水蒸发得到的还是原来的物质?有不溶的物质如弱酸生成了啊
 苹苹苹苹1年前1
苹苹苹苹1年前1 -
 lnn1123 共回答了23个问题
lnn1123 共回答了23个问题 |采纳率95.7%关于盐的电离与水解这节,为啥盐电离出来的离子和水中的离子结合,然后把水蒸发得到的还是原来的物质
其他我不太记得了 虽然考完才每多久 我只能说 这个问题不准确 不一定得到原来的物质 例如 氯化铝溶液蒸发得到的是氧化铝
而得到原来物质的 都是不可挥发性酸的盐的水溶液 当然他的阳离子也不能被氧化怎样的 如硫酸铁 硫酸是不挥发性酸 硫酸铁的水溶液水解 是氢氧化铁和硫酸 这个反映是可逆的 水少了 反映怎样 不需我多说了吧
还有 你所说的不溶的物质 你恐怕把他水解的功能想的太强大了 你见过哪瓶硫酸铁里面是有氢氧化铁固体的?
至于第一二两个问题 我不知道该如何解释 毕竟这两个点 我没有深究过 也不能这么说 只能说因为考试试卷再每接触过 所以在上完课 纠结完 自己理解了 记住了 可是有人把这么个问题放上来 却是真的不知道如何解释的 就这样 高中的化学还是很简单的 好好学 加油1年前查看全部
- 电解精炼铜 为什么阳极溶解的铜与阴极析出的铜不等 为什么电解质溶液铜离子浓度减小
 ff否1年前2
ff否1年前2 -
 我想拉巴巴 共回答了22个问题
我想拉巴巴 共回答了22个问题 |采纳率90.9%精炼铜 阳极失电子的有Zn Fe Cu 等,还有Ag Au Pt 等沉淀为阳极泥.
阴极只有Cu2+得电子,一部分来自于阳极生成的Cu2+ ,一部分来自于溶液中.
所以阳极溶解的铜与阴极析出的铜不等 ,电解质溶液铜离子浓度减小1年前查看全部
- 当锌和铜做两极,稀硫酸作电解质溶液,实验现象是什么?导线上有电流表,并且说出实验结论及解释
 idwriter1年前2
idwriter1年前2 -
 szwzg88 共回答了12个问题
szwzg88 共回答了12个问题 |采纳率75%铜的那极产生气泡,电流表偏转,
铜和锌的金属活动性不同,锌比铜活泼.铜和锌构成了原电池,锌被氧化,铜那端的氢离子被还原,形成了原电池.1年前查看全部
- 我知道铜在空气中变成cu2(oh)2co3,那么铜棒和碳棒用导线连接放在氯化钠溶液中,就应该是吸氧腐蚀,要是把电解质溶液
我知道铜在空气中变成cu2(oh)2co3,那么铜棒和碳棒用导线连接放在氯化钠溶液中,就应该是吸氧腐蚀,要是把电解质溶液换成盐酸或氢氧化钠,那是什么腐蚀,两极电极反应式是啥,
我知道把电解质溶液换成盐酸或氢氧化钠,肯定还是吸氧腐蚀,因为要是析氢腐蚀,就是铜能和盐酸反应了。cu2(oh)2co3和盐酸反应是强酸制弱酸,但cu2(oh)2co3和氢氧化钠为什么不反应 coolma19841年前2
coolma19841年前2 -
 xqfed88gn18c6 共回答了20个问题
xqfed88gn18c6 共回答了20个问题 |采纳率90%答:是吸氧腐蚀.
正极反应:2(H2O)+O2+4e=4(OH-) (这好难表达化学式好,完全正确的写法写不出来)
负极反应:Cu+2(OH-)-2e=Cu(OH)2↓
假如Cu2(OH)2CO3能和NaOH反应,就会生成Cu(OH)2与Na2CO3
而Cu(OH)2在碱性环境下是沉淀的,它会在反应物表面形成一层阻碍反应进行的膜,只要反应还能进行,在能反应的地方膜就会加厚,直到膜把两反应物完全分开而停止反应.1年前查看全部
- 正极是铁,负极是铁,电解质溶液是氯化铜,写出电极反应和总反应
 不长叶子之树1年前4
不长叶子之树1年前4 -
 男人孟 共回答了20个问题
男人孟 共回答了20个问题 |采纳率95%负极,Cu2+ +2e-=cu
正极,2cl- -2e-=Cl2
CuCl2=(电解)=Cu+Cl21年前查看全部
- 电解CuSO 4 溶液时,若要达到如下三点要求:①阳极质量减少 ②阴极质量增加 ③电解质溶液中Cu 2+ 浓度不变。则选
电解CuSO 4 溶液时,若要达到如下三点要求:①阳极质量减少 ②阴极质量增加 ③电解质溶液中Cu 2+ 浓度不变。则选用的电极是( )
A.纯铜作阳极,含锌、银的铜合金作阴极 B.铁作阳极,铜作阴极 C.石墨作阳极,铂作阴极 D.含锌、银的铜合金作阳极,纯铜作阴极  dido2001_20011年前1
dido2001_20011年前1 -
 yy霞 共回答了20个问题
yy霞 共回答了20个问题 |采纳率80%A
Cu作阳极时,电解液中Cu 2+ 浓度不变,若用粗Cu作阳极,溶液中Cu 2+ 浓度会略有减小。1年前查看全部
- 如果在Fe和C组成的原电池中,N acl溶液为电解质溶液,那么N acl溶液的作用是什么?
 月半女古女良1年前2
月半女古女良1年前2 -
 jiasi9128 共回答了18个问题
jiasi9128 共回答了18个问题 |采纳率88.9%就是起到电解质溶液的作用
以铁为负极,碳棒为正极,NaCl溶液为电解质溶液,则空气中的氧气溶解在电解质溶液中,并在正极放电,则铁在负极放电从而电极反应式为
负极 Fe-2e-=Fe2+
正极O2+4e-+2H20=4OH-1年前查看全部
- 为什么在碱性燃料电池中一般以氢氧化钾作为电解质溶液而不用更便宜的氢氧化钠?
 lancelot8591年前1
lancelot8591年前1 -
 秋风2000 共回答了23个问题
秋风2000 共回答了23个问题 |采纳率95.7%碱性燃料电池的电解质通常是氢氧化钾水溶液.之所以选择氢氧化钾,是因为与氢氧化钠相比,它的使用寿命长,不易形成溶解度小的杂质,而且溶液蒸汽压低,在高温下可以使用,在高温和高浓度下可以获得高电流密度.1年前查看全部
- 原电池里,正负级的氧化还原反应和电解质溶液到底有什么关系啊?
 都察御史1年前2
都察御史1年前2 -
 九九归 共回答了17个问题
九九归 共回答了17个问题 |采纳率94.1%原电池里,负极发生氧化反应,相当于阳极.
正极发生还原反应,相当于阴极.
电解质溶液是否参与反应要看具体是何种离子.有四种情况,分别是阳离子反应、阴离子反应、阴阳离子都反应,阴阳离子都不反应(电解水)1年前查看全部
- 铜不溶于稀硫酸,但当铜作为电解的阳极,稀硫酸作为电解质溶液时,铜就能溶解于稀硫酸.还想问下是不是金属作阳极时,可以溶于任
铜不溶于稀硫酸,但当铜作为电解的阳极,稀硫酸作为电解质溶液时,铜就能溶解于稀硫酸.还想问下是不是金属作阳极时,可以溶于任何电解质溶液.
 hlq09311年前1
hlq09311年前1 -
 人世一浮尘 共回答了20个问题
人世一浮尘 共回答了20个问题 |采纳率95%铜不溶于稀硫酸,但当铜作为电解的阳极,稀硫酸作为电解质溶液时,铜就能溶解于稀硫酸,但前提是阳极的电压大于铜的电极电位(Cu2+/Cu0),铜才会溶解.金属作阳极时,并不是可以溶于任何电解质溶液,一是电解时的电压,是否大于金属离子的电极电位,二是要考虑氢,氧离子的离解,比如铂电极,在氯化钠水溶液中,你再怎么电解,阳极也只能产生氧气,而不是铂离子.1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH 3 OH+3O 2 +4OH - 2CO 3 2- +6H 2 O,则下列说法错误的是[ ]
2CO 3 2- +6H 2 O,则下列说法错误的是[ ]A.放电时CH 3 OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH 3 OH-6e - +8OH - =CO 3 2- +6H 2 O
D.充电时每生成1mol CH 3 OH转移6mol电子 coangel1年前1
coangel1年前1 -
 poppy05 共回答了10个问题
poppy05 共回答了10个问题 |采纳率90%A1年前查看全部
- 用惰性电极点解下列电解质溶液,求阳极反应式,阴极反应式,总反应方程式,溶液复原所需物质,Na2So4,H2SO4。
用惰性电极点解下列电解质溶液,求阳极反应式,阴极反应式,总反应方程式,溶液复原所需物质,Na2So4,H2SO4。
若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是? huxinan1231年前3
huxinan1231年前3 -
 6517556 共回答了17个问题
6517556 共回答了17个问题 |采纳率94.1%1、楼上说的不错,电解Na2SO4和H2SO4事实上就是【电解水】
不过楼上写的反应式有点问题,应该是:
阳极:4OH- - 4e- ==== 2H2O + O2
阴极:2H+ + 2e- ==== H2
总反应:2H2O ==== 2H2 + O2
【要复原溶液,需要补充被电解掉的水即可】
2、若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是?
【这个题楼上答错了】
阳离子交换膜的作用是【使阴阳离子隔绝,避免其相互反应】.
2NaCl + 2H2O ==== 2NaOH + H2 + Cl2而这样的产物极易反应.所以如果没有阳离子交换膜,这些产物就会继续反应.
具体如下:2NaCl + 2H2O ==== 2NaOH + H2(气体) + Cl2(气体)
2NaOH + Cl2 ==== NaCl + NaClO + H2O
【所以最终的结果是:NaCl + H2O ==(通电)== NaClO + H2(气体)】1年前查看全部
- (2008•广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定滴定反应的终点.如图所示是KO
 (2008•广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定滴定反应的终点.如图所示是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线.下列示意图中,能正确表示用NH3•H2O滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
(2008•广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定滴定反应的终点.如图所示是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线.下列示意图中,能正确表示用NH3•H2O滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
A.
B.
C.
D.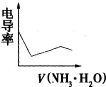
 人在行云里1年前1
人在行云里1年前1 -
 钟小洁 共回答了12个问题
钟小洁 共回答了12个问题 |采纳率83.3%解题思路:醋酸和一水合氨是弱电解质,在溶液里部分电离,氯化氢是强电解质,完全电离,向混合溶液中滴加氨水,氨水先和氯化氢反应生成强电解质氯化铵,氯化氢完全反应后,氨水再和醋酸反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答.氯化氢是强电解质,醋酸是弱电解质,滴加的弱电解质先和氯化氢反应生成强电解质氯化铵,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氯化氢完全被中和后,一水合氨继续电离与弱电解质醋酸反应生成强电解质醋酸铵,所以电导率增大;醋酸也完全反应后,继续滴加氨水,因为溶液被稀释,电导率有下降趋势,故选D.
点评:
本题考点: 电解质溶液的导电性;中和滴定.
考点点评: 本题考查了酸碱中和溶液电导率的变化,明确电导率与离子浓度的关系是解本题关键,根据电解质的强弱、离子浓度的变化来分析解答即可,难度中等.1年前查看全部
- 电解精炼铝单质能用氯化铝做电解质溶液吗?
 3505956591年前1
3505956591年前1 -
 hhijj 共回答了13个问题
hhijj 共回答了13个问题 |采纳率84.6%不能,因为三氯化铝是分子晶体,融容状态下为分子小颗粒,不能用电解AlCl3得到单质铝1年前查看全部
- 如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,
 如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )
如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )
A.装置Ⅰ中b电极为负极,电极上发生的是氧化反应
B.装置Ⅰ中,电解质溶液中的阳离子移向a电极
C.电镀时,装置Ⅱ中阳极发生的电极反应式为4OH--4e-=H2O+O2↑
D.若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷1.12L (标准状况下) 海斌8881年前1
海斌8881年前1 -
 忽儿 共回答了17个问题
忽儿 共回答了17个问题 |采纳率88.2%解题思路:通过装置Ⅱ实现铁棒上镀铜,则铁做阴极,铜作阳极,a是负极,b是正极,
A.通入燃料的电极是负极,通入氧化剂的电极是正极;
B.原电池放电时,阳离子向正极移动;
C.电镀时,阳极上金属电极失电子发生氧化反应;
D.根据转移电子相等计算.通过装置Ⅱ实现铁棒上镀铜,则铁做阴极,铜作阳极,a是负极,b是正极,
A.b是正极,正极上通入氧化剂,正极上氧化剂得电子发生还原反应,故A错误;
B.原电池I放电时,阳离子向正极b移动,故B错误;
C.电镀时,阳极上金属电极失电子发生氧化反应,电极反应式为:Cu-2e-=Cu 2+,故C错误;
D.串联电路中转移电子相等,II中阴极上铜离子放电生成铜,生成12.8g铜时转移电子的物质的量=
12.8g
64g/mol×2=0.4mol,根据甲烷和转移电子的关系知,消耗甲烷的体积=
0.4mol
[4−(−4)]×22.4L/mol=1.12L,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,明确原电池和电解质电极的判断、各个电极上发生的反应是解本题关键,易错选项是C,注意如果活泼金属作电解池阳极材料,则电解时阳极上金属材料失电子而不是电解质溶液中阴离子失电子,为易错点.1年前查看全部
- 在有盐桥的铜锌原电池中,电解质溶液的选择为什么要与电极材料的阳离子相同?
在有盐桥的铜锌原电池中,电解质溶液的选择为什么要与电极材料的阳离子相同?
如果两个溶液都选硫酸铜,是不是在锌上析出铜,那还是叫原电池吗?请分析下原理
 jason21ce1年前1
jason21ce1年前1 -
 Prince_handsome 共回答了9个问题
Prince_handsome 共回答了9个问题 |采纳率77.8%不是,还是在铜棒上析出铜。锌棒上锌失的电子通过导线转移到铜棒上,溶液中的铜离子在铜棒上得电子,被还原。1年前查看全部
大家在问
- 1看到草原,我想到的成语有:
- 2来到草原会想到哪些成语
- 3苯丙氨基酸等于苯胺基丙酸吗
- 4绝对值a=7,根号下b=3,且绝对值a+b=多少 你们懂的
- 5火车轨道重力与向心力合力方向是怎样的?
- 6第一行2 3 4 5第二列是3 4 5 6第二行是3 4 5 6第三列4567到N行和N列交叉点怎么用
- 7来到草原,我想起了( ),( ),( ),( )等成语
- 8高二数学题手机上可以看得懂的!解关于X的不等式 X乘以X-2的绝对值小于且等于3
- 9在原电池的两极采用不同的电解质溶液是什么原理
- 10小亮与小明讨论有关近似数的问题.小亮:如果把3 498精确到千位,可得到3 000.小明:不,我的想法是,先把3 498
- 11电势处处相等且不为零的空间中各点场强必为零,这句话到底对不对,为什么?
- 12英语翻译The AAA power booster is designed for pumping high visco
- 13氯酸钾与亚硫酸钠在有硫酸的条件下反应,生成二氧化氯,求方程式
- 14场强为零的点,电势必定为零.这句话对吗
- 15已知线段AB=6cm,线段BC=4cm,那么线段的取值范围是多少
