电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
 swimg2022-10-04 11:39:541条回答
swimg2022-10-04 11:39:541条回答某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
(1).请写出上述六种物质的化学式
(2).请写出相关的化学方程式

已提交,审核后显示!提交回复
共1条回复
 wbjsl 共回答了27个问题
wbjsl 共回答了27个问题 |采纳率88.9%- 题目不完整吧.步骤呢?
- 1年前
相关推荐
- 下列句子中没有语病的一项是 A.电子工业能否迅速发展。并广泛渗透到各行各业中,关键在于要加速造就一批专门人才。 B.青年
下列句子中没有语病的一项是
a.电子工业能否迅速发展。并广泛渗透到各行各业中,关键在于要加速造就一批专门人才。 b.青年男女不再以财产多寡和门第高低为条件,而以能劳动、有科学文化知识的标准去选择自己的伴侣。 c.学习成绩的好坏是三好生的重要条件。 d.他们在广州市文化公园展出近年来的近300件书画作品,***各界对这些作品好评如潮。  janetxxx1年前1
janetxxx1年前1 -
 cranberry_ly 共回答了17个问题
cranberry_ly 共回答了17个问题 |采纳率100%D
A.(两面对一面)
B.〈前面是"多寡""高低"关涉两面,而后面只兼涉肯定一面,前后不一致。可将"能"改为"能否","有"改为"有没有")
C.(前面是"好坏"关涉两方面,后面只有肯定一面,前后不一致,可在"三好生"前加上"能否成为")1年前查看全部
- 在电子工业上,常用氯化铁溶液来腐蚀铜,制造电路板.据报道,通常状况下,铜与氯化铁溶液反应转化为氯化铜(氯化铜能溶于水).
在电子工业上,常用氯化铁溶液来腐蚀铜,制造电路板.据报道,通常状况下,铜与氯化铁溶液反应转化为氯化铜(氯化铜能溶于水).
(1)请完成该反应的化学方程式:Cu+2FeCl 3 ═CuCl 2 +2______,该反应______(填“属于”或“不属于”)置换反应.
(2)若把一块铜板(足量)放入1000g溶质质量分数为16.25%的氯化铁溶液中,充分反应,待反应停止后取出铜片(假设无其它反应发生,操作过程中无损耗).
求:
①反应前溶液中溶质的质量.
②反应后所得溶液的质量. 手插兜独自玩1年前1
手插兜独自玩1年前1 -
 olliwy 共回答了19个问题
olliwy 共回答了19个问题 |采纳率84.2%(1)根据反应前后各原子的种类和数目不变,可知还缺少2个铁原子,4个氯原子,因为前面系数是2,所以化学式为:FeCl 2 ;一种单质和一种化合物反应生成另一种单质和另一种化合物的反应属于置换反应,该反应的生成物中没有单质,所以不属于置换反应;
(2)①反应前溶液中溶质为氯化铁质量为:1000g×16.25%=162.5g;
②设参加反应的铜的质量为X
Cu+2FeCl 3 ═CuCl 2 +2FeCl 2
64 325
X 162.5g
根据:
64
325 =
X
162.5g 解得X=32,所以反应后所得溶液的质量为:32g+1000g=1032g.
故答案为:(1)FeCl 2 ;不属于;(2)①162.5g;②1032g.1年前查看全部
- 氧化还原反应在生产生活和科学研究中有重要的用途,电子工业中常用FeCl3溶液腐蚀线路板.小明对某种印刷线路板废液成分进行
氧化还原反应在生产生活和科学研究中有重要的用途,电子工业中常用FeCl3溶液腐蚀线路板.小明对某种印刷线路板废液成分进行如下探究.1 取少量废液加KSCN溶液显红色.2 取10ml废液加入足量的AgNO3溶液析出沉淀12.915g 3 再取10ml废液加铁片充分反应,测得铁片质量没变,再加KSCN不变色.问废液中正3价铁离子和正2价铜离子物资的量比为多少(郑州市2013-2014年高一期末化学测试题)
 杀出一片天1年前1
杀出一片天1年前1 -
 akguozongwei 共回答了25个问题
akguozongwei 共回答了25个问题 |采纳率88%2:7
涉及到的反应方程式如下:
Fe+2FeCl3=3FeCl2
Fe+CuCl2=Cu+FeCl2
由测得测得铁片质量不变,可得参与反应的铁的质量与析出的铜的质量相等
假设铜离子物质的量为amol,由以上反应方程式得
参与正3价铁离子反应的单质Fe的物质的量为(64a-56a)÷56=a/7mol
因此正3价铁离子物质的量为2a/7mol
所以正3价铁离子和正2价铜离子物质的量比为2:71年前查看全部
- 一道语文题,修改病句下列句中没有语病的一项是:( )A、为了搞好工作,我们要虚心接受和征求群众意见.B、电子工业能否迅速
一道语文题,修改病句
下列句中没有语病的一项是:( )
A、为了搞好工作,我们要虚心接受和征求群众意见.
B、电子工业能否迅速发展,并广泛渗透到各行各业中去,关键在于要加强训练并造就一批专门技术人才.
C、我不得不承认我确实是错了.
D、理想的教育应该培养学生善于发现、善于探索的水平. tingting7777771年前1
tingting7777771年前1 -
 wt5370 共回答了16个问题
wt5370 共回答了16个问题 |采纳率87.5%选C.至于有疑问的B选项,前面是“能否”,后面应该也是两种可能“关键在于能否加强训练并造就……”.1年前查看全部
- (2014•南通三模)一氧化碳被广泛应用于冶金工业和电子工业.
(2014•南通三模)一氧化碳被广泛应用于冶金工业和电子工业.
(1)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)═4CO2(g)+3Fe(s)△H=a kJ•mol-1
CO(g)+3Fe2O3(s)═CO2(g)+2Fe3O4(s)△H=b kJ•mol-1
反应3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)的△H=[2a+b/3][2a+b/3]kJ•mol-1(用含a、b 的代数式表示).
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到.
第一步:2CH3OH(g)⇌HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)⇌CH3OH(g)+CO(g)△H>0
①第一步反应的机理可以用图表示: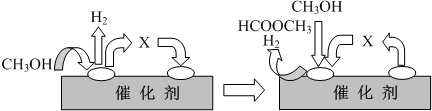
图中中间产物X的结构简式为______.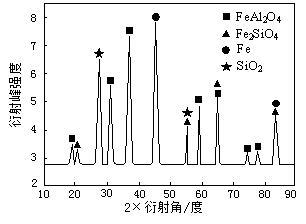
②在工业生产中,为提高CO的产率,可采取的合理措施有______.
(3)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如右图1示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为______.
(4)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质.
上述两步中消耗CO的物质的量之比为______.
(5)为安全起见,工业生产中需对空气中的CO进行监测.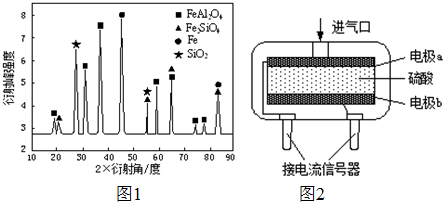
①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀.每生成5.3gPd沉淀,反应转移电子数为______.
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如右图2示.这种传感器利用原电池原理,则该电池的负极反应式为______. 张ll1年前1
张ll1年前1 -
 zwqzwqzwq 共回答了22个问题
zwqzwqzwq 共回答了22个问题 |采纳率100%解题思路:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①依据分解反应过程和反应机理图示分析判断,中间产物为甲醛;
②反应是气体体积增大的吸热反应,依据化学平衡移动原理分析判断;
(3)反应后混合物中的一种产物能与盐酸反应生产两种盐,依据图示中物质组成分析可知是FeAl2O4,反应生成铁盐和铝盐;
(4)依据反应的化学方程式定量关系分析计算;
(5)①依据生成Pd质量,结合PdCl2~Pd~2e-,计算分析;
②依据原电池原理分析,测定一氧化碳气体含量,使一氧化碳发生氧化还原反应生成二氧化碳,原电池的负极是失电子发生氧化反应,据此书写负极电极反应.(1)①4CO(g)+Fe3O4(s)═4CO2(g)+3Fe(s)△H=a kJ•mol-1
②CO(g)+3Fe2O3(s)═CO2(g)+2Fe3O4(s)△H=b kJ•mol-1
依据盖斯定律[2×①+②/3]得到反应热化学方程式为:3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)的△H=[2a+b/3]KJ/mol,
故答案为:[2a+b/3];
(2)①依据图示和分解反应过程,结合原子守恒分析,甲醇去氢后得到的是甲醛,
故答案为:HCHO;
②第二步:HCOOCH3(g)⇌CH3OH(g)+CO(g)△H>0,反应是气体体积增大的吸热反应,依据平衡移动原理可知提高一氧化碳产率,应使平衡正向进行,升温,减压实现,
故答案为:升高温度,降低压强;
(3)反应后混合物中的一种产物能与盐酸反应生产两种盐,依据图示中物质组成分析可知是FeAl2O4,反应生成铁盐和铝盐,反应的离子方程式为FeAl2O4+8H+=Fe2++2Al3++4H2O,故答案为:FeAl2O4+8H+=Fe2++2Al3++4H2O;
(4)首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质,反应的化学方程式为:Ni2O3+3CO=2Ni+3CO2,Ni+4CO=Ni(CO)4,Ni(CO)4,
△
.
Ni+4CO,两步中消耗CO的物质的量之比为3:8,
故答案为:3:8;
(5)①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀.每生成5.3gPd沉淀,物质的量=[5.3mol/106g/mol]=0.05mol,依据PdCl2~Pd~2e-,转移电子数为0.05mol×2×NA=0.1NA,
故答案为:0.1NA ;
②测定一氧化碳气体含量,使一氧化碳发生氧化还原反应生成二氧化碳,原电池的负极是失电子发生氧化反应,酸性介质中负极电极反应为CO+H2O-2e-=CO2+2H+,
故答案为:CO+H2O-2e-=CO2+2H+.点评:
本题考点: 用盖斯定律进行有关反应热的计算;氧化还原反应的电子转移数目计算;原电池和电解池的工作原理;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式书写和盖斯定律计算应用,图象分析方法,原电池原理的应用,原子守恒,电子守恒的反应过程分析是解题关键,题目难度中等.1年前查看全部
- 纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.[已知:硫酸铝铵晶体的化
纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.[已知:硫酸铝铵晶体的化学式为Al2(NH4)2(SO4)4•24H2O,相对分子质量为906]
(1)制备硫酸铝铵晶体的实验流程如下: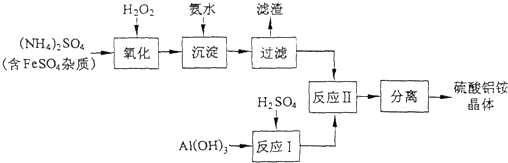
①检验上述流程中“过滤”后杂质是否除尽的实验方法是______.
②上述流程中,“分离”所包含的操作依次为:______、______、过滤、洗涤、干燥.
(2)取4.53g 硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.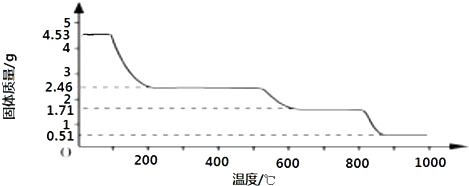
请通过计算确定400℃时剩余固体成分的化学式(写出计算过程). cyluoo1年前1
cyluoo1年前1 -
 xzlovesj 共回答了21个问题
xzlovesj 共回答了21个问题 |采纳率90.5%解题思路:由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体,
(1)①由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,用KSCN溶液检验是否含有Fe3+;
②由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;
(2)计算晶体中水的质量,根据固体质量差,计算晶体中剩余结晶水的质量,进而计算剩余固体中n[(NH4)Al(SO4)2]:n(H2O),据此书写化学式.由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体;
(1)①由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽.
故答案为:取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽;
②由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,故答案为:蒸发浓缩;冷却结晶;
(2)取4.53g硫酸铝铵晶体的物质的量为[4.53g/906g/mol]=0.005mol,
4.53g硫酸铝铵晶体中水的质量为0.005mol×24×18g/mol=2.16g,
加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g
剩余固体中结晶水的物质的量为[2.16g−2.07g/18g/mol]=0.005mol.
剩余固体中n[(NH4)2Al2(SO4)4]:n(H2O)=0.005mol:0.005mol=1:1,
故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.
答:400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查镁铝及其化合物的性质,对工艺流程理解、常用化学用语、盐类水解、物质的分离提纯与离子检验、化学计算等,综合性较大,难度较高,需要学生具备扎实的基础与运用知识分析解决问题的能力.1年前查看全部
- 过去电子工业常用30%的FeCl 3 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。发生反应的化学方程式为:2FeCl 3
过去电子工业常用30%的FeCl 3 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。发生反应的化学方程式为:2FeCl 3 +Cu=2FeCl 2 +CuCl 2 。
(1)检验腐蚀后的溶液中是否含有Fe 3+ 应用的试剂是____________________。
(2)为了从使用过的腐蚀液中回收铜,并重新制得纯净的FeCl 3 ,溶液,采用下列实验步骤,请在各空格内填上适当的物质以使实验达到预期目的。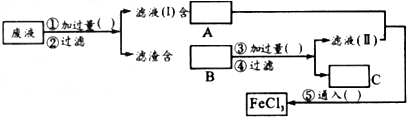
(3)写出有关反应的离子方程式:_____________________。  晨风裹雾1年前1
晨风裹雾1年前1 -
 落花满怀 共回答了19个问题
落花满怀 共回答了19个问题 |采纳率89.5%(1)KSCN(或其他含SCN - 的盐)溶液
(2)Fe粉;FeCl 2 ;Fe、Cu;盐酸;H 2 ;Cl 2
(3)2Fe 3+ +Fe=3Fe 2+, 、Fe+Cu 2+ =Fe 2+ +Cu、Fe+2H + =Fe 2+ +H 2 ↑、2Fe 2+ + Cl 2 =2Fe 3+ +2Cl -1年前查看全部
- 硅晶体(Si)是一种重要的半导体材料,广泛应用于电子工业的各个领域。硅的冶炼中,第一步常用碳在高温下还原二氧化硅制得粗硅
硅晶体(Si)是一种重要的半导体材料,广泛应用于电子工业的各个领域。硅的冶炼中,第一步常用碳在高温下还原二氧化硅制得粗硅,反应的化学方程式如下:
SiO 2 +2C Si+2CO↑
Si+2CO↑
现要制备含硅7 kg的粗硅,理论上需要二氧化硅多少千克? hewei81101年前1
hewei81101年前1 -
 我是楚沛 共回答了16个问题
我是楚沛 共回答了16个问题 |采纳率81.3%15kg1年前查看全部
- (2012•当涂县三模)用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:
(2012•当涂县三模)用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:
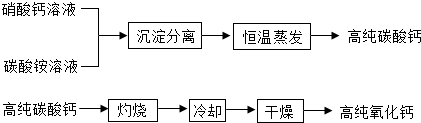
(1)写出下列物质的化学式:硝酸钙______、碳酸铵______.
(2)硝酸钙与碳酸铵在溶液中反应,其基本反应类型为______.
(3)实验室常采用______操作进行沉淀分离.
(4)生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是:______.
(5)高纯氧化钙生产过程中,“干燥”的主要目的是为了防止(用化学方程式表示)______. 开平王高宠1年前1
开平王高宠1年前1 -
 牛人哦 共回答了12个问题
牛人哦 共回答了12个问题 |采纳率91.7%解题思路:(1)根据化合物中各元素的代数和为0进行解答;
(2)两种化合物相互交换成分生成另外两种化合物的反应是复分解反应;
(3)过滤就是将液体和不溶于液体的固体分离开的一种方法;
(4)采用恒温干燥而不用灼烧是防止碳酸钙在高温下分解;
(5)生产高纯氧化钙是干燥是防止氧化钙和水发生反应.(1)依据化合物中各元素的代数和为0,其中钙元素的化合价为+2价,硝酸根的化合价为-1价,所以硝酸钙的化学式为:Ca(NO3)2;碳酸根的化合价为-2价,铵根的化合价为+1价,所以碳酸铵的化学式为:(NH4)2CO3;
(2)硝酸钙和碳酸铵的反应是两种化合物之间的反应,且反应后有沉淀生成,满足复分解反应的定义和条件,所以二者的反应是复分解反应;
(3)过滤可以将液体和不溶于液体的固体分开,而沉淀是不溶于水的固体,所以可以用过滤法把硝酸钙和碳酸铵反应产生的沉淀从溶液中过滤出去;
(4)生产高纯碳酸钙时,选择“20℃恒温干燥”而不选择“灼烧”的原因是,碳酸钙在高温下易分解;
(5)生产高纯氧化钙时,“干燥”的主要目的是为了防止氧化钙和水反应.
故答案为:(1)Ca(NO3)2;(NH4)2CO3.(2)复分解反应;(3)过滤;(4)高温灼烧会使碳酸钙分成,所得的碳酸钙含有杂质氧化钙而不纯;(5)CaO+H2O═Ca(OH)2.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;复分解反应及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题综合性较强,考查的知识点较多,但难度不是很大,很好的考查了学生的基础知识和一些常识性知识.1年前查看全部
- 金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石
金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁(硅铁含硅量达95%--99%)还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁.反应工艺流程如下图:

(1)写出还原炉中硅铁还原氧化镁发生置换反应的化学方程式2MgO+Si
2Mg↑+SiO2高温 .2MgO+Si
2Mg↑+SiO2高温 .
(2)在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,该还原反应属于______(填“吸热”“放热”)反应,理由是______.
(3)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
真空条件对制备金属镁来讲,可以达到的目的是:①______②______剩余压强mmHg 760 10 1 0.1 平衡时的温度℃ 2370 1700 1430 1235
(4)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2•6H2O),其中
KCl•MgCl2•6H2O属于______.
A.盐 B.混合物
(5)写出煅烧白云石的反应化学方程式CaCO3•MgCO3
CaO•MgO+2CO2↑高温 .CaCO3•MgCO3.
CaO•MgO+2CO2↑高温 . 222768921年前1
222768921年前1 -
 cdcdkey 共回答了20个问题
cdcdkey 共回答了20个问题 |采纳率90%解题思路:(1)根据化学方程式的书写方法考虑本题;(2)根据图象中热量的变化考虑;(3)根据镁易与空气中氧气反应,真空可以降低反应的温度考虑;(4)根据混合物是由不同物质组成的物质考虑;(5)根据化学方程式的书写方法考虑.(1)反应物是氧化镁和硅,生成物是镁和二氧化硅,反应条件是高温,镁属于镁蒸汽,标上上升符号,所以方程式是:2MgO+Si
高温
.
2Mg↑+SiO2
(2)吸热,因为升高温度Mg的产率增大,说明反应是吸热反应;
(3)①由于镁与氧气能反应生成氧化镁,真空条件防止高温下Mg被空气氧化;②真空条件可以降低反应所需温度,节约能源;
(4)混合物是由不同物质组成的物质,KCl•MgCl2•6H2O是由一种物质组成,属于纯净物,且属于盐;
(5)难溶性的碳酸盐碳酸钙和碳酸镁在高温下分解为氧化物和二氧化碳,即CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑.
故答案为:(1)2MgO+Si
高温
.
2Mg↑+SiO2;(2)吸热;升高温度Mg的产率增大,说明反应是吸热反应;(3)①防止高温下Mg被空气氧化;②降低反应所需温度,节约能源;(4)A;(5)CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑.点评:
本题考点: 物质的相互转化和制备;常见的氧化物、酸、碱和盐的判别;物质发生化学变化时的能量变化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生镁的化合物的有关知识,可以根据所学知识进行回答,难度不大,需要学会从题干中提取有用信息.1年前查看全部
- (2013•无锡)高纯氧化钙是用于电子工业重要的无机化工原料.用硝酸钙溶液制备高纯氧化钙的工艺流程如图:
(2013•无锡)高纯氧化钙是用于电子工业重要的无机化工原料.用硝酸钙溶液制备高纯氧化钙的工艺流程如图:
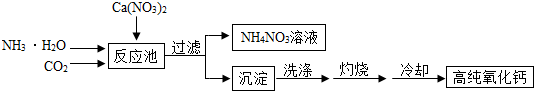
反应池中发生反应的化学方程式为:CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓+H2O
请回答下列问题:
(1)过滤操作中玻璃棒的作用是______.
(2)过滤后所得沉淀表面可能含有的可溶性杂质有______(写出一种即可).
(3)该工艺流程中可循环使用的物质是______.
(4)冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有的杂质是______.
(5)上述流程中的副产物NH4NO3可用作氮肥,氮肥的主要作用是______.
A、促进植物生长,叶色浓绿
B、增强作物的抗寒,抗旱能力
C、增强作物的抗病虫害和抗倒伏能力. 紫荆爱人1年前1
紫荆爱人1年前1 -
 众里寻她千百度XX 共回答了16个问题
众里寻她千百度XX 共回答了16个问题 |采纳率87.5%解题思路:(1)玻璃棒的用途有引流、搅拌、转移物质等;
(2)硝酸钙、硝酸铵都是易溶于水的物质;
(3)二氧化碳可以循环使用;
(4)氧化钙能和水反应生成氢氧化钙;
(5)氮肥能使农作物枝叶繁茂、叶色浓绿、还能提高产量.(1)过滤操作中玻璃棒的作用是引流.
故填:引流.
(2)过滤后所得沉淀表面可能含有的可溶性杂质有硝酸钙、硝酸铵等.
故填:硝酸钙.
(3)因为碳酸钙受热分解能生成二氧化碳,所以该工艺流程中可循环使用的物质是二氧化碳.
故填:二氧化碳.
(4)冷却需在干燥的环境中进行,否则制得的高纯氧化钙能和水反应生成氢氧化钙.
故填:氢氧化钙.
(5)上述流程中的副产物NH4NO3可用作氮肥,氮肥的主要作用是促进植物生长,叶色浓绿.
故填:A.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;碳酸钙、生石灰、熟石灰之间的转化;常见化肥的种类和作用.
考点点评: 本题主要考查物质之间的转化,比较简单,只要熟记教材内容即可顺利解答.1年前查看全部
- 金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石
金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁.反应工艺流程如图1:
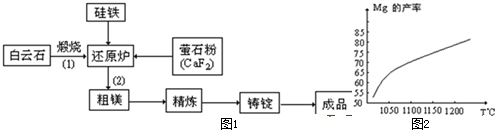
(1)在冶炼过程中反应温度对生成金属镁的影响如图2,从图中分析,还原反应的反应热△H______0(填“<”“>”“=”)理由是______.
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
真空条件对制备金属镁来讲,可以达到的目的是:①______②______剩余压强mmHg 760 10 1 0.1 平衡时的温度℃ 2370 1700 1430 1235
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2•6H2O),其中KCl•MgCl2•6H2O属于______.
A.复盐 B.混合物C.配合物
(4)写出煅烧白云石的反应化学方程式CaCO3•MgCO
CaO•MgO+2CO2↑高温 .CaCO3•MgCO.
CaO•MgO+2CO2↑高温 . X黄氏1年前1
X黄氏1年前1 -
 想飞只狗 共回答了16个问题
想飞只狗 共回答了16个问题 |采纳率87.5%解题思路:(1)根据图象中Mg的产率随温度的变化考虑;
(2)根据镁易与空气中氧气反应,真空可以降低反应的温度考虑;
(3)根据混合物是由不同物质组成的物质考虑;
(4)根据化学方程式的书写方法考虑.(1)由图象可知,温度越高,Mg的产率增大,说明升高温度平衡正移,所以正方向为吸热方向,即△H>0,
故答案为:>;升高温度Mg的产率增大,平衡向正反应方向移动,说明正反应为吸热反应;
(2)①由于镁与氧气能反应生成氧化镁,真空条件防止高温下Mg被空气氧化;②真空条件可以降低反应所需温度,节约能源,
故答案为:①降低反应所需温度,节约能源②防止Mg被空气氧化;
(3)混合物是由不同物质组成的物质,KCl•MgCl2•6H2O是由一种物质组成,属于纯净物,且属于盐;故答案为:A;
(4)难溶性的碳酸钙和碳酸镁在高温下分解为氧化物和二氧化碳,即CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑,
故答案为:CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑.点评:
本题考点: 金属冶炼的一般原理;镁的化学性质.
考点点评: 本题考查学生镁的化合物的有关知识,涉及了平衡图象的分析,方程式的书写等,难度中等,需要学会从题干中提取有用信息.1年前查看全部
- 1.柏林()汉堡()慕尼黑() A首都B啤酒城C德国最大的城市D德国最大海港E德国最大的电子工业中心 2.德国大多数主要
1.柏林()汉堡()慕尼黑() a首都b啤酒城c德国最大的城市d德国最大海港e德国最大的电子工业中心 2.德国大多数主要河流的流向是() a自北向南b自南向北c自东向西d自西向东 3.德国地势的高低分布状况是() a西高东低b东高西低c北高南低d南高北低 4.基尔运河沟通了() a易北河与莱茵河b莱茵河与多瑙河c波罗的海与北海d地中海与波罗的海 5.***城(打一德国城市) 常青树从(打一德国城市) 喜欢(地理)的原因是由于发现了中亚五国国名的共同点(打一德国名人) 6.工业区鲁尔区在地图的哪个方位
 Spaceshuttle1年前1
Spaceshuttle1年前1 -
 WS妖怪 共回答了19个问题
WS妖怪 共回答了19个问题 |采纳率89.5%1、A、C、B 2、B、自南向北 3、D、南高北低 4、C、波罗的海与北海 5、汉堡 爱因斯坦 6、位于德国北威州中部
满意请采纳1年前查看全部
- Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不
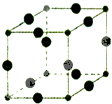 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
(1)N位于周期表中第______周期______族,与N3-含有相同电子数的三原子分子的空间构型是______.
(2)C、N、O三种元素的第一电离能由大到小的顺序为______.
(3)Cu+的电子排布式为______,其在酸性溶液中不稳定,可发生歧化反应生成Cu 2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O______.
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是______,乙醛分子中H-C-O的键角______乙醇分子中的H-C-O的键角.(填“大于”、“等于”或“小于”)
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式______.
(6)Cu3N的晶胞结构如图,N3-的配位数为______,Cu+半径为a pm,N3-半径为bpm,Cu3N的密度1.03×1032 4(a+b)3N A g/cm3.(阿伏加德罗为常数用NA表示)(1pm=10-10 cm)1.03×1032 4(a+b)3N A  wei33611年前1
wei33611年前1 -
 七月猫咪 共回答了26个问题
七月猫咪 共回答了26个问题 |采纳率96.2%解题思路:(1)N位于周期表中第二周期第VA族,与N3-含有相同电子数的微粒为等电子体,如NO2-,等电子体结构相似,根据价层电子对互斥理论确定其空间构型;
(2)同周期自左而右元素第一电离能呈增大趋势,但N元素原子的2p能级含有3个电子,处于半满稳定状态,能量较低,失去第1个电子需要的能量较大;
(3)Cu+的核外有28个电子,根据构造原理书写其基态离子核外电子排布式,原子轨道处于全空、半满或全满时最稳定;
(4)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称;
(6)Cu3N的晶胞结构如图,大球个数=12×[1/4]=3,小球个数=[1/8]=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,Cu3N的密度=[m/V].(1)N位于周期表中第二周期第VA族,与N3-含有相同电子数的微粒为等电子体,如NO2-,得电子体结构相似,亚硝酸根离子中N原子价层电子对个数=2+[1/2]×(5+1-2×2)=3且含有一个孤电子对,所以为V形结构,
故答案为:二;VA;V形;
(2)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:N>O>C;
(3)Cu+的核外有28个电子,根据构造原理知其基态离子核外电子排布式1s22s22p63s23p63d10,原子轨道处于全空、半满或全满时最稳定,Cu+的3d轨道上全满,稳定,
故答案为:1s22s22p63s23p63d10;Cu+的3d轨道上电子全满其结构稳定;
(4)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,
故答案为:sp3、sp2;大于;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称,则其结构式为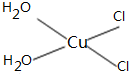 ,故答案为:
,故答案为: ;
;
(6)Cu3N的晶胞结构如图,大球个数=12×[1/4]=3,小球个数=[1/8]=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,晶胞的体积=[(2a+2b)×10-10cm]3,Cu3N的密度=[m/V]=
64×3+14
NA
[(2a+2b)×10 −10]3g/cm3=
1.03×1032
4(a+b)3N Ag/cm3,
故答案为:6;
1.03×1032
4(a+b)3N A.点评:
本题考点: 晶胞的计算;元素电离能、电负性的含义及应用;极性分子和非极性分子;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了物质结构和性质,涉及晶胞的计算、原子杂化、核外电子排布等知识点,根据密度公式、价层电子对互斥理论、构造原理等知识点来分析解答,这些知识点都是考试热点,难点是晶胞的计算,明确各个字母的含义,注意(1)中采用知识迁移的方法进行解答,题目难度中等.1年前查看全部
- (2008•北京一模)在电子工业上,常用氯化铁溶液来腐蚀铜,制造电路板.据报道,通常状况下,铜与氯化铁溶液反应转化为氯化
(2008•北京一模)在电子工业上,常用氯化铁溶液来腐蚀铜,制造电路板.据报道,通常状况下,铜与氯化铁溶液反应转化为氯化铜(氯化铜能溶于水).
(1)请完成该反应的化学方程式:Cu+2FeCl3═CuCl2+2______,该反应______(填“属于”或“不属于”)置换反应.
(2)若把一块铜板(足量)放入1000g溶质质量分数为16.25%的氯化铁溶液中,充分反应,待反应停止后取出铜片(假设无其它反应发生,操作过程中无损耗).
求:
①反应前溶液中溶质的质量.
②反应后所得溶液的质量. bqpjpq1年前1
bqpjpq1年前1 -
 kaka的皮球 共回答了27个问题
kaka的皮球 共回答了27个问题 |采纳率88.9%解题思路:(1)根据质量守恒定律和置换反应的定义考虑本题;(2)①反应前溶液中溶质为氯化铁;②反应后所得溶液的质量就是增加了参加反应的铜的质量.(1)根据反应前后各原子的种类和数目不变,可知还缺少2个铁原子,4个氯原子,因为前面系数是2,所以化学式为:FeCl2;一种单质和一种化合物反应生成另一种单质和另一种化合物的反应属于置换反应,该反应的生成物中没有单质,所以不属于置换反应;
(2)①反应前溶液中溶质为氯化铁质量为:1000g×16.25%=162.5g;
②设参加反应的铜的质量为X
Cu+2FeCl3═CuCl2+2FeCl2
64 325
X 162.5g
根据:[64/325=
X
162.5g]解得X=32,所以反应后所得溶液的质量为:32g+1000g=1032g.
故答案为:(1)FeCl2;不属于;(2)①162.5g;②1032g.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;置换反应及其应用;质量守恒定律及其应用.
考点点评: 解答本题的关键是利用质量守恒定律来求化学式,由于该反应没有产生沉淀、气体,所以反应后所得溶液的质量就是增加了参加反应的铜的质量.1年前查看全部
- 氮化铝(AIN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如
氮化铝(AIN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al 2 O 3 +N 2 +3C  2AlN+3CO。下列叙述正确的是[ ]
2AlN+3CO。下列叙述正确的是[ ]A.在氮化铝的合成反应中,N 2 是还原剂,Al 2 O 3 是氧化剂
B.上述反应中每生成2 molAlN,N 2 就得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体 liceice1年前1
liceice1年前1 -
 贵机 共回答了19个问题
贵机 共回答了19个问题 |采纳率84.2%C1年前查看全部
- 电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu═2FeCl2+CuCl
电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu═2FeCl2+CuCl2.FeCl3溶液也可跟铁发生反应:2FeCl3+Fe═3FeCl2.现向FeCl3溶液中加入一定量的铁粉和铜粉,充分反应后,发现有固体剩余.下面有关说法正确的是( )
A. 向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu2+
B. 若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解
C. 剩余固体可能只含有铜
D. 剩余固体中如果有铁,一定也有铜 wacjy1年前1
wacjy1年前1 -
 韦大人 共回答了17个问题
韦大人 共回答了17个问题 |采纳率88.2%解题思路:掌握住金属的活动性顺序,金属和盐反应若想生成新的金属,必须是在金属活动性顺序表中前面的金属可以把排在它后面的金属从盐溶液中置换出来.在这一过程中发生的反应可能有2FeCl3+Cu═2FeCl2+CuCl2,2FeCl3+Fe═3FeCl2
A.向剩余的固体加入稀盐酸,若无气体放出,说明固体没有金属铁,因此溶液中可能有Cu2+,也可能没有,故A不对.
B.由于铁的化学性质比铜活泼,因此铁首先和氯化铁溶液反应,当铁全部被消耗之后,氯化铁才和铜反应,因此剩余固体是铜与铁的混合物,说明铜并没有参与反应,故B不对.
C.由于铁首先和氯化铁溶液反应,因此若有剩余固体时有可能只有铜,故C正确.
D.由于铁首先和氯化铁溶液反应,因此剩余固体中如果有铁一定也有铜,故D正确.
故选CD.点评:
本题考点: 金属的化学性质.
考点点评: 本题主要考查了对金属活动性顺序的应用,加强学生对信息资料的分析能力的培养,培养学生分析能力、解决问题的能力.1年前查看全部
- 下列各句中没有语病的一项是( ) A.电子工业能否迅速发展,并广泛渗透到各
下列各句中没有语病的一项是()
a.电子工业能否迅速发展,并广泛渗透到各行各业中去,关键在于能不能加速训练并造就一批专业技术人才。 b.奶奶看到我俩非常高兴,就急忙从炕上下来,拉住我们的手问这问那。 c.鲁迅先生的晚年,仍然精力充沛,充满高昂的斗志,手握一支“金不换”,写了许多富有激情的作品。 d.她从《羊城晚报》上看到了南方医院采用新技术,为小儿***后遗症、两腿长度不一的患者施行肌骨一次延长手术。  ddnvvf1年前1
ddnvvf1年前1 -
 haiyang984 共回答了17个问题
haiyang984 共回答了17个问题 |采纳率94.1%A.
B项歧义,一是“我俩非常高兴”,二是“奶奶看到我俩后,她自己非常高兴”。C主谓不配,改为“晚年的鲁迅先生”。D.项缺宾语中心词,最后应加上“的消息”三个字。1年前查看全部
- Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
(1)N位于周期表中第______周期______族,与N3-含有相同电子数的三原子分子的空间构型是______.
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因______.
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是______,乙醛分子中H-C-O的键角______乙醇分子中的H-C-O的键角.(填“大于”、“等于”或“小于”)
(4)Cu+的电子排布式为______,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O______.
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式______.
(6)Cu3N的晶胞结构如图,N3-的配位数为______,Cu+半径为a pm,N3-半径为b pm,Cu3N的密度103×1030 4(a+b)3NA g/cm3.(阿伏加德罗为常数用NA表示)103×1030 4(a+b)3NA  枫叶在树梢1年前1
枫叶在树梢1年前1 -
 等待ing天亮 共回答了19个问题
等待ing天亮 共回答了19个问题 |采纳率94.7%解题思路:(1)N位于周期表中第二周期第VA族,与N3-含有相同电子数的微粒为等电子体,如NO2-,等电子体结构相似,根据价层电子对互斥理论确定其空间构型;(2)含有自由电子的金属单质能导电;(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;(4)Cu+的核外有28个电子,根据构造原理书写其基态离子核外电子排布式,原子轨道处于全空、半满或全满时最稳定;(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称;(6)Cu3N的晶胞结构如图,大球个数=12×14=3,小球个数=18×8=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,Cu3N的密度=mV.(1)N位于周期表中第二周期第VA族,与N3-含有相同电子数的微粒为等电子体,如NO2-,得电子体结构相似,亚硝酸根离子中N原子价层电子对个数=2+[1/2]×(5+1-2×2)=3且含有一个孤电子对,所以为V形结构,故答案为:二;VA;V;
(2)铜属于金属晶体,晶体中含有可以自由移动的电子,通电后定向移动,所以能导电,
故答案为:Cu为金属晶体,晶体中存在可自由移动的电子,通电后定向移动;
(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,
故答案为:sp3、sp2;大于;
(4)Cu+的核外有28个电子,根据构造原理知其基态离子核外电子排布式1s22s22p63s23p63d10,原子轨道处于全空、半满或全满时最稳定,Cu+的3d轨道上全满,稳定,故答案为:1s22s22p63s23p63d10;Cu+的3d轨道上电子全满其结构稳定;
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称,则其结构式为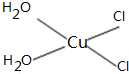 ,故答案为:
,故答案为: ;
;
(6)Cu3N的晶胞结构如图,大球个数=12×[1/4]=3,小球个数=[1/8×8=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数=3×2=6,晶胞的体积=[(2a+2b)×10-10cm]3,Cu3N的密度=
m
V]=
64×3+14
NA
[(2a+2b)×10−10]3g/cm3=
103×1030
4(a+b)3NAg/cm3,故答案为:6;
103×1030
4(a+b)3NA.点评:
本题考点: 晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了物质结构和性质,涉及晶胞的计算、原子杂化、核外电子排布等知识点,根据密度公式、价层电子对互斥理论、构造原理等知识点来分析解答,这些知识点都是考试热点,难点是晶胞的计算,明确各个字母的含义,注意(1)中采用知识迁移的方法进行解答,题目难度中等.1年前查看全部
- 有“硅谷”之称的电子工业中心位于( )
有“硅谷”之称的电子工业中心位于( )
A.休斯敦附近
B.芝加哥附近
C.洛杉矶附近
D.圣弗朗西斯科附近 风飘寒舞1年前1
风飘寒舞1年前1 -
 合肥紫薇 共回答了17个问题
合肥紫薇 共回答了17个问题 |采纳率82.4%解题思路:(1)圣弗朗西斯科又叫旧金山、三藩市,是美国太平洋沿岸的金融、贸易、教育和文化中心之一,也是著名的天然海港;
(2)圣弗朗西斯科附近的“硅谷”,是世界上最大的高新技术产业区.(1)休斯顿是新兴的宇航中心,故A错误;
(2)芝加哥是以传统的畜牧产品加工为主,故B错误;
(3)洛杉矶是太平洋沿岸的最大港口城市,享誉世界的好莱坞和迪斯尼乐园都在这里,故C错误;
(4)世界上最大的“硅谷”位于圣弗朗西斯科附近.
故选:D.点评:
本题考点: 技术创新对美国经济发展的意义;美国的人口、居民和主要城市.
考点点评: 本题考查的是美国高新技术产业的分布和主要城市分布.1年前查看全部
- NH1kl(jn1)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH1Hjn1在分析试剂、医药、电子工业中用途广
NH1kl(jn1)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH1Hjn1在分析试剂、医药、电子工业中用途广泛.请回答下列问题:

(1)NH1kl(jn1)2可作净水剂,其理由是______(用必要的化学用语和相关文字说明).
(2)相同条件下,1.1mnl•L-1NH1kl(jn1)2中c(NH
)______1.1mnl•L-1NH1Hjn1中c(NH+1
).(填“等于”、“大于”或“小于”)+1
(3)用等式表示1.1mnl•L-1NH1kl(jn1)2溶液中各离子浓度关系______.
(1)如图1是1.1mnl•L-1电解质溶液的pH随温度变化的图象.其中符合1.1mnl•L-1NH1kl(jn1)2的pH随温度变化的曲线是______(填写字母),导致pH随温度变化的原因是______;
(5)室温时,向111mL1.1mnl•L-1NH1Hjn1溶液中滴加1.1mnl•L-1NknH溶液,得到溶液pH与NknH溶液体积的关系曲线如图2所示:试分析图中k、b、c、d四个点,水的电离程度最大的是______;在b点,溶液中各离子浓度由大到小的排列顺序是______. create10291年前1
create10291年前1 -
 xx沦落女 共回答了17个问题
xx沦落女 共回答了17个问题 |采纳率94.1%解题思路:(1)Al3+水解生成的Al(OH)3具有吸附性;
(2)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(3)溶液中存在电荷守恒分析;
(4)NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
(5)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.(1)Alf+水解生成的Al(OH)f具有吸附性,离子方程式:Alf++fH2O═Al(OH)f+fH+,Al(OH)f,
故答案为:Alf+水解生成的Al(OH)f具有吸附性,即Alf++fH2O═Al(OH)f+fH+,Al(OH)f吸附悬浮颗粒使其沉降从而净化水;
(2)NH着Al(SO着)2与NH着HSO着中的NH着+均发生水解,但是NH着Al(SO着)2中Alf+水解呈酸性抑制NH着+水解,HSO着-电离出H+同样抑制NH着+水解,因为HSO着-电离生成的H+浓度比Alf+水解生成的H+浓度大,所以NH着HSO着中NH着+水解程度比NH着Al(SO着)2中的小,故答案为:小于;
(f)根据电荷守恒,可以求出c(NH着+)+fc(Alf+)+c(H+)=2c(SO着2-)+c(OH-);
故答案为:c(NH着+)+fc(Alf+)+c(H+)=2c(SO着2-)+c(OH-);
(着)NH着Al(SO着)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:Ⅰ;NH着Al(SO着)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
(5)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH着)2SO着与Na2SO着;b、c、d三点溶液均含有NHf•H2O,(NH着)2SO着可以促进水的电离,而NHf•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH着)2SO着、Na2SO着、NHf•H2O三种成分,a点时c(Na+)=c(SO着2-),b点时c(Na+)>c(SO着2-),根据N元素与S元素的关系,可以得出c(SO着2-)>c(NH着+),故c(Na+)>c(SO着2-)>c(NH着+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO着2-)>c(NH着+)>c(OH-)=c(H+).点评:
本题考点: 盐类水解的应用;水的电离;影响盐类水解程度的主要因素.
考点点评: 本题考查盐类的水解和离子浓度大小的比较,题目难度较大,注意电解质溶液中离子浓度大小和电荷守恒守恒的分析应用.1年前查看全部
- 电子工业制作电路板的过程中,用FeCl 3 溶液来溶解电路板中多余的铜,反应如下:2FeCl 3 +Cu═2FeCl 2
电子工业制作电路板的过程中,用FeCl 3 溶液来溶解电路板中多余的铜,反应如下:2FeCl 3 +Cu═2FeCl 2 +CuCl 2 .FeCl 3 溶液也可跟铁发生反应:2FeCl 3 +Fe═3FeCl 2 .现向FeCl 3 溶液中加入一定量的铁粉和铜粉,充分反应后,发现有固体剩余.下面有关说法正确的是( ) A.向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu 2+ B.若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解 C.剩余固体可能只含有铜 D.剩余固体中如果有铜,一定也有铁  soon0061年前1
soon0061年前1 -
 schuvler 共回答了22个问题
schuvler 共回答了22个问题 |采纳率86.4%在这一过程中发生的反应可能有2FeCl 3 +Cu═2FeCl 2 +CuCl 2 ,2FeCl 3 +Fe═3FeCl 2
A.向剩余的固体加入稀盐酸,若无气体放出,说明固体没有金属铁,因此溶液中可能有Cu 2+ ,也可能没有,故A不对.
B.由于铁的化学性质比铜活泼,因此铁首先和氯化铁溶液反应,当铁全部被消耗之后,氯化铁才和铜反应,因此剩余固体是铜与铁的混合物,说明铜并没有参与反应,故B不对.
C.由于铁首先和氯化铁溶液反应,因此若有剩余固体时有可能只有铜,故C正确.
D.由于铁首先和氯化铁溶液反应,因此若有剩余固体时有可能只有铜,也有可能是铁和铜的混合物,即可能有铁,但不是一定有铁,故D不对.
故选C.1年前查看全部
- 电子工业上用30%的氯化铁溶液腐蚀印刷线路板上的铜箔 这个要怎么反应?
 chp5551年前1
chp5551年前1 -
 妍0591 共回答了16个问题
妍0591 共回答了16个问题 |采纳率100%就是铜和氯化铁的反应.
反应方程式:Cu + 2FeCl3 == CuCl2 + 2FeCl2
离子方程式:Cu + 2Fe3+ == Cu2+ + 2Fe2+
这个反应说明氧化性:Fe3+ > Cu2+ > Fe2+1年前查看全部
- 电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu═2FeCl2+CuCl
电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu═2FeCl2+CuCl2.FeCl3溶液也可跟铁发生反应:2FeCl3+Fe═3FeCl2.现向FeCl3溶液中加入一定量的铁粉和铜粉,充分反应后,发现有固体剩余.下面有关说法正确的是( )
A.向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu2+
B.若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解
C.剩余固体可能只含有铜
D.剩余固体中如果有铁,一定也有铜 thepowerofdream1年前1
thepowerofdream1年前1 -
 ミ流云ミ 共回答了22个问题
ミ流云ミ 共回答了22个问题 |采纳率95.5%解题思路:掌握住金属的活动性顺序,金属和盐反应若想生成新的金属,必须是在金属活动性顺序表中前面的金属可以把排在它后面的金属从盐溶液中置换出来.在这一过程中发生的反应可能有2FeCl3+Cu═2FeCl2+CuCl2,2FeCl3+Fe═3FeCl2
A.向剩余的固体加入稀盐酸,若无气体放出,说明固体没有金属铁,因此溶液中可能有Cu2+,也可能没有,故A不对.
B.由于铁的化学性质比铜活泼,因此铁首先和氯化铁溶液反应,当铁全部被消耗之后,氯化铁才和铜反应,因此剩余固体是铜与铁的混合物,说明铜并没有参与反应,故B不对.
C.由于铁首先和氯化铁溶液反应,因此若有剩余固体时有可能只有铜,故C正确.
D.由于铁首先和氯化铁溶液反应,因此剩余固体中如果有铁一定也有铜,故D正确.
故选CD.点评:
本题考点: 金属的化学性质.
考点点评: 本题主要考查了对金属活动性顺序的应用,加强学生对信息资料的分析能力的培养,培养学生分析能力、解决问题的能力.1年前查看全部
- (2012•泉港区质检)硅晶体(Si)是一种重要的半导体材料,广泛应用于电子工业的各个领域.硅的冶炼中,第一步常用碳在高
(2012•泉港区质检)硅晶体(Si)是一种重要的半导体材料,广泛应用于电子工业的各个领域.硅的冶炼中,第一步常用碳在高温下还原二氧化硅制得粗硅,反应的化学方程式如下:SiO2+2C
Si+2CO↑;高温 .
现要制备含硅7 kg的粗硅,理论上需要二氧化硅多少千克? ellalianlei1年前1
ellalianlei1年前1 -
 yzgsen 共回答了16个问题
yzgsen 共回答了16个问题 |采纳率75%解题思路:由粗硅的质量根据化学方程式可以计算出需要二氧化硅的质量.设需要二氧化硅的质量为x.
SiO2+2C
高温
.
Si+2CO↑
60 28
x 7kg
[60/28]=[x/7kg],x=15kg
答:理论上需要二氧化硅15kg.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较小.1年前查看全部
- (2008•茂名一模)Al和Si、Ge和As在元素周期表金属和非金属过渡位置上,在其单质和化合物在建筑业、电子工业和石油
(2008•茂名一模)Al和Si、Ge和As在元素周期表金属和非金属过渡位置上,在其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛.请回答下列问题:
(1)As 的价层电子构型为______
(2)AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,其中铝原子与氯原子的成键类型是______
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与个N原子相连,与同一个Al原子相连的N原子构成的空间构型为______.在四大晶体类型中,AlN属于______晶体.
(4)Si和C同主族,Si、C和0成键情况如下:
在C和0之间可以形成双键形成CO2分子,而Si和O则不能和碳那样形成有限分子原因是______C-O C=O Si-O Si=O 键能/KJ•mol-1 360 803 464 640
(5)SiCl4(l)常用作烟雾剂,原因Si存在3d轨道,能同H20 (l)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理______. MaiKfan1年前1
MaiKfan1年前1 -
 肝肝 共回答了16个问题
肝肝 共回答了16个问题 |采纳率100%解题思路:(1)As为第四周期第ⅤA族元素;
(2)由信息可知,熔点较低,以分子形式存在;
(3)AlN晶体与金刚石类似,每个Al原子与个N原子相连,为空间网状结构,与同一个Al原子相连的N原子构成正四面体;
(4)利用表格中键能的数据可知,C=O键能较大,Si-O键能较大;
(5)由信息可知,SiCl4(l)水解生成HCl和硅酸,以此来解答.(1)As为第四周期第ⅤA族元素,则价电子构型为4s24p3,故答案为:4s24p3;
(2)由信息可知,熔点较低,以分子形式存在,则属于分子晶体,所以Al、Cl之间以共价键结合,故答案为:共价键(或σ键);
(3)AlN晶体与金刚石类似,每个Al原子与个N原子相连,为空间网状结构,与同一个Al原子相连的N原子构成正四面体,且晶体类型与金刚石相同,为原子晶体,故答案为:正四面体;原子;
(4)由表格中键能的数据可知,C=O键能较大,Si-O键能较大,即Si一0大于C一0的键,C=0的键能大于Si=O的键能,所以Si和O成单键,而C和O以双键形成稳定分子,故答案为:Si一0大于C一0的键,C=0的键能大于Si=O的键能,所以Si和O成单键,而C和O以双键形成稳定分子;
(5)由信息可知,SiCl4(l)水解生成HCl和硅酸该反应为SiCl4(l)+3H2O (l)=H2Si03 (s)+4HCl(aq),故答案为:SiCl4(l)+3H2O (l)=H2Si03 (s)+4HCl(aq).点评:
本题考点: 化学键;键能、键长、键角及其应用.
考点点评: 本题考查化学键,侧重物质结构与性质的考查,为高考常见考点,涉及价电子、化学键、晶体类型、键能、水解等知识点,综合性较强,注重学生知识迁移应用能力的培养,题目难度中等.1年前查看全部
- (c888•茂名二模)电子工业制造光电管时,需要一种经强光照射就失去电子从而接通电路的材料.制造这种材料的物质属于(
(c888•茂名二模)电子工业制造光电管时,需要一种经强光照射就失去电子从而接通电路的材料.制造这种材料的物质属于( )
A.ⅦA族元素
B.聚乙烯
C.ⅠA族元素
D.二氧化硅 神奇猪猪1年前1
神奇猪猪1年前1 -
 爱USD的猫 共回答了18个问题
爱USD的猫 共回答了18个问题 |采纳率88.9%解题思路:根据金属活动顺序表和原子失电子的难易程度方面来分析,找原子半径最大,最外层电子最少,最容易失去电子的元素.根据题意,金属4原子应该是一种经强光照射就失去电子4金属原子,要求金属4活泼性相当强,极易失去电子,
A、ⅦA族元素在同周期元素中原子半径小,得电子能力强,故A不选;
B、聚乙烯是最结构简单4高分子,也是应用最广泛4高分子材料,无法失去电子,故B不选;
C、ⅠA族元素在同周期元素中原子半径最大,最外层电子最少,最容易失去电子4元素,故选C;
着、二氧化硅用途很广泛,主要用于制玻璃、水玻璃、陶器、搪瓷、耐火材料、气凝胶毡、硅铁、型砂、单质硅、水泥,也是光导纤维4主要成份,故着不选.
故选C.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用.
考点点评: 本题主要考查学生根据题目信息结合金属活动顺序表来分析解决问题的能力,以金属活动顺序表为载体,来透视金属活动顺序表的其它应用.1年前查看全部
- 电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷电路板,若反应过程中有4mol电子发生转移,会有____mol铜溶解
 小雪薇薇1年前1
小雪薇薇1年前1 -
 yinling 共回答了25个问题
yinling 共回答了25个问题 |采纳率80%2mol1年前查看全部
- 电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu═2FeCl2+CuCl
电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu═2FeCl2+CuCl2.FeCl3溶液也可跟铁发生反应:2FeCl3+Fe═3FeCl2.现向FeCl3溶液中加入一定量的铁粉和铜粉,充分反应后,发现有固体剩余.下面有关说法正确的是( )
A. 向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu2+
B. 若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解
C. 剩余固体可能只含有铜
D. 剩余固体中如果有铁,一定也有铜 liuhanyuan1年前1
liuhanyuan1年前1 -
 a1q1s2w2 共回答了20个问题
a1q1s2w2 共回答了20个问题 |采纳率80%解题思路:掌握住金属的活动性顺序,金属和盐反应若想生成新的金属,必须是在金属活动性顺序表中前面的金属可以把排在它后面的金属从盐溶液中置换出来.在这一过程中发生的反应可能有2FeCl3+Cu═2FeCl2+CuCl2,2FeCl3+Fe═3FeCl2
A.向剩余的固体加入稀盐酸,若无气体放出,说明固体没有金属铁,因此溶液中可能有Cu2+,也可能没有,故A不对.
B.由于铁的化学性质比铜活泼,因此铁首先和氯化铁溶液反应,当铁全部被消耗之后,氯化铁才和铜反应,因此剩余固体是铜与铁的混合物,说明铜并没有参与反应,故B不对.
C.由于铁首先和氯化铁溶液反应,因此若有剩余固体时有可能只有铜,故C正确.
D.由于铁首先和氯化铁溶液反应,因此剩余固体中如果有铁一定也有铜,故D正确.
故选CD.点评:
本题考点: 金属的化学性质.
考点点评: 本题主要考查了对金属活动性顺序的应用,加强学生对信息资料的分析能力的培养,培养学生分析能力、解决问题的能力.1年前查看全部
- (14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe 3 O 4 (s)=4CO 2 (g)+3Fe(s)△H="a" kJ·mol -1
CO(g)+3Fe 2 O 3 (s)=CO 2 (g)+2Fe 3 O 4 (s)△H="b" kJ·mol -1
反应3CO(g)+Fe 2 O 3 (s)=3CO 2 (g)+2Fe(s)的△H= kJ·mol -1 (用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH 3 OH(g) HCOOCH 3 (g)+2H 2 (g)△H>0
HCOOCH 3 (g)+2H 2 (g)△H>0
第二步:HCOOCH 3 (g) CH 3 OH(g) +CO(g) △H>0
CH 3 OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: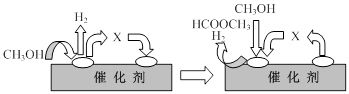
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。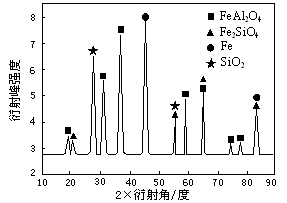
⑷某催化剂样品(含Ni 2 O 3 40%,其余为SiO 2 )通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO) 4 (沸点43 ℃),并在180 ℃时使Ni(CO) 4 重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl 2 溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。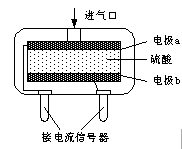
 乐乐_小鱼儿1年前1
乐乐_小鱼儿1年前1 -
 耀眼Dê瞬间 共回答了16个问题
耀眼Dê瞬间 共回答了16个问题 |采纳率75%⑴(2a+b)/3 ⑵①HCHO ②升高温度,降低压强
⑶FeAl 2 O 4 +8H + =Fe 2+ +2Al 3+ +4H 2 O ⑷3:8
⑸①0.1mol(或0.1N A ) ②CO+H 2 O-2e - =CO 2 +2H + (每空2分,共14分)
1年前查看全部
- 电子工业上用氯化铁溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收铜及制取纯净的氯化铁溶液中的化学方程式
 winnerlz1年前1
winnerlz1年前1 -
 13121796608 共回答了23个问题
13121796608 共回答了23个问题 |采纳率91.3%用氯化铁溶液腐蚀印刷电路板发生:2FeCl3 + Cu = 2FeCl2 + CuCl2,所得溶液中既有CuCl2、FeCl2,还可能有剩余的FeCl3.在其中加入过量的铁粉,过滤,在滤渣中加入足量盐酸,等不再有气体产生时再过滤,洗涤,干燥得到纯净铜粉.将两次过滤所得滤液合并,通入足量氯气,剩余盐酸可不必除去,可防止氯化铁水解变质.1年前查看全部
- 没有电子工业的发展,也就不可能有电视机的消费;没有VCD机的生产,人们就不会有VCD机的需求。随着生产的发展,人们的消费
没有电子工业的发展,也就不可能有电视机的消费;没有VCD机的生产,人们就不会有VCD机的需求。随着生产的发展,人们的消费水平在不断提高。这主要说明了 [ ]A、消费是生产的目的,生产为消费服务
B、生产是消费的动力,生产比消费更为重要
C、生产决定消费,没有生产就没有消费
D、生产和消费是社会再生产过程中的两个重要环节 逍遥人19811年前1
逍遥人19811年前1 -
 dfjzy 共回答了19个问题
dfjzy 共回答了19个问题 |采纳率78.9%C1年前查看全部
- 下图中,①是电子工业区,周围有众多的高等院校,②是石油化工区。读图,完成下列各题。 (1)电子工业区位选择的主导因素是_
下图中,①是电子工业区,周围有众多的高等院校,②是石油化工区。读图,完成下列各题。 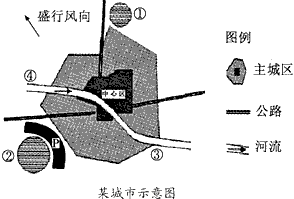
(1)电子工业区位选择的主导因素是________________。
(2)许多与石油化工企业有生产联系的厂家纷纷集聚在石油化工区,其根本目的是________________。
(3)若在图中③处布局钢铁厂,是否合理?_______,其理由是_________________________________。
(4)若在图中④处建自来水厂,是否合理?_______,其理由是_________________________________。
(5)为了保护城市环境,处于石油化工区与主城区间的P带应设置__________。 群鸥散1年前1
群鸥散1年前1 -
 qingquan6 共回答了17个问题
qingquan6 共回答了17个问题 |采纳率94.1%(1)知识、技术
(2)降低成本,获得规模效益
(3)不合理;钢铁厂污染大气,应放在盛行风向的下风向
(4)合理;河流上游,水质最好
(5)绿化带1年前查看全部
- 下列城市与其主要工业部门的组合,正确的是( ) A.郑州——钢铁工业 B.洛阳——电子工业 C.平顶山——煤炭工业 D
下列城市与其主要工业部门的组合,正确的是( )
A.郑州——钢铁工业 B.洛阳——电子工业 C.平顶山——煤炭工业 D.开封——石油工业  w哈哈哈1年前1
w哈哈哈1年前1 -
 冻结888 共回答了14个问题
冻结888 共回答了14个问题 |采纳率92.9%C
1年前查看全部
- 电子技术离不开高纯硅,硅广泛应用于电子工业,工业上制硅的基本原理是:SiO2+2C 高温 .
电子技术离不开高纯硅,硅广泛应用于电子工业,工业上制硅的基本原理是:SiO2+2C
Si+2CO↑,该反应中还原剂是______,该反应中氧化剂是______.高温 . ayan352251年前1
ayan352251年前1 -
 纳可鲁鲁 共回答了21个问题
纳可鲁鲁 共回答了21个问题 |采纳率95.2%解题思路:根据氧化反应中得氧的物质为还原剂,失氧的物质为氧化剂进行解答.在SiO2+2C
高温
.
Si+2CO↑,碳在该反应中得到氧,是还原剂,二氧化硅在该反应中失去氧,是氧化剂.
故答案为:C;SiO2.点评:
本题考点: 还原反应;氧化反应.
考点点评: 解答本题要充分理解氧化还原反应的含义,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 指出句子中的错误并改正。电子工业能否迅速发展,并广泛渗透到各行各业中去,关键在于要加速训练并造就一批专门技术人才。
 xuyue011年前1
xuyue011年前1 -
 假扮的精灵 共回答了15个问题
假扮的精灵 共回答了15个问题 |采纳率93.3%将“能否”改为“能”。
考查病句的修改。修改病句的前提是正确辨识。一面词和两面词要注意呼应,如“能否”、“该不该”等。1年前查看全部
- 在线求指导:过去电子工业常用30%
在线求指导:过去电子工业常用30%
过去电子工业常用30%的FeCl 3 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.发生反应的化学方程式为:2FeCl 3 +Cu=2FeCl 2 +CuCl 2 .
(1)检验腐蚀后的溶液中是否含有Fe 3+ 应用的试剂是____________________.
(2)为了从使用过的腐蚀液中回收铜,并重新制得纯净的FeCl 3 ,溶液,采用下列实验步骤,请在各空格内填上适当的物质以使实验达到预期目的.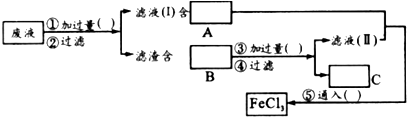
(3)写出有关反应的离子方程式:_____________________.  问天得豆奶1年前1
问天得豆奶1年前1 -
 snow-cj 共回答了23个问题
snow-cj 共回答了23个问题 |采纳率87%(1)KSCN(或其他含SCN - 的盐)溶液
(2)Fe粉;FeCl 2 ;Fe、Cu;盐酸;H 2 ;Cl 2
(3)2Fe 3+ +Fe=3Fe 2+, 、Fe+Cu 2+ =Fe 2+ +Cu、Fe+2H + =Fe 2+ +H 2 ↑、2Fe 2+ + Cl 2 =2Fe 3+ +2Cl -1年前
91年前查看全部
- 一道高一化学题 电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
一道高一化学题 电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
(1).请写出上述六种物质的化学式
(2).请写出相关的化学方程式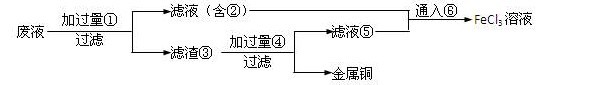
 fxshu1年前1
fxshu1年前1 -
 水恋冰 共回答了15个问题
水恋冰 共回答了15个问题 |采纳率100%(1) Fe FeCl2 Fe Cu HCl FeCl2 Cl2
(2) Fe + Cu2+ = Cu + Fe 2+
Fe + 2Fe3+ = 3 Fe2+
Fe + 2H + = H2 + Fe 2+
2Fe 2+ + Cl2 = 2Fe3+ + 2Cl -1年前查看全部
- (2008•南京二模)氮化铝(AlN)广泛用于电子工业、陶瓷工业等领域.可通过如下反应制取:Al2O3+N2+3C
(2008•南京二模)氮化铝(AlN)广泛用于电子工业、陶瓷工业等领域.可通过如下反应制取:Al2O3+N2+3C
2AlN+3CO,下列叙述正确的( )高温 .
A.该反应中,Al2O3是氧化剂
B.该反应中,N2是还原剂
C.该反应中,C是还原剂
D.该反应中每生成2molAlN,N2得到3mole- asdasg0g00h001年前1
asdasg0g00h001年前1 -
 AMY_10 共回答了17个问题
AMY_10 共回答了17个问题 |采纳率100%解题思路:反应Al2O3+N2+3C
2AlN+3CO中N元素化合价降低,被还原,N2为氧化剂,C元素化合价升高,被氧化,C为还原剂,Al和O元素的化合价没有变化,可根据化合价的变化计算转移的电子数目.高温 .反应Al2O3+N2+3C
高温
.
2AlN+3CO中N元素化合价降低,被还原,N2为氧化剂,C元素化合价升高,被氧化,C为还原剂,Al和O元素的化合价没有变化,该反应中每生成2molAlN,有1molN2参加反应,得到电子的物质的量为2×(3-0)mol=6mol,
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,解答本题的关键是能从化合价变化的角度判断.1年前查看全部
- (10湛江15).电子工业制作电路板的过程中,用FeCl 3 溶液来溶解电路板中多余的铜,反应如下: 2FeCl 3 +
(10湛江15).电子工业制作电路板的过程中,用FeCl 3 溶液来溶解电路板中多余的铜,反应如下: 2FeCl 3 +Cu==2FeCl 2 +CuCl 2 。FeCl3溶液也可跟铁发生反应:2FeCl 3 +Fe==3FeCl 2 。现向FeCl 3 溶液中加入一定量的铁粉和铜粉,充分反应后,发现有固体剩余。下面有关说法正确的是
A.向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu 2+ B.若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解 C.剩余固体可能只含有铜 D.剩余固体中如果有铁,一定也有铜  suixx1081年前1
suixx1081年前1 -
 xin妞 共回答了14个问题
xin妞 共回答了14个问题 |采纳率100%C D
本题考查的是金属活动性顺序及其应用,在金属活动性顺序表中前面的金属可以把排在它后面的金属从盐溶液中置换出来。在本题这一过程中发生的反应可能有2FeCl 3 +Cu═2FeCl 2 +CuCl 2 ,2FeCl 3 +Fe═3FeCl 2 。
A.向剩余的固体加入稀盐酸,若无气体放出,说明固体没有金属铁,因此溶液中可能有Cu 2+ ,也可能没有,故A不正确;
B.由于剩余固体是铜与铁的混合物,而铁的化学性质比铜活泼,因此铁会首先和氯化铁溶液反应,当铁完全反应完之后,氯化铁才会和铜反应,据此可知铜并没有参与反应,故B不正确;
C.由于会铁首先和氯化铁溶液反应,之后氯化铁才会和铜反应,因此若有剩余固体时会有可能只有铜而没有铁,故C正确;
D.由于铁会首先和氯化铁溶液反应,之后氯化铁才会和铜反应,如果铁有剩余,则氯化铁已反应完,故铜没有机会参加反应,所以一定剩余,故D正确。故选C、D1年前查看全部
- 一道化学高一的题求解释陆发表点评] 电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl
一道化学高一的题求解释
陆发表点评] 电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl3的溶液与未受保护的铜膜反应以去掉铜,腐蚀后的废液中含有大量的Cu2+.为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4·5H2O),常用如下步骤: ①向废液中加过量的铁屑,搅拌,静置;②滤出固体物质;③将滤出的固体物质加热煅烧;④把煅烧后的物质放在硫酸中溶解;⑤调节溶液的pH在3.4—4之间,使Fe(OH)3沉淀完全,过滤;⑥浓缩滤液,析出晶体;⑦将过滤得到的晶体溶解,再结晶. (1)上述③步操作所得煅烧产物成分是_______________. A.CuO B.CuO和FeO C.CuO和Fe2O3 D.CuO和Fe3O4 (2)上述第⑤步操作中,调节溶液的pH宜加入的物质是_______________. A.氧化铜粉末 B.NaOH溶液 C.稀氨水 D.Na2CO3 (3)上述第⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是_______________. A.蒸干所得到的物质可能含有无水硫酸铜 B.温度升高CuSO4溶解度增大 C.温度升高Cu2+被还原为Cu D.温度升高CuSO4分解 答案 (1)D (2)A (3)A 解析: 铁加入硫酸铜溶液中可将铜置换出来,得到的是硫酸亚铁,但亚铁盐水解后,生成的氢氧化亚铁则会被空气中的氧气氧化为氢氧化铁,进一步加热则失水成为氧化铁,而铜在空气中受热也会被氧化为氧化铜.调节pH不能带入新的杂质.蒸干浓缩液可能有没有反应完的硫酸铜. 好的,下面是我的问题:1第一小问为+什么选D而不选C?Fe3O4是怎么来的?2第二小问中加氧化铜怎么调节ph值 ?是通过氧化铜和H+反应来升高ph吗?
 酒鬼也清醒1年前1
酒鬼也清醒1年前1 -
 总会有情天 共回答了16个问题
总会有情天 共回答了16个问题 |采纳率87.5%1.因为高温下四氧化三铁是比其他氧化铁更为稳定的存在.四氧化三铁就是高温下三氧化二铁自己脱氧的产物.
2.正如你所说,而且用氧化铜不会引入新的杂质.1年前查看全部
- 半导体材料在电子工业中有着广泛的应用,下面的产品中哪个是由半导体材料制成的( )
半导体材料在电子工业中有着广泛的应用,下面的产品中哪个是由半导体材料制成的( )
A. 二极管
B. 滑动变阻器
C. 电路开关
D. 电容器 JohnnyWei1年前1
JohnnyWei1年前1 -
 凝谊 共回答了27个问题
凝谊 共回答了27个问题 |采纳率88.9%解题思路:根据半导体的定义和特性去半导体是指在常温下,导电性能介于导体和绝缘体之间.它有五大特性,其中有一个是导电特性.A、二极管是由半导体做成的器件,它具有单向导电性.二极管是由P型半导体和N型半导体组成的,这两种半导体相互接触时,其交接区域称为PN结,PN结具有单向导电性.
B、滑动变阻器是由电阻率较大的电阻丝做成的.
C、电路开关是用金属制成的,是导体.
D、电容器是由两片接近并且相互绝缘的导体组成的储存电荷和电能的器件.
故选 A.点评:
本题考点: 半导体的特点.
考点点评: 半导体的应用非常广泛,初中物理只简单的介绍了半导体的定义,课外应多了解一下.1年前查看全部
- 高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰制备高纯氧化钙的工艺流程如图:
高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰制备高纯氧化钙的工艺流程如图:

请回答下列问题:
(1)过滤操作中玻璃棒的作用是______;
(2)反应A中的化学方程式为______;
(3)反应B中为提高产率,所加气体的顺序是______;(填字母)
A.先通入二氧化碳再通入氨气B.先通入氨气再通入二氧化碳
(4)灼烧时发生反应的化学方程式为CaCO3
CaO+CO2↑高温 .CaCO3,该工艺流程中可循环使用的物质是______.
CaO+CO2↑高温 .
(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙中会混有的两种杂质分别是______和______.
(6)生产过程中的NH4NO3在农业上属于______肥,在使用过程中不能与______性物质混用,否则会降低肥效,写出硝酸铵与熟石灰反应的方程式______.检验该反应中产生的刺激性气味的气体是用湿润的______试纸. phc07141年前1
phc07141年前1 -
 footmans 共回答了17个问题
footmans 共回答了17个问题 |采纳率76.5%解题思路:(1)根据过滤操作中玻璃棒的作用是引流进行解答;
(2)根据硝酸和氧化钙反应生成硝酸钙和水进行解答;
(3)根据二氧化碳溶于水生成碳酸,溶液呈酸性,有利于氨气的吸收进行解答;
(4)根据碳酸钙高温煅烧生成氧化钙和二氧化碳,生成的二氧化碳可以循环使用进行解答;
(5)根据氧化钙能和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水进行解答;
(6)根据硝酸铵中含有氮元素,属于铵态氮肥,遇到碱会放出氨气,氨气能使湿润的红色石蕊试纸变蓝进行解答.(1)过滤操作中玻璃棒的作用是引流.故填:引流;
(2)硝酸和氧化钙反应生成硝酸钙和水,化学方程式为2HNO3+Ca0=Ca(NO3)2+H2O;故填:2HNO3+Ca0=Ca(NO3)2+H2O;
(3)二氧化碳溶于水生成碳酸,溶液呈酸性,有利于氨气的吸收,所以所加气体的顺序是先通入二氧化碳再通入氨气;故填:A;
(4)反应物是碳酸钙,生成物是氧化钙和二氧化碳,反应条件是高温,二氧化碳后面标上上升符号,所以方程式是:CaCO3
高温
.
CaO+CO2↑;因为碳酸钙受热分解能生成二氧化碳,二氧化碳在前边的反应中是反应物,所以该工艺流程中可循环使用的物质是二氧化碳;故填:CaCO3
高温
.
CaO+CO2↑;二氧化碳;
(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙能和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水;故填:氢氧化钙;碳酸钙;
(6)硝酸铵中含有氮元素,属于铵态氮肥,遇到碱会放出氨气,氨气能使湿润的红色石蕊试纸变蓝,硝酸铵与熟石灰反应生成硝酸钙、水和氨气,反应的方程式2NH4NO3+Ca(OH)2═Ca(NO3)2+2NH3↑+2H2O;所以硝酸铵在使用过程中不能与碱性物质混用,否则会降低肥效.
故填:铵态氮;碱;2NH4NO3+Ca(OH)2═Ca(NO3)2+2NH3↑+2H2O;红色石蕊.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;生石灰的性质与用途;常见化肥的种类和作用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查物质之间的转化,比较简单,只要熟记教材内容即可顺利解答,知道玻璃棒在操作中的作用,熟悉方程式的书写方法,循环利用的物质在前面是反应物,在后面是生成物.1年前查看全部
- 电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu═2FeCl2+CuCl
电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu═2FeCl2+CuCl2.FeCl3溶液也可跟铁发生反应:2FeCl3+Fe═3FeCl2.现向FeCl3溶液中加入一定量的铁粉和铜粉,充分反应后,发现有固体剩余.下面有关说法正确的是( )
A. 向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu2+
B. 若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解
C. 剩余固体可能只含有铜
D. 剩余固体中如果有铁,一定也有铜 GuanXi_05300RX1年前1
GuanXi_05300RX1年前1 -
 waln 共回答了24个问题
waln 共回答了24个问题 |采纳率87.5%解题思路:掌握住金属的活动性顺序,金属和盐反应若想生成新的金属,必须是在金属活动性顺序表中前面的金属可以把排在它后面的金属从盐溶液中置换出来.在这一过程中发生的反应可能有2FeCl3+Cu═2FeCl2+CuCl2,2FeCl3+Fe═3FeCl2
A.向剩余的固体加入稀盐酸,若无气体放出,说明固体没有金属铁,因此溶液中可能有Cu2+,也可能没有,故A不对.
B.由于铁的化学性质比铜活泼,因此铁首先和氯化铁溶液反应,当铁全部被消耗之后,氯化铁才和铜反应,因此剩余固体是铜与铁的混合物,说明铜并没有参与反应,故B不对.
C.由于铁首先和氯化铁溶液反应,因此若有剩余固体时有可能只有铜,故C正确.
D.由于铁首先和氯化铁溶液反应,因此剩余固体中如果有铁一定也有铜,故D正确.
故选CD.点评:
本题考点: 金属的化学性质.
考点点评: 本题主要考查了对金属活动性顺序的应用,加强学生对信息资料的分析能力的培养,培养学生分析能力、解决问题的能力.1年前查看全部
- 下列各句中,没有语病的一句是( ) A.电子工业要迅速发展,并广泛渗透到各行各业中去,关键在于要加速训练并造就一批专门
下列各句中,没有语病的一句是( )
a.电子工业要迅速发展,并广泛渗透到各行各业中去,关键在于要加速训练并造就一批专门人才是十分重要的。 b.文章对环境问题都作了比较具体的分析,同时也概括地介绍了关于环境科学的基本知识,引起人们对环境科学的重视。 c.心理健康思想的研究源远流长,单在***战国时代的《内经》一书中,就有心理因素在人体疾病的发生,诊断和预防中起着重要的作用。 d.加快西部地区发展的步伐,除了要尽力争取***外投资,建设好基础设施,努力发展高新科技产业外,搞好节水农业,办好乡镇企业,也是能否发展西部经济的一条重要道路。  ybyy204271年前1
ybyy204271年前1 -
 big_bug1981 共回答了21个问题
big_bug1981 共回答了21个问题 |采纳率95.2%B
(A句式杂糅;C成分残缺;D.不合事理,前后矛盾。)1年前查看全部
大家在问
- 1小学语文课前3分钟可以说些什么?
- 21.52里面包括X X 8 8,列方程并解 2.一个天平秤,西瓜4.6kg ,菠萝两个(其中一个xkg,还有一个2.5K
- 3将阻挠,艰苦,恶劣写一段话,注意是一段话
- 4试判断函数f (x )=1除以1加x 平方在(-∞,0)上的单调性
- 5过双曲线x2/3-y2/6=1的右焦点,倾斜角为30°的直线交双曲线于A、B两点,求A、B两点的坐标
- 6Do students ever work as well as study?这句怎么翻译?ever在句中是什么意思?
- 7Students,study,English,for,different,reasons
- 8王老汉为了与客户签订购销合同,对自己的鱼塘中的鱼的总条数进行估计.第一次捞出100条,并将每条鱼作出记号放入水中;当它们
- 9Is there anyone require aid with your English?
- 10解关于x的方程3x-2=mx 过程 详细
- 11用艰苦,施工,恶劣,写一段话是一段话,不是一句
- 12没有情人的情人节 英语怎么说
- 13一个长方体玻璃容器,从里面量,长30厘米,宽25厘米,水深12厘米,把一块石头完全浸入后,水面上升到
- 14若某DNA分子片段中,一条链上的A:T:C:G=1:2:3:4,则其互补链中的相应碱基比为 (为什么)
- 15Tony is an _____(11 year old) student.用所给单词的适当形式填空.
