以铜为阳极,石墨为阴极,电解稀硫酸 阴极放电的H离子为什么是来自于硫酸?为什么不是水中的H离子放电?
 caixiaohu2022-10-04 11:39:543条回答
caixiaohu2022-10-04 11:39:543条回答那当用两个惰性电极电解硫酸的时候,不是相当于电解水吗?

已提交,审核后显示!提交回复
共3条回复
 royaltyw 共回答了17个问题
royaltyw 共回答了17个问题 |采纳率94.1%- 这要涉及到放电顺序的问题 酸中的氢离子先得电子
而实际上是浓度的问题 - 1年前
 wsnbaba 共回答了197个问题
wsnbaba 共回答了197个问题 |采纳率- 因为硫酸中氢离子浓度大,阴极得电子的是氢离子
2H+ +2e=H2
不能写成
2H2O+2e=H2+2OH-
若这样写氢氧根是不能存在的。
说电解硫酸相当于电解水那是对惰性电极而言。这里不能相当于电解水。就是惰性电极也只能这样写。 - 1年前
 星梦之旅 共回答了11个问题
星梦之旅 共回答了11个问题 |采纳率- 因为水的氧化性比不上硫酸,所以,先硫酸进行反应。
记住一个问题:电解水,很难…… - 1年前
相关推荐
- 原电池的正极和电解池的阳极反应本质是否相同?为什么?
 金ww1年前1
金ww1年前1 -
 nicolaou 共回答了14个问题
nicolaou 共回答了14个问题 |采纳率78.6%不.原电池正极上的物质得电子,化合价降低,是还原反应;而电解池的阳极和电源的正极相连,化合价升高,是氧化反应.这就是本质区别.1年前查看全部
- 用铝6063做导热器表面要做处理吗?是做氧化阳极处理吗?处理后是否会影响导热?
 朵朵3201年前2
朵朵3201年前2 -
 aa19751201 共回答了17个问题
aa19751201 共回答了17个问题 |采纳率82.4%要做表面处理.
阳极氧化及镀镍都可以,由於阳极氧化膜导热效果较金属差,如果有计较到轻微的影响都不行的话电镀镍或化学镍是较好的选项,只是工艺流程较复杂,良率较低,相对的成本高些.1年前查看全部
- 以石墨为阳极、铁为阴极电解200mL氯化钠溶液.当转移了0.02mol电子后停止电解.
以石墨为阳极、铁为阴极电解200mL氯化钠溶液.当转移了0.02mol电子后停止电解.
以石墨为阳极、铁为阴极电解200mL氯化钠溶液.当转移了0.02mol电子后停止电解.若溶液体积前后不变,求混合均匀后的PH 为什么只看氢氧根,不看氢离子,为什么消耗的氢氧根就等于生成的氢离子(氢氧根是水电离出来的啊,根据勒夏特列原理,怎么可能相等),无奈、、 帖军zz1年前1
帖军zz1年前1 -
 复仇者的眼泪 共回答了22个问题
复仇者的眼泪 共回答了22个问题 |采纳率90.9%这道题你需要根据转移电子的物质的量来推算出生成OH-的物质的量
的确,水电离得到H+和OH-,但是在反应过程中H+得到电子变为H2而逸出了.而OH-留在溶液里.
但是不管再怎么反应,反应的后OH-和H+的浓度之积依然等于Kw.
电解氯化钠溶液的化学反应方程式为:
2NaCl+2H2O=通电=2NaOH+H2↑+Cl2↑
每有1mol氢气生成,会转移电子2mol.
当转移了0.02mol电子,生成氢气的物质的量就是0.01mol.得到氢氧化钠的物质的量也是0.02mol
所以得知OH-的浓度为0.02/0.2=0.1mol/L=1×10^-1mol/L
根据Kw常数可知H+离子的浓度为1×10^-13mol/L
所以根据pH的定义可知混合均匀后的pH值为131年前查看全部
- 答案说应该把 F改成E可是我还是有个不解的地方这个题目写出 阴、阳极的方程式后,分析发现实际上是少了2MOL OH- ,
答案说应该把 F改成E
可是我还是有个不解的地方
这个题目写出 阴、阳极的方程式后,分析发现实际上是少了2MOL OH- ,然后溶液就多出了 2 mol H+,由于CU的缘故,可以理解成生成了 2 mol H2SO4 .但是少了 2 mol OH- 后,不是存在着水电离平衡吗?平衡向生成水的方向移动,那么H+ 就应该少于 2 mol ,所以生成的 h2so4 应该少于 2 mol 而不能说等于.我这样说哪里有错么?

 874538c053181cd01年前2
874538c053181cd01年前2 -
 liyfive 共回答了18个问题
liyfive 共回答了18个问题 |采纳率94.4%阴极是Cu,阳极是C
阳极:4OH- - 4e- = O2 + 2H2O
阴极:Cu2+ + 2e- = Cu
总反应
2CuSO4 + 2H2O =电解= 2Cu + O2 + 2H2SO4-----转移电子4e-
横坐标表示电子,4mol
所以,生成Cu为2mol------A对
消耗水为2mol------------B对
生成硫酸2mol------------C错,若F改成E就对了
生成O2为1mol------------D对1年前查看全部
- 阴离子和金属放电顺序我们资料书一般都有介绍,当活泼金属作为阳极时一般都是活泼金属失去电子,那么像铜这种不活泼的金属又该怎
阴离子和金属放电顺序
我们资料书一般都有介绍,当活泼金属作为阳极时一般都是活泼金属失去电子,那么像铜这种不活泼的金属又该怎么办呢?(例子:铜铁氯化钠电解池,铜作为阳极却是氯离子放电,也就是说铜被当做惰性电极,是因为铜和氯化钠,铜和水都无法反应的原因吗?) 皓月狂刀1年前1
皓月狂刀1年前1 -
 恋爱宝贝001 共回答了26个问题
恋爱宝贝001 共回答了26个问题 |采纳率96.2%铜铁氯化钠电解池,铜作为阳极,不是氯离子放电.仍是铜放电变为铜离子.
不活泼的电极一般有:Au Pt 石墨等.金属Mg Al FePb Cu Ag 等是活性电极.
上述活性电极之所以先于溶液中阴离子失电子(放电),归根于其还原性强于有关阴离子.1年前查看全部
- 2010山东理科综合第29题 描述:主要讲那个铝做阳极电解硫酸的阳极反应式
2010山东理科综合第29题 描述:主要讲那个铝做阳极电解硫酸的阳极反应式
生成氧化膜 eyrehfh1年前1
eyrehfh1年前1 -
 幽游_血痕 共回答了25个问题
幽游_血痕 共回答了25个问题 |采纳率84%阳极:Al - 3e ---> Al3+1年前查看全部
- 正极负极 阴极阳极 这两个有什么区别?
 都督大kk1年前1
都督大kk1年前1 -
 任性飞扬 共回答了18个问题
任性飞扬 共回答了18个问题 |采纳率83.3%正负极是电路中的,阴阳极是化学里电池中的.1年前查看全部
- 电解硫酸铜溶液电极阴、阳极的反应式
 李文吉1年前1
李文吉1年前1 -
 七色板 共回答了11个问题
七色板 共回答了11个问题 |采纳率100%如果是惰性电极
阴极:2Cu2+ + 4e- == 2Cu
阳极:2H2O - 4e- == 4H+ + O2(溶液呈酸性,最好不要写氢氧根)
总方程式:2Cu2+ + 2H2O =通电= 2Cu + O2 + 4H+
或 2CuSO4 + 2H2O =通电= 2Cu + O2 + 2H2SO41年前查看全部
- 电解溶液的阴 阳极的反应式怎么写,书写规则
 czhhgg19811年前3
czhhgg19811年前3 -
 lnn0625 共回答了28个问题
lnn0625 共回答了28个问题 |采纳率85.7%首先,阴极和阳极是针对电解池的,阴极得电子,阳极失去电子;原电池是正极和负极,负极失去电子,正极得电子,原电池中的负极相当于电解池中的阳极,正极相当于电解池中的阴极,这是就电子而言的,对于电极反应式的书写,首先要知道离子的放电顺序,阴离子有氟离子1年前查看全部
- 电解池中如果是活性阳极,阴阳两极的点解反应式怎么写
 ok6111年前1
ok6111年前1 -
 xiaozhu841017 共回答了9个问题
xiaozhu841017 共回答了9个问题 |采纳率100%阴极原来怎么写就怎么写,阳极就只写活泼金属失去电子价态升高.
例如铜电解精炼的原理如下:
阳极反应:Cu — 2e = Cu2+阴极反应:Cu2+ + 2e = Cu1年前查看全部
- 用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,
用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,切断电源,使电极仍浸在溶液中.
1)写出开始电解时反应式(两条)
2)电解后电极在溶液经充分反应后,阴极比原来增重多少g?溶液的H+浓度时多少(溶液体积保持不变) 5493381681年前1
5493381681年前1 -
 虚掩的门yoyo 共回答了27个问题
虚掩的门yoyo 共回答了27个问题 |采纳率88.9%cu+ + 2e- =cu
2H2o -- 4e- = O2 + 4H+
2Cu+ 2 H2O2 = 2Cu +O2 + 4H+ 0.896L/22.4L/mol=0.04mol(O2) 可推出阳极一共失去0.04*4=0.16摩尔电子,一摩尔铜有2摩尔电子,所以依照对因关系有0.08摩尔铜生成,即为0.08*64=5.12g铜,即阴极增重5.12g
在阳极增加0.16摩尔H+原子,除以液体体积0.1L得1.6摩尔每升,即H+离子的浓度为1.6摩尔每升
总体是这样了,你在组织下语言,这道题就能得分了1年前查看全部
- 电解精炼铜 为什么阳极溶解的铜与阴极析出的铜不等 为什么电解质溶液铜离子浓度减小
 ff否1年前2
ff否1年前2 -
 我想拉巴巴 共回答了22个问题
我想拉巴巴 共回答了22个问题 |采纳率90.9%精炼铜 阳极失电子的有Zn Fe Cu 等,还有Ag Au Pt 等沉淀为阳极泥.
阴极只有Cu2+得电子,一部分来自于阳极生成的Cu2+ ,一部分来自于溶液中.
所以阳极溶解的铜与阴极析出的铜不等 ,电解质溶液铜离子浓度减小1年前查看全部
- 用惰性电极电解硫酸铜溶液,若阴极上析出的铜的质量为3.2g.则阳极上产生的气体在标准状况下的体积?
 wjh20081年前1
wjh20081年前1 -
 zhglen 共回答了24个问题
zhglen 共回答了24个问题 |采纳率91.7%根据电荷守恒原理,阴极消耗0.1mol电荷,所以阳极消耗0.05,阳极电解oh根,产生氧气,所以最后产生0.025氧气,再乘以22.4即可得0.561年前查看全部
- 我做电解食盐水实验,用10.5V的电压,阳极插入食盐水的是铅笔芯,阴极插入食盐水的是铜导线,发现两极都有气体产生,到后来
我做电解食盐水实验,用10.5V的电压,阳极插入食盐水的是铅笔芯,阴极插入食盐水的是铜导线,发现两极都有气体产生,到后来靠近阳极的盐水变黄(像尿一样),在后来我拿掉铅笔芯,阳极变成了铁导线,最后盐水又有点黑了,请问盐水为什么变黄,黑的东西是什么,阴极产生的是什么气体?
 时尚之都1年前1
时尚之都1年前1 -
 jccwp 共回答了20个问题
jccwp 共回答了20个问题 |采纳率85%电解食盐水,=阳极产生氯气,氯气能溶于水,所以靠近阳极附近溶液会变黄
阳极换成铁之后,阳极是铁变成亚铁离子,阴极产生氢气和氢氧化钠,
阳极的亚铁离子和先前产生的氯气以及阴极产生的氢氧化钠反应生成氢氧化铁,也可能是先生成氢氧化亚铁再转化成氢氧化铁,所以可能看到类似灰绿色到红褐色,至于黑色还真是不好说,你确定是黑色吗1年前查看全部
- 在镀件上镀Zn,溶液用:Znso4溶液,阳极用Zn片吗,可以吗
 狐群狗oo1年前1
狐群狗oo1年前1 -
 生即爱 共回答了18个问题
生即爱 共回答了18个问题 |采纳率94.4%不可以,因为阴极阳离子得电子顺序为Ag+>Hg2+>Cu2+>H+,Zn2+在H+后,一般不得电子.只有当浓度很大时才会得电子,所以一般不用这个方法.1年前查看全部
- 电解CuCl2溶液时,如果阴极上有1.6g铜析出,则阳极上产生气体的体积(标况)约为
 也是一个ii1年前1
也是一个ii1年前1 -
 今天不上班 共回答了18个问题
今天不上班 共回答了18个问题 |采纳率94.4%阴极产生的是CL2气体
阳极产生1mol铜,则阴极失去2mol电子,产生1molCl2
所以,阴极产生CL2的体积为
1.6/64*22.4=0.56L1年前查看全部
- 电化学-电解溶液时,阴阳极得是电子的顺序
电化学-电解溶液时,阴阳极得是电子的顺序
麻烦说一下规律,做题时该怎么考虑
举一些常见离子 暮晚掠雨1年前1
暮晚掠雨1年前1 -
 sou777 共回答了23个问题
sou777 共回答了23个问题 |采纳率87%阳极:当电极为惰性电极(石墨或铂金)时,溶液中离子失电子
顺序:硫离子>碘离子>溴离子>氯离子>氢氧根
不是惰性电极的,电极金属失电子
阴极:溶液中离子得电子
顺序:银离子>3价铁离子>铜离子>2价铁离子>氢离子1年前查看全部
- 高中化学(电解)刚刚看到这句话:电子流向是,电子由电解池的阳极流出,流回直流电源的正极.由直流电源负极流出流到电解池的阴
高中化学(电解)
刚刚看到这句话:电子流向是,电子由电解池的阳极流出,流回直流电源的正极.由直流电源负极流出流到电解池的阴极.
那老师上课说的 电子的流向从负极到正极
电子流向到底从哪到哪啊
 9522191年前1
9522191年前1 -
 wuqinghui1984 共回答了18个问题
wuqinghui1984 共回答了18个问题 |采纳率88.9%电解池外接电源的正极,是电解池中的阳极;外接的负极,是电解池中的阴极.
在电解池的外部,电子由正极流向负极.
在电解池的内部,阴离子带着电子从阴极流向阳极;阳离子带着正电荷从阳极流向阴极.
你一定把老师的的话听错了.因为在电解池内部没有负极和正极只有阴极和阳极.老师也不可能说电解池中“ 电子的流向从负极到正极”,因为电解池中是离子的转移,或称流动也可以,不是电子的流动.1年前查看全部
- 用Pt电极电解AgF(aq),电流强度为a A,通电时间为t min,阴极增重m g,阳极
用Pt电极电解AgF(aq),电流强度为a A,通电时间为t min,阴极增重m g,阳极上生成标准状况下的纯净气体V L,以q C表示一个电子的电量,Mr示Ag的相对原子质量,则阿伏加德罗常数NA可表示为( )
A. [1344at/qV] mol-1
B. [atMr/qm] mol-1
C. [60atMr/qm]mol-1
D. 以上答案都不对 衣香满亭台1年前5
衣香满亭台1年前5 -
 nazic_job 共回答了21个问题
nazic_job 共回答了21个问题 |采纳率95.2%解题思路:根据电解AgF时,阳极氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑;
阴极银离子放电,电极反应式为:2Ag++2e-=2Ag;
依据电解过程生成沉淀的质量和生成气体的体积与转移电子数之间关系解答.电解AgF时,阳极氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑;
阴极银离子放电,电极反应式为:2Ag++2e-=2Ag;
4OH--4e-=2H2O+O2↑;
4×NA22.4L
(a×t×60)/q V
解得:NA=[336at/qV]mol-1;
2Ag++2e-=2Ag;
2×NA 2×Mr
(a×t×60)/q m
解得:NA=[60atMr/qm]mol-1;
故选:C.点评:
本题考点: 阿伏加德罗常数;电解原理.
考点点评: 本题考查了阿伏伽德罗的计算,题目难度中等,明确电解氟化银溶液的原理,准确写出电解反应式是解题关键,注意离子放电顺序.1年前查看全部
- 电解CuSO 4 溶液时,若要达到如下三点要求:①阳极质量减少 ②阴极质量增加 ③电解质溶液中Cu 2+ 浓度不变。则选
电解CuSO 4 溶液时,若要达到如下三点要求:①阳极质量减少 ②阴极质量增加 ③电解质溶液中Cu 2+ 浓度不变。则选用的电极是( )
A.纯铜作阳极,含锌、银的铜合金作阴极 B.铁作阳极,铜作阴极 C.石墨作阳极,铂作阴极 D.含锌、银的铜合金作阳极,纯铜作阴极  dido2001_20011年前1
dido2001_20011年前1 -
 yy霞 共回答了20个问题
yy霞 共回答了20个问题 |采纳率80%A
Cu作阳极时,电解液中Cu 2+ 浓度不变,若用粗Cu作阳极,溶液中Cu 2+ 浓度会略有减小。1年前查看全部
- Cu片碳棒共同组成原电池Cu片碳棒同时进入到稀硫酸中,并连接好闭合回路会形成原电池,阴极和阳极的反应式是什么?总反应方程
Cu片碳棒共同组成原电池
Cu片碳棒同时进入到稀硫酸中,并连接好闭合回路会形成原电池,阴极和阳极的反应式是什么?总反应方程式?
实验证明会发生原电池反应 zljlily1年前1
zljlily1年前1 -
 南kk木棉jewel 共回答了15个问题
南kk木棉jewel 共回答了15个问题 |采纳率80%...
不能发生原电池反应.铜的电极电势比氢高.1年前查看全部
- 电解精炼铜时,电解池每转移一摩尔电子,阳极溶解的铜原子为0.5NA
电解精炼铜时,电解池每转移一摩尔电子,阳极溶解的铜原子为0.5NA
这句话为什么不对 本日蛋塔1年前2
本日蛋塔1年前2 -
 疯掉算了 共回答了15个问题
疯掉算了 共回答了15个问题 |采纳率100%既然是精炼说明这个铜里面有其它的杂质,比如Fe,这样溶解的铜原子就少于0.5NA了1年前查看全部
- 高铁电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列判断正确的是 A.充电时阳极反
高铁电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
 下列判断正确的是
下列判断正确的是A.充电时阳极反应为:2FeO 4 2 - +8H 2 O-6e - =2Fe(OH) 3 +10OH - B.充电时阴极附近溶液的pH变大 C.放电时,负极材料为Zn D.放电时,每转移0.2 mol电子,正极的质量减少6.5 g  landed1年前1
landed1年前1 -
 lzgui 共回答了15个问题
lzgui 共回答了15个问题 |采纳率93.3%BC
该电池放电时,电极反应式为:
负极:3Zn-6e - +6OH - =3Zn(OH) 2
正极:2FeO 4 2- +6e - +8H 2 O=2Fe(OH) 3 +10OH -
该电池充电时,电极反应式为:
阴极:3Zn(OH) 2 +6e - =3Zn+6OH -
阳极:2Fe(OH) 3 +10OH - -6e - =2FeO 4 2- +8H 2 O1年前查看全部
- 用铜和碳棒做电极电解水生成什么用铜做阳极,用碳棒做阴极,生成的淡蓝色的东西是什么?
 jiangbo_andy1年前4
jiangbo_andy1年前4 -
 llna8 共回答了16个问题
llna8 共回答了16个问题 |采纳率87.5%因为阳极是活泼电极,阳极参加氧化还原反应,阳极铜失去电子变为铜离子电极反应为:
阳极:Cu-2e^-=Cu2+
阴极:2H2O+2e-=H2+2OH-
所以会生成淡蓝色的氢氧化铜.
望采纳,谢谢!1年前查看全部
- 在铜上镀银 在电解槽中,阴极是铜,阳极是银,那么.电解质是硫酸.这样可以不?因为银离子得电子比氢离子厉害,所以阴极上应该
在铜上镀银 在电解槽中,阴极是铜,阳极是银,那么.电解质是硫酸.这样可以不?因为银离子得电子比氢离子厉害,所以阴极上应该是镀银而不是放氢气把.阳极应该是放氧气把.重点疑问::若是在铁上镀锌,铁是阴极,锌是阳极.那么电解质若是硫酸锌的话,那么硫酸锌溶液中的水电离的氢离子得电子比锌厉害,那么铁上应该冒氢气啊?难道说是把硫酸锌溶液中的水电解完了,剩下纯的硫酸锌?那也说不通啊.
一楼的。我说的就是 阴极是铜,阳极是银 还有。电解质是硫酸为什么不行、、、 请说明原因好么 还有。3楼的,AG2SO4难溶和我镀银有什么关系。银离子应该直接就在阴极得电子直接镀到铜上了。那我们辅导书上写的银离子得电子能力比氢离子强啊。那么银离子应该直接就到阴极去了啊。怎么还会和电解质中的硫酸根离子结合生成硫酸银呢? 慧熙1年前4
慧熙1年前4 -
 褶子戏 共回答了18个问题
褶子戏 共回答了18个问题 |采纳率94.4%电镀银的镀液中,一般包括主盐(含有阴离子的盐,如AgNO3)等,络合剂(配位剂),导电盐等,不只是加硫酸那么简单.假设如你所说,阳极银溶出,变成银离子,那么硫酸银的溶解度是比较低的,很容易从溶液中析出.电镀需要一定的主盐浓度和电流密度,不是你想象的那么简单.
铁上镀锌,如你考虑的那样,可能会有一部分的氢析出,但是结果肯定不是你说的那样.因为标准电极电位只是提供一种理论上的可能性,真正析出的物质要看实际的电位(跟介质环境有关),这涉及到极化,析氢过电位等概念,所以不是你想象的那样.如果真的对这方面敢兴趣,可以看看这方面的书籍.1年前查看全部
- (2013•北京模拟)(一)电解饱和食盐水的阳极产物是______(写化学式).
 (2013•北京模拟)(一)电解饱和食盐水的阳极产物是______(写化学式).
(2013•北京模拟)(一)电解饱和食盐水的阳极产物是______(写化学式).
(二)废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用.
(1)回收二氯化锰.将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热,试写出MnO(OH)与浓盐酸反应的化学方程式:2MnO(OH)+6HCl
2MnCl2+Cl2↑+4H2O△ .2MnO(OH)+6HCl.
2MnCl2+Cl2↑+4H2O△ .
(2)萃取法回收锰离子.实验室萃取操作中使用的玻璃仪器是______.
(3)制备锰锌铁氧体.锰锌铁氧体可用作隐形飞机吸收雷达波的涂料.一种以锌锰废电池为原料制备锰锌铁氧体的主要流程如下:
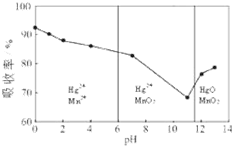
①除汞时,铁粉的作用是______(填“氧化剂”或“还原剂”或“吸附剂”)在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如图.
②据图说明pH对Hg吸收率的影响规律______
③在强酸性环境下Hg的吸收率高的原因可能是______.
(4)锰回收新方法.向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为:
2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O①每1molMnO2参加反应时,共有______mol电子发生转移.
②新方法的优点是______(答1点即可). 步枪OK1年前1
步枪OK1年前1 -
 cemen 共回答了18个问题
cemen 共回答了18个问题 |采纳率77.8%解题思路:(一)先判断离子的放电顺序,然后根据阳极发生反应的反应类型确定产物;
(二)(1)+4价的锰能把浓盐酸氧化为氯气;
(2)根据萃取的操作分析;
(3)①利用铁粉把Hg还原出来;
②根据图象分析;
③根据影响KMnO4氧化性的条件分析;
(4)①根据氧化还原反应方程中得失电子守恒分析;
②分析回收工艺的优点从可操作性、产品的纯度、对环境的影响等方面分析.(一)电解饱和食盐水时,溶液中存在的阴离子是Cl-、OH-,Cl-的放电能力大于OH-的放电能力,所以 Cl-放电,Cl-失电子在阳极上生成氯气,故答案为:Cl2;
(二)(1)+4价的锰能把浓盐酸氧化为氯气,即MnO(OH)与浓盐酸反应生成氯气和氯化锰、水,其反应方程式为:2MnO(OH)+6HCl
△
.
2MnCl2+Cl2↑+4H2O,故答案为:2MnO(OH)+6HCl
△
.
2MnCl2+Cl2↑+4H2O;
(2)根据萃取的操作可知,萃取操作中使用的玻璃仪器是分液漏斗,故答案为:分液漏斗;
(3)①铁粉具有还原性,能把汞离子还原为汞单质,所以铁粉的作用是还原剂,故答案为:还原剂;
②由图象可知,汞的吸收率随着PH的增大先降低后增加,故答案为:随pH的升高汞的吸收率先降低后增加;
③在中性或碱性条件下KMnO4氧化性较低,而酸性条件下氧化性较强,所以作氧化剂时一般用酸性高锰酸钾溶液,故答案为:KMnO4在酸性条件下氧化性强;
(4)①已知2MnO(OH)+MnO2+2H 2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O,MnO2~2H 2C2O4~4CO2,碳元素从+3价升高到+4,转移1个电子,当生成4molCO2时转移4mol电子,所以1molMnO2参加反应时生成4molCO2,转移4mol电子,故答案为:4;
②分析回收工艺的优点从可操作性、产品的纯度、对环境的影响等方面分析,可知工艺流程简单;生成CO2和H2O不影响MnSO4纯度;反应过程无有毒有害物质生成,不造成二次污染;废物资源化等,
故答案为:工艺流程简单;生成CO2和H2O不影响MnSO4纯度;反应过程无有毒有害物质生成,不造成二次污染;废物资源化等.点评:
本题考点: 电解原理;"三废"处理与环境保护;物质的分离、提纯和除杂.
考点点评: 本题考查了工业上回收金属锰的操作流程,题目难度中等,注意对图象的分析.1年前查看全部
- 电解Al2o3时阳极生成的氧气全部与石墨反应转化,若co2和co的体积之比为1:1,当阴极得到27gAl时,若阳极生成的
电解Al2o3时阳极生成的氧气全部与石墨反应转化,若co2和co的体积之比为1:1,当阴极得到27gAl时,若阳极生成的气体用作燃料放出能量多少kj c+o2=co2 △H=-393.5 c+o2=2CO △H=-221.0
 鲁西法的猫1年前2
鲁西法的猫1年前2 -
 场院的碌碡nn心眼 共回答了19个问题
场院的碌碡nn心眼 共回答了19个问题 |采纳率78.9%2CO+O2=2CO2.Delta H=-566.0kJ/mol
27gAl 3mol电子 变为CO的获得三分之一.
故有二分之一molCO,即 566.0/4=141.5(kJ)1年前查看全部
- 铜为阳极,石墨为阴极电解氯化钠关于这个反应,阳极有铜,氢氧根离子和氯离子,我想问这3个哪个的失电子能力强?为什么是铜?难
铜为阳极,石墨为阴极电解氯化钠
关于这个反应,阳极有铜,氢氧根离子和氯离子,我想问这3个哪个的失电子能力强?为什么是铜?难道说是只要是金属就比硫离子那些离子的失电子能力强?要是这样的话,那金呢?意思金的失电子能力也比那些离子强?顺便问一下,加入阳极也为石墨是不是就轮氯离子放电了?还有什么情况下电极会出现水得失电子的情况,我一般做这种写电极方程式的题都是看电极处有什么离子,然后再看他们的放电顺序,但是我发现有些反应居然是水在反应物种,而不是离子,请问什么情况下回出现这种情况?例如惰性电极电解硫酸铜的时候.阳极应该有氢氧根离子和硫酸根离子,应该是氢氧根离子失电子放电啊?怎么它的方程式却是2H20-4e-=O2+4H+?出现了水失电子的情况,这是怎么回事? 卫7121年前3
卫7121年前3 -
 xcwangtao 共回答了13个问题
xcwangtao 共回答了13个问题 |采纳率100%金属活动性顺序表 其中有(H) 仔细看看就行的了
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢)铜 汞 银 铂 金
另外 非金属的活动性顺序就要自己掌握了
点解反应中写水才是最正确的 因为水是弱点解质 在离子反应方程式中本来就不能拆
只是现在大家都错习惯了 默认写离子正确1年前查看全部
- 光电效应测定普朗克常数为什么 光电管一般都用逸出功小的 金属作阴极,用逸出功大的金属作阳极?
 女乃制品1年前1
女乃制品1年前1 -
 你是虫 共回答了19个问题
你是虫 共回答了19个问题 |采纳率94.7%在实验中,电子是从阴极走向阳极,要检测到电流,应该使阴极有电子打出,而阳极要吸收电子,才能形成明显的电流,用逸出功小的金属做阴极,可以保证光电子顺利产生,不需要多么高频率的光照射,就会有光电子打出,而用逸出功大的金属,则阳极上自由电子少,有利于阳极吸收电子.1年前查看全部
- 电解熔融碳酸盐的产物麻烦问下 电解熔融态的碳酸盐生成什么?阴极是什么 阳极是什么 记住 是 电解池 而非原电池 还有 电
电解熔融碳酸盐的产物
麻烦问下 电解熔融态的碳酸盐生成什么?
阴极是什么 阳极是什么
记住 是 电解池 而非原电池
还有 电子是怎么移动的?
烦劳诸位 stakistaki1年前1
stakistaki1年前1 -
 writer71529 共回答了19个问题
writer71529 共回答了19个问题 |采纳率84.2%产物 相应的阳离子金属 一氧化碳和氧气 阴极 与电源负极相连 阳极与电源正极连接 电子由负极向正极 移动1年前查看全部
- 弗兰克赫兹实验思考题 阳极电流的峰谷是如何形成的
弗兰克赫兹实验思考题 阳极电流的峰谷是如何形成的
1、电子在弗兰克赫兹管中与亚原子是如何交换能量的
2、阳极电流的峰谷是如何形成的
3、为什么IA-UG2K曲线上第一峰值对应的UGK2要比11.5大 绚青1701年前1
绚青1701年前1 -
 yycbj 共回答了19个问题
yycbj 共回答了19个问题 |采纳率94.7%1.碰撞
2.每达到一次第一激发相位就会有一次电子与原子大规模碰撞,电子动能减为零,对应一次电流的波谷.
3.零电压对应的电流不严格为零,所以要测波谷之间的距离.1年前查看全部
- 做“电解水”实验时,老师通常往水中加少量硫酸以增加导电性,电解该溶液一段时间后,观察到的现象错误的是 A.阳极玻璃管内产
做“电解水”实验时,老师通常往水中加少量硫酸以增加导电性,电解该溶液一段时间后,观察到的现象错误的是
A.阳极玻璃管内产生的气体使带火星的木条复燃 B.阳极玻璃管与阴极玻璃管内产生的气体体积比约为2:1 C.阴极玻璃管内产生的气体被点燃时发出“噗”声 D.向电解后的残留溶液中滴加紫色石蕊试液呈红色  dw_s1年前1
dw_s1年前1 -
 jimling0 共回答了20个问题
jimling0 共回答了20个问题 |采纳率85%B
1年前查看全部
- 电解硫酸钠溶液的方程式我知道总的方程式怎么写,但是阳极生成氧气,阴极生成氢气后,溶液中剩余的钠离子和硫酸根离子怎么办?电
电解硫酸钠溶液的方程式
我知道总的方程式怎么写,但是阳极生成氧气,阴极生成氢气后,溶液中剩余的钠离子和硫酸根离子怎么办?电解硫酸铜溶液最后不是把没放电的氢离子和硫酸根离子加起来生成硫酸了么?例如:阳极:2H2O - 4e- == O2(气体) + 4H+
阴极:Cu2+ + 2e- == Cu
总方程式:2CuSO4 + 2H2O ==(电解)== 2Cu + O2(气体) + 2H2SO4 请速回答。 lyl1980a1年前0
lyl1980a1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 铜不溶于稀硫酸,但当铜作为电解的阳极,稀硫酸作为电解质溶液时,铜就能溶解于稀硫酸.还想问下是不是金属作阳极时,可以溶于任
铜不溶于稀硫酸,但当铜作为电解的阳极,稀硫酸作为电解质溶液时,铜就能溶解于稀硫酸.还想问下是不是金属作阳极时,可以溶于任何电解质溶液.
 hlq09311年前1
hlq09311年前1 -
 人世一浮尘 共回答了20个问题
人世一浮尘 共回答了20个问题 |采纳率95%铜不溶于稀硫酸,但当铜作为电解的阳极,稀硫酸作为电解质溶液时,铜就能溶解于稀硫酸,但前提是阳极的电压大于铜的电极电位(Cu2+/Cu0),铜才会溶解.金属作阳极时,并不是可以溶于任何电解质溶液,一是电解时的电压,是否大于金属离子的电极电位,二是要考虑氢,氧离子的离解,比如铂电极,在氯化钠水溶液中,你再怎么电解,阳极也只能产生氧气,而不是铂离子.1年前查看全部
- 下列说法正确的是( )A. 铅蓄电池放电时铅电极发生还原反应B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠C. 给
下列说法正确的是( )
A. 铅蓄电池放电时铅电极发生还原反应
B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C. 给铁钉镀铜可采用CuSO4作电镀液
D. 生铁浸泡在食盐水中发生析氢腐蚀 雪晶乐乐1年前1
雪晶乐乐1年前1 -
 persha 共回答了19个问题
persha 共回答了19个问题 |采纳率78.9%解题思路:A.铅蓄电池放电时铅电极为原电池的负极;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液;
D.生铁浸泡在食盐水中发生吸氧腐蚀.A.铅蓄电池放电时铅电极为原电池的负极,发生氧化反应,正极发生还原反应,故A错误;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠,阴极上得到氢气和氢氧化钠,故B错误;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液,则给铁钉镀铜可采用CuSO4作电镀液,故C正确;
D.生铁浸泡在食盐水中发生吸氧腐蚀,在酸性溶液中发生析氢腐蚀,故D错误.
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理;原电池和电解池的工作原理.
考点点评: 本题考查电化学知识,题目难度不大,注意原电池的工作原理、电镀以及金属的腐蚀及防护措施.1年前查看全部
- 用惰性电极电解CuSO4和NaCl 的混合溶液,开始时阴极和阳极上分别析出的物质是
用惰性电极电解CuSO4和NaCl 的混合溶液,开始时阴极和阳极上分别析出的物质是
请解析~ free_air191年前1
free_air191年前1 -
 zx910731 共回答了16个问题
zx910731 共回答了16个问题 |采纳率93.8%Cu、Cl2
根据离子反应顺序.1年前查看全部
- 求高二电解、原电池方程式的总结就是常用的电解某物质的阴极和阳极分别的离子方程式……,我是想要写出来的,可以拿上背的 ,我
求高二电解、原电池方程式的总结
就是常用的电解某物质的阴极和阳极分别的离子方程式……,
我是想要写出来的,可以拿上背的 ,我在书上找不全常用电解方程式 AmNothing1年前1
AmNothing1年前1 -
 liufenghuixue 共回答了19个问题
liufenghuixue 共回答了19个问题 |采纳率89.5%电解水和精炼铜,还有就是它们的分解式(就是要标明失去多少个电子,电子怎样走的化学式)书上有一个图,是关于电解氯化钠的,记住要背下来,包括氢气在哪边出,钠在哪里出,哪个得电子,哪个失去电子,有水和无水的情况下产物是什么;只要记住这些就差不多得了1年前查看全部
- 已知电解池总方程式1已知总方程式写阴阳极,需要知道电解质是酸性还是碱性吗?2为什么电解饱和食盐水我根据总方程式写不出阴极
已知电解池总方程式
1已知总方程式写阴阳极,需要知道电解质是酸性还是碱性吗?2为什么电解饱和食盐水我根据总方程式写不出阴极方程式,因为水拆不了.3冷却结晶和蒸发结晶怎么区分 csallen5001年前2
csallen5001年前2 -
 lcxcyj 共回答了16个问题
lcxcyj 共回答了16个问题 |采纳率87.5%1.高中阶段,我们这边是不要求电解质是酸性还是碱性对电极方程式的影响的,但是大学或者竞赛里就一定要求,或者题目中给出.
而且,知道了总方程式,一般都能根据反应物推出电解质的酸碱性的.
2.电解饱和食盐水:
2NaCl+2H2O==(电解)==2NaOH+Cl2+H2
离子方程式:2H2O+2H2+Cl- ====2OH-+ Cl2+H2
阳极被氧化:Cl- —— Cl2
配平:2Cl-====Cl2+2e-
阴极被还原:H2O——H2+OH-
配平:2H2O+2e-====H2+2OH-
3.冷却结晶一般是跟在加热浓缩之后,也就是“冷却热饱和溶液法”,结晶出来的一般是漂亮的晶体,而且是在溶液中就析出晶体的
蒸发结晶是加热至溶剂全部挥发,出来的一般是粉末,像高中、初中常见的提取粗盐实验中,在坩埚中把粗盐溶液蒸发完全.1年前查看全部
- 用惰性电极点解下列电解质溶液,求阳极反应式,阴极反应式,总反应方程式,溶液复原所需物质,Na2So4,H2SO4。
用惰性电极点解下列电解质溶液,求阳极反应式,阴极反应式,总反应方程式,溶液复原所需物质,Na2So4,H2SO4。
若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是? huxinan1231年前3
huxinan1231年前3 -
 6517556 共回答了17个问题
6517556 共回答了17个问题 |采纳率94.1%1、楼上说的不错,电解Na2SO4和H2SO4事实上就是【电解水】
不过楼上写的反应式有点问题,应该是:
阳极:4OH- - 4e- ==== 2H2O + O2
阴极:2H+ + 2e- ==== H2
总反应:2H2O ==== 2H2 + O2
【要复原溶液,需要补充被电解掉的水即可】
2、若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是?
【这个题楼上答错了】
阳离子交换膜的作用是【使阴阳离子隔绝,避免其相互反应】.
2NaCl + 2H2O ==== 2NaOH + H2 + Cl2而这样的产物极易反应.所以如果没有阳离子交换膜,这些产物就会继续反应.
具体如下:2NaCl + 2H2O ==== 2NaOH + H2(气体) + Cl2(气体)
2NaOH + Cl2 ==== NaCl + NaClO + H2O
【所以最终的结果是:NaCl + H2O ==(通电)== NaClO + H2(气体)】1年前查看全部
- 电解池阴阳极怎么分
 johnliu1231年前1
johnliu1231年前1 -
 梦中的芙蓉 共回答了17个问题
梦中的芙蓉 共回答了17个问题 |采纳率94.1%原电池中活泼金属做负极,发生氧化反应.相应的不活泼金属或非金属做正极,发生还原反应. 电解池的阴阳极正好和原电池相反,阴极对应正极,即发生还原反应,而阳极对应负极,发生氧化反应.1年前查看全部
- 电解尿素( CO(NH2)2 )的碱性溶液制氢的装置中,电解时,阴极、阳极的电极反应式分别是什么?
 More20031年前1
More20031年前1 -
 韩庚加油 共回答了10个问题
韩庚加油 共回答了10个问题 |采纳率80%阳极:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
阴极:6H2O + 6e-= 3H2↑ +6OH-1年前查看全部
- 关于电解的高二化学题用惰性电极电解b L MSO4的水溶液,当阴极上有Wg 金属析出(阴极上无气体产生)时,阳极上产生a
关于电解的高二化学题
用惰性电极电解b L MSO4的水溶液,当阴极上有Wg 金属析出(阴极上无气体产生)时,阳极上产生a L气体(标准状况),同时溶液的PH由原来的6.5变为2.0(设电解前后溶液体积不变).则M的相对原子质量的表示式为
A.100W/b B.200W/b C.22.4W/a D.11.2W/a
请写出解答过程,谢谢
 锋00241年前1
锋00241年前1 -
 q3223926 共回答了22个问题
q3223926 共回答了22个问题 |采纳率86.4%PH由原来的6.5变为2.0,说明水溶液是酸性的,所以产生的气体一定是氧气
H2o+MSO4=H2SO3+ M + O2
X 32
Wg (a/22.4)*32
x=32W/(a/22.4)*32=22.4W/a
C1年前查看全部
- 电解稀硫酸制氢气、氧气时铜能不能作阳极?
电解稀硫酸制氢气、氧气时铜能不能作阳极?
如题 xlb011年前1
xlb011年前1 -
 bennycheng03 共回答了11个问题
bennycheng03 共回答了11个问题 |采纳率81.8%铜会被氧化,比氢氧根更易氧化.1年前查看全部
- 某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质
某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质量增加;c电解液pH减小,则应选用的电极是( )
①阴阳两极都用石墨
②铜作阳极铁作阴极
③铁作阳极铜作阴极
④铂作阳极铜作阴极.
A.①③
B.①②
C.③④
D.①④ 纪海1年前1
纪海1年前1 -
 忧游uu 共回答了16个问题
忧游uu 共回答了16个问题 |采纳率81.3%解题思路:依据电解原理分析,电极若是惰性电极,溶液中的阴离子在阳极失电子发生氧化反应,若阳极是活性电极,则电极本身是单质发生氧化反应,电极质量减小;阴极是溶液中阳离子得到电子发生还原反应;欲达到如下要求:a阳极质量不变 b阴极质量增加 c电解液pH减小,是惰性电极做阳极,电解质溶液中铜离子得到电子在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,溶液中氢离子浓度增大,pH减小.依据电解原理分析,电极若是惰性电极,溶液中的阴离子在阳极失电子发生氧化反应,若阳极是活性电极,则电极本身是单质发生氧化反应,电极质量减小;阴极是溶液中阳离子得到电子发生还原反应;欲达到如下要求:a阳极质量不变 b阴极质量增加 c电解液pH减小,是惰性电极做阳极,电解质溶液中铜离子得到电子在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,溶液中氢离子浓度增大,pH减小,
①阴阳两极都用石墨电极,电解反应为2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4,符合要求条件,故①符合;
②铜作阳极,铁作阴极,阳极是活性电极铜失电子质量减小,不符合题干条件,故②不符合;
③铁作阳极,铜作阴极,阳极是活性电极铁失电子质量减小,不符合题干条件,故③不符合;
④铂作阳极,铜作阴极,阳极是惰性电极,电解反应为2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4,符合要求条件,故④符合;
故选:D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的分析判断,主要是阳极材料的分析应用,掌握基础是关键,题目难度中等.1年前查看全部
- 请熟悉化工的各位大侠汉译英请大侠们把这几个翻译成英语:鼓泡,阳极液浓度,离子交换膜,开停车
 不穿窑裤儿1年前1
不穿窑裤儿1年前1 -
 丁XY 共回答了15个问题
丁XY 共回答了15个问题 |采纳率73.3%鼓泡:Bubble
阳极液浓度:Concentration of anodic solution
离子交换膜:Ion-exchange membrane
开停车:Start and Stop Production1年前查看全部
- 电解硫酸钠,pH升高的到底是阴极还是阳极,阴极由于有氢气放出,氢离子减少,但根据异性相吸原理,氢氧根离子会到阳极去,所以
电解硫酸钠,pH升高的到底是阴极还是阳极,阴极由于有氢气放出,氢离子减少,但根据异性相吸原理,氢氧根离子会到阳极去,所以本人感到纠结,求高手赐教.
 雪域凌峰1年前4
雪域凌峰1年前4 -
 hch20911 共回答了23个问题
hch20911 共回答了23个问题 |采纳率91.3%阳极反应 2H2O -4e ==O2 +4H+
阴极反应, 4H+ +4e==2H2
阳极产生H+ pH降低
阴极消耗H+ pH升高
OH-会运动到阳极去,但是运动去的OH-要少于产生的H+
如果有盐桥的话那就更少了.因此不能马上中和,就显示酸碱性了.1年前查看全部
- 在电解池中,阳极的电极材料一定发生氧化反应,这句话对吗,如果错错在
 小猪笨笨mei1年前2
小猪笨笨mei1年前2 -
 金贝子 共回答了22个问题
金贝子 共回答了22个问题 |采纳率95.5%不一定,惰性电极就不会发生氧化反应,比如石墨(C单质),金,铂.别的都会发生氧化反应.
题目的表述太绝对了,所以是错的1年前查看全部
- 电解精炼铜时阳极不断产生锌、铁离子,是否会使反应越来越快?
电解精炼铜时阳极不断产生锌、铁离子,是否会使反应越来越快?
就是产生铜的速度(阴极增重速度) kfys1年前1
kfys1年前1 -
 月亮蝉 共回答了23个问题
月亮蝉 共回答了23个问题 |采纳率95.7%我觉得,阳极不断产生产生锌离子和铁离子,这和产生铜的速度没有什么关系.因为产生铜单质是因为铜离子接受了电子从而被还原,所以说产生铜的速度因该是和外加电场有关系,而不会因为产生的锌铁离子而变化.得电子是铜先得到.1年前查看全部
- 用pt为电极,通电于稀CuSO4溶液,指出阴极部,中部,阳极部中溶液的颜色在通电过程中有何变化?
用pt为电极,通电于稀CuSO4溶液,指出阴极部,中部,阳极部中溶液的颜色在通电过程中有何变化?
若改用Cu作电极,三个部分溶液颜色变化又将如何? kk红蛙1年前1
kk红蛙1年前1 -
 天蝎座的矛盾体 共回答了23个问题
天蝎座的矛盾体 共回答了23个问题 |采纳率82.6%【不考虑因为电极上吸引和排斥导致的颜色变化】
惰性电极
那么Cu2+ OH-放电 阴极2Cu2+ + 4e-=2Cu(蓝色变浅,因为Cu2+减少)
阳极4OH- - 4e-= O2 + 2H2O(蓝色不变)
2Cu2+ + 4OH- = O2 + 2H2O+2Cu
中间:不变
Cu电极
Cu2+ + 2e-=Cu
Cu-2e-=Cu2+
阴极变深,因为生成Cu2+
阳极变浅,因为消耗Cu2+
中间不变1年前查看全部
大家在问
- 1描写小动物样子的四字词语
- 2质量守恒定律有什么重大意义?书上没有说啊
- 3食醋与大理石反应的方程式
- 4苏教国标版五年级上册语文天天练的答案,18课莫高窟
- 5将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
- 6将李白的《望天门山》改写成长短句
- 7什么是弱酸弱碱盐强酸强碱盐…再举些例子
- 8汉语句子译成英语如果我的产品有问题,您必须马上通知我我会给您满意的答复
- 9求发酵法制食醋的主要反应方程式
- 10记承天寺夜游的阅读答案一、文中并未直接叙述作者与张怀民的友情,但字里行间却可以看出两个人的亲密无间.请找出相关词语加以体
- 11怎么做一个周长是18.84厘米,高是19.5厘米的圆锥
- 12你有自己喜爱的小动物吗?请你用饱含情感的语言对它进行“外貌描写”,让别人也认识认识你的可爱的小生灵.
- 13英语翻译:我们经常散发传单叫人们不要乱扔垃圾
- 14他过去乱扔垃圾,他现在清洁校园,用英语怎么说?
- 15《小石潭记》选文高度概括小石潭的氛围并表现作者对现实不满及被贬后凄苦心情的句子是?
