硫元素在生物群落中以何种形式流动
 gg何处存芳草2022-10-04 11:39:541条回答
gg何处存芳草2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 风信子0605 共回答了24个问题
风信子0605 共回答了24个问题 |采纳率91.7%- 主要以含硫的氨基酸和蛋白质的形式.
- 1年前
相关推荐
- 下列各种物质中,硫元素化合价最低的是( )
下列各种物质中,硫元素化合价最低的是( )
A. S
B. SO2
C. H2SO4
D. Na2S2O3 rr一切1年前6
rr一切1年前6 -
 zhaofat 共回答了19个问题
zhaofat 共回答了19个问题 |采纳率84.2%解题思路:根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.A、根据单质中元素的化合价为0,S属于单质,故硫元素的化合价为0.
B、氧元素显-2,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,则:x+(-2)×2=0,解得x=+4.
C、氢元素显+1,氧元素显-2,设硫元素的化合价是y,根据在化合物中正负化合价代数和为零,则:(+1)×2+y+(-2)×4=0,则y=+6.
D、钠元素显+1,氧元素显-2,设硫元素的化合价是z,根据在化合物中正负化合价代数和为零,则:(+1)×2+2z+(-2)×3=0,则x=+2.
故硫元素的化合价最低的是A.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
- 硫酸锌中硫元素的化合价达到+6,是否意味着硫酸锌有强氧化性?
 马一元1年前1
马一元1年前1 -
 ts2nm 共回答了15个问题
ts2nm 共回答了15个问题 |采纳率100%不是.硫酸锌中有硫酸根,硫酸根很稳定,不体现氧化性.而硫酸分子有氧化性(浓硫酸有强氧化性,浓硫酸中主要是硫酸分子)1年前查看全部
- 硫代硫酸纳中硫元素的氧化值是平均价态还是实际价态?
 无锡青团飞1年前2
无锡青团飞1年前2 -
 未到zz已断魂 共回答了14个问题
未到zz已断魂 共回答了14个问题 |采纳率92.9%与实际价很接近的整数.应该是与氧有化学键的硫原子比+4价略低一点,与氧没有化学键的硫原子比0价略高一点.1年前查看全部
- 1.165毫克的硫酸钡中硫元素的质量怎么算
 似睡时光似水流年1年前1
似睡时光似水流年1年前1 -
 yuanhappy 共回答了17个问题
yuanhappy 共回答了17个问题 |采纳率88.2%硫酸钡(BaSO4)中硫元素的质量=硫酸钡质量×硫元素质量分数
m(S)=1.165×(32/(137+32+16×4))=1.165×32/233=0.16mg1年前查看全部
- 生物群落中硫元素以什么形式传递顺便说下c元素,是不是CO2啊
 daogudaogu1年前1
daogudaogu1年前1 -
 俊友乐 共回答了21个问题
俊友乐 共回答了21个问题 |采纳率95.2%碳是以有机物的形式传递 不是CO2
生物群落中硫元素以蛋白质等有机物形式传递的1年前查看全部
- 在MgSO4,MgSO3,NaHSO4,三种化合物组成的混合物中,已知硫元素的质量分数为a%,则氧元素的质量分数为
在MgSO4,MgSO3,NaHSO4,三种化合物组成的混合物中,已知硫元素的质量分数为a%,则氧元素的质量分数为
是MgSO4 MgSO3 NaHSO4 海秀东路走九遍1年前1
海秀东路走九遍1年前1 -
 枫林丸子 共回答了22个问题
枫林丸子 共回答了22个问题 |采纳率86.4%通过观察可以发现
3种物质都有"S",且氮只有1个
另外,“NaH”原子量和为24,正好等于Mg的原子量,就可以将,“NaH”看成是Mg
所以“Mg”质量分数24/32×a%
所以氧元素的质量分数为1-a%-0.75a%1年前查看全部
- 现有硫酸铁和硫酸亚铁的混合物若干克,已知在混合物中硫元素的质量分数为16%,求在混合物中铁元素的质量分
现有硫酸铁和硫酸亚铁的混合物若干克,已知在混合物中硫元素的质量分数为16%,求在混合物中铁元素的质量分
要过程 最好把为什么得出结论也写出来
 jonny_swww1年前1
jonny_swww1年前1 -
 004160 共回答了15个问题
004160 共回答了15个问题 |采纳率93.3%Fe2(SO4)3
FeSO4
其中S都是在硫酸根中
S占SO42-的质量分数是
32/(32+16*4)=1/3
则混合物中硫酸根的质量分数是0.16/(1/3)=0.48
即剩下的都是Fe
Fe占1-0.48=52%1年前查看全部
- 下列不能说明氯元素的非金属性比硫元素强的事实是( )
下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定;②HClO氧化性比H2SO4强;③HClO4酸性比H2SO4强;④Cl2能与H2S反应生成S;⑤氯原子最外层有7个电子,硫原子最外层有6个电子.
A. ②⑤
B. ①②
C. ①②④
D. ①③⑤ 艳_dd1年前1
艳_dd1年前1 -
 爱喝七喜的猫 共回答了17个问题
爱喝七喜的猫 共回答了17个问题 |采纳率82.4%解题思路:比较非金属性可通过以下角度:①氢化物的稳定性,②与氢气反应的难易程度,③最高价氧化物对应的水化物的酸性,④单质之间的置换反应,⑤对应阴离子的还原性强弱,⑥与变价金属反应的化合价高低等.①元素的非金属性越强,对应的氢化物越稳定,故①正确;
②比较非金属性的强弱不能根据含氧酸的氧化性强弱,如F不存在含氧酸,但F的非金属性最强,故②错误;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故③正确;
④Cl2能与H2S反应生成S,说明氯气的氧化性比S强,单质的氧化性越强,对应的元素的非金属性越强,故④正确;
⑤比较非金属性的强弱不能根据最外层电子数的多少,应根据得电子能力判断,故⑤错误.
故选A.点评:
本题考点: 非金属在元素周期表中的位置及其性质递变的规律.
考点点评: 本题考查非金属性的比较,学习中注意把握比较非金属性强弱的角度,题目难度中等.1年前查看全部
- (1)用化学符号表示:2个铜原子______;地壳中含量最高的金属元素______;二氧化硫中硫元素的化合价+4SO2+
 (1)用化学符号表示:2个铜原子______;地壳中含量最高的金属元素______;二氧化硫中硫元素的化合价
(1)用化学符号表示:2个铜原子______;地壳中含量最高的金属元素______;二氧化硫中硫元素的化合价
O2+4 S .
O2+4 S
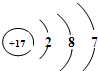
(2)图是氯原子的原子结构示意图,该原子核外有______个电子层,在化学反应中容易______电子(填“得”或“失”),所形成微粒的符号是______,该微粒与钠离子形成化合物的化学式为______. 我看见我来1年前1
我看见我来1年前1 -
 j145 共回答了22个问题
j145 共回答了22个问题 |采纳率90.9%解题思路:(1)本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
(2)原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个铜原子,就可表示为:2Cu;
地壳中含量最高的金属元素是铝元素,其元素符号为:Al.
元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以二氧化硫中硫元素的化合价可表示为:
+4
SO2;
(2)由氯元素的原子结构示意图,圆圈内的数字是17,该原子的核电荷数为17,核外有3个电子层,最外层电子数是7,在化学反应中易得到1个电子而形成阴离子,其符号为:Cl-.该微粒与钠离子形成化合物的化学式为NaCl;
故答案为:(1)2Cu;Al;
+4
SO2;(2)3;得;Cl-;NaCl;点评:
本题考点: 化学符号及其周围数字的意义;原子结构示意图与离子结构示意图.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.1年前查看全部
- 原煤(含硫元素)在氧气中不完全燃烧会生成CO、CO2 和SO2.若测得CO、CO2、和SO2的混合气体中碳元素
原煤(含硫元素)在氧气中不完全燃烧会生成CO、CO2 和SO2.若测得CO、CO2、和SO2的混合气体中碳元素的质量分数为24%,则其中SO2的质量分数可能是( )
A. 10%
B. 30%
C. 50%
D. 70% 随心的鸽子1年前1
随心的鸽子1年前1 -
 财大小哥哥 共回答了16个问题
财大小哥哥 共回答了16个问题 |采纳率93.8%解题思路:本题可采用极端假设法进行假设,假设混合气体全为CO和SO2和混合气体全为CO2和SO2时计算出SO2的质量分数,进而求出混合气体中SO2的质量分数的范围.原煤(含硫元素)在氧气中不完全燃烧会生成CO、CO2、和SO2.若测得CO、CO2、和SO2的混合气体中碳元素的质量分数为24%,则其中SO2的质量分数可能是
1、当混合气体全为CO和SO2时:
CO的含量是:24%÷[12/28]=56%
SO2的含量=100%-56%=44%
2、当混合气体全为CO2和SO2:
CO2的含量是:24%÷[12/44]=88%
SO2的含量=100%-88%=12%
所以SO2的质量分数在12%到44%之间.
故选B.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 本题是一道考查混合物质中根据某元素的质量分数来求的另外几种物质或者元素的质量分数,难度较大,培养了学生的创新思维能力.1年前查看全部
- 已知硫的氧化物sox,其相对分子质量为80,求硫元素的化合价
 最爱莱昂1年前2
最爱莱昂1年前2 -
 ponny_wpy 共回答了23个问题
ponny_wpy 共回答了23个问题 |采纳率95.7%32+16x=80 x=3 设化合价为y 则有 y-2*3=0 得y=+6 硫元素化合价为+61年前查看全部
- 某物质含H2,H2S,SO2中的一种或几种,经测定该物质中硫元素的质量分数为50%,则该物质的成分可能是
 luciferxie1年前1
luciferxie1年前1 -
 妞妞332 共回答了13个问题
妞妞332 共回答了13个问题 |采纳率76.9%so2的相对分子质量是64,s的相对原子质量是32,o的相对原子质量是2*16=32,所以so2中硫元素的质量分数为50%
H2与H2S的混合物中 ,硫元素的质量分数可以为50%
SO2,H2与H2S的混合物中 ,硫元素的质量分数也可以为50%
所以答案是 :
1. so2
2. H2, H2S
3. SO2, H2, H2S1年前查看全部
- 验证氯元素金属性比硫元素强实验
 眼泪后的彩虹1年前2
眼泪后的彩虹1年前2 -
 xingxing_0824 共回答了18个问题
xingxing_0824 共回答了18个问题 |采纳率88.9%1. 依据非金属单质与H2反应的难易程度、剧烈程度和生成气态氢化物的稳定性.与氢气反应越容易、越剧烈,气态氢化物越稳定,其非金属性越强.
2. 依据最高价氧化物的水化物酸性的强弱.酸性越强,其元素的非金属性越强.
3. 依据元素周期表.同周期中,从左向右,随着核电荷数的增加,非金属性逐渐增强;同主族中,由上而下,随着核电荷数的增加,非金属性逐渐减弱.
4. 非金属单质与盐溶液中简单阴离子之间的置换反应.非金属性强的置换非金属性弱的.
5. 依据两非金属元素在同种化合物中相互形成化学键时化合价的正负来判断.如在KClO3中Cl显+5价,O显-2价,则说明非金属性是O > Cl;在OF2中,O显+2价,F显-1价,则说明非金属性是F > O
以上是判断非金属性强弱的方法,若设计实验,最简单的是将氯气通入氢硫酸,看到黄色浑浊.Cl2+H2S→S↓+2HCl1年前查看全部
- 硫与氧形成的氧化物中,硫元素与氧元素的质量比为2:3,则此氧化物中硫元素的化合价是( )
硫与氧形成的氧化物中,硫元素与氧元素的质量比为2:3,则此氧化物中硫元素的化合价是( )
A. +4
B. +6
C. -2
D. +2 hbbhjk1年前1
hbbhjk1年前1 -
 baosila 共回答了13个问题
baosila 共回答了13个问题 |采纳率100%解题思路:要计算硫的氧化物中元素S元素的化合价,首先要确定S、O两元素所组成氧化物的化学式;而确定物质的化学式需要确定分子中的S原子和O原子个数;利用原子个数比=[元素质量比/相对原子质量比]可确定原子个数比,从而写出化学式,然后根据化合物中各元素的化合价代数和为0,计算硫元素的化合价.硫的氧化物中硫和氧的原子个数比=[2/32:
3
16]=1:3,则硫的氧化物的化学式可表示为SO3;
设化合物中S元素化学价为x,已知O元素为-2价,依据化合物中各元素的化合价代数和为0的原则,有x+(-2)×3=0,解得x=+6;
故选:B.点评:
本题考点: 有关化学式的计算和推断;有关元素化合价的计算.
考点点评: 本题是化学式的推断与化合价的计算相结合的综合题,由元素的质量比进行化学式的推断是计算化合价的基础和关键.1年前查看全部
- 含有氮元素的有机物的燃烧产物是N2还是NO2 氯元素呢是HCl还是光气?硫元素呢是SO2么
 水果呢呢1年前4
水果呢呢1年前4 -
 jolin121 共回答了32个问题
jolin121 共回答了32个问题 |采纳率87.5%N一般是N2,Cl是HCl,S是SO2;1年前查看全部
- 用方程式表示氯元素的非金属性比硫元素强
用方程式表示氯元素的非金属性比硫元素强
如题:越多越好 沈倒得1年前2
沈倒得1年前2 -
 坏怀淮 共回答了20个问题
坏怀淮 共回答了20个问题 |采纳率95%氯气+硫化氢=氯化氢+硫1年前查看全部
- Na2SO3固体在空气中易变质成Na2SO4,计算在Na2SO3部分变质后的样品中,(1)所含钠、硫元素的质量为比多少
 liweimao8881年前1
liweimao8881年前1 -
 rdfddddd 共回答了25个问题
rdfddddd 共回答了25个问题 |采纳率88%因为原子守恒,所以不管是Na2SO3还是Na2SO4,Na和S的物质的量之比都是2:1.所以质量比就是46:32=23:16.
后面几问你也都可以写出来.有更多的化学问题也可以专门问我.我的QQ:654416540 我常在1年前查看全部
- 已知NaHSO4、MgS、MgSO4组成的混合物中,硫元素的质量分数为48%,则混合物中氧元素的质量分数为( )
已知NaHSO4、MgS、MgSO4组成的混合物中,硫元素的质量分数为48%,则混合物中氧元素的质量分数为( )
A. 16%
B. 25%
C. 50%
D. 无法确定 肥肠米线1年前1
肥肠米线1年前1 -
 夏zz营小猪 共回答了14个问题
夏zz营小猪 共回答了14个问题 |采纳率71.4%解题思路:根据三者之间的共同点,把Mg、Na和H元素的总质量作为一个整体进行分析,得出正确结论.NaHSO4、MgS、MgSO4组成的混合物中,硫元素的质量分数为48%,
Mg元素质量:S元素质量=24:32,(Na+H)元素质量:S元素质量=24:32,故可把Mg、Na和H元素的总质量作为一个整体,则在混合物中Mg、Na和H元素的总质量:S元素的质量=24:32,
S元素质量分数48%,故Mg、Na和H元素的总的质量分数为:
24
32×48%=36%,
故混合物中氧元素的质量分数为:1-48%-36%=16%,
故选A.点评:
本题考点: 元素质量分数的计算.
考点点评: 本题考查元素质量分数的计算,难度中等.要注意找出三者之间的共同点是解题的关键,侧重考查学生思维能力的培养.1年前查看全部
- 为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)实验室制氯气的反应原理为______,盛有饱和食盐水的洗气瓶的作用是______.
(2)装置B中盛放的试剂是______(填选项),实验现象为______.
A.Na 2 S溶液B.Na 2 SO 3 溶液C.Na 2 SO 4 溶液
(3)装置C中盛放烧碱稀溶液,目的是______,写出反应的离子方程式______.
(4)能证明氯元素比硫元素非金属性强的依据为______. (填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;③S 2- 比Cl - 还原性强;
④HCl比H 2 S稳定.
 ldkjzx1年前1
ldkjzx1年前1 -
 顿怀 共回答了18个问题
顿怀 共回答了18个问题 |采纳率83.3%(1)实验室用二氧化锰和浓盐酸来制取氯气,其原理为:MnO 2 +4HCl(浓) △ . MnCl 2 +Cl 2 ↑+2H 2 O;由于浓盐酸易挥发,所以制备的Cl 2 中混有HCl,...1年前查看全部
- (2014•福州模拟)原煤(含硫元素)在氧气中不完全燃烧会生成CO、CO2 和SO2.若测得CO、CO2、和S
(2014•福州模拟)原煤(含硫元素)在氧气中不完全燃烧会生成CO、CO2 和SO2.若测得CO、CO2、和SO2的混合气体中碳元素的质量分数为24%,则其中SO2的质量分数可能是( )
A.10%
B.30%
C.50%
D.70% 丫丫的心情故事1年前1
丫丫的心情故事1年前1 -
 无才小子 共回答了27个问题
无才小子 共回答了27个问题 |采纳率88.9%解题思路:本题可采用极端假设法进行假设,假设混合气体全为CO和SO2和混合气体全为CO2和SO2时计算出SO2的质量分数,进而求出混合气体中SO2的质量分数的范围.原煤(含硫元素)在氧气中不完全燃烧会生成CO、CO2、和SO2.若测得CO、CO2、和SO2的混合气体中碳元素的质量分数为24%,则其中SO2的质量分数可能是1、当混合气体全为CO和SO2时:CO的含量是:24%÷1228=56%SO2的含量=1...
点评:
本题考点: 有关化学式的计算和推断.
考点点评: 本题是一道考查混合物质中根据某元素的质量分数来求的另外几种物质或者元素的质量分数,难度较大,培养了学生的创新思维能力.1年前查看全部
- 1.硫酸铁和硫酸亚铁的混合物中,若其中铁元素的质量分数为a%,则其中硫元素的质量分数为多少,为什么
 cherio1281年前1
cherio1281年前1 -
 miai5 共回答了19个问题
miai5 共回答了19个问题 |采纳率94.7%处理一下有:Fe(SO4)1.5和FeSO4
所以可以看出剩下的(100-a)%为SO42(硫酸根)
在为SO42(硫酸根)中S占1/3,所以硫元素的质量分数为:(100-a)/3%1年前查看全部
- 当二氧化硫和三氧化硫的质量比为多少时两种物质中所含硫元素质量相等
当二氧化硫和三氧化硫的质量比为多少时两种物质中所含硫元素质量相等
帮帮忙 枪手水文1年前1
枪手水文1年前1 -
 xixi1301 共回答了22个问题
xixi1301 共回答了22个问题 |采纳率86.4%x*32/64=y*32/80
可以得出x:y1年前查看全部
- 下列物质在氧化还原反应中,硫元素只表现还原性的是
下列物质在氧化还原反应中,硫元素只表现还原性的是
A.H2S
B.SO2
C.H2SO3
D.H2SO4 NOTFOUND1年前1
NOTFOUND1年前1 -
 c62xhh 共回答了15个问题
c62xhh 共回答了15个问题 |采纳率93.3%答案A
S有-2、0、+4、+6价,-2价是硫的最低价态,只表现还原性.0、+4价既可以表现还原性,也可表现氧化性,+6价仅表现氧化性.故选A.1年前查看全部
- 在Fe2(SO4)3和FeSO4组成的混合物中,经测定硫元素的质量分数为23%,则该混合物中铁元素的质量分数为_____
在Fe2(SO4)3和FeSO4组成的混合物中,经测定硫元素的质量分数为23%,则该混合物中铁元素的质量分数为______.
 小小老师1年前1
小小老师1年前1 -
 翻身的日子 共回答了17个问题
翻身的日子 共回答了17个问题 |采纳率100%解题思路:根据FeSO4和Fe2(SO4)3两物质的组成特点,可知混合物中硫元素与氧元素的质量比为1:2,混合物中硫元素的质量分数为23%,可计算出混合物中氧元素质量分数,进而可计算出该混合物中铁元素的质量分数.在FeSO4和Fe2(SO4)3组成的混合物中,硫元素与氧元素的质量比=32:(16×4)=1:2,由于混合物中硫元素的质量分数为23%,则混合物中氧元素的质量分数=23%×2=46%,该混合物中铁元素的质量分数为1-23%-46%=31%.
故答案为:31%.点评:
本题考点: 元素的质量分数计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 聚合硫酸铁处理过的水经过水解酸化 是否会引起丝状菌 因为硫元素会引起硫细菌 导致污泥膨胀
 tiantian1101191年前1
tiantian1101191年前1 -
 ww人都傻了 共回答了19个问题
ww人都傻了 共回答了19个问题 |采纳率94.7%不会~1年前查看全部
- 100g二氧化硫中所含硫元素的质量为
 yxty1年前2
yxty1年前2 -
 courage777 共回答了16个问题
courage777 共回答了16个问题 |采纳率93.8%100*32/(32+32)=50g1年前查看全部
- 在Fe2(SO4)3和FeSO4的固体混合物中,如果硫元素的质量分数为a%,则铁元素的质量分数为( )
在Fe2(SO4)3和FeSO4的固体混合物中,如果硫元素的质量分数为a%,则铁元素的质量分数为( )
A. 0.31a%
B. (100-3a)%
C. (100-4a)%
D. 2.25a% 毛胚房1年前1
毛胚房1年前1 -
 菲羊 共回答了10个问题
菲羊 共回答了10个问题 |采纳率90%解题思路:根据FeSO4和Fe2(SO4)3两物质的组成特点,可知混合物中S元素与O元素的质量比为1:2,混合物中硫元素的质量分数为22%则混合物中O元素质量分数为44%,则可计算混合物中铁元素质量分数.在FeSO4和Fe2(SO4)3组成的混合物中,硫元素与氧元素的质量比=32:(16×4)=1:2,
由于混合物中硫元素的质量分数为a%,则混合物中氧元素的质量分数=a%×2=2a%
则混合物中铁元素的质量分数=1-a%-2a%=(100-3a)%
故选B.点评:
本题考点: 元素的质量分数计算.
考点点评: 根据混合物组成中两化合物的中组成元素的特别关系,确定混合物中元素的质量分数,此类问题通过存在这种特点.1年前查看全部
- 下列物质中,不含有硫元素的是.芒硝、明矾、石膏、漂粉精.
 strawg1年前2
strawg1年前2 -
 见上帝去吧 共回答了11个问题
见上帝去吧 共回答了11个问题 |采纳率90.9%漂粉精1年前查看全部
- 怎么判断该示意图粒子是原子 怎么写氮化硅的化学式 计算 :某铜矿石,主要成分为CuFeS2中含硫元素29.75%
怎么判断该示意图粒子是原子 怎么写氮化硅的化学式 计算 :某铜矿石,主要成分为CuFeS2中含硫元素29.75%
求该矿石中铜元素的质量分数.
某硝酸铵样品中NH4NO3的纯度为90%,求此氮元素的质量分数 madanone1年前1
madanone1年前1 -
 chivaschen 共回答了19个问题
chivaschen 共回答了19个问题 |采纳率94.7%1:示意图中 核内质子数=核外电子总数 则为原子
2;Si5N4
3;在CuFeS2中 Cu和S的质量比=64|32=2:1
即 2:1=铜元素的质量分数:硫元素29.75%
所以:铜元素的质量分数=59%
4:NH4NO3中 氮元素的质量分数=28:80=35 %
此氮元素的质量分数=90 %*35 %=31.5 %1年前查看全部
- 某混合物中含有Na 2 SO 4 和Al 2 (SO 4 ) 3 ,经实验测知,其中硫元素的质量分数为25%,则该混合物
某混合物中含有Na 2 SO 4 和Al 2 (SO 4 ) 3 ,经实验测知,其中硫元素的质量分数为25%,则该混合物中铝元素的质量分数为______.  chm48492781年前1
chm48492781年前1 -
 ppcro 共回答了18个问题
ppcro 共回答了18个问题 |采纳率77.8%假设混合物的质量为100g,设Na 2 SO 4 的质量为x,则Al 2 (SO 4 ) 3 的质量为100g-x,
Na 2 SO 4 中硫元素的质量分数为:
32
142 × 100% ≈22.5%,
Al 2 (SO 4 ) 3 中硫元素的质量分数为:
96
342 ×100% ≈28.1%,
∴22.5%x+28.1%×(100-x)=100×25%,
解之得:x≈55.4g,则Al 2 (SO 4 ) 3 的质量为100g-55.4g=44.6g;
Al 2 (SO 4 ) 3 中铝元素的质量分数为:
54
342 ×100% ≈15.8%,
则该混合物中铝元素的质量分数为:
44.6g×15.8%
100 ×100% ≈7%.
故答案为:7%.1年前查看全部
- 氢氧根离子,负2价的硫元素,2个水分子
氢氧根离子,负2价的硫元素,2个水分子
用元素符号或化学式怎么表达啊? rainqin_198306261年前2
rainqin_198306261年前2 -
 xqzr1369 共回答了12个问题
xqzr1369 共回答了12个问题 |采纳率91.7%OH-,S2-,2H2O1年前查看全部
- (2012•沈阳)火力发电厂用燃煤进行发电,由于煤中含有硫元素,燃烧时会产生二氧化硫,所以该发电厂采用石灰石浆吸收废气中
(2012•沈阳)火力发电厂用燃煤进行发电,由于煤中含有硫元素,燃烧时会产生二氧化硫,所以该发电厂采用石灰石浆吸收废气中的二氧化硫以防止污染大气,其发生反应的化学方程式为2CaCO3+2SO2+O2
2CaSO4+2CO2,若处理2000t这种废气(假设废气中的二氧化硫全部被吸收),理论上需要62.6t含碳酸钙80%的石灰石.高温 .
试解答:
(1)若二氧化硫排放到空气中,会造成的环境污染问题是______.
(2)所吸收的废气中二氧化硫的质量分数是多少? 乔峰-阿紫1年前1
乔峰-阿紫1年前1 -
 goodmz 共回答了15个问题
goodmz 共回答了15个问题 |采纳率86.7%解题思路:(1)酸雨产生的原因主要是因为空气中含有二氧化硫、二氧化氮等酸性氧化物引起的.当雨水的pH<5.6时称为酸雨;
(2)根据石灰石浆吸收废气中的二氧化硫的反应方程式找到碳酸钙与二氧化硫的比例关系,根据碳酸钙的质量即可求得所选二氧化硫的质量.(1)雨、雪、雾、霜、露、雹等在降落过程中吸收了空气中的二氧化碳、二氧化硫、氮氧化物等致酸物质,就变成酸性的降水--酸雨.
故填:酸雨;
(2)设废气中二氧化硫的质量为x.则
反应所用CaCO3的质量为:62.6t×80%=50.08t;
2CaCO3+2SO2+O2
高温
.
2CaSO4+2CO2,
200 128
50.08t x
[200/50.08t]=[128/x],
解得,x=32.0512t;
所吸收的废气中二氧化硫的质量分数是:[32.0512/2000t]×100%=1.60256%;
答:所吸收的废气中二氧化硫的质量分数是1.60256%.点评:
本题考点: 含杂质物质的化学反应的有关计算;酸雨的产生、危害及防治.
考点点评: 本题考查了含有杂质物质的化学反应的有关计算.注意,参与反应的反应物的质量应该是纯净物的质量,而非混合物的质量.1年前查看全部
- 硫化氢与浓硫酸反应生成硫、二氧化硫和水.在这个反应中,所有含硫物质硫元素的化合价共有几种?
 简单雅1年前1
简单雅1年前1 -
 冰冰块儿 共回答了18个问题
冰冰块儿 共回答了18个问题 |采纳率88.9%有4种 硫酸中的硫 正六价硫化氢中的硫 负二价硫单质 零价二氧化硫 正四价1年前查看全部
- 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下
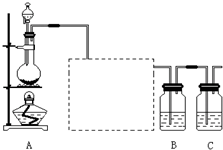
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中加入的试剂是______.
(2)画出虚线框内的实验装置图,并注明所加试剂,______说明装置的作用______.
(3)装置B中盛放的试剂是______(选填下列所给试剂的代码),实验现象为______,化学反应方程式是______,该反应属于四种基本反应类型中的______反应.
A.Na 2 S溶液B.Na 2 SO 3 溶液C.Na 2 SO 4 溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
______
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
______
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
______
______.
 jiangcheng7171年前1
jiangcheng7171年前1 -
 eent123 共回答了21个问题
eent123 共回答了21个问题 |采纳率90.5%(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO 2 .故答案为:浓盐酸;MnO 2 ;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为:
.故答案为:
;除去Cl 2 中的HCl气体;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na 2 S溶液,发生的是置换反应,化学方程式为:Na 2 S+Cl 2 =2NaCl+S↓.
故答案为:A;有淡黄色沉淀生成;Na 2 S+Cl 2 =2NaCl+S↓;置换;
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;
(5)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H 2 S的稳定性强或者HClO 4 的酸性比H 2 SO 4 的酸性强.
故答案为:HCl的稳定性比H 2 S的稳定性强或者HClO 4 的酸性比H 2 SO 4 的酸性强.(其他合理答案均可);
(6)判断元素金属性强弱的依据有:最高价氧化物对应水化物的碱性强弱、单质与水或酸反应置换出氢气的剧烈程度、金属之间的置换反应等,而判断元素具有金属的依据与之不同,如(5)所述.因此,Cl元素的化合价既有升高又有降低,不能说明氯元素既具有金属性又具有非金属性.本题答案为:金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.
故答案为:不能;金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)1年前查看全部
- FeS2中铁元素和硫元素各几价?
 董星辰1年前1
董星辰1年前1 -
 Tiu_LAND 共回答了25个问题
Tiu_LAND 共回答了25个问题 |采纳率88%Fe+2价 S-1价1年前查看全部
- 有一种硫元素的氧化物,其相对分子质量为80,其中硫元素和氧元素的质量比为2:3,试通过计算确定这种氧化物的化学式为 __
有一种硫元素的氧化物,其相对分子质量为80,其中硫元素和氧元素的质量比为2:3,试通过计算确定这种氧化物的化学式为 ___ .
 xinglan27801年前2
xinglan27801年前2 -
 星星x亮了 共回答了20个问题
星星x亮了 共回答了20个问题 |采纳率100%解题思路:先用假设法,假设这种氧化物的化学式为SxOy,然后根据题意列出方程组,就可计算出一个硫元素的氧化物分子中硫的个数和氧的个数,进而得出这种氧化物的化学式.设这种氧化物的化学式为SxOy,
根据题意得:
32x+16y=80
32x:16y=2:3
解之得:
x=1
y=3
∴这种氧化物的化学式为:SO3.
故答案为:SO3.点评:
本题考点: 有关化学式的计算和推断;元素质量比的计算.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 铝元素和硫元素形成化合物的化学式是
 yongyouyang20071年前2
yongyouyang20071年前2 -
 kkk446 共回答了20个问题
kkk446 共回答了20个问题 |采纳率85%Al2S31年前查看全部
- 某混合物中含有硫酸钠和硫酸铝,经实验测知,硫元素的质量分数为25%,则该混合物中铝元素的的质量分数为?
 sweetttea1年前2
sweetttea1年前2 -
 小小小爱心 共回答了17个问题
小小小爱心 共回答了17个问题 |采纳率94.1%设Na2SO4和Al2(SO4)3物质的量分别是x和y
则有:(32x+96y)/(142x+342y)=25%
得x:y=3:1(142x+342y)
所以Na2SO4和Al2(SO4)3物质的量之比=3:1
所以铝元素的质量分数=2*27/(142*3+342)=7%1年前查看全部
- 按硫元素化合价顺序排列的物质:KHS、S、(M)、K2SO4,其中括号内的物质M可能是( )
按硫元素化合价顺序排列的物质:KHS、S、(M)、K2SO4,其中括号内的物质M可能是( )
A.H2S
B.Na2SO3
C.MgSO4
D.SO3 gsw10252631年前1
gsw10252631年前1 -
 anns 共回答了17个问题
anns 共回答了17个问题 |采纳率100%解题思路:根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各化学式进行解答本题.钾显+1价,氢显+1价,氧显-2价,根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,可知KHS、S、K2SO4含硫物质的化合价分别为:-2,0,+6;排列规律为化合价由低到高;故M中硫元素的化合价在0和+6之间.
A、H2S中硫元素的化合价为:-2;
B、Na2SO3中硫元素的化合价为:+4;
C、MgSO4硫元素的化合价为:+6;
D、SO3中硫元素的化合价为:+6;
+4介于0和+6之间.
故选:B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生灵活应用元素化合价的规律进行分析解题的能力.1年前查看全部
- 已知NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量为a%,则混合物中氧元素的质量分数是( )
已知NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量为a%,则混合物中氧元素的质量分数是( )
A. a%
B. 2a%
C. (100-1.75a)%
D. (1-0.75a)% ibm5021年前1
ibm5021年前1 -
 tblz07dgy2_8fd 共回答了18个问题
tblz07dgy2_8fd 共回答了18个问题 |采纳率83.3%解题思路:若把混合物看成1,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-镁元素的质量分数-钠元素的质量分数-氢元素的质量分数;由于Na和H的相对原子质量的和等于Mg的相对原子质量,抛开元素仅从数字的角度来看,“NaH”与Mg相等,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,可看作其相对原子质量为24).那么,这样处理后混合物就相当于是由AS、ASO4、ASO3组成的了,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-A元素的质量分数;而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32;利用硫元素的质量分数可求得A的质量分数,从而计算出混合物中氧元素质量分数.由于Na和H的相对原子质量和等于Mg的相对原子质量,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,其相对原子质量可作24).
根据A、S质量比为24:32以及硫的质量分数为a%,设A的质量分数为x,则有24:32=x:a%,解之得,混合物中A的质量分数为
3
4a%,
氧的质量分数为1-a%-
3
4a%=1-1.75a%=(100-1.75a)%;
故选C.点评:
本题考点: 元素的质量分数计算;元素质量比的计算.
考点点评: 根据物质组成元素的特点,利用数学的技巧处理复杂的化学计算,是解决此类问题所需要的能力.1年前查看全部
- 三氧化硫和二氧化硫两物质的质量比为3:2,则两物质中硫元素的质量比,氧原子的个数比
 zcq100011年前2
zcq100011年前2 -
 niudawan 共回答了21个问题
niudawan 共回答了21个问题 |采纳率90.5%两物质中硫元素的质量比=3/80:2/64=6:5,所以两物质的物质的量比为6:5,
所以氧原子的个数比=6*3:5*2=9:51年前查看全部
- FeSO4和Fe2SO4的混合物中,硫元素质量分数为a%,求铁元素的百分含量
 不得2006不爱1年前1
不得2006不爱1年前1 -
 vivienne11 共回答了15个问题
vivienne11 共回答了15个问题 |采纳率100%解析:FeSO4, Fe2(SO4)3 从中可以看出,S和O原子之比为1:4
因为S%=a% 则有O%=4O/S *S% O%=64/32*a%=2a%
故:Fe%=1-S%-O%=1-a%-2a%=1-3a%1年前查看全部
- 由MgSO4、MgSO3两种物质组成的混合物,经测定混合物中硫元素的质量分数为28%,则混合物中氧元素的质量分数是___
由MgSO4、MgSO3两种物质组成的混合物,经测定混合物中硫元素的质量分数为28%,则混合物中氧元素的质量分数是______.
 sz快乐天使1年前1
sz快乐天使1年前1 -
 重歼241 共回答了14个问题
重歼241 共回答了14个问题 |采纳率100%解题思路:若把混合物看成1,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-镁元素的质量分数,分析所给的化学式可以知道,此时的混合物中Mg、S原子个数比为1:1,二者的质量比为24:32;利用硫元素的质量分数可求得Mg的质量分数,从而计算出混合物中氧元素质量分数.根据Mg、S质量比为24:32以及硫的质量分数为28%,
设Mg的质量分数为x,则有
[24/32]=[x/28%]
解得:x=21%
所以氧元素的质量分数为:1-28%-21%=51%
故答案为:51%.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 根据物质组成元素的特点,利用数学的技巧处理复杂的化学计算,是解决此类问题所需要的能力.1年前查看全部
- 判断氧化剂与还原剂?氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可
判断氧化剂与还原剂?
氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可以做还原剂? onlyhanyan1年前5
onlyhanyan1年前5 -
 雪rr嫩 共回答了14个问题
雪rr嫩 共回答了14个问题 |采纳率85.7%氧化剂和还原剂的判断一般是在具体的化学反应中来说的,在化学反应中,只要有升价此物质即为还原剂,有降价即为氧化剂.(如H2+O2).
如果单从物质判断,那么就要判断此元素是否还可以升价(还原性)或降价(氧化性)
如Cl元素,最高价为+7 ,最低位-1价,当Cl处于+1,+3,+5价时(2价Fe也是),均具有氧化性和还原性,因为均可再升或再降.当元素处于最低或最高价时,没有氧化性(不能再降)和还原性(不能再升).1年前查看全部
- 已知由NaHS、MgSO4、NaHSO3组成的混合物,硫元素的质量分为a%,则混合物中氧元素的质量分数为( )
已知由NaHS、MgSO4、NaHSO3组成的混合物,硫元素的质量分为a%,则混合物中氧元素的质量分数为( )
A. a%
B. 2a%
C. 1-1.75a%
D. 1-0.75a% 417670531年前1
417670531年前1 -
 甲会员 共回答了17个问题
甲会员 共回答了17个问题 |采纳率94.1%解题思路:NaHS、NaHSO3中“NaH”的总相对原子质量为24,与1个Mg原子的相对原子质量相等,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,可看作其相对原子质量为24).那么,这样处理后混合物就相当于是由AS、ASO4、ASO3组成的了,而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32;利用硫元素的质量分数可求得A的质量分数,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-A元素的质量分数.由于Na和H的相对原子质量和等于Mg的相对原子质量,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,其相对原子质量可作24),
混合物就相当于是由AS、ASO4、ASO3组成,而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32=3:4,由于w(S)=a%,故w(A)=[3/4]×a=0.75a%,
氧元素的质量分数=1-a%-0.75a%=1-1.75a%.
故选:C.点评:
本题考点: 元素质量分数的计算.
考点点评: 本题考查质量分数的有关计算,根据物质组成元素的特点,利用数学的技巧进行换元计算,是解决此类问题所需要的能力,难度中等.1年前查看全部
- 下列关于含硫元素的物质的转化过程中,硫元素未被氧化的是( )
下列关于含硫元素的物质的转化过程中,硫元素未被氧化的是( )
A. H2S→SO2
B. SO2→SO3
C. SO2→HSO 2−3
D. S→SO 2−3 张雨轩辽宁1年前2
张雨轩辽宁1年前2 -
 万径人踪 共回答了19个问题
万径人踪 共回答了19个问题 |采纳率94.7%解题思路:硫元素未被氧化,则选项中S元素的化合价没有升高,以此来解答.A.H2S→SO2中,S元素的化合价升高,被氧化,故A不选;
B.SO2→SO3中,S元素的化合价升高,被氧化,故B不选;
C.该转化过程中,S元素的化合价均为+4价,没有变化,则没有被氧化,故C选;
D.S→SO32-中,S元素的化合价升高,被氧化,故D不选;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重还原剂的考查,题目难度不大.1年前查看全部
- 1.在硫与氧形成的氧化物中,硫与氧的质量比为2:3,则此氧化物中,硫元素的化合价是( )
1.在硫与氧形成的氧化物中,硫与氧的质量比为2:3,则此氧化物中,硫元素的化合价是( )
A.+4 B.+6 C.-2 D.+2
我以经演算到比值了,,
但是不是得到3:1么?
你们怎么算得1: fast37211年前1
fast37211年前1 -
 TIANYONGLE 共回答了11个问题
TIANYONGLE 共回答了11个问题 |采纳率100%B
三氧化硫
你不是写着2:3的1年前查看全部
- 含有32g硫元素的硫酸的质量是多少?
 AnotherEnd1年前1
AnotherEnd1年前1 -
 deephouse 共回答了19个问题
deephouse 共回答了19个问题 |采纳率89.5%硫酸H2SO4中S的质量分数=32/98
所以含有32gS的硫酸的质量=32/(32/98)=98g1年前查看全部
- 硫酸铁和硫酸亚铁混合物,其中铁元素质量分数a%,硫元素质量分数为
 花开物语1年前1
花开物语1年前1 -
 我凤我凰 共回答了15个问题
我凤我凰 共回答了15个问题 |采纳率93.3%剩下的都是硫酸根百分数等于1-a%
硫酸根中硫百分数等于1/3
所以硫百分数等于1/3乘以(1-a%)1年前查看全部
大家在问
- 1求《环境污染调查报告》600字左右
- 22除以7除得进吗?是无理数吗?那22除以7是不是无理数
- 3“黔”这个字念什么?(有分)
- 4文言文《与长子受之》翻译
- 5四年级下册英语第一课课文(苏教版)
- 6海水倒灌、海岸线倒退的原因,请给我一个体系好吗.
- 7三阶魔方公式 简单些
- 8生物传递信息的方式给了我们什么启示?
- 9氮元素在生物群落中以有机物形式传递
- 10碳和硫在生物群落的流动形式依次为?
- 11宇宙、天空、世界,三者有什么区别?
- 12世界上是不是不止一个宇宙,每个宇宙都有另外的自己,
- 13人胰岛素原基因在大肠杆菌中表达的胰岛素无生物活性答案说它是因为有内含子的缘故,但是它不是也含有
- 14人胰岛素原基因在大肠肝菌中表达的胰岛素无生物活性 为什么
- 15人胰岛素原基因在大肠杆菌中表达的胰岛素原无生物活性?这句话对还是错?请说明一下原因?
