核素只能是原子吗 离子呢?原子核呢?
 gladsea2022-10-04 11:39:541条回答
gladsea2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 冬夏秋 共回答了21个问题
冬夏秋 共回答了21个问题 |采纳率90.5%- 核素是指具有一定数目质子和一定数目中子的一种原子.例如,原子核里有6个质子和6个中子的碳原子,质量数是12,称为碳-12核素,或写成12C核素.原子核里有6个质子和7个中子的碳原子,质量数为13,称13C核素.氧元素有16O,17O,18O三种核素.具有多种核素的元素称多核素元素.自然界仅有一种核素存在的元素称为单核素元素,如氦、氟、铝、钠等20种元素.质子数为偶数的元素,可有较多的稳定核素,一般不少于3种,而质子数为奇数的元素,通常只有一个稳定核素,从不会多于两种,这是由核子的结合能所决定的.多核素元素中各核素互称同位素,因为它们处于周期表中同一位置上,化学性质基本相同,但核性质不同;单核素元素没有同位素.核素的质量即原子质量,总小于孤立质子、中子和电子的质量总和,在概念上也不等于质量数,在数值上除12C外均与质量数稍有不同.核素的质量是用质谱仪测定的,这种测定很先进,可测得7位或更多位有效数字.
- 1年前
相关推荐
- 核素质量数由什么决定
 I LOVE芳芳1年前1
I LOVE芳芳1年前1 -
 断刀客108 共回答了13个问题
断刀客108 共回答了13个问题 |采纳率100%由中子数和质子数共同决定.等于2者之和1年前查看全部
- 核素同位素的区别是什么?
 sos8311051年前1
sos8311051年前1 -
 老太上网叼根烟 共回答了16个问题
老太上网叼根烟 共回答了16个问题 |采纳率87.5%核素是指具有一定数目质子和一定数目中子的一种原子
同为素就是质子数相同,中子数不同,比如氢
应该有三种同位素吧,氕氘氚,质子数都是1但中子数不一样,这就是同位素1年前查看全部
- 核素,同位素,元素的区别.
 粉红加灰1年前3
粉红加灰1年前3 -
 抱抱亲亲抱抱 共回答了21个问题
抱抱亲亲抱抱 共回答了21个问题 |采纳率95.2%核素:具有确定质子数和中子数的单核粒子称为核素(氢的三种核素:氕、氘、氚)
同位素:质子数相同而中子数不等的同一种元素的原子互称同位素.他们在元素周期表中处于同一位置.
元素:具有相同质子数的一类单核粒子的总称.1年前查看全部
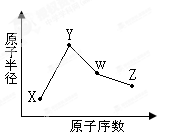
- W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。 
(1)X位于元素周期表中第_____周期第_____族;W的基态原子核外有_____个未成对电子。
(2)X的单质子和Y的单质相比,熔点较高的是__________(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是__________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________。
(4)在25℃、101 kPa下,已知Y的气态化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是____________________。 mkada07231年前1
mkada07231年前1 -
 飞天2 共回答了13个问题
飞天2 共回答了13个问题 |采纳率84.6%(1)三;IA;2
(2)Si;HCl
(3)SiCl 4 +3H 2 O=H 2 SiO 3 +3HCl (其他合理答案均可)
(4)SiH 4 (g)+2O 2 (g)=SiO 2 (s)+2H 2 O(l) ΔH=760kJ/mol1年前查看全部
- 下列叙述中,正确的是( )A.14C中含有14个中子B.1H、2H、3H是同一种核素C.根据酸溶液中c(H+)大小,可
下列叙述中,正确的是( )
A.14C中含有14个中子
B.1H、2H、3H是同一种核素
C.根据酸溶液中c(H+)大小,可将酸分为强酸和弱酸
D.根据分散质颗粒大小,可将分散系分为浊液、胶体和溶液 quanyuany1年前1
quanyuany1年前1 -
 齐腰短发 共回答了17个问题
齐腰短发 共回答了17个问题 |采纳率100%解题思路:A.质量数=质子数+中子数;
B.核素是指具有一定数目质子和一定数目中子的一种原子;
C.完全电离的叫强酸,不完全电离的叫弱酸;
D.按照分散质粒子的直径大小可以把分散系分为溶液、胶体和浊液三种..A.C是核内有7个质子,根据质量数=质子数+中子数可知,14C中含有7中子,故A错误;
B.1H、2H、3H是质子数都是1,中子数分别是0,1,2,不是同一种核素,故B错误;
C.完全电离的叫强酸,不完全电离的叫弱酸,与c(H+)大小无关,故C错误;
D.溶液分散质微粒直径小于1nm,胶体分散质微粒直径介于1nm~100nm之间,浊液分散质微粒直径大于100nm,按照分散质粒子的大小可以把分散系分为溶液、胶体和浊液,故D正确.
故选D.点评:
本题考点: 质量数与质子数、中子数之间的相互关系;核素;分散系、胶体与溶液的概念及关系.
考点点评: 本题考查质量数与质子数、中子数之间的相互关系,核素定义,强弱酸的判断,分散系的分类,难度不大,注意掌握强弱酸的判断.1年前查看全部
- (10分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数
(10分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。
(1)W位于元素周期表中第 周期第 族画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。 zy8401021年前1
zy8401021年前1 -
 sedlqy 共回答了20个问题
sedlqy 共回答了20个问题 |采纳率100%(10分)(1)三、ⅣA (各1分)
(各1分)
(2)HCl HF (各1分)
(3)Na (1分)Na与冷水反应剧烈,而Mg与冷水反应缓慢(其他答案合理也可)(2分)
(4)NaOH+HClO4=NaClO4+H2O (2分)
X的一种核素的质量数为18,中子数为10,则X是氧元素。W的单质是一种常见的半导体材料,所以W是硅。根据原子半径大小顺序可知,Y、W、Z属于第三周期,则Y是钠,Z是氯元素。
(1)氧离子的最外层电子数是8个,所以结构示意图为 。
。
(2)非金属性越强,相应氢化物的稳定性越强。氯元素的非金属性强于溴元素的,所以氯化氢的稳定性强于溴化氢的。氟化氢分子中还原氢键,所以沸点高于氯化氢的。
(3)同周期自左向右金属性逐渐增强,所以钠的金属性强于镁的。比较金属性强弱可以用金属单质和水反应的剧烈程度来检验。Na与冷水反应剧烈,而Mg与冷水反应缓慢,所以钠强于镁。
(4)氢氧化钠和高氯酸反应的方程式为NaOH+HClO4=NaClO4+H 2 O。1年前查看全部
- 判断下列说法的正误.(1)任何一种原子核内都含有质子和中子.______(2)元素的种类和核素的种类相同.______(
判断下列说法的正误.
(1)任何一种原子核内都含有质子和中子.______
(2)元素的种类和核素的种类相同.______
(3)同位素和核素都属于原子.______
(4)互为同位素的原子性质完全相同.______
(5)1940K 与2040Ca 属于同位素.______
(6)O2与O3 属于同位素.______
(7)1940K 与1939K属于同位素.______. 不胜弱衣1年前1
不胜弱衣1年前1 -
 muyi8181 共回答了27个问题
muyi8181 共回答了27个问题 |采纳率96.3%解题思路:(1)氢原子不含有中子;
(2)计算核素种类要考虑中子数和质子数,元素种类只考虑质子数;
(3)具有相同质子数,不同中子数同一元素的不同原子互为同位素,核素是指具有一定数目质子和一定数目中子的一种原子;
(4)同位素的化学性质相同但物理性质不同;
(5)具有相同质子数,不同中子数同一元素的不同原子互为同位素;
(6)具有相同质子数,不同中子数同一元素的不同原子互为同位素;
(7)具有相同质子数,不同中子数同一元素的不同原子互为同位素.(1)氢原子不含有中子,故答案为:×;
(2)计算核素种类要考虑中子数和质子数,元素种类只考虑质子数,故后者多,故答案为:×;
(3)同位素和核素都属于原子,故答案为:√;
(4)元素的原子的最外层电子数决定了元素性质,而同位素的外层电子数相等,所以它们的化学性质几乎完全相同,但物理性质不一定相同,故答案为:×;
(5)质子数不同,为不同元素的原子,不是同位素关系,故答案为:×;
(6)O2与O3均为单质,为氧的同素异形体,故答案为:×;
(7)1940K 与1939K有相同质子数、不同中子数,互为同位素,故答案为:√.点评:
本题考点: 同位素及其应用;原子构成.
考点点评: 本题考查原子结构以及同1年前查看全部
- 原子个数比的题目氯的两种天然核素35cl 37cl 已知氯的相对分子质量分别为70 72 74的三种分子个数比为6:3:
原子个数比的题目
氯的两种天然核素35cl 37cl 已知氯的相对分子质量分别为70 72 74的三种分子个数比为6:3:1 求35cl和 37cl的原子个数比 知名不具04051年前3
知名不具04051年前3 -
 青风大侠 共回答了23个问题
青风大侠 共回答了23个问题 |采纳率87%假设70 72 74三种分子的个数分别为6 3 1
70中含2个35cl 则此处35c个数为6*2=12
72 中含1个35cl 一个37cl 则此处35cl个数为3 37cl个数为3
74中含2个37cl 此处37cl个数为2
综上所述 35cl :37cl=3:11年前查看全部
- 某元素的一种核素X 的质量数为A,含N个中子,它与1H 原子组成H m X 分子。在ag H m X中所含质子的物质的量
某元素的一种核素X 的质量数为A,含N个中子,它与1H 原子组成H m X 分子。在ag H m X中所含质子的物质的量是 [ ]A. 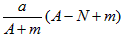 mol
mol
B. mol
mol
C.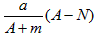 mol
mol
D. mol
mol  idacat1年前1
idacat1年前1 -
 踏网飘零 共回答了20个问题
踏网飘零 共回答了20个问题 |采纳率90%A1年前查看全部
- 某元素的一种核素X的质量数为A,含N个中子,它与 35 Cl原子组成X 35 C
某元素的一种核素X的质量数为A,含N个中子,它与
Cl原子组成X35
Clm分子,则ag X35
Clm中所含质子的物质的量是( )35
A.[a/A+35m](A-N+17m) mol
B.[a/A+m](A-N+17m) mol
C.[a/A+m](A-N) mol
D.[a/A+35m](A-N) mol 会唱歌的太阳1年前1
会唱歌的太阳1年前1 -
 Katrina_Ann 共回答了18个问题
Katrina_Ann 共回答了18个问题 |采纳率88.9%解题思路:X的质量数为A,含N个中子,则质子数为A-N,X
Clm的相对分子质量为A+35m,n(X35
Clm)=35
以及1个Xag (A+35m)g/mol
Clm含有质子数A-N+17m为此解答.35X
35 Clm的相对分子质量为A+35m,agX
35 Clm分子的物质的量为n(X
35 Clm)=[ag
(A+35m)g/mol=
a/A+35m]mol,X原子的质量数为A,含N个中子,则质子数为A-N,所以在ag X
35 Clm分子中含质子的物质的量是[a/A+35m]mol×(A-N+17m)=[a/A+35m]×(A-N+17m)mol,
故选A.点评:
本题考点: 质量数与质子数、中子数之间的相互关系.
考点点评: 本题考查物质的量的计算,侧重于学生的分析能力能力和计算能力的考查,为高频考点,注意把握原子构成以及相关物理量的计算公式的运用,难度不大.1年前查看全部
- 已知氧元素有16O、18O两种核素,按中学化学知识要求,下列说法正确的是( )
已知氧元素有16O、18O两种核素,按中学化学知识要求,下列说法正确的是( )
A. Na2O2与H218O反应时生成产生18O2气体
B. 向2SO2(g)+O2(g)⇌2SO3(g)的平衡体系中加入18O2,结果18O2只出现在产物中
C. CH3COOH和CH3CH218OH发生酯化反应时,产物中分子式为H218O
D. 用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 andychan991年前1
andychan991年前1 -
 盘中果 共回答了17个问题
盘中果 共回答了17个问题 |采纳率94.1%解题思路:A.过氧化钠的还原产物是氧气;
B.根据可逆反应的特征来回答;
C.根据酯化反应的实质是:酸掉羟基醇掉氢来回答;
D.根据氧元素的不同核素之间可以形成分子的种数来回答.A.过氧化钠的还原产物是氧气,不可能出现18O2气体,故A错误;
B.2SO2(g)+O2(g)⇌2SO3(g) 的平衡体系中加入18O2,由于反应是可逆反应,所以达到新的平衡后18O2出现在SO2、O2与SO3中,故B错误;
C.CH3COOH和CH3CH218OH发生酯化反应时,根据“酸掉羟基醇掉氢”的原则,则产物中18O进入乙酸乙酯中,故C错误;
D.用惰性电极电解含有H218O的普通水时,阳极上放电的是氢氧根离子,放出氧气分子,两个18O可以构成氧气分子,两个16O可以构成氧气分子,16O和18O可以构成氧气分子,共可以形成三种相对分子质量不同的氧分子,故D正确.
故选D.点评:
本题考点: 核素.
考点点评: 本题考查核素的概念以及应用方面的知识,注意掌握各种反应的原理,难度中等.1年前查看全部
- 下列说法正确的是( )A.乙烷与乙炔互为同系物B.32S与33S是同种核素C.正丁烷与异丁烷互为同素异形体D.CH3C
下列说法正确的是( )
A.乙烷与乙炔互为同系物
B.32S与33S是同种核素
C.正丁烷与异丁烷互为同素异形体
D.CH3CH2NO2与 互为同分异构体
互为同分异构体  pumimi1年前1
pumimi1年前1 -
 542218955 共回答了15个问题
542218955 共回答了15个问题 |采纳率86.7%解题思路:有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素;
具有相同分子式而结构不同的化合物互为同分异构体;
结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
相同元素组成,不同形态的单质互为同素异形体.A.乙烷与乙炔结构不同,故A错误;
B.32S与33S质子数相同,中子数不同,故互为同位素,故B错误;
C.正丁烷与异丁烷分子式相同,但结构不同,故互为同分异构体,故C错误;
D.CH3CH2NO2与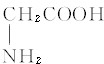 分子式相同,但结构不同,故互为同分异构体,故D正确,
分子式相同,但结构不同,故互为同分异构体,故D正确,
故选D.点评:
本题考点: 芳香烃、烃基和同系物;同素异形体;同分异构现象和同分异构体.
考点点评: 本题考查同位素、同素异形体、同分异构体、同系物的概念,难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.1年前查看全部
- 有一个质子数和0个中子数的原子叫不叫做核素
 hnrblf1年前4
hnrblf1年前4 -
 dreamwjp 共回答了18个问题
dreamwjp 共回答了18个问题 |采纳率88.9%每一种元素中都有不同种的原子,它们质子数相同,中子数不同.质子和中子都相同的原子叫核素;质子数相同而中子数不同的原子互称同位素.所谓原子量,是对元素而言,同一种元素可能有几种不同的核素,比如Cl就有35和37两种,这里的35和37就是对单个的原子来说的相对原子质量,而我们一般在计算或使用的时候不可能总把核素之间的区别考虑进去 ,所以我们要算出一个自然界的Cl的平均相对原子量,计算方法就是35乘以Cl35在自然界所占的百分含量(叫丰度)再加上37乘以Cl37的丰度,得到的就是我们平时用的35.5的这个值,本来我们应该把这个值叫做Cl元素的平均相对原子质量的,但是我们在使用中一般不计较这些,所以会直接吧35.5叫做Cl的相对原子质量.
即在元素周期表中查得的相对原子质量=∑(每种核素的相对原子质量×该核素在自然界中的丰度 )1年前查看全部
- 下列叙述正确的是( )A.13C和14C属于同一种元素,它们互为同位素B.2H和3H是不同的核素,它们的质子数不相等C
下列叙述正确的是( )
A.13C和14C属于同一种元素,它们互为同位素
B.2H和3H是不同的核素,它们的质子数不相等
C.14C和14N的质量数相等,它们的中子数相等
D.6Li和7Li的电子数相等,中子数相等 nimeichi031年前1
nimeichi031年前1 -
 梁祝2004 共回答了19个问题
梁祝2004 共回答了19个问题 |采纳率89.5%解题思路:A.质子数相同,中子数不同的原子互为同位素;
B.同位素的质子数相同;
C.元素符号左上角的数字为质量数,质量数=质子数+中子数;
D.原子中,质子数=电子数,质量数=质子数+中子数.A.13C和14C的质子数相同,则属于同一种元素,但中子数不同,所以它们互为同位素,故A正确;
B.2H和3H是不同的核素,它们的质子数相等,均为1,故B错误;
C.14C和14N的质量数相等,均为14,但它们的中子数分别为8、7,故C错误;
D.6Li和7Li的电子数相等,均为3,中子数分别为3、4,故D错误;
故选A.点评:
本题考点: 质量数与质子数、中子数之间的相互关系;核素.
考点点评: 本题考查原子的构成及原子中的数量关系,把握同位素的判断及原子中质子数=电子数、质量数=质子数+中子数为解答的关键,注重基础知识的考查,题目较简单.1年前查看全部
- 化学:什么是核素?详细!
 002e2gg41年前3
002e2gg41年前3 -
 ad305040 共回答了19个问题
ad305040 共回答了19个问题 |采纳率84.2%核素是指具有一定数目质子和一定数目中子的一种原子.同一种同位素的核性质不同的原子核,它们的质子数相同而中子数不同,结构方式不同,因而表现出不同的核性质.
即如氕氘氚,它们互为同位素,是一种元素,但是是3种核素
核素只要质子或中子有一个不一样就为一种核素1年前查看全部
- 两种核素,1H 2H 离子酸性的强弱,快
两种核素,1H 2H 离子酸性的强弱,快
如题,1H为核中无中子,2H为核中有一个中子
比较两者离子酸性强弱
快 qw_er_ty1年前2
qw_er_ty1年前2 -
 花开凤凰 共回答了12个问题
花开凤凰 共回答了12个问题 |采纳率75%一样的.同位素之间的化学性质完全相同1年前查看全部
- 如果某元素有两种核素,一种核素形成的单质的质量数是158,另一种核素形成的单质的质量数是160
如果某元素有两种核素,一种核素形成的单质的质量数是158,另一种核素形成的单质的质量数是160
问:两种单质的质量数分别等于它们相对分子质量吗?
两种单质的物质的量按质量数算还是按平均相对分子质量算? 一笑悠扬1年前1
一笑悠扬1年前1 -
 bfghe44 共回答了18个问题
bfghe44 共回答了18个问题 |采纳率83.3%质量数与相对分子质量在针对同一分子时是相同的
如果算自然界的该元素的物质的量用平均质量数人为混合物质用其平均相对分子质量
对于一种分子应该用其质量数算1年前查看全部
- 什么叫某元素天然同位素 原子所占的百分数和有关核素的相对原子质量 这两个分别解释下.
什么叫某元素天然同位素 原子所占的百分数和有关核素的相对原子质量 这两个分别解释下.
这两个是求 该元素的相对原子质量的条件.但是我看不懂 我是高一新生 暑假预习功课. 爱你可知否1年前1
爱你可知否1年前1 -
 上蔚 共回答了23个问题
上蔚 共回答了23个问题 |采纳率82.6%同位素是质子数相同,中了数不同的核素,天然同位是自然条件下就存在的,因为有的同位数是我们人工合成的,自然界并不存在,对于比较广义的化学来说,没多大的意义,所以基本不研究它.
相对原子质量是怎么得出来的呢?举个例吧,当然数据不一定准确,记不得了,但是算法肯定是正确的.如氯的天然同位数就只有氯-35和氯-37两种,现假设我们共收集到10000个氯原子,其中氯-35有7000个,其余的都是氯-37,则它们所占的百分比分别是70%和30%
相对原子质量=35*70%+37*30%=35.6的样子,数据有点出入啊
其中35就是氯-35这个核素的相对原子质量,37就是氯-37这个核素的相对原子质量,1年前查看全部
- 重水中的氢元素的核素符号
 ttttkkkk1年前5
ttttkkkk1年前5 -
 歌乐山zly 共回答了22个问题
歌乐山zly 共回答了22个问题 |采纳率86.4%写成D或者2,1H(2,1应该是一个在上,一个在下)1年前查看全部
- 各种核素的原子百分比为定值?为什么?
各种核素的原子百分比为定值?为什么?
如题,为什么? SDGF67881年前1
SDGF67881年前1 -
 海-鸥 共回答了11个问题
海-鸥 共回答了11个问题 |采纳率81.8%核素的百分比是依照它们在自然界中存在的比例得出的,所以是固定的1年前查看全部
- 什么叫某元素天然同位素 原子所占的百分数和有关核素的相对原子质量 这两个分别解释下.
什么叫某元素天然同位素 原子所占的百分数和有关核素的相对原子质量 这两个分别解释下.
这两个是求 该元素的相对原子质量的条件.但是我看不懂 我是高一新生 暑假预习功课. 萧机1年前1
萧机1年前1 -
 强就一个字8 共回答了5个问题
强就一个字8 共回答了5个问题 |采纳率80%在自然界中天然存在的同位素称为天然同位素,人工合成的同位素称为人造同位素.
天然同位素原子所占的百分数指以原子百分数表示的地壳中某种元素各同位素的相对含量.例如,氧的同位素16O、17O、18O的原子百分数(%)为99.76、0.04和0.20
计算元素的相对原子质量会用到:
元素的相对原子质量=MA·a%+MB·b%+MC·c%+…(式中MA,MB,MC…是各同位素的相对原子质量,a%,b%,c%…是各同位素原子百分数.
望采纳1年前查看全部
- 什么叫核素核素 和 同位素 有什么区别?
 gm621717171年前2
gm621717171年前2 -
 68663208 共回答了25个问题
68663208 共回答了25个问题 |采纳率96%核素就是原子,他们只是不同的称谓1年前查看全部
- 质子数相同的原子一定是同种核素 这句话对吗
 nijzh1年前1
nijzh1年前1 -
 dd色眼 共回答了22个问题
dd色眼 共回答了22个问题 |采纳率90.9%错误.核素是指具有一定数目质子和一定数目中子的一种原子.质子数相同中子数不同不是同种核素1年前查看全部
- 核素与同位素到底有什么区别?
 LSNJ65661年前1
LSNJ65661年前1 -
 yf44 共回答了15个问题
yf44 共回答了15个问题 |采纳率93.3%核素是指具有一定数目质子和一定数目中子的一种原子.
具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.
同位素是指的是有相同质子数多种核素的总称.1年前查看全部
- 核素是什么?什么是核素?它和同位素有什么区别?
 ywu24251年前2
ywu24251年前2 -
 芒果叶青青 共回答了13个问题
芒果叶青青 共回答了13个问题 |采纳率100%1.核素
核素是指具有一定数目质子和一定数目中子的一种原子.例如,原子核里有6个质子和6个中子的碳原子,质量数是12,称为碳-12核素,或写成12C核素.原子核里有6个质子和7个中子的碳原子,质量数为13,称13C核素.氧元素有16O,17O,18O三种核素.具有多种核素的元素称多核素元素.自然界仅有一种核素存在的元素称为单核素元素,如氦、氟、铝、钠等20种元素.质子数为偶数的元素,可有较多的稳定核素,一般不少于3个,而质子数为奇数的元素,通常只有一个稳定核素,从不会多于两个,这是由核子的结合能所决定的.多核素元素中各核素互称同位素,因为它们处于周期表中同一位置上,化学性质基本相同,但核性质不同;单核素元素没有同位素.核素的质量即原子质量,总小于孤立质子、中子和电子的质量总和,在概念上也不等于质量数,在数值上除12C外均与质量数稍有不同.核素的质量是用质谱仪测定的,这种测定很先进,可测得7位或更多位有效数字.
2.同位素:
定义:具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.
这里的原子是广义的概念,指微观粒子.
例如氢有三种同位素,H氕、 D氘(又叫重氢)、 T氚(又叫超重氢).1年前查看全部
- 核外电子数相等的原子一定是A.同种元素B.同种核素C.质子数相同D.质量数相同
 Joe宝贝1年前1
Joe宝贝1年前1 -
 v3bp9 共回答了15个问题
v3bp9 共回答了15个问题 |采纳率100%既然是原子,就是中性,核外电子数相等,质子数相同,核电荷数相同,属同种元素.AC对
B,D不对,因为可有不同的中子数(虽然属同种元素)1年前查看全部
- 氕氘氚 是否属于同种原子氕氘氚都是氢元素 是否属于同种原子 什么样的才算是同种原子 还有核素的概念怎么理解 举几个例子
 ycsqlc1年前3
ycsqlc1年前3 -
 hanshanweng04 共回答了17个问题
hanshanweng04 共回答了17个问题 |采纳率88.2%核素是指具有一定数目质子和一定数目中子的一种原子.例如,原子核里有6个质子和6个中子的碳原子,质量数是12,称为碳-12核素,或写成12C核素.原子核里有6个质子和7个中子的碳原子,质量数为13,称13C核素.氧元素有16O,17O,18O三种核素.
氕氘氚都是氢元素,但他们不是同种原子.他们互为同位素
同种元素取决于质子数是否一致,如12C,14C也是同种元素
同一种原子取决于质子数与中子数是否分别都相等,12C与14C质子数(原子序数)相同,但他们中子数一个是6另一个是8,不相等,所以不是同种原子
而1H,2H,3H同理因为质子数都是1,中子数分别为0,1,2,所以不是同种原子,只能说他们是同位素
补充:同位素是具有相同原子序数(即质子数相同,因而在元素周期表中的位置相同),但质量数不同,亦即中子数不同的一组核素.1年前查看全部
- 放射性核素衰变 满足什么衰变规律?假定t=0时,有放射性核素N0个,经过t时间,由于衰变,还留下的核素为多少?
 oime1年前1
oime1年前1 -
 uuclxy 共回答了13个问题
uuclxy 共回答了13个问题 |采纳率100%N=No*e^-λt
半衰期T=ln2/λ
平均寿命T=1/λ
λ是衰变常数1年前查看全部
- 核素与同位素有什么区别?
 佛曾经曰1年前2
佛曾经曰1年前2 -
 Semi_Sleep 共回答了19个问题
Semi_Sleep 共回答了19个问题 |采纳率100%同位素是只几种 互为同位素.氕氘氚是同一种核素1年前查看全部
- 8个中子的碳原子的核素符号是?
 断翅冰蝶1年前2
断翅冰蝶1年前2 -
 lovelyunyun 共回答了15个问题
lovelyunyun 共回答了15个问题 |采纳率80%14(上面) 6(下面)C1年前查看全部
- 核素是指同种元素的原子,还是指所有元素的原子
 jane999991年前1
jane999991年前1 -
 独爱nic 共回答了15个问题
独爱nic 共回答了15个问题 |采纳率93.3%同位素和是指质子数相同,中子数不同的一类不同种类的原子之间的互称.
元素是指质子数相同一类原子的总称,可以说与同位素的定义差不多.
核素就是原子.
希望能解决您的问题.1年前查看全部
- 同一元素各核素的质量数不同的化学性质相同么?
 青面瘦1年前2
青面瘦1年前2 -
 不要随便乱说 共回答了15个问题
不要随便乱说 共回答了15个问题 |采纳率86.7%化学性质主要与最外层电子数有关,所以同一元素各核素的化学性质是相同的.1年前查看全部
- 核素能不能算是元素的一种推广?还有任意一种核素在该元素内所占的原子数目百分比都相同.这个又怎么理解
 美味八宝粥1年前1
美味八宝粥1年前1 -
 我的元素之力 共回答了16个问题
我的元素之力 共回答了16个问题 |采纳率100%核素是狭义的就好像我们以前说的原子
元素是广义的是宏观的
氢有核素D T H
每种核素占气占其总数是一定的
我们的元素周期表的的相对原子质量就是所有核素的平均质量1年前查看全部
- 有人推测尚未合成的第114号元素有相当稳定的同位素,恰处在不稳定核素的“海洋”中浮起的一群较稳定核素的“岛屿”的中心.问
有人推测尚未合成的第114号元素有相当稳定的同位素,恰处在不稳定核素的“海洋”中浮起的一群较稳定核素的“岛屿”的中心.问:114号元素是第几周期第几族元素?它的可能氧化态?
这怎么推啊,不要翻化学元素周期表!
你这么厉害啊,"恰处在不稳定核素的“海洋”中浮起的一群较稳定核素的“岛屿”的中心"就能说明是主族元素? xiaoranchen1年前4
xiaoranchen1年前4 -
 乐712 共回答了17个问题
乐712 共回答了17个问题 |采纳率82.4%题目中已经说明是“114号元素”了.有个是肯定的:112号元素以后的第七周期的元素是哪个族的其实就是它的原子序数的个位数.114,那就是第IVA族了.第七周期排到118号元素,所以它就是第七周期的.又根据第IVA族(俗称碳族...1年前查看全部
- 为什么元素的化学性质主要取决于原子的最外层电子数?同位素中中子数对核素化学性质的影响大么?
 gatesbi1年前1
gatesbi1年前1 -
 wawamama 共回答了22个问题
wawamama 共回答了22个问题 |采纳率81.8%最外层电子数可以反映活泼程度啦啦啦比如稀有气体八电子较稳定1年前查看全部
- 氧元素的一种核素有十个中子,它的符号是什么,
 qqqqq45451年前1
qqqqq45451年前1 -
 鲜ll红了便池 共回答了17个问题
鲜ll红了便池 共回答了17个问题 |采纳率94.1%O2-是氧负二,对不起,打不出来.1年前查看全部
- 互称同位素的不同核素为什么具有几乎完全相同的化学性质?
 ca134741年前1
ca134741年前1 -
 dhaze 共回答了12个问题
dhaze 共回答了12个问题 |采纳率75%因为同位素的不同核素,它们都具有相同的质子数或核电荷数,这些原子电子排布一样,即结构一样,所以化学性质几乎完全相同.1年前查看全部
- 核素与元素的关系是什么?核素要在元素的前提下产生的吗 相同的中子不同的质子是不同的核素吗
核素与元素的关系是什么?核素要在元素的前提下产生的吗 相同的中子不同的质子是不同的核素吗
核素只与中子有关吗? 金色的发带1年前3
金色的发带1年前3 -
 asdfasaaa 共回答了23个问题
asdfasaaa 共回答了23个问题 |采纳率78.3%核素是指具有一定数目质子和一定数目中子的一种原子.例如,原子核里有6个质子和6个中子的碳原子,质量数是12,称为碳-12核素,或写成12C核素.原子核里有6个质子和7个中子的碳原子,质量数为13,称13C核素.
元素是具有相同质子数(核电荷数)的同一类原子的总称.1年前查看全部
- .(奖分)急元素的种类多于、少于还是等于核素的种类?为什么?是否所有的元素都有多种核素?质量数为35,质子数为17的CL
.(奖分)急
元素的种类多于、少于还是等于核素的种类?为什么?
是否所有的元素都有多种核素?
质量数为35,质子数为17的CL离子.
质子数?中子数?质量数?电荷数?电子数? 祭祀seven1年前4
祭祀seven1年前4 -
 颈上的玉 共回答了25个问题
颈上的玉 共回答了25个问题 |采纳率92%少于,中子可能不同
不一定
17,18,35,35,171年前查看全部
- 同位素概念中的‘同一元素的不同核素’是什么意思?
同位素概念中的‘同一元素的不同核素’是什么意思?
同一元素?不同核素? aisha48ma1年前1
aisha48ma1年前1 -
 婕语 共回答了19个问题
婕语 共回答了19个问题 |采纳率89.5%是有相同的质子数不同的中子数 ,对.1年前查看全部
- 已知自然界中铱(Ir)有两种质量数分别为191和193的核素,而铱元素的相对原子质量为192.22.这两种同位素的原子个
已知自然界中铱(Ir)有两种质量数分别为191和193的核素,而铱元素的相对原子质量为192.22.这两种同位素的原子个数比应为( )
A. 39:61
B. 61:39
C. 1:1
D. 39:11 W _ii1年前0
W _ii1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 物理概念的区分元素与核素的区别
 aa开最晚1年前1
aa开最晚1年前1 -
 梦中兴来 共回答了21个问题
梦中兴来 共回答了21个问题 |采纳率95.2%元素:是具有相同质子数(核电荷数)的同一类原子的总称
核素:核素是指具有一定数目质子和一定数目中子的一种原子.1年前查看全部
- 是否所有的核素都含有质子,电子和中子?
 sdrsa1年前1
sdrsa1年前1 -
 iqe2r 共回答了11个问题
iqe2r 共回答了11个问题 |采纳率63.6%氢不含中子1年前查看全部
- 同种元素的不同核素可以相互转化吗
 侧耳根1年前2
侧耳根1年前2 -
 tpjack 共回答了17个问题
tpjack 共回答了17个问题 |采纳率76.5%同种元素的不同核素与不同元素的不同核素间的转换,理论上应该是可能的,但那都不是化学反应,都属于原子核物理.1年前查看全部
- 下列叙述错误的是( )A. 13C和14C属于同一种元素,它们互为同位素B. 1H和2H是不同的核素,它们的质子数相等
下列叙述错误的是( )
A. 13C和14C属于同一种元素,它们互为同位素
B. 1H和2H是不同的核素,它们的质子数相等
C. 14C和14N的质量数相等,它们的中子数不等
D. 6Li和7Li的电子数相等,中子数也相等 wjlwz31年前1
wjlwz31年前1 -
 misskongkong 共回答了9个问题
misskongkong 共回答了9个问题 |采纳率100%解题思路:根据原子表示法的知识,元素符号左上角数字表示质量数,左下角数字表示质子数,质量数-质子数=中子数,质子数相同而中子数不同的同种元素的原子互为同位素.A、13C和14C属于同一种元素,质子数相同而中子数不同,它们互为同位素,故A正确;
B、1H和2H是氢元素的不同核素,质子数相同均为1,故B正确;
C、14C和14N的质量数相等,质子数分别为6、7,中子数分别为:14-6=8、14-7=7,它们的中子数不等,故C正确;
D、6Li和7Li的电子数相等均为3,中子数分别为:6-3=3、7-3=4,不相等,故D错误.
故选D.点评:
本题考点: 同位素及其应用;质量数与质子数、中子数之间的相互关系.
考点点评: 本题是对教材概念的考查,可以根据所学知识进行回答,较简单.1年前查看全部
- ★先看大题图:1)质子数与中子数不相等的核素有__________________;互称同位素的核素有_________
★先看大题图:

1)质子数与中子数不相等的核素有__________________;互称同位素的核素有___________________.
中子数相等的不同元素的原子是_________________.
2)现有10.0g由
和

组成的水分子的物质的量为________;其中含质子数为________NA;中子数为_______________个.
3)由

和

构成的CO2摩尔质量为______________.标准状况下9.2g这种CO2所占有的体积约为_______________. 雪花美人1年前1
雪花美人1年前1 -
 Shabl 共回答了19个问题
Shabl 共回答了19个问题 |采纳率84.2%h1 c14 o18;hi&h2;o16&o18
0.2,2,2na
50,0.184*22.41年前查看全部
- 核素与同位素的区别
 亲亲宝贝BB1年前2
亲亲宝贝BB1年前2 -
 单Cheng票 共回答了16个问题
单Cheng票 共回答了16个问题 |采纳率87.5%核素是指具有一定数目质子和一定数目中子的一种原子.
同位素是指质子数相同,中子数不同的原子,例如C12、C13和C141年前查看全部
- 如何理解元素、原子、核素、分子、同位素?
 adld04151年前2
adld04151年前2 -
 威尔士gg 共回答了20个问题
威尔士gg 共回答了20个问题 |采纳率80%元素:所有核电荷数(即质子数)相同的原子的总称
原子:参与化学反应的最小粒子,由原子核和核外电子组成.
核素:所有核内质子数和中子数均相同的原子的总称(注意中子数必须相同)
分子:保持物质物理和化学性质的最小粒子,由原子通过成键形成
同位素:核电荷数(即质子数)相同,但中子数不同的核素,它们在周期表中在同一格.如C-12和C-14,二者核内均有6个质子,但分别有6个和8个中子1年前查看全部
- 某实验测定地下水样中构成水分子的是(如图)据此何以判断水中 核素有几种,可以组成的水分子有多少种
 bixinripple1年前3
bixinripple1年前3 -
 colindog 共回答了15个问题
colindog 共回答了15个问题 |采纳率86.7%有五种核素,分别是氢-1,氢-2(氘),氢-3(氚),氧-16,氧-18
可以组成的水分子有12种1年前查看全部
大家在问
- 1岩石圈是指软流层及其以上部分,由坚硬的岩石组成.______.(判断对错)
- 2白云千载空悠悠前一句是什么啊?
- 3甲、乙、丙三根竹竿直立地插入吃糖的水中,这三根竹竿的长度总和是360厘米.已知甲
- 4涂腊的木棍下端缠住一段铁丝,使它能竖直浮在水面,如果用刀把它露出水面的部分全切去,则余下的部分将
- 5课外活动时,老师发给小林和小雨各一条长为23cm的细铁丝,要求他们用这根细铁丝去围成一个有一边长为7cm的
- 6十毫升等于几厘米?
- 7哪些碳氧双键可以加氢?
- 8判断一下正误:氢原子核外有一层带负电荷的电子
- 9如题:岩石圈与软流层的物质状态?人类认识地球形状和大小的漫长历程?
- 10请问寒带,温带,热带的分界线,精略的纬度数?
- 11地球上四季变化最明显的地区( )A:热带 B:寒带 C:温带 D:南寒带
- 12软流层位于下列地球内部结构的哪个部位
- 13,白云千载空悠悠.上一句
- 14白云千载空悠悠的上一句
- 15100以内,既有因数2,又有因数3的数有多少个?分别是什么?
