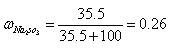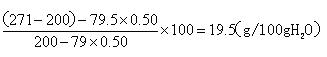Na 2 SO 3 ·7H 2 O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na 2 SO 3 在30℃时的溶解度为3
 anwcwccc2022-10-04 11:39:541条回答
anwcwccc2022-10-04 11:39:541条回答| Na 2 SO 3 ·7H 2 O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na 2 SO 3 在30℃时的溶解度为35.5g/100gH 2 O。 1)计算30℃时Na 2 SO 3 饱和溶液中Na 2 SO 3 的质量分数  。(保留2位小数) 。(保留2位小数)[来源:学#科#网Z#X#X#K] 2)计算30℃时271g Na 2 SO 3 饱和溶液中水的质量。 3)将30℃的Na 2 SO 3 饱和溶液271g冷却到10℃,析出Na 2 SO 3 ·7H 2 O晶体79.5g。计算10℃时Na 2 SO 3 在水中的溶解度。 |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
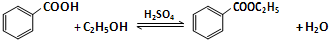
已知:某些物质的物理常数如表所示:
*苯甲酸在100℃会迅速升华.物质 颜色状态 密度/g/cm3 熔点/℃ 沸点/℃ 苯甲酸* 白色固体 1.2659 122 249 苯甲酸乙酯 无色液体 1.05 -34.6 212.6 乙酸 无色液体 1.0492 16.6 117.9 乙醇 无色液体 0.789 -117.3 78.5 乙酸乙酯 无色液体 0.894-0.898 -83.6 77.1 乙醚 无色液体 0.713 -116.3 34.6
(1)如图1为课本上制取乙酸乙酯的实验装置图,请回答下列问题:
①导管口不能伸入液面下的原因是______;
②浓硫酸的作用是______、______
③能否用NaOH溶液代替饱和碳酸钠溶液?______(填“能”或“否”),并简述原因______
(2)实验室制取苯甲酸乙酯.
在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、4mL浓硫酸,混合均匀并加入沸石,按图2所示装好仪器,控制温度加热回流2h.
①实验室制取苯甲酸乙酯为什么不同样使用制取乙酸乙酯的装置?______;
②实验中使用分水器不断分离除去水的目的是:______;
(3)产品的提纯.
①将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,分批加入______溶液至溶液呈中性.
②用分液漏斗分出有机层得粗产品.水层用乙醚______(填实验操作名称),醚层与粗产品合并;
③在粗产品加入无水氯化钙后,按图3进行______(填实验操作名称),低温蒸出乙醚后,继续升温,接收210~213℃的馏分.
④产品经检验合格,测得产品体积为12.86mL.
(4)该实验的产率为90%.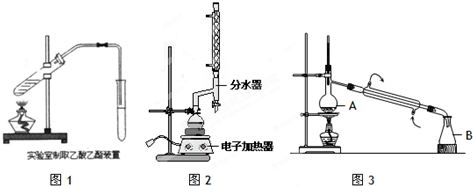
 superyellow1年前1
superyellow1年前1 -
 zip198306 共回答了18个问题
zip198306 共回答了18个问题 |采纳率83.3%解题思路:(1)①乙酸乙酯挥发出来的乙酸和乙醇易溶于水,加热过程中容易发生倒吸现象;
②浓硫酸在酯化反应中起到了吸水剂和催化剂的作用;
③生成的乙酸乙酯在氢氧化钠溶液中发生水解;
(2)依据装置中反应物挥发出的多减小反应物的利用率分析;使用分水器不断分离除去水,促进反应正向进行,生成酯的产率增大;
(3)①产品中含有未反应的乙醇、浓硫酸、苯甲酸、水,加入饱和碳酸钠溶液吸收乙醇,中和硫酸;
②用分液漏斗分出有机层得粗产品,水层用乙醚萃取后醚层与粗产品合并;
③操作③采取分馏的方法,将苯甲酸乙酯与乙醇、水分离,由苯甲酸乙酯的沸点可知应收集沸点212.6℃的馏分.(1)①该实验过程中,给试管中的混合液体加热若不均匀,容易发生倒吸现象,实验试管Ⅱ中的导管不插入液面下,目的是防止倒吸;
故答案为:防止倒吸;
②乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,所以浓硫酸的作用为催化作用、吸水作用;
故答案为:催化剂;吸水剂;
③氢氧化钠溶液是强碱溶液,生成的乙酸乙酯在氢氧化钠溶液中会发生水解;
故答案为:否;氢氧化钠是强碱,促进乙酸乙酯水解;
(2)①如果使用制取乙酸乙酯的装置,反应过程中加热,会使乙醇大量蒸馏出去,乙醇挥发混入酯中,降低反应物的利用率,实验效率大大降低,
故答案为:如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
②酯化反应是可逆反应,使用分水器不断分离除去水,促进酯化反应正反应方向进行,提高生成酯的产量,
故答案为:分离反应过程中生的水,促进酯化反应向正反应方向进行;
(3)①由实验过程分析可知,将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,是洗去苯甲酸甲酯中的硫酸、苯甲酸,应选择饱和碳酸钠溶液,故答案为:饱和Na2CO3;
②用分液漏斗分出有机层得粗产品,水层用乙醚萃取后,醚层与粗产品合并,减少产品的损耗,故答案为:萃取;
③操作③采取蒸馏的方法,将苯甲酸乙酯与乙醇、水分离,由苯甲酸乙酯的沸点可知应收集沸点212.6℃的馏分,故答案为:蒸馏.点评:
本题考点: 乙酸乙酯的制取.
考点点评: 本题考查有机物的合成,侧重对化学实验的考查,涉及对装置的理解、物质的分离提纯、对实验条件的控制、对数据的分析处理等,难度中等,需要学生基本知识的基础与灵活运用能力.1年前查看全部
- 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO2的主要流程如下.
(1)双氧水的结构式为:______;Ⅰ中发生反应的还原剂是______(填化学式).
(2)Ⅱ中反应的离子方程式是______.
(3)A的化学式是______,装置Ⅲ中A在______极区产生.
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备.
①写出该反应的化学方程式______
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因______.
(5)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量______(填相同、不相同或无法判断)
 136851122511年前1
136851122511年前1 -
 zylisten 共回答了16个问题
zylisten 共回答了16个问题 |采纳率81.3%(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,其结构式为:H-O-O-H,
,其结构式为:H-O-O-H,
由流程图可知反应Ⅰ,反应物为NaClO3、Na2SO3、加入A溶液,产生C1O2、Na2SO4溶液,反应离子方程式为2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,所以Na2SO3具有还原性是还原剂,将ClO3-还原为C1O2,
故答案为:H-O-0-H;Na2SO3;
(2)Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),所以反应方程式为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2↑,离子方程式是2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)Ⅲ为电解硫酸钠本质是电解水,阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O,所以A为硫酸,为阳极放出氧气,故答案为:H2SO4;阳;
(4)①亚氯酸钠和稀盐酸反应生成ClO2、NaCl和水,化学方程式为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,故答案为:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O;
②5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,ClO2-具有氧化性,ClO2-的氧化性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2,离子方程式为ClO2-+3Cl-+4H+=2Cl2+2H2O,根据研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,
故答案为:ClO2-+3Cl-+4H+=2Cl2+2H2O;
(5)Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同,故答案为:相同.1年前查看全部
- Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH2O.
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω.(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量.
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g.计算10℃时Na2SO3在水中的溶解度. 小号骂人1年前1
小号骂人1年前1 -
 强行插入 共回答了20个问题
强行插入 共回答了20个问题 |采纳率95%解题思路:1)根据溶质的质量分数=[溶质的质量/溶液的质量]和Na2SO3在30℃时的溶解度来计算饱和溶液中Na2SO3的质量分数ω;
2)根据Na2SO3在30℃时的溶解度来计算271g Na2SO3饱和溶液中水的质量;
3)根据Na2SO3•7H2O晶体和原溶液中溶质的质量求出10℃是饱和溶液中溶质的质量和溶剂的质量,再求出10℃时Na2SO3在水中的溶解度,即100g水中溶解 Na2SO3的质量.1)根据Na2SO3的溶解度,其饱和溶液中溶质为35.5g,溶剂为100g,溶液总质量=100+35.5=135.5g,
则ω(Na2SO3)=[35.5g/135.5g]≈0.26;
2)271g饱和溶液中,假设其含有的溶剂为x,
Na2SO3在30℃时的溶解度为35.5g/100gH2O,
则[100g/135.5g=
x
271g],
解之得:x=200(g);
3)冷却溶液后,析出晶体79.5g,根据其晶体Na2SO3•7H2O的组成,其中含有水和亚硫酸钠为:
m(Na2SO3)=79.5g×[126/126+126]=39.75g
m(H2O)=79.5g-39.75g=39.75g
10℃时Na2SO3的质量为271-200-39.75=31.25g
10℃时H2O的质量为200-39.75=160.25g
假设10℃时Na2SO3的溶解度为y
[100g/y=
160.25g
31.25g],
解得y=19.5g;
答:1)30℃时Na2SO3饱和溶液中Na2SO3的质量分数为0.26;
2)30℃时271g Na2SO3饱和溶液中水的质量为200g;
3)10℃时Na2SO3在水中的溶解度为19.5g.点评:
本题考点: 溶液中溶质的质量分数及相关计算;溶解度、饱和溶液的概念.
考点点评: 此题考查了溶液的质量分数、溶剂的质量、溶解度等化学计算知识,要理解溶解度的概念.1年前查看全部
- 小苏打(NaHCO3)是食品工业中一种应用最广泛的疏松剂.资料显示,NaHCO3在潮湿的空气中会缓慢分解成Na2CO3,
小苏打(NaHCO3)是食品工业中一种应用最广泛的疏松剂.资料显示,NaHCO3在潮湿的空气中会缓慢分解成Na2CO3,H2O和CO2.某化学兴趣小组同学为了对在潮湿空气中久置的NaHCO3样品进行分析,称取一份31.4g混合均匀的样品,用酒精灯对其充分加热,冷却后称得其质量为21.2g,另称取一份相同质量的样品,逐滴加入稀硫酸至没有气泡产生为止,共收集到气体折算成标准状况下的体积为7.28L.通过计算回答下列问题:(1)加热后得到的21.2g固体是 (填化学式)(2)该一份样品原有的NaHCO3和质量是 g(3)样品中Na2CO3的质量分数是多少?
 sirczj1年前1
sirczj1年前1 -
 爱上蓝珊瑚海 共回答了28个问题
爱上蓝珊瑚海 共回答了28个问题 |采纳率89.3%1.碳酸钠 Na2CO3(碳酸氢钠加热分解后固体产物只有碳酸钠,而碳酸钠加热不分解,故完全加热后产物只有碳酸钠)2. 21g设固体混合物中NaHCO3的物质的量为Xmol,Na2CO3的物质的量为Ymol.由化学学方程式得,a.加热过程中,NaHCO3分解生成的Na2CO3的物质的量为1/2 Xmol,而混合固体中原有的Na2CO3的物质的量为Ymol,所以有 1/2 X + Y = 21.2/106 b.加入稀硫酸,NaHCO3反应生成气体的物质的量为Xmol,Na2CO3反应生成的气体的物质的量为Ymol则有 X + Y =7.28/22.4由以上两式得 X=0.25 Y=0.075故一份样品中原有的NaHCO3的质量是 0.25x84=21g3. 25%一份样品中Na2CO3的质量为 0.075x106=7.95g,故质量分数为7.95/31.4=25%(约等于)1年前查看全部
- A为常见烃是一种水果催熟剂,乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业.如图是乙酸苯甲酯的一种合成路线
A为常见烃是一种水果催熟剂,乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业.如图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去).

请回答:
(1)E的官能团名称为______F的结构简式为______
(2)反应①条件为______,反应④的类型是______
(3)反应②的化学方程式为2CH3CH2OH+O2
2CH3CHO+2H2OCu △ 2CH3CH2OH+O2;反应类型是______
2CH3CHO+2H2OCu △
(4)物质D与新制氢氧化铜反应方程式为CH3CHO+2Cu(OH)2
CH3COOH+Cu2O+2H2O△ CH3CHO+2Cu(OH)2
CH3COOH+Cu2O+2H2O△
(5)G有多种同分异构体,其中属于芳香族化合物的有______种 (不包括G)
写出其中的任意一种同分异构体的结构简式______. condongy1年前1
condongy1年前1 -
 杀倭寇一亿 共回答了20个问题
杀倭寇一亿 共回答了20个问题 |采纳率90%解题思路:E与苯甲醇反应生成乙酸苯甲酯,可知E为CH3COOH,C能发生连续氧化生成E,则C为CH3CH2OH,D为CH3CHO,A与氯化氢反应生成B,B转化生成C,A为常见烃是一种水果催熟剂,所以A应为CH2=CH2,B为CH3CH2Cl.甲苯与氯气在光照条件下发生反应生成F,F水解生成苯甲醇,故甲苯与氯气发生甲基上的一氯取代反应生成F为 ,然后结合有机物的结构和性质来解答.
,然后结合有机物的结构和性质来解答.
E与苯甲醇反应生成乙酸苯甲酯,可知E为CH3COOH,C能发生连续氧化生成E,则C为CH3CH2OH,D为CH3CHO,A与氯化氢反应生成B,B转化生成C,A为常见烃是一种水果催熟剂,所以A应为CH2=CH2,B为CH3CH2Cl.甲苯与氯气在光照条件下发生反应生成F,F水解生成苯甲醇,故甲苯与氯气发生甲基上的一氯取代反应生成F为
 ,
,
(1)由上述分析可知,E为CH3COOH,含有羧基,F的结构简式为:,
故答案为:羧基; ;
;
(2)反应①为CH3CH2Cl在氢氧化钠溶液、加热条件下生成CH3CH2OH,
反应④是CH3COOH与苯甲醇发生酯化反应生成乙酸苯甲酯,属于取代反应,
故答案为:氢氧化钠溶液、加热;取代反应;
(3)反应②的化学方程式为2CH3CH2OH+O2
Cu
△2CH3CHO+2H2O,属于氧化反应,
故答案为:2CH3CH2OH+O2
Cu
△2CH3CHO+2H2O;氧化反应;
(4)物质D与新制氢氧化铜反应方程式为:CH3CHO+2Cu(OH)2
△
CH3COOH+Cu2O+2H2O,
故答案为:CH3CHO+2Cu(OH)2
△
CH3COOH+Cu2O+2H2O;
(5)G有多种同分异构体,其中属于芳香族化合物的甲基苯酚(有邻、间、对三种)、苯甲醚,符合条件的同分异构体为: ,
,
故答案为:4; 任意一种.
任意一种.点评:
本题考点: 有机物的推断;有机物的合成.
考点点评: 本题考查有机物的推断,明确乙酸苯甲酯的结构及逆合成分析法来推断各物质是解答本题的关键,注意C能发生连续氧化及E发生酯化反应即可解答,题目难度不大.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某
亚氯酸钠(NaClO 2 )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某亚氯酸钠(NaClO 2 )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO 2 的主要流程如下。

(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO 2 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO 2 + 4HCl =" 5NaCl" + 4ClO 2 ↑ + 2H 2 O。
① 该反应中氧化剂和还原剂的物质的量之比是 。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl 2 的含量越大,运用氧化还原反应规律分析其原因是 。
(5)NaClO 2 变质可分解为NaClO 3 和NaCl。取等质量变质前后的NaClO 2 试样配成溶液,分别与足量FeSO 4 溶液反应时,消耗Fe 2+ 的物质的量相同,从电子守恒的角度解释其原因是 。
 shenlong091年前1
shenlong091年前1 -
 hwk520hwk 共回答了18个问题
hwk520hwk 共回答了18个问题 |采纳率94.4%(1)Na 2 SO 3 H 2 O(2分)
(2)2ClO 2 + H 2 O 2 + 2OH - = 2ClO + O 2 ↑+ 2H 2 O(2分)
+ O 2 ↑+ 2H 2 O(2分)
(3)H 2 SO 4 (2分)阳 (2分)
(4)1∶4 (2分) ClO 的氧化性或Cl - 的还原性随溶液的酸性和浓度的增大而增强,因此Cl - 被氧化得到Cl 2 (2分)
的氧化性或Cl - 的还原性随溶液的酸性和浓度的增大而增强,因此Cl - 被氧化得到Cl 2 (2分)
(5)NaClO 2 变质前后分别与Fe 2+ 反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同(2分)
试题分析:(1)Ⅰ中发生的反应是亚硫酸钠被氯酸钠氧化,、Ⅲ中发生的反应是电解水,因此在这两个反应中还原剂分别是:Na 2 SO 3 H 2 O(2分)
(2)2ClO 2 + H 2 O 2 + 2OH - = 2ClO + O 2 ↑+ 2H 2 O(2分)
+ O 2 ↑+ 2H 2 O(2分)
(3)Ⅲ装置中左边氢氧根离子放电,剩余的氢离子跟硫酸根离子结合成硫酸,所以A是:H 2 SO 4 ; 因为是氢氧根离子放电,所以这边是电解池的阳极。
(4)在这个反应中发生的是亚氯酸钠中氯元素的自身氧化还原反应,既作氧化剂,也作还原剂,作氧化剂的亚氯酸钠是化合价降低的,也就是由正三价变成正一价,为一摩尔,作还原剂的亚氯酸钠是化合价升高的,也就是由正三价变成正四价,为四摩尔,所以该反应中氧化剂和还原剂的物质的量之比是1∶4 ;ClO 的氧化性或Cl - 的还原性随溶液的酸性和浓度的增大而增强,因此Cl - 被氧化得到Cl 2 。
的氧化性或Cl - 的还原性随溶液的酸性和浓度的增大而增强,因此Cl - 被氧化得到Cl 2 。
(5)NaClO 2 变质前后分别与Fe 2+ 反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同(2分)1年前查看全部
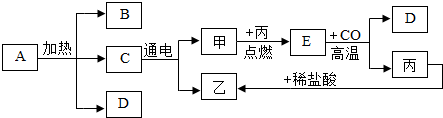
- (2012·德阳)下图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质,A、B、C、D、E为化合物,A在食品工业上
(2012·德阳)下图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质,A、B、C、D、E为化合物,A在食品工业上是发酵粉的一种主要原料,D是使地球产生温室效应的一种气体,丙是生产生活中占据主导地位的金属。(图中部分生成物已略去)

请回答:
(1)B中阴离子的化学符号是 。
(2)写出A受热分解的化学方程式 。
(3)在C生成甲和乙的化学反应中,所得甲乙两种气体的体积比是 。
(4)写出E与CO反应生成D和丙的化学方程式 。 每日经济hh1年前1
每日经济hh1年前1 -
 假面王子 共回答了20个问题
假面王子 共回答了20个问题 |采纳率100%(1)CO 3 2- (2)2NaHCO 3 Na 2 CO 3 +H 2 O+CO 2 ↑
Na 2 CO 3 +H 2 O+CO 2 ↑
(3)1:2(4)4CO+Fe 3 O 4 3Fe+4CO 2
3Fe+4CO 2
因为A在食品工业上是发酵粉的一种主要原料,所以A为碳酸氢钠;D是使地球产生温室效应的一种气体,所以D为二氧化碳,则B为碳酸钠、C为水;丙是生产生活中占据主导地位的金属,能和盐酸反应,所以乙为氢气,则甲为氧气;丙能在氧气中燃烧,且其生成物能在高温的条件下被还原,所以丙为铁,E为四氧化三铁。所以:
(1)B中阴离子的化学符号是CO 3 2- ;
(2)A受热分解的化学方程式为2NaHCO 3 = ( △ ) Na 2 CO 3 +CO 2 ↑+H 2 O ;
(3)C生成甲和乙的化学反应为电解水的反应甲、乙两种气体的体积比是1:2;
(4)E与CO反应生成D和丙的化学方程式为4CO+Fe 3 O 4 = ( 高温 ) 3Fe+4CO 2 。1年前
91年前查看全部
- 柠檬醛是一种具有柠檬香味的有机化合物,广泛存在于香精油中,是食品工业中重要的调味品,且可用于合成维生素A.已知柠檬醛的结
柠檬醛是一种具有柠檬香味的有机化合物,广泛存在于香精油中,是食品工业中重要的调味品,且可用于合成维生素A.已知柠檬醛的结构简式为

(1)试推测柠檬醛可能发生的反应有______.
①能使溴的四氯化碳溶液退色 ②能与乙醇发生酯化反应 ③能发生银镜反应 ④能与新制的Cu(OH)2悬浊液反应 ⑤能使酸性KMnO4溶液退色
A.①②③④B.①②④⑤C.①③④⑤D.①②③④⑤
(2)要检验柠檬醛分子含有醛基的方法是______.
(3)要检验柠檬醛分子中含有碳碳双键的方法:______.
(4)实验操作中,应先检验哪一种官能团?______. ywj_net1年前1
ywj_net1年前1 -
 wormfish 共回答了19个问题
wormfish 共回答了19个问题 |采纳率94.7%解题思路:有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有醛基,可发生氧化和加成(还原)反应,鉴别碳碳双键可用溴水,但应首先排除醛基的影响,以此解答该题.(1)分子中含有碳碳双键,可发生加成、加聚和氧化反应,则①②正确,含有醛基,可发生氧化反应,则③④⑤正确,分子中不含羧基,则与乙醇不反应,②错误,
故答案为:C;
(2)检验醛基可用新制备氢氧化铜浊液或银氨溶液,可将少量柠檬醛加入盛有氢氧化铜浊液的试管中并加热,有砖红色沉淀生成,说明含有醛基,
故答案为:将少量柠檬醛加入盛有氢氧化铜浊液的试管中并加热,有砖红色沉淀生成;
(3)因醛基也能使溴水或酸性高锰酸钾以及溶液褪色,则检验碳碳双键时,应先排除醛基对碳碳双键的影响,可将(2)中反应后的溶液静置,取上层清液加入酸性高锰酸钾溶液中,振荡,溶液褪色,说明含有碳碳双键,
故答案为:将(2)中反应后的溶液静置,取上层清液加入酸性高锰酸钾溶液中,振荡,溶液褪色,说明含有碳碳双键;
(4)应先检验醛基,因氢氧化铜浊液可氧化醛基但不能氧化碳碳双键,与用溴水,则醛基和碳碳双键都发生反应,故答案为:醛基.点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握有机物官能团的性质的异同,为解答该题的关键,也是易错点,难度不大.1年前查看全部
- (2013•鹰潭模拟)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在
(2013•鹰潭模拟)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO2的主要流程如下.

(1)双氧水的结构式为:______;Ⅰ中发生反应的还原剂是______(填化学式).
(2)Ⅱ中反应的离子方程式是______.
(3)A的化学式是______,装置Ⅲ中A在______极区产生.
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备.
①写出该反应的化学方程式______
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因______.
(5)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量______(填相同、不相同或无法判断) woyoudan1年前1
woyoudan1年前1 -
 howard_kog 共回答了17个问题
howard_kog 共回答了17个问题 |采纳率100%解题思路:(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键;根据反应Ⅰ发生的反应进行解答,还原剂是指有元素化合价升高的物质;
(2)根据C1O2、双氧水、氢氧化钠、气体、NaClO2、的性质分析解答;
(3)根据(1)的解答可知A为硫酸,为阳极放出的是氧气;
(4)①亚氯酸钠和稀盐酸反应生成ClO2、NaCl和水;
②根据题干信息“研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大”结合①方程式进行分析解答;
(5)已变质和未变质的NaClO2与Fe2+反应都生成Cl-,根据转移电子守恒判断.(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为
 ,其结构式为:H-O-O-H,
,其结构式为:H-O-O-H,
由流程图可知反应Ⅰ,反应物为NaClO3、Na2SO3、加入A溶液,产生C1O2、Na2SO4溶液,反应离子方程式为2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,所以Na2SO3具有还原性是还原剂,将ClO3-还原为C1O2,
故答案为:H-O-0-H;Na2SO3;
(2)Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),所以反应方程式为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2↑,离子方程式是2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)Ⅲ为电解硫酸钠本质是电解水,阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O,所以A为硫酸,为阳极放出氧气,故答案为:H2SO4;阳;
(4)①亚氯酸钠和稀盐酸反应生成ClO2、NaCl和水,化学方程式为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,故答案为:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O;
②5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,ClO2-具有氧化性,ClO2-的氧化性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2,离子方程式为ClO2-+3Cl-+4H+=2Cl2+2H2O,根据研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,
故答案为:ClO2-+3Cl-+4H+=2Cl2+2H2O;
(5)Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同,故答案为:相同.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查生产NaClO2的制备实验的工业设计,把握物质的性质熟练运用氧化还原反应为解答该题的关键,题目难度中等.1年前查看全部
- 明胶常应用于制药和食品工业,其所含的一种蛋白质在人体内水解,可得产物之一是苯丙氨酸(C9H11O2N).下列关于苯丙氨酸
明胶常应用于制药和食品工业,其所含的一种蛋白质在人体内水解,可得产物之一是苯丙氨酸(C9H11O2N).下列关于苯丙氨酸的说法正确的是( )
A.属于氧化物
B.由C、H、O、N四种元素组成
C.由23个原子构成
D.各元素的质量比为9:11:2:1 loglover1年前1
loglover1年前1 -
 寂雷 共回答了26个问题
寂雷 共回答了26个问题 |采纳率92.3%解题思路:A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物.
B、根据苯丙氨酸化学式的含义进行分析判断.
C、根据苯丙氨酸的微观构成进行分析判断.
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.A、苯丙氨酸是由C、H、O、N四种元素组成的化合物,不属于氧化物,故选项说法错误.
B、苯丙氨酸是由C、H、O、N四种元素组成的,故选项说法正确.
C、苯丙氨酸是由苯丙氨酸分子构成的,1个苯丙氨酸分子是由23个原子构成的,故选项说法错误.
D、苯丙氨酸中碳、氢、氧、氮四种元素质量比为(12×9):(1×11):(16×2):14≠9:11:2:1,故选项说法错误.
故选:B.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业.如图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件
乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业.如图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去). 
请回答:
(1)运用逆合成分析法推断,C的结构简式为______.
(2) 的化学方程式为______.
的化学方程式为______.
(3)与 互为同分异构体的芳香族化合物有______种,其中一种同分异构体的核磁共振氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为______.
互为同分异构体的芳香族化合物有______种,其中一种同分异构体的核磁共振氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为______. 6816281年前1
6816281年前1 -
 lanniapeng 共回答了14个问题
lanniapeng 共回答了14个问题 |采纳率85.7%1年前查看全部
- 苏打(NaHCO3)是食品工业中一种应用最广泛的疏松剂.资料显示,NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H
苏打(NaHCO3)是食品工业中一种应用最广泛的疏松剂.资料显示,NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.
某化学兴趣小组同学为了对在潮湿空气中久置的NaHCO3样品进行分析,称取一份31.4 g混合均匀的样品,用酒精灯对其充分加热,冷却后称得其质量为21.2 g;另称取一份相同质量的样品,逐滴加入稀硫酸至没有气泡产生为止,共收集到气体折算成标准状况下的体积为7.28 L.通过计算回答下列问题:
(3)样品中Na2CO3的质量分数是多少? superrenzhe1年前1
superrenzhe1年前1 -
 lujingchao 共回答了17个问题
lujingchao 共回答了17个问题 |采纳率100%假设其中有xgNaHCO3,ygNa2CO3,zgH2O;
则x+y+z=31.4;
2NaHCO3---Na2CO3 △m
2×84 168-106
x 31.4-21.2;
求出x;
NaHCO3--CO2;
168 44
x m1;
Na2CO3---CO2;
106 44
y m2;
m1+m2=7.28/22.4×44;
m1,m2可以用x,y表示;
x已知,可以求出y;
求出y;
那么质量分数=y/31.4×100%
有问题请追问~~1年前查看全部
- 英语翻译摘要:食品添加剂是食品工业的重要组成部分,对食品的生产和质量改善起至关重要的作用.随着食品工业的发展以及人们生活
英语翻译
摘要:食品添加剂是食品工业的重要组成部分,对食品的生产和质量改善起至关重要的作用.随着食品工业的发展以及人们生活水平的提高,食品添加剂的研究和安全评价越来越受到关注.本文较系统的介绍了食品添加剂的作用分类以及食品添加剂的安全性问题,综述了加强食品添加剂的监督管理的必要性和食品添加剂的发展趋势. 招财猫43111年前1
招财猫43111年前1 -
 shumin_1982 共回答了20个问题
shumin_1982 共回答了20个问题 |采纳率95%Abstract
Food additive as an important integral part of food industry plays a critical role in the improvement of food production and quality.With the development of food industry and the improvement of people's living standard,the research and safety of food additive have attracted more and more attention.This paper introduces the classification of the function of food additive and its safety issues systematically and summarizes the necessity to strengthen the supervision and administration of food additive and its development trend.
供参考1年前查看全部
- Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH2O.
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω.(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量.
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g.计算10℃时Na2SO3在水中的溶解度. dingzhihu1年前1
dingzhihu1年前1 -
 piao84 共回答了21个问题
piao84 共回答了21个问题 |采纳率81%解题思路:1)根据溶质的质量分数=[溶质的质量/溶液的质量]和Na2SO3在30℃时的溶解度来计算饱和溶液中Na2SO3的质量分数ω;
2)根据Na2SO3在30℃时的溶解度来计算271g Na2SO3饱和溶液中水的质量;
3)根据Na2SO3•7H2O晶体和原溶液中溶质的质量求出10℃是饱和溶液中溶质的质量和溶剂的质量,再求出10℃时Na2SO3在水中的溶解度,即100g水中溶解 Na2SO3的质量.1)根据Na2SO3的溶解度,其饱和溶液中溶质为35.5g,溶剂为100g,溶液总质量=100+35.5=135.5g,
则ω(Na2SO3)=[35.5g/135.5g]≈0.26;
2)271g饱和溶液中,假设其含有的溶剂为x,
Na2SO3在30℃时的溶解度为35.5g/100gH2O,
则[100g/135.5g=
x
271g],
解之得:x=200(g);
3)冷却溶液后,析出晶体79.5g,根据其晶体Na2SO3•7H2O的组成,其中含有水和亚硫酸钠为:
m(Na2SO3)=79.5g×[126/126+126]=39.75g
m(H2O)=79.5g-39.75g=39.75g
10℃时Na2SO3的质量为271-200-39.75=31.25g
10℃时H2O的质量为200-39.75=160.25g
假设10℃时Na2SO3的溶解度为y
[100g/y=
160.25g
31.25g],
解得y=19.5g;
答:1)30℃时Na2SO3饱和溶液中Na2SO3的质量分数为0.26;
2)30℃时271g Na2SO3饱和溶液中水的质量为200g;
3)10℃时Na2SO3在水中的溶解度为19.5g.点评:
本题考点: 溶液中溶质的质量分数及相关计算;溶解度、饱和溶液的概念.
考点点评: 此题考查了溶液的质量分数、溶剂的质量、溶解度等化学计算知识,要理解溶解度的概念.1年前查看全部
- 利用铁生锈的原理在食品工业上还有应用.“纳米α-Fe粉”,可以用于食品保鲜,称之为“双吸剂
利用铁生锈的原理在食品工业上还有应用.“纳米α-Fe粉”,可以用于食品保鲜,称之为“双吸剂
”,它能够吸收空气中的水分和氧气.若用化学方法检验使用一段时间后的“双吸剂”是否完全失效,写出鉴别过程_________ 能填加稀硫酸后如溶液变蓝,未失效,不变蓝, ya_1021年前1
ya_1021年前1 -
 kkk513 共回答了24个问题
kkk513 共回答了24个问题 |采纳率70.8%答:Fe + 2HCl ===== FeCl2 + H2↑ 取少量该“双吸剂”于试管中,滴加稀盐酸(稀硫酸),若有气泡产生,则“双吸剂”还有效;否则无效.
变蓝你说的是硫酸铜吧.1年前查看全部
- 近年来,乳酸成为人们研究的热点之一,乳酸在医疗、食品工业中应用前景广阔.已知乳酸的化学式C3H6O3,试计算:
近年来,乳酸成为人们研究的热点之一,乳酸在医疗、食品工业中应用前景广阔.已知乳酸的化学式C3H6O3,试计算:
(1)乳酸(C3H6O3)分子中碳、氢、氧原子个数比______;
(2)乳酸(C3H6O3)中碳、氢、氧三种元素的质量比______;
(3)从分子角度,C3H6O3表示的意义为______(任写一条). zaozishu1年前1
zaozishu1年前1 -
 413ddd 共回答了23个问题
413ddd 共回答了23个问题 |采纳率95.7%解题思路:(1)根据乳酸(C3H6O3)分子的构成进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化学式的意义进行微观意义:a.表示该物质的一个分子; b.表示该物质的分子构成; C.表示物质的一个分子中各原子个数比.(1)1个乳酸(C3H6O3)分子是由3个碳原子、6个氢原子和3个氧原子构成的,则乳酸(C3H6O3)分子中碳、氢、氧原子个数比3:6:3=1:2:1.
(2)乳酸(C3H6O3)中碳、氢、氧三种元素的质量比(12×3):(1×6):(16×3)=6:1:8.
(3)从分子角度,C3H6O3表示1个乳酸分子;乳酸分子有碳、氢、氧三种原子构成等.
故答案为:(1)1:2:1;(2)6:1:8;(3)乳酸分子有碳、氢、氧三种原子构成等.点评:
本题考点: 化学式的书写及意义;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2009•龙岩一模)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂
(2009•龙岩一模)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保鲜剂等.化学兴趣小组在实验室对Y中硫元素的价态进行探究:
①将过量的稀硝酸加入少许样品中,振荡;
②取少许反应后的溶液,滴加硝酸钡溶液,出现白色沉淀.
甲认为不能由此确定Y中硫的价态为+6.
(1)上述实验中产生的沉淀是______.
(2)你认为甲的判断是否正确?答:______(“正确”或“不正确”).作出这种判断的依据是______.
(3)乙对Y中硫的价态作出三种猜想:
①硫的价态是+6;
②硫的价态是+4;
③硫的价态是+4和+6价.
请设计实验检验乙的猜想③是否正确,并按要求填写下表.
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管和试管架;1mol•L-1H2SO4、2mol•L-1HCl、2mol•L-1HNO3、3%H2O2、0.5mol•L-1BaCl2、品红试纸、蒸馏水.
实验操作 预期现象及实验结论 ______ ______  弓弦断1年前1
弓弦断1年前1 -
 五岳独尊 共回答了9个问题
五岳独尊 共回答了9个问题 |采纳率100%解题思路:(1)滴加硝酸钡溶液,出现白色沉淀,沉淀不溶于酸,应为硫酸钡;
(2)原溶液中可能存在亚硫酸根离子,生成的亚硫酸钡能被硝酸氧化生成硫酸钡沉淀;
(3)加盐酸或稀硫酸产生气体能使品红褪色,可说明含亚硫酸根离子,然后加氯化钡生成白色沉淀,说明含硫酸根离子,反之,不存在,以此来解答.(1)由实验②中的操作和现象可知,滴加硝酸钡溶液,出现白色沉淀,沉淀不溶于酸,应为硫酸钡,故答案为:硫酸钡(或BaSO4);
(2)原溶液中可能存在亚硫酸根离子,生成的亚硫酸钡能被硝酸氧化生成硫酸钡沉淀,即原溶液中可能存在亚硫酸根离子,可能存在硫酸根离子,或二者都有,
所以甲的判断正确,故答案为:正确;硝酸有强氧化性,无论样品中硫是+4还是+6价,加入硝酸后最终都有硫酸钡生成;
(3)由给出的试剂可知,加盐酸或稀硫酸产生气体能使品红褪色,可说明含亚硫酸根离子,然后加氯化钡生成白色沉淀,说明含硫酸根离子,反之,不存在,
则设计实验操作为①取少许样品于试管中,加入足量的2mol•L-1HCl溶液,并将湿润的品红试纸至于试管口;②往上述反应后溶液中再滴加0.5 mol•L-1BaCl2溶液,
现象与结论为品红试纸褪色(或不褪色),样品中含有(不含)+4价硫元素;有(无)白色沉淀生成,样品中含有(不含)+6价硫元素,
故答案为:
实验操作 预期现象及结论
①取少许样品于试管中,加入足量的2mol•L-1HCl溶液,并将湿润的品红试纸至于试管口
②往上述反应后溶液中再滴加0.5 mol•L-1BaCl2溶液 品红试纸褪色(或不褪色),样品中含有(不含)+4价硫元素;
有(无)白色沉淀生成,样品中含有(不含)+6价硫元素;.点评:
本题考点: 探究物质的组成或测量物质的含量;含硫物质的性质及综合应用.
考点点评: 本题以探究形式考查物质的组成,注意由硫的含氧酸盐可能为亚硫酸盐或硫酸盐,把握硝酸的氧化性能氧化亚硫酸根离子即可解答,侧重物质性质的考查,题目难度不大.1年前查看全部
- 下列说法不正确的是( )A.铵态氮肥一定不能与碱同时施用B.食品工业中,发酵粉的主要成份是小苏打--Na2CO3C.撒
下列说法不正确的是( )
A.铵态氮肥一定不能与碱同时施用
B.食品工业中,发酵粉的主要成份是小苏打--Na2CO3
C.撒食盐能融化公路上积雪--食盐水的凝固点低于0℃
D.庄稼生长不茂盛,叶色淡绿,还出现倒伏,可建议施复合肥料--KNO3 纯棉的我1年前1
纯棉的我1年前1 -
 cnxjlxh 共回答了18个问题
cnxjlxh 共回答了18个问题 |采纳率83.3%解题思路:A、铵态氮肥与碱性物质混合后能放出氨气,降低肥效.
B、发酵粉的主要成分是小苏打,小苏打是碳酸氢钠的俗称.
C、食盐溶于水后使溶液的凝固点降低,从而加快雪的溶解.
D、氮肥能使农作物枝叶繁茂、叶色浓绿,钾肥能使农作物抗倒伏、抗病虫害.A、铵态氮肥与碱性物质混合后能放出氨气,降低肥效,铵态氮肥一定不能与碱同时施用,故选项说法正确.
B、食品工业中,发酵粉的主要成份是小苏打,小苏打是碳酸氢钠的俗称,其化学式为NaHCO3,故选项说法错误.
C、食盐溶于水后使溶液的凝固点降低,食盐水的凝固点低于0℃,从而加快雪的溶解,故选项说法正确.
D、庄稼生长不茂盛,叶色淡绿,还出现倒伏,说明土壤中缺乏氮元素、钾元素,可施用含钾元素和氮元素的复合肥,如KNO3,故选项说法正确.
故选:B.点评:
本题考点: 铵态氮肥的检验;常用盐的用途;常见化肥的种类和作用.
考点点评: 本题难度不大,掌握铵态氮肥的性质(与碱性物质混合后能放出氨气)、常见盐、常见化肥的分类和作用是正确解答本题的关键.1年前查看全部
- 塑料的发明堪称为20世纪人类的一大杰作。它广泛应用于航空、航天、通讯工程、计算机、军事以及农业、轻工业、食品工业等各行各
塑料的发明堪称为20世纪人类的一大杰作。它广泛应用于航空、航天、通讯工程、计算机、军事以及农业、轻工业、食品工业等各行各业之中,大大拓展了人们生活的领域和空间,也大大方便了人们的生活。科学家指出,在21世纪,随着纳米塑料、光纤、能导电的塑料、有磁性的塑料、会记忆的  塑料等各种更新颖的塑料的出现,人类的生活将更加丰富多彩。这表明[ ]
塑料等各种更新颖的塑料的出现,人类的生活将更加丰富多彩。这表明[ ]A、生产决定消费的质量和水平
B、生产和消费相互决定
C、消费决定生产的规模和效益
D、消费推动人类历史的进步 赵深雅1年前1
赵深雅1年前1 -
 partuo 共回答了17个问题
partuo 共回答了17个问题 |采纳率88.2%A1年前查看全部
- 明胶常应用于制药和食品工业,其所含的一种蛋白质在人体内水解,可得产物之一是苯丙氨酸(C 9 H 11 O 2 N)。下列
明胶常应用于制药和食品工业,其所含的一种蛋白质在人体内水解,可得产物之一是苯丙氨酸(C 9 H 11 O 2 N)。下列关于苯丙氨酸的说法正确的是
A.属于氧化物
B.由C、H、O、N四种元素组成
C.由23个原子构成
D.各元素的质量比为9∶11∶2∶1 蒋ff华1年前1
蒋ff华1年前1 -
 maomibei 共回答了27个问题
maomibei 共回答了27个问题 |采纳率92.6%B
1年前查看全部
- 已知:下图中,D常用于化妆品工业和食品工业,E是生产农药的一种中间体.它们合成路线如图所示:填写下列空白:(1)A为苯的
已知:

下图中,D常用于化妆品工业和食品工业,E是生产农药的一种中间体.它们合成路线如图所示:
填写下列空白:
(1)A为苯的同系物,其结构简式为______.
(2)物质B所含官能团有______,反应④的反应类型为______.
(3)反应③的化学方程式为______.
(4)下列关于E的说法正确的是______
A、属于卤代烃B、属于芳香族化合物C、能发生取代反应 D、能与氢氧化钠溶液反应E、所有原子可能在同一平面上,
在水溶液中很不稳定,易发生水解反应,其反应的化学方程式为______.
(5)简述检验某同分异构体中含有醛基的方法(操作、现象和结论):______. 优优2231年前1
优优2231年前1 -
 32940260 共回答了21个问题
32940260 共回答了21个问题 |采纳率76.2%由D的结构结合反应③可知,C为 ,A与氯气光照生成B,B在氢氧化钠水溶液、加热条件下水解生成C,故A为
,A与氯气光照生成B,B在氢氧化钠水溶液、加热条件下水解生成C,故A为 ,B为
,B为 ,
, 与
与 反应生成E,结合反应信息可知,E为
反应生成E,结合反应信息可知,E为 ,
,
(1)A为苯的同系物,其结构简式为 ,故答案为:
,故答案为: ;
;
(2)B为 ,含有官能团为:氯原子,反应④是
,含有官能团为:氯原子,反应④是 与
与 反应取代反应生成
反应取代反应生成 ,
,
故答案为:氯原子;取代反应;
(3)反应③是乙酸与苯甲醇发生酯化反应生成乙酸苯甲酯,反应方程式为
故答案为: ;
;
(4) 含有氧原子,不属于卤代烃,含有苯环,属于芳香族化合物,含有酯基、氯原子,能发生取代反应、能与氢氧化钠溶液反应,分子中含有-CH2-,具有甲烷的四面体结构,所有原子不可能在同一平面上,故BCD正确、AE错误;
含有氧原子,不属于卤代烃,含有苯环,属于芳香族化合物,含有酯基、氯原子,能发生取代反应、能与氢氧化钠溶液反应,分子中含有-CH2-,具有甲烷的四面体结构,所有原子不可能在同一平面上,故BCD正确、AE错误; 在水溶液中很不稳定,易发生水解反应,由反应信息可知,水解生成苯甲醇、二氧化碳、HCl,反应方程式为:
在水溶液中很不稳定,易发生水解反应,由反应信息可知,水解生成苯甲醇、二氧化碳、HCl,反应方程式为: +H2O→
+H2O→ +CO2↑+HCl,
+CO2↑+HCl,
故答案为:BCD; +H2O→
+H2O→ +CO2↑+HCl;
+CO2↑+HCl;
(5)取少量该有机物放入洁净的试管中,加入银氨溶液,水浴加热,若观察到试管内壁附着一层光亮的银镜,证明该有机物分子中含有醛基,
故答案为:取少量该有机物放入洁净的试管中,加入银氨溶液,水浴加热,若观察到试管内壁附着一层光亮的银镜,证明该有机物分子中含有醛基.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后
亚氯酸钠(NaClO 2 )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO 2 的主要流程如下。
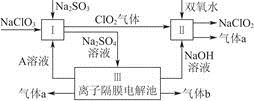
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO 2 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:__________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl 2 。用离子方程式解释产生Cl 2 的原因:__________________________________________。
(5)NaClO 2 变质可分解为NaClO 3 和NaCl。取等质量NaClO 2 ,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO 4 溶液反应时,消耗Fe 2 + 的物质的量________(填“相同”“不相同”或“无法判断”)。 caocao2526271年前1
caocao2526271年前1 -
 罗氏天才 共回答了23个问题
罗氏天才 共回答了23个问题 |采纳率95.7%(1)H—O—O—H Na 2 SO 3
(2)2ClO 2 +H 2 O 2 +2OH - =2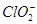 +O 2 ↑+2H 2 O
+O 2 ↑+2H 2 O
(3)H 2 SO 4 阳
(4)5NaClO 2 +4HCl=5NaCl+4ClO 2 ↑+2H 2 O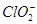 +3Cl - +4H + =2Cl 2 ↑+2H 2 O
+3Cl - +4H + =2Cl 2 ↑+2H 2 O
(5)相同
(1)NaClO 3 中Cl原子化合价为+5价,具有很强的氧化性,而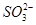 在酸性条件下具有较强的还原性,故Ⅰ中发生反应的氧化剂是NaClO 3 ,还原剂是Na 2 SO 3 ;(2)电解Na 2 SO 4 溶液相当于电解水,由气体a、b是Na 2 SO 4 溶液的电解产物可知为H 2 和O 2 ,由气体a为反应Ⅱ的产物之一可知其为O 2 ,为H 2 O 2 被ClO 2 氧化得到的产物,故反应Ⅱ的反应物为ClO 2 、H 2 O 2 和NaOH,生成物有NaClO 2 和O 2 ,根据电子守恒和原子守恒配平即可;(3)电解Na 2 SO 4 溶液时OH - 在阴极生成,故Na + 通过离子隔膜向阴极移动得到产物NaOH溶液,而阳极生成H + ,
在酸性条件下具有较强的还原性,故Ⅰ中发生反应的氧化剂是NaClO 3 ,还原剂是Na 2 SO 3 ;(2)电解Na 2 SO 4 溶液相当于电解水,由气体a、b是Na 2 SO 4 溶液的电解产物可知为H 2 和O 2 ,由气体a为反应Ⅱ的产物之一可知其为O 2 ,为H 2 O 2 被ClO 2 氧化得到的产物,故反应Ⅱ的反应物为ClO 2 、H 2 O 2 和NaOH,生成物有NaClO 2 和O 2 ,根据电子守恒和原子守恒配平即可;(3)电解Na 2 SO 4 溶液时OH - 在阴极生成,故Na + 通过离子隔膜向阴极移动得到产物NaOH溶液,而阳极生成H + ,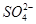 向阳极移动得到产物A(即H 2 SO 4 溶液);(4)①由题意可知反应物为NaClO 2 和HCl,其中NaClO 2 中Cl元素的化合价为+3价,既可升高也可降低,故反应为NaClO 2 自身的氧化还原反应,根据电子守恒可知氧化产物ClO 2 和还原产物Cl - 的物质的量之比为4∶1,根据原子守恒将方程式配平即可;②若产物为Cl 2 则
向阳极移动得到产物A(即H 2 SO 4 溶液);(4)①由题意可知反应物为NaClO 2 和HCl,其中NaClO 2 中Cl元素的化合价为+3价,既可升高也可降低,故反应为NaClO 2 自身的氧化还原反应,根据电子守恒可知氧化产物ClO 2 和还原产物Cl - 的物质的量之比为4∶1,根据原子守恒将方程式配平即可;②若产物为Cl 2 则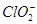 和HCl发生了归中反应,根据电子守恒可知反应的
和HCl发生了归中反应,根据电子守恒可知反应的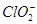 和HCl的物质的量之比为3∶1,根据原子守恒将方程式配平即可;(5)变质过程为NaClO 2 自身的氧化还原反应,无论变质与否,与Fe 2 + 反应时氯元素最终都转化为Cl - ,故转移电子数相等。
1年前查看全部
和HCl的物质的量之比为3∶1,根据原子守恒将方程式配平即可;(5)变质过程为NaClO 2 自身的氧化还原反应,无论变质与否,与Fe 2 + 反应时氯元素最终都转化为Cl - ,故转移电子数相等。
1年前查看全部
- 俄罗斯下列经济部门中,在世界上占重要地位的有 A.宇航工业 B.农业 C.食品工业 D.纺织工业
 dzddz1年前1
dzddz1年前1 -
 www151519190 共回答了18个问题
www151519190 共回答了18个问题 |采纳率100%A
本题考查俄罗斯主要工业区和工业部分及其分布。俄罗斯工业发达,许多产品产量居世界前列。它的核工业和航空航天工业在世界占有重要地位。所以本题选择A选项。1年前查看全部
- (2012•陕西)不含有害物质的明胶,可以在制药与食品工业中使用.明胶里含有多种蛋白质,其中某蛋白质在人体内水解产物之一
(2012•陕西)不含有害物质的明胶,可以在制药与食品工业中使用.明胶里含有多种蛋白质,其中某蛋白质在人体内水解产物之一为苯丙氨酸(化学式为C9H11O2N).下列对相关物质的说法正确( )
A.苯丙氨酸由23个原子构成
B.苯丙氨酸分子由碳、氢、氧、氮四种元素组成
C.苯丙氨酸为有机物,明胶为混合物
D.苯丙氨酸中氢元素的质量分数最大 wjz08761年前1
wjz08761年前1 -
 gty001 共回答了14个问题
gty001 共回答了14个问题 |采纳率92.9%解题思路:A、根据苯丙氨酸是由分子构成的进行解答;
B、根据分子是由原子构成的,物质是由元素组成的进行解答;
C、根据有机物和混合物的定义进行解答;
D、根据元素质量比最大的质量分数最大进行解答;A、苯丙氨酸是由苯丙氨酸分子构成的,苯丙氨酸分子是由原子构成的,故A错误;
B、苯丙氨酸分子由碳原子、氢原子、氧原子、氮原子构成的,故B错误;
C、含有碳元素的化合物为有机物,故苯丙氨酸为有机物正确,明胶里含有多种蛋白质,故明胶为混合物正确,故C正确;
D、由苯丙氨酸的化学式C9H11O2N可知,碳、氢、氧、氮四种元素的质量比为:12×9:1×11:16×2:14=108:11:32:14,故碳元素的质量分数最大,故D错误;
故选C点评:
本题考点: 化学式的书写及意义;纯净物和混合物的判别;有机物与无机物的区别;元素的质量分数计算.
考点点评: 本题难度不大,考查了化学式的含义、有关化学式的简单计算等知识,灵活运用所学知识解答实际问题是解题的关键.1年前查看全部
- (2009•浙江模拟)乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业.乙酸苯甲酯可以用下面的设计
(2009•浙江模拟)乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业.乙酸苯甲酯可以用下面的设计方案合成.

(1)写出A,C的结构简式;A:______,C:______.
(2)D有很多同分异构体,含有酯基和一取代苯结构的同分异构体有五个.其中三个结构简式是:
请写出另外两个同分异构体结构简式:①______ ②______. hltl1年前1
hltl1年前1 -
 dzrior 共回答了17个问题
dzrior 共回答了17个问题 |采纳率88.2%解题思路:A发生取代反应生成B,B发生水解反应生成C,C与乙酸发生酯化反应生成D,由D可知C为 ,则B应为
,则B应为 ,A应为
,A应为 ,D有很多同分异构体,含有酯基和一取代苯结构的同分异构体可为乙酸、甲酸、苯甲酸、苯乙酸和丙酸对应形成的酯,共5种.
,D有很多同分异构体,含有酯基和一取代苯结构的同分异构体可为乙酸、甲酸、苯甲酸、苯乙酸和丙酸对应形成的酯,共5种.
解;(1)A发生取代反应生成B,B发生水解反应生成C,C与乙酸发生酯化反应生成D,由D可知C为
 ,则B应为
,则B应为 ,A应为
,A应为 ,
,
故答案为: ;
; ;
;
(2)D有很多同分异构体,含有酯基和一取代苯结构的同分异构体可为乙酸、甲酸、苯甲酸、苯乙酸和丙酸对应形成的酯,共5种,分别为: 、
、 和
和 ,
,
故答案为: ;
; .
.点评:
本题考点: 有机物的合成;结构简式.
考点点评: 本题考查有机物的合成与推断,题目难度不大,注意根据物质的性质从逆向推断,易错点为同分异构体的判断,注意根据对应酸和醇的种类解答.1年前查看全部
- 近年来,乳酸成为人们研究的热点之一,乳酸在医疗、食品工业中应用前景广阔.已知乳酸的化学式C3H6O3,试计算:
近年来,乳酸成为人们研究的热点之一,乳酸在医疗、食品工业中应用前景广阔.已知乳酸的化学式C3H6O3,试计算:
(1)该物质由______种元素组成;
(2)该物质的相对分子质量是______;
(3)该物质分子中碳、氢、氧原子个数比为______;
(4)该物质中碳、氢、氧元素的质量比为______. 我的18岁1年前1
我的18岁1年前1 -
 wendell_1978 共回答了15个问题
wendell_1978 共回答了15个问题 |采纳率93.3%解题思路:(1)根据物质的组成来分析;
(2)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答;
(3)根据乳酸(C3H6O3)分子的构成进行分析解答;
(4)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(1)由乳酸的化学式可知,乳酸是由碳、氢、氧三种元素组成的;(2)乳酸的相对分子质量为12×3+1×6+16×3=90;(3)1个乳酸(C3H6O3)分子是由3个碳原子、6个氢原子和3个氧原子构成的,则乳酸(C3H6O3)分子中碳、...
点评:
本题考点: 化学式的书写及意义;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- (16分)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保
(16分)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保鲜剂等。化学兴趣小组在实验室对Y中硫元素的价态进行探究:①将过量的稀硝酸加入少量样品中,振荡;②取少许反应后的溶液,滴加硝酸钡溶液,出现白色沉淀。甲认为不能由此确定Y中硫的价态为+6价。
(1)上述实验中产生的沉淀是 。
(2)你认为甲的判断是否正确 (填“是”或“否”),作出这种判断的依据是 。
(3)请完成对硫元素价态的探究:
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管和试管架;1mol·L -1 H 2 SO 4 、2mol·L -1 HCl、2mol·L -1 HNO 3 、3%H 2 O 2 、0.5mol·L -1 BaCl 2 、品红试纸、蒸馏水。
①提出合理假设
假设1,硫的价态是+4价
假设2,硫的价态是+6价
假设3,
②设计实验方案证明你的假设
③实验过程
根据②的实验方案,进行实验。请写出实验步骤、预期现象与结论。实验操作 预期的现象与结论 操作1 操作2  和弦一生1年前0
和弦一生1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•上海)Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35
(2010•上海)Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH2O.
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω.(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量.
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g.计算10℃时Na2SO3在水中的溶解度. lars761年前1
lars761年前1 -
 飞翔的山谷 共回答了18个问题
飞翔的山谷 共回答了18个问题 |采纳率83.3%解题思路:1)根据溶质的质量分数=[溶质的质量/溶液的质量]和Na2SO3在30℃时的溶解度来计算饱和溶液中Na2SO3的质量分数ω;
2)根据Na2SO3在30℃时的溶解度来计算271g Na2SO3饱和溶液中水的质量;
3)根据Na2SO3•7H2O晶体和原溶液中溶质的质量求出10℃是饱和溶液中溶质的质量和溶剂的质量,再求出10℃时Na2SO3在水中的溶解度,即100g水中溶解 Na2SO3的质量.1)根据Na2SO3的溶解度,其饱和溶液中溶质为35.5g,溶剂为100g,溶液总质量=100+35.5=135.5g,
则ω(Na2SO3)=[35.5g/135.5g]≈0.26;
2)271g饱和溶液中,假设其含有的溶剂为x,
Na2SO3在30℃时的溶解度为35.5g/100gH2O,
则[100g/135.5g=
x
271g],
解之得:x=200(g);
3)冷却溶液后,析出晶体79.5g,根据其晶体Na2SO3•7H2O的组成,其中含有水和亚硫酸钠为:
m(Na2SO3)=79.5g×[126/126+126]=39.75g
m(H2O)=79.5g-39.75g=39.75g
10℃时Na2SO3的质量为271-200-39.75=31.25g
10℃时H2O的质量为200-39.75=160.25g
假设10℃时Na2SO3的溶解度为y
[100g/y=
160.25g
31.25g],
解得y=19.5g;
答:1)30℃时Na2SO3饱和溶液中Na2SO3的质量分数为0.26;
2)30℃时271g Na2SO3饱和溶液中水的质量为200g;
3)10℃时Na2SO3在水中的溶解度为19.5g.点评:
本题考点: 溶液中溶质的质量分数及相关计算;溶解度、饱和溶液的概念.
考点点评: 此题考查了溶液的质量分数、溶剂的质量、溶解度等化学计算知识,要理解溶解度的概念.1年前查看全部
- (18分)A为常见烃是一种水果催熟剂,乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业。下图是乙酸苯甲酯的一
(18分)A为常见烃是一种水果催熟剂,乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业。下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。

请回答:
(1)E的官能团名称为 F的结构简式为
(2)反应①条件为 ,反应④的类型是
(3)反应②的化学方程式为 ;反应类型是
(4)物质D与新制氢氧化铜反应方程式为
(5)G有多种同分异构体,其中属于芳香族化合物的有 种(不包括G)
写出其中的任意一种同分异构体的结构简式 herohqs1年前1
herohqs1年前1 -
 qq魅影010 共回答了20个问题
qq魅影010 共回答了20个问题 |采纳率95%1年前查看全部
- 读某城市规划平面示意图回答下列问题 (1)该城市打算布局微电子工业、纺织工业、食品工业和化学工业,在①——④地中适合布局
读某城市规划平面示意图回答下列问题 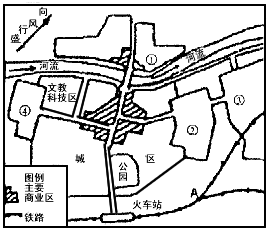
(1)该城市打算布局微电子工业、纺织工业、食品工业和化学工业,在①——④地中适合布局微电子
工业的是 (填序号),其理由是 ;适合布局化学工
业的是 (填序号),其理由是 。(2)为解决市民的副食品供应问题,有关部门打算在A处建一奶牛场,此举可行吗,为什么?
。 8g4q11年前1
8g4q11年前1 -
 foldeghen 共回答了19个问题
foldeghen 共回答了19个问题 |采纳率78.9%(1)④ 接近文教科技区 ③ 流经城市河流的下游,盛行风向的下风
(2)不可行 靠近铁路,噪音大,影响奶牛的产奶量1年前查看全部
- 下图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质,A、B、C、D、E为化合物,A在食品工业上是发酵粉的一种主要
下图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质,A、B、C、D、E为化合物,A在食品工业上是发酵粉的一种主要原料,D是使地球产生温室效应的一种气体,丙是生产生活中占据主导地位的金属。(图中部分生成物已略去) 
请回答:
(1)B中阴离子的 化学符号是___________。
(2)写出A受热分解的化学方程式___________。
(3)在C生成甲和乙的化学反应中,所得甲乙两种气体的体积比是______________。
(4)写出E与CO反应生成D和丙的化学方程式__________。 lc80821年前1
lc80821年前1 -
 linq29 共回答了18个问题
linq29 共回答了18个问题 |采纳率88.9%1年前查看全部
- 乳酸在医疗、食品工业中应用前景广阔,乳酸近年来已成为人们研究的热点之一.已知乳酸的化学式C3H6O3,试计算:
乳酸在医疗、食品工业中应用前景广阔,乳酸近年来已成为人们研究的热点之一.已知乳酸的化学式C3H6O3,试计算:
(1)乳酸(C3H6O3)的相对分子质量;
(2)乳酸(C3H6O3)中碳、氢、氧三种元素的质量比;
(3)25g C3H6O3中含碳元素的质量. wfxwfx1231年前1
wfxwfx1231年前1 -
 yqysp 共回答了23个问题
yqysp 共回答了23个问题 |采纳率100%解题思路:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)乳酸的相对分子质量为12×3+1×6+16×3=90.
(2)乳酸(C3H6O3)中碳、氢、氧三种元素的质量比为(12×3):(1×6):(16×3)=6:1:8.
(3)25gC3H6O3中含碳元素的质量为25g×
12×3
90×100%=10g.
答:(1)乳酸的相对分子质量为90;(2)乳酸(C3H6O3)中碳、氢、氧三种元素的质量比为6:1:8;(3)25gC3H6O3中含碳元素的质量为10g.点评:
本题考点: 相对分子质量的概念及其计算;元素质量比的计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2009•滨湖区一模)蛋白质是一种含氮的有机高分子化合物.现代食品工业普遍采用一种叫做“凯氏定氮法”的方法来测定蛋白质
(2009•滨湖区一模)蛋白质是一种含氮的有机高分子化合物.现代食品工业普遍采用一种叫做“凯氏定氮法”的方法来测定蛋白质的含量.测定原理为:把蛋白质样品用强酸处理,使其中的氮元素释放出来,通过测定氮元素的质量从而换算出蛋白质的含量.
(1)准确称量1.0g某品牌奶粉置于凯氏定氮器中,在一定条件下完全反应,使奶粉蛋白质中的氮元素全部转化为(nh4)2so4.
(2)将(nh4)2so4与naoh反应.写出发生反应的化学方程式:______.
再将生成的nh3用硼酸(h3bo3)溶液完全吸收,发生的化学反应如下:2nh3+4h3bo3=(nh4)2b4o7+5h2o,(nh4)2b4o7属于______类物质(填酸、碱、盐或氧化物).
(3)用溶质质量分数为0.365%的盐酸与(nh4)2b4o7完全反应,消耗盐酸的质量为20.0g,反应的化学方程式如下:
(nh4)2b4o7+2hcl+5h2o=2nh4cl+4h3bo3 ;则根据上述反应可计算出1.0g奶粉样品中氮元素的质量为______.若蛋白质中氮元素的平均含量为16.0%,此奶粉中蛋白质的质量分数为______.
凯氏定氮法测定奶粉中蛋白质含量灵敏度高,操作简单.但在2008年“***奶粉事件”中,却暴露出了这种方法的缺点.你认为其缺点是______. 慕容棠1年前1
慕容棠1年前1 -
 浩然轩蓝 共回答了18个问题
浩然轩蓝 共回答了18个问题 |采纳率100%解题思路:(2)根据(NH4)2SO4与NaOH的反应原理:(NH4)2SO4与NaOH发生复分解反应;根据盐的概念判断:金属离子和酸根离子构成的化合物;
(3)结合题意再根据此方程式(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3可以计算出(NH4)2B4O7的质量,根据N元素守恒,
即(NH4)2B4O7中的氮元素来自1.0g奶粉,所以只要计算出(NH4)2B4O7中的氮元素质量即可计算出该奶粉中N元素的含量;
根据N元素守恒,设此奶粉中蛋白质的质量分数为x,则可以得到关系式0.028=1×16%x,从而计算出此奶粉中蛋白质的质量分数;因为“凯氏定氮法”的原理是用其它方法让蛋白质样品中的N元素释放出来,然后通过测定氮元素的质量从而换算出蛋白质的含量.此方法的局限性很明显,它把样品中释放出来的N元素全部归为蛋白质中的N元素,而样品中释放出来的N元素也可能不是从蛋白质中来的.答:(2)(NH4)2SO4可以与NaOH反应,化学方程式为:(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+H2O,
盐:电离时生成金属阳离子(或NH4)和酸根离子的化合物,叫盐.所以(NH4)2B4O7属于盐.
故答案为::(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+H2O,盐
(3)设消耗20g盐酸需要(NH4)2B4O7中的N元素x,则
(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3
28 73
x 20×0.365%
[28/73]=[x/20×0.365%]
解得x=0.028g
根据题意可知,该奶粉中的N元素都转化为了(NH4)2B4O7中的N元素,即1.0g奶粉中含N元素的质量为0.028g
又因为蛋白质中氮元素的平均含量为16.0%,所以含0.028gN元素的蛋白质的质量=[0.028/0.16]=0.175g,
所以此奶粉中蛋白质的含量=
0.175
1×100%=17.5%
因为此方法是让蛋白质中的N原素释放出来,通过测定氮元素的质量从而换算出蛋白质的含量.可见该方法有局限性,若奶粉中含有其他含氮化合物,则无法准确测出蛋白质含量.
故答案为:0.028g 17.5% 缺点:若奶粉中含有其他含氮化合物,则无法准确测出蛋白质含量.点评:
本题考点: 实验数据处理或者误差分析的探究;常见的氧化物、酸、碱和盐的判别;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 在有关化学方程式的计算中,利用元素守恒法可以省去很多中间步骤,从而简化计算过程.1年前查看全部
- 柠檬酸是一种可溶于水的无色晶体,在食品工业中常用作酸味剂,其酸性比碳酸强.
柠檬酸是一种可溶于水的无色晶体,在食品工业中常用作酸味剂,其酸性比碳酸强.
下列有关推测不合理的是
A它能电离出大量oh-
B柠檬酸溶液的ph小于7
C柠檬酸溶液能使紫色石蕊试液变红色
D柠檬酸溶液不能使无色酚酞试液变色 xjklspi1年前1
xjklspi1年前1 -
 没有读书的人 共回答了19个问题
没有读书的人 共回答了19个问题 |采纳率78.9%A
一个柠檬酸有3个H+可以电离,而不是能电离出大量oh-1年前查看全部
- (2014•烟台三模)果胶酶是食品工业中的重要酶制剂,可以从植物组织中提取获得,也可以从激光诱变的黑曲霉高产菌株中提取获
(2014•烟台三模)果胶酶是食品工业中的重要酶制剂,可以从植物组织中提取获得,也可以从激光诱变的黑曲霉高产菌株中提取获得.流程如图.
(1)果汁加工中,加入果胶酶的主要作用是分解______中的果胶,使榨取果汁变得容易;同时使果汁变得澄清,是由于果胶分解成______.
(2)如果以葡萄为原料榨取果汁,经过高温灭菌、冷却后,再加入果胶酶进行处理,为了保持酶的催化活性和高效率,必要的条件是保持______,同时还必须做到施加的果胶酶______.
(3)产果胶酶的菌株一般可从腐烂的果蔬或果园泥土中分离,利用以______ 为唯一碳源的培养基筛选.在培养基上进行菌落培养时,样品稀释液的稀释度要足够高,是为了做到培养基上的菌落是______生长,这样有利于进行______.
(4)激光诱变选育果胶酶高产菌株时,应选取黑曲霉的______,制成一定浓度的悬液,进行激光辐射;然后再对悬液中的辐射对象进行______ 培养,以获得突变菌落.
(5)诱变得到的高产菌株生产的果胶酶,可耐93℃高温.据此,可利用该菌株提取______,用于PCR技术,以进行DNA扩增. 我和狗狗去流浪1年前1
我和狗狗去流浪1年前1 -
 云沐天香 共回答了17个问题
云沐天香 共回答了17个问题 |采纳率94.1%解题思路:全面把握从激光诱变的黑曲霉高产菌株中提取果胶酶的流程,考查果胶酶的作用、影响果胶酶活性的因素、果胶酶菌株的培养及应用.(1)果胶酶的主要作用是分解细胞壁及胞间层,使榨取果汁变得更容易,而果胶分解成可溶性的半乳糖醛酸,也使得浑浊的果汁变得澄清.
(2)以葡萄味原料榨取果汁,经过高温灭菌、冷却后,再加入果胶酶进行处理时,溶液的温度、酸碱度要适宜,果胶酶要适量,因为温度、酸碱度会影响酶的活性,生产果汁时为了使果胶酶得到充分的利用,节约成本,需要控制好酶的用量.
(3)从腐烂的果蔬或果园泥土中分离出产果胶酶的菌株,利用以果胶为唯一碳源的培养基进行筛选.在培养基上进行菌落培养时,在样品稀释液的稀释度要足够高的菌液里,聚集在一起的微生物将被分散成单个细胞,从而能在培养基的表面形成单个的菌落,这是为了培养基上的菌落是单个生长,这样有利于进行菌落计数.
(4)利用激光诱变选育果胶酶高产菌株时,应选取黑曲霉的成熟孢子,制成一定浓度的悬浮液激光辐射后,再对悬浮液中的辐射对象进行分离培养,以便获得突变菌株.
(5)快速、高效、灵活和易于操作是PCR技术的突出特点,从诱变得到的高产菌株生产的果胶酶耐高温,因此可利用该菌株提取耐高温的DNA聚合酶,用于PCR技术,进行DNA的扩增.
答案:
(1)细胞壁和胞间层可溶性的半乳糖醛酸
(2)适宜的温度和PH适量
(3)果胶单个菌落计数
(4)成熟孢子分离
(5)耐高温的DNA聚合酶点评:
本题考点: 果胶酶的活性测定.
考点点评: 考查果胶酶的活性测定的知识,要求学生记忆的知识.1年前查看全部
- 关于俄罗斯的叙述正确的是( ) A.轻工业发达,特别是食品工业 B.交通运输发达,铁路网密集,以圣彼得堡为中心呈放射状
关于俄罗斯的叙述正确的是( ) A.轻工业发达,特别是食品工业 B.交通运输发达,铁路网密集,以圣彼得堡为中心呈放射状分布 C.伏尔加河被俄罗斯人称为“母亲河” D.俄罗斯热带面积分布广  修ee息1年前1
修ee息1年前1 -
 19307095 共回答了18个问题
19307095 共回答了18个问题 |采纳率100%俄罗斯经济结构不平衡,重工业发达,轻工业较落后,故A错误;
俄罗斯的铁路分布地区差异大,其亚洲部分的铁路主要修筑在南部山区,故B错误;
伏尔加河被俄罗斯人称为“母亲河”,故C正确;
俄罗斯纬度位置较高,大部分位于北温带,没有热带分布,故D错误.
故选:C.1年前查看全部
- (2013•永修县模拟)菠萝酯(C11H12O3)是一种具有菠萝香气的食用香料,广泛应用于饮料、糖果、食用香精等食品工业
(2013•永修县模拟)菠萝酯(C11H12O3)是一种具有菠萝香气的食用香料,广泛应用于饮料、糖果、食用香精等食品工业.请回答:
(1)菠萝酯由______种元素组成;
(2)菠萝酯中氢、氧元素的质量比是______;
(3)菠萝酯中碳元素的质量分数是______. sh11imo1年前1
sh11imo1年前1 -
 剑不悔 共回答了18个问题
剑不悔 共回答了18个问题 |采纳率100%解题思路:(1)根据菠萝酯化学式的含义进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析解答.(1)菠萝酯是由碳、氢和氧三种元素组成的.
(2)菠萝酯中氢、氧元素的质量比为(1×12):(16×3)=1:4.
(3)菠萝酯中碳元素的质量分数是[12×11/12×11+1×12+16×3]×100%=68.75%.
故答案为:(1)三;(2)1:4;(3)68.75%.点评:
本题考点: 化学式的书写及意义;元素质量比的计算;元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 碳酸氢钠在灭火器里 他是产生()的原料,在食品工业中,他是()的一种主要成分;
碳酸氢钠在灭火器里 他是产生()的原料,在食品工业中,他是()的一种主要成分;
在制造饮料时,他也是一种常用的()在医疗上他是治疗()过多的一种药剂 凋零香儿1年前1
凋零香儿1年前1 -
 超级牛市1 共回答了17个问题
超级牛市1 共回答了17个问题 |采纳率100%CO2,膨化剂,CO2生成物,胃酸1年前查看全部
- (2012•通州区一模)菠萝酯(C11H12O3)学名苯氧乙酸烯丙酯,广泛用于饮料、糖果等食品工业.下列关于菠萝酯化学式
(2012•通州区一模)菠萝酯(C11H12O3)学名苯氧乙酸烯丙酯,广泛用于饮料、糖果等食品工业.下列关于菠萝酯化学式的说法正确的是( )
A.菠萝酯由26个原子构成
B.各元素质量的比为11:12:3
C.菠萝酯的相对分子质量为192
D.菠萝酯是一种无机化合物 粉ggtang1年前1
粉ggtang1年前1 -
 攻击的狮子 共回答了16个问题
攻击的狮子 共回答了16个问题 |采纳率93.8%解题思路:根据物质的化学式的表示意义,利用各元素的相对原子质量进行计算.A、菠萝酯是由分子构成的,一个分子中含有26个原子,故A错误;
B、菠萝酯中碳、氢、氧三种元素的质量比为12×11:1×12:16×3=11:1:4,因此B选项错误.
C、菠萝酯的相对分子质量为12×11+1×12+16×3=192,故C正确;
D、菠萝酯是含有碳元素的化合物,属于有机物,故D错误;
故选C.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;有机物与无机物的区别;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 化学式的意义有:①表示一种物质,②表示该物质的元素组成,③表示该物质的一个分子,④表示该分子的原子构成,⑤该物质中各元素的质量比,⑥该物质中各元素的原子个数比,⑦该物质的相对分子质量,⑧该物质中各元素的质量分数等.1年前查看全部
- Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH2O.
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω.(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量.
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g.计算10℃时Na2SO3在水中的溶解度. yingyin_star1年前1
yingyin_star1年前1 -
 lixiurong 共回答了15个问题
lixiurong 共回答了15个问题 |采纳率86.7%解题思路:1)根据溶质的质量分数=[溶质的质量/溶液的质量]和Na2SO3在30℃时的溶解度来计算饱和溶液中Na2SO3的质量分数ω;
2)根据Na2SO3在30℃时的溶解度来计算271g Na2SO3饱和溶液中水的质量;
3)根据Na2SO3•7H2O晶体和原溶液中溶质的质量求出10℃是饱和溶液中溶质的质量和溶剂的质量,再求出10℃时Na2SO3在水中的溶解度,即100g水中溶解 Na2SO3的质量.1)根据Na2SO3的溶解度,其饱和溶液中溶质为35.5g,溶剂为100g,溶液总质量=100+35.5=135.5g,
则ω(Na2SO3)=[35.5g/135.5g]≈0.26;
2)271g饱和溶液中,假设其含有的溶剂为x,
Na2SO3在30℃时的溶解度为35.5g/100gH2O,
则[100g/135.5g=
x
271g],
解之得:x=200(g);
3)冷却溶液后,析出晶体79.5g,根据其晶体Na2SO3•7H2O的组成,其中含有水和亚硫酸钠为:
m(Na2SO3)=79.5g×[126/126+126]=39.75g
m(H2O)=79.5g-39.75g=39.75g
10℃时Na2SO3的质量为271-200-39.75=31.25g
10℃时H2O的质量为200-39.75=160.25g
假设10℃时Na2SO3的溶解度为y
[100g/y=
160.25g
31.25g],
解得y=19.5g;
答:1)30℃时Na2SO3饱和溶液中Na2SO3的质量分数为0.26;
2)30℃时271g Na2SO3饱和溶液中水的质量为200g;
3)10℃时Na2SO3在水中的溶解度为19.5g.点评:
本题考点: 溶液中溶质的质量分数及相关计算;溶解度、饱和溶液的概念.
考点点评: 此题考查了溶液的质量分数、溶剂的质量、溶解度等化学计算知识,要理解溶解度的概念.1年前查看全部
- [化学--有机化学基础]已知: 图中,D常用于化妆品工业和食品工业,E是生产农药的一种中间体.它们合成路线如下所示: 填
[化学--有机化学基础]
已知:
图中,D常用于化妆品工业和食品工业,E是生产农药的一种中间体.它们合成路线如下所示:
填写下列空白:
(1)A为苯的同系物,其结构简式为______.
(2)物质B所含官能团有______,反应④的反应类型为______.
(3)反应③的化学方程式为______.
(4)E在水溶液中很不稳定,易发生水解反应,其反应的化学方程式为______.
(5)有机物C通过连续氧化可以得到一种羧酸F.F有多种同分异构体,其中苯环上含两个官能团的同分异构体有______种.简述检验某同分异构体中含有醛基的方法(操作、现象和结论):______. 小猪BOB1年前1
小猪BOB1年前1 -
 millar333 共回答了13个问题
millar333 共回答了13个问题 |采纳率92.3%由D的结构结合反应③可知,C为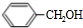
A与氯气光照生成B,B在氢氧化钠水溶液、加热条件下水解生成C,故A为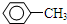
,B为
,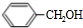
与
反应生成E,结合反应信息可知,E为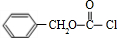
,
(1)A为苯的同系物,其结构简式为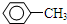
,故答案为: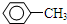
;
(2)B为
,含有官能团为:氯原子,
反应④是
与
反应取代反应生成
,
故答案为:氯原子,取代反应;
(3)反应③是乙酸与苯甲醇发生酯化反应生成乙酸苯甲酯,反应方程式为: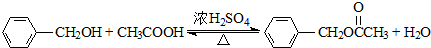
故答案为: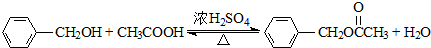
;
(4)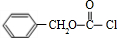
在水溶液中很不稳定,易发生水解反应,由反应信息可知,水解生成苯甲醇、二氧化碳、HCl,反应方程式为: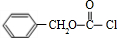
+H 2 O→
+CO 2 ↑+HCl,
故答案为:
+H 2 O→
+CO 2 ↑+HCl;
(5)有机物
通过连续氧化可以得到羧酸
,苯甲酸F有多种同分异构体,其中苯环上含两个官能团为-OH、-CHO,两个取代基有邻、间、对三种位置,故符合条件的同分异构体由3种,
取少量该有机物放入洁净的试管中,加入银氨溶液,水浴加热,若观察到试管内壁附着一层光亮的银镜,证明该有机物分子中含有醛基,
故答案为:3,取少量该有机物放入洁净的试管中,加入银氨溶液,水浴加热,若观察到试管内壁附着一层光亮的银镜,证明该有机物分子中含有醛基.1年前查看全部
- 小苏打(NaHCO3)是食品工业中一种应用最广泛的疏松剂.资料显示,NaHCO3在潮湿的
小苏打(NaHCO3)是食品工业中一种应用最广泛的疏松剂.资料显示,NaHCO3在潮湿的
8.
苏打(NaHCO3)是食品工业中一种应用最广泛的疏松剂.资料显示,NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.
某化学兴趣小组同学为了对在潮湿空气中久置的NaHCO3样品进行分析,称取一份31.4 g混合均匀的样品,用酒精灯对其充分加热,冷却后称得其质量为21.2 g;另称取一份相同质量的样品,逐滴加入稀硫酸至没有气泡产生为止,共收集到气体折算成标准状况下的体积为7.28 L.通过计算回答下列问题:
(1)加热后得到的21.2 g固体是 -----(填化学式).
(2)该一份样品原有的NaHCO3质量是 -------- g.
(3)样品中Na2CO3的质量分数是多少?
第2问有两个版本的答案:①33.6g
②21g dgy5881年前1
dgy5881年前1 -
 NZ卡卡 共回答了16个问题
NZ卡卡 共回答了16个问题 |采纳率81.3%(1)Na2CO3
NaHCO3加热会
分解成Na2CO3、H2O和CO2.
(2)加稀硫酸后,一共生成CO2的量为44*7.28/22.4=14.3g
21.2 gNa2CO3生成的CO2的量为44*21.2/106=8.8g
所以加热时NaHCO3分解生成的CO2量为14.3-8.8=5.5g
2NaHCO3=Na2CO3+H2O+CO2
得到NaHCO3量为2*84*5.5/44=21g
两个版本都有意义,理解不同而已
21指样品中NaHCO3含量(潮解后的)
33.6指的是潮解前样品中NaHCO3含量(此时样品是100%的NaHCO3)
根据最后Na2CO3有21.2g,得潮解前NaHCO3总量为2*84*21.2/106=33.6g
(3)NaHCO3分解生成的Na2CO3质量为106*5.5/44=13.25g
所以原来样品中NaCO3质量为21.2-13.25=7.95g
质量分数为7.95/31.4=25.3%
需要注意的是31.4-7.95-21=2.45g
这部分是NaHCO3分解后的水1年前查看全部
- (2012•德阳)如图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质,A、B、C、D、E为化合物,A在食品工业上
(2012•德阳)如图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质,A、B、C、D、E为化合物,A在食品工业上是发酵粉的一种主要原料,D是使地球产生温室效应的一种气体,丙是生产生活中占据主导地位的金属.(图中部分生成物已略去)
请回答:
(1)B中阴离子的化学符号是______.
(2)写出A受热分解的化学方程式2NaHCO3
Na2CO3+H2O+CO2↑△ .2NaHCO3.
Na2CO3+H2O+CO2↑△ .
(3)在C生成甲和乙的化学反应中,所得甲乙两种气体的体积比是______.
(4)写出E与CO反应生成D和丙的化学方程式4CO+Fe3O4
3Fe+4CO2高温 .4CO+Fe3O4.
3Fe+4CO2高温 . jackyh011年前1
jackyh011年前1 -
 父亲的名字001 共回答了22个问题
父亲的名字001 共回答了22个问题 |采纳率95.5%解题思路:本题属于推断题,根据题目给出的流程图和信息:A在食品工业上是发酵粉的一种主要原料,D是使地球产生温室效应的一种气体,丙是生产生活中占据主导地位的金属,因此A是碳酸氢钠,D是二氧化碳,丙是铁;碳酸氢钠在加热的条件下生成碳酸钠和水和二氧化碳,因此B是碳酸钠;水通电分解生成氢气和氧气,因此甲是氧气,乙是氢气,氧气和氢气的体积比是1:2;铁和氧气在点燃的条件下生成四氧化三铁,四氧化三铁和一氧化碳在高温的条件下生成铁和二氧化碳,配平即可.(1)碳酸氢钠在加热的条件下生成碳酸钠和水和二氧化碳,因此B是碳酸钠,碳酸钠中的阴离子是碳酸根离子;故答案为:CO32-
(2)A在食品工业上是发酵粉的一种主要原料,因此A是碳酸氢钠,碳酸氢钠在加热的条件下生成碳酸钠和水和二氧化碳,配平即可;故答案为:2NaHCO3
△
.
Na2CO3+H2O+CO2↑
(3)水通电分解生成氢气和氧气,又因为铁能在氧气中燃烧,因此甲是氧气,乙是氢气,氧气和氢气的体积比是1:2;故答案为:1:2
(4)四氧化三铁和一氧化碳在高温的条件下生成铁和二氧化碳,配平即可,故答案为:4CO+Fe3O4
高温
.
3Fe+4CO2点评:
本题考点: 物质的鉴别、推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于图框式物质的推断题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.本考点是中考的重要内容之一,是通过实验现象,从而得出物质的组成.书写化学方程式时,要注意配平,此考点主要出现在填空题和实验题中.1年前查看全部
- 酶在食品工业应用时应注意哪些事项
酶在食品工业应用时应注意哪些事项
能不能详细一点啊,大概要300字左右, 歪歪boy97531年前1
歪歪boy97531年前1 -
 twister1983 共回答了13个问题
twister1983 共回答了13个问题 |采纳率92.3%保持酶的活性!1年前查看全部
大家在问
- 1小明三天读完一本书,第一天读了全书的一半少32页,第二天读了全书的1/4 ,第三天读的页数是第一天读的页数的4/5 ,求
- 2The question is very easy.We can answer it easily.改同义句
- 3《答谢中书书》中,全文抓住那个字去写?共描写了哪些景物?这些景物在描写上有哪些特点?
- 4listen to music is good for you ,singing alone won't hurt
- 5判断函数f(x)=x²-2ax+3在(-2,2)内的单调性
- 6已知实数a,b满足a²+3a-1=0,b²+3b-1=0.求a/b+b/a的值
- 7求解释一段文言文是笑话,不解.有公子兼封君者,父对之乃欣羡不已.讶问其故,曰:“你的爷既胜过我的爷,你的儿又胜过我的儿.
- 8afraid(遗憾的) 用法不是害怕是遗憾意思的用法,
- 9下列哪一组中的函数f(x)与g(x)相等?
- 10(十三分之二+十九分之一)*13+十九分之六
- 11社会主义初级阶段理论提出的过程及时间?
- 12关于肝脏石灰化是什么意思?
- 13写出下列各数.三十八万四千二百五十一写作:______五亿零九十万三千七百八十写作:______五百亿三千万六千写作:_
- 14一堆煤,第一天运走总数的12.5%,第二天运走总数的10%,第二天比第一天少运7.5吨,这堆煤共多少吨?
- 15把一个棱长是10cm的正方体木块加工成一个最大的圆柱.这个圆柱的体积是多少立方厘米?比原来减少了百分之几?