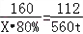冶炼1000t含杂质百分之2.5的生铁,需含四氧化三铁百分之85的磁铁矿多少
 _vv恶_2022-10-04 11:39:542条回答
_vv恶_2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 futuretoday 共回答了17个问题
futuretoday 共回答了17个问题 |采纳率88.2%- (1)Fe3O4 中 Fe的质量分数为
3Fe/Fe3O4 * 100% =56 * 3/(168+64) * 100% = 72%
(2)冶炼1000t含杂质百分之2.5的生铁中Fe的质量
1000t * (1 - 2.5%) = 975t
(3)设需含四氧化三铁百分之85的磁铁矿为x
x * 85% * 72% = 975t
解得x=1593t
答:需含四氧化三铁百分之85的磁铁矿1593t - 1年前
 RTG13 共回答了23个问题
RTG13 共回答了23个问题 |采纳率- 1000*0.975 = 0.85*【56*3/(16*4+56*3)】X
解得x=1584.034t - 1年前
相关推荐
- 高炉冶炼过程中炉渣的AI2O3多少为合里?
 爬墙米英伦超1年前1
爬墙米英伦超1年前1 -
 bgmsw 共回答了21个问题
bgmsw 共回答了21个问题 |采纳率90.5%炼铁炉渣氧化铝含量稳定在13%,氧化镁含量8%左右为佳.主要为控制炉皮结瘤.1年前查看全部
- 工业上用一氧化碳高温还原赤铁矿的方法冶炼铁,若要生产56t铁,理论上至少需要多少吨三氧化二铁
工业上用一氧化碳高温还原赤铁矿的方法冶炼铁,若要生产56t铁,理论上至少需要多少吨三氧化二铁
其化学方程式为:Fe2O3+3CO=2Fe+3CO2 樱桃柠檬苹果派1年前1
樱桃柠檬苹果派1年前1 -
 g47exa 共回答了21个问题
g47exa 共回答了21个问题 |采纳率81%Fe2O3 + 3CO = 2Fe + 3CO2
160 112
X=80T 56T需要三氧化二铁80吨1年前查看全部
- 某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方
某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方程式Fe2O3+3CO
2Fe+3CO2)高温 . 秦小绵1年前1
秦小绵1年前1 -
 wty1706 共回答了18个问题
wty1706 共回答了18个问题 |采纳率94.4%解题思路:这是一道一题多解的题目,可利用化学式计算也可利用化学方程式计算,但不管是哪种方式计算时先要把不纯的物质转化为纯净物计算,一般是混合物的质量乘以这种物质中纯净物的质量分数即为这种纯净物的质量.设需要含氧化铁80%的赤铁矿的质量为x
3CO+Fe2O3
高温
.
2Fe+3CO2
160112
x•80% 1120t•95%
x=[160•1120t•95%/112•80%]=1900t
答:需要含氧化铁80%的赤铁矿1900吨.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 此题是对含杂质物质的有关计算,问题的关键是首先解决纯净物与混合物的相互转化,利用混合物的质量乘以某种物质的质量分数即为这种纯净物质的质量,并结合化学式或化学方程式是解决这类题目的关键.1年前查看全部
- 下列有关金属的说法中不符合实际的是() A.冶炼某些很不活泼的金属,不一定需要还原剂B.金属铝可用氢气还
下列有关金属的说法中不符合实际的是() A.冶炼某些很不活泼的金属,不一定需要还原剂B.金属铝可用氢气还
A.冶炼某些很不活泼的金属,不一定需要还原剂 B.金属铝可用氢气还原法冶炼
C.回收废旧金属可以治理污染,又可以缓解资源短缺 D.金属的冶炼过程均为金属阳离子还原成单质的过程 漂亮MM20081年前1
漂亮MM20081年前1 -
 蓝菲儿 共回答了9个问题
蓝菲儿 共回答了9个问题 |采纳率88.9%A正确,因为对于活泼性位于H后面的那些金属,因为其还原性弱,所以结合氧气结合的不怎么牢固,只要高温就足以使其分解成单质了,所以不一定都要用还原剂,这是老师上课时作为课外知识补充说的.B错错误,因为铝矿中的铝主要以氧化铝形式存在,而铝的活泼性在氢元素前面,这样氢气就不能够把铝从中置换出来了.至于C选项,楼主应该不用我多说吧.是对的,然后最容易错的的就是D选项了,我特地在网上查了一下容我抄袭下: 什么是金属的冶炼?
把金属从矿石中或化合物中提炼出来,这个过程就叫做金属的冶炼.
金属的冶炼原理是什么?
金属冶炼的本质是金属的离子从化合物中被还原成金属单质的过程.
金属冶炼与金属化学性质有什么关系?
从金属活动顺序表可知,越活泼的金属,其阳离子的氧化性越弱;反之,越不活泼的金属,其阳离子的氧化性越强,因此不同的金属冶炼方法也不同.金属的位置越靠后,越容易被还原,用一般的还原方法就能使金属还原;金属的位置越靠前,越难被还原,最活泼的金属只能用最强的还原手段(电解)来还原.
参考资料:《无机化学》,张祖德,中科大出版社所以,这道题应该选择B啦愿能够帮到楼主:)1年前查看全部
- 文献记载:“钢铁是杂炼生(生铁)鍒(熟铁)作刀镰者.”此文献提到的金属冶炼技术发明于什么朝代
 akai81041年前1
akai81041年前1 -
 wuhan 共回答了20个问题
wuhan 共回答了20个问题 |采纳率90%魏晋南北朝时期
《重修政和证类本草·玉石部》“铁精”条引南齐陶弘景的话:“钢铁是杂炼生(生铁)鍒(熟铁)作刀镰者”.近年从河南渑池、洛阳,四川昭化,湖北均县,江苏南京等地出土的大量农具犁、铲、?、锄、镰等,也都为白口铁柔化制成的.说明魏晋南北朝时期制造农具的原料质量有较大提高.1年前查看全部
- 某钢铁冶炼4000t含杂质4%的生铁,需要含Fe3O4 质量分数为80%的磁铁矿石多少t?
 A200120831年前1
A200120831年前1 -
 beckhamdavi 共回答了18个问题
beckhamdavi 共回答了18个问题 |采纳率83.3%在不考虑冶炼损失的前提下:
1,我们需要纯铁质量4000t*96%
2,设需要磁铁xt,方程列出:我们的磁铁中纯铁的质量是x*80%*(56*3/56*3+16*4);
3,让1,2中的式子相等.
得出x=6628.6t
希望能帮助你理解,而不是帮你做作业.1年前查看全部
- 赤铁矿(主要成分是Fe2O3)是冶炼生铁的主要原料.若测得某赤铁矿石中铁元素的质量分数为56%.(假设杂质不含铁元素)请
赤铁矿(主要成分是Fe2O3)是冶炼生铁的主要原料.若测得某赤铁矿石中铁元素的质量分数为56%.(假设杂质不含铁元素)请回答下列问题:
(1)氧化铁中铁元素与氧元素的质量比______.
(2)该矿石中氧化铁的质量分数为______.
(3)冶炼生铁的化学方程式为______. 巡逻一队1年前1
巡逻一队1年前1 -
 何休 共回答了19个问题
何休 共回答了19个问题 |采纳率84.2%解题思路:(1)Fe2O3中铁元素与氧元素的质量比为:(铁的相对原子质量×铁原子个数):(氧的相对原子质量×氧原子个数);
(2)该矿石中氧化铁的质量分数为:赤铁矿石中铁元素的质量分数÷氧化铁中铁元素的质量分数;
(3)生铁冶炼采用的是高温固态还原法,即在炉温提高到1150~1300℃的条件下把铁矿石(氧化铁)还原成铁.据此写出化学方程式.(1)氧化铁中铁元素与氧元素的质量比为:(56×2):(16×3)=7:3;
(2)该矿石中氧化铁的质量分数为:56%÷[56×2/160]=80%;
(3)生铁冶炼是把铁矿石(氧化铁)还原成铁,还原剂主要是CO,反应的化学方程式为:Fe2O3+3CO
高温
.
2Fe+3CO2.
故答案为:(1)7:3;(2)80%;(3)Fe2O3+3CO
高温
.
2Fe+3CO2.点评:
本题考点: 元素质量比的计算;一氧化碳还原氧化铁.
考点点评: 本题主要考查学生运用化学式进行计算的能力.同时要知道生铁冶炼采用的是高温固态还原法.1年前查看全部
- 还原WO3还原剂?冶炼钨的第一个阶段是用炭、氢气等还原剂在高温条件下把氧化钨WO3还原乘金属钨,为了获得纯度高的钨,赢选
还原WO3还原剂?
冶炼钨的第一个阶段是用炭、氢气等还原剂在高温条件下把氧化钨WO3还原乘金属钨,为了获得纯度高的钨,赢选择——————(H2 C)作为还原剂,写出所选物质还原WO3的化学方程式————————
PS:写出理由啊 大家的老同学1年前2
大家的老同学1年前2 -
 咖啡苦滋味 共回答了15个问题
咖啡苦滋味 共回答了15个问题 |采纳率93.3%H2
WO3+3H2高温==W+3H2O
因为H2是气体,产物水是液态,不会引入固体杂质1年前查看全部
- 求磁铁矿石冶炼生铁的公式是化学方程式
 lio_lv1年前3
lio_lv1年前3 -
 南山客 共回答了18个问题
南山客 共回答了18个问题 |采纳率100%Fe3O4+4H2==高温==3Fe+4H2O↑1年前查看全部
- 希望帮忙)下列金属冶炼的化学反应原理, 错误的是
希望帮忙)下列金属冶炼的化学反应原理, 错误的是
下列金属冶炼的化学反应原理, 错误的是 ( )
A. MgO + N2 ==三角== Mg + H2O
B. 2NaCl(熔融) ==电解== 2Na + Cl2(向上箭头)
C. 2HgO ==三角== 2Hg + O2(向上箭头)
D. Fe3O4 + 4CO ==三角== 3Fe + 4CO2
求解析,错误的错在哪了? 这个怎么判断?
希望有人愿意帮忙,短时间里一定采纳,谢谢了. juanlan7101年前2
juanlan7101年前2 -
 嬉皮哥 共回答了21个问题
嬉皮哥 共回答了21个问题 |采纳率100%A1年前查看全部
- 人类冶炼金属的顺序是铜铁铝,是偶然么?
 直通车1年前4
直通车1年前4 -
 才疏学浅 共回答了16个问题
才疏学浅 共回答了16个问题 |采纳率93.8%不是
它们的活泼性如下
铜<铁<铝
化学性质越不活泼,就越容易被发现和冶炼
所以人类冶炼金属的顺序是铜铁铝1年前查看全部
- 不同的金属应选用不同的冶炼方法,如:热还原法、热分解法、电解法等.你认为选择的原则主要是依据( )
不同的金属应选用不同的冶炼方法,如:热还原法、热分解法、电解法等.你认为选择的原则主要是依据( )
A. 金属在自然界的存在形式
B. 金属熔点的高低
C. 金属离子得电子的能力
D. 金属元素在地壳中的含量 小新七代1年前1
小新七代1年前1 -
 我想揣他 共回答了9个问题
我想揣他 共回答了9个问题 |采纳率100%解题思路:根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,较活泼金属用热还原法,不活泼金属如Hg、Ag等用热分解法冶炼.不同的金属应选用不同的冶炼方法,金属的冶炼方法是根据金属的活动性强弱确定,即金属离子得电子的能力.
故选C.点评:
本题考点: 金属冶炼的一般原理.
考点点评: 本题考查了确定金属冶炼方法的依据,难度不大,注意根据金属的活动性强弱确定金属的冶炼方法.1年前查看全部
- 化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是 A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁
化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是
A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁 C.硫酸厂用接触法生产硫酸 D.炼油厂用分馏法生产汽油  激活十二1年前1
激活十二1年前1 -
 dw284716363 共回答了16个问题
dw284716363 共回答了16个问题 |采纳率81.3%D
1年前查看全部
- 下列关于铝及其化合物的说法不正确的是 A.Al既可用于食品包装,也可用做建筑材料 B.Al 2 O 3 既可用来冶炼金属
下列关于铝及其化合物的说法不正确的是
A.Al既可用于食品包装,也可用做建筑材料 B.Al 2 O 3 既可用来冶炼金属Al,也可用做耐火材料 C.明矾[KAl(SO 4 ) 2 ·12H 2 O]既可用做净水剂,也可用作消毒剂 D.Al(OH) 3 既可用作治疗胃酸过多的药物,也可用来制备一些铝盐  thereisdesire1年前1
thereisdesire1年前1 -
 cll_a 共回答了24个问题
cll_a 共回答了24个问题 |采纳率91.7%C
1年前查看全部
- 工业炼铁,用到的原料有:铁矿石、焦炭、空气、石灰石,下列对原料在冶炼过程中的作用叙述不正确的是: [
工业炼铁,用到的原料有:铁矿石、焦炭、空气、石灰石,下列对原料在冶炼过程中的作用叙述不正确的是: [ ]
A.焦炭是铁矿石炼铁时的还原剂
B.空气在与焦炭的反应中,为炼铁提供能量
C.石灰石是助矿石中杂质形成炉渣
D.固体原料需粉碎,增大与气体的接触面 风吹的脸1年前1
风吹的脸1年前1 -
 zhangpengtao1 共回答了15个问题
zhangpengtao1 共回答了15个问题 |采纳率86.7%A1年前查看全部
- 某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方
某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方程式Fe2O3+3CO
2Fe+3CO2)高温 . loki6131年前1
loki6131年前1 -
 46hf 共回答了22个问题
46hf 共回答了22个问题 |采纳率86.4%解题思路:这是一道一题多解的题目,可利用化学式计算也可利用化学方程式计算,但不管是哪种方式计算时先要把不纯的物质转化为纯净物计算,一般是混合物的质量乘以这种物质中纯净物的质量分数即为这种纯净物的质量.设需要含氧化铁80%的赤铁矿的质量为x
3CO+Fe2O3
高温
.
2Fe+3CO2
160112
x•80% 1120t•95%
x=[160•1120t•95%/112•80%]=1900t
答:需要含氧化铁80%的赤铁矿1900吨.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 此题是对含杂质物质的有关计算,问题的关键是首先解决纯净物与混合物的相互转化,利用混合物的质量乘以某种物质的质量分数即为这种纯净物质的质量,并结合化学式或化学方程式是解决这类题目的关键.1年前查看全部
- 冶炼烟气制酸三换后放置省煤器(SO3冷却器)的作用是什么
 虹色璐璐1年前1
虹色璐璐1年前1 -
 fxlulu 共回答了19个问题
fxlulu 共回答了19个问题 |采纳率89.5%冷却SO3气温,降低进一吸塔的温度,减轻吸收塔的负荷,充分利用热量1年前查看全部
- 如图甲所示是利用涡流冶炼金属的感应炉示意图,冶炼炉内装入被冶炼的金属,线圈通上高频交变电流,这时被冶炼的金属中就产生很强
如图甲所示是利用涡流冶炼金属的感应炉示意图,冶炼炉内装入被冶炼的金属,线圈通上高频交变电流,这时被冶炼的金属中就产生很强的涡流,从而产生大量的热使金属熔化,这种冶炼方法速度快,温度容易控制,并能避免有害杂质混入被冶炼的金属中,因此适于冶炼特种合金和特种钢,其简化模型如图乙所示.假设金属环的阻值R=10πΩ,半径r=10cm,其外侧线圈中通以高频的交流电,线圈中产生垂直于金属环所在平面的变化磁场,磁场的磁感应强度B随时间变化关系为B=0.1sin(4×104t)(T).不计温度变化对电阻的影响,计算结果可保留π.求:

(1)金属环中产生的感应电动势最大值;
(2)1s时间内金属环内产生的焦耳热;
(3)在磁场变化的0时刻到四分之一周期时间内,通过金属环截面的电荷量. 笨人1111年前1
笨人1111年前1 -
 fascination616 共回答了16个问题
fascination616 共回答了16个问题 |采纳率87.5%解题思路:(1)根据法拉第电磁感应定律为E=[△B/△t]求出感应电动势,由欧姆定律求出感应电流.画出电流图象.
(2)根据电流的热效应,求出此电流在一个周期通过阻值为R的电阻产生的热量,与直流相比较,求出有效值.然后根据焦耳定律求出热量.
(3)根据法拉第电磁感应定律、欧姆定律、电流与电量的关系式求解通过圆环的电荷量.(1)由于磁感应强度B随时间变化关系为B=0.1sin(4×104t)(T),
所以金属环中的电动势:
e=
△Φ
△t=
△B
△t•S=0.1×4×104×π×0.12cos(4×104t)V=40πcos(4×104t)V
金属环中产生的感应电动势最大值是40πV
(2)金属环中产生的感应电动势有效值:E=
Em
2=20
2πV
1s时间内金属环内产生的焦耳热:Q=
E2
R=
(20
2π)2
10π=80πJ
(3)在磁场变化的0时刻到四分之一周期时间内,磁通量从0增大到0.1T,
通过金属环截面的电荷量:q=
.
e
R•△t=
△Φ
△t•R•△t=
△B•S
R=
0.1×π×0.12
10π=1×10−4C
答:(1)金属环中产生的感应电动势最大值是40πV;
(2)1s时间内金属环内产生的焦耳热是80πJ;
(3)在磁场变化的0时刻到四分之一周期时间内,通过金属环截面的电荷量是1×10-4C.点评:
本题考点: * 涡流现象及其应用.
考点点评: 本题运用法拉第电磁感应定律、欧姆定律和焦耳定律研究高频焊接的原理,抓住B-t的变化率是B对t的导数,即求出磁通量的变化率,得到感应电动势.根据有效值的定义求解有效值.求解电量的关键是掌握法拉第电磁感应定律E=△Φ△t=△BSR.,1年前查看全部
- 工业从铝土矿(主要成分是Al2O3•xH2O、SiO2、Fe2O3等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如图
工业从铝土矿(主要成分是Al2O3•xH2O、SiO2、Fe2O3等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如图,图中操作错误的是( )

A. ④⑤
B. ③④
C. ②⑤
D. ①② onisho1年前1
onisho1年前1 -
 如果一生 共回答了19个问题
如果一生 共回答了19个问题 |采纳率73.7%解题思路:铝土矿灼烧除去结晶水,灼热后的不挥发物质中加入过量的盐酸,Al2O3、Fe2O3溶解成铝盐、铁盐,过滤除去不溶的杂质二氧化硅等,溶液中含有过量的盐酸,向②的滤液中加入过量氢氧化钠使铝盐变成偏铝酸盐,而铁离子转化为氢氧化铁沉淀,过滤除去,滤液中含有过量的氢氧化钠,向③的滤液中加入过量盐酸,溶液中偏铝酸根、氢氧化钠转化为氯化铝、氯化钠,溶液溶质为氯化铝、氯化钠,不能生成氢氧化铝沉淀,应通入二氧化碳,可得氢氧化铝沉淀,氢氧化铝沉淀灼热分解生成氧化铝.如果把第二步的盐酸换成氢氧化钠 那溶解的只有氧化铝,变成偏铝酸盐,去掉步骤③,然后进行第四第五步就行了.铝土矿灼烧除去结晶水,灼热后的不挥发物质中加入过量的盐酸,Al2O3、Fe2O3溶解成铝盐、铁盐,过滤除去不溶的杂质二氧化硅等,溶液中含有过量的盐酸,向②的滤液中加入过量氢氧化钠使铝盐变成偏铝酸盐,而铁离子转化为氢氧化铁沉淀,过滤除去,滤液中含有过量的氢氧化钠,向③的滤液中加入过量盐酸,溶液中偏铝酸根、氢氧化钠转化为氯化铝、氯化钠,溶液溶质为氯化铝、氯化钠,不能生成氢氧化铝沉淀,应通入二氧化碳,可得氢氧化铝沉淀,故④错误,
氢氧化铝沉淀灼热分解生成氧化铝,干燥不能使氢氧化铝分解,故⑤错误.
故选:A.点评:
本题考点: 镁、铝的重要化合物;制备实验方案的设计.
考点点评: 考查学生对工艺流程的理解、元素化合物性质等,难度中等,掌握元素化合物的性质是关键.1年前查看全部
- 多少年前,用煤冶炼铜
 淡水之交1年前1
淡水之交1年前1 -
 seedkang 共回答了17个问题
seedkang 共回答了17个问题 |采纳率94.1%商朝1年前查看全部
- 铁的冶炼实验必须有--装置,防止--?
 superade1年前3
superade1年前3 -
 wskld_hh 共回答了22个问题
wskld_hh 共回答了22个问题 |采纳率81.8%铁的冶炼实验必须有( 尾气处理 )装置,防止(尾气中的CO污染空气)
尾气处理常用燃着的酒精灯烧掉CO或用空的气囊来收集1年前查看全部
- 点解熔融的氧化铝冶炼金属铝时,当电路中通过3mol电子时,理论上可以得到多少克金属铝?
点解熔融的氧化铝冶炼金属铝时,当电路中通过3mol电子时,理论上可以得到多少克金属铝?
如题,..特别是通过3mol电子这个条件怎么用...忘记了... GEGB1年前1
GEGB1年前1 -
 a1381966 共回答了17个问题
a1381966 共回答了17个问题 |采纳率94.1%电解时,Al由+3价还原为0价,所以1 mol Al得到3 mol电子.
现在电路通过3 mol电子,说明产生1 mol Al,即27 g.1年前查看全部
- 为什么不采用电解食盐水的方法冶炼金属钠
 夏日的梦想1年前1
夏日的梦想1年前1 -
 生如冬草 共回答了16个问题
生如冬草 共回答了16个问题 |采纳率87.5%因为电解食盐水无法得到金属钠.
2NaCl+2H2O=通电=2NaOH+Cl2↑+H2↑
氯碱工业依据这个原理生产NaOH和Cl2.
制取金属钠的正确方法是电解熔融状态的氯化钠.
2NaCl(熔融)=通电=2Na+Cl2↑1年前查看全部
- 请用所学化学知识解释下列原理。(1)铁矿石能冶炼成铁,说明碳和一氧化碳具有
请用所学化学知识解释下列原理。
(1)铁矿石能冶炼成铁,说明碳和一氧化碳具有 性。
(2)不能用铁制容器来配制波尔多液的化学反应原理 ;
(3)已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。写出氢氧化锂(LiOH)与稀硫酸反应的化学方程式 ;
(4)煤炉取暖时能发生多个化学反应,它们是(用化学方程式表示):
① ;
② ;
③ 。 空谷之幽幽1年前1
空谷之幽幽1年前1 -
 销魂忙 共回答了16个问题
销魂忙 共回答了16个问题 |采纳率93.8%1年前查看全部
- (12分)已知铝土矿主要成分为Al 2 O 3 ,还含有少量的Fe 2 O 3 、SiO 2 等杂质。下图是工业上冶炼铝
(12分)已知铝土矿主要成分为Al 2 O 3 ,还含有少量的Fe 2 O 3 、SiO 2 等杂质。下图是工业上冶炼铝的工艺流程图:
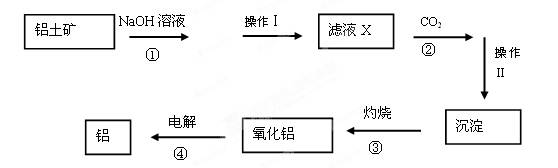
⑴操作Ⅰ和Ⅱ是用于分离溶液和沉淀,称为 。需要用到哪些玻璃仪器
⑵操作Ⅰ分离出的沉淀除了含有泥沙外,一定还含有 ,滤液X 中,含铝元素的溶质的化学式为 。写出步骤②中与过量CO 2 反应的化学方程式
中,含铝元素的溶质的化学式为 。写出步骤②中与过量CO 2 反应的化学方程式
⑶操作Ⅱ得到的 沉淀除了氢氧化铝还有 ,它属于 (填“酸”、“碱”或“盐”)类物质。
沉淀除了氢氧化铝还有 ,它属于 (填“酸”、“碱”或“盐”)类物质。
⑷实 验室里常往氯化铝溶液中加入 (填“氨水”或“NaOH溶液”),写出对应的离子方程式
验室里常往氯化铝溶液中加入 (填“氨水”或“NaOH溶液”),写出对应的离子方程式  留缘剑客1年前1
留缘剑客1年前1 -
 噜噜哩 共回答了29个问题
噜噜哩 共回答了29个问题 |采纳率93.1%1年前查看全部
- 高二化学 科学家冶炼出很纯很纯的铁,它不会具有的性质是
高二化学 科学家冶炼出很纯很纯的铁,它不会具有的性质是
A.硬度比生铁低
B.熔点比生铁低
为什么B是对,A是错的
比较钢和生铁中碳的质量分数,前者与后者含碳量的关系是
为什么是小于啊 Chouisno11年前1
Chouisno11年前1 -
 风吹草舞 共回答了23个问题
风吹草舞 共回答了23个问题 |采纳率78.3%B.
生铁和钢都是铁的合金,一般而言,合金的熔点比成分元素低,即生铁的熔点比纯铁低.合金的硬度一般比成分金属大,即生铁的硬度比纯铁高.
钢中碳的含量低,生铁中碳的含量高.
含碳量越大,硬度越大,韧性越差(即脆,硬而易碎)1年前查看全部
- 金属冶炼的实质是什么
 hahadiyi1年前1
hahadiyi1年前1 -
 Cristalgirl 共回答了17个问题
Cristalgirl 共回答了17个问题 |采纳率100%把金属里面的杂质尽可能的氧化掉!获得比较纯净的金属或者合金!1年前查看全部
- 冶炼技术在中国有着悠久的历史,我国古代将炉甘石(ZnCO3)、赤铜矿(主要成分为Cu2O)和木炭粉混合加热至800℃左右
冶炼技术在中国有着悠久的历史,我国古代将炉甘石(ZnCO3)、赤铜矿(主要成分为Cu2O)和木炭粉混合加热至800℃左右,即可得到金光闪闪与黄金外观相似的“药金”.
(1)用上述方法不能制得黄金是因为______.
(2)药金的主要成分是______. 小妖精的苹果1年前1
小妖精的苹果1年前1 -
 月牙_牛牛 共回答了21个问题
月牙_牛牛 共回答了21个问题 |采纳率100%解题思路:黄金的成分主要是金,根据质量守恒定律可知,化学反应前后元素的种类不变,那么我们通过分析此题反应前是否存在金(Au)元素来判断能否制得黄金;根据“药金”的制取过程其主要含有的金属是锌和铜.(1)因为黄金的主要成分是金,它是由金元素组成;那么要制取黄金,根据质量守恒定律可知,反应物中一定要有金元素,但是上述材料不含有金元素,故不能制取.
(2)根据质量守恒定律,反应前后元素种类不变和“药金”的冶炼材料可知:与黄金外观相似的“药金”主要成分是Zn、Cu.
故正确答案:
(1)在化学反应中原子种类不变Zn、Cu、C、O不可能变成Au;
(2)Zn、Cu点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查了对质量守恒定律的应用情况,能够利用该定律解释一些生活中常见的现象;质量守恒定律是初中化学中一个非常重要的定理,也是中考中的热点问题,所以深刻理解质量守恒定律,并能够应用质量守恒定律解决问题对同学来说是非常重要的.1年前查看全部
- 下列金属冶炼的反应原理中错误的是:A Fe+CuSO4=FeSO4+Cu B 3MgO+2Al=(高温)3Mg+Al2O
下列金属冶炼的反应原理中错误的是:A Fe+CuSO4=FeSO4+Cu B 3MgO+2Al=(高温)3Mg+Al2O3 C 2Al2O3(熔融)=电解、冰晶石=4Al+3O2↑ D 2HgO=(加热)2Hg+O2
 li3762762171年前2
li3762762171年前2 -
 涂亮 共回答了16个问题
涂亮 共回答了16个问题 |采纳率93.8%B 镁比铝更活泼1年前查看全部
- 钢铁工业是国家工业的基础.铁矿石的冶炼是一个复杂的过程,其中赤铁矿冶炼的主要反应原理是:Fe 2 O 3 +3CO 2F
钢铁工业是国家工业的基础.铁矿石的冶炼是一个复杂的过程,其中赤铁矿冶炼的主要反应原理是:Fe 2 O 3 +3CO  2Fe+3CO 2 .某钢铁厂现要冶炼560吨的铁,理论上需要含氧化铁80%的赤铁矿多少吨?
2Fe+3CO 2 .某钢铁厂现要冶炼560吨的铁,理论上需要含氧化铁80%的赤铁矿多少吨? zjessie1年前1
zjessie1年前1 -
 css_205 共回答了28个问题
css_205 共回答了28个问题 |采纳率96.4%1年前查看全部
- 高中化学,电解制纯铁,电量计算求最后一空的详细计算式,答案是3.4*10^6 C从高炉冶炼得到的生铁,含铁约95%左右,
高中化学,电解制纯铁,电量计算
求最后一空的详细计算式,答案是3.4*10^6 C
从高炉冶炼得到的生铁,含铁约95%左右,要得到纯铁(含铁99.9%以上)可采用电解的方法.
电解槽的阳极材料应选用_____,阴极材料应选用_____ 电解质溶液应采用______溶液.要获取1.0kg纯铁,电极上通过的电量理论值为___________.(电子电量e=1.60×10-19C)
 pfc5zk1年前1
pfc5zk1年前1 -
 mexiaolv 共回答了16个问题
mexiaolv 共回答了16个问题 |采纳率100%阳极:粗铁;阴极:纯铁;亚铁盐;
= (1000/56)mol * 2 * 1.60*10^(-19) * 6.02 * 10^(23) = 3.44 * 10^(6) C1年前查看全部
- 铜的冶炼过程大致可分为: ①富集,将硫化物矿进行浮选; ②焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S
铜的冶炼过程大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S+3SO 2 +2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 =2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑;
④电解精炼铜
下列说法正确的是[ ]A.上述过程中,由1molCuFeS 2 制取1molCu时共消耗2molO 2
B.在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,只有Cu 2 O作氧化剂
C.电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量一定为32g
D.冶炼过程中的尾气可用来制硫酸 duke5111年前1
duke5111年前1 -
 20070910cd 共回答了19个问题
20070910cd 共回答了19个问题 |采纳率94.7%D1年前查看全部
- 铜的冶炼大致可分为:(1)富集,将硫化物矿进行浮选;(2)焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为:2CuFeS 2 +4O 2 =Cu 2 S+3SO 2 +2FeO(炉渣);
(3)制粗铜,在1200℃发生的主要反应为:2Cu 2 S+3O 2 =2Cu 2 O+2SO 2 ;2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑;
(4)电解精炼.
下列说法正确的是( )A.上述灼烧过程的尾气均可直接排空 B.由6molCuFeS 2 生成6molCu,上述共消耗15molO 2 C.在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,作氧化剂只有Cu 2 O D.电解精炼时,粗铜应与外电源负极相连  shapei0011年前1
shapei0011年前1 -
 mmqsf 共回答了25个问题
mmqsf 共回答了25个问题 |采纳率84%A、SO 2 有毒,不能直接排放到空气中,故A错误;
B、反应的总分应方程式为6CuFeS 2 +15O 2 =6Cu+12SO 2 +6FeO,由6molCuFeS 2 生成6molCu,共消耗15molO 2 ,故B正确;
C、在反应2Cu 2 O+Cu 2 S=6Cu+SO 2 ↑中,Cu的化合价由+1价升高为+2价,S的化合价由-2价升高为+4价,反应物中Cu 2 O只做氧化剂,Cu 2 S既是氧化剂又是还原剂,故C错误;
D、精炼铜时,粗铜做阳极,与电源的正极相连,故D错误.
故选B.1年前查看全部
- 工业上用焦炭冶炼金属铜,如果用200吨含杂质为20%的氧化铜与足量的焦炭反应,可制得含杂质10%的铜多少吨?
 信至指定客服1年前1
信至指定客服1年前1 -
 我要我们在一起W 共回答了21个问题
我要我们在一起W 共回答了21个问题 |采纳率85.7%CuO质量160吨 CuO----------------Cu
80 64
160 X X=128吨 可以得到纯铜128吨
现在含杂质10%,所以真正得到的铜为 128/0.9=142.2吨1年前查看全部
- (2014•朝阳区)工业上冶炼金属铁的主要反应为:Fe2O3+xCO 高温 . 2Fe+3CO2其中该化学方程式中x
(2014•朝阳区)工业上冶炼金属铁的主要反应为:Fe2O3+xCO
2Fe+3CO2其中该化学方程式中x的数值是______,CO作______(填“氧化剂”或“还原剂”).在该反应中,若消耗了1mol Fe2O3,则生成______mol Fe.高温 . raphealwon1年前1
raphealwon1年前1 -
 清晨的黄昏 共回答了21个问题
清晨的黄昏 共回答了21个问题 |采纳率85.7%解题思路:反应Fe2O3+xCO
2Fe+3CO2中Fe元素化合价降低,Fe2O3为氧化剂,C元素化合价升高,CO为还原剂,根据元素质量守恒可确定x值,结合方程式计算.高温 .反应Fe2O3+xCO
高温
.
2Fe+3CO2中,由质量守恒可知x=3,C元素化合价升高,CO为还原剂,在该反应中,若消耗了1mol Fe2O3,则生成2molFe,
故答案为:3;还原剂;2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意从元素化合价升降的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.1年前查看全部
- (2009•江门一模)工业上用铝土矿(主要成分是A1203,还有少量的Fe203,SiO2)提取冶炼铝的原料氧化铝.工艺
(2009•江门一模)工业上用铝土矿(主要成分是A1203,还有少量的Fe203,SiO2)提取冶炼铝的原料氧化铝.工艺流程图如图:
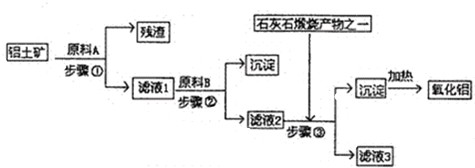
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______.步骤②反应的离子方程式是:______.
(3)步骤③的离子化学方程式是:______.
(4)步骤①②③的操作都是______(填操作名称),要检验Al(OH) 3沉淀是否完全的方法是______.
(5)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?______. san2700211年前1
san2700211年前1 -
 善莫大焉 共回答了21个问题
善莫大焉 共回答了21个问题 |采纳率81%解题思路:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液2含有AlO2-.步骤②应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,所以滤液1中含有Al3+,步骤①应为加入盐酸,除去SiO2.由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液2含有AlO2-.步骤②应加入氢氧化钠,所以滤液1中含有Al3+,步骤①应为加入盐酸,除去SiO2.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,
氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O.
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O.
(2)步骤①加入过量盐酸,滤液1中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为 H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O.
故答案为:NaOH; H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O.
(3)滤液2含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,
反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(4)由工艺流程可知步骤①②③的操作都是过滤.检验Al(OH) 3沉淀是否完全,只要检验滤液3中是否含有AlO2-即可.取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全.
故答案为:过滤;取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全.
(5)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质.
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.点评:
本题考点: 镁、铝的重要化合物;硅和二氧化硅;铁的氧化物和氢氧化物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题以框图题形式考查铝的化合物的性质,难度中等,清楚冶炼铝工艺流程原理,是对知识迁移的综合运用.1年前查看全部
- 某钢铁厂冶炼四千吨含杂质百分之四的生铁需要含四氧化三铁百分之85的磁铁矿石多少吨?
 天边的云10311年前2
天边的云10311年前2 -
 bionli 共回答了17个问题
bionli 共回答了17个问题 |采纳率82.4%4000t含杂质4%的生铁中Fe质量为:4000×(1-4%)=3960t
设需要含Fe3O4的90%的磁铁矿xt
Fe3O4+4CO=3Fe+4CO2
232.168
85%x.3960
232/85%x=168/3960
x≈6434吨
如还有新的问题,请不要追问的形式发送,另外发问题并向我求助或在追问处发送问题链接地址,1年前查看全部
- 铝热反应是否可以用在冶炼金属镁
 evilweng1年前1
evilweng1年前1 -
 wfhe 共回答了18个问题
wfhe 共回答了18个问题 |采纳率100%不可,铝热反应只可以炼不如铝活泼的的金属,而镁比铝还活泼,比铝更易得电子,因此不可用铝炼镁(倒是可以用镁炼铝,但似乎经济上不划算,镁比铝贵)1年前查看全部
- 问懂冶金的人:铝的冶炼为什么这么困难,以至于十九世纪才被大规模冶炼?
问懂冶金的人:铝的冶炼为什么这么困难,以至于十九世纪才被大规模冶炼?
听说拿破仑时代因为铝比黄金还贵重,所以拿破仑用铝星来取代军旗上的金星,铝这么这么难冶炼啊? handewei1年前4
handewei1年前4 -
 fanxin324 共回答了18个问题
fanxin324 共回答了18个问题 |采纳率94.4%我是搞冶金的.铝的化学性质很活泼,熔点仅为660℃,且塑性好.铝土矿通过拜耳法或烧结法只能得到氧化铝而不是金属铝.
1825年,德国人维勒先用先用钾汞齐,后来用钾还原无水氯化铝制得金属铝,1845年法国人戴维尔用钠还原氯化钠和三氯化铝混合盐得到金属铝,并在法国进行小规模生产,但成本昂贵,这就是拿破仑时代得意的原因.
1882年美国人霍尔和法国人埃鲁特申请了电解法炼铝的专利,开创了电解法炼铝的时代,这就是现代铝工业发展的过程.1年前查看全部
- 赤铁矿的主要成分是Fe2O3,通过冶炼可以把其中的铁元素转化为铁单质.
赤铁矿的主要成分是Fe2O3,通过冶炼可以把其中的铁元素转化为铁单质.
(1)炼铁的过程属于-----(填“物理”或“化学”)变化.
(2)某地开采的赤铁矿中氧化铁的质量分数为80%(假设其它成分中不含铁元素)冶炼过程中铁元素的利用率为90%.要生产1000吨铁,需要这种铁矿石多少吨? 中场小贝隆1年前1
中场小贝隆1年前1 -
 LY-cyd 共回答了15个问题
LY-cyd 共回答了15个问题 |采纳率93.3%(1)是化学变化.
(2)需要1984.13吨.设需要x吨.则x*0.8*0.9*(56*2)/(56*2+16*3)=1000,得x=1984.131年前查看全部
- 下列有关金属冶炼的说法中错误的是( )
下列有关金属冶炼的说法中错误的是( )
A.冶炼铁是在高温下利用还原反应将铁从其铁矿石中还原出来
B.炼钢是在高温下利用氧化剂把生铁中过多的碳和其他杂质氧化
C.1mol Fe3O4被CO全部还原成Fe时,转移9mol电子
D.铝热法还原铁的反应,可放出大量的热,并能使铁熔化 冰凉的手1年前1
冰凉的手1年前1 -
 ajajia 共回答了22个问题
ajajia 共回答了22个问题 |采纳率86.4%解题思路:常用以下方法冶炼金属:
Ⅰ.Fe、Zn、Cu等中等活泼金属通常用热还原法;
Ⅱ.Na、Mg、Al等活泼或较活泼金属通常采用电解法冶炼制备;
Ⅲ.Hg、Ag等不活泼金属通常采用热分解法冶炼.A.铁可用热还原法冶炼,工业常用CO还原,故A正确;
B.生铁中含有较多的碳,可应氧化而除去,达到炼钢的目的,故B正确;
C.Fe3O4中Fe元素化合价有+2价、+3价,1mol Fe3O4被CO全部还原成Fe时,转移8mol电子,故C错误;
D.铝热反应放出大量的热,常用来冶炼一些难熔金属,故D正确.
故选C.点评:
本题考点: 金属冶炼的一般原理;高炉炼铁.
考点点评: 本题考查金属的冶炼,为高频考点,金属的活泼性不同,冶炼方法不同,活泼金属采用电解法冶炼,不活泼的金属采用直接加热法冶炼,大部分金属的冶炼都是在高温下采用氧化还原反应法.1年前查看全部
- 尝试解释冶炼金属铝时,为何不像冶炼金属Na、Mg那样,用电解熔融氯化物的办法,而采用电解熔融氧化铝的办法
 古洞1年前3
古洞1年前3 -
 qwnh189 共回答了16个问题
qwnh189 共回答了16个问题 |采纳率100%因为AlCl3是共价化合物,液态的共价化合物是不导电的,所以采用电解熔融氧化铝的方法.1年前查看全部
- 我国早在南北朝时就开始冶炼黄铜.黄铜是铜和锌的
我国早在南北朝时就开始冶炼黄铜.黄铜是铜和锌的
我国约在南北朝时就开始冶炼黄铜.黄铜是铜和锌的合金(Cu-Zn),它可用来制造及其、电器零件及日用品.为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15mL稀盐酸分三次加入到5g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 第二次 第三次
加入稀盐酸的体积(mL) 5 5 5
生成氢气的质量(g) 0.04 m 0.02
我知道第二次生成氢气的质量为0.04g但是不晓得为什么,就只有这一个问题,理由详细一点,不可以很简单的草草了事哦!不要复制别人的答案...
 成吉思汗2221年前1
成吉思汗2221年前1 -
 小马慢慢跑 共回答了17个问题
小马慢慢跑 共回答了17个问题 |采纳率82.4%第三次加入盐酸时还有气体生成,说明第二次加入酸反应之后依然有金属剩余.那么也就是第二次加酸还是金属过量酸不足,所以一定是0.04,1年前查看全部
- 下列生产、生活中的事例不属于氧化还原反应的是( ) A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐
下列生产、生活中的事例不属于氧化还原反应的是()
A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐  断无魂1年前1
断无魂1年前1 -
 有福不享 共回答了17个问题
有福不享 共回答了17个问题 |采纳率88.2%D
1年前查看全部
- 硫酸铅(PbSO 4 )广泛应用于制造蓄电池、白色颜料等。利用锌冶炼过程中的铅浮渣生产PbSO 4 的流程如下:
硫酸铅(PbSO 4 )广泛应用于制造蓄电池、白色颜料等。利用锌冶炼过程中的铅浮渣生产PbSO 4 的流程如下:
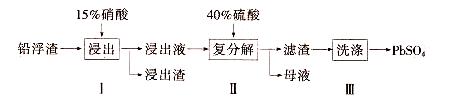
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,K sp (CaSO 4 )=4.9x10 -5 ,K sp (PbSO 4 )=1.6xl0 -8 。
(1)已知步骤I有NO气体产生,浸出液中含量最多的阳离子是Pb 2+ 。分别写出PbO、Pb参加反应的化学方程式 。
(2)步骤I需控制硝酸的用量并使Pb稍有剩佘,目的是 。
(3)母液可循环利用于步骤I,其溶质主要是 (填一种物质化学式),若母液中残留的SO 4 2- 过多,循环利用时可能出现的问题是 。
(4)产品PbSO 4 还需用Pb(NO 3 ) 2 溶液多次洗涤,目的是除去 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO 4 分别转化为PbO 2 和Pb,充电时阴极的电极反应式为 。 爱妻骑士1年前1
爱妻骑士1年前1 -
 T冲凉 共回答了17个问题
T冲凉 共回答了17个问题 |采纳率100%(1)PbO+2HNO 3 =Pb(NO 3 ) 2 +H 2 O (2分)
3Pb+8HNO 3 =3Pb(NO 3 ) 2 +2NO↑+4H 2 O (3分)
(2)防止Ag被溶解进入溶液 (或使Ag留在浸出渣中)(2分)
(3)HNO 3 (2分) 浸出时部分铅离子生成PbSO 4 随浸出渣排出,降低PbSO 4 的产率 (2分)
(4)CaSO 4 杂质 (2分)
(5))PbSO 4 +2e - =Pb+SO 4 2 - (2分)
1年前查看全部
- 铁的冶炼 化学式8个分别是什么?
 久天1年前6
久天1年前6 -
 晚间ii2号 共回答了22个问题
晚间ii2号 共回答了22个问题 |采纳率81.8%1.C+O2=CO2
2.C+CO2=2CO
3.3CO+Fe2O3=2Fe+3CO2
4.CaCO3=CaO+CO2
5.CaO+SiO2=CaSiO3
6.Fe+Fe2O3=3FeO
7.CO2+C=2CO
8.FeO+CO=Fe+CO21年前查看全部
- 由黄铜矿(主要成分是CuFeS 2 )可以冶炼得到粗铜,再经过电解精炼得到纯铜.
由黄铜矿(主要成分是CuFeS 2 )可以冶炼得到粗铜,再经过电解精炼得到纯铜.
(1)黄铜矿冶炼得到粗铜的一步反应为:8CuFeS 2 +21O 2
8Cu+4FeO+2Fe 2 O 3 +16SO 2 若CuFeS 2 中的Fe的化合价为+2,反应中被还原的元素是______(填元素符号).高温 .
根据原电池原理,稀硫酸做电解质溶液,使用惰性电极,一极通入SO 2 ,另一极通入O 2 ,治理SO 2 污染,负极反应的离子方程式为______
(2)粗铜的电解精炼如图所示.在粗铜的电解过程中,纯铜板应是图中电极______(填图中的字母);在电极d上发生的电极反应式为______;若粗铜中还含有金、银、铁,它们在电解槽中的存在形式位置为______.
(3)生物炼铜近几年来逐渐被重视,其原理是:在细菌的帮助下,氧气氧化硫化铜矿石为可溶解性硫酸铜,再进行简单的后续生产.生物炼铜与高温火炼铜相比,优点有______(回答两点)硫酸铜可以配制波尔多液,杀灭果树上的某些细菌,其杀菌原理是______.
 我看着你微笑1年前1
我看着你微笑1年前1 -
 yiranzhi 共回答了25个问题
yiranzhi 共回答了25个问题 |采纳率88%(1)黄铜矿冶炼得到粗铜的一步反应为:8CuFeS 2 +21O 2
高温
.
8Cu+4FeO+2Fe 2 O 3 +16SO 2 若CuFeS 2 中的Fe的化合价为+2价,铜的化合价为+2价,硫的化合价为-1价,氧气中氧元素的化合价为0价,产物中铜的化合价为0价,氧化亚铁中铁的化合价为+2价,氧元素为-2价,三氧化二铁中铁的元素化合价为+3价,氧元素为-2价,二氧化硫中硫元素的化合价为+4价,氧元素为-2价,根据氧化还原规律,化合价降低的发生还原反应,所以反应中被还原的元素是Cu、O;根据原电池原理,稀硫酸做电解质溶液,使用惰性电极,一极通入SO 2 ,另一极通入O 2 ,治理SO 2 污染,负极反应是化合价升高的反应,所以负极离子反应是SO 2 -2e - +2H 2 O=SO 4 2+ +4H + ,
故答案为:Cu、O;SO 2 -2e - +2H 2 O=SO 4 2+ +4H + ;
(2)该装置中a为原电池的正极,b为原电池的负极,所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜-硫酸溶液为电解液,溶液中的Cu 2+ 得到电子沉积在阴极上,发生还原反应,即Cu 2+ +2e - =Cu,作阳极的粗铜中的铜以及比铜活泼的金属失去电子进入溶液,如Fe以Fe 2+ 的形式进入溶液中;比铜不活泼的金属Au、Ag不会失去电子,以单质的形成沉入电解槽形成“阳极泥”,
故答案为:d;Cu 2+ +2e - =Cu;Au、Ag以单质的形成沉积在c(阳极)下方,Fe以Fe 2+ 的形式进入溶液中;
(3)生物炼铜技术是一种利用微生物开矿的湿式制铜技术,生物炼铜的成本远远低于其他冶炼法,具有污染小、反应条件简单、即使含量(品味)很低的矿石也可以被利用等优点;硫酸铜可以配制波尔多液,杀灭果树上的某些细菌,其杀菌原理是铜离子与蛋白质作用使蛋白质变性而丧失其生理功能杀菌,
故答案为:污染小、能量消耗少、反应条件简单等;Cu 2+ 可以使蛋白质变性.1年前查看全部
- 有色金属冶炼行业 硫化锌精矿焙烧后,二氧化硫烟气制硫酸,请问从投矿量算产酸量的公式 理论值
有色金属冶炼行业 硫化锌精矿焙烧后,二氧化硫烟气制硫酸,请问从投矿量算产酸量的公式 理论值
矿S含量32% 水分9% 转化率99.6% 吸收率99.5% 酸浓93% evening_mist1年前1
evening_mist1年前1 -
 tense 共回答了20个问题
tense 共回答了20个问题 |采纳率90%工业硫酸的计算一般以干基计算.你的矿含硫32%,可能指干基含硫.吸收率99.5%不能达标排放,一般吸收率很容易达到99.95%.计算产量,一般按标酸(浓度100%,不是含量100%)计算.还需要焙烧的烧出率,净化的收得率的值.一般硫的总收得率在95%~96%之间.硫的总收得率取96%,一吨含硫32%(干基)矿可生产940kg标酸.1年前查看全部
- 英语翻译“吉象牌”产品使用说明书1.使用环境:建筑施工、冶金开采、石油冶炼、森林采对人体头部受外力伤害起防护作用.2.主
英语翻译
“吉象牌”产品使用说明书
1.使用环境:建筑施工、冶金开采、石油冶炼、森林采
对人体头部受外力伤害起防护作用.
2.主要技术参数:依据GB2811-GB2812要求,耐冲击性能
低于4900(N)耐穿透性,不发生触顶,具有侧向钢性 (最
大变形小于40 mm,最小残余变形小于15mm ),抗静电
性能(电阻率不大于1×10 ).
3.使用须知:(一)要据头型调好帽箍长度,佩带后锁紧
下颚带.(二)不得随意改变安全帽结构.(三)不得用
安全帽当座垫或摔砸.(四)受过一次力冲击的安全帽
不得使用.
4.使用年限,塑料材质一年半,玻璃钢两年.
第三条第四小条(four)是"受过一次力冲击的安全帽不得使用。" 怎么你翻译的就一个"had accepted."啊,哪位帮我翻译准确点啊,我急用啊 kindows1年前1
kindows1年前1 -
 芽巴 共回答了21个问题
芽巴 共回答了21个问题 |采纳率85.7%"Auspicious elephant plate " product
operating instruction manual
1.Use an
environment:Construction ,the
metallurgy exploit ,petroleum smelt ,
forest fells a building to wait for
school assignment,the protection effect
to be hurt up by the outside force to
the human body head.
2.Main technology
parameter:The function is able to bear
penetrability lower than 4900 (N) ,does
not happen touching the top to judge by
GB2811-GB2812 demanding impingement ,
being able to bear,have (maximal
deformation of side direction rigidity
being smaller than 40 mms,minimal
remains deformation is smaller than 15
mms) ,antistatic function (resistivity
no greater than 1 X 10).
3.Use points for attention:(One) is going to
tune up the cap hoop length ,to lock mandible
belt after wearing on the grounds of head type.
(Two) changes safety helmet structure not to at
will.(Three) have squashed must not using safety
helmet to pawn a cushion or falling.(Four) had
accepted.
4.Service life ,plastic material
quality 1 year partly,glass fiber reinforced
plastics 2 years.1年前查看全部
大家在问
- 1Al(OH)3与NaOH反应除了生成偏铝酸钠还生成什么物质?化学方程式是什么?
- 2呋喃甲醛久置后出现的红棕色是什么物质
- 3舍小家为大家的故事要4,5行左右的急.
- 4为什么“潜意识”又称为"右脑意识"、"宇宙意识"?
- 5湖北 英语学习方法 完成句子重点知识
- 6无论什么情况,我们都可以用四舍五入法 取商的近似值
- 7These actors are ______(Asia). 此题的答案是用Asian 还是Asians
- 8数学题目,很简单,可我不会,谁会我给他高分,共3题
- 9改错1.i afraid i just don't konw!2.don't ask me3.i haven't the
- 10第二节:书面表达(满分30分)假设你叫李华。你的朋友Mike 是一名高三学生,他最近有点烦恼,因此写信向你求助,请根据目
- 11修路队用三天时间修完一段公路,第一天修了全长的20%,第二天修了600米,第三天修的是前两天的总和
- 12They are going to have a picnic next Sunday.另一种表达方式,意思不变。求学霸
- 13短文改错(共10小题,每小题1分,Dear Jack,I'm very glad to receive your e -
- 14a^2≤2a+3求a的取值范围 求详解
- 15关于韩愈的《马说》和《师说》1.《马说》:原文中的到底是“其真无马邪?其真不知马也.”还是“其真无马也,其真不知马也?”