氯化铵晶体受热后由试管底部移到试管上部是什么变化
 唧唧猫2022-10-04 11:39:541条回答
唧唧猫2022-10-04 11:39:541条回答为什么?越详细越好,课本上说不是物理变化,只是转移,怎么会发生化学变化?

已提交,审核后显示!提交回复
共1条回复
 yanghuatiandi 共回答了23个问题
yanghuatiandi 共回答了23个问题 |采纳率91.3%- 氯化铵受热分解为氨气和氯化氢,这两种气体在试管上部接触,重新反应生成氯化铵,所以转移了,中间有化学变化
- 1年前
相关推荐
- "70℃"时,氯化铵的溶解度约为60g,则此温度下,氯化铵饱和溶液中的质量关系正确的是
"70℃"时,氯化铵的溶解度约为60g,则此温度下,氯化铵饱和溶液中的质量关系正确的是
A.溶质质量:溶剂质量=6:10 B..溶质质量:溶剂质量=6:10 C.溶剂质量:溶液质量=4:16 D.溶液质量:溶质质量=16:6 野云野花1年前1
野云野花1年前1 -
 颂gg 共回答了18个问题
颂gg 共回答了18个问题 |采纳率94.4%D吧 因为溶解度为60g 说明在100g水中达到饱和最多能溶解60g氯化铵 说明氯化铵饱和溶液 他的溶质可假设成60g 溶剂 100g 溶液160g
这样D溶液质量:溶质质量=160g/60g=8:3 所以D对
请采纳答案,支持我一下.1年前查看全部
- 实验室制取氨气 可行的是1,固态氯化铵加热分解2,固体氢氧化钠中滴加浓氨水3,氯化铵溶液与氢氧化钠溶液共热4,固态氯化铵
实验室制取氨气 可行的是
1,固态氯化铵加热分解2,固体氢氧化钠中滴加浓氨水3,氯化铵溶液与氢氧化钠溶液共热4,固态氯化铵与氢氧化钙混合加热 哪个是对的啊?还有为什么对.哪个是因为把试管口堵住,别的都是因为什么呀? 高昂风1年前4
高昂风1年前4 -
 qwj62688 共回答了24个问题
qwj62688 共回答了24个问题 |采纳率95.8%4是对的.
1会堵住试管口.
2反应太快,不利于收集气体.
3是因为氨气极易溶于水,且使用氢氧化钠成本较高.
以上纯为个人看法.1年前查看全部
- 沉淀的形成为什么要调节PH除去氯化铵中的氯化铁,选用氨水 为什么要调节PH值7-8
 zz00011年前3
zz00011年前3 -
 hlhdy 共回答了16个问题
hlhdy 共回答了16个问题 |采纳率93.8%调pH好理解,那是因为让Fe(3+)生成Fe(OH)3沉淀:
Fe(3+) + 3NH3.H2O = Fe(OH)3 + 3NH4(+)
而是否一定要调到pH=7-8倒是未必,调节pH=5-8没有本质上的差别,可能pH=5-6更好!
因为在此pH下,Fe(OH)3也沉淀完全,而又大致对应NH4Cl溶液的酸碱性.1年前查看全部
- 氧化锌与氯化铵一起有什么用途
 猫猫731年前1
猫猫731年前1 -
 曹辉caohui 共回答了18个问题
曹辉caohui 共回答了18个问题 |采纳率100%物理和化学性质及其用途1.氯化铵是一种无色立方结晶,味咸,1.53的比重,熔点400℃,100℃加热开始升华,分解为氨和氯化氢气体在337.8℃,易溶水,易溶于乙醇,在水中随温度升高显著,水溶液呈酸性,腐蚀性,对大多数金属的溶解度.2干氯化铵和硫酸铵点湿,干铵氮25.4%,约24.0%的湿铵氮含量的内容,硫酸铵,碳酸铵高对比;我公司生产的干,湿氯化铵,因为它很容易吸收水分,很容易结块,因此在生产过程中应客户要求,添加少量的松散剂保持其灵活性,用户友好.在运输过程中有双PVC包装袋,密封好,净重50kg /袋;贮存和运输过程中应粉碎疤痕,造成产品的大量流失后要特别注意防雨,防潮,注意.3是一种中性肥料铵对大多数作物和一些行业.由于硝化作用缓慢,不易流失,肥效长,先进的功能氮,水稻,玉米,高粱,小麦,棉花,麻类,蔬菜等农作物常用的有效利用,并能减少作物倒伏,稻瘟病,白叶枯病发生,腐病等疾病,氮肥生产商的主要来源;但一些农作物的品质会受到氯离子,是不适用的,如烟草,甘薯,甜菜,使用时应特别注意分清对待.4行业,氯化铵主要用于:电池,金属焊接,制药,印刷,染料,精密铸造等行业.1年前查看全部
- 鉴别氯化钠和氯化铵固体的混合物能否利用加热并回收气体的方法
 heroliu3241年前1
heroliu3241年前1 -
 darvey 共回答了19个问题
darvey 共回答了19个问题 |采纳率89.5%氯化钠和氯化铵固体的混合物加热后,
氯化铵固体会分解成氨气和氯化氢,
剩余的固体就是氯化钠,
因此可以利用加热并回收气体的方法1年前查看全部
- 氯化铵加热生成氨气的现象
 eo237351年前1
eo237351年前1 -
 再次失败 共回答了24个问题
再次失败 共回答了24个问题 |采纳率91.7%试管中加热氯化铵晶体时,氯化铵逐渐受热分解为氯气和氨气,从试管底部消失,但与此同时,在试管上口部位,会出现白色结晶物质,即为受热分解后的氯气和氨气在试管口冷环境下重新化合生成氯化铵,这一现象与物理变化中的升华极为相似,因此被称为“假升华”,但一定注意这是化学变化,是氯化铵分解又化合的反应.1年前查看全部
- 假升华的物质除了氯化铵还有别的吗?
 散养oo团胖胖1年前1
散养oo团胖胖1年前1 -
 伤心的牧羊人 共回答了18个问题
伤心的牧羊人 共回答了18个问题 |采纳率94.4%碳酸铵1年前查看全部
- 加入氯化铵固体对氯化铵溶液水解平衡影响
 无耐的雪宁1年前3
无耐的雪宁1年前3 -
 Amy99 共回答了17个问题
Amy99 共回答了17个问题 |采纳率88.2%水解平衡当然正向移动了,不过铵根离子的水解程度却是减小的.1年前查看全部
- 氯化铵与碱混合共热生成一种有刺激性气味的气体,该气体是
 戒掉你的爱1年前1
戒掉你的爱1年前1 -
 晨雾 共回答了14个问题
晨雾 共回答了14个问题 |采纳率78.6%氨气1年前查看全部
- 取下万化肥各少量,分别加入少量熟石灰粉末,混合、研磨,能否嗅到气味?硫酸铵、氯化铵、硫酸钾、氯化钾
 radgzu1年前2
radgzu1年前2 -
 poui 共回答了18个问题
poui 共回答了18个问题 |采纳率88.9%氯化铵可以!硫酸铵应该也可以.能嗅到有刺激性臭味道气体,是氨气.1年前查看全部
- 某化学兴趣小组进行了识别化肥的探究活动.他们对氯化铵、碳酸铵、硫酸钾三种化肥的实验探究步骤如下:
某化学兴趣小组进行了识别化肥的探究活动.他们对氯化铵、碳酸铵、硫酸钾三种化肥的实验探究步骤如下:
(1)步骤一:在装有三种化肥的试管中,分别加入少量稀盐酸,有气体产生的是______.
(2)步骤二:再分别取少量未区分出的另外两种化肥于研钵中,各加入少量熟石灰粉末,混合、研磨,有刺激性气味气体放出的是______.由此可知,在使用该类化肥时,要避免与______ (填“酸”或“碱”)性物质混合施用,以防降低肥效.
(3)为了证明产生的气体为氨气,也可以分别取少量未区分出的另外两种化肥于试管中,加入氢氧化钠溶液,加热,用湿润的______试纸放在试管口处,若试纸变______,则可证明产生的气体为氨气.反应的方程式为NH4Cl+NaOH
NaCl+H2O+NH3↑△ .NH4Cl+NaOH.
NaCl+H2O+NH3↑△ .
(4)有同学提出,氯化铵、硫酸钾也可用下列某种物质进行区分,你认为可行的是______
A.硝酸钡溶液B.氯化钠溶液 C.酚酞溶液 D.稀盐酸. 莨菪q1年前1
莨菪q1年前1 -
 ZHAOCHOU 共回答了14个问题
ZHAOCHOU 共回答了14个问题 |采纳率100%解题思路:利用氯化铵、碳酸铵、硫酸钾的物理性质及化学性质解决此题,主要利用碳酸盐遇酸放出二氧化碳,铵盐遇碱会放出氨气等知识解决.(1)碳酸盐和稀盐酸反应会放出二氧化碳气体,所以在装有三种化肥的试管中,分别加入少量稀盐酸,有气体产生的是碳酸铵;
(2)根据铵盐遇碱会放出氨气可知,再分别取少量未区分出的另外两种化肥于研钵中,各加入少量熟石灰粉末,混合、研磨,有刺激性气味气体放出的是氯化铵,由此可知,在使用该类化肥时,要避免与碱性物质混合施用,以防降低肥效;
(3)氨气溶于水显碱性,遇到湿润红色石蕊试纸变蓝,所以取少量未区分出的另外两种化肥于试管中,加入氢氧化钠溶液,加热,用湿润的红色石蕊试纸放在试管口处,若试纸变蓝,则可证明产生的气体为氨气.反应的方程式为NH4Cl+NaOH
△
.
NaCl+H2O+NH3↑;
(4)采用其他方式对氯化铵及硫酸钾鉴别时可从硫酸钾中的硫酸根入手,加入钡盐能生成白色沉淀的即是硫酸钾,所以可用硝酸钡.
故答案为:
(1)碳酸铵;(2)氯化铵;碱;(3)红色石蕊;蓝;NH4Cl+NaOH
△
.
NaCl+H2O+NH3↑;(4)A.点评:
本题考点: 化肥的简易鉴别;酸的化学性质;铵态氮肥的检验.
考点点评: 此题是对化肥知识的考查,解题的关键是对三种化肥的相关物理及化学性质的掌握,主要是结合铵根离子及硫酸根离子的检验进行解题.1年前查看全部
- 为什么该反应是放热反应?为什么X是氯化铵?Na2O2的作用是与HCl反应生成O2,为什么要生成O2?HCl哪来的?
为什么该反应是放热反应?为什么X是氯化铵?Na2O2的作用是与HCl反应生成O2,为什么要生成O2?HCl哪来的?
某兴趣小组用题27图装置探究氨的催化氧化.
(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
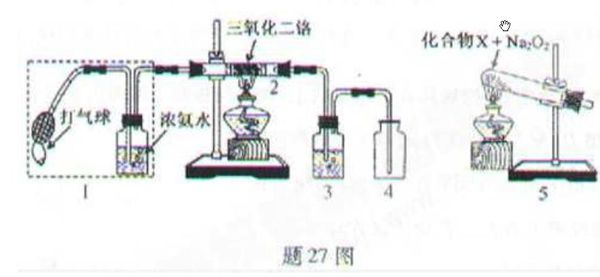
 jichoo1年前1
jichoo1年前1 -
 __hahahnje__ 共回答了18个问题
__hahahnje__ 共回答了18个问题 |采纳率94.4%1.4NH3+5O2=4NO+6H2O(俗称4546反应)
2.保持红热说明是放热反应.
3.保证在装置4中观察到红棕色气体,装置3应装入 (浓硫酸) ;若取消3,在4中仅观察到大量白烟,原因是 (反应生成的水、一氧化氮、氧气反应生成硝酸酸雾和未反应完全的氨气发生反应)
4.实现氨催化氧化,也可用装置5替换装置 (1) (填装置代号);化合物X为 (NH4Cl)(只写一种),Na2O2的作用是 (氧气发生并且在氨气反应中充当碱).
根据反应(1)看到生成一氧化氮反应一定要有氧气,HCl就是通过氯化铵分解得到的,1年前查看全部
- 氯化铵与氢氧化钠反应的化学方程式;
氯化铵与氢氧化钠反应的化学方程式;
cu与硝酸生成no、硝酸铜和水,铁也一样,哪位高手能说说在怎样情况下哪些单质与***生成no? newtree1年前6
newtree1年前6 -
 Sunshinesea 共回答了19个问题
Sunshinesea 共回答了19个问题 |采纳率94.7%NH4Cl + NaOH =△= NaCl + NH3↑ + H2O
Cu + 4 HNO3 (浓) = Cu(NO3)2 + 2 NO2 + 2 H2O(NO2为气体)
3Cu + 8 HNO3 (稀) = 3Cu(NO3)2 + 2 NO + 4 H2O (NO为气体)
一般的金属与稀硝酸反应都生成NO1年前查看全部
- 1.物质的量浓度相同的下列五种溶液:1.氨水 2.氯化铵 3.碳酸氢铵 4.硫酸氢铵 5.硫酸铵
1.物质的量浓度相同的下列五种溶液:1.氨水 2.氯化铵 3.碳酸氢铵 4.硫酸氢铵 5.硫酸铵
按根离子的浓度由大到小的顺序?
为什么?
2.醋酸钠中加入醋酸,各离子浓度大小比较? 龙红太1年前2
龙红太1年前2 -
 wangshicheng113 共回答了19个问题
wangshicheng113 共回答了19个问题 |采纳率89.5%1、醋酸与醋酸钠等体积等浓度混合呈酸性!醋酸的电离程度大于醋酸根离子的水解!这个可以用醋酸的电离常数和水的离子积常数来计算得出!2、注意:并不是弱酸和相应的弱酸盐混合,就是呈酸性的!假如是很弱的酸和相应的弱...1年前查看全部
- 取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有白霜,白霜的成分是
取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有白霜,白霜的成分是
A.氯化铵固体 B.盐酸小液滴 C.氨水小夜滴 D.碳酸氨固体 猪小头1年前4
猪小头1年前4 -
 冰释忐忑 共回答了14个问题
冰释忐忑 共回答了14个问题 |采纳率100%霜是水汽(也就是气态的水)在温度很低时,一种凝华现象,跟雪很类似.严寒的冬天清晨,户外植物上通常会结霜,这是因为夜间植物散热的慢、地表的温度又特别低、水汽散发不快,还聚集在植物表面时就结冻了,因此形成霜.科学上,霜是由冰晶组成,和露的出现过程是雷同的,都是空气中的相对湿度到达100%时,水分从空气中析出的现象,它们的差别只在于露点(水汽液化成露的温度)高于冰点,而霜点(水汽凝华成霜的温度)低于冰点,因此只有近地表的温度低于摄氏零度时,才会结霜.
霜是固体,答案应该是A 氯化铵分解成氨气和氯化氢,在试管口处又会重新反应生成氯化铵,氯化铵高温下不稳定,但是常温下氨气和氯化氢极易反应生成氯化铵1年前查看全部
- 氢氧化钡和氯化铵常温下生成氨气吗?为什么?
 朱丽叶家的苍蝇1年前1
朱丽叶家的苍蝇1年前1 -
 joke126 共回答了21个问题
joke126 共回答了21个问题 |采纳率90.5%可以,但必须是浓氢氧化钡
一水合氨的电离是可逆的氢氧根离子浓度大时,一水合氨电离受制,且水中饱和时就会放出氨气.所以浓氢氧化钡和氯化铵常温下生成氨气1年前查看全部
- 某不纯的氯化铵样品,含氮的质量分数是百分之二十,求此氯化铵样品的纯度.
 QQ平步青云1年前1
QQ平步青云1年前1 -
 BTWANG 共回答了25个问题
BTWANG 共回答了25个问题 |采纳率80%随便带个数字进去..
比如说有样品100g
所以有氮元素质量为100*20%=20g
所以有NH4Cl质量为20/(14/53.5)=76.4g
所以样品纯度为76.4g/100g*100%=76.4%1年前查看全部
- 选择下列物质填空(填写序号): ①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠 ⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜
选择下列物质填空(填写序号):
①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠 ⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体
(1)固态时能导电的有_____________
(2)熔化时不破坏化学键的有_____________
(3)含有配位键的有_____________
(4)含有非极性共价键的有_____________ htsmc0051年前1
htsmc0051年前1 -
 spring89522 共回答了19个问题
spring89522 共回答了19个问题 |采纳率84.2%(1)⑧⑩
(2)②③④
(3)⑨
(4)①④⑥⑧1年前查看全部
- PH=10(+-0.2)氨水-氯化铵缓冲溶液怎么配制?
PH=10(+-0.2)氨水-氯化铵缓冲溶液怎么配制?
如题,
NH3.H2O-NH4CL体系
PH=10正负0.2 mouse8881年前2
mouse8881年前2 -
 昨叶何草 共回答了18个问题
昨叶何草 共回答了18个问题 |采纳率88.9%9.25=10+lg(NH4Cl/NH3)1年前查看全部
- 现有氯化铵.硫酸铵两种固体混合物,试说明检验其中的硫酸根的实验步骤,实验现象和实验结论?
现有氯化铵.硫酸铵两种固体混合物,试说明检验其中的硫酸根的实验步骤,实验现象和实验结论?
详细点 谢啦 lucky小狐狸1年前2
lucky小狐狸1年前2 -
 天使之珠 共回答了8个问题
天使之珠 共回答了8个问题 |采纳率62.5%溶解_加氯化钡溶液_若出现白色沉淀,则可说明硫酸根离子的存在!
本题是在已知物质的情况下的检验,否则则需要在未知溶液中先加盐酸以排除其他离子的干扰,譬如:碳酸根离子磷酸根离子,银离子硅酸根等离子的干扰!
注意:以上回答适用高中化学教学!1年前查看全部
- 物质量浓度一样的氨水 ,氯化铵,碳酸氢铵,硫酸氢铵,硫酸氨中铵根离子浓度最大是?pH由大到小的顺序是?
 qqqbbbfff1年前1
qqqbbbfff1年前1 -
 七宝SAMA 共回答了18个问题
七宝SAMA 共回答了18个问题 |采纳率77.8%物质的量浓度相同的NH3•H2O,NH4Cl,NH4HCO3,NH4HSO4,(NH4)2SO4
铵根的水NH4+ + H2O ==可逆== NH3•H2O + H+
铵根离子浓度大小:
1,(NH4)2SO4强电解质,铵根完全电离,加上铵根正常的水解,铵根离子浓度最大
2,其次是NH4HSO4,铵根离子完全电离,硫酸氢根中氢离子也完全电离,这样电离出的氢离子可以抑制铵根离子的水解,即铵根离子完全电离加上受抑制的水解
3,再次是NH4Cl,即铵根离子完全电离加铵根正常的水解
4,接着是NH4HCO3,铵根离子完全电离,这里注意因为HCO3-水解程度大于电离,为了方便我们就只考虑水解,不影响结论,HCO3- + H2O ==可逆== H2CO3 + OH-(碳酸氢根的水解),这里的OH-离子促使铵根离子的水解,使铵根离子浓度降低,即铵根离子完全电离加上铵根受促进的水解(这里实际上是双水解)
5,最小的是NH3•H2O,只有它是弱电解质,电离出的铵根离子浓度小的可怜,远远远远小于上面4种物质
综上:(NH4)2SO4大于NH4HSO4大于NH4Cl大于NH4HCO3大于NH3•H2O
溶液PH的大小:
1,这里NH3•H2O是弱碱,PH最大无疑问
2,NH4HSO4中H+完全电离,呈酸性,PH最小无疑问
好了我们再看剩下的3种物质:NH4Cl,NH4HCO3,(NH4)2SO4
3,NH4Cl和(NH4)2SO4同为强酸弱碱盐,(NH4)2SO4中铵根离子浓度较大,水解程度也就更大,水解得到的H+浓度更大酸性更强,PH更小
即PH:NH3•H2O大于NH4Cl大于(NH4)2SO4大于NH4HSO4
4,还剩下NH4HCO3,NH4HCO3和NH4Cl相比,Cl-在水中不变而HCO3-在水中水解大于电离,考虑水解,产生OH-,则NH4HCO3碱性更强,PH更大
综上:PH:NH3•H2O大于NH4HCO3大于NH4Cl大于(NH4)2SO4大于NH4HSO4
说了好多,
亲!1年前查看全部
- 亚硝酸钠和氯化铵常温下能否反应
 stormzhe1年前2
stormzhe1年前2 -
 舒舒88888 共回答了19个问题
舒舒88888 共回答了19个问题 |采纳率89.5%这个反应在常温下进行得相当缓慢,通常是在加热的条件下进行.
NO2- + NH4+ = 2H2O + N2↑
这是实验室制取氮气的方法.1年前查看全部
- 在氯气与氨气反应生成氯化铵和氮气,若有21.3可氯气与足量的氨气反应,试求
在氯气与氨气反应生成氯化铵和氮气,若有21.3可氯气与足量的氨气反应,试求
(1)有多少克氨气被氧化
(2)生成氧化产物多少克?
请告诉我答案及解题过程!谢谢! Frog5111年前1
Frog5111年前1 -
 红茶-ESSE 共回答了20个问题
红茶-ESSE 共回答了20个问题 |采纳率90%3Cl2+8NH3===6NH4Cl+N2
213------------------28-----被氧化氨34
21.3--------------X------------------Y
X=2.8G
Y=3.4G1年前查看全部
- 向少量Mg(OH)2固体中加饱和氯化铵或醋酸铵溶液,固体完全溶解,用平衡移动原理解释
 shang1112221年前3
shang1112221年前3 -
 lalala_j 共回答了11个问题
lalala_j 共回答了11个问题 |采纳率90.9%答:Mg(OH)2 ↔Mg2++2OH¯
加入饱和NH4Cl后,NH4+结合OH¯,使OH¯浓度减小,平衡右移,所以Mg(OH)2溶解.
加入NH4Ac后,NH4+结合OH¯,使OH¯浓度减小,平衡右移,所以Mg(OH)2溶解.1年前查看全部
- 八水合氢氧化钡与氯化铵反应的化学方程式
 EzNc战1年前3
EzNc战1年前3 -
 weigy 共回答了19个问题
weigy 共回答了19个问题 |采纳率89.5%八水合氢氧化钡与氯化铵反应的化学方程式
Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
如果本题有什么不明白可以追问,1年前查看全部
- 氯化铵和硫酸铵的水解平衡常数一样吗
氯化铵和硫酸铵的水解平衡常数一样吗
计算方法一样吗orz?
还是说因为c(NH4+)不同有K1^2=K2的关系orz
 alpinehill1年前1
alpinehill1年前1 -
 嘴唇有点厚 共回答了16个问题
嘴唇有点厚 共回答了16个问题 |采纳率81.3%二者水解常数不一样1年前查看全部
- 【材料Ⅰ】实验室常用加热氯化铵固体和氢氧化钙粉末的方法来制取氨气(NH3),它是一种无色,有刺激性气味,极易溶于水,密度
【材料Ⅰ】实验室常用加热氯化铵固体和氢氧化钙粉末的方法来制取氨气(NH3),它是一种无色,有刺激性气味,极易溶于水,密度比空气小的气体.
【材料Ⅱ】实验室常用锌粒和稀硫酸在常温下反应制取氢气(H2),它是一种无色,无味,难溶于水的气体.相同条件下氢气是密度最小的气体.
【问题Ⅰ】:研究实验室制取气体的发生装置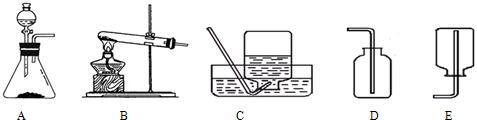
(1)实验室制取NH3的发生装置是______,可以选择与______(KMnO4制取O2,H2O2制取O2,制取CO2)相同的装置,原因是______;
(2)实验室制取H2的发生装置是______,可以选择与______(KMnO4制取O2,H2O2制取O2,制取CO2)相同的装置,原因是______.
(3)总结:实验室制取气体选择发生装置的依据是______.
【问题Ⅱ】:研究实验室制取气体的收集装置
(1)NH3的收集装置是______,原因是______.
(2)H2的收集装置是______,原因是______.
(3)总结:实验室制取气体选择收集装置的依据是______. loveni13141年前1
loveni13141年前1 -
 zhuzhumylove 共回答了19个问题
zhuzhumylove 共回答了19个问题 |采纳率89.5%解题思路:【问题Ⅰ】(1)实验室制取氨气、利用高锰酸钾制取氧气都需要加热,反应物都是固体;(2)实验室制取氢气、制取二氧化碳、利用过氧化氢制取氧气都不需要加热,反应物是固体和液体;(3)实验室制取气体选择发生装置时,要考虑反应物的状态、反应条件;【问题Ⅱ】(1)根据氨气的性质可以选择收集的方法;(2)根据氢气的性质可以选择收集的方法;(3)实验室制取气体选择收集装置时,要考虑气体的水溶性、密度.【问题Ⅰ】
(1)实验室制取氨气需要加热,应该用B装置作为发生装置,可以选择与高锰酸钾制取氧气相同的装置,原因是反应物是固体,需要加热.
故填:B;KMnO4制取O2;反应物是固体,需要加热.
(2)实验室制取氢气不需要加热,应该用A装置作为发生装置,可以选择与过氧化氢制取氧气、制取二氧化碳相同的装置,原因是反应物是液体和固体,不需要加热.
故填:A;H2O2制取O2,制取CO2;反应物是液体和固体,不需要加热.
(3)实验室制取气体选择发生装置的依据是反应物状态和反应条件.
故填:反应物状态和反应条件.
【问题Ⅱ】
(1)氨气极易溶于水,不能用排水法收集,密度比空气小,可以用向下排空气法收集,即用E装置收集.
故填:E;氨气的密度比空气小.
(2)因为氢气不溶于水,可以用排水法收集,即用C装置收集,密度比空气小,可以用向下排空气法收集,即用E装置收集.
故填:C或E;不溶于水或密度比空气小.
(3)实验室制取气体选择收集装置的依据是水溶性和密度.
故填:水溶性和密度.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取气体的思路;实验室制取氧气的反应原理;氢气的制取和检验.
考点点评: 选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、密度、能否和空气中的物质发生化学反应等因素.1年前查看全部
- 请问在化学镍配方中柠檬酸钠是络合剂吗?氯化铵是铵盐吗?氯化铵是络合剂还是缓冲剂?
 阿青老姐1年前1
阿青老姐1年前1 -
 plwang 共回答了13个问题
plwang 共回答了13个问题 |采纳率100%请问在化学镍配方中柠檬酸钠是络合剂吗?----------是
氯化铵是铵盐吗?----------是
氯化铵是络合剂还是缓冲剂?---------不是络合剂,一般与氨水混合,可以形成缓冲溶液1年前查看全部
- (2014•顺德区二模)实验室有三瓶化肥未贴标签,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素
(2014•顺德区二模)实验室有三瓶化肥未贴标签,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种,为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如下实验(此处箭头表示得出实验结论)

根据上述实验,下列说法不正确的是( )
A.三种化肥中,尿素的含氮量最高
B.B物质为碳酸氢铵
C.常温下如要鉴别B、C两种样品,能能采取闻气味的方法
D.如果实验Ⅱ中B、C两种样品没有另取,则会使检验结果不准确 wlh751年前1
wlh751年前1 -
 eruyhrts 共回答了17个问题
eruyhrts 共回答了17个问题 |采纳率88.2%解题思路:A、根据三种肥料的含氮量考虑;B、根据碳酸氢铵与盐酸反应产生二氧化碳,氯化铵与盐酸不反应分析;C、根据碳酸氢铵易分解产生有刺激性气味气体分析;D、根据碳酸氢根离子与酸反应生成二氧化碳考虑;A、NH4Cl中氮元素的质量分数=[14/58.5]×100%=26.2%;NH4HCO3中氮元素的质量分数=[14/79]×100%=17.7%;CO(NH2)2中氮元素的质量分数=[28/60]×100%=46.7%故A说法正确;
B、因为碳酸氢铵与盐酸反应产生氯化铵、水、二氧化碳,氯化铵与盐酸不反应,所以B物质为碳酸氢铵,故B说法正确;
C、因为碳酸氢铵、氯化铵都是铵态氮肥,但是碳酸氢铵能分解,而氯化铵常温不分解.所以能采取闻气味的方法鉴别,C说法正确;
D、碳酸氢铵与盐酸反应产生氯化铵、水、二氧化碳,氯化铵与盐酸不反应,所以只要含有碳酸氢铵和氯化铵就能通过加入盐酸鉴别开,故D说法错误.
故选D.点评:
本题考点: 铵态氮肥的检验.
考点点评: 本题主要是考查了铵态氮肥的检验和碳酸氢根离子与酸反应产生气体,应熟悉物质之间的化学反应及反应的现象,能利用现象来确定物质.1年前查看全部
- 0.5MOL/L氯化铵的PH值是多少?给出氨水的电离常数是K1.
 heixingjie1年前1
heixingjie1年前1 -
 非繁 共回答了20个问题
非繁 共回答了20个问题 |采纳率90%c(H+) = [ Kh* c(NH4+) ] ^1/2
= [ (Kw / K1)* 0.5 ] ^1/2
= [ 10^-14/ 1.77*10^-5]^1/2
= 2.38 *10^-5
pH = 4.61年前查看全部
- 含八个水分子的氢氧化钡晶体与氯化铵晶体反应的方程式
 greenli1年前1
greenli1年前1 -
 kristofic 共回答了15个问题
kristofic 共回答了15个问题 |采纳率93.3%Ba(OH)2.8H2O + 2NH4Cl = BaCl2 + 2NH3(^) + 10H2O
方程式上不用写条件:玻璃棒搅1年前查看全部
- 带8个结晶水的氢氧化钡与氯化铵反应是什么能转化为什么能?
 爱喝七喜的猫1年前2
爱喝七喜的猫1年前2 -
 maydayzhang125 共回答了23个问题
maydayzhang125 共回答了23个问题 |采纳率100%BA(OH)2.8H2O+2NH4CL=BACL2+NH3+10H2O主要是生成氨气促进反应转化1年前查看全部
- 次氯酸钙和二氧化碳的反应 二氧化硫和氧化钙的反应 氯化铵和氢氧化钙的反应 一氧化
次氯酸钙和二氧化碳的反应 二氧化硫和氧化钙的反应 氯化铵和氢氧化钙的反应 一氧化
二氧化氮和氨气反应 硝酸钠和浓硫酸反应 碳酸钙和氢氧化钙反应 碳酸钠和二氧化硅反应 硅酸钠和盐酸反应 硅酸钠和二氧化碳反应 的化学方程式 如果有原因的话下解释一 rswto生活频道1年前1
rswto生活频道1年前1 -
 路人love 共回答了19个问题
路人love 共回答了19个问题 |采纳率78.9%次氯酸钙在有水条件下与二氧化碳反应,因为碳酸的酸性强于次氯酸:Ca(ClO)2+H2O+CO2=CaCO3+2HClO
氧化钙与二氧化硫,酸性氧化物和碱性氧化物反应产生盐CaO+SO2=CaSO3
氯化铵和氢氧化钙,铵盐与强碱反应产生氨气2NH4Cl+Ca(OH)2=CaCl2+2NH3+2H2O
氨气与二氧化氮发生归中反应产生氮气8NH3 + 6NO2 = 7N2 + 12H2O
硝酸钠和浓硫酸,加热反应,由高沸点酸制低沸点酸得到硝酸,但硝酸容易受热分解,因此得到的硝酸不会很纯净2NaNO3+H2SO4=2HNO3+Na2SO4
碳酸钙和氢氧化钙不会反应,碳酸钠与氢氧化钙反应产生氢氧化钠,因为有碳酸钙沉淀生成Na2CO3+Ca(OH)2=2NaOH+CaCO3
碳酸钠和二氧化硅在高温下反应产生硅酸钠,因为另一产物二氧化碳是挥发性的Na2CO3+SiO2=Na2SiO3+CO2
硅酸钠和盐酸,强酸制弱酸得到原硅酸沉淀Na2SiO3+2HCl+H2O=H4SiO4+2NaCl
硅酸钠和二氧化碳在溶液中反应,碳酸酸性强于硅酸,因此产生原硅酸沉淀Na2SiO3+2H2O+CO2=Na2CO3+H4SiO41年前查看全部
- (2011•福州)氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )
 (2011•福州)氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )
(2011•福州)氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )
A.60℃时,硝酸钾的溶解度小于氯化铵的溶解度
B.40℃的硝酸钾饱和溶液降低温度会变为不饱和溶液
C.t℃时,氯化铵饱和溶液与硝酸钾饱和溶液的溶质的质量分数相等
D.60℃时,100g水中加入120g硝酸钾,充分搅拌,得到的是硝酸钾不饱和溶液 nalan_yc1年前1
nalan_yc1年前1 -
 阳光kk 共回答了17个问题
阳光kk 共回答了17个问题 |采纳率82.4%解题思路:根据物质的溶解度曲线,分析判断:60℃时,两种物质的溶解度大小;根据硝酸钾溶解度随温度变化而变化的情况判断溶液是否饱和;比较两物质在同一温度时的饱和溶液中溶质的质量分数;A、60℃时,硝酸钾的溶解度大于氯化铵的溶解度,故A错误.
B、硝酸钾的溶解度随着温度的降低而减小,故40℃的硝酸钾饱和溶液降低温度仍为饱和溶液,故B错误.
C、t℃时,氯化铵和硝酸钾两物质的溶解度相等,故氯化铵饱和溶液与硝酸钾饱和溶液的溶质的质量分数相等;故C正确.
D、60℃时,硝酸钾的溶解度为110g,故100g水中加入120g硝酸钾,充分搅拌,只能溶解110g,得到的是硝酸钾的饱和溶液;故D错误.
故选C.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.1年前查看全部
- 氯化铵与硝酸银反应,溶液的温度是否会下降
氯化铵与硝酸银反应,溶液的温度是否会下降
还有,用稀硝酸酸化硝酸银是否能防止硝酸银见光分解? 流长莱1年前6
流长莱1年前6 -
 卖驴的花丫 共回答了25个问题
卖驴的花丫 共回答了25个问题 |采纳率88%氯化铵溶于水是吸热的 但是生成沉淀是放热的 就反应本身而言放热(不考虑溶解)
确实不会见光分解 但是当硝酸消耗完了 就会分解 这个方法的实质是硝酸与分解出来的银反应1年前查看全部
- 氯化铵与熟石灰共热的方程式
 蓝色加菲猫1年前3
蓝色加菲猫1年前3 -
 wyg2620 共回答了23个问题
wyg2620 共回答了23个问题 |采纳率82.6%2NH4Cl+Ca(OH)2=(加热)==CaCl2+2NH3↑+2H2O
含有NH4+的和OH-反应都会放出NH3和H2O1年前查看全部
- 氯化钠、硝酸钾、氯化铵、碳酸铵、尿素、属于盐类的是什么
氯化钠、硝酸钾、氯化铵、碳酸铵、尿素、属于盐类的是什么
如题 牛肉兔九1年前1
牛肉兔九1年前1 -
 天地无心 共回答了16个问题
天地无心 共回答了16个问题 |采纳率87.5%氯化钠、硝酸钾、氯化铵、碳酸铵属于盐类1年前查看全部
- 能否用熟石灰鉴别氯化铵和氯化钾
 裙子睡着1年前1
裙子睡着1年前1 -
 btql9370 共回答了19个问题
btql9370 共回答了19个问题 |采纳率94.7%可以
和氯化铵反应有刺激性气味气体生成
和氯化钾不反应1年前查看全部
- (2014•福州模拟)下列数据是氯化钠和氯化铵固体在不同温度时的溶解度.
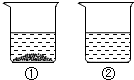 (2014•福州模拟)下列数据是氯化钠和氯化铵固体在不同温度时的溶解度.
(2014•福州模拟)下列数据是氯化钠和氯化铵固体在不同温度时的溶解度.
(1)医疗上,氯化钠常用于配制0.9%的生理盐水,生理盐水中溶质为______.温度/℃ 0 20 40 60 80 100 溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8 NH4Cl 29.4 37.2 45.8 55.2 65.6 77.3
(2)从海水中提取食盐通常采取晾晒海水的方法,这是因为随温度升高氯化钠的溶解度变化______(填“大”或“小”).
(3)20℃时,向100g水中加入25g氯化钠,充分溶解后,溶液中溶质质量分数为______.
(4)现有200g溶质质量分数为10%的氯化钠溶液,若使溶液的溶质质量分数增加一倍,应该蒸发掉______ g水.
(5)30℃时,向两个分别盛有相同质量的氯化钠和氯化铵的烧杯中,各加入100g水,充分溶解后,恢复至30℃,其结果如图所示.有关下列说法中,正确的是______(填字母序号).
A.烧杯②中溶液是不饱和溶液
B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
C.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
D.将得到的烧杯②中溶液降温至0℃时,溶液中溶质质量分数一定减小. airaaaa1年前1
airaaaa1年前1 -
 sy182838 共回答了12个问题
sy182838 共回答了12个问题 |采纳率83.3%解题思路:(1)根据溶质的判断方法考虑;(2)根据氯化钠的溶解度数值变化考虑;(3)根据溶质质量分数的计算考虑;(4)根据蒸发水溶质不变列等式;(5)根据饱和溶液和不饱和溶液的判断和相互转化方法,溶质质量分数的计算方法考虑.(1)0.9%的生理盐水,是氯化钠溶于水形成的,溶质是氯化钠,溶剂是水;(2)由表中氯化钠溶解度数值的变化可知温度对氯化钠的溶解度的影响较小;(3)在20℃时,氯化钠的溶解度为36g,所以向100g水中加入25g氯化钠...
点评:
本题考点: 固体溶解度的影响因素;结晶的原理、方法及其应用;溶液、溶质和溶剂的相互关系与判断;饱和溶液和不饱和溶液;有关溶质质量分数的简单计算.
考点点评: 解答本题的关键是要通过表中数据分析出有晶体析出的是氯化钠,再根据溶解度可知它们放入的质量大于36g,再进行分析.1年前查看全部
- 在100ml 0.2mol/L 的氯化锰溶液中加入100ml 含氯化铵的0.01mol/L的氨水,计算氨水中含有多少氯化
在100ml 0.2mol/L 的氯化锰溶液中加入100ml 含氯化铵的0.01mol/L的氨水,计算氨水中含有多少氯化铵才不至生成氢氧化锰沉淀?
已知:氢氧化锰的Ksp=4*10^-14,氨水的Kb=1.8*10^-5
7克,按您的计算好像不对……
请问平衡时[Mn2+]是0.1mol/L吗?铵根应该抑制氨水的电离啊,这是湖南师大的《奥赛经典》上的一道题,我太傻…… woxiangzuoxingnu1年前1
woxiangzuoxingnu1年前1 -
 迈克儿唐僧 共回答了21个问题
迈克儿唐僧 共回答了21个问题 |采纳率95.2%[Mn2+][OH-]^2=Ksp=4*10^-4
等体积混合:[Mn2+]=0.1mol/L ; [OH-]=(4*10^-3)^1/2
[OH-]{NH4+}/[NH3]=Kb=1.8*10^-5
[OH-]=(4*10^-3)^1/2 ;[NH3]=0.005 mol/L
[NH4+] =(0.005*1.8*10^-5)/(4*10^-3)^1/2
含有2[NH4+]的NH4Cl.1年前查看全部
- 用硫酸铵,氯化铵和氯化钾怎么制出硫酸钾
 心态平常1年前3
心态平常1年前3 -
 zxcvoas0df9809as 共回答了9个问题
zxcvoas0df9809as 共回答了9个问题 |采纳率100%根据这三种盐的性质,硫酸铵是强酸弱碱盐,水解加热后,NH4(+)会以NH3形式挥发出去;
氯化铵是强酸弱碱盐,但水解加热后,NH4(+)会以NH3形式挥发出去,Cl(-)也会以HCl形式挥发出去;
氯化钾是强酸强碱盐,它不水解,只电离,电离出K(+),Cl(-)
选择硫酸铵和氯化钾,溶解于水中加热搅拌,便于NH4(+)和Cl(-)挥发出去,就能制得硫酸钾了1年前查看全部
- 在允许加热的条件下,只用一种试剂就可以鉴别硫酸铁,硫酸亚铁,硫酸钠,氯化铝,氯化铵五种溶液,这种试剂是?
在允许加热的条件下,只用一种试剂就可以鉴别硫酸铁,硫酸亚铁,硫酸钠,氯化铝,氯化铵五种溶液,这种试剂是?
A 硝酸银溶液 B 氯化钡溶液 C氨水 D氢氧化钠溶液
我想问为什么B不可以,硫酸铁和硫酸亚铁可以直接看出,氯化铵加热就可以看出,硫酸钠和氯化铝不可以用B直接鉴别嘛 啸弘1年前3
啸弘1年前3 -
 yo727yo 共回答了15个问题
yo727yo 共回答了15个问题 |采纳率80%氯化铵是不会受热分解的,需要加入氢氧化钠1年前查看全部
- 题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
最终分别要得到氯化铵和硫酸铵,提示是用溶解性,我不知道具体的, haifeng5321年前2
haifeng5321年前2 -
 yang_cheng7261 共回答了22个问题
yang_cheng7261 共回答了22个问题 |采纳率81.8%查找一下在不同温度下两种物质的溶解度,找一个合适的温度可以分离出两种物质的晶体!1年前查看全部
- 请写出三种不同的鉴别氯化铵和硫酸钾的方法
 hong09301年前1
hong09301年前1 -
 糖妖 共回答了13个问题
糖妖 共回答了13个问题 |采纳率84.6%氯化钡
硝酸银
氢氧化钠1年前查看全部
- 向氢氧化钙悬浊液中加碳酸钠或氯化铵,溶液变澄清为什么是错的?
 乱世孤雁1年前2
乱世孤雁1年前2 -
 钝感 共回答了15个问题
钝感 共回答了15个问题 |采纳率86.7%氢氧化钙可以和碳酸钠反应生成碳酸钙白色沉淀.
方程式:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
2NH4Cl+Ca(OH)2===2NH4OH+CaCl21年前查看全部
- 物质的量相同的氨水和氯化铵混合液中,氨水电离能力大于铵根的水解能力,氨水和氢氧根还有铵根的浓度怎样
 zhou_ho1年前2
zhou_ho1年前2 -
 我不是风芝 共回答了11个问题
我不是风芝 共回答了11个问题 |采纳率90.9%因为氨水电离(呈碱性)能力大于铵根的水解(呈酸性)能力,所以溶液呈碱性,即c(H+)c(Cl-).
又c(NH4+)+c(NH3.H2O)=2c(Cl-),所以c(NH4+)>c(NH3.H2O).
无论是氨水电离还是铵根水解都是很微弱的,所以c(OH-)是三者中最小的.
综上所述:c(NH4+)>c(NH3.H2O)>c(OH-)1年前查看全部
- 氯化铵与氢氧化钠混合固体受热
 上来丢个图1年前1
上来丢个图1年前1 -
 懒人MM 共回答了30个问题
懒人MM 共回答了30个问题 |采纳率90%NH4Cl +NaOH ===加热==NaCl +H2O+NH3气体1年前查看全部
- 1:氯化铵固体加热再通过氢氧化钙出去氯化氢制氨气 为什么不可以?
1:氯化铵固体加热再通过氢氧化钙出去氯化氢制氨气 为什么不可以?
2:干燥氨气不用浓硫酸无水氯化钙硫酸铜 为什么?
3:收集氨气为防止倒吸,加入四氯化碳 为什么? 虎儿乖1年前0
虎儿乖1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 硫酸铵,碳酸氢铵,醋酸铵和氯化铵的PH大小
 圣斗士-一辉1年前4
圣斗士-一辉1年前4 -
 lyhabcde 共回答了15个问题
lyhabcde 共回答了15个问题 |采纳率100%碳酸氢铵>醋酸铵>氯化铵>硫酸铵1年前查看全部
大家在问
- 1根据短文内容,从短文后的七个选项中选出能填入空白处的最佳选项.选项中有两项为多余选项.
- 2这个怎么改为转述句?他笑着对我说:“让我看看你的马草.”
- 3空白的深层含义如题,请问空白有哪几层意思?呵呵
- 41 You are a newcomer,aren't you?2 What year are you in?3 I'm
- 5阅读短文,完成练习。 女娲补天 在很早很早以前,天地间突然发生了一场大灾难:天柱折断,地面破裂,洪水滚滚,烈火熊熊。
- 6下面关于水电解实验的叙述正确的是( )
- 7下列错误不能通过试算平衡发现的( ).
- 8已知角a的终边过点(-3,4),求cos (a +丌/3)的值.
- 91.将4.6克某物质在O2中充分燃烧生成8.8gCO2和5.4g的H2O.由此可判断( )
- 10在看见他第一面时,我就爱上了他翻译
- 11He is very busy at the m___.You can come to see him an hour
- 12设方程2cos2x+4(a-1)sinx-4a+1=0,在0≤x
- 13一个正方形水池的四周等距离栽树,四个角上都要栽1棵,共栽树152棵,那么每边栽树多少棵?快,今天九点以前
- 14这个由强到弱怎么排?原理呢?跟Ka有关系么?顺便问下Ka值怎么求啊?
- 15角的3个高中,在外部的最多有2条.为什么
