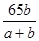以辉铜矿(Cu 2 S)为原料冶炼铜,其反应原理可表示为:Cu 2 S+O 2 高温 .
 你个rr2022-10-04 11:39:541条回答
你个rr2022-10-04 11:39:541条回答 以辉铜矿(Cu 2 S)为原料冶炼铜,其反应原理可表示为:Cu 2 S+O 2
下列说法不正确的是( )
|

已提交,审核后显示!提交回复
共1条回复
 meichuo 共回答了13个问题
meichuo 共回答了13个问题 |采纳率92.3%- A.该反应Cu 2 S+O 2
高温
.
2Cu+SO 2 中,硫元素化合价由-2价变为+4价,氧元素化合价由0价变为-2价,铜元素化合价由+1价变为0价,所以化合价发生变化的元素是3种,故A正确;
B.该反应中硫元素化合价由-2价变为+4价,铜元素化合价由+1价变为0价,所以Cu 2 S既是氧化剂又是还原剂,故B正确;
C.铜元素化合价从+1价变化为0价,硫元素化合价从-2价变化为+4价,氧元素化合价从 0价变化为-2价,依据电子守恒得到:当1 mol O 2 参加反应时,共转移6mole - ,故C错误;
D.二氧化硫被分离、回收后氧化生成SO 3 ,三氧化硫和水反应生成硫酸,所以可以作为制取硫酸的原料,故D正确;
故选C. - 1年前
相关推荐
- (2005•广州)辉铜矿的主要成分是Cu2S,Cu2S中Cu元素的质量分数是______;现有含Cu2S 35
(2005•广州)辉铜矿的主要成分是Cu2S,Cu2S中Cu元素的质量分数是______;现有含Cu2S 35%的辉铜矿石5t.最多能够冶炼出金属铜______t.
 夜叉hh了1年前1
夜叉hh了1年前1 -
 唯薆KIMI 共回答了19个问题
唯薆KIMI 共回答了19个问题 |采纳率84.2%解题思路:(1)根据Cu2S的Cu元素的原子量和Cu2S的中各元素原子的相对原子质量总和来计算Cu2S中Cu元素的质量分数(某元素的质量分数=[该元素的相对原子质量×原子个数/化合物的相对分子质量]×100%);
(2)辉铜矿石中铜元素全部来自于辉铜矿石中的主要成分Cu2S.因此,若知道了主要成分Cu2S 的质量就可以得到辉铜矿石中的铜元素的质量;然后根据铜元素在炼出的Cu2S 中的质量分数即可求得冶炼出来的铜的质量.(1)Cu2S中Cu元素的质量分数=[2×64/2×64+32]×100%=80%;
(2)辉铜矿石中Cu2S的质量=5t×35%=1.75t;
辉铜矿石中Cu元素的质量=1.75×80%=1.4t;
故本题的答案:
(1)80%;
(2)1.4.点评:
本题考点: 含杂质物质的化学反应的有关计算;元素的质量分数计算.
考点点评: 利用化学式计算组成物质的各元素的质量比.根据化学式先计算出物质中所含元素各自的相对原子质量总和,依据相对原子质量总和列出比例式.1年前查看全部
- 全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+
全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2
2Cu+SO2下列说法正确的是( )高温 .
A.该反应中Cu2S只是还原剂
B.每生产1molCu需转移2mol电子
C.该反应中Cu2S既是氧化剂又是还原剂
D.若用该反应生产铜,全世界每年产生的SO2的体积 为1.4×106L 明日qq1年前1
明日qq1年前1 -
 红康乃馨 共回答了17个问题
红康乃馨 共回答了17个问题 |采纳率88.2%解题思路:Cu2S+O2
2Cu+SO2中,Cu元素的化合价由+1价降低为0,O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,以此来解答.高温 .A.因Cu元素的化合价降低,S元素的化合价升高,则Cu2S既是还原剂又是氧化剂,故A错误;
B.每生产1molCu,0.5molS失去电子,需转移0.5mol×[4-(-2)]=3mol电子,故B错误;
C.Cu元素的化合价降低,S元素的化合价升高,则Cu2S既是还原剂又是氧化剂,故C正确;
D.全世界每年铜的产量为8×106t,由反应可知,Cu、SO2的物质的量比为2:1,以此可计算其物质的量,但状况未知,不能计算其体积,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子数目的考查,选项D为易错点,题目难度不大.1年前查看全部
- 赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合物加热有以下反应发生:2Cu2O+Cu2S
赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合物加热有以下反应发生:2Cu2O+Cu2S
6Cu+SO2↑,填写下列空白:△ .
①在该反应中,氧化剂是______.还原剂是______.
②氧化产物与还原产物的质量比是______. 叫我小公主1年前1
叫我小公主1年前1 -
 xiao0z 共回答了18个问题
xiao0z 共回答了18个问题 |采纳率83.3%解题思路:该反应2Cu2O+Cu2S
6Cu+SO2↑中,Cu元素化合价由+1价变为0价,S元素化合价由-2价变为+4价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化产物是SO2、还原产物是Cu.△ .①该反应2Cu2O+Cu2S
△
.
6Cu+SO2↑中,Cu元素化合价由+1价变为0价,S元素化合价由-2价变为+4价,所以氧化剂是Cu2O、Cu2S,还原剂是Cu2S,故答案为:Cu2O、Cu2S;Cu2S;
②氧化产物是SO2、还原产物是Cu,根据方程式知,氧化产物和还原产物的物质的量之比为1:6,故答案为:1:6.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确物质中元素化合价是解本题关键,再结合基本概念解答即可,注意Cu2O、Cu2S中Cu元素为+1价,为易错点.1年前查看全部
- 4)自然界中当胆矾矿与黄铁矿(FeS2二硫化亚铁)相遇时会缓慢发生下列反应产生辉铜矿.对反应:14CuSO4+ 5FeS
4)自然界中当胆矾矿与黄铁矿(FeS2二硫化亚铁)相遇时会缓慢发生下列反应产生辉铜矿.对反应:14CuSO4+ 5FeS2 +12H2O==7Cu2S+5FeSO4+12H2SO4
被氧化的硫和被还原的硫的质量比为 ma甲1年前0
ma甲1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 求菱铁矿、黄铜矿、辉铜矿的主要成分的化学表达式
 喵基1年前2
喵基1年前2 -
 zhhy07 共回答了17个问题
zhhy07 共回答了17个问题 |采纳率76.5%菱铁矿FeCO3、黄铜矿CuFeS2、辉铜矿Cu2S1年前查看全部
- 孔雀石 赤铜矿 辉铜矿 最好选那种冶炼铜
 philpszj1年前2
philpszj1年前2 -
 falcon8305 共回答了25个问题
falcon8305 共回答了25个问题 |采纳率92%孔雀石 CuCO3·Cu(OH)2 铜的质量分数57.7%
赤铜矿 Cu2O 铜的质量分数 88.9%
辉铜矿 Cu2S 铜的质量分数 80%
选择赤铜矿.含铜最多1年前查看全部
- 赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O═6C
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O═6Cu+SO2↑,关于该反应的说法中,正确的是( )
A. 该反应的氧化剂只有Cu2O
B. Cu2S在反应中既是氧化剂,又是还原剂
C. Cu既是氧化产物又是还原产物
D. 每生成19.2gCu,反应中转移1.8mol电子 bvvc3341年前3
bvvc3341年前3 -
 fsrhbs 共回答了25个问题
fsrhbs 共回答了25个问题 |采纳率84%解题思路:A、化合价降低的元素所在的反应物是氧化剂;
B、化合价降低的元素所在的反应物是氧化剂;化合价升高的元素所在的反应物是还原剂;
C、氧化剂对应的是还原产物,还原剂对应的是氧化产物;
D、根据转移电子的量来分析生成的金属铜的量.A、反应Cu2S+2Cu2O═6Cu+SO2↑中,化合价降低的元素是铜元素,所在的反应物Cu2S、Cu2O是氧化剂,故A错误;
B、硫化铜中硫元素化合价升高,铜元素的化合价升高,所以Cu2S在反应中既是氧化剂,又是还原剂,故B正确;
C、反应物Cu2S、Cu2O中硫元素化合价降为金属铜中的0价,金属铜为还原产物,故C错误;
D、反应Cu2S+2Cu2O═6Cu+SO2↑中,化合价升高了6价,转移了6mol电子,生成金属铜6mol,所以每生成19.2g(即0.3mol)Cu,反应中转移0.3mol电子,故D错误.
故选B.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
考点点评: 本题考查学生氧化还原反应中的有关概念和电子转移知识,是一道基本知识题目,难度不大.1年前查看全部
- 关于化学方程式矿物胆矾溶于水下渗时 遇到黄铁矿(FeS2)铜将以辉铜矿(Cu2S)的形式沉积下来 反应得到的铁和硫进入水
关于化学方程式
矿物胆矾溶于水下渗时 遇到黄铁矿(FeS2)铜将以辉铜矿(Cu2S)的形式沉积下来 反应得到的铁和硫进入水溶液 该溶液无臭味 透明不浑浊 绿色呈强酸性俗称“黑水” 上述反应可以用一个方程式来描述 请写出来(配平) 请给出配平的思路
仁兄 不对啊 千黛云兰1年前1
千黛云兰1年前1 -
 尘瞳如水 共回答了13个问题
尘瞳如水 共回答了13个问题 |采纳率100%8H2O+6CuSO4+5FeS2=3Cu2S+5FeS+8H2SO4 应该就是这样的
左边:Cu +2 S (不是SO4里的)-1
右边:Cu降低,S升高化合价.
符合题意,当硫酸浓度低时,无氧化性,不和Fes2反应.1年前查看全部
- 赤铜矿的成分是Cu 2 O,辉铜矿的成分是Cu 2 S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu 2 S+2Cu 2
赤铜矿的成分是Cu 2 O,辉铜矿的成分是Cu 2 S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu 2 S+2Cu 2 O═6Cu+SO 2 ↑,请填写下列空白:
(1)在该反应中,氧化剂是______.
(2)还原剂是______.
(3)氧化产物与还原产物的质量比______. qddxysh1年前1
qddxysh1年前1 -
 琼秋 共回答了17个问题
琼秋 共回答了17个问题 |采纳率82.4%(1)反应Cu 2 S+2Cu 2 O═6Cu+SO 2 ↑中,化合价降低元素是Cu,所在的反应物Cu 2 S、Cu 2 O是氧化剂,故答案为:Cu 2 S、Cu 2 O;
(2)反应Cu 2 S+2Cu 2 O═6Cu+SO 2 ↑中,化合价升高元素是S,所在的反应物Cu 2 S是还原剂,故答案为:Cu 2 S;
(3)氧化剂Cu 2 S、Cu 2 O对应产物Cu是还原产物,还原剂Cu 2 S对应产物SO 2 是氧化产物,氧化产物与还原产物的质量比是1:6,故答案为:1:6.1年前查看全部
- 辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,
辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,
当1mol O2发生反应时,还原剂所失电子的物质的量为 熊圈养小草吧1年前2
熊圈养小草吧1年前2 -
 一个人过得更好 共回答了24个问题
一个人过得更好 共回答了24个问题 |采纳率91.7%氧化剂是氧气,还原剂是Cu2S
还原剂失电子的量,就是氧化剂的电子的量
氧气从0价到-2价
1 mol*4=4 mol1年前查看全部
- 安徽省的铜陵是我国著名“铜都”.该地产的一种矿石叫辉铜矿,其主要成分为硫化亚铜(Cu 2 S).______kg的硫化亚
安徽省的铜陵是我国著名“铜都”.该地产的一种矿石叫辉铜矿,其主要成分为硫化亚铜(Cu 2 S).______kg的硫化亚铜(Cu 2 S)中含有32kg的铜.  深流无语1年前1
深流无语1年前1 -
 邸嘟嘟 共回答了20个问题
邸嘟嘟 共回答了20个问题 |采纳率95%硫化亚铜(Cu 2 S)的质量为:32kg÷(
64×2
64×2+32 ×100%)=40kg
故答案为:401年前查看全部
- (2013•东城区模拟)辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少
(2013•东城区模拟)辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰和碱式碳酸铜.主要工艺流程如下:
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2Mn2+:8.3~9.8Cu2+:4.4~6.4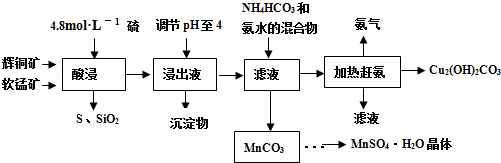
(1)实验室配制250mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要______、______.
(2)酸浸时,为了提高浸取率可采取的措施有______(任写一点).
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等.
写出该反应的化学方程式______.
(4)调节浸出液pH=4的作用是______.
(5)本工艺中可循环使用的物质是______(写化学式).
(6)获得的MnSO4•H2O晶体后常用酒精洗涤,主要目的是______.
(7)用标准的BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有______(任写一种). 文盲小固1年前1
文盲小固1年前1 -
 zhimeilansan 共回答了13个问题
zhimeilansan 共回答了13个问题 |采纳率76.9%解题思路:(1)配制250mL溶液,需要250mL容量瓶,还需要胶头滴管定容;
(2)矿石的颗粒大小、温度及是否搅拌等会影响浸取率;
(3)MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫,生成物是CuSO4、MnSO4、S,反应物是硫酸、二氧化锰和硫化亚铜,根据化合价升降法配平;
(4)氢氧化铁开始沉淀PH=1.5,完全沉淀PH=3.2,Cu2+:开始沉淀是4.4,使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4;
(5)根据工艺流程可以看出,可循环使用的物质是氨气;
(6)MnSO4•H2O晶体在酒精中溶解度小;
(7)晶体失去结晶水,测定硫酸锰晶体的质量分数会大于100%.(1)配制一定物质的量浓度的溶液,必不可少的是容量瓶和胶头滴管,容量瓶要标明规格,本题必须使用250mL容量瓶,
故答案为:250mL容量瓶、胶头滴管;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:粉碎矿石、适当升高温度或者搅拌;
(3)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4 ,生成物是CuSO4、MnSO4、S,
把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4,
Mn元素化合价变化是:4-2=2,
所以二氧化锰化学计量数是2,硫化亚铜的是1,再根据观察法配平其它物质;反应的化学方程式是:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O,
故答案为:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O;
(4)根据金属阳离子生成氢氧化物沉淀的pH范围,使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4,故选择PH=4目的是使Fe3+完全水解生成氢氧化铁沉淀,
故答案为:使Fe3+完全水解生成氢氧化铁沉淀;
(5)工艺流程中,加入了氨水,最后又得到了氨气,NH3 可循环使用,故答案为:NH3 ;
(6)在酒精中,硫酸锰晶体溶解度小,故获得的MnSO4•H2O晶体后常用酒精洗涤,目的是减少MnSO4•H2O晶体的损失,
故答案为:减少MnSO4•H2O晶体的损失;
(7)质量分数大于100%,说明了硫酸锰晶体中可能混有硫酸盐杂质或部分晶体失去结晶水,故答案为:混有硫酸盐杂质或部分晶体失去结晶水.点评:
本题考点: 铜金属及其重要化合物的主要性质;硅和二氧化硅;铁的氧化物和氢氧化物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了硫酸锰晶体的制取,涉及的知识点比较多,可以根据所学知识,合理分析得出正确结论,本题难度中等.1年前查看全部
- 请教,高一化学题.如下:全世界每年铜的产量为8X10^6吨.工业上由辉铜矿生产铜的主要反应为:Cu2S+O2==2Cu+
请教,高一化学题.
如下:全世界每年铜的产量为8X10^6吨.工业上由辉铜矿生产铜的主要反应为:Cu2S+O2==2Cu+SO2↑下列说法正确的是:
A该反应中CU2S只是还原剂
B每生产1MOLCU需转移2MOL电子
C该反应中CU2S既是氧化剂又是还原剂
D若用该反应生产铜,全世界每年产生的SO2体积(标准状况下)约为1.4X10^6L.
请说明一下电子转移情况.谢谢.
不是说氧化还原反应中高价被还原的价态不得低于低价被氧化的价态么? CrazyHE1年前5
CrazyHE1年前5 -
 朵dudo朵 共回答了22个问题
朵dudo朵 共回答了22个问题 |采纳率68.2%Cu从+1变成0,被还原了,Cu2S充当了氧化剂
S从-2变成+4,被氧化了,Cu2SS充当了还原剂
O从0变成了-2,被还原了,O2充当了氧化剂
每生成1molCu,会产生0.5molSO2,转移3mol电子
楼上的说错了.单位应该是克而不是千克.所以还要乘以10^3.
产生的SO2体积(标准状况下)约为1.4X10^12L1年前查看全部
- 赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu
赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O=6Cu+SO2↑,下列对于该反应的说法正确的是( )
A.该反应中的氧化剂只有Cu2O
B.Cu既是氧化产物又是还原产物
C.Cu2S在反应中既是氧化剂又是还原剂
D.氧化产物与还原产物的物质的量之比为6:1 绝望的水是冰1年前1
绝望的水是冰1年前1 -
 cento 共回答了17个问题
cento 共回答了17个问题 |采纳率88.2%解题思路:Cu2S+2Cu2O=6Cu+SO2↑ 中,得电子化合价降低的反应物的氧化剂,失电子化合价升高的反应物是还原剂,氧化剂对应的产物的还原产物,还原剂对应的产物是氧化产物,根据得失电子数相等确定氧化产物和还原产物的物质的量之比.A.反应中,Cu2S和Cu2O中的+1价Cu元素得电子生成0价的Cu,所以Cu2S和Cu2O都是氧化剂,故A错误;
B.反应中,+1价Cu元素得电子生成0价的Cu,所以Cu是还原产物,故B错误;
C.硫化铜中硫元素化合价升高,铜元素的化合价升高,所以Cu2S在反应中既是氧化剂,又是还原剂,故C正确;
D.根据Cu2S+2Cu2O=6Cu+SO2↑知,还原产物和氧化产物的物质的量之比是6:1,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确元素化合价是解本题的关键,注意该题中反应物都是氧化剂,但Cu2S还是还原剂,为易错点.1年前查看全部
- 赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S+2Cu2O
赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S+2Cu2O
6Cu+SO2↑.对于该反应的下列说法正确的是( )△ .
A.该反应中的氧化剂只有Cu2O
B.Cu2O在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为1:6 箐耧男子1年前1
箐耧男子1年前1 -
 漂亮女人123 共回答了21个问题
漂亮女人123 共回答了21个问题 |采纳率90.5%解题思路:反应Cu2S+2Cu2O
6Cu+SO2↑,反应中Cu元素化合价降低,S元素化合价升高,根据元素化合价的变化解答该题.△ .A.Cu2O和Cu2S中Cu元素化合价都降低,都为氧化剂,故A错误;
B.反应中Cu2O只起到氧化剂的作用,故B错误;
C.反应中Cu元素化合价只降低,Cu为还原产物,故C错误;
D.根据方程式可知氧化产物与还原产物的物质的量之比为1:6,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考高频考点,注意从元素化合价变化的角度认识物质表现出的性质,明确元素化合价为解答该题的关键,题目难度不大.1年前查看全部
- 工业上由辉铜矿(主要成分为Cu2S)生产铜的主要反应为Cu2S+O2===2Cu+SO2,则下列说法正确的是:(
工业上由辉铜矿(主要成分为Cu2S)生产铜的主要反应为Cu2S+O2===2Cu+SO2,则下列说法正确的是:(
)
A.Cu2S只做还原剂,O2只做氧化剂
B.Cu2S中Cu的化合价为+2价
C.每生成1molSO2,转移电子6mol
D.每生成2molCu,转移电子2mol donlosie1年前0
donlosie1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2009•黄浦区二模)某工厂以精辉铜矿(主要成份为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
(2009•黄浦区二模)某工厂以精辉铜矿(主要成份为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):2Cu2S+3O2→2Cu2O+2SO22Cu2O+Cu2S→6Cu+SO2
(1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
(3)今将a mol Cu2S 与b mol 空气(氧气约占空气体积的20%)在密闭容器中高温下发生反应,请完成下列表格:
反应后固体
的成分Cu Cu2S、Cu Cu2O、Cu b的取值范围  江南云客1年前1
江南云客1年前1 -
 温筱婷 共回答了16个问题
温筱婷 共回答了16个问题 |采纳率87.5%解题思路:根据反应的化学方程式或关系式,从元素守恒的角度分析并解答.(1)设需精辉铜矿的质量为x,根据元素守恒:
Cu2S--------2Cu
160t 128t
x•80%38.4t
x=[160t×38.4t/128t×80%]=60t
(2)设可生产98%的浓H2SO4的质量为y,根据元素守恒:
Cu2S→2Cu------------→H2SO4
160128 98
38.4×92%×98% y×98%
y=27.05
(3)①反应后固体全部是Cu时,则:
Cu2S+O2=2Cu+SO2
a0.2y
y=5a
②反应后固体为Cu2S、Cu时,氧气不足,则0<b<5a
③反应后固体为Cu2O、Cu,氧气过量,但并没有完全反应生成Cu2O,
根据2Cu2S+3O2→2Cu2O+2SO2
2 3
a 0.2y
y=7.5a
则:5a<b<7.5a
故答案为:
反应后固体的成分 Cu Cu2S、Cu Cu2O、Cu
b的取值范围 b=5a 0<b<5a 5a<b<7.5a点评:
本题考点: 化学方程式的有关计算;化学平衡的计算;金属冶炼的一般原理.
考点点评: 本题考查化学方程式的相关计算,题目难度中等,注意从元素守恒的角度,利用关系式计算.1年前查看全部
- (1)辉铜矿的主要成分为硫化亚铜(Cu2S),其中铜的化合阶是_,铜元素与硫元素的质量比是_.
(1)辉铜矿的主要成分为硫化亚铜(Cu2S),其中铜的化合阶是_,铜元素与硫元素的质量比是_.
(2)孔雀石主要成分为Cu(OH)2CO3,加热时生成三种氧化物,该反应化学方程式为_,反应类型_. maro_12281年前3
maro_12281年前3 -
 joyce_yl 共回答了20个问题
joyce_yl 共回答了20个问题 |采纳率85%(1)CU是+1价的,质量比为(64×2):32=4:1
(2)Cu2(OH)2CO3==加热==2CuO+CO2↑+H2O 你的孔雀石化学式少了一个铜原子哦!这个反应是一个分解反应!1年前查看全部
- 全世界每年铜的产量为8×10 6 t,工业上由辉铜矿(主要成分是Cu 2 S,其中铜元素为+1价)生产铜的主要反应为:C
全世界每年铜的产量为8×10 6 t,工业上由辉铜矿(主要成分是Cu 2 S,其中铜元素为+1价)生产铜的主要反应为:Cu 2 S+O 2

A.该反应中Cu 2 S只是还原剂 B.每生产1molCu需转移2mol电子 C.该反应中Cu 2 S既是氧化剂又是还原剂 D.若用该反应生产铜,全世界每年产生的SO 2 的体积(标准状况)约为1.4×10 6 L  小小微尘风1年前1
小小微尘风1年前1 -
 王晨俊 共回答了22个问题
王晨俊 共回答了22个问题 |采纳率95.5%C
反应中铜的化合价由+1价降至0价,氧由0价降至—2价,硫由—2价升至+4价,电子转移为6个
A:Cu 2 S既是还原剂又是氧化剂
B:每生产1molCu需转移3mol电子
C:正确
D:全世界每年铜的产量为8×10 6 t,即8×10 12 g,由方程式可计算出同时产生SO 2 的体积(标准状况)约为1.4×10 12 L
答案为C1年前查看全部
- 赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O
6Cu+SO2↑,关于该反应的说法中正确的是( )△ .
A.该反应的氧化剂只有Cu2O
B.每生成19.2g Cu,反应中转移0.6mol电子
C.Cu既是氧化产物又是还原产物
D.Cu2S在反应中既是氧化剂,又是还原剂 盛夏剩下sil1年前1
盛夏剩下sil1年前1 -
 ywqg888 共回答了21个问题
ywqg888 共回答了21个问题 |采纳率100%解题思路:反应中Cu元素化合价降低,S元素化合价升高,则反应中Cu2S和Cu2O都表现为氧化性,而Cu2S还表现为还原性.A.反应中Cu元素化合价降低,Cu2S和Cu2O都表现为氧化性,都为氧化剂,故A错误;
B.每生成19.2g Cu,n(Cu)=[19.2g/64g/mol]=0.3mol,转移电子为0.3mol×(1-0)=0.3mol,故B错误;
C.Cu元素化合价只降低,为还原产物,故C错误;
D.反应中Cu元素化合价降低,S元素化合价升高,则Cu2S在反应中既是氧化剂,又是还原剂,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意元素化合价的判断,题目难度不大.1年前查看全部
- 火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
①2CuFeS2+4O2
Cu2S+3SO2+2FeO800℃ .
②2Cu2S+3O2
2Cu2O+2SO21200℃ .
③2Cu2O+Cu2S
6Cu+SO2↑1200℃ .
下列说法正确的是( )
A. 反应②、③中,Cu2S都只做还原剂
B. 1mol CuFeS2生成1molCu,理论上消耗2.5mol O2
C. 1mol Cu2S和O2反应生成2molCu转移的电子数为4mol
D. 反应①中,共转移的电子数为16mol,CuFeS2中铜元素的化合价为+2 moon_男孩1年前1
moon_男孩1年前1 -
 bgszcj 共回答了14个问题
bgszcj 共回答了14个问题 |采纳率100%解题思路:A.②中S元素的化合价升高,O元素的化合价降低;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,以此分析;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价;
D.反应①中,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价升高.A.②中S元素的化合价升高,O元素的化合价降低,Cu2S只做还原剂;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高,Cu2S既是还原剂又是氧化剂,故A错误;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,则1mol CuFeS2生成1molCu,理论上消耗2.5molO2,故B正确;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价,则转移的电子数为1mol×[4-(-2)]=6mol,故C错误;
D.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价,2molCuFeS2反应转移电子为24mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应的计算;氧化还原反应.
考点点评: 本题考查氧化还原反应及计算,明确反应中的元素的化合价变化是解答本题的关键,注意电子守恒、原子守恒的应用,选项D为易错点,题目难度较大.1年前查看全部
- 赤铜矿的主要成分是Cu 2 O,辉铜矿的主要成分是Cu 2 S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu 2 S+2C
赤铜矿的主要成分是Cu 2 O,辉铜矿的主要成分是Cu 2 S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu 2 S+2Cu 2 O═6Cu+SO 2 ↑,关于该反应的说法中,正确的是( ) A.该反应的氧化剂只有Cu 2 O B.Cu 2 S在反应中既是氧化剂,又是还原剂 C.Cu既是氧化产物又是还原产物 D.每生成19.2gCu,反应中转移1.8mol电子  高原之鹰6616011年前1
高原之鹰6616011年前1 -
 liebao08 共回答了19个问题
liebao08 共回答了19个问题 |采纳率84.2%A、反应Cu 2 S+2Cu 2 O═6Cu+SO 2 ↑中,化合价降低的元素是铜元素,所在的反应物Cu 2 S、Cu 2 O是氧化剂,故A错误;B、硫化铜中硫元素化合价升高,铜元素的化合价升高,所以Cu 2 S在反应中既是氧化剂,又是还原...1年前查看全部
- 辉铜矿Cu2S可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,当1mol O2发生反应时,还原剂所失
辉铜矿Cu2S可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,当1mol O2发生反应时,还原剂所失电子的物质的量为
 ss公1年前1
ss公1年前1 -
 非一般遐想 共回答了15个问题
非一般遐想 共回答了15个问题 |采纳率93.3%还原剂失去电子的量=氧化剂得到电子的量
反应中O2是唯一的氧化剂,而1molO2得到4mol电子,因此此时还原剂也失去了4mol电子1年前查看全部
- (2006•荔湾区二模)辉铜矿的主要成分是Cu2S,Cu2S中Cu元素的质量分数是( )
(2006•荔湾区二模)辉铜矿的主要成分是Cu2S,Cu2S中Cu元素的质量分数是( )
A.8%
B.80%
C.4%
D.40% binya20001年前0
binya20001年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2005•海珠区一模)安徽省的铜陵是我国著名“铜都”.该地产的一种矿石叫辉铜矿,其主要成分为硫化亚铜(Cu2S).__
(2005•海珠区一模)安徽省的铜陵是我国著名“铜都”.该地产的一种矿石叫辉铜矿,其主要成分为硫化亚铜(Cu2S).______kg的硫化亚铜(Cu2S)中含有32kg的铜.
 IceHeaven1年前1
IceHeaven1年前1 -
 fish77119 共回答了22个问题
fish77119 共回答了22个问题 |采纳率90.9%解题思路:已知铜元素的质量求硫化亚铜的质量除以铜在硫化亚铜中的质量分数即可硫化亚铜(Cu2S)的质量为:32kg÷([64×2/64×2+32]×100%)=40kg
故答案为:40点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 本题主要考查学生运用质量分数进行计算的能力,属于基础知识的考查,难度不大,但要注意解题步骤的规范性.1年前查看全部
- (16分)辉铜矿是冶炼铜的重要原料。
(16分)辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu 2 S+O 2 =2Cu+SO 2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜: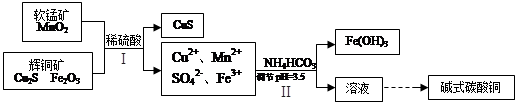
①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是 ;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe 2 O 3 +3H 2 SO 4 =Fe 2 (SO 4 ) 3 +3H 2 O
ii) Cu 2 S+ Fe 2 (SO 4 ) 3 =CuSO 4 +CuS+2FeSO 4
iii)
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过 mol/L。
(已知K sp [(Cu(OH) 2 )]=2×10 -a ) 樱雪舞人1年前1
樱雪舞人1年前1 -
 黄梦龙 共回答了17个问题
黄梦龙 共回答了17个问题 |采纳率100%1年前查看全部
- 高温条件下,辉铜矿(主要成分为Cu 2 S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。
高温条件下,辉铜矿(主要成分为Cu 2 S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。

请回答下列问题:
(1)辉铜矿(Cu 2 S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS 2 )相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO 4 +5FeS 2 +12H 2 O=7Cu 2 S+5FeSO 4 +12H 2 SO 4 ,被氧化的硫和被还原的硫的质量比为 。 互助0ntuzhelp881年前1
互助0ntuzhelp881年前1 -
 似水留鱼 共回答了15个问题
似水留鱼 共回答了15个问题 |采纳率93.3%(1)Cu 2 S+O 2 (适量) 2Cu+SO 2 O 2 和Cu 2 S
2Cu+SO 2 O 2 和Cu 2 S
(2)Cu+2H 2 SO 4 (浓) CuSO 4 +SO 2 ↑+2H 2 O
CuSO 4 +SO 2 ↑+2H 2 O
(3)粗铜 硫酸铜或含Cu 2 + 的盐溶液
(4)3∶7
(1)根据图示,Cu 2 S与O 2 的反应为氧化还原反应,结合B与O 2 的反应条件,可以推断B为SO 2 ,该反应为Cu 2 S+O 2 (适量) 2Cu+SO 2 。反应中Cu、O的化合价降低,因此氧化剂为O 2 和Cu 2 S。(2)B为SO 2 ,则D为SO 3 ,E为H 2 SO 4 。反应②为Cu+2H 2 SO 4 (浓)
2Cu+SO 2 。反应中Cu、O的化合价降低,因此氧化剂为O 2 和Cu 2 S。(2)B为SO 2 ,则D为SO 3 ,E为H 2 SO 4 。反应②为Cu+2H 2 SO 4 (浓)  CuSO 4 +SO 2 ↑+2H 2 O。(3)电解精炼铜时,粗铜作阳极,含Cu 2 + 的盐溶液作电解质溶液。(4)根据化学方程式中硫元素的化合价变化,可知被氧化的硫和被还原的硫的质量比为3∶7。
1年前查看全部
CuSO 4 +SO 2 ↑+2H 2 O。(3)电解精炼铜时,粗铜作阳极,含Cu 2 + 的盐溶液作电解质溶液。(4)根据化学方程式中硫元素的化合价变化,可知被氧化的硫和被还原的硫的质量比为3∶7。
1年前查看全部
- 赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O==6
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O==6Cu+SO2↑
每生成19.2gCu,反应中转移1.8mol电子怎么错了 ftalou1年前1
ftalou1年前1 -
 xcurt 共回答了19个问题
xcurt 共回答了19个问题 |采纳率94.7%显然错了,19.2g铜为0.3mol.得到一个铜原子需转移一个电子,0.3mol铜当然是0.3mol的电子转移了 .(矿石中的为+1价,铜单质为0价)1年前查看全部
- Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分.铜的冶炼过程通常发生反应:Cu2S+Cu2O=6Cu+SO2↑,
Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分.铜的冶炼过程通常发生反应:Cu2S+Cu2O=6Cu+SO2↑,下列有关说法正确的是( )
A.该反应中有三种元素的化合价发生了变化
B.每生成0.1mol Cu,转移0.2 mol 电子
C.Cu2S在反应中既是氧化剂又是还原剂
D.Cu既是氧化产物又是还原产物 野刺梅1年前1
野刺梅1年前1 -
 yiji44 共回答了21个问题
yiji44 共回答了21个问题 |采纳率90.5%解题思路:反应中Cu元素化合价降低,S元素化合价升高,则反应中Cu2S和Cu2O都表现为氧化性,而Cu2S还表现为还原性.A.该反应中Cu元素化合价降低,S元素化合价升高,所以有两种元素化合价变化,故A错误;
B.每生成0.1mol Cu,转移电子=0.1 mol×(1-0)=0.1mol,故B错误;
C.该反应中Cu元素化合价降低,S元素化合价升高,则Cu2S在反应中既是氧化剂,又是还原剂,故C正确;
D.该反应中铜元素化合价降低,所以铜是还原产物,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,注意把握元素的化合价的变化,为解答该题的关键,从化合价变化的角度理解相关概念.1年前查看全部
- 赤铜矿的成分是Cu 2 O,辉铜矿的成分是Cu 2 S,将赤铜矿与辉铜矿混合加热有以下反应: Cu2S +
赤铜矿的成分是Cu 2 O,辉铜矿的成分是Cu 2 S,将赤铜矿与辉铜矿混合加热有以下反应: Cu2S + 2Cu 2 O  6Cu + SO 2 ↑。对于该反应的下列说法正确的是[ ]
6Cu + SO 2 ↑。对于该反应的下列说法正确的是[ ]A.该反应中的氧化剂只有Cu 2 O
B.Cu 2 O在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为1:6 小狐狸爱人1年前1
小狐狸爱人1年前1 -
 oldwall_chen 共回答了24个问题
oldwall_chen 共回答了24个问题 |采纳率91.7%D1年前查看全部
- 赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O═6Cu
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O═6Cu+SO2↑ 下列关于该反应的说法正确的是( )
A.Cu2S在反应中既是氧化剂,又是还原剂
B.Cu既是氧化产物,又是还原产物
C.该反应中氧化剂只有Cu2O
D.每生成19.2g Cu,反应中转移0.6mol电子 荣俊标1年前1
荣俊标1年前1 -
 ksdasda 共回答了16个问题
ksdasda 共回答了16个问题 |采纳率75%解题思路:Cu2S中Cu元素化合价为+1价,S为-2价,Cu2O中Cu元素化合价为+1价,O为-2价,反应Cu2S+2Cu2O═6Cu+SO2↑中,Cu元素化合价降低,S元素化合价升高,以此解答该题.A.Cu2S在反应中Cu元素化合价降低,S元素化合价升高,则Cu2S在反应中既是氧化剂,又是还原剂,故A正确;
B.Cu元素化合价降低,Cu为还原产物,故B错误;
C.反应中Cu2S和Cu2O为氧化剂,故C错误;
D.每生成19.2g Cu,即0.3mol,反应中转移0.3mol×(1-0)=0.3mol电子,故D错误.
故选:A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,侧重于相关概念的考查,为高考高频考点,难度不大,注意从元素化合价的角度认识相关概念和物质的性质.1年前查看全部
- 赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu
赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O=6Cu+SO2↑,下列对于该反应的说法正确的是( )
A. 该反应中的氧化剂只有Cu2O
B. Cu既是氧化产物又是还原产物
C. Cu2S在反应中既是氧化剂又是还原剂
D. 氧化产物与还原产物的物质的量之比为6:1 xzw_52111年前4
xzw_52111年前4 -
 ZLCZLN 共回答了13个问题
ZLCZLN 共回答了13个问题 |采纳率92.3%解题思路:Cu2S+2Cu2O=6Cu+SO2↑ 中,得电子化合价降低的反应物的氧化剂,失电子化合价升高的反应物是还原剂,氧化剂对应的产物的还原产物,还原剂对应的产物是氧化产物,根据得失电子数相等确定氧化产物和还原产物的物质的量之比.A.反应中,Cu2S和Cu2O中的+1价Cu元素得电子生成0价的Cu,所以Cu2S和Cu2O都是氧化剂,故A错误;
B.反应中,+1价Cu元素得电子生成0价的Cu,所以Cu是还原产物,故B错误;
C.硫化铜中硫元素化合价升高,铜元素的化合价升高,所以Cu2S在反应中既是氧化剂,又是还原剂,故C正确;
D.根据Cu2S+2Cu2O=6Cu+SO2↑知,还原产物和氧化产物的物质的量之比是6:1,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确元素化合价是解本题的关键,注意该题中反应物都是氧化剂,但Cu2S还是还原剂,为易错点.1年前查看全部
- 赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生Cu2S+2Cu2O
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生Cu2S+2Cu2O
6Cu+SO2↑,关于该反应的下列说法中,正确的是( )△ .
A.该反应的氧化剂中只有Cu2O
B.Cu既是氧化产物,又是还原产物
C.氧化产物与还原产物的物质的量之比为6:1
D.Cu2S在反应中既是氧化剂,又是还原剂 风萧萧20041年前1
风萧萧20041年前1 -
 147258369 共回答了23个问题
147258369 共回答了23个问题 |采纳率82.6%解题思路:反应中Cu元素化合价降低,S元素化合价升高,则反应中Cu2S和Cu2O都表现为氧化性,而Cu2S还表现为还原性.A.反应中Cu元素化合价降低,Cu2S和Cu2O都表现为氧化性,故A错误;
B.Cu元素化合价只降低,为还原产物,故B错误;
C.氧化产物为SO2,还原产物为Cu,氧化产物与还原产物的物质的量之比为1:6,故C错误;
D.反应中Cu元素化合价降低,S元素化合价升高,则Cu2S在反应中既是氧化剂,又是还原剂,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,注意把握元素的化合价的变化,为解答该题的关键,从化合价变化的角度理解相关概念.1年前查看全部
- 自然界中有赤铜矿(主要成分是Cu2O)、辉铜矿(主要成分是Cu2S)等铜的矿物.
自然界中有赤铜矿(主要成分是Cu2O)、辉铜矿(主要成分是Cu2S)等铜的矿物.
(1)Cu2S中铜元素的质量分数为______.
(2)将赤铜矿(Cu2O)和木炭粉混合后加热到约800℃,生成铜和二氧化碳.反应的化学方程式是C+2Cu2O
4Cu+CO2↑800℃ .C+2Cu2O.
4Cu+CO2↑800℃ .
(3)工业上利用辉铜矿炼铜的一个主要反应是在高温下,辉铜矿(Cu2S)与氧气反应,生成铜和二氧化硫,反应的化学方程式是Cu2S+O2
2Cu+SO2↑高温 .Cu2S+O2.
2Cu+SO2↑高温 . cola3281年前1
cola3281年前1 -
 短暂2004 共回答了30个问题
短暂2004 共回答了30个问题 |采纳率93.3%解题思路:(1)根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析解答.
(2)赤铜矿(Cu2O)和木炭粉混合后加热到约800℃,生成铜和二氧化碳,写出反应的化学方程式即可.
(3)在高温下,辉铜矿(Cu2S)与氧气反应,生成铜和二氧化硫,写出反应的化学方程式即可.(1)Cu2S中铜元素的质量分数为[64×2/64×2+32×100%=80%.
(2)赤铜矿(Cu2O)和木炭粉混合后加热到约800℃,生成铜和二氧化碳,反应的化学方程式为:C+2Cu2O
800℃
.
]4Cu+CO2↑.
(3)在高温下,辉铜矿(Cu2S)与氧气反应,生成铜和二氧化硫,反应的化学方程式为:Cu2S+O2
高温
.
2Cu+SO2↑.
故答案为:(1)80%;(2)C+2Cu2O
800℃
.
4Cu+CO2↑;(3)Cu2S+O2
高温
.
2Cu+SO2↑.点评:
本题考点: 元素的质量分数计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握化学式的有关计算、化学方程式的书写方法是正确解答本题的关键.1年前查看全部
- 31、某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
31、某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
2 Cu2S+3O22Cu2O+2 SO2 2Cu2O+Cu2S6Cu+SO2
(1) 若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(2) 若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?(保留3位小数)
(3) 今将a mol Cu2S与b mol空气(氧气约占空气体积的20%)在密闭容器中高温加热,设反应前容器内的压强为P1,反应结束后冷却到原来的温度,容器内的压强为P2,请完成下列表格:
反应后固体的成分 Cu Cu2S、Cu Cu2O、Cu
b的取值范围
P1与P2的关系
(填>、 法兰西上空的鹰1年前1
法兰西上空的鹰1年前1 -
 dyh1972 共回答了16个问题
dyh1972 共回答了16个问题 |采纳率93.8%31. (1)设需精辉铜矿的质量为x,根据元素守恒:
Cu2S —— 2Cu
160 t 128 t 则x= =60 t
x·80% 38.4 t
(2)设可生产98%的浓H2SO4的质量为y,根据元素守恒:
Cu2S → 2Cu → H2SO4
160 128 98 38.4×92%×98% y×98% y=27.05
(3)
反应后固体
的成分 Cu Cu2S 、Cu Cu2O、 Cu
b的取值范围 b=5a 01年前查看全部
- (2013•德州模拟)铜、硫及其化合物在工业上有着重要的应用.工业上以辉铜矿(主要成分 Cu2S)为原料,采取
(2013•德州模拟)铜、硫及其化合物在工业上有着重要的应用.工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2KJ•mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ•mol-1
(1)反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=______.
(2)SO2气体直接排放会污染大气,对环境造成的后果是______,工业上常用氨水吸收硫酸厂尾气中的SO2,反应的化学方程式为______.
(3)该工艺炼铜的副产品SO2常用于制硫酸,其中重要的一步反应为:2SO2(g)+O2(g)⇌2SO3(g)△H<0
若在一个2L的容器中充入0.4molSO2、0.2molO2和0.4molSO3发生上述反应.
①当反应达到平衡时,各物质的浓度可能是______(选填字母标号).
A.c(SO2)=0.3mol•L-1、c(O2)=0.15mol•L-1
B.c(SO3)=0.4mol•L-1
C.c(SO3)=0.3mol•L-1
D.c(O2)=0.2mol•L-1或c(SO2)=0.4mol•L-1
②对于上述可能的情况,达到平衡时的平衡常数为[20/27]L•mol-1或180L•mol-1[20/27]L•mol-1或180L•mol-1.
③某温度下,若将等体积的SO2和O2混合,达平衡时SO2的转化率为80%,则升高温度时SO2的转化率将______(填“增大“、“减小“或“不变“).
(4)铜和硫直接化合生成Cu2S,Cu2S和CuS都是黑色固体,都能溶于硝酸,它们高温灼烧的产物相同,鉴别CuS和Cu2S的合理方法是______. 风_沙与星星1年前1
风_沙与星星1年前1 -
 闯涯 共回答了20个问题
闯涯 共回答了20个问题 |采纳率80%解题思路:(1)根据盖斯定律进行分析;
(2)SO2+H2O=H2SO3,形成酸雨,会对植物和建筑物造成严重影响;可用氨水吸收;
(3)对于可逆反应反应既可以向正反应进行、也可以向逆反应进行,但是不能完全转化;根据平衡常数公式进行计算;
(4)“高温灼烧的产物相同”,都是CuO,但同质量的两种物质高温灼烧后产物的质量不等.(1)将两个方程式相加得:3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g),△H=-642.2kJ•mol-1,则Cu2S(s)+O2(g)=2Cu(s)+SO2(g),△H=-217.4kJ•mol-1;故答案为:-217.4KJ•mol-1;
(2)SO2+H2O=H2SO3,形成酸雨,会对植物和建筑物造成严重影响;氨水显碱性,与酸性氧化物SO2反应的方程式为:SO2+2NH3+H2O=(NH4)2SO3或SO2+NH3•H2O=NH4HSO3,故答案为:形成酸雨,会对植物和建筑物造成严重影响;SO2+2NH3•H2O=(NH4)2SO3+H2O 或SO2+NH3•H2O=NH4HSO3;
(3)①对于可逆反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,在一个2L的容器中充入0.4molSO2、0.2molO2和0.4molSO3,反应既可以向正反应进行、也可以向逆反应进行,但是不能完全转化,故排除BD;AC皆有可能,故答案为:AC;
②根据AC的平衡浓素及起始浓度,其平衡常数分别为:K1=
c2(SO3)
c2(SO2)•c(O2)=
0.12
0.32×0.15L•mol-1=[20/27]L•mol-1,K2=
c2(SO3)
c2(SO2)•c(O2)=
0.32
0.12×0.05L•mol-1=180L•mol-1,故答案为:[20/27]L•mol-1或180L•mol-1;
③该反应为放热反应,升高温度时平衡逆向移动,SO2的转化率将减小,故答案为:减小;
(4)“高温灼烧的产物相同”,都是CuO,但同质量的两种物质高温灼烧后产物的质量不等,故可取等质量的两种固体,高温灼烧后分别称量残留固体的质量,可鉴别之,故答案为:取两种同质量的样品分别高温灼烧,区别残留固体的质量.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡建立的过程;化学平衡的计算.
考点点评: 本题考查盖斯定律、化学平衡的移动、化学平衡常数的计算以及尾气处理,综合性强,难度较大.分析平衡移动,注意反应不能进行到底.1年前查看全部
- (15分)工业上为了测定辉铜矿(主要成分是Cu 2 S)中Cu 2 S的质量分数,设计了如图装置。实验时按如下步骤操作:
(15分)工业上为了测定辉铜矿(主要成分是Cu 2 S)中Cu 2 S的质量分数,设计了如图装置。实验时按如下步骤操作:
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu 2 S+O 2A.连接好仪器,使其成为如图装置,并检查装置的气密性。 B.称取研细的辉铜矿样品1.000g。 C.将称量好的样品小心地放入硬质玻璃管中。 D.以每分钟1L的速率鼓入空气。  SO 2 +2Cu。
SO 2 +2Cu。
F.移取25.00mL含SO 2 的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO 4 标准溶液滴定至终点。按上述操作方法重复滴定2—3次。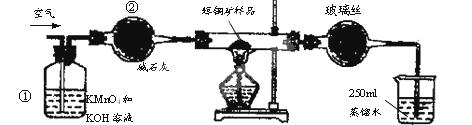
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO 2 ,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu 2 S的质量分数是________。
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种即可)。滴定
次数待测溶液的
体积/mL标准溶液的体积 滴定前刻度/mL 滴定后刻度/mL 1 25.00 1.04 21.03 2 25.00 1.98 21.99 3 25.00 3.20 21.24
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18 , H 2 S 饱和溶液中 c (H + )与 c (S 2 - )之间存在如下关系:c 2 (H + )·(S 2 - ) =" 1" . 0×10 -22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe 2+ )为1 mol/L,应调节溶液的c(H 十 )为__________________。 烟雾随风1年前1
烟雾随风1年前1 -
 dangerzhang 共回答了27个问题
dangerzhang 共回答了27个问题 |采纳率88.9%(1)除去空气中的还原性气体与酸性气体 (2分)
干燥空气(2分)
(2)2KMnO 4 +5H 2 SO 3 =2MnSO 4 +K 2 SO 4 +2H 2 SO 4 +3H 2 O (2分)
滴入最后一滴标准KMnO 4 溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色 (2分)
(3)80% (2分)
(4)在KMnO 4 滴定前,未反应完的O 2 与空气中的O 2 也可将H 2 SO 3 氧化,造成测定结果偏低(2分)
(5)4 ×10 -3 mol/L1年前查看全部
- 赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6C
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中不正确的是 ( )
A.该反应的氧化剂与还原剂物质的量之比为3:1
B.Cu2S在反应中既是氧化剂,又是还原剂
C.Cu是氧化产物,SO2是还原产物
D.每生成38.4g Cu,反应中转移0.6mol电子 紫色红颜Q1年前2
紫色红颜Q1年前2 -
 楼民1号 共回答了22个问题
楼民1号 共回答了22个问题 |采纳率95.5%Cu2S+2Cu2O=6Cu+SO2↑
铜被还原 氧化剂 Cu2S 2Cu2O
S被氧化 还原剂 Cu2S
A.该反应的氧化剂与还原剂物质的量之比为3:1 正确
B.Cu2S在反应中既是氧化剂,又是还原剂 正确
C.Cu是氧化产物,SO2是还原产物
不正确 铜是氧化剂 被还原 还原产物 SO2是氧化产物
D.每生成38.4g Cu,反应中转移0.6mol电子
38.4g Cu 0.6mol 产生0.1mol SO2 S由-2到+4价 转移0.6mol电子 正确1年前查看全部
- 辉铜矿的主要成分为Cu2S,是提取铜的主要原料.Cu2S在1200℃高温下被氧气氧化而发生如下反应:
辉铜矿的主要成分为Cu2S,是提取铜的主要原料.Cu2S在1200℃高温下被氧气氧化而发生如下反应:
2Cu2S + 3 O2 → 2Cu2O + 2 SO2 2 Cu2O + Cu2S → 6Cu + SO2
不考虑其它反应,(工业所用的氧气来自于空气的分离,设空气中N2、O2的体积分数分别为0.80和0.20),试完成下列各题:
(2)1.0molCu2S 与126升标准状况下空气反应,可生成Cu的物质的量 8477951201年前1
8477951201年前1 -
 田牙客 共回答了18个问题
田牙客 共回答了18个问题 |采纳率94.4%提交答案后有时会有错行现象,自己对齐一下.Cu为y (2)126L标况下空气中氧气为126L÷22.4 L/mol×0.2=1.125mol;根据反应系数可知,1molCu2S与氧气完全反应需要1.5mol氧气,所以氧气不足, 2...1年前查看全部
- 胆矾(CuSO4.5H2O)当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积,反应得到的铁
胆矾(CuSO4.5H2O)当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积,反应得到的铁和硫的混合物进入水溶液,该溶液无臭味,透明不浑浊,绿色,呈强酸性,试用一个方程式来表示.
 yeyi1281年前1
yeyi1281年前1 -
 从青岛到上海 共回答了14个问题
从青岛到上海 共回答了14个问题 |采纳率92.9%反应物有CuSO4、FeS2,生成物中有Cu2S.
溶液显绿色 说明Fe2+存在
溶液无臭味,透明,不浑浊,呈强酸性 ,可能存在(SO4)2-
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO41年前查看全部
- 当胆矾渗入地下,遇到黄铁矿(FeS2)时可生成辉铜矿(Cu2S),同时还升成FeSO4和H2SO4,反应中Cu离子与Fe
当胆矾渗入地下,遇到黄铁矿(FeS2)时可生成辉铜矿(Cu2S),同时还升成FeSO4和H2SO4,反应中Cu离子与FeS2的物质的量比是?
 hchott1年前2
hchott1年前2 -
 倦倚西风夜已昏 共回答了18个问题
倦倚西风夜已昏 共回答了18个问题 |采纳率94.4%反应中Cu2+与FeS2的物质的量之比是14∶5
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
由题给的信息可知:反应物有CuSO4?5H2O、FeS2、还有可能有H2O.生成物有中Cu2S,硫和铁的价态运用直接法可确定:排除了硫以-2,0,+4等价态进入水溶液的可能,只能以SO42-存在.1年前查看全部
- 辉铜矿(Cu2S)冶炼铜的化学方程式是什么
 jmpt5201年前2
jmpt5201年前2 -
 jay_liucc 共回答了13个问题
jay_liucc 共回答了13个问题 |采纳率84.6%4CuS+5O2==2Cu2O+4SO2↑
2Cu2S+3O2==2Cu2O+2SO2↑
再由氧化亚铜与剩余的CuS和Cu2S反应:
CuS+2Cu2O==5Cu+SO2↑
Cu2S+2Cu2O==6Cu+2SO2↑
但是,比起氧化铜与氧化亚铜,辉铜矿(Cu2S)中的铜质量分数低,有污染,故没有氧化铜与氧化亚铜用途广.1年前查看全部
- (14分)辉铜矿(主成份为Cu 2 S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。
(14分)辉铜矿(主成份为Cu 2 S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。
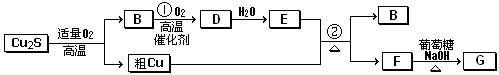
请回答下列问题:
(1)辉铜矿(Cu 2 S)通适量的空气冶炼金属铜的化学方程式__________________________
______其中氧化剂为____________________。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯粗,在该电解反应中阳极物质是 ,电解质溶液是 ;
(4)自然界中当胆矾矿与黄铁矿(FeS 2 二硫化亚铁)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO 4 + 5FeS 2 +12H 2 O==7Cu 2 S+5FeSO 4 +12H 2 SO 4
被氧化的硫和被还原的硫的质量比为_________________________; duqingqing1年前1
duqingqing1年前1 -
 hh我依然等你 共回答了17个问题
hh我依然等你 共回答了17个问题 |采纳率94.1%1年前查看全部
- 世界上每年铜的产量是八百万吨(8×106t),铜的主要来源之一是由辉铜矿(主要成分是Cu2S),工业上由辉铜矿生产铜的反
世界上每年铜的产量是八百万吨(8×106t),铜的主要来源之一是由辉铜矿(主要成分是Cu2S),工业上由辉铜矿生产铜的反应是:Cu2S+O2
2Cu+SO2,如果完全采用这种方法生产这八百万吨铜,则每年需要消耗的Cu2S为多少吨?由此得到的二氧化硫在标准状况下体积是多少升?高温 . tianyatowa1年前1
tianyatowa1年前1 -
 a123455 共回答了12个问题
a123455 共回答了12个问题 |采纳率100%解题思路:根据方程式计算需要Cu2S的质量,计算Cu的物质的量,根据方程式计算生成二氧化碳的物质的量,根据V=nVm计算二氧化硫的体积.设需要消耗的Cu2S为x,则:
Cu2S+O2
高温
.
2Cu+SO2
160 128
x 8×106t
x=
160×8×106t
128=1×107t
8×106t Cu 的物质的量=
8×1012g
64g/mol=1.25×1011mol,
由方程式可知,n(SO2)=[1/2]×1.25×1011mol,故V(SO2)=[1/2]×1.25×1011mol×22.4L/mol=1.4×1010L,
答:每年需要消耗的Cu2S为1×107吨,由此得到的二氧化硫在标准状况下体积是1.4×1010升.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式计算,难度不大,注意对基础知识的理解掌握.1年前查看全部
- 从矿物学资料查得:当蓝矾溶液渗入地下遇硫铁矿FeS2时,可以生成辉铜矿Cu2S,同时还生成硫酸亚铁和硫酸.化学方程式如下
从矿物学资料查得:当蓝矾溶液渗入地下遇硫铁矿FeS2时,可以生成辉铜矿Cu2S,同时还生成硫酸亚铁和硫酸.化学方程式如下:
14CuSO4 + 5FeS2 +12H2O == 7Cu2S + 5FeSO4 + 12H2SO4
在上述反应中,氧化剂是 ,还原剂是 ,氧化产物与还原产物的物质的量之比是 ;生成1molCu2S时转移电子 mol .
这里有很多元素变价,转移电子用单线桥表不清楚的感觉,光是算电子守恒就有点晕乎
S元素到底是如何变价, rumengjinan1年前1
rumengjinan1年前1 -
 luckyboyhao 共回答了24个问题
luckyboyhao 共回答了24个问题 |采纳率87.5%首先你应该明白氧化还原的实质:其本质在高中阶段就是化合价的升降相等、得电子失电子相等.在一个特别复杂的反应或者是说多种元素变价的时候你不用怕,需要做的就是把每一种元素的化合价标出来,分析它们是怎么变化的,以这个反应为例:铜的化合价就是从+2到+1.而硫的化合价有三种:-2、-1、+6这种情况最好判断,当出现三种价态时要么是中间向两边变,要么是两边向中间变,啥意思呢?就是这里硫的化合价-1是中间价态那么一定是-1到-2,-1到+6 这是规律记住就行了,一个铜降低一价14个铜降低14价,一个硫从-1到-2降低一价,七个硫降低七价,现在一共降低14+7=21价,很明显剩下的三个-1价硫升到+6价,一个硫升高7价三个硫升高21价,现在升高降低相等了,很明显氧化剂为FeS2,还原剂为CuSO4和FeS2,你也可以知道生成了7molCu2S转移21mol电子,那么生成1mol的话转移3mol电子,氧化产物是FeSO4注意这里只有三个硫是从-1到+6的所以氧化产物与还原产物之比为3:71年前查看全部
大家在问
- 1周子明同学在课外探究活动过程中,用一束太阳光照在一张红纸板上,看见纸板是红色,如果他用一束蓝光照在该红纸板上,看见纸板颜
- 2如图,弦AB,CD在圆O上相交于一点P,弧AB=弧CD(1)求证:OP平分∠APC (2)若AB,CD相交于圆
- 3Pandas feed on______shoots.
- 4阅读短文《只弯一次腰 阅读短文《只弯一次腰》,然后根据语境在文末横线处填上耶稣教育弟子的话.
- 5若c是实数,且X2-3x+c=0的一个解的相反数是方程X2+3x-c=0的一个解,求方程X2-3x+c=0的解.
- 6I was caught in the war and put to prison.
- 7两个老同学的年龄的平方差是63,求这两个人现在的年龄
- 8升和公升的关系
- 9影响动能大小的因素为什么在让同一个小球从不同高度滚下的实验中,木块被撞得远,就说小球具有的动能大?能量的大小不是看做功多
- 10Dreams of you and me
- 11数学家英文,谢谢翻译。。
- 12ab-(2ab-3a^2b)怎么算?
- 13我认为那真是有趣的一天,用英语怎么说
- 14已知(a-2)x的平方y的|a|+1次方是关于x,y的单项式.
- 15把6表示成两个整数的积,有多少种可能性,分别是什么