2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O 氧化还原
 isolat2022-10-04 11:39:541条回答
isolat2022-10-04 11:39:541条回答用双线桥分析此氧化还原反应,并指出:
氧化剂
还原剂
氧化产物
还原产物.

已提交,审核后显示!提交回复
共1条回复
 扣扣XX 共回答了10个问题
扣扣XX 共回答了10个问题 |采纳率100%- 2个锰得10个电子;氧共失10个电子.氧化剂高锰酸钾,还原剂过氧化氢;氧化产物氧气,还原产物硫酸锰;氧化过程从过氧化氢到氧气,还原过程从高锰酸钾到硫酸锰.
- 1年前
相关推荐
- 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(
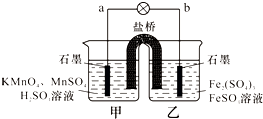 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.外电路的电流方向是从a到b 甜唯1年前1
甜唯1年前1 -
 motta332 共回答了13个问题
motta332 共回答了13个问题 |采纳率100%解题思路:由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,
A.b为负极,则乙烧杯中发生氧化反应,故A错误;
B.甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,则pH逐渐增大,故B错误;
C.阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故C错误;
D.由上述分析可知,a为正极,电流由正极流向负极,即从a流向b,故D正确.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池的工作原理及常见的化学电源,明确氧化还原反应中元素的化合价变化及原电池工作原理是解答本题的关键,题目难度不大.1年前查看全部
- 对氧化还原反应2KMnO4+5H2S+3H2SO4=2MnSO4+5S+K2SO4+8H2O,叙述正确得是( ).
对氧化还原反应2KMnO4+5H2S+3H2SO4=2MnSO4+5S+K2SO4+8H2O,叙述正确得是( ).
对氧化还原反应2KMnO4+5H2S+3H2SO4=2MnSO4+5S+K2SO4+8H2O,叙述正确得是( ).
A、 H2SO4既不是氧化剂也不是还原剂
B、 K2SO4是氧化产物
C、 KMnO4的氧化性比S的氧化性要强
D、 H2S中S一部分被氧化成MnSO4中的硫酸根 SWGTDHFGGGHKHJKG1年前0
SWGTDHFGGGHKHJKG1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 2KMnO4+10FeSO4+8H2SO4=K2SO4+5Fe2(SO4)3+2MnSO4+8H2O氧化剂与还原剂的比
 深爱深似海1年前2
深爱深似海1年前2 -
 载有关洋 共回答了23个问题
载有关洋 共回答了23个问题 |采纳率87%改成离子反应式:2MnO4 2-+10Fe2+ +16H+=10Fe3++2Mn2++8H2O
氧化剂:高锰酸根:2
还原剂:亚铁离子:10
∴氧化剂:还原剂=1:51年前查看全部
- S的化合价变化5SO2 + 2KMnO4 + 2H2O == K2SO4 + 2MnSO4 + 2MnO4 为什么S的化
S的化合价变化
5SO2 + 2KMnO4 + 2H2O == K2SO4 + 2MnSO4 + 2MnO4 为什么S的化合价由+2变为+4 除了复分解反应,还有什么反应 元素的化合价不变
 傻根他三大爷1年前1
傻根他三大爷1年前1 -
 虫二无边境 共回答了19个问题
虫二无边境 共回答了19个问题 |采纳率78.9%S元素被高锰酸钾氧化 化合价升高 还有一些单质的反应也不变化合价 比如3O2=放电=2O31年前查看全部
- PH=5,向MnSO4溶液加入高锰酸钾生成沉淀,方程式3Mn2++2MnSO4-+4OH-=5MnSO2↓+2H2O。这
PH=5,向MnSO4溶液加入高锰酸钾生成沉淀,方程式3Mn2++2MnSO4-+4OH-=5MnSO2↓+2H2O。这句话哪里不对?
打错了是方程式3Mn2++2MnSO4-+4OH-=5MnO2↓+2H2O。这句话哪里不对? vind_0_1年前1
vind_0_1年前1 -
 沫沫小米 共回答了12个问题
沫沫小米 共回答了12个问题 |采纳率91.7%酸性条件下,反应物不能有氢氧根1年前查看全部
- (2014•温州二模)利用下列反应可设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO
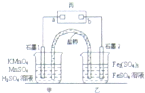 (2014•温州二模)利用下列反应可设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液,丙是浸有KI淀粉溶液的滤纸,a、b是Pt电极.下列叙述中不正确的是( )
(2014•温州二模)利用下列反应可设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液,丙是浸有KI淀粉溶液的滤纸,a、b是Pt电极.下列叙述中不正确的是( )
A.电池工作时.盐桥中的SO42-移向甲烧杯
B.电池工作时,电子由石墨1电极经外电路移向石墨2电极
C.甲烧杯中电极反应式为MnO4-+5e++8H+═Mn2++4H2O
D.滤纸丙的a电极附近出现蓝色现象 为了吃饭的nn1年前1
为了吃饭的nn1年前1 -
 eook00 共回答了13个问题
eook00 共回答了13个问题 |采纳率76.9%解题思路:根据电池反应式知,石墨2是负极、石墨1是正极,
A.放电时,盐桥中硫酸根离子移向负极所在电解质溶液;
B.放电时,电子从负极沿导线流向正极;
C.甲烧杯中高锰酸根离子得电子发生还原反应;
D.a为阳极、b为阴极,滤纸a电极上碘离子放电、b电极上氢离子放电.根据电池反应式知,石墨2是负极、石墨1是正极,
A.放电时,盐桥中硫酸根离子移向负极所在电解质溶液,所以盐桥中的SO42-移向甲烧杯,故A正确;
B.放电时,电子从负极石墨2沿导线流向正极石墨1,故B错误;
C.甲烧杯中高锰酸根离子得电子发生还原反应,电极反应式为MnO4-+5e++8H+═Mn2++4H2O,故C正确;
D.a为阳极、b为阴极,滤纸a电极上碘离子放电生成碘单质,碘遇淀粉试液变蓝色,所以滤纸丙的a电极附近出现蓝色现象,故D正确;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,根据电池反应式元素化合价变化确定正负极,再结合电解池中离子放电顺序分析解答,难点是电极反应式书写.1年前查看全部
- 某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H
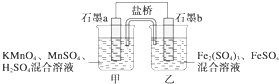 某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.回答下列问题:
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.回答下列问题:
(1)此原电池的正极是石墨______(填“a”或“b”),发生______反应.
(2)电池工作时,盐桥中的SO42-移向______(填“甲”或“乙”)烧杯.
(3)两烧杯中的电极反应式分别为
甲______,
乙______.
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5mol•L-1,则反应中转移的电子为______mol. dhallan1年前1
dhallan1年前1 -
 danmawang 共回答了19个问题
danmawang 共回答了19个问题 |采纳率84.2%解题思路:(1)反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,KMnO4作氧化剂,发生还原反应;
(2)电池工作时,阴离子向负极移动;
(3)甲烧杯中的电极发生还原反应;乙烧杯中的电极发生氧化反应;
(4)溶液中的MnSO4浓度由1mol•L-1变为1.5mol•L-1,计算物质的量,结合化合价的变化可计算转移电子的物质的量.(1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极,故答案为:a;还原;
(2)电池工作时,SO42-向负极移动,即向乙烧杯移动,故答案为:乙;
(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+═Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-═5Fe3+,
故答案为:MnO4-+5e-+8H+═Mn2++4H2O;5Fe2+-5e-═5Fe3+;
(4)溶液中的MnSO4浓度由1mol•L-1变为1.5mol•L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5mol•L-1×0.2L=0.1mol,转移的电子为0.1mol×5=0.5mol.
故答案为:0.5.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查原电池知识,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握原电池的工作原理,答题时注意体会电极方程式的书写方法,难度不大.1年前查看全部
- 关于Mn的化学反应问题 5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2此反应中,H2
关于Mn的化学反应问题
5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2
此反应中,H2O2被氧化,氧气中的氧全是H2O2中的氧来的,为什么KMnO中的氧不会提供氧气中的氧呢?
请不要以化学式配平的角度来解答此问题,
另外,氧化还原反应中的不交叉定律我也知道,有没有可能KMnO4中的氧一部分变为氧气中零价的氧,一部分还是-2价的氧,而H2O2中的氧全部变为0价的氧呢?
这也满足氧化还原反应中的不交叉定律啊?
回答时请说详细点 谢 qiu听雨1年前3
qiu听雨1年前3 -
 kan1984 共回答了15个问题
kan1984 共回答了15个问题 |采纳率100%这个反应的条件是正常条件
我们通过经验知道,像SO4^2-、PO4^3-、MnO4-这类含氧酸根是很稳定的,一般条件的化学反应难以破坏
反而,H2O2的结构为H-O-O-H,其中有很容易断裂的过氧键,可以释放出O原子,O原子又结合成氧分子
基于这些道理,可以相信氧气中的氧全是H2O2中的氧来的
并且用同位素标记应该也能证明这一结论
这属于客观科学事实
这样讲可以理解么?1年前查看全部
- 高锰酸钾与硫酸和双氧水反应的化学方程式H2O2 +2 KMnO4 + 3 H2SO4 = K2SO4 + 2MnSO4
高锰酸钾与硫酸和双氧水反应的化学方程式H2O2 +2 KMnO4 + 3 H2SO4 = K2SO4 + 2MnSO4 + 3 O2 + 4H2O哪里错了,为什么非是5 H2O2 + 2 KMnO4 + 3 H2SO4 = 8 H2O+2 MnSO4 + K2SO4+ 5 O2
电子转移哪里出问题了?
到底是怎么回事? Accent_cn1年前1
Accent_cn1年前1 -
 qzdong 共回答了19个问题
qzdong 共回答了19个问题 |采纳率100%光看电子转移没什么问题,但是因为双氧水比较不稳定,在氧化条件里面更容易失电子化合价上升,而KMnO4和H2SO4里面的O一般则化合价不变,所以存在电子转移的氧,也就是生成的氧气一般全部来源于双氧水.
楼主配平的时候-2价的氧少了4个,相当于认为KMnO4里面的氧被氧化了.在双氧水充足的情况下,这种情形不会出现.1年前查看全部
- 5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S+8H2O
5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S+8H2O
1.___是还原剂
2___是氧化剂
3还原产物是___
4被氧化的物质是___
5被氧化的物质是___
6.发生氧化反应的物质是—
7.被还原的物质是---
8 发生还原反应的物质是-- 淘金者1年前2
淘金者1年前2 -
 nntt 共回答了18个问题
nntt 共回答了18个问题 |采纳率88.9%高锰酸钾是氧化剂,硫化氢是还原剂.还原产物硫酸锰.氧化产物硫.被氧化的物质硫化氢.被还原的物质是高锰酸钾.发生氧化反应的物质是硫化氢.发生还原反应的是高锰酸钾1年前查看全部
- 氧化还原反应基本题目判断?2KMnO4+5H2O2+3H2S04→2MnSO4+5O2↑+K2SO4+8H20氧化剂是?
氧化还原反应基本题目判断?
2KMnO4+5H2O2+3H2S04→2MnSO4+5O2↑+K2SO4+8H20
氧化剂是?
还原剂是?
被还原的元素是?
被氧化的元素是? 刘首1年前3
刘首1年前3 -
 小圆子9070 共回答了16个问题
小圆子9070 共回答了16个问题 |采纳率93.8%氧化剂是KMnO4.
还原剂是H2O2.
被还原的元素是Mn
被氧化的元素是O1年前查看全部
- (2012•镇江二模)已知①5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4(无色溶液)②SO2
(2012•镇江二模)已知
①5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4(无色溶液)
②SO2能漂白某些有色物质,如将SO2通入品红溶液中,品红溶液褪色.
③一些含硫物质的溶解性(20℃):
含硫物质 K2SO4 MnSO4 CaSO4 CaSO3 FeSO4 Fe2(SO4)3 溶解性 溶 溶 微溶 难溶 溶 溶 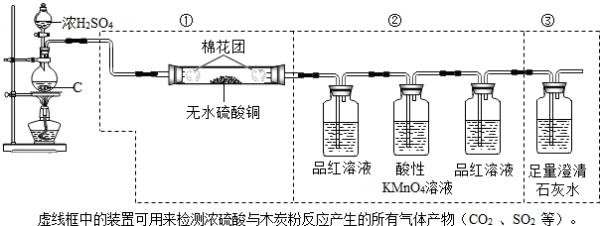
请回答下列问题:
(1)写出圆底烧瓶中反应的化学方程式:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O△ .C+2H2SO4(浓).
2SO2↑+CO2↑+2H2O△ .
(2)装置中第①部分的作用是______,可观察到的现象是______.第②部分最后一个洗气瓶中品红溶液的作用是______.
(3)若将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则不能检出的物质是______.
(4)若将仪器的连接顺序改为①、③、②,则只可检出的物质是______. jokerbao1年前1
jokerbao1年前1 -
 howardzj 共回答了23个问题
howardzj 共回答了23个问题 |采纳率82.6%解题思路:根据题目提供的信息,二氧化硫也能使澄清石灰水变浑浊,是因为二氧化硫和氢氧化钙反应生成亚硫酸钙白色沉淀和水的缘故.由信息知,二氧化硫具有能使石灰水变浑浊和使高锰酸钾溶液、品红溶液褪色的性质,二氧化碳也能使澄清的石灰水变浑浊.无水硫酸铜是检验是否有水生成的,只要白色变蓝色,就一定有水生成;木炭和浓硫酸在加热的条件下反应生成二氧化碳和二氧化硫和水,因此②中品红溶液和高锰酸钾溶液都变无色,③中澄清石灰水变浑浊.检验生成物时,为避免干扰,要先检验水,再检验二氧化硫,最后检验二氧化碳.(1)木炭和浓硫酸在加热的条件下反应生成二氧化碳和二氧化硫和水,配平即可;故答案为:C+2H2SO4(浓)
△
.
2SO2↑+CO2↑+2H2O
(2)无水硫酸铜是检验是否有水生成的,只要白色变蓝色,就一定有水生成;第②部分最后一个洗气瓶中品红溶液是检验二氧化硫是否被完全除去;故答案为:检验是否有水生成;白色变蓝色;检验二氧化硫是否被完全除去
(3)若将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则不能检出的物质是水蒸气,因为品红和高锰酸钾溶液中都有水;故答案为:水蒸气
(4)若将仪器的连接顺序改为①、③、②,则只可检出的物质是水蒸气,因为二氧化硫和二氧化碳都能使澄清石灰水变浑浊,故答案为:水蒸气点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于实验探究题,既有气体的性质又有气体与水反应后生成物的检验,还有化学方程式的书写,综合性比较强.本题根据题目提供的信息,结合实验探究的一般步骤和酸的性质等知识来解决,还要注意化学方程式的书写和配平.本考点主要出现在实验题中.1年前查看全部
- (1)、在反应2KMnO4+5H2S+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O中,电子转移总数为----
(1)、在反应2KMnO4+5H2S+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O中,电子转移总数为--------.
当有1mol电子转移时,有------mol-------(物质名称)被还原.当有80gS析出时,有-----gH2S被-----(氧化/还原)
(2)/ 已知反应:5RxO42-+(4x-6)MnO4-+(12x-8)H+====5xRO2+(4x-6)Mn2++(6x-4)H2O,如有0.2molRxO4^2-参加反映,则反应过程中共转移0.4mol电子.试回答下列问题:
①x的值为
②参加反应的H+物质的量是----
(3)、氧化铜在高温下发生分解反应,其反应方程式可表示为:4CuO=2Cu2O+O2,
①氧化剂是?还原剂?氧化产物?还原产物?
若反应中转移电子的物质的量为1mol,则在标准状况下产生气体的体积为多少升?
②现将80gCuO进行灼烧,测得固体残渣含铜的质量分数为86%,请通过计算该CuO的分解百分率. zzx995271年前1
zzx995271年前1 -
 soplarcini 共回答了14个问题
soplarcini 共回答了14个问题 |采纳率100%(1)只有Mn的化合价是降低的,由高锰酸钾中的+7价,变到了硫酸锰中的+2价,降低了5价,前边的化学计量数是2,5乘2等于10,所以电子转移总数为10,10mol电子转移,对应2mol高锰酸钾被还原,所以1mol电子转移时,有0.2mol高锰酸钾被还原.此反应中一共有5mol×32g/mol=160g S 生成,即有5mol S 被还原,所以当有80g S 析出时有2.5mol×34=85g H2S被氧化1年前查看全部
- 二氧化硫和高锰酸钾、水反应生成硫酸锰,硫酸钾和硫酸 5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2S
二氧化硫和高锰酸钾、水反应生成硫酸锰,硫酸钾和硫酸 5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
可是这个方程式中并未体现氢离子,那就相当于在中性溶液中发生的,为什么又要求是在酸性溶液中发生 jenny_present1年前4
jenny_present1年前4 -
 舞起狂澜陈 共回答了18个问题
舞起狂澜陈 共回答了18个问题 |采纳率88.9%KMnO4的氧化性与溶液的酸碱度有很大的关系.在高中阶段,要求学生了解KMnO4的氧化性随pH的升高而降低.在酸性条件下,KMnO4能被还原为Mn2+;在中性条件下,KMnO4能被还原为MnO2;在碱性条件下,KMnO4只能被还原为K2MnO4,其中,酸性条件和碱性条件下的KMnO4的氧化性是必须熟练掌握的.在上述方程式中,KMnO4被还原为Mn2+,表明是在酸性条件下进行反应.此外,氢离子在这个反应中起到的作用是增大氧化剂的电位差(这是大学内容),换言之,它改变了氧化剂的氧化性,改变了反应产物,使反应发生实质性的变化,而不是起催化作用(催化剂只是改变了反应的过程,不改变反应的结果).1年前查看全部
- 对化学略知一二的近~请看:1 2kMnO4+5SO2+H2O====2MnSO4+K2SO4+2H2SO42 Br2+2
对化学略知一二的近~
请看:
1 2kMnO4+5SO2+H2O====2MnSO4+K2SO4+2H2SO4
2 Br2+2H2O+SO2====2HBr+H2SO4
在这里kMnO4`Br2不会是强酸吧?但为什么又能制H2SO4? 宛宛儿1年前2
宛宛儿1年前2 -
 小草依依_888 共回答了20个问题
小草依依_888 共回答了20个问题 |采纳率100%强酸制弱酸指的是在复分解反应里有这么规律,上面的两个反应是氧化还原反应,反应类型不同,kMnO4`Br2都是强氧化剂.1年前查看全部
- 10Fe3O4 + 48H2SO4 + 2KMnO4 = K2SO4 + 2MnSO4 + 15Fe2(SO4)3 +
10Fe3O4 + 48H2SO4 + 2KMnO4 = K2SO4 + 2MnSO4 + 15Fe2(SO4)3 + 48H2O哪个是氧化剂
10Fe3O4 + 48H2SO4 + 2KMnO4 = K2SO4 + 2MnSO4 + 15Fe2(SO4)3 + 48H2O哪个是氧化剂哪个是还原剂请把转移方向和转移的电子个数写出来谢啦 东北的七爷1年前3
东北的七爷1年前3 -
 34572889 共回答了14个问题
34572889 共回答了14个问题 |采纳率85.7%你这个有点复杂啊.
氧化剂是KMnO4,还原剂是Fe3O4.电子从Fe到Mn,共转移10e-.方程式不好写就不写了,见谅.
注意,Fe3O4中只有+2价的铁有还原性.1年前查看全部
- PbO2氧化问题在H2SO4和MNSO4中加入少量pbo2方程式是5PbO2+2MnSO4+2H2SO4=Pb(MnO4
PbO2氧化问题
在H2SO4和MNSO4中加入少量pbo2
方程式是5PbO2+2MnSO4+2H2SO4=Pb(MnO4)2+4PbSO4↓+2H2O
为什么不写成2MnSO4 + 5PbO2 + 3H2SO4 =2HMnO4+ 5PbSO4 ↓+ 2H2O xingqing981年前2
xingqing981年前2 -
 minghu2wj 共回答了17个问题
minghu2wj 共回答了17个问题 |采纳率88.2%是你写的更有道理.这种情况写离子方程式就明白了.给的那个 5PbO2 + 2Mn2+ + 4SO42- + 4H+ = Pb2+ + 2MnO4- + 4PbSO4↓+ 2H2O你的那个 5PbO2 + 2Mn2+ + 5SO42- + 4H+ = 2MnO4- + 5PbSO4↓+ 2H2O由于溶液中加入的PbO2...1年前查看全部
- 10HBr+2KMnO4+3H2SO4=5Br2+2MnSO4+K2SO4+8H2O 离子方程式
 wuhanxumin1年前1
wuhanxumin1年前1 -
 五亭 共回答了16个问题
五亭 共回答了16个问题 |采纳率87.5%+ - - 2+
16H +10Br +2MnO4 =5Br2=2Mn +8H2O1年前查看全部
- 2KMno4+5H2O+3H2SO4==K2SO4+2MnSO4+5O2+8H2O 写出其半方程
 craxun01年前3
craxun01年前3 -
 sucky 共回答了17个问题
sucky 共回答了17个问题 |采纳率94.1%你给的反应反应物应是H2O2,不是H2O.化学方程式为:
2KMno4+5H2O2+3H2SO4==K2SO4+2MnSO4+5O2+8H2O
负极反应:5H2O2-10e^-=5O2↑+10H^+ 氧化反应
正极反应:2Mno4^-+10e^-+16H^+=2Mn^2++8H2O,还原反应
希望我的回答能对你学习有帮助!1年前查看全部
- 二氧化硫与酸性高锰酸钾溶液反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4为什么没有沉淀气体
二氧化硫与酸性高锰酸钾溶液反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4为什么没有沉淀气体水什么的生成?
这样为什么可以反应啊 1__t1年前1
1__t1年前1 -
 asdgjawrklrtsg 共回答了16个问题
asdgjawrklrtsg 共回答了16个问题 |采纳率81.3%这是一个氧化还原反应,不是复分解反应,你所说的沉淀气体水是复分解反应发生的条件1年前查看全部
- 3SO2+2KMNO4+2H2SO4==K2SO4+2MNSO4+2H2O 二氧化硫能使高锰酸钾(酸性)褪色的方程式对吗
 huang11421年前1
huang11421年前1 -
 风林海啸 共回答了22个问题
风林海啸 共回答了22个问题 |采纳率86.4%你自己数都知道S原子不守恒了,而且你反应物也错了,难怪你配不平.
5SO2+2H2O+2KMnO4=2MnSO4+2H2SO4+K2SO41年前查看全部
大家在问
- 1“最后一次通知”的英文怎么说,正式一些的,
- 2在1-2009者2009个自然数中,能被6或8 整除的数共有多少个
- 3在一个只有三厘米热水的塑料瓶口处放一块冰,会有怎样的变化?
- 4如图,在Rt三角形ABC中,∠ACB=90,CD垂直AB于D,AF平分∠BAC交CD于E,交AB于F,CG平分∠BCD交
- 5Water,coffee and cola___healthy...这里不是应该用就近原则..为什么答案是are?.
- 6什么才是人生真正的意义,人活着到底是为了什么?21岁的男生感到非常迷茫
- 7为什么河套平原农业面临的可持续发展面临的主要问题是土壤盐渍化,>_
- 8(2014•闸北区二模)袋中共有6个除了颜色外完全相同的球,其中有1个红球,2个白球和3个黑球.从袋中任取两球,两球颜色
- 9fx log2(a-2x/1+x)为奇函数(1)判断单调区间(2)解不等式f(x-1)>f(x)
- 10请你写一句名言警句或一副对联,用作“爱心图书馆”的环境不置?
- 11请回答 破与败历览前贤国与家的后一句是成由勤俭破由奢 还是 成由勤俭败由奢啊?我要准确的答案◎#¥¥%※……
- 12送给祖国60岁生日的礼物最近要演讲比赛,要送给祖国60周年的礼物,(要实物),大家有什么建议
- 13南水北调.南至的是什么流域,北指的是什么和什么地区.
- 14下列现象与物态变化过程对应正确的是( )
- 15阅读下面的文字,完成1~4题。 江河
