燃料是重要的能源.(1)天然气是常用的燃料,它的主要成分的名称是______,燃烧的化学方程式是CH4 +2O2 点燃
 snowflake20042022-10-04 11:39:541条回答
snowflake20042022-10-04 11:39:541条回答(1)天然气是常用的燃料,它的主要成分的名称是______,燃烧的化学方程式是
| ||
| ||
(2)天然气燃烧还需要的条件是______和______.

已提交,审核后显示!提交回复
共1条回复
 怪怪不怪 共回答了21个问题
怪怪不怪 共回答了21个问题 |采纳率95.2%- 解题思路:(1)根据天然气燃烧生成水和二氧化碳进行解答;
(2)根据可燃物燃烧的条件有:与氧气接触;达到可燃物的着火点进行解答.(1)天然气是常用的燃料,它的主要成分的名称是甲烷,甲烷燃烧生成水和二氧化碳,化学方程式CH4 +2O2
点燃
.
CO2 +2H2O.
(2)可燃物燃烧的条件有:与氧气接触;达到可燃物的着火点.所以天然气燃烧还需要的条件是与氧气接触和达到天然气的着火点.
故答案为:(1)甲烷;CH4 +2O2
点燃
.
CO2 +2H2O;
(2)与氧气接触;达到天然气的着火点.点评:
本题考点: 常用燃料的使用与其对环境的影响;燃烧与燃烧的条件.
考点点评: 在解此类题时,要根据反应原理和方程式的书写规则进行书写方程式. - 1年前
相关推荐
- 在太空中卫星变轨喷出的燃料的受力物体
在太空中卫星变轨喷出的燃料的受力物体
是什么?是怎样获得反作用力的?
 火狐狸列那1年前1
火狐狸列那1年前1 -
 ttyh 共回答了23个问题
ttyh 共回答了23个问题 |采纳率91.3%卫星对喷出的燃料有推力,燃料对卫星有反作用力
所以答案是卫星1年前查看全部
- 液氢作为火箭燃料是化学性质吗?
 3587579591年前2
3587579591年前2 -
 幸cc 共回答了19个问题
幸cc 共回答了19个问题 |采纳率100%是,氢气燃烧释放大量能量作为推动火箭的动力.1年前查看全部
- (2008•雅安)2008年北京奥运会火炬的燃料是丙烷,丙烷的分子模型如下图所示:
 (2008•雅安)2008年北京奥运会火炬的燃料是丙烷,丙烷的分子模型如下图所示:
(2008•雅安)2008年北京奥运会火炬的燃料是丙烷,丙烷的分子模型如下图所示:
(1)丙烷的化学式是______;
(2)一个丙烷分子中有______个原子;
(3)丙烷完全燃烧后生成水和二氧化碳,试写出丙烷完全燃烧的化学方程式C3H8+5O2
3CO2+4H2O点燃 .C3H8+5O2
3CO2+4H2O点燃 .
(4)甲烷、乙烷(C2H6)、丙烷、丁烷(C4H10)、戊烷(C5H12)…、n烷(CnHy)等分子结构相似的一类有机物,统称为“烷烃”.在CnHy中y=______(用含n的代数式表达). ofajuxr1年前1
ofajuxr1年前1 -
 njckp 共回答了18个问题
njckp 共回答了18个问题 |采纳率94.4%解题思路:根据图中信息可以判断物质的化学式,根据质量守恒定律可以书写化学方程式,根据相关数据可以判断物质的组成规律.(1)由图中可知丙烷的化学式为C3H8.故填:C3H8.
(2)由图中可知一个丙烷分子中有11个原子.故填:11.
(3)丙烷燃烧能生成二氧化碳和水,化学方程式为:C3H8+5O2
点燃
.
3CO2+4H2O
(4)由烷烃的化学式可知,y=2n+2.故填:2n+2.点评:
本题考点: 微粒观点及模型图的应用;分子和原子的区别和联系;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要把图中信息和所学知识有机的结合起来,只有这样才能对烷烃做出正确的判断.1年前查看全部
- 北京奥运会火炬“祥云”将于2008年8月进入我省。火炬使用的燃料为丙烷,其化学式为C 3 H 8 ;丙烷燃烧后其生成物为
北京奥运会火炬“祥云”将于2008年8月进入我省。火炬使用的燃料为丙烷,其化学式为C 3 H 8 ;丙烷燃烧后其生成物为二氧化碳和水。请写出丙烷燃烧的化学方程式:__________________;22g丙烷中含碳元素的质量为___________。  soking1年前0
soking1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 液化石油气主要成分为C3H8+502=3CO2+4H2O.某用户现有一套一液化石油气为燃料的杜具,欲改为烧天然气
液化石油气主要成分为C3H8+502=3CO2+4H2O.某用户现有一套一液化石油气为燃料的杜具,欲改为烧天然气
你认为应采取的措施
A.增大空气的进入量或减少天然气的进入量
B.同时增大空气和天然气的进入量
C.减少空气的进入量或增大天然气的进入量
D.同时减少空气和天然气的进入量 阿猪0071年前2
阿猪0071年前2 -
 nn都听阿布的 共回答了13个问题
nn都听阿布的 共回答了13个问题 |采纳率92.3%首先,他减少了氧气的使用
减少二氧化碳的排放
C.减少空气的进入量或增大天然气的进入量
以下是化学方程式
天然气主要成分为甲烷CH4
CH4 + 2O2 = CO2 + 2H2O1年前查看全部
- 燃料燃烧所产生的热量给生活与生产带来了很大的便利,但燃烧不当也会造成极大的损害。
燃料燃烧所产生的热量给生活与生产带来了很大的便利,但燃烧不当也会造成极大的损害。
(1)燃料不完全燃烧既浪费资源,产生的气体又对环境造成污染。为研究影响物质燃烧的因素,现设计如图所示实验:将燃烧匙内小木炭块灼烧至红热后,立即伸入集气瓶内,并塞紧橡皮塞。将注射器内氧气迅速推入集气瓶内,观察到木炭发白光。该实验说明燃烧的剧烈程度与 有关。燃烧的剧烈程度还与可燃物与氧气的接触面积有关,如 (举一日常生活实例)
(2)小明、小刚同学在研究灭火的原理时,进行了如下实验:分别在两个小铁盒中倒入少量植物油并点燃,小明用坩埚钳把小铁盒放在冰水共存的水面上,观察到火焰立即熄灭,该实验证明了灭火的原理是 ,小刚同学将一块湿抹布盖在小铁盒上,火焰也立即熄灭,他依据的灭火原理是 。 foucesu1年前1
foucesu1年前1 -
 smartming1981 共回答了24个问题
smartming1981 共回答了24个问题 |采纳率95.8%(1)氧气浓度 刨花比小木块在空气中燃烧更旺(2)降低温度到着火点以下 隔绝空气
1年前查看全部
- 下列有关空气中各成分用途的说法中,错误的是( ) A.氮气是制造氮肥的原料之一 B.氧气可用作火箭发射的燃料 C.氦气
下列有关空气中各成分用途的说法中,错误的是( ) A.氮气是制造氮肥的原料之一 B.氧气可用作火箭发射的燃料 C.氦气可用于填充探空气球 D.二氧化碳可促进植物光合作用  dtlyj1年前1
dtlyj1年前1 -
 stevenyy 共回答了15个问题
stevenyy 共回答了15个问题 |采纳率93.3%A、氮气是制造氮肥的重要原料,故说法正确.
B、氧气具有助燃性,不具有可燃性,不能作燃料,故说法错误;
C、氦气的密度比空气小,可用于填充探空气球,故说法正确;
D、二氧化碳是植物进行光合作用的原料,因此二氧化碳可促进植物的光合作用,故说法正确;
故选B.1年前查看全部
- (2010•卢湾区模拟)甘蔗是一种高光效的植物,单位面积产量很高,目前已成为燃料酒精生产的重要原料.与化石燃料相比,酒精
(2010•卢湾区模拟)甘蔗是一种高光效的植物,单位面积产量很高,目前已成为燃料酒精生产的重要原料.与化石燃料相比,酒精燃料可以再生,而且二氧化碳排放量少,符合低能耗、低污染、低排放为基础的低碳经济模式.
(1)利用甘蔗生产燃料酒精的一般工艺流程为:甘蔗-榨汁(蔗糖)-酵母发酵-蒸馏-成品(燃料酒精)-蔗渣由微生物分解再利用.具有耐高糖和耐酸特性的酵母菌是理想的酒精发酵菌种,对野生酵母菌进行诱变后通过筛选可以得到具有这些特性的突变菌,诱变及筛选过程如下:
步骤1:野生菌液体培养一段时间后接受紫外线照射诱变处理.
步骤2:根据筛选要求制备选择培养基时要注意______和______. 加琼脂后灭菌,制成固体培养基.为防止培养皿出现冷凝水影响菌落生长,需将培养皿______.
步骤3:将紫外照射后的菌液稀释,涂布在固定培养基的表面.
步骤4:根据______筛选出突变菌.
由上述步骤筛选出的酵母菌与野生酵母菌相比,具有______的特点.
(2)利用获得的突变菌和蔗汁进行酒精发酵实验,除了将培养基灭菌、保持空间洁净外,发酵过程中防止外来杂菌入侵可行的方法还有(列举一种)______
(3)酵母菌不能分解蔗渣,因其不含有能够分解蔗渣的______酶.若从土壤中分离具有这种酶的微生物,所需要培养基中的碳源为______,如果要生产这种酶,那么就将所培养的该种微生物进行工业化发酵,然后将其产生的这种酶进行______,上述过程中通过控制______和______来保持酶的活力.为了使酶回收和再利用,可以采取______技术. kurtali1年前1
kurtali1年前1 -
 谢真伟 共回答了16个问题
谢真伟 共回答了16个问题 |采纳率75%解题思路:要善于利用题目信息如“具有耐高糖和耐酸特性的酵母菌是理想的酒精发酵菌种”,就能找第(1)题的答案;利用酶具有专一性的特点,才能解决第(3)题.第(2)题属于开放性题目,只要答案合理即可.(1)根据题干信息“具有耐高糖和耐酸特性的酵母菌是理想的酒精发酵菌种”可知,制备培养基时,在基本培养基的基础上,注意添加高浓度蔗糖(葡萄糖)和调低pH值;为防止培养皿出现冷凝水影响菌落生长,需将培养皿倒置.最后根据酵母菌能否在选择培养基上生存筛选出突变菌.由上述步骤筛选出的酵母菌是理想的酒精发酵菌种,与野生酵母菌相比,具有耐高糖和耐酸的特性的特点
(2))防止外来杂菌人侵的方法除了灭菌、保持空间洁净外,还有①利用突变菌的耐酸特性,降低培养基的pH值,达到抑菌的目的;②利用突变菌的耐高糖特性,通过高渗环境达到抑菌目的;③保持厌氧环境,达到抑菌目的;④在培养基中添加一些抑制物如特殊的抗生素,达到抑菌目的.
(3)蔗渣的主要成分为纤维素,酵母菌不能分解蔗渣,因其不含有能够分解蔗渣的纤维素酶.若从土壤中分离具有这种酶的微生物,所需要培养基中的碳源为纤维素;如果要生产这种酶,那么就将所培养的该种微生物进行工业化发酵,然后将其产生的这种酶进行分离纯化,温度和PH值会影响酶的活性,为了使酶回收和再利用,可以采取固定化技术.
故答案为:
(1)添加高浓度蔗糖(葡萄糖) 调低pH 倒置
是否能在选择培养基上生长 耐高糖和耐酸的特性
(2)①利用突变菌的耐酸特性,降低培养基的pH,达到抑菌的目的
②在培养基中添加一些抑制物如特殊的抗生素,达到抑菌目的
(3)纤维素 纤维素 分离纯化 温度 pH 固定化点评:
本题考点: 利用微生物进行发酵来生产特定的产物;微生物的分离和培养;制备和应用固相化酶.
考点点评: 本题综合考查考生对生物技术实践模块中的特殊微生物的筛选及应用、酶的应用等内容的掌握;理论联系实际,针对生物学问题进行初步研究,设计实验路线,对实验结果和现象进行正确的分析与判断,综合运用所学知识解决实际问题的能力.1年前查看全部
- 煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤中含有硫,燃烧后生成的二氧化硫会造成空气污染.某工厂用煤做燃料
煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤中含有硫,燃烧后生成的二氧化硫会造成空气污染.某工厂用煤做燃料,每天燃烧含硫2%的煤4800kg
该厂废气中二氧化硫的含量可根据下列反应测定:so2+2h2o=h2so4+2hi.现取该厂废气样品500ml,用含碘2x10-6次方即(0.0000002%)的碘溶液200g与废气中二氧化硫恰好完全反应,试计算该厂排放的废气是否符符合***规定的工业废气排放标准(废气中二氧化硫的含量不得超过0.15mg/m3)
用煤做燃料,你认为有什么方法可以减少so2对空气的污染?
不要到网上复制啊 这道题与网上的不同,)
会的帮我答一下
so2+2h2o+i2=h2so4+2hi
是这样的 lounge_lu1年前1
lounge_lu1年前1 -
 liuyu683 共回答了24个问题
liuyu683 共回答了24个问题 |采纳率91.7%SO2+2H2O+I2=H2SO4+2HI
64g 254g
x 2x10-6*200
x=1x10-4 g=0.1mg
含量=0.1mg/500ml(即0.5x10-3m3)=200mg/m3
超标
可以将尾气通过碱液后排放1年前查看全部
- 下列说法正确的是( )A.燃料的热值与燃料燃烧情况无关B.容易燃烧的燃料的热值一定大C.煤的热值大于干木柴的热值,燃烧煤
下列说法正确的是( )
A.燃料的热值与燃料燃烧情况无关
B.容易燃烧的燃料的热值一定大
C.煤的热值大于干木柴的热值,燃烧煤放出的热量比燃烧干木柴放出的热量一定多
D.1KG的煤的热值是2KG煤的热值的一半
我知道正确答案,但是我不知道原因.请你们陈述原因且是正确的我才会采纳. 魔界阿房宫1年前1
魔界阿房宫1年前1 -
 清澈溪流 共回答了17个问题
清澈溪流 共回答了17个问题 |采纳率94.1%【思路一】
错解 C
错因分析 因为思维的片面性,只考虑到燃料的热值,而忽略了决定燃料燃烧放出热量多少的其他因素:燃料的质量大小和是否完全燃烧.1 kg的某种燃料完全燃烧放出的热量叫做这种燃料的热值,可见热值是区分不同燃料放热本领不同的物理量,它是燃料的一种特性,只与燃料的种类有关.
正解 A
【思路二】
A
提高锅炉效率,主要是提高燃烧效果,就是降低固体不完全燃烧热损失和气体不完全燃烧热损失,和提高传热效率,就是降低排烟热损失和散热损失.
这只和锅炉本身性质有关.
试想,用了热值高的燃料,但是损失了很多热量,并不能提高效率.1年前查看全部
- 一种氢气燃料的汽车,质量为m=2.0×103kg,发动机的额定输出功率为P=80kW,行驶在平直公路上时所受阻力恒
一种氢气燃料的汽车,质量为m=2.0×103kg,发动机的额定输出功率为P=80kW,行驶在平直公路上时所受阻力恒
一种氢气燃料的汽车,质量为m=2.0×103kg,发动机的额定输出功率为P=80kW,行驶在平直公路上时所受阻力恒为车重的K=0.1倍.若汽车从静止开始先匀加速启动,加速度的大小为a=1.0m/s2.达到额定输出功率后,汽车保持功率不变又加速行驶了S=800m才匀速行驶.(g=10m/s2)试求:
(1)汽车匀速行驶的速度vm的大小;
(2)汽车匀加速结束时的速度v1的大小;
(3)当汽车的速度大小为v=32m/s时的加速度a′的大小;
(4)汽车从静止到获得最大速度所用的时间t为多少.
 快点nn1年前1
快点nn1年前1 -
 michael_mql 共回答了14个问题
michael_mql 共回答了14个问题 |采纳率78.6%(1)当牵引力等于阻力时,速度最大,根据P=Fvm=fvm得,最大速度为:
vm=
P
f=
P
kmg=
80000
2000=40m/s;
(2)根据牛顿第二定律得:F-f=ma,
则牵引力为:F=f+ma=0.1×2×104+2×103×1N=4×103N,
则匀加速运动的末速度为:v1=
P
F=
80000
4000=20m/s.
(3)当速度为32m/s时,牵引力为:F=
P
v=
80000
32N=2500N,
根据牛顿第二定律得,加速度为:a′=
F?f
m=
2500?0.1×20000
2000=0.25m/s2.
(4)匀加速运动的时间为:t1=
v1
a=
20
1=20s,
变加速运动阶段,根据动能定理得:Pt2?fs=
1
2mvm2?
1
2mv12
代入数据解得:t2=35s
则有:t=t1+t2=20+35=55s.
答:(1)汽车匀速行驶的速度vm为40m/s;
(2)汽车匀加速结束时的速度v1的大小为20m/s;
(3)当汽车的速度大小为v=32m/s时的加速度a′的大小为0.25m/s2;
(4)汽车从静止到获得最大速度所用的时间t为55s.1年前查看全部
- 如何证明相同质量的不同燃料燃烧放出热量不相同
 haoman881年前1
haoman881年前1 -
 sungirl0202 共回答了18个问题
sungirl0202 共回答了18个问题 |采纳率83.3%多点水,来吸收热量,看温度高低.1年前查看全部
- 过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料
过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).其化学方程式为:

请填空:
(1)写出上述反应的平衡常数表达式K=c(CH3OH)•c(H2O) c(CO2)•c3(H2) K=:c(CH3OH)•c(H2O) c(CO2)•c3(H2)
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是______(填序号) A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
mol•(L•min)-1nA tA
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,
增大n(H2) n(CH3OH)
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:CH3OH(l)+[3/2]O2=CO2(g)+2H2O(l)△H=-725.8kJ/molCH3OH(l)+[3/2]O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是______;正极的电极反应式:______. 万年大道1年前1
万年大道1年前1 -
 gracezou 共回答了20个问题
gracezou 共回答了20个问题 |采纳率80%解题思路:(1)根据化学平衡常数故的书写方法:K=生成物的浓度幂之积除以反应物的浓度幂之积来书写;
(2)A、化学反应速率等于单位时间内物质浓度的变化量来计算回答;
B、升高温度,对于放热反应平衡常数减小;
C、根据温度变化导致的甲醇的浓度的变化来回答;
D、C点时反应达到平衡状态,升高温度,对于放热反应,平衡逆向进行;
(3)根据热化学方程式的含义和书写方法来回答;
(4)甲醇为原料的燃料电池,甲醇为负极,氧气是正极,根据两极的放电规律来回答.(1)根据K=生成物的浓度幂之积除以反应物的浓度幂之积,得出K=
c(CH3OH)•c(H2O)
c(CO2)•c3(H2),故答案为:K=
c(CH3OH)•c(H2O)
c(CO2)•c3(H2);
(2)A、化学反应速率等于单位时间内物质浓度的变化量,甲醇的平均反应速率v(CH3OH)=
nA
2
tAmol•(L•min)-1,故A错误;
B、根据图示信息:升高温度,甲醇的物质的量减少,所以反应逆向进行,即反应是放热反应,对于放热反应,升高温度,平衡常数减小,故B错误;
C、根据图示信息:升高温度,甲醇的物质的量减少,所以反应逆向进行,即反应是放热反应,故C正确;
D、C点时反应达到平衡状态,升高温度,对于该放热反应,平衡逆向进行,所以
n(H2)
n(CH3OH)增大,故D正确;
故选CD.
(3)16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,则1mol 液态甲醇完全燃烧,当恢复到原状态时,放出725.8kJ的热量,即热化学方程式为:
CH3OH(l)+[3/2] O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol,故答案为:CH3OH(l)+[3/2] O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(4)甲醇为原料的燃料电池中,燃料甲醇为负极,发生失电子的氧化反应,氧气是正极,发生得电子得还原反应,根据所给试剂,只能选择氢氧化钠为电解质,在碱性环境下,氧气的放电情况为:O2+2H2O+4e-=4OH-,故答案为:甲醇;O2+2H2O+4e-=4OH-.点评:
本题考点: 化学平衡常数的含义;热化学方程式;原电池和电解池的工作原理;物质的量或浓度随时间的变化曲线.
考点点评: 本题是一道化学平衡常数化学平衡移动以及电化学和热化学知识的一道综合题,注重了对高考常考查知识的点的训练,题目难度较大.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)写出CO燃烧的热化学方程式______;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
①温度升高该反应的平衡常数______(增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是3nB 2tB mol•L-1•min-13nB 2tB
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,负极的反应式为______. mwemei1年前1
mwemei1年前1 -
 津女 共回答了16个问题
津女 共回答了16个问题 |采纳率100%解题思路:(1)依据热化学方程式书写方法和注意问题标注物质聚集状态和对应焓变;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)①依据先拐先平的判断方法可知T1<T2,温度变化判断平衡移动的分析分析平衡常数变化;
②依据图象分析甲醇的平衡物质的量和时间,结合化学方程式计算消耗氢气的物质的量,结合反应速率概念计算得到;
(4)甲醇燃料电池,燃料在负极失电子发生氧化反应.(1)由CO(g)的燃烧热△H分别为-283.0kJ•mol-1,则一氧化碳燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)①图象分析先拐先平,温度高,T1<T2,温度越高甲醇物质的量越小,说明平衡逆向进行,平衡常数减小,故答案为:减小;
②B过程依据图象分析,在tB达到平衡时生成甲醇nBmol,依据化学方程式CO2+3H2=CH3OH+H2O,消耗氢气物质的量为3nBmol,用H2表示该反应的化学反应速率=
3nBmol
2L
tBmin=
3nB
2tBmol/L•min,故答案为:
3nB
2tB;
(4)直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,甲醇燃料电池,燃料在负极失电子发生氧化反应,负极的反应式为:
CH3OH-6e-+8OH-═CO32-+6H2O,故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式的书写和盖斯定律的应用,化学平衡的影响因素分析判断,图象分析应用能力,原电池电极反应书写方法,题目难度中等.1年前查看全部
- 核能正广泛地被全世界开发和使用中核电站中核燃料和在中子的撞击下原子核发生 23题!
 晓云儿1年前1
晓云儿1年前1 -
 包包背着洋娃娃 共回答了25个问题
包包背着洋娃娃 共回答了25个问题 |采纳率88%准确点说:
核变化是原子核在变化,核反应将产生新的原子核(并非产生原子).
化学变化是原子与分子在变化,它们将形成新的原子或者分子,整个过程中原子核不变化.
好吧,貌似这答案有点长,所以概况起来我认为可以这样写:化学变化会生成新的化学分子或者原子,而核变化则会生成新的原子核(或新元素).
从严谨的角度来看再强调一次,是生成新的原子核,而不是新的原子.因为核反应的产物都是不带电子的裸原子核和高能γ射线(能量),整个过程也不需要电子的“任何帮助”,完全是由原子核内的质子与中子在执行核反应的过程.1年前查看全部
- 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为________,B原子的杂化类型为________。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。图(a)是磷化硼晶体的晶胞示意图,则磷化硼的化学式为________,该晶体的晶体类型是________。
(3)正硼酸(H 3 BO 3 )是一种片层状结构白色晶体,层内的H 3 BO 3 分子间通过氢键相连[如图(b)]。
①硼酸分子中B最外层有________个电子,1 mol H 3 BO 3 的晶体中有________mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH) 3 ·H 2 O,它电离生成少量[B(OH) 4 ] - 和H + 离子。则硼酸为________元酸,[B(OH) 4 ] - 含有的化学键类型为________。
 打马吊1年前1
打马吊1年前1 -
 夏秋春 共回答了12个问题
夏秋春 共回答了12个问题 |采纳率83.3%(1)平面三角形 sp 2
(2)BP 原子晶体
(3)①6 3 ②一 共价键、配位键
(1)BF 3 分子中,B原子形成了3个σ键,不含孤电子对,故杂化轨道数为3,杂化方式为sp 2 杂化,BF 3 分子立体构型为平面三角形。(2)一个晶胞中含有B原子的个数为8×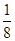 +6×
+6×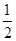 =4个,P原子个数为4个,故化学式为BP;磷化硼晶体中只含共价键且耐磨,为原子晶体。(3)①由图可知,B原子形成了三个共价单键,最外层电子数为6;1 mol H 3 BO 3 的晶体中含有3 mol H原子,每个H原子都与相邻的O原子形成氢键,故氢键个数为3 mol;②1 mol B(OH) 3 ·H 2 O可电离出1 mol H + ,故硼酸为一元酸;[B(OH) 4 ] - 离子中B原子有一个空的2p轨道,而OH - 含有孤电子对,两者之间可以形成配位键。
1年前查看全部
=4个,P原子个数为4个,故化学式为BP;磷化硼晶体中只含共价键且耐磨,为原子晶体。(3)①由图可知,B原子形成了三个共价单键,最外层电子数为6;1 mol H 3 BO 3 的晶体中含有3 mol H原子,每个H原子都与相邻的O原子形成氢键,故氢键个数为3 mol;②1 mol B(OH) 3 ·H 2 O可电离出1 mol H + ,故硼酸为一元酸;[B(OH) 4 ] - 离子中B原子有一个空的2p轨道,而OH - 含有孤电子对,两者之间可以形成配位键。
1年前查看全部
- 可燃冰是一种新型燃料.他是------和-------在低温高压下混合产生的晶体状物质?
可燃冰是一种新型燃料.他是------和-------在低温高压下混合产生的晶体状物质?
1.水 2.一氧化碳 3.二氧化碳 4.天然气
它是在( )和( )在低温高压下混合产生的晶体状物质? doremi9131年前1
doremi9131年前1 -
 piaobo879 共回答了18个问题
piaobo879 共回答了18个问题 |采纳率83.3%水和天气气1年前查看全部
- 在不考虑空气阻力的条件下,火箭的最大速度vm/s和燃料的质量Mkg、火箭(除燃料外)的质量mkg的函数关系是v=2000
在不考虑空气阻力的条件下,火箭的最大速度vm/s和燃料的质量Mkg、火箭(除燃料外)的质量mkg的函数关系是v=2000ln(1+
).当燃料质量是火箭质量的______倍时,火箭的最大速度可达12km/s.M m  hai17781年前1
hai17781年前1 -
 70866 共回答了22个问题
70866 共回答了22个问题 |采纳率77.3%解题思路:火箭的最大速度可达12km/s,即12000m/s,将v=12000代入题中函数关系式,再将所得对数式转化为指数式,化简整理可得[M/m]的值,即为燃料质量是火箭质量的倍数.∵v=2000ln(1+
M
m)
∴火箭的最大速度可达12km/s,即12000=2000ln(1+
M
m)
可得ln(1+
M
m)=6,1+
M
m=e6,解之得[M/m]=e6-1
故答案为:e6-1点评:
本题考点: 对数函数的值域与最值.
考点点评: 本题以含有对数的函数为例,考查了用函数知识解决实际应用题和指、对数的互化等知识点,属于基础题.1年前查看全部
- (2006•泉州)“神舟六号”载人航天飞船的火箭发射时是以偏二甲肼(C2H8N2)为燃料、以N2O4为助燃物的.请你回答
(2006•泉州)“神舟六号”载人航天飞船的火箭发射时是以偏二甲肼(C2H8N2)为燃料、以N2O4为助燃物的.请你回答有关问题:
(1)C2H8N2是由______等元素组成的化合物.
(2)1个C2H8N2分子共含有______个原子.2C2H8N2的相对分子质量总和等于______.
(3)C2H8N2燃烧能推进燃料舱升空是由于反应中释放出巨大的______.
(4)C2H8N2完全燃烧产物有三种在空气中都含有,其中一种是氮单质,请写出C2H8N2完全燃烧的产物中任意一种物质的化学式:______. caobbvaobb1年前1
caobbvaobb1年前1 -
 zrdhdo 共回答了21个问题
zrdhdo 共回答了21个问题 |采纳率90.5%解题思路:由化学式可以直接得出组成元素.每个分子中含有的原子个数等于各原子的个数之和.相对分子质量等于各原子的相对原子质量之和.燃料之所以称之为燃料是因为燃烧能放出能量.含碳化合物在完全燃烧时,碳元素全部转化为二氧化碳,氢元素转化为水.(1)偏二甲肼中是由碳、氢、氮三种元素组成.
(2)一个偏二甲肼中含有的原子个数为:2+8+2=12
2个C2H8N2的相对分子质量总和为:2(12×2+1×8+14×2)=120
(3)C2H8N2做燃料是因为能放出大量的热
故答案为:能量
(4)含碳化合物中完全燃烧时,碳元素转化为CO2而氢元素转化为H2O.题目中还告诉有一种是氮单质.
故答案为:N2或CO2或H2O点评:
本题考点: 有关化学式的计算和推断;元素在化学变化过程中的特点;化学式的书写及意义;质量守恒定律及其应用.
考点点评: 熟记化学式的意义,是解决化学式中的计算的前提.1年前查看全部
- 在汽油中加入乙醇可以减少汽车尾气的污染,使燃料充分燃烧,请写出乙醇三千的化学方程式_____
 tukai9991年前1
tukai9991年前1 -
 静藤 共回答了20个问题
静藤 共回答了20个问题 |采纳率95%CH3CH2OH+3O2点燃=2CO2+3H2O1年前查看全部
- 发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为2N2H4
发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为2N2H4+N2O4
3N2+4H2O点燃 .2N2H4+N2O4.
3N2+4H2O点燃 . shangxinzhidi1年前1
shangxinzhidi1年前1 -
 品尝qq 共回答了11个问题
品尝qq 共回答了11个问题 |采纳率90.9%解题思路:根据题意,发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,写出反应的化学方程式即可.联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,反应的化学方程式为:2N2H4+N2O4
点燃
.
3N2+4H2O.
故答案为:2N2H4+N2O4
点燃
.
3N2+4H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 具有“绿色环保、科技创新、燃料节能”的交通工具在世博园区内展示和应用,以下燃料最符合绿色环保的是( ) A.天然气 B
具有“绿色环保、科技创新、燃料节能”的交通工具在世博园区内展示和应用,以下燃料最符合绿色环保的是( ) A.天然气 B.汽油 C.氢气 D.液化石油气  小蜗牛21年前1
小蜗牛21年前1 -
 每天学习 共回答了18个问题
每天学习 共回答了18个问题 |采纳率88.9%天然气、汽油、液化石油气属于化石燃料,在燃烧过程中产生二氧化碳等物质,对环境造成污染,而氢气燃烧生成水,水不污染环境,符合绿色环保.
故选:C.1年前查看全部
- 完全燃烧1kg某种燃料时放出的热量为1.2×107J,则该种燃料的热值为______J/kg;木炭的热值是3.4×107
完全燃烧1kg某种燃料时放出的热量为1.2×107J,则该种燃料的热值为______J/kg;木炭的热值是3.4×107J/kg,0.5kg木炭完全燃烧所放出的热量是______J.
 小蝌蚪5171年前1
小蝌蚪5171年前1 -
 khmoo 共回答了18个问题
khmoo 共回答了18个问题 |采纳率100%解题思路:(1)已知燃料的质量和完全燃烧放出的热量,利用q=[Q/m]可计算出该燃料的热值.
(2)已知木炭的热值和质量,利用Q=mq可计算出木炭完全燃烧放出的热量.(1)该燃料的热值:q=[Q/m]=
1.2×107J
1kg=1.2×107J/kg;
(2)0.5kg木炭完全燃烧所放出的热量:Q放=m木炭q木炭=3.4×107J/kg×0.5kg=1.7×107J.
故答案为:1.2×107;1.7×107J.点评:
本题考点: 燃料的热值.
考点点评: 考查了学生对燃料燃烧放出热量的公式Q=qm的变形应用,这属于基础知识基本技能,必须掌握.1年前查看全部
- 关于热机的物理选择题下面哪一个是正确的A 热值大的燃料比热值小的燃料完全燃烧时放出的热量多B 柴油机工作是,燃料燃烧没放
关于热机的物理选择题
下面哪一个是正确的
A 热值大的燃料比热值小的燃料完全燃烧时放出的热量多
B 柴油机工作是,燃料燃烧没放出1J热量,就可以得到1J的机械能
C 热机的效率越大,它的功率就越大
D 柴油机的效率一般比汽油机高,就是说完成相同的有用功,柴油机所有的燃料完全燃烧放出的能量比汽油机少
要一个个解释原因.
谢谢各位. elephantnj1年前1
elephantnj1年前1 -
 7vde 共回答了21个问题
7vde 共回答了21个问题 |采纳率81%选D
A 表面上是这样,可是你要看热值大的燃料被燃烧的程度,再来做比较
B 热机效率和机械效率是一样的,它们的值都<1
C 热机的效率是和功率无关的
D 他们所比较的,就是额外功,柴油机在做功冲程中,才运用燃料,所消耗的燃料也较少,额外功就比较少
懂了没?还可以再问我哦.1年前查看全部
- 太阳能是不是燃料能源?地球上一切能量来自太阳对不对?
 sg234561年前1
sg234561年前1 -
 azurecici 共回答了20个问题
azurecici 共回答了20个问题 |采纳率80%太阳能不是燃料能源,而是清洁能源.地球上的能量一部分来源太阳,风能、水力等能量来源于地球的自转和公转等.
麻烦点下右上角【满意】以兹鼓励,1年前查看全部
- 为了减少大气污染,许多城市推广汽车使用清洁燃料.目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石
为了减少大气污染,许多城市推广汽车使用清洁燃料.目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG).这两类燃料的主要成份都是( )
A.碳水化合物
B.烃类
C.氢气
D.醇类 小兔撞墙晕晕1年前1
小兔撞墙晕晕1年前1 -
 想要只苏牧的兰寇 共回答了18个问题
想要只苏牧的兰寇 共回答了18个问题 |采纳率94.4%解题思路:天然气的主要成分是甲烷,液化石油气的主要成分是乙烯、乙烷、丙烷、丙烯、丁烷、丁烯等,都属于烃类物质.A、天然气和液化石油气都属于烃类物质,只含碳和氢两种元素,碳水化合物含C、H、O三种元素,故A错误;
B、烃类物质属于碳氢化合物,故B正确;
C、天然气和液化石油气中不含氢气,故C错误;
D、天然气和液化石油气都属于烃类物质,不含氧元素,而醇类物质一定含有氧元素,故D错误;
故选B.点评:
本题考点: 饱和烃与不饱和烃.
考点点评: 本题考查有机物的组成,较为简单,注意天然气和液化石油气的区别.1年前查看全部
- (1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应
(1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应
(1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,请写出该反应的热化学方程式.______
(2)已知N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol 请写出用NO2做氧化剂时的热化学方程式(产物为N2和H2O)______,通过上述数据可知,在O2、NO2两者间,火箭发射通常用______做氧化剂,原因是______.
 很认真地用kk1年前1
很认真地用kk1年前1 -
 yuanaji 共回答了22个问题
yuanaji 共回答了22个问题 |采纳率95.5%(1)根据化学反应的焓变意义,结合图中给出反应的焓变,得到热化学方程式为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol,
故答案为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol;
(2)二氧化氮和肼反应生成氮气和水,N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g),
已知反应①N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol;
②N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol,
所求反应可以是①-②×[1/2]得到,所以N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g)的焓变△H=-567.85kJ/mol,
对比反应①和②,可以看出消耗相同的N2H4 产生的热量更多,并且NO2的沸点更高,更容易储存,
故答案为:N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g)△H=-567.85kJ/mol;NO2;消耗相同的N2H4 产生的热量更多,NO2的沸点更高,更容易储存.1年前查看全部
- 煤是一种常用的燃料,由于煤燃烧产生的废气含有SO 2 、NO 2 和NO等多种有害气体和烟尘会对环境造成污染,因此需要对
煤是一种常用的燃料,由于煤燃烧产生的废气含有so 2 、no 2 和no等多种有害气体和烟尘会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要方面之一是形成硝酸型酸雨
①写出有关物质转化为硝酸的化学方程式__________________________
②以下是对硝酸型酸雨的若干项评价,其中正确的是__________
a:***水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统
b:对电线,铁轨,桥梁,房屋等均会造成严重损害
c:导致臭氧层空洞
d:硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)对煤用石灰石进行脱硫处理,过程中发生的方程式为:__________________________
(3)脱硫后,在废气中含有的不良气体是___________,它对环境的负面影响是_________________。
(4)检验脱硫后废气中是否含有so 2 的简单方法是_________________________。 tongsheng1年前0
tongsheng1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•邵阳)N(NO2)3是科学家2011年发现的一种新型火箭燃料.试计算:
(2013•邵阳)N(NO2)3是科学家2011年发现的一种新型火箭燃料.试计算:
(1)1个N(NO2)3分子中含______个原子.
(2)N(NO2)3的相对分子质量是______.
(3)N(NO2)3中氮元素和氧元素的质量比是______.(化为最简整数比)
(4)N(NO2)3中氮元素的质量分数是______.(精确到0.1%) vt_vanas1年前1
vt_vanas1年前1 -
 WEBBER2891 共回答了18个问题
WEBBER2891 共回答了18个问题 |采纳率94.4%解题思路:(1)根据分子的构成分析;
(2)根据物质的相对分子质量为组成分子的各原子的相对原子质量之和解决;
(3)依据元素的质量比等于各元素相对原子质量和的比分析解答即可;
(4)根据化合物中元素的质量分数[相对原子质量×原子个数/相对分子质量]×100%,进行分析判断.(1)1个N(NO2)3分子中含有的原子个数为1+(1+2)×3=10.
(2)N(NO2)3的相对分子质量为14+(14+16×2)×3=152.
(3)依据元素的质量比等于各元素相对原子质量和的比,所以N(NO2)3中氮元素和氧元素的质量比是14×4:16×6=7:12;
(4)N(NO2)3中氮元素的质量分数为[14×4/152]×100%≈36.8%.
故答案为:(1)10;(2)152;(3)7:12;(4)36.8%;点评:
本题考点: 相对分子质量的概念及其计算;元素质量比的计算;元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义、有关计算进行分析问题、解决问题的能力.1年前查看全部
- (5分) A、B、C、D四种元素,A元素的单质是最清洁的燃料,B元素的单质是空气中最多的气体,C是地壳中含量最多的元素,
(5分) A、B、C、D四种元素,A元素的单质是最清洁的燃料,B元素的单质是空气中最多的气体,C是地壳中含量最多的元素,C元素和D元素组成的化合物能使澄清石灰水变浑浊。则元素A为 、元素B的单质为 、元素C为 、元素D为 、C和地壳中含量居的金属元素形成的化合物的化学式是 。(填符号)
 喜欢听故事的人1年前1
喜欢听故事的人1年前1 -
 爱的小虫虫 共回答了18个问题
爱的小虫虫 共回答了18个问题 |采纳率100%H 、 N 2 、O、C、Al 2 O 3 .
由于氢气燃烧后产物是水,不污染环境,燃烧放出的热量多所以最清洁的燃料是氢气,A是氢元素;空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、水蒸气和杂质:0.03%.所以空气里最多的气体单质是氮气,元素B的单质为 N 2 ;地壳中含量最多的前五种元素有:氧、硅、铝、铁、钙,所以地壳中最多的元素是氧元素,所以C元素是氧元素;使澄清的石灰水变浑浊的气体是二氧化碳,因为C是氧元素,所以D是碳元素;氧元素和地壳中含量最多的金属元素铝形成的化合物的化学式是 Al 2 O 3 .1年前查看全部
- 从环境保护的角度考虑,下列燃料中最理想的是( )
从环境保护的角度考虑,下列燃料中最理想的是( )
A.煤
B.天然气
C.汽油
D.氢气 xzshark20041年前1
xzshark20041年前1 -
 114225728 共回答了24个问题
114225728 共回答了24个问题 |采纳率91.7%解题思路:根据已有的知识进行分析,氢气是最理想的燃料,据此解答.氢气燃烧只生成水,不污空气,是最理想的燃料,观察选项,故选D.
点评:
本题考点: 氢气的用途和氢能的优缺点.
考点点评: 本题考查了化学与能源的知识,完成此题,可以依据已有的知识进行.1年前查看全部
- 请列举一些常见燃料的热值,以J/kg作单位
请列举一些常见燃料的热值,以J/kg作单位
再多几个? 电视节目演1年前1
电视节目演1年前1 -
 飞舞之鹰 共回答了21个问题
飞舞之鹰 共回答了21个问题 |采纳率76.2%木炭的燃烧热是3.4X104kJ/kg,
柴油的燃烧值:12.8*10^6J/Kg
天燃气的燃烧值:52.7~55.6*10^6J/Kg
酒精3.0x10七次方j/kg
汽油汽油的热值为4.6×10七次方J/kg1年前查看全部
- 选择燃料只要考虑燃料热值的大小吗?
 爱着镜子的老鼠1年前1
爱着镜子的老鼠1年前1 -
 qweazht 共回答了20个问题
qweazht 共回答了20个问题 |采纳率95%当然还要考虑来源,经济利益,和对环境的污染等多方面的因素1年前查看全部
- 燃料电池上,若用C2H4来做燃料,负极反应式是什么
燃料电池上,若用C2H4来做燃料,负极反应式是什么
能知道正极反应式吗 庄梦鱼1年前4
庄梦鱼1年前4 -
 秋意已浓YOYO 共回答了20个问题
秋意已浓YOYO 共回答了20个问题 |采纳率100%打错了 O2+2H2O+4e- =4OH- 是正极的反应 负极的是C2H4+3O2-4e-=2CO2+2H2O1年前查看全部
- 在土地荒漠化的人为因素中,与农村燃料问题密切
 007551年前1
007551年前1 -
 fengnesta 共回答了19个问题
fengnesta 共回答了19个问题 |采纳率84.2%农村燃料大多使用的是木柴,这就造成了大量的乱砍乱伐,使得植被被大量破坏,地表暴露,水土流失,土地蓄水能力变弱,土地荒漠化程度也就加深1年前查看全部
- 2.一架飞机所带的燃料最多可以飞行9小时.飞机去时顺风,每小时可飞行1500千米……
2.一架飞机所带的燃料最多可以飞行9小时.飞机去时顺风,每小时可飞行1500千米……
2.一架飞机所带的燃料最多可以飞行9小时.飞机去时顺风,每小时可飞行1500千米;返回时逆风,每小时飞行1200千米.这架飞机最多飞出去多少千米就需要往回飞? diesha1年前1
diesha1年前1 -
 jojo_ch05 共回答了18个问题
jojo_ch05 共回答了18个问题 |采纳率94.4%1500*X=1200*(9-X),X=4.所以能够飞出的距离为:1500*4=6000(千米)1年前查看全部
- 把质量为20kg、温度为25℃的水加热到60℃,需要多少热量?若用热值为42000000J/kg的液化石油气作燃料,且液
把质量为20kg、温度为25℃的水加热到60℃,需要多少热量?若用热值为42000000J/kg的液化石油气作燃料,且液化石油气完全燃烧放出的热量有70%被水吸收,问需要完全燃烧多少千克的液化石油气?
 kiristy圆1年前3
kiristy圆1年前3 -
 燕儿158 共回答了29个问题
燕儿158 共回答了29个问题 |采纳率96.6%把质量为20kg、温度为25℃的水加热到60℃,需要多少热量?
答:Q吸=cm(t2-t1)=4.2*20*(60-25)=2940kJ,(水的比热容:c=4.2kJ/kg℃)
需要完全燃烧多少千克的液化石油气?
答:根据Q吸=70%Q放
得:2940=0.7*42000*m
解得:
m=0.1kg.1年前查看全部
- 问几道六年级数学题、急盼回音1.一艘轮船所带的燃料最多可用12小时,驶出时顺水,速度是30千米/小时;返回时逆水,速度是
问几道六年级数学题、急盼回音
1.一艘轮船所带的燃料最多可用12小时,驶出时顺水,速度是30千米/小时;返回时逆水,速度是顺水速度的4/5.这艘轮船在此航道上最多驶出多少千米就应往回返?
2.甲乙丙三人,甲每分钟走20米,乙每分钟走22米,丙每分钟走25米,甲乙从东镇,丙从西镇,同时相对出发,丙遇到乙后10分钟再遇到甲,求两镇相距多少米? 看咱帅的1年前4
看咱帅的1年前4 -
 lichang66 共回答了22个问题
lichang66 共回答了22个问题 |采纳率90.9%由于驶出的距离等于驶回的距离
所以驶出的时间与驶回的时间与它们的速度成反比
驶出的时间与驶回的时间之比是:4:5
4+5=9,然后按比例分配
驶出的时间是:12×4/9=16/3小时
最多能驶出的距离是:30×(16/3)=160千米
--------------------
两镇相距:10/[1/(25+20)-1/(25+22)]=10575m1年前查看全部
- 各种燃料的热值与热效率我想知道柴油、天然气、液化石油气、电能等能源,它们分别热值是千卡/公斤和热效率是多小百分比?
 yingfeng19861年前1
yingfeng19861年前1 -
 炽W色 共回答了22个问题
炽W色 共回答了22个问题 |采纳率77.3%柴油的燃烧值:12.8*10^6J/Kg
天燃气的燃烧值:52.7~55.6*10^6J/Kg
液化石油气的燃烧值:47×10^6J/Kg
电一度能产生的热量为:3.6*10^6J
各种能源能产生的热效率与产生热的方式和工具有关,与燃料无关.1年前查看全部
- 评价把煤作为燃料的两种途径(高一化学),急,看过答案后给悬赏
评价把煤作为燃料的两种途径(高一化学),急,看过答案后给悬赏
法一 C+O2=CO2 (放热Q1)
法二 先制水煤气C+H2O=CO+H2 (吸热Q2)
再燃烧水煤气CO+0.5O2=CO2
H2+0.5O2+H2O (两个反应共放热Q3)
Q1,Q2,Q3的关系,以及燃烧水煤气的好处 璐猪1年前2
璐猪1年前2 -
 kingof609 共回答了19个问题
kingof609 共回答了19个问题 |采纳率100%Q1+Q2=Q3
热值更高,煤的利用率更高1年前查看全部
- 下列物质的用途中,利用其化学性质的是A钨用于制作白炽灯丝B铁用于制作炊具C一氧化碳作燃料D石墨作电极
 掸烟先生1年前1
掸烟先生1年前1 -
 太阳mami 共回答了12个问题
太阳mami 共回答了12个问题 |采纳率83.3%c一氧化碳燃烧放热1年前查看全部
- 用火箭发射人造卫星时,假设最后一节火箭的燃料用完后,火箭壳和卫星一起以v=7.0*13^3m/s的速度绕地球做匀
用火箭发射人造卫星时,假设最后一节火箭的燃料用完后,火箭壳和卫星一起以v=7.0*13^3m/s的速度绕地球做匀
速圆周运动.已知卫星的质量m=500kg,最后一节火箭壳体的质量M=1000kg.某时刻火箭壳体与卫星分离,分离时卫星与火箭壳体沿轨道切线方向的相对速度u=1.8*10^3m/s,试计算分离后瞬间卫星的速度和火箭壳体的速度.(紧急,) bdgdj1年前1
bdgdj1年前1 -
 fallout216 共回答了27个问题
fallout216 共回答了27个问题 |采纳率81.5%卫星与箭壳只受万有引力作用.引力垂直于运动方向,运动方向上动量守恒
(M+m)v=M(x-u)+mx
其中x为卫星的速度
x-u为箭壳的速度
自己解吧1年前查看全部
- 现有一套以天然气为燃料的灶具,欲改为燃烧液化石油气,应采取的正确措施是()
现有一套以天然气为燃料的灶具,欲改为燃烧液化石油气,应采取的正确措施是()
A.减少空气进入量,增大石油气进入量
B.增大空气进入量,减小石油气进入量
C.增大空气进入量,也增大石油进入量
D.增大空气进入量,或减小石油气进入量
为什么不选B
老师说根据体积
但一个天然气分子与一个液化石油气分子质量又不一样 呀11年前1
呀11年前1 -
 aozplt 共回答了16个问题
aozplt 共回答了16个问题 |采纳率87.5%D1年前查看全部
- 弱问一道关于燃料电池的问题这种有机物燃料的原电池反应要怎么写……
弱问一道关于燃料电池的问题

这种有机物燃料的原电池反应要怎么写…… 眼睛里的湖1年前2
眼睛里的湖1年前2 -
 lihengshan 共回答了15个问题
lihengshan 共回答了15个问题 |采纳率93.3%CH3OH~CO2,反应物少O酸性条件下加水,配平电荷得到CH3OH+H2O-6e-=CO2+6H+,另一边就简单了1年前查看全部
- 既可以做还原剂又可以做燃料的是什么
 axjm19871年前4
axjm19871年前4 -
 紫色的阳光 共回答了14个问题
紫色的阳光 共回答了14个问题 |采纳率100%CO、H2、1年前查看全部
- 由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙其分子中均有氧且1个乙分子中含
由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙其分子中均有氧且1个乙分子中含有18个电子则甲和乙分别是________.乙是一种清洁燃料工业上可用甲和氢气反应制得.
甲烷也是一种清洁燃料但不完全燃烧时热效率降低并会产生有毒气体造成污染.已知 CH4(g) + 2O2(g)= CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol 2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol 则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍保留1位小数 珍惜3331年前1
珍惜3331年前1 -
 陶朱公 共回答了29个问题
陶朱公 共回答了29个问题 |采纳率75.9%甲:CO 乙:CH2O 最后一空 列式 [-890.3-(-566)]/(-890.3)=0.41年前查看全部
- 用消毒酒精做酒精锅(涮羊肉用的小锅)的燃料,会有危险吗?
 言咏春1年前3
言咏春1年前3 -
 全世界下雨雨 共回答了16个问题
全世界下雨雨 共回答了16个问题 |采纳率87.5%有,不要放太多了1年前查看全部
- 强风或大雨下火炬仍可以保持燃烧,是因为火炬燃料的燃烧不受燃烧的条件的影响.这句话对吗?为什么?(火炬
强风或大雨下火炬仍可以保持燃烧,是因为火炬燃料的燃烧不受燃烧的条件的影响.这句话对吗?为什么?(火炬
燃料为丙烷) yanyongde1年前2
yanyongde1年前2 -
 txd1000 共回答了18个问题
txd1000 共回答了18个问题 |采纳率77.8%不对,因为任何燃烧都无法离开燃烧的三个条件:1,可燃物2,与氧气或空气接触3,温度达到可燃物的着火点1年前查看全部
- 黑洞的引力场怎么产生的?“黑洞是由质量足够大的恒星在核聚变反应的燃料耗尽而死亡后,发生引力坍缩而形成.黑洞质量是如此之大
黑洞的引力场怎么产生的?
“黑洞是由质量足够大的恒星在核聚变反应的燃料耗尽而死亡后,发生引力坍缩而形成.黑洞质量是如此之大,它产生的引力场是如此之强,以至于任何物质和辐射都无法逃逸,就连光也逃逸不出来.”
上面是百度搜到的,意思是:黑洞质量大所以产生的引力场大,所以能吸引吞噬其他恒信吧?
我想问的是:恒信坍塌后的质量会变大吗?如果坍塌后质量不会变大,那么恒星坍塌前不是质量更大,吸引力更大吗?为什么坍塌后才会形成黑洞? prettycat20461年前4
prettycat20461年前4 -
 未见ooqq 共回答了9个问题
未见ooqq 共回答了9个问题 |采纳率100%恒星之所以塌缩成黑洞不是因为引力变得更大,而是引力场变得更加浓缩.
举个简单的例子,假设一颗恒星的体积是100000000(1亿),质量是100倍太阳,假设每个太阳的引力强度是100万.那么这颗恒星的总引力强度也是1亿.但这1亿的引力被分散到恒星体积1亿的空间内.平均下来,每1点空间承受的引力强度只有1点.
现在这个恒星塌缩成了黑洞,超新星爆炸导致它损失了90%的质量.恒星残骸只剩下不到10倍的太阳质量,这些质量的引力强度总和只剩下了1000万.但是它的体积是多少呢?我们假设内核塌缩后只剩下1的体积.那么1000万的引力强度被压缩在了1点的空间内,在这一狭小的区域,每1点空间承受的引力强度是1000万,比成为恒星的时候要强1000万倍.
当然上述只是一种简单的计算,真正的引力计算并不是简单的得出平均值,只是为了让你更好理解,但原理仍然是相同的.以大犬座VY恒星为例,它的直径是30亿公里,当它塌缩成黑洞时,黑洞的直径会骤减到不到30公里.体积缩小到不到原来恒星的1000亿分之一,即便质量只有原来的十分之一.但当这些为数不多的质量(引力)被浓缩到了如此小的一个区域,仍然可以形成了黑洞.
在恒星死亡前,内部的核燃料会通过核聚变释放能量辐射产生一个支撑力,阻止恒星塌缩.而当恒星的燃料耗尽时,核聚变也随之停止,引力赢得了最终的胜利,内核才会在这一时刻塌缩成黑洞.1年前查看全部
大家在问
- 1乙醇等绿色能源的开发备受世界关注.利用玉米秸秆生产酒精,首先要把秸秆用相应的酶进行预处理,然后用特定的微生物在特定的条件
- 2星期五的那天,突然乌云密布,我没有雨伞,我冒雨回家,路上有个同学送我回家.把以上的中文翻译成英语?
- 3下列有关生物体内水和无机盐的叙述错误的是( )
- 4写期中考试的作文 600字 题目不限 关于期中考试的就行了
- 5修一条公路,5天共修4500米,照这样计算20天共可修多少米?
- 6(5a-3b)-3(a的平方-2b)合并同类项怎么算啊,O W
- 7已知A地在B地的正南方3千米处,甲、乙两人分别从A、B两地向正北方向匀速直行,他们和B地的距离S(千米)与所用的时间t(
- 8急,关于一个向心力的疑惑我们都知道地球在自转,物体随着地球自转会产生向心力,根据公式F=MV的平方/R可以知道,高处的物
- 9四分之三[三分之二(二分之一X-四分之一)-8]=二分之三X
- 10注意√代表根号 x^2代表X的平方 第一题.√10的整数部分是X小数部分是y,则y乘(X+√10)的值是多少?
- 11阅读下面语段,按要求回答问题:深秋的太阳没( )地照在身上,煦暖得像阳春三月。 A.遮拦 B.阻拦 C.遮掩 D.遮
- 12it is our faithfulfriend it says"woof!woof!"what is it?
- 13张丽的爸爸把6万元存入银行,定期三年,年利率是5.13%。到期时扣除5%的利息税,张丽的爸爸共取回本息多少元
- 14已知抛物线y=x2+(m-2)x-2m,当m=—时,顶点在y轴上;当m=——时,顶点在x轴上;当m=___时,顶点经过原
- 15托尔斯泰在一书中一共塑造了多少个人物?
